BAWAL, Widya Riset Perikanan Tangkap adalah wadah informasi perikanan,
baik laut maupun perairan umum. Publikasi ini memuat hasil-hasil penelitian bidang “natural history” ikan (pemijahan, pertumbuhan, serta kebiasaan makan dan makanan)
serta lingkungan sumber daya ikan.
Terbit pertama kali tahun 2006 dengan frekuensi penerbitan tiga kali dalam setahun, yaitu pada bulan:
APRIL, AGUSTUS, DESEMBER. Ketua Redaksi:
Drs. Bambang Sumiono, M.Si (Biologi Perikanan-P4KSI)
Anggota:
Prof. Dr. Wudianto, M.Si (Teknologi Penangkapan Ikan-P4KSI) Prof. Dr. Ali Suman (Biologi Perikanan-BPPL)
Prof. Dr. Ir. Sam Wouthuyzen, M.Sc. (Oseanografi Perikanan-LIPI) Dr. Agus Djoko Utomo, M.Si ( Biologi Perikanan-BRPPU)
Ir. Sulastri (Limnologi-LIPI)
Mitra Bestari untuk Nomor ini:
Prof. Dr. Ir. Indra Jaya, M.Sc (Hidro Akustik Perikanan-IPB) Dr. Ir. Zainal Arifin, M.Sc. (Pencemaran Perairan-LIPI)
Dr. Ir. M. Mukhlis Kamal (Ikhtiologi-IPB) Dr. Estu Nugroho (Genetika Populasi Ikan-BPPAT) Lilis Sadiyah, Ph.D. (Permodelan Perikanan-P4KSI)
Redaksi Pelaksana: Ralph Thomas Mahulette, S.Pi., M.Si.
Kharisma Citra, S.Sn.
Desain Grafis: Darwanto, S.Sos.
BAWAL
WIDYA RISET PERIKANAN TANGKAP
BAWAL-WIDYA RISET PERIKANAN TANGKAP diterbitkan oleh Pusat Penelitian Pengelolaan Perikanan dan Konservasi Sumber Daya Ikan - Badan Penelitian dan Pengembangan Kelautan dan
ISSN 1907-8226
Volume 5 Nomor 2 Agustus 2013 Nomor Akreditasi : 419/AU/P2MI-LIPI/04/2012
(Periode: April 2012-April 2015)
Alamat Redaksi/Penerbit:
Pusat Penelitian Pengelolaan Perikanan dan Konservasi Sumber Daya Ikan Gedung Balitbang KP II Jl. Pasir Putih II, Ancol Timur Jakarta Utara 14430 Telp. (021) 64700928; Fax. (021) 64700929
i
KATA PENGANTAR
Widya Riset Perikanan Tangkap “BAWAL” merupakan wadah untuk menyampaikan informasi hasil penelitian yang dilakukan para peneliti dari dalam maupun luar lingkup Pusat Penelitian Pengelolaan Perikanan dan Konservasi Sumber daya Ikan. Informasi-informasi tersebut sangat berguna bagi para pemangku kepentingan (stakeholders) terutama para pengambil kebijakan sebagai dasar dalam pengelolaan perikanan dan konservasi sumberdaya ikan di laut maupun perairan umum daratan.
Seiring dengan terbitnya Widya Riset Perikanan Tangkap Bawal Volume 5 Nomor 2 Agustus 2013 ini, kami ucapkan terima kasih kepada para Evaluator dan Mitra Bestari atas kesediaannya dalam menelaah beberapa naskah.
Pada volume ini, Bawal menampilkan delapan artikel hasil penelitian perikanan di perairan umum daratan dan perairan laut. Delapan artikel tersebut mengulas tentang, beberapa aspek biologi ikan kurau (Polynemus dubius) di estuari sungai Indragiri, Riau, distribusi, kelimpahan dan variasi ukuran larva ikan di estuaria sungai Musi, dinamika populasi ikan swanggi (Priacanthus tayenus) di perairan Tangerang–Banten, biologi reproduksi ikan betutu (Oxyeleotris marmorata) di waduk Kedung Ombo Propinsi Jawa Tengah, hubungan panjang-berat dan faktor kondisi lobster batu (Panulirus penicillatus) di perairan selatan Gunung Kidul dan Pacitan, karakteristik biologi cumi-cumi di perairan Laut Jawa, potensi invasif ikan zebra cichlid (Amatitlania nigrofasciata Günther, 1867) di Danau Beratan, Bali ditinjau dari aspek biologinya, laju tangkap, kepadatan stok dan beberapa aspek biologi udang jerbung (Penaeus merguiensis) di perairan Dolak, Laut Arafura.
Semua artikel pada edisi ini diharapkan dapat memberikan kontribusi bagi pengembangan ilmu pengetahuan dan teknologi bidang perikanan tangkap di Indonesia. Redaksi mengucapkan terima kasih atas partisipasi aktif para penulis dan semua pihak yang telah berkontribusi dalam edisi ini.
i iii 67-72 73-79 81-87 89-96 97-102 103-111 113-121 123-129
ISBN 1907-8226
BAWAL
Widya Riset Perikanan Tangkap
Volume 5 Nomor 2 Agustus 2013
DAFTAR ISI
KATA PENGANTAR ………... DAFTAR ISI ………... Beberapa Aspek Biologi Ikan Kurau (Polynemus dubius) di Estuari Sungai Indragiri, Riau
Oleh: Asyari dan Herlan………
Distribusi, Kelimpahan dan Variasi Ukuran Larva Ikan di Estuaria Sungai Musi
Oleh: Eko Prianto, Syarifah Nurdawaty, dan Mohammad Mukhlis Kamal………
Dinamika Populasi Ikan Swanggi (Priacanthus tayenus) di Perairan Tangerang – Banten
Oleh: Prihatiningsih, Bambang Sadhotomo,dan Muhamad Taufik………
Biologi Reproduksi Ikan Betutu (Oxyeleotris marmorata) di Waduk Kedung Ombo Propinsi Jawa Tengah
Oleh: Khoirul Fatah dan Susilo Adjie………
Hubungan Panjang-Berat dan Faktor Kondisi Lobster Batu (Panulirus penicillatus) di Perairan Selatan Gunung Kidul dan Pacitan
Oleh: Mohammad Fauzi, Andhika Prima Prasetyo, Ignatius Tri Hargiyatno, Fayakun Satria, dan Andria Ansri Utama
Karakteristik Biologi Cumi-Cumi di Perairan Laut Jawa
Oleh: Reny Puspasari dan Setya Triharyuni………
Potensi Invasif Ikan Zebra Cichlid (Amatitlania nigrofasciata Günther, 1867) di Danau Beratan, Bali Ditinjau dari Aspek Biologinya
Oleh: Agus Arifin Sentosa dan Danu Wijaya……….
Laju Tangkap, Kepadatan Stok dan Beberapa Aspek Biologi Udang Jerbung (Penaeus merguiensis) di Perairan Dolak, Laut Arafura
67
BAWAL Vol. 5 (2) Agustus 2013 : 67-72
BEBERAPA ASPEK BIOLOGI IKAN KURAU (Polynemus dubius)
DI ESTUARI SUNGAI INDRAGIRI, RIAU
SOME BIOLOGICAL ASPECT OF EASTERN PARADISE FISH (Polynemus
dubius) IN IDRAGIRI RIVER ESTUARY, RIAU
Asyari dan Herlan
Balai Penelitian Perikanan Perairan Umum Palembang
Teregistrasi I tanggal: 04 Juni 2012; Diterima setelah perbaikan tanggal: 18 April 2013; Disetujui terbit tanggal: 21 Juni 2013
Email: [email protected] ABSTRAK
Ikan kurau (Polynemus dubius) merupakan salah satu jenis ikan yang mempunyai nilai ekonomi penting di Kabupaten Indragiri Hilir, Riau. Penelitian tentang aspek biologi meliputi hubungan panjang-berat, jenis pakan dan kebiasaan makan, tingkat kematangan gonad, fekunditas dan indek kematangan gonad dilakukan pada bulan Maret, Mei, Juli dan Oktober 2011. Hasil penelitian menunjukkan bahwa hubungan panjang - berat ikan kurau mengikuti persamaan W = 0, 005 L 2,9851 , dengan nilai b = 3. Dengan demikian ikan kurau mempunyai pola pertumbuhan yang isometrik dimana terdapat keseimbangan antara pertumbuhan panjang dengan pertumbuhan berat. Ikan kurau bersifat karnivora dengan pakan utama jenis udang-udangan (krustasea) dan ikan-ikan kecil. Proses kematangan gonad terjadi secara bertahap dan ikan kurau diduga mengalami pemijahan secara tidak serentak (partial spawning). Fekunditas ikan kurau berkisar antara 5.468 – 10.256 butir dengan indeks kematangan gonadantara 7,64 % - 11,00 %.
KATA KUNCI : Aspek biologi, ikan kurau, Polynemus dubius, estuari, Sungai Indragiri ABSTRACT:
Eastern paradise fish (Polynemus dubius) is one of species of fish which have economic value in the Distric of Indragiri Hilir, Riau. Research was carried out regarding length-weight relationship, food and feeding habits, maturity stage, fecundity and gonad maturity index. Data collected in March, May, July and October 2011. The results showed that the length-weight relationship of Eastern paradise fish (Polynemus dubius) follow the equation of W = 0. 005 L 2.9851 with value of b = 3. It means that have isometric growth pattern where there is a balance between growth in length and weight. As a carnivore fish, it has main feeding of Cruatacean and small fish. Gonad maturation process was gradual and no simultaneously (partial spawning). Mean while the fecundity in the range of 5,468 – 10,256 eggs with gonad maturity index between 7.64 % - 11.00%.
KEYWORDS : Biology aspects, eastern paradise fish, Polynemus dubius, estuary, Indragiri River PENDAHULUAN
Estuari adalah perairan semi tertutup yang berhubungan dengan laut, sehingga air laut yang bersalinitas tinggi dapat bercampur dengan air tawar (sungai) yang bersalinitas rendah (Pritchard, 1967). Estuari dikenal sebagai daerah pembesaran (nursery ground) bagi berbagai jenis ikan, invertebrata (Crustacea, Bivalva, Echinodermata, Annelida) dan kelompok fauna lainnya. Jenis ikan kurau, baronang dan sunu menggunakan daerah estuari sebagai daerah pemijahan dan sebagai tempat mencari makan (Kasim, 2005).
Sungai Indragiri di Propinsi Riau mempunyai panjang sekitar 250 km dengan kedalaman antara 6 – 12 m. Bagian hulu sungai ini disebut Batang Kuantan yang berhubungan dengan Danau Singkarak di Provinsi Sumatera Barat. Perairan estuari Sungai Indragiri dikenal sebagai penghasil beberapa jenis ikan khas daerah muara
sungai antara lain belanak, kurau, gulama, lome, beberapa jenis udang dan kepiting (Anonimus, 2008a).
Habitat ikan kurau (Polynemus dubius) terdapat di perairan muara sungai yang dangkal dengan dasar berlumpur bahkan sering memasuki daerah sungai di pedalaman atau perairan tawar. Daerah penyebaran di Indonesia meliputi Sumatera, Jawa, Madura, Kalimantan dan Sulawesi (Weber & Beaufort, 1922). Selain itu juga ditemukan di Thailand dan negara-negara Asia Tenggara lainnya (Kottelat et al., 1993). Ikan kurau bersama beberapa jenis ikan demersal lainnya seperti ikan gerot-gerot, bawal hitam, kurisi, layur, pari, cucut dan baronang dikelompokkan kedalam kelas komersial nomor dua (Widodo et al., 1999).
Hamidy et al. (1983) mengatakan ikan kurau di Kabupaten Indragiri Hilir merupakan salah satu jenis ikan yang mempunyai nilai ekonomi cukup penting dan
Korespondensi penulis:
Balai Penelitian Perikanan Perairan Umum Palembang
berharga mahal terutama yang berukuran di atas 1 kg. Potensi ikan kurau di perairan pantai timur Provinsi Riau sebesar 87 ton/tahun (Anonimus, 2010). Ikan kurau di perairan estuari Indragiri umumnya ditangkap oleh nelayan dengan bermacam alat tangkap seperti : trawl, gill net, tuguk, pukat pantai dan pancing. Ikan ini bersama jenis ekonomis lainnya dipasarkan dalam keadaan segar atau diberi es terutama ke kota Pekanbaru. Menurut Suradiwijaya et al. (2009) penangkapan ikan yang terus meningkat dapat mengakibatkan pemanfaatan yang melebihi batas MSY (Maximum Sustainable Yield) sehingga terjadi lebih tangkap (overfishing). Menurut para nelayan ikan kurau yang tertangkap sekarang jumlahnya makin sedikit dan ukurannya jauh lebih kecil dibandingkan dengan hasil tangkapan beberapa tahun yang lalu.
Mengingat harganya yang mahal dan tingginya minat masyarakat terhadap ikan kurau, sementara hasil tangkapan nelayan makin lama makin menurun, dikhawatirkan ikan
ini menjadi langka. Informasi mengenai beberapa aspek biologi seperti hubungan panjang-berat, kebiasaan makanan, tingkat kematangan gonad dan fekunditas ikan kurau di muara Sungai Indragiri masih sangat terbatas. Aspek biologi ini sangat penting sebagai acuan dalam upaya pengelolaan yang rasional khususnya di perairan Riau.
BAHAN DAN METODE
Data dikumpulkan pada bulan Maret, Mei, Juli dan Oktober 2011. Contoh ikan diperoleh dari hasil tangkapan mini trawl yang beroperasi di muara Sungai Indragiri Hilir. Pengambilan sampel dilakukan pada beberapa lokasi yaitu : 1. Terusan Mas, 2. Tanjung Lian, 3. Tanjung Lajau, 4. Muara Sungai Merusi, 5. Sungai Buluh, 6. Kuala Sungai Indragiri, 7. Sungai Merusi, 8. Concong Dalam, 9. Sungai Majenai, 10. Sungai Perigiraja dan 11. Kuala Sungai Perigiraja (Gambar 1).
Gambar 1. Lokasi stasiun penangkapan ikan di estuari Sungai Indradiri, 2011 Figure 1. Map showing sampling site in Indragiri estuarine waters, 2011 Ikan yang tertangkap diukur panjang dan berat
tubuhnya. Analisis hubungan panjang-berat mengikuti hukum kubik bahwa bobot ikan sebagai pangkat tiga dari panjangnya yang mengacu pada persamaan dari Effendie (1992) sebagai berikut :
W = a L b
Keterangan : W = bobot ikan (gram) L = panjang ikan (cm)
a = intercept (perpotongan antara garis regresi dengan sumbu y) b = koefisien regresi (sudut kemiringan garis)
Nilai b yang didapatkan dilanjutkan dengan uji t (t. tabel) pada tingkat signifikasi 95%.
Uji-t : Ho : b = 3 (isometrik), pertambahan panjang sebanding dengan pertambahan berat.
H1 : b 3 (Allometrik positif/negatif), pertambahan panjang tidak sebanding dengan pertambahan berat. t hitung > t. tabel = beda nyata (tolak H0, terima H1)
t hitung < t. tabel = tidak berbeda nyata (terima H0, tolak H1 ) Kebiasaan makan ikan, diketahui dengan cara mengamati isi lambung dengan metode indeks bagian terbesar (Index of preponderance) dari Natarajan & Jhingran (1961) dalam Effendie (1992) sebagai berikut :
Vi x Fi
IP = —————— x 100% Vi x Fi
69 Keterangan :
IP = Index of preponderance Vi = persentase volume pakan ke-i
Fi = persentase frekuensi kejadian pakan ke-i Vi Fi = jumlah Vi x Fi dari semua macam makanan Penentuan tingkat kematangan gonad didasarkan kepada modifikasi (Cassie, 1954; dalam Effendie, 1992) yang terdiri atas TKG I – TKG V.
Fekunditas dihitung sebagai jumlah telur yang terdapat dalam ovari pada ikan yang telah matang gonad (TKG IV). Fekunditas total dihitung berdasarkan metoda grafimetrik (Effendie, 1992) sebagai berikut :
F = ( G / g ) n Keterangan :
F = jumlah total gonad (fekunditas) G = bobot gonad tiap satu ekor ikan
g = bobot sebagian gonad (sampel) satu ekor ikan n = jumlah telur dari sampel gonad
Indeks Kematangan Gonad (IKG) dihitung dengan cara mengukur bobot gonad dan bobot tubuh ikan termasuk gonadnya mengacu kepada Effendie (1992) sebagai berikut :
Bg
IKG = ___________ x 100 % Bi
Keterangan :
IKG = Indeks kematangan gonad Bg = Bobot gonad (gram) Bi = Bobot ikan (gram) HASIL DAN BAHASAN HASIL
Hubungan Panjang-Berat
Analisis hubungan-panjang berat terhadap 316 ekor ikan kurau (Polynemus dubius), menunjukkan pola pertumbuhannya mengikuti persamaan : W = 0. 005 L 2,9851
dengan nilai r2 = 0,929 (Gambar 2). Setelah dilakukan uji t
pada tingkat signifikasi 95 %, ternyata nilai b ini mempunyai nilai thitung < ttabel yang berarti nilai b = 3. Dengan demikian ikan kurau mempunyai pola pertumbuhan isometrik dimana terdapat keseimbangan antara pertumbuhan panjang dengan pertumbuhan berat.
Kebiasaan Makan
Ikan kurau yang dianalisa isi lambungnya berjumlah 17 ekor dengan ukuran panjang total bervariasi antara 14,2 – 22,3 cm dan berat antara 16,6 gram – 56 gram. Makanan
yang banyak dikonsumsi berturut-turut adalah krustasea sebesar 47,5 %, potongan ikan 38 %, cacing (Annelida) 6,5 % dan siput (Mollusca) 3,2 %, sedangkan bagian yang tidak teridentifikasi sebesar 4,8 % (Gambar 3). Berdasarkan komposisi makanan yang dikonsumsi tersebut menunjukkan bahwa ikan kurau bersifat karnivora/ pemangsa hewan. Tiga jenis krustasea yang ditemukan di dalam lambung adalah udang putih (Penaeus merguensis), udang pepeh (Metapenaeus ensis) dan udang duri (Metapenaeus. sp). Sedangkan potongan ikan yang terdapat di lambung ikan kurau yaitu : ikan duri (Arius leiotocephalus), bilis (Clupeichthys goniognathus) dan bulu ayam (Coilia lindmani).
W = 0.005L2.9851 r² = 0.929 n = 316 0 10 20 30 40 50 60 0 5 10 15 20 25 Be rat (g ra m ) Panjang total (cm)
Gambar 2. Hubungan panjang-berat ikan kurau (Polynemus dubius).
Figure 2. Length-weight relationship of eastern paradise fish (Polynemus dubius).
0% 10% 20% 30% 40% 50% A B C D E P e rsen tase Jenis pakan Komposisi isi lambung
Gambar 3. Komposisi isi lambung ikan kurau (Polynemus dubius) di estuari Sungai Indragiri.
Figure 3. Diet composition of easter paradise fish (Polynemus dubius) in Indragiri estuarine waters. Keterangan/Remarks :
A = Krustasea= 47,5 % ; B = Potongan ikan= 38 % C = Annelida = 6,5 % ; D = Mollusca = 3,2 % E = Tak teridentifikasi = 4,8 %
Tingkat Kematangan Gonad
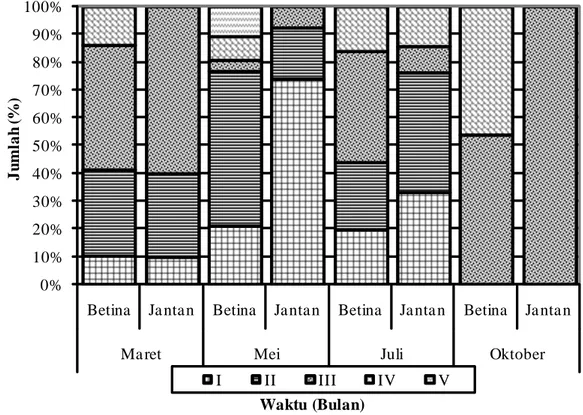
Ikan kurau mengalami proses pematangan gonad dari bulan Maret sampai Oktober secara bertahap. Pada pengamatan bulan Maret, Mei dan Juli belum ditemukan ikan kurau yang memijah, namun pada pengamatan bulan Oktober sudah ada ikan kurau yang memijah, ditandai dengan adanya tingkat kematangan gonad Tingkat V sebesar 7,1 % (Tabel 1). Dari hasil pengamatan tingkat kematangan gonad, diperkirakan ikan kurau mengalami pemijahan secara bertahap (parsial) sesuai dengan persentase tingkat kematangan dari bulan ke bulan.
mengestimasi produksi perikanan (Smith, 1996). Selain itu pengukuran panjang-berat yang dihubungkan dengan umur dapat memberikan informasi tentang komposisi stok, umur matang gonad, mortalitas, siklus hidup dan pertumbuhan (Fatioye & Oluajo, 2005).
Hasil penelitian ini sama dengan ikan dari famili Polynemidae lainnya yaitu ikan senangin (Eleutheronema tetradactylum) di muara Sungai Musi yang juga mempunyai pola pertumbuhan isometrik dengan persamaan panjang-berat : W = 1,253L 3,0382 (Djamali et al.,
1988). Muthmainnah (2008) mendapatkan pola pertumbuhan yang bersifat alometrik negatif untuk ikan janggutan (Polynemus longipectoralis) di estuari Sungai Musi, yang berarti pertumbuhan panjang lebih cepat dari pertumbuhan berat. Perbedaan hasil tersebut antara lain disebabkan oleh jenis ikan dan waktu penelitian yang berbeda.
Menurut (Effendie, 1992). pertumbuhan ikan dipengaruhi oleh beberapa faktor antara lain : jumlah dan ukuran makan yang tersedia, jumlah ikan yang menggunakan sumber makanan, suhu, oksigen terlarut, kualitas air, umur ikan dan tingkat kematangan gonad. Kebiasaan Makan
Terdapat 3 golongan pakan ikan ditinjau dari jumlah makanan pada lambung ikan yaitu pakan utama, pakan pelengkap dan pakan tambahan. Sebagai batasan, dimaksud dengan pakan utama adalah jenis pakan yang mempunyai index of preponderance (IP) lebih besar dari 25 %, pakan pelengkap mempunyai IP antara 4 – 25 %, sedangkan pakan tambahan memiliki IP kurang dari 4 % (Nikolsky,1963).
Makanan bagi ikan dapat merupakan faktor yang menentukan populasi, pertumbuhan dan kondisi ikan. Jenis makanan satu spesies ikan biasanya tergantung pada umur, tempat, waktu dan alat pencernaan dari ikan itu sendiri, dengan mengetahui makanan atau kebiasaan makan satu jenis ikan dapat dilihat hubungan ekologi antara ikan dengan organisme lain yang ada di suatu perairan, misalnya bentuk-bentuk pemangsaan, saingan dan rantai makanan (Effendie, 1992).
Menurut Anonimus (2008b), ikan kuro (Polynemidae)
dapat memangsa krustasea kecil, ikan kecil dan organisme dasar lainnya. Selain itu, menurut Motomura (2004) makanan ikan jenis Polynemus dubius adalah krustasea, ikan kecil dan hewan-hewan zoobenthos yang terdapat di perairan berlumpur atau berpasir di daerah estuari atau kuala. Bila dibandingkan dengan ikan janggutan (Polynemus longipectoralis) yang terdapat di perairan estuari Sungai Musi, hasil penelitian ini ternyata tidak Tabel 1. Tingkat kematangan gonad ikan kurau di estuari
Sungai Indragiri.
Table 1. Gonad maturity stage of eastern paradise fish in Indragiri estuarine waters.
Tingkat Kematangan Gonad Persentase TKG Maret (n = 16) Mei (n= 18) Juli (n=20) Oktober (n=14) I 62,5 22,2 - - II 37,5 55,6 20 - III - 22,2 40 42,9 IV - - 40 50,0 V - - - 7,1
Tabel 2. Fekunditas dan indek kematangan gonad (IKG) ikan kurau di estuary Sungai Indragiri, Riau. Table 2. Fecundity and gonado somatic index of eastern
paradise fish in Indragiri estuarine waters, Riau.
Fekunditas dan Indek Kematangan Gonad
Fekunditas ikan kurau di estuari Sungai Indragiri berkisar antara 5.468 – 10.256 butir, sedangkan nilai indek kematangan gonad (IKG) ikan kurau pada TKG IV antara 7,64 % - 11,00 %. (Tabel 2).
BAHASAN
Hubungan Panjang-Berat
Penentuan biomassa dapat dilakukan melalui pengukuran berat ikan dan dapat digunakan untuk
Asyari dan Herlan / BAWAL Vol. 5 (2) Agustus 2013 : 67-72
No. Panjang (cm) Berat (gram) Fekunditas (butir) IKG ( % ) 1. 19,7 55,25 9.700 8,94 2. 16,7 28,0 5.468 11,00 3. 18,4 30,3 6.840 10,23 4. 22,3 56,0 10.256 7,64 5. 17,6 29,4 6.610 9,66 6. 17,1 28,8 7.146 9,20
71 jauh berbeda. Menurut Muthmainnah (2008) ikan
janggutan juga memakan udang sebagai pakan utamanya. Tingkat Kematangan Gonad
Tingkat kematangan gonad (TKG) merupakan hal yang sangat penting dari suatu siklus hidup ikan. Mengetahui tingkat kematangan gonad ikan dapat memberikan keterangan yang berarti mengenai frekuensi, musim pemijahan, ukuran ikan pertama kali matang gonad dan memijah (Nikolsky, 1963).
Ikan kurau memijah secara bertahap (parsial). Menurut Wootton & Pott (1984) tidak samanya proses pematangan gonad merupakan indikasi bahwa ikan ini termasuk ikan yang memijah secara tidak serentak (partial spawning), karena proses pematangan telur di dalam ovary atau peristiwa miosis yang berlangsung juga tidak serentak.
Hasil pengamatan ikan kurau di muara Sungai Indragiri Hilir menunjukkan ikan kurau sudah ada yang memijah pada bulan Oktober. Diindikasikan dengan diperoleh sejumlah contoh ikan dengan kondisi gonad selesai memijah (Tk.V) dengan ciri-ciri kantong telur telah kempes atau berkerut pertanda selesai memijah. Wawancara dengan beberapa nelayan, mengemukakan biasanya ikan kurau memijah atau menetas pada musim hujan antara bulan Oktober – Februari. Satu ekor induk ikan dapat mengalami 2 - 3 tiga kali pemijahan pada musim tersebut. Fekunditas dan Indek Kematangan Gonad
Bila dibandingkan dengan ikan Polynemus paradiseus yang diteliti oleh Gupta (1967) di perairan estuari Roopnarayan India, fekunditas ikan kurau di Sungai Indragiri ternyata lebih rendah. Ikan kurau dari jenis Polynemus paradiseus dengan ukuran 15,4 – 30,7 cm, mempunyai fekunditas antara 6.842 – 39.010 butir. Fekunditas satu spesies ikan dipengaruhi oleh bobot dan panjang ikan, selain itu dipengaruhi juga oleh faktor lingkungan, genetis, ketersediaan pakan dan umur ikan (Royce, 1984). Menurut Nasution (2005), berat total ikan lebih berpengaruh terhadap jumlah fekunditas dibandingkan dengan panjang total ikan.
Indek kematangan gonad (IKG) adalah suatu nilai persentase hasil perbandingan berat gonad dengan berat tubuh ikan secara keseluruhan, nilai IKG semakin besar dengan semakin berkembangnya gonad sampai ikan memijah atau mengeluarkan telur. Dengan demikian telur ikan kurau berada pada indek kematangan gonad yang lebih kecil (< 20 %). Menurut Bagenal (1978) dalam Nasution (2005), ikan betina yang mempunyai nilai IKG lebih kecil dari 20 % dapat melakukan pemijahan beberapa kali setiap tahunnya.
KESIMPULAN
1. Pola pertumbuhan ikan kurau bersifat isometrik, dimana terdapat keseimbangan antara pertumbuhan panjang dengan pertumbuhan berat.
2. Ikan kurau bersifat karnivora dengan pakan utama sekitar 48 % berupa udang putih (Penaeus merguensis), udang pepeh (Metapenaeus ensis) dan udang duri (Metapenaeus. sp).
3. Proses kematangan gonad ikan kurau terjadi secara bertahap, diduga mengalami pemijahan secara tidak serentak (partial spawning). Fekunditas ikan kurau berkisar antara 5.468 – 10.256 butir dengan indeks kematangan gonad antara 7,64 % - 11,00 %.
PERSANTUNAN
Tulisan ini merupakan bagian dari kegiatan Penelitian Kajian Stok dan Bioekologi Sumber Daya Ikan di Perairan Estuari Sungai Indragiri Propinsi Riau tahun anggaran 2011 yang didanai APBN di Balai Penelitian Perikanan Perairan Umum Palembang.
DAFTAR PUSTAKA
Anonimus. 2008a. Hutan mangrove di Indragiri Hilir rusak
parah. http://mukhtarapi.blogspot.com.2008/06/ hutanmangrovedi indragiri-hilir-rusak-html. Diunduh 28 November 2011.
Anonimous. 2008b. Direktorat Jenderal Perikanan, Buku
pedoman pengenalan sumberdaya perikanan laut. Direktorat Jenderal Perikanan. Departemen Pertanian Jakarta. 167 p.
Anonimus. 2010. Potensi perikanan tangkap di Riau, dalam Statistik Perikanan Tangkap Indonesia 2009. Departemen Kelautan dan Perikanan. Direktorat Jenderal Perikanan Tangkap Jakarta. http:// regionalinvestemen.bkpm.go.id/newsipid/id/ commodityarea.php. Diunduh tanggal 6 Agustus 2012. Djamali, A., Burhanuddin & S.Martosewojo. 1988. Telaah biologi ikan kuro (Eleutheronema tetradactylum) Polynemidae di muara Sungai Musi Sumatera Selatan. Dalam Perairan Indonesia ; Biologi, Budidaya, Kualitas perairan dan Osenografi. Balai Penelitian Bilogi Laut. Pusat Penelitian dan Pengembangan Osenologi. LIPI, Jakarta. 83-86.
Effendie, M.I. 1992. Metoda Biologi Perikanan. Fakultas Perikanan. Bagian Ichtiology IPB : 112 p.
Fatioye, O.O & Oluajo,O.A. 2005. Length-weight relationships of five fish species in Epe Lagoon, Negeria. African Journal of biotechnology. 4 (7): 749-751.
Gupta, M.V. 1967. Observation on the fecundity of Polynemus paradiseus. Linn from the hooghly estuarine system. Journal Marine .Biol. Ass. U.K . 34 B.(6): 330-345.
Hamidy, R., M. Ahmad., T. Dahril., H. Alawi., M.M. Siregar & C.P.Pulungan. 1983. Identifikasi dan inventarisasi jenis ikan di Sungai Siak, Riau. Pusat Penelitian Universitas Riau. Pekanbaru. 63 p.
Kasim, M. 2005. Estuary : Lingkungan unik yang sangat penting/Lingkungan ekosistem pesisir. http:// marufwordpress.com /tag/estuary/. Diunduh tanggal 25 April 2011.
Kottelat, M; A. J Whitten; S.N Kartikasari & S. Wirjoatmodjo, 1993. Freshwater fishes of Western Indonesia and Sulawesi (Ikan Air Tawar Indonesia Bagian Barat dan Sulawesi). Periplus Editions-Proyek EMDI. Jakarta : 293 hal.
Motomura. 2004. Food and feeding habits Polynemus dubius. www.fishbase.us/./foodltems Summary.php?. Wikipedia, the free encyclopedia. Diunduh tanggal 22 Desember 2011.
Muthmainnah, D. 2008. Length-weight relationship and food habits of Polynemus longipectoralis in lower part of Musi River. Book 2. General paper, proceeding International conference on Indonesian inland waters. 17 - 18 November, Research Institute for Inland Fisheries, Research Centre for Capture Fisheries, Marine and Fisheries Research Agency. 51-54. Nasution, S.H. 2005. Karakteristik reproduksi ikan endemik
rainbow selebensis (Telmatherina celebencis Boulenger) di Danau Towuti. Jurnal Penelitian
Perikanan Indonesia. Edisi Sumber Daya dan Penangkapan. Badan Riset Kelautan dan Perikanan. Departemen Kelautan Dan Perikanan. 11 (2): 29-37. Nikolsky, G.V. 1963. The ecology of fishes. Academic Press:
325 p.
Pritchard. 1967. Observation of circulation coastal plain estuaries. In G. Lauff (Ed) : Estuaries. American Assosiation for the Advancement og Science. Pcb I. No. 83, Washington D-C. 37-44.
Royce, W. 1984. Introduction to the practice of fishery science. Academic Press Inc. New York: 753 p. Suradiwijaya, S., P.Sudarsono & G.A Sulistiawati.2009.
Beberapa aspek biologi ikan kuniran (Upeneus. spp) di Perairan Demak. Jurnal Saintek Perikanan. 5 (1): 1-6.
Smith, K.M.M. 1996. Length-weight relationships of fishes in a diverse tropical freshwater cunnunity, Sabah, Malaysia. Journal of fish biology (49). p.731- 734. Weber, M & De Beaufort. 1922. The fishes of the
Indo-Australian Archipelago. E.J Brill Ltd. Leiden. I – XII. 410 p.
Widodo.,Salim. S., Tapsirin & Soewito. 1999. Sumberdaya perikanan demersal di perairan Arafura dan sekitarnya. Balai Pengembangan Penangkapan ikan. Semarang. 82 p.
Wootton, R.J & Pott, G.W. 1984. Fish reproduction : Strategies and Tacties. Academic Press. London. p. 55-75.
73
DISTRIBUSI, KELIMPAHAN DAN VARIASI UKURAN LARVA IKAN
DI ESTUARIA SUNGAI MUSI
DISTRIBUTION, ABUNDANCE AND VARIATION IN SIZE OF FISH
LARVAE ON MUSI RIVER ESTUARY
Eko Prianto1, Syarifah Nurdawaty2 dan Mohammad Mukhlis Kamal3 1) Pusat Penelitian Pengelolaan Perikanan dan Konservasi Sumberdaya Ikan-Jakarta
2) Balai Penelitian Perikanan Perairan Umum-Muara Baru 3) Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor
Teregistrasi I tanggal: 09 Maret 2012; Diterima setelah perbaikan tanggal: 28 Maret 2013; Disetujui terbit tanggal: 31 Mei 2013
E-mail: [email protected]
ABSTRAK
Penelitian tentang distribusi, kelimpahan dan ukuran larva ikan dilakukan pada bulan Maret, Mei, Juni dan Oktober 2011. Stasiun pengambilan contoh meliputi Muara Delta Upang (stasiun 1), Muara Sungai Musi (stasiun
2) dan Pulau Payung (stasiun 3). Pengambilan larva pada siang hari menggunakan Bongo net yang berukuran mata
jaring 250 μm. Hasil identifikasi diperoleh 13 famili ditinjau menurut musim, pada bulan Mei dan Oktober masing-masing diperoleh 7 famili, dan pada bulan Juni sebanyak 3 famili. Kelimpahan larva ikan berkisar antara 9-46 ind/ m3 dengan jumlah yang tertinggi (46 ind/m3) pada bulan Mei dan terendah pada bulan Juni (9 ind/m3). Larva ikan
dari famili Gobiidae memiliki sebaran yang cukup luas baik spasial maupun temporal. Variasi ukuran larva ikan menurut famili setiap bulannya memiliki variasi ukuran yang hampir sama.
KATA KUNCI: Larva ikan, estuaria sungai Musi ABSTRAC
Research about the distribution, abundance and size of fish larvae was conducted in March, May, June and October 2011. Sampling stations encompasses Delta Upang (station 1), Muara Sungai Musi (station 2) and Pulau Payung (station 3). Larvae taken during the daytime using a Bongo net with mesh size of 250 μm. Identification results obtained 13 families based on the season, in May and October respectively 7 families, and in June as many as 3 families. Abundance of fish larval around 9-46 ind/m3 with the highest number (46 ind/m3) in May and the lowest in June (9 ind/m3). Larvae of Gobiidae family have a large distribution on spatial and temporal. The variation in size of fish larvae by family on each month are the same.
KEYWORD: Fish larvae, Musi river estuary
Korespondensi penulis:
Pusat Penelitian Pengelolaan Perikanan dan Konservasi Sumberdaya Ikan
Gedung Balitbang KP II, Jl. Pasir Putih II Ancol Timur, Jakarta Utara PENDAHULUAN
Kehidupan ikan pertama kali dimulai pada fase larva, dicirikan dengan pembentukan organ tubuh yang belum terbentuk secara sempurna. Pada fase ini pergerakan larva masih sangat lemah dan sangat tergantung dengan pergerakan arus. Sebagai sumber energi pada umur 0-3 hari, larva masih tergantung pada kuning telur yang dikandungnya sebagai sumber makanannya. Setelah kuning telur habis larva selanjutnya memakan fitoplankton dan zooplankton. Ukuran larva sangat kecil (mikroskopis), transparan dan bentuk tubuh masih sulit dibedakan dengan ukuran dewasa.
Keberadaan larva didalam perairan sangat penting, sebagai suksesor atau menggantikan peran ikan-ikan dewasa dimasa mendatang. Jika pertumbuhan dan perkembangan larva ikan terganggu atau lambat maka dapat menyebabkan produksi ikan menurun. Menurut
Smith (1972) dalam Sediadi & Sidabutar (1994) melaporkan bahwa penelitian telur dan larva ikan sangat efektif untuk mengetahui perubahan relatif biomasa ikan hasil pemijahan (spawning biomassa). Walaupun seekor ikan dalam memijah dapat menghasilkan ribuan bahkan jutaan telur, namun pada perkembangannya tidak semua telur yang menetas bahkan ketika mencapai dewasa hanya tinggal beberapa puluh ekor yang mampu bertahan.
Ekosistem estuaria merupakan salah satu habitat asuhan yang penting dalam siklus hidup perkembangan larva organisme perairan baik ikan maupun udang (McHugh, 1967 dalam Boehlert & Mundy, 1988). Kemampuan organisme perairan menempati suatu habitat, dipengaruhi adanya rangsangan untuk tinggal pada lingkungan tersebut guna kelangsungan hidupnya (Boehlert & Mundy, 1988). Beberapa jenis ikan bermigrasi antara perairan laut dan perairan tawar bertujuan untuk berkembang biak dan mencari pakan (Jobling, 1995).
Menurut Mchugh (1967) dalam Bergan et al. (2002) sebagian besar ikan-ikan yang ditemukan di etuaria melakukan pemijahan di laut. Spesies laut memanfaatkan estuaria sebagai daerah pengasuhan khususnya setelah ikan berpijah. Larva ikan estuaria di daerah temperate dan subtropik cenderung mencapai puncak kelimpahan pada musim semi, panas dan musim gugur dan kelimpahan yang paling sedikit pada musim dingin Neira & Potter, 1994). Untuk estuaria di daerah tropik bahwa kelimpahan relatif larva ikan sebagian besar dipengaruhi oleh salinitas dan pasokan air tawar. Demikian pula, di daerah estuaria tropik wilayah lainnya, menunjukkan dampak pasokan air tawar terhadap komunitas ichthyofauna (Morais & Morais, 1994).
Pada umumnya jenis ikan yang memijah di perairan laut terbuka atau di teluk, komunitas larva ikan tersebut bermigrasi menuju ke perairan dimana dengan sedikit atau tanpa adanya tumbuhan (sea grass dan sea weeds, misal estuaria dan laguna), kecuali larva dari jenis ikan demersal (Pratt & Arnold, 2000). Informasi tentang penyebaran komunitas larva ikan pada perairan pantai relatif belum banyak dilaporkan baik mengenai survival, pola penyebaran maupun migrasinya (Stottrup, 2002).
Ekosistem estuaria berfungsi sebagai tempat pemijahan dan tempat pengasuhan. Sehingga banyak ikan-ikan laut atau tawar yang bermigrasi memasuki perairan
estuaria untuk memijah atau membesarkan larva. Hal ini disebabkan kandungan nutrien estuaria yang sangat tinggi untuk memenuhi kebutuhan makanan bagi larva ikan. Studi mengenai larva ikan secara komprehensif belum banyak dilakukan, sehingga informasi dan data mengenai larva ikan masih sangat sedikit. Penelitian tentang larva ikan di estuaria Indonesia telah dilakukan oleh Anggraeni (2007), Amarullah (2008), Subiyanto; Ruswahyuni & Cahyono (2008) dan Prianto; Kaban & Aprianti (2010). Informasi ini diperlukan dalam penyusunan pengelolaan sumberdaya perikanan di estuaria. Penelitian ini bertujuan mengetahui tentang distribusi, kelimpahan dan variasi ukuran larva ikan pelagis di estuaria sungai Musi.
BAHAN DAN METODE Waktu dan Lokasi Pengamatan
Penelitian ini dilaksanakan tahun 2011 di estuaria Sungai Musi. Jumlah stasiun pengambilan sampel sebanyak 3 titik. Pengambilan sampel pada masing-masing stasiun pengamatan dilakukan empat kali yaitu bulan Maret, Mei, Juni dan Oktober. Penentuan stasiun pengambilan contoh dilakukan pada lokasi yang mewakili perairan estuaria yaitu stasiun 1 (Muara Delta Upang), stasiun 2 (Muara Sungai Musi) dan stasiun 3 (Pulau Payung). Lokasi pengambilan contoh dijelaskan pada Gambar 1.
Gambar 1. Peta menunjukkan lokasi pengambilan contoh larva ikan di muara sungai Musi, 2011
Figure 1. Map of fish larvae collection site in estuarine waters of Musi river, 2011
75 Pengambilan Sampel
Sampel larva ikan diambil dengan menggunakan
Bonggo net berukuran mata jaring 250 μm selama 15 menit. Jumlah sampel air yang diambil sebanyak 500 ml dan diawetkan dengan menggunakan formalin 10 %. Sampel diamati di Laboratorium Hidrobiologi Balai Penelitian Perikanan Perairan Umum Palembang. Larva ikan diukur panjang dan lebar tubuhnya dengan menggunakan mikrometer ketelitian 0.05 mm serta diidentifikasi sampai tingkat famili dengan menggunakan acuan Leis & Carson-Ewart (2000). Untuk membedakan antara satu famili dengan lainnya dilakukan pengamatan morfologi terhadap bentuk tubuh, jumlah myomere, letak sirip dada, perut, punggung, bentuk sirip ekor, perbandingan ukuran panjang dengan lebar tubuh. Perbedaan morfologi tersebut yang dijadikan dasar dalam identifikasi larva. Pengukuran salinitas masing-masing lokasi penelitian dengan menggunakan salinometer.
Analisis Data
Kelimpahan larva ikan dihitung dengan menggunakan rumus (modifikasi APHA (2005):
N = n / Vtsr ... (1) Vtsr = l x t x v ... (2)
Keterangan :
N = kelimpahan larva ikan (ind/m3),
n = jumlah larva ikan yang tercacah (ind), Vtsr = volume air tersaring.
l = luas bukaan mulut bonggo net (m). t = lama penarikan (menit).
v = kecepatan tarikan (m/menit).
HASIL DAN BAHASAN HASIL
Komposisi Jenis dan Distribusi Larva
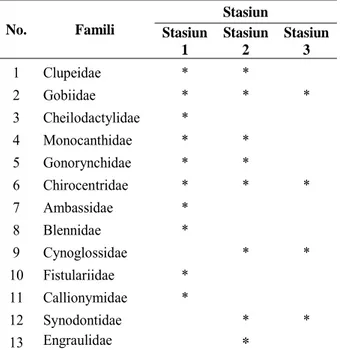
Identifikasi larva ditemukan 13 famili dengan komposisi yang berbeda untuk masing-masing stasiun pengamatan (Tabel 1). Jumlah famili yang tertinggi (10 famili) dijumpai pada stasiun 1 dan terendah (4 famili) pada stasiun 3. Famili Gobiidae dan Chirocentridae memiliki distribusi cukup luas, dimana dapat ditemukan di seluruh stasiun penelitian. Sedangkan sebanyak 11 famili larva ikan hanya ditemukan lokasi tertentu saja.
Komposisi larva berdasarkan musim, menunjukkan jumlah famili tertinggi dijumpai pada bulan Mei dan Oktober masing-masing sebanyak 7 famili, dan terendah pada bulan Juni sebanyak 3 famili. Famili dengan sebaran
temporal (musiman) yang luas adalah Gobiidae, dimana dapat ditemukan pada setiap bulan pengamatan (Tabel 2).
No. Famili Stasiun Stasiun 1 Stasiun 2 Stasiun 3 1 Clupeidae * * 2 Gobiidae * * * 3 Cheilodactylidae * 4 Monocanthidae * * 5 Gonorynchidae * * 6 Chirocentridae * * * 7 Ambassidae * 8 Blennidae * 9 Cynoglossidae * * 10 Fistulariidae * 11 Callionymidae * 12 Synodontidae * * 13 Engraulidae *
Tabel 1. Distribusi larva ikan menurut stasiun pengamatan di estuaria Sungai Musi.
Table 1. Fish larvae distribution based on sampling site in Musi river estuary.
Tabel 2. Distribution temporal larva ikan di estuaria Sungai Musi
Table 2. Temporary distribution of fish larvae at Musi river estuary
No. Famili Waktu Pengamatan
Maret Mei Juni Oktober
1 Clupeidae * * 2 Gobiidae * * * * 3 Cheilodactylidae * 4 Monocanthidae * * * 5 Gonorynchidae * * * 6 Chirocentridae * * 7 Ambassidae * 8 Blennidae * 9 Cynoglossidae * 10 Fistulariidae * 11 Callionymidae * 12 Synodontidae * 13 Engraulidae *
Kelimpahan Larva Ikan
Kelimpahan larva ikan berkisar antara 9-46 ind/m3,
dengan jumlah tertinggi ditemukan pada bulan Mei dan terendah pada bulan Juni (Gambar 2). Gambar 2 dapat dilihat kelimpahan larva setiap bulan memiliki perbedaan yang mencolok. Pada bulan Maret dan Mei memiliki kelimpahan yang tinggi (masing 45 dan 46 ind/m3)
sedangkan bulan Juni dan Oktober memiliki kelimpahan yang lebih rendah (masing-masing 9 dan 15 ind/m3).
Gambar 2. Kelimpahan larva ikan di estuaria sungai Musi. Figure 2. The abundant of fish larvae in Musi river
estuary
Perbedaan kelimpahan larva ikan pada setiap stasiun kemungkinan disebabkan oleh faktor fisika-kimia perairan yang berbeda. Disamping itu, kondisi geomorfologi perairan juga mempengaruhi kesuburan perairan. Secara tidak langsung kesuburan perairan akan mempengaruhi kelimpahan meroplankon. Gambar 3 menunjukkan stasiun 1 memiliki kelimpahan rata-rata 65 ind/m3 dan stasiun 3
sebanyak 7 ind/m3. Tingginya kelimpahan di stasiun 1
Gambar 3. Kelimpahan larva ikan menurut stasiun pengamatan diperairan estuaria sungai Musi. Figure 3. The abundance of fish larvae based on
sampling site in Musi river estuary Variasi Ukuran Larva Ikan
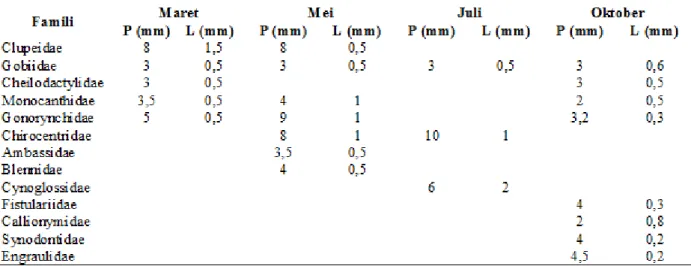
Pada bulan Maret ukuran larva ikan terbesar memiliki panjang total 8 mm dan lebar 1,5 mm yaitu famili Clupeidae. Ukuran terkecil ditemukan pada famili Gobiidae dan Cheilodactylidae masing-masing memiliki panjang 3 mm dan lebar 0,5 mm. Pada bulan Mei ukuran larva ikan terbesar terdapat pada famili Gonorynchidae dengan panjang 9 mm dan lebar 1 mm, sedangkan ukuran terkecil pada famili Gobiidae dengan ukuran panjang 3 mm dan lebar 0,5 mm. Selanjutnya pada bulan Juli ukuran terbesar terdapat pada famili Chirocentridae dengan panjang 10 mm dan lebar 1 mm. Pada bulan Oktober ukuran terbesar terdapat pada famili Engraulidae dengan panjang 4,5 mm dan lebar 0,2 mm (Tabel 3).
diduga lokasi tersebut memiliki habitat yang cocok untuk pemijahan dan pengasuhan larva ikan.
Tabel 3. Variasi ukuran larva ikan pada setiap bulan pengamatan Table 3. Size variation of fish larvae based on observation by month
Keterangan/remarks : P = Panjang/length L = Lebar/width
E. Prianto, et al. / BAWAL Vol. 5 (2) Agustus 2013 : 73-79
0 5 10 15 20 25 30 35 40 45 50
Maret Mei Juni Oktober
Kel im p a h an (I nd/m 3 ) Bulan
77 BAHASAN
Gobiidae dan Chirocentridae merupakan famili yang ditemukan diseluruh lokasi sampling, sedangkan beberapa famili lainnya ditemukan hanya pada lokasi tertentu. Dengan demikian, penyebaran famili Gobiidae dan Chirocentridae cukup luas dan kedua famili tersebut memiliki toleransi atau kemampuan adaptasi yang baik terhadap perubahan salinitas yang besar (euryhaline), sehingga dapat ditemukan pada semua stasiun penelitian. Kedua famili tersebut dapat dijadikan indikator bahwa lokasi yang didiaminya termasuk perairan estuaria. Subiyanto et al. (2008) menyatakan famili Gobiidae dan Chirocentridae memiliki kemampuan adaptasi yang baik terhadap lingkungan estuaria dan biasanya dominan tertangkap di perairan tersebut.
Penelitian di estuaria sungai Musi diperoleh jumlah larva ikan sebanyak 6 famili yang terdiri dari Gobiidae, Antennariidae, Scombridae, Gonorynchidae, Schindleriidae dan Synodontidae (Prianto et al., 2010). Dibandingkan dengan hasil penelitian sebelumnya maka terdapat perbedaan komposisi larva ikan. Perbedaan komposisi ini diduga karena perbedaan lokasi sampling dan waktu pengambilan sampel.
Penelitian yang dilakukan Subiyanto et al. (2008) di estuaria Pelawangan Timur Segara Anakan Cilacap diperoleh 15 famili yang didominasi oleh Clupeidae, Atherinidae, Pomacentridae dan Gobiidae. Raynie & Shaw (1994) dalam Añorve et al. (2003) menyatakan bahwa larva ikan di wilayah estuaria dapat berasal dari perairan laut atau air tawar atau berasal dari estuaria itu sendiri. Hasil pengamatan di laboratorium selama penelitian tahun 2011 diperoleh informasi bahwa beberapa jenis larva ikan merupakan spesies laut yang melakukan pemijahan di estuaria.
Menurut Castro & Boncker (1996) jumlah jenis ichytoplankton di estuaria Caete-Brazil sebanyak 63 taxa dan 28 famili. Jumlah ini lebih tinggi dari estuaria di bagian utara Brazil yang terdiri dari 24 taxa dan 17 famili selanjutnya Krishnamurthy & Jeysaleelam (1981) melakukan penelitian di perairan estuaria India menemukan 195 taxa. Menurut Dianthani (2003) dalam Prianto et al. (2008), jumlah spesies di estuaria pada umumnya lebih sedikit dari pada di air tawar atau air laut didekatnya. Hal ini antara lain karena ketidakmampuan organisme air tawar mentolerir kenaikan salinitas sedangkan organisme air laut mampu mentolerir penurunan salinitas.
Komposisi dan jumlah jenis larva pada setiap stasiun pengamatan di etsuaria sungai Musi berbeda. Karena adanya perbedaan salinitas pada masing-masing stasiun pengamatan. Menurut Flores-Coto (1988) dalam Ocana-Luna & Sanches-Ramirez (2003) bahwa komposisi, kelimpahan dan pola distribusi larva ikan di laguna
disebabkan oleh pertukaran massa air laut dan laguna. Tzeng et al. (1997) memberikan pandangan bahwa variasi salinitas yang tinggi akan menyebabkan kekayaan jenis yang rendah dan lebih mudah didominasi oleh jenis tertentu.
Amarullah (2008) menyatakan aliran arus sepanjang pantai (along shore drift) sangat berperan terhadap akumulasi larva di daerah asuhan atau di daerah pasang surut (inter tidal zone), surf zone ataupun estuari. Selain itu, faktor hidrografi di perairan pantai atau daerah asuhan yang berpengaruh sebagai stimuli tingkah laku imigrasi larva ikan diantaranya adalah aliran pasang surut (tidal flux) termasuk di dalamnya kecepatan arus, salinitas (terutama untuk perairan estuari), kekeruhan, komposisi substrat dan juga pengaruh siklus bulan. Berdasarkan informasi diatas dapat diduga bahwa salah satu penyebab perbedaan komposisi dan jumlah jenis larva diestuaria disebabkan karena perbedaan salinitas. Salinitas perairan pada stasiun 1 sekitar 13 ‰, stasiun 2 (1 ‰) dan stasiun 3 (0 ‰).
Ditinjau menurut waktu pengamatan, tingginya kelimpahan pada bulan Maret dan Mei diduga berkaitan dengan musim pemijahan. Salinitas pada saat itu berkisar antara 5-15 ‰. Menurut Anggraeni (2007) kisaran salinitas (6,8-27,6 ‰) merupakan salinitas yang dapat ditoleransi bagi larva ikan sehingga ikan-ikan di estuaria melakukan pemijahan pada kisaran salinitas tersebut. Kemudian ditinjau lokasi sampling bahwa stasiun 1 memiliki kelimpahan yang tertinggi yaitu 65 ind/m3. Hal ini diduga
karena pada stasiun 1 salinitas perairan cukup tinggi (13 ‰), dimana salinitas tersebut merupakan kondisi yang ideal untuk pemijahan ikan.
Añorve (2003) menyatakan kelimpahan larva di estuaria Carribean tidak menunjukkan adanya pola distribusi secara spasial dan nilai kelimpahan pada bulan Oktober bervariasi antara 0-227 ind/100 m3. Jika dibandingkan antara estuaria
sungai Musi dengan di estuaria Carribean maka kelimpahan larva ikan di estuaria sungai Musi jauh lebih tinggi. Penelitian oleh Prianto et al. (2010) di estuaria sungai Musi diperoleh kelimpahan larva ikan sebesar 6 ind/10 m3, sedangkan yang diperoleh pada tahun 2011
kelimpahan larvanya lebih tinggi (9-46/ m3). Pengambilan
sampel yang dilakukan Prianto et al. (2010) dilakukan pada malam hari, sedangkan pada penelitian ini pada siang hari.
Variasi ukuran larva setiap bulan pengamatan pada masing-masing famili menunjukkan perbedaan yang mencolok. Hal ini mengindikasikan bahwa ukuran larva ikan setiap famili berbeda-beda tergantung kepada jenisnya. Dengan adanya perbedaan ukuran ini kemungkinan ukuran dan jenis makanan yang dikonsumsi juga akan berbeda sehingga kompetisi dalam mendapatkan makanan akan berkurang.
Penelitian oleh Sugiharto (2005) menujukkan variasi ukuran (panjang standar) larva ikan di estuaria Pelawangan Timur Segara Anakan Cilacap diperoleh ukuran antara 1,53-41,4 mm. Data yang diperoleh selama penelitian di Sungai Musi diperoleh kisaran ukuran larva sama dengan hasil pengamatan di Segara Anakan Cilacap. Dimana variasi ukuran larva ikan di estuaria sungai musi berkisar (3-8 mm (bulan Maret), 3-8 mm (bulan Mei), 4-10 mm (bulan Juli) dan 2-4.5 mm (bulan Oktober). Ini menunjukkan bahwa ukuran larva ikan pada beberapa estuaria di Indonesia memiliki ukuran yang sama.
KESIMPULAN
1. Stasiun 1 memiliki komposisi famili dan kelimpahan yang tinggi sehingga diduga merupakan daerah pemijahan dan asuhan ikan yang cukup baik di estuaria sungai Musi.
2. Larva ikan dari famili Gobiidae memiliki sebaran yang cukup luas baik spasial maupun temporal.
3. Kelimpahan ikan yang tertinggi dijumpai pada bulan Maret (45 ind/m3) dan Mei (46 ind/m3). Diduga bulan tersebut merupakan musim pemijahan.
4. Ukuran larva ikan (panjang total) di estuaria sungai Musi setiap bulannya memiliki variasi ukuran yang hampir sama.
PERSANTUNAN
Tulisan ini merupakan bagian dari kegiatan Dampak Perubahan Iklim Terhadap Sumberdaya Ikan di Sungai Musi. Tahun anggaran 2011yang didanai APBNdi Balai Penelitian Perikanan Perairan Umum Palembang.
DAFTAR PUSTAKA
Amarullah, M. H. 2008. Hidro-Biologi Larva Ikan Dalam Proses Rekrut. Jurnal Hidrosfir Indonesia. 3 (2): 75-80.
American Public Health Association. 2005. Standard Methods for The Examination of Water and Waste Water. 21st edition. Washington DC. America.
Anggraeni, R.D. 2007. Pengaruh Pembuangan Limbah Tambak Udang Terhadap Densitas dan Pola Distribusi Larva dan Juvenil Ikan di Muara Sungai Bogowonto Kabupaten Kulonprogo. Sekolah Pascasarjana Universitas GadjahMada Program Studi Biologi. Tesis.
Añorve, L.S; A.H. Gallardo; S. A. Aguirre & C. F. Coto. 2003. Fish larvae from a Caribbean estuarine system. The big fish bang. In Howard I. Browman & A.B Skiftesvik (Eds). Proceedings of the 26th Annual Larval Fish Conference. Institute of Marine Research, Postboks 1870 Nordnes, N-5817, Bergen, Norway.
Bergan, B; M, Barletta & U. Saint-Paul. 2002. Structure and Seasonal Dynamics of Larva Fish in The Caete River Estuary in North Brazil. Estuarine, Coastal and Shelf Science : p. 193-206.
Boehlert, G.W & B.C. Mundy. 1988. Roles of Behavioral and Physical Factors in Larval and Juvenile Fish Recruitment to Estuarine Nursery Area. Proceeding of American Fisheries Society Symposium 3: 51-67.
Castro, M. S & A. C. T. Boncker,. 1996. Ocorreˆncia de larvas de peixe no sistema estuarino de Rio Mucuri.
Arquivo de Biologia eTechnologia 39: 171–185.
Jobling, M. 1995. Environmental Bioloy of Fishes. Fish and Fisheries Series 16. Chapman & Hall T.J. Press, Ltd. New York.
Leis, J. M & B. M. Carson Ewart. 2000. The Larvae of Indo-Pacifik Coastal Fishes. An Identification Guide to Marine Fishes Larva. (Fauna Malesiana Handbooks 2) : 850 p.
Morais, T. A. & T. L. Morais. 1994. The abundance and diversity of larval and juvenile fish in a tropical estuary.
Estuaries 17: 216–225.
Neira, F. J. & I. C. Potter. 1994. The larval fish assemblage of the Nornalup-Walpole Estuary, a permanently open estuary on the southern coast of western Australia.
Australian Journal of Marine and Freshwater Research 45:1193–1207.
Ocana-Luna, A & M. Sanches-Ramirez. 2003. Diversity of ichtyoplankton in Tampamachoco Lagoon Veracruz, Meico. Anales del Instituto de Biologia, Universidad Nacional Autonoma de Mexico, Serie Zoologia. 74 (2): 179-193.
Prianto, E., S. Kaban & S. Aprianti. 2010. Sebaran dan Kelimpahan Larva ikan di Perairan Pantai Timur Sumatera. Prosiding Seminar Nasional Tahunan. Sekolah Tinggi Perikanan. Jakarta. p. 361-364.
Prat, C. & J. D Arnold. 2000. Studies of the Temporal and Spatial Distribution of Larvae in Laguna Madre and the Impact of the Brown Atide. www.utmsi.zo.utezas. edu/research/mfrp/index.htm
:
diunduh pada Maret 2012.Sediadi & T. Sidabutar. 1994. Kelimpahan telur dan larva ikan diperairan Teluk Baguala, Pulau Ambon. Himpunan Alumni Fakultas Perikanan Universitas Riau. Pekanbaru. Jurnal Terubuk (XX). 59: 26-31.
79 Stottrup, J. G. 2002. Coastal Juvenile Fish Ecology.
Departement of Marine Ecology and Aquaculture, Danish Institute for Fisheries Research, Charlottenlund Castle. www.dfu.min.dk/jgs/research diunduh pada Maret 2012.
Subiyanto; Ruswahyuni & D. G. Cahyono. 2008. Komposisi dan Distribusi Larva Ikan Pelagis di Estuaria Pelawangan Timur, Segara Anakan, Cilacap. Jurnal
Saintek Perikanan. 4 (1): 62 – 68.
Sugiharto. 2005. Analisis Keberadaan dan Sebaran Komunitas Larva Ikan Pelagis pada Ekosistem Pelawangan Timur Segara Anakan-Cilacap. Tesis
Magister Manajemen Sumberdaya Pantai Program Pascasarjana Universitas Diponegoro. 80 p.
Tzeng, W.N; Y.T. Wang & C.W. Chang. 2002. Spatial and temporal variations of the estuarine larval fish community of the west coast of Taiwan. Mar. Freshwater Res. 53: 419-430.
81
Korespondensi penulis:
Balai Penelitian Perikanan Laut Jakarta
Jl. Muara Baru Ujung, Komp. Pelabuhan Perikanan Nizam Zachman, Jakarta Utara
DINAMIKA POPULASI IKAN SWANGGI (Priacanthus tayenus)
DI PERAIRAN TANGERANG – BANTEN
POPULATION DYNAMIC OF PURPLE SPOTTED BIGEYE (Priacanthus
tayenus) IN TANGERANG WATERS – BANTEN
Prihatiningsih, Bambang Sadhotomodan Muhamad Taufik Balai Penelitian Perikanan Laut, Jakarta
Teregistrasi I tanggal: 02 Oktober 2012; Diterima setelah perbaikan tanggal: 19 Juni 2013; Disetujui terbit tanggal: 28 Juni 2013
Email : [email protected] ABSTRAK
Ikan swanggi merupakan ikan ekonomis dan ekologis penting dan statusnya di perairan belum terevaluasi dengan baik. Penelitian ini bertujuan untuk mengetahui pertumbuhan, umur dan mortalitas ikan swanggi yang dapat memberikan kontribusi terhadap pengelolaan sumber daya ikan yang berkelanjutan dan lestari. Data frekuensi panjang dan berat ikan pada Januari – Desember 2012 diperoleh dari perairan Tangerang dan sekitarnya berasal dari hasil tangkapan jaring cantrang. Sebaran frekuensi panjang ikan dipisahkan kedalam sebaran normal menggunakan metode Bhattacharya. Hubungan panjang-berat ikan swanggi jenis jantan dan betina bersifat allometrik negatif dan memiliki faktor kondisi yang baik (k=1,26). Rata-rata ukuran pertama kali tertangkap ikan swanggi (Lc=20,84 cm) lebih besar dibandingkan dengan ukuran pertama kali matang gonad (Lm=16,03 cm). Ikan swanggi dapat tumbuh hingga mencapai panjang infinitive (L”) = 32,34 cm dengan laju pertumbuhan (K) sebesar 0,91 tahun-1 dan nilai dugaan umur teoritis pada saat panjang ikan sama dengan nol (t0) adalah 0,14 tahun-1. Panjang maksimal ikan swanggi diduga berumur 3,5 tahun dan rata-rata panjang ikan pertama kali matang gonad (Lm) diduga berumur 0,75 tahun. Mortalitas alami (M) ikan swanggi adalah 1,67, mortalitas karena penangkapan (F) 0,83, mortalitas total (Z) 2,50 dan tingkat eksploitasi (E) sebesar 0,33 yang berarti pemanfaatannya masih dapat ditingkatkan sekitar 34% dari keadaan saat ini.
KATA KUNCI : Pertumbuhan, umur, mortalitas, ikan swanggi, Tangerang - Banten. ABSTRACT:
The purple spotted bigeye an economically and ecologically important fish and status in the waters have not been evaluated well. This research was aimed to understand the growth, age and mortality of the purple spotted bigeye. It was hoped that the results of this research can be contributed in sustainable fisheries management. The length frequency data and weight of fish in January - December 2012 was obtained from Tangerang and surrounding waters derived from trawl’s catch,. The size distribution of the fish was divided into normal distribution by using Battacharya Method. Length weight relationship of the male and female fish were negative allometric and has a good condition factor (K=1,26). The average length at first capture of the purple spotted bigeye (Lc = 20,84) was higher than the average length at first maturity (Lm=16,03). The purple spotted bigeye can grow into infinitive length of (L”) = 32,34 cm with growth rate (K) of 0,91 year-1 and (t
0) value of 0,14 year
-1. The maximum length of the fish was predicted reach at age of 3,5 years with the average length of first maturity predicted reach at age 0,75 years. Natural mortality value (M) of the purple spotted bigeye was 1,67; fishing mortality (F) value was 0,83; total mortality value (Z) was 2,5 and exploitation rate (E) was at 0,33 which mean utilization can be improved about 34% from the current state.
KEYWORDS : Population dynamic, purple spotted bigeye, Tangerang - Banten.
PENDAHULUAN
Ikan swanggi (Priacanthus tayenus) memiliki potensi besar dalam mendukung pemenuhan kebutuhan pangan. Menurut Sivakami et al. (2001) ikan swanggi pada awalnya bukan merupakan ikan hasil tangkapan utama, namun belakangan banyak didaratkan di pelabuhan perikanan sebagai salah satu hasil tangkapan yang bersifat komersial dan menjadikan ikan ini sebagai ikan komoditas ekspor.
Ikan swanggi dikatakan bernilai ekologis karena merupakan salah satu ikan karang yang berperan dalam struktur trofik (Powell 2000). Ikan Priacanthidae merupakan ikan predator pemakan zooplankton dan dominasi makanannya berupa udang-udangan yang berasal dari kelas krustasea (CMFRI, 2001). Dalam kaitan itu keberadaannya sangat berpengaruh terhadap keseimbangan ekosistem di perairan.
Ikan swanggi merupakan salah satu jenis ikan demersal dan biasanya terdapat di daerah karang atau terumbu karang dengan karakteristik khusus berwarna merah muda, memiliki mata besar dan pada sirip perutnya terdapat bintik berwarna kehitam-hitaman (FAO 1999). Umumnya ikan ini memiliki daya tahan yang rendah terhadap tekanan penangkapan. Jika upaya penangkapan ditingkatkan, maka akan segera menunjukkan tanda-tanda ‘kejenuhan’ yang seterusnya akan mengarah kepada ‘overfishing’. Pemahaman tentang dinamika populasi dari suatu jenis ikan yang dieksploitasi merupakan hal yang sangat penting bagi pengelolaan yang efektif dari suatu perikanan untuk memperoleh manfaat yang maksimum (Gulland, 1983).
Penelitian ini bertujuan untuk mengetahui pendugaan dinamika populasi terutama pertumbuhan, umur dan mortalitas ikan swanggi di perairan Tangerang dan sekitarnya yang merupakan bagian dari WPP 712 Laut Jawa berdasarkan analisis secara analitik terhadap sejumlah data yang dikumpulkan secara periodik. BAHAN DAN METODE
Penelitian Lapangan
Pengambilan contoh ikan swanggi (Priacanthus tayenus) dilakukan di Tempat Pendaratan Ikan (TPI) Kronjo dan Cituis (Tangerang, Banten) mulai Januari – Desember 2012. Contoh panjang dan berat individu ikan diperoleh dari hasil tangkapan jaring cantrang dengan mata jaring (mesh size) 1 inch. Jaring cantrang dioperasikan di perairan Utara Jawa khususnya di perairan Tangerang dan sekitarnya sampai kedalaman 30 m. Contoh ikan diukur panjang dengan ketelitian 0,1 cm dan bobotnya dengan ketelitian 0,1 gram.
Analisis Data
Hubungan Panjang-Bobot
Hubungan panjang-bobot mengacu pada Effendie (1979) dengan formula:
W = aLb ...(1)
dimana : W = Bobot; L = panjang
a = intersep (perpotongan kurva hubungan panjang-bobot dengan sumbu Y)
b = kemiringan (slope)
Untuk menguji nilai b = 3 atau b 3 dilakukan uji –t (uji parsial), maka dilakukan hipotesis terhadap nilai b dengan asumsi:
H0 : b = 3, hubungan panjang dan bobot adalah isometrik H1 : b 3, hubungan panjang dengan bobot adalah
allometrik yaitu :
Pola hubungan panjang-bobot bersifat allometrik positif, bila b > 3 (pertambahan berat lebih cepat daripada pertambahan panjang), dan allometrik negatif, bila b < 3 (pertambahan panjang lebih cepat daripada pertambahan berat).
Faktor Kondisi
Faktor kondisi dihitung menurut panjang dan berat ikan, setelah pola pertumbuhan panjang diketahui, perhitungan dilakukan berdasarkan pada rumus dari (Effendie, 1979):
k = 102 W/L3 ………...………...(2)
dimana:
k = faktor kondisi; W = bobot rata-rata ikan; L = panjang rata-rata ikan
Pendugaan Rata-rata Panjang Pertama Kali Tertangkap (Lc) dan Panjang Pertama Kali Matang Gonad (Lm)
Pendugaan ukuran pertama kali tertangkap dilakukan dengan membuat grafik hubungan antara panjang ikan (sumbu X) dengan jumlah ikan (sumbu Y) sehingga diperoleh kurva berbentuk sigmoid. Nilai length at first capture yaitu panjang pada 50% pertama kali tertangkap dihitung dengan persamaan sebagai berikut (Jones, 1976 dalam Sparre & Venema, 1999) :
) * exp( 1 1 2 1 S L S est SL ...(3) L S S SL Ln 1 1 1 2* ...(4) 2 1 % 50 S S L ...(5) dimana : SL = kurva logistik; S1= a; S2= b
S1 dan S2 = konstanta pada rumus kurva logistik
Pendugaan panjang pertama kali matang gonad (length at first maturity) dilakukan sesuai dengan prosedur penghitungan yang dilakukan oleh Udupa (1986), melalui rumus :
m = Xk + X/2 – (X Pi )...(6) dimana :
m = log ukuran ikan saat pertama matang gonad Xk = log ukuran ikan dimana 100% ikan sampel sudah matang
83 X = selang log ukuran (log size increment)
Pi = proporsi ikan matang pada kelompok ke-i
Rata-rata ukuran ikan pertama matang gonada diperoleh dari nilai antilog (m).
Estimasi Parameter Pertumbuhan
Penentuan kelompok ukuran (kohort) dilakukan menggunakan metode Bhattacharya dari program paket software FISAT. Pendugaan nilai koefesien pertumbuhan L” dan K dilakukan dengan menggunakan metode ELEFAN (Electronic Length – Frequency Analysis) I dan Gulland & Holt plot, sedangkan t0 diperoleh melalui persamaan Pauly (1983). Ketiga nilai dugaan parameter pertumbuhan tersebut dimasukkan ke model pertumbuhan Bartalanffy. Pola pertumbuhan ikan swanggi menggunakan rumus Von Bartalanffy (Sparre & Venema, 1999) sebagai berikut :
Lt = L (1- e-k (t – to))...(7)
dimana :
Lt = ukuran panjang ikan pada saat umur t tahun(cm) L” = panjang maksimum ikan yang dapat dicapai t0 = umur ikan teoritis pada saat panjangnya 0 cm K = Koefisien pertumbuhan
Nilai t0 ikan diperoleh dengan menggunakan rumus (Pauly, 1984) yaitu :
Log- (t0) = -0,3922–0,2752 Log L-1,038 Log K ...(8) Mortalitas
Mortalitas total (Z) dalam suatu kegiatan perikanan tangkap sangat penting untuk menganalisis dinamika populasi atau stok ikan. Mortalitas dapat dibedakan dalam mortalitas alami (M) dan mortalitas karena penangkapan (F). Mortalitas total dapat diduga dari pergeseran
kelimpahan kelompok umur dan dari analisis kurva hasil tangkapan menggunakan data frekuensi panjang (Sparre & Venema, 1999). Mortalitas total dihitung menggunakan rumus :
Z = M + F ...(9) Mortalitas alami (M) diduga dengan metode persamaan empiris Pauly (1983) dengan rumus :
Ln M = -0,152 – 0,279*LnL +0,6543*LnK + 0,463 * Ln T ...(10) dimana :
M = mortalitas alami per tahun
L = panjang maksimum ikan yang dapat dicapai K = Koefisien pertumbuhan
T = Suhu rata-rata tahunan (ºC) HASIL DAN BAHASAN
HASIL
Hubungan Panjang-Bobot
Pengukuran individu terhadap 3.814 ekor ikan swanggi (Priacanthus tayenus) di perairan Tangerang - Banten diperoleh sebaran ukuran panjang cagak berkisar antara 11,3 – 31,0 cm FL dengan rata-rata 20,7 cm FL dan kisaran bobotnya antara 32,0 – 228,0 gram dengan rata-rata 110,5 gram.
Persamaan panjang-bobot ikan swanggi bagi kelamin jantan adalah W = 0,074L2,467 dan kelamin betina adalah
W = 0,126L2,286 dengan nilai koefesien korelasi (r)
masing-masing 0,912 dan 0,847 (Gambar 1). Jika nilai koefisien korelasi (r) mendekati nilai -1 atau 1, maka terdapat hubungan linier yang kuat antara kedua variabel tersebut (Walpole, 1993). Dengan demikian terdapat hubungan
Gambar 1. Hubungan panjang – berat ikan swanggi (Priacanthus tayenus) di perairan Tangerang
Figure 1. Length – weight relationship of purple spotted bigeye (Priacanthus tayenus) in Tangerang waters.
Prihatiningsih, et al. / BAWAL Vol. 5 (2) Agustus 2013 : 81-87
yang erat sekitar 80-90% antara panjang dengan berat ikan swanggi di perairan Tangerang-Banten.
Faktor Kondisi
Faktor kondisi adalah suatu keadaan yang menyatakan kemontokan ikan (Effendie, 1979). Nilai faktor kondisi ikan swanggi berkisar antara 1,14 – 1,49 dengan rata-rata 1,26. Nilai terkecil terdapat pada bulan Oktober (1,14) dan terbesar pada bulan Januari (1,49). Mengacu pada Effendie (1997) hasil ini menandakan ikan swanggi masih berada pada batas ambang kondisi yang baik dengan kisaran nilai (k) antara 1-3.
Pendugaan Rata-rata Panjang Pertama Kali Tertangkap (Lc) dan Panjang Pertama Kali Matang Gonad (Lm)
Pendugaan rata-rata ukuran panjang pertama kali tertangkap (Lc) ikan swanggi diperoleh nilai 20,84 cm FL
Gambar 2. Panjang rata-rata (50% kumulatif) ikan swanggi (Priacanthus tayenus) di perairan Tangerang. Figure 2. Average length (50% cumulatif) of purple spotted bigeye (Priacanthus tayenus) in Tangerang waters.
dan rata-rata ukuran panjang pertama kali matang gonad (Lm) adalah 16,03 cm FL (Gambar 2).
Estimasi Parameter Pertumbuhan
Dari model pertumbuhan Von Bartalanffy, didapat koefesien pertumbuhan (K) sebesar 0,91 tahun-1. Nilai
panjang asimtotik (L ) sebesar 32,34 cm, dan nilai dugaan umur teoritis pada saat panjang ikan sama dengan nol (t0) adalah 0,14 tahun-1 sehingga diperoleh persamaan
pertumbuhan ikan swanggi di perairan Tangerang - Banten adalah Lt = 32,34 (1 – e-0,91(t-+0,14)) (Gambar 3 dan 4).
Mortalitas
Nilai mortalitas alami (M) ikan swanggi (Priacanthus tayenus) pada suhu air 29°C di perairan Banten adalah 1,67 tahun-1; mortalitas karena penangkapan (F) 0,83 tahun
-Gambar 3. Kurva distribusi frekuensi panjang ikan swanggi (Priacanthus tayenus)
Figure 3. Length frequency distribution curve length of Purple Spotted Bigeye (Priacanthus tayenus).
Gambar 4. Kurva pertumbuhan von Bertalanffy ikan swanggi (Priacanthus tayenus)
Figure 4. Von Bertalanffy growth curve of Purple Spotted Bigeye (Priacanthus tayenus)
1 dan mortalitas total (Z) 2,50 tahun-1 dan tingkat eksploitasi
(E) ikan swanggi adalah 0,33. BAHASAN
Nilai b pada jenis kelamin jantan dan betina ikan swanggi adalah 2,467 dan 2,286. Dari hasil uji –t terhadap parameter b pada selang kepercayaan 95% (á=0,05), diperoleh thitung > ttabel, yang artinya b < 3. Secara keseluruhan pola pertumbuhan ikan swanggi baik jantan maupun betina bersifat allometrik negatif dimana pertambahan panjang lebih cepat dibandingkan pertambahan berat. Hasil penelitian ini tidak berbeda dengan hasil penelitian Nugroho & Rustam (1983) bahwa pola pertumbuhan ikan swanggi di pantai Utara Jawa bersifat allometrik negatif.
Penentuan faktor kondisi dilakukan untuk mendeteksi perubahan yang terjadi secara mendadak di suatu perairan yang mempengaruhi kondisi ikan. Nilai faktor kondisi hasil penelitian ini menunjukkan bahwa ikan swanggi rata-rata memiliki kondisi yang baik (k = 1,26).
Prihatiningsih, et al. / BAWAL Vol. 5 (2) Agustus 2013 : 81-87
0 5 10 15 20 25 30 35 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Pa n ja n g cag a k/ Fo rk Le ngt h (cm)
Umur (Tahun)/ Age (Year)
85 Perubahan nilai faktor kondisi tiap bulan diduga
adanya pengaruh pola musim yang terjadi di perairan Banten dimana pada Januari terjadi musim barat sehingga ikan harus beradaptasi terhadap perubahan kondisi lingkungan yang berpengaruh pada ketersediaan makanan. Tingginya nilai faktor kondisi (k) pada Januari diduga merupakan musim pemijahan ikan swanggi, hal ini ditunjang dengan tingkat kematangan gonad III pada bulan tersebut didapatkan lebih banyak. Pada saat kondisi ini pertambahan berat semakin meningkat dibandingkan pertambahan panjang ikan. Menurut Effendie (1997), nilai faktor kondisi berkaitan dengan makanan (indeks relatif penting), umur, jenis kelamin dan indeks kematangan gonad (IKG).
Pendugaan rata-rata ukuran ikan swanggi pertama kali matang gonad di perairan Tangerang-Banten yaitu pada panjang 16,03 cm. Hal ini berbeda dengan hasil penelitian Sivakami et al. (2001) pada spesies satu genus dari Priacanthus tayenus yaitu Priacanthus hamrur yang
diteliti disepanjang pantai India yang rata-rata ukuran pertama kali matang gonad berada pada panjang 19,1-20,0 cm.
Pendugaan rata-rata ukuran ikan swanggi pertama kali tertangkap lebih besar dibandingkan dengan ukuran pertama kali matang gonad (Lc>Lm ; 20,84cm > 16,03 cm). Keadaan ini baik untuk ketersediaan stok ikan swanggi karena sebelum ikan tersebut tertangkap maka terlebih dulu sudah melangsungkan proses rekruitmen. Hal ini akan dapat menjamin sumberdaya ikan swanggi berada dalam keadaan berkelanjutan dan lestari.
Koefesien pertumbuhan (K) ikan swanggi di perairan Tangerang-Banten sebesar 0,91 tahun-1 dan panjang total
maksimum adalah 31,0 cm atau lebih kecil dibandingkan dengan panjang asimtotik (L”) 32,34 cm. Perbedaan antara panjang maksimum yang diperoleh dengan panjang asimtotik, menimbulkan penafsiran bahwa ada ikan berukuran besar lebih dari 31,0 cm yang belum tertangkap.
Hasil estimasi parameter pertumbuhan ikan swanggi
(Priacanthus tayenus) di daerah penangkapan yang
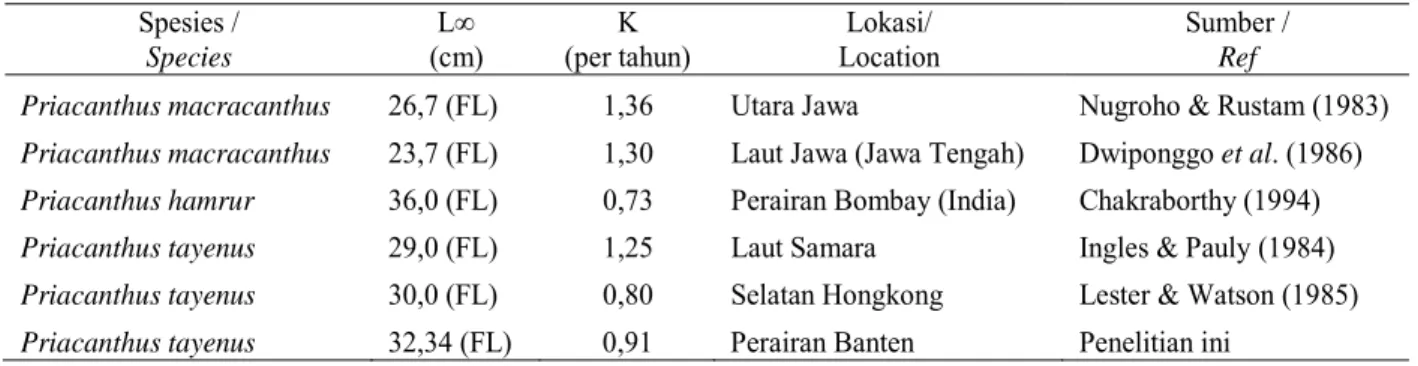
berbeda diantaranya Utara Jawa (Indonesia), Laut Samara dan Selatan Hongkong telah diteliti (Tabel 1). Dari beberapa parameter populasi yang berbeda, didapatkan
Tabel 1. Estimasi parameter pertumbuhan ikan swanggi (Priacanthus tayenus) dengan daerah penangkapan yang
berbeda.
Table 1. Estimation of parameters of purple spotted bigeye (Priacanthus tayenus) with different of fishing ground.
Keterangan/Remark : FL = Fork Length.
panjang maksimum ikan yang dapat dicapai setiap wilayah dan laju pertumbuhan yang berbeda pula.
Umur dan pertumbuhan ikan digunakan untuk memahami komposisi umur dari populasi, umur kematangan, rentang hidup yang merupakan dasar dalam perhitungan pertumbuhan, mortalitas, rekrutmen dan parameter populasi lainnya. Berdasarkan persamaan pertumbuhan ikan swanggi di perairan Tangerang-Banten diperoleh panjang maksimal ikan swanggi (L” = 32,34 cm) diduga berumur 3,5 tahun; rata-rata panjang ikan pada saat pertama kali tertangkap (Lc) : 20,84 cm diduga berumur 1,13 tahun serta rata-rata panjang ikan pertama kali matang gonad (Lm) : 16,03 cm diduga berumur 0,75 tahun. Hasil penelitian Nugroho & Rustam (1983) mendapatkan umur ikan swanggi jenis Priacanthus macracanthus untuk
mencapai panjang maksimal diduga setelah mencapai 4 – 5 tahun. Chakraborthy (1994) menemukan umur ikan swanggi jenis Priacanthus hamrur di perairan Bombay
diduga berumur 1 tahun untuk panjang 19,3 cm dan berumur 2 tahun untuk panjang ikan 28,3 cm serta berumur 3 tahun untuk panjang ikan 32,3 cm. Dengan demikian, ikan swanggi memiliki laju pertumbuhan yang tinggi dan umur yang relatif pendek.
Mortalitas alami (M) ikan swanggi (Priacanthus tayenus) di perairan Tangerang-Banten dan sekitarnya
adalah 1,67, mortalitas karena penangkapan (F) 0,83, mortalitas total (Z) 2,50. Lester & Watson (1985) menemukan laju mortalitas alami (M) ikan swanggi (Priacanthus tayenus) di Laut Cina Selatan adalah 1,4;
Prihatiningsih, et al. / BAWAL Vol. 5 (2) Agustus 2013 : 81-87
Spesies / Species
L∞
(cm) (per tahun) K Location Lokasi/ Sumber / Ref
Priacanthus macracanthus 26,7 (FL) 1,36 Utara Jawa Nugroho & Rustam (1983)
Priacanthus macracanthus 23,7 (FL) 1,30 Laut Jawa (Jawa Tengah) Dwiponggo et al. (1986)
Priacanthus hamrur 36,0 (FL) 0,73 Perairan Bombay (India) Chakraborthy (1994)
Priacanthus tayenus 29,0 (FL) 1,25 Laut Samara Ingles & Pauly (1984)
Priacanthus tayenus 30,0 (FL) 0,80 Selatan Hongkong Lester & Watson (1985)
Priacanthus tayenus 32,34 (FL) 0,91 Perairan Banten Penelitian ini