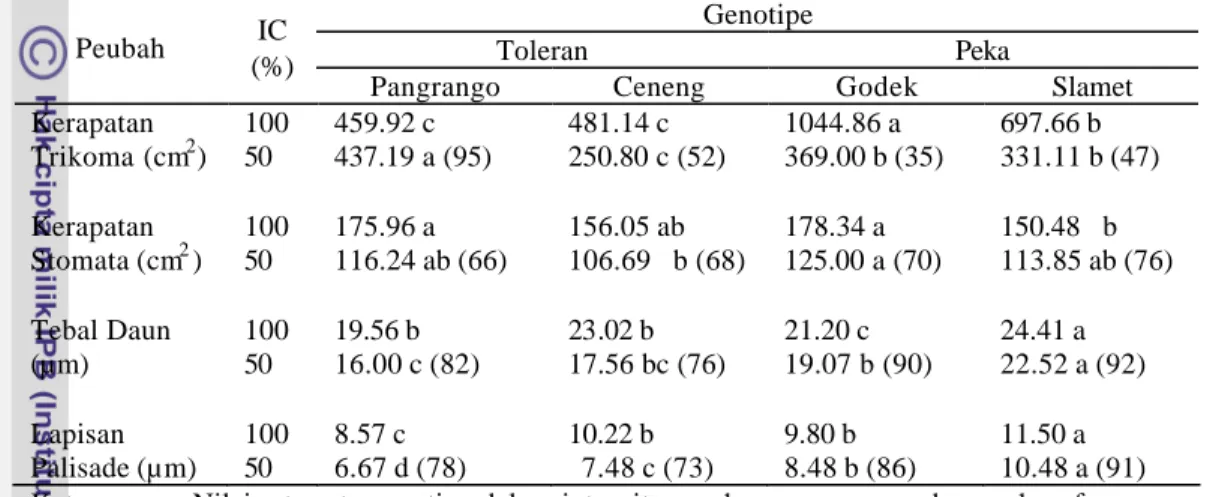
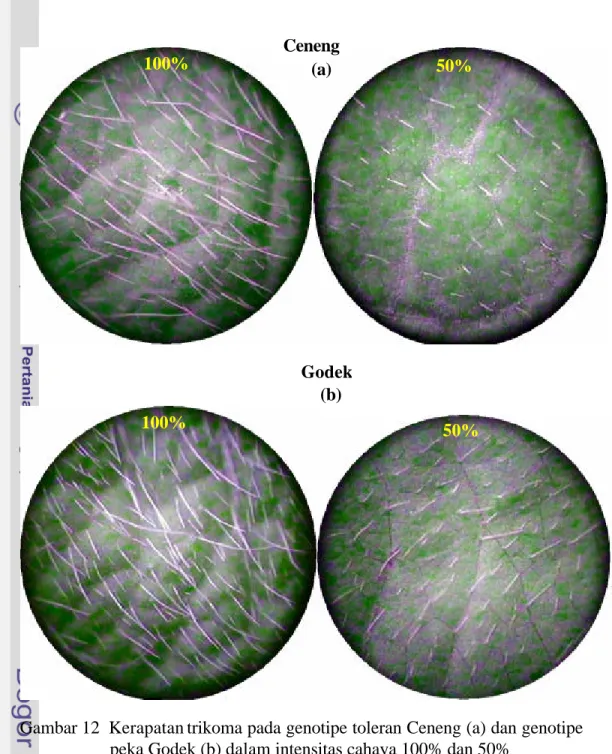
Anatomi Daun Kedelai
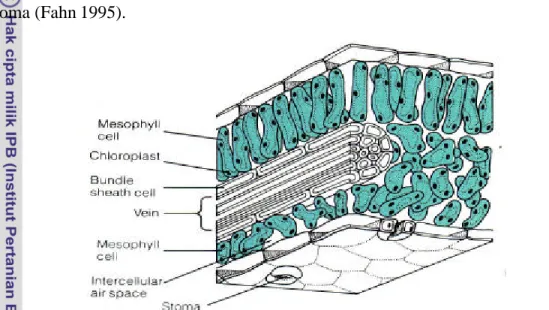
Daun mempunyai dua permukaan, permukaan yang menghadap ke atas (adaksial) dan permukaan yang menghadap ke bawah (abaksial). Susunan anatomi daun tanaman C3 disajikan pada Gambar 2. Epidermis daun berbagai tumbuhan berbeda-beda dalam jumlah lapisan jaringan, bentuk, struktur, susunan stomata, dan ada-tidaknya trikoma (Fahn 1995).
Gambar 2 Struktur anatomi daun tanaman C3 (Beecker et al. 2000)
Stomata terdapat pada lapisan epidermis, merupakan pintu gerbang pertukaran gas antara jaringan tumbuhan dengan lingkungan luar sekitarnya (Bohlar-Nordenkampf dan Draxler 1993), terdapat pada epidermis adaksial maupun abaksial tetapi umumnya banyak terdapat pada bagian epidermis abaksial daun. Daun yang memiliki stomata pada kedua epidermis disebut amphistomatous; yang hanya terdapat pada epidermis abaksial disebut hypostomatous; dan yang hanya terdapat pada epidermis adaksial disebut epistomatous (Fahn 1995, Bohlar-Nordenkampf dan Draxler 1993). Daun kedelai memiliki amphistomatous, tetapi paling banyak ditemukan pada epidermis abaksial. Pada kedelai varietas Ottawa-Mandarin perbandingan stomata antara epidermis adaksial dengan abaksial sekitar 1:3 (1.700/cm2 : 5.000/cm2). Lersten dan Carlson (1987) melaporkan bahwa dari 43 genotipe tanaman kedelai yang diteliti terdapat variasi jumlah stomata antar genotipe dengan rata-rata jumlah stomata pada epidermis adaksial 130/mm2 dan pada permukaan epidermis abaksial 316/mm2. Jones (1996) juga melaporkan bahwa kisaran jumlah stomata tanaman kedelai dari 43 kultivar yang diteliti adalah 81-174/mm2 pada epidermis adaksial dan 242-385/mm2 pada epidermis abaksial.
8
Percobaan dengan intensitas cahaya yang berbeda pada daun Iris sp. memperlihatkan bahwa jumlah stomata berkurang dengan menurunnya intensitas cahaya (Fahn 1995). Allard et al. (1991) dalam penelitiannya menggunakan tall fescue menemukan bahwa perlakuan radiasi rendah menyebabkan penurunan kerapatan stomata pada kedua permukaan daun dan pengaruh paling kuat adalah terhadap kerapatan stomata pada epidermis abaksial.
Selain stomata, pada lapisan epidermis daun kedelai juga ditemukan bulu daun atau trikoma. Trikoma memiliki peranan ekologis yang cukup penting antara lain : mengurangi evaporasi dengan cara melindungi stomata dari suhu yang terlalu tinggi, menurunkan suhu daun dengan cara merefleksikan radiasi surya, serta meningkatkan ketebalan daun dan menurunkan transpirasi (Velasco et al. 2001). Bentuk, ukuran, struktur dan tempat trikoma, dan komposisi eksudat yang dihasilkannya sangat beragam di antara spesis dan karena itu digunakan dalam taxonomi untuk membedakan spesies atau hibrida yang hubungan kekerabatannya sangat dekat (Valkama et al. 2003). Pada kedelai cultivar Clark, kepadatan trikoma telah menjadi penciri untuk membedakan galur-galur isogenik dan Clark tetraploid (Rosaria et al. 2004).
Lapisan kedua setelah sel-sel epidermis adalah sel-sel palisade, terdiri dari satu atau dua baris, panjang sel-sel dalam barisan yang berbeda dapat sama, semakin ke tengah ukuran sel-sel menjadi lebih pendek. Jaringan palisade biasanya terdapat di bawah lapisan epidermis adaksial daun. Genotipe kedelai yang ditumbuhkan pada kondisi cahaya penuh memiliki palisade lebih dari satu lapisan sehingga daun menjadi lebih tebal sedangkan genotipe yang ditumbuhkan pada kondisi cahaya 50% hanya memiliki satu lapisan palisade sehingga daun menjadi lebih tipis (Khumaida 2002).
Lapisan ketiga adalah mesofil palisade, terdiri dari sel- sel berbentuk tiang yang mengandung 15 – 30 kloroplas. Mesofil daun kedelai terdiri dari 5 – 6 lapisan interior (Lersten dan Calson 1987). Pada daun yang ternaungi, terjadi pengurangan jumlah sel-sel mesofil sehingga helaian daun menjadi lebih tipis (Allard at al. 1991).
Kloroplas terdapat dalam sitoplasma dan mengandung DNA, RNA, ribosom, serta enzim. Kloroplas pada tumbuhan tingkat tinggi selalu mengandung dua jenis klorofil, klorofil a (C55H72O5N4Mg) dan klorofil b (C55H70O6N4Mg), keduanya
dibedakan oleh adanya gugus methyl (CH3) pada klorofil a dan gugus aldehid (CHO)
pada klorofil b (Malkin dan Niyogi 2000).
Klorofil merupakan pigmen fotosintetik, tersusun dalam membran tilakoid kloroplas dalam suatu rangkaian fungsional yang dikenal dengan fotosistem. Fotosistem
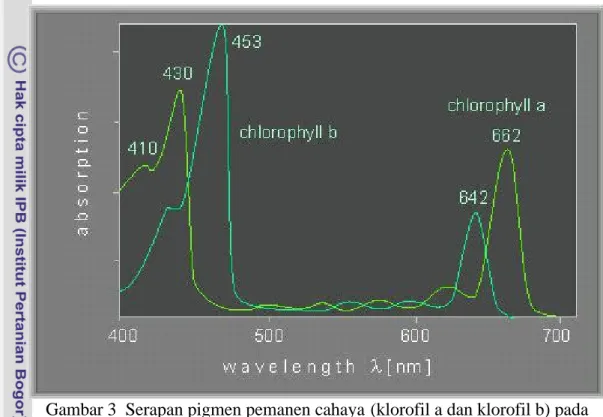
mengandung 200 – 300 molekul klorofil dan 40 molekul karotenoid. Pigmen fotosintetik menyerap cahaya pada panjang gelombang 400 – 700 nm dan biasa disebut pigmen pemanen caha ya atau antena (Taiz dan Zeiger 2002) (Gambar 3). Kandungan klorofil berkorelasi dengan laju fotosintesis total sehingga evaluasi potensi hasil dapat dilakukan melalui analisis kandunga n klorofil (Lersten dan Carlson 1987).
Fotosintesis
Proses fotosintesis memegang peranan kunci dalam siklus hidup tanaman. Proses ini terdiri dari tiga bagian yang terpisah : (i) reaksi terang, dimana energi radiasi diabsorbsi dan digunakan untuk menghasilkan senyawa berenergi tinggi ATP dan NADPH, (ii) reaksi gelap, meliputi reduksi biokimia CO2 menjadi gula menggunakan
senyawa berenergi tinggi yang dihasilkan pada reaksi terang, dan (iii) suplai CO2 dari
udara ke tempat reduksi di kloroplas (Malkin dan Niyogi 2000).
Secara umum, fotosintesis dipengaruhi oleh umur daun, genotipe tanaman, besarnya kebutuhan hasil asimilat oleh sink, dan pengaruh lingkungan seperti kesuburan tanah, kandungan CO2 di atmosfir, kelembaban, suhu, dan cahaya. Dalam kondisi tanpa
cekaman, intensitas cahaya merupakan faktor lingkungan terpenting yang menyebabkan perbedaan laju fotosintesis (Sinclair dan Torrie 1989).
Gambar 3 Serapan pigmen pemanen cahaya (klorofil a dan klorofil b) pada panjang gelombang 400 – 700 nm (Beecker et al. 2000)
10
Efisiensi konversi energi dalam tanaman yang didefinisikan sebagai kandungan energi dalam bobot kering tanaman dibagi dengan total energi surya yang tersedia sangat rendah (Frageria 1991). Pada intensitas cahaya rendah, tanaman yang dapat berfotosintesis secara efisien akan mempunyai kecepatan pertumbuhan yang lebih besar dan akan sukses dalam berkompetisi, seperti yang terjadi pada vegetasi yang rapat atau pada habitat yang ternaungi (Lawlor 1987).
Penangkapan Cahaya oleh Kanopi Tanaman
Cahaya tampak (visible light) sebagai sumber energi yang digunakan tumbuhan untuk fotosintesis merupakan bagian spektrum energi radiasi. Energi radiasi memiliki karakteristik yang khas, yang dapat dijelaskan dengan dua macam teori; teori gelombang elektromagnet dan teori kuantum (Malkin dan Niyogi 2000). Teori gelombang elektromagnet menyatakan bahwa cahaya merambat melalui ruangan sebagai suatu gelombang, jumlah gelombang yang merambat melewati titik tertentu dalam interval tertentu dinyatakan sebagai frekuensi. Teori kuantum menyatakan bahwa cahaya merambat dalam bentuk aliran partikel yang disebut foton; energi yang terkandung dalam satu foton disebut satu kuantum dan berbanding lurus dengan frekuensi tetapi berbanding terbalik dengan panjang gelombang. Jadi cahaya memiliki sifat gelombang dan sifat partikel (Salisbury dan Ross 1992).
Reaksi cahaya dalam fotosintesis merupakan akibat langsung penyerapan foton oleh molekul- molekul pigmen pemanen cahaya. Tingkat energi yang cocok untuk mengaktifkan pigmen pemanen cahaya berada pada kisaran 390 – 760 nm. Foton di atas 760 nm tidak memiliki cukup energi untuk aktivitas fotosintesis, sedangkan foton di bawah 390 nm memiliki energi yang terlalu banyak sehingga dapat merusak pigmen.
Aktivitas pigmen pemanen cahaya merupakan akibat langsung interaksi antara foton dan pigmen sehingga pengukuran cahaya yang digunakan dalam fotosintesis seringkali berdasarkan densitas aliran foton, bukan berdasarkan energi. Salisbury dan Ross (1992) menjelaskan bahwa fotosintesis dan reaksi fotokimia tidak bergantung pada energi total cahaya tetapi tergantung pada jumlah foton atau kuanta yang diserap. Densitas aliran foton adalah jumlah foton yang menerpa suatu luas permukaan tertentu per satuan waktu. Panjang gelombang yang paling efisien untuk fotosintesis adalah antara 400 dan 700 nm, karena itu pengukuran cahaya untuk fotosintesis biasanya didasarkan pada densitas aliran foton dalam panjang gelombang tersebut. Pengukuran ini disebut radiasi aktif fotosintesis atau photosynthetically active radiation (PAR), atau
densitas aliran foton fotosintesis atau photosynthetic photon flux density (PPFD) dengan satuan µmol.m-2.det-1.
Untuk memahami bagaimana cahaya mempengaruhi fotosintesis secara kuanti-tatif, harus ditelaah berapa banyak energi cahaya yang disediakan oleh matahari. Pada puncak atmosfer, pada jarak bumi- matahari rata-rata, total radiasi matahari (termasuk cahaya infra merah dan ultraviolet) adalah sebesar 1360 J.m-2.det-1, nilai ini disebut konstanta matahari. Pada saat cahaya matahari menuju permukaan bumi, banyak energi yang hilang karena diserap atau dipantulkan oleh uap air, debu, dan gas-gas lainnya yang terkandung dalam atmosfer. Hanya sekitar 900 J.m-2.det-1 yang diterima oleh permukaan bumi; terdiri dari 50% cahaya infra merah, 5% cahaya ultraviolet, dan sisanya adalah cahaya dengan panjang gelombang 400 – 700 nm (PAR) dengan kandungan energi sebanyak kira-kira 400 J.m-2.det-1. Sekitar 80% dari PAR tersebut akan diserap oleh daun sedangkan sisanya (20%, yakni cahaya hijau) diteruskan atau dipantulkan. Dari jumlah yang diserap daun, lebih dari 95% hilang dalam bentuk panas dan hanya kurang dari 5% yang berhasil dimanfaatkan untuk fotosintesis (Salisbury dan Ross 1992).
Cahaya yang tiba pada permukaan sehelai daun terdiri dari empat komponen : (1) cahaya langsung, (2) cahaya difus, (3) cahaya refleksi, dan (4) cahaya transmisi (Valladares 2003). Daun-daun pada lapisan kanopi atas (yang tidak ternaungi) lebih banyak memperoleh cahaya langsung dan cahaya difusi untuk proses fotosintesisnya, sedangkan daun-daun sebelah bawah atau bagian dalam kanopi memperoleh cahaya fotosintesis dalam bentuk cahaya difusi, cahaya yang direfleksikan dan ditransmisikan oleh daun lain, serta yang direfleksikan oleh permukaan lain seperti dari tanah.
Penyebaran daun dalam ruang tajuk yang sedemikian rupa mengakibatkan kuanta cahaya yang diterima setiap helai daun tidak sama. Apabila ruang tajuk dibagi ke dalam lapisan- lapisan penampang melintang; kuanta cahaya yang jatuh pada permukaan penampang semakin sedikit dengan semakin rendahnya kedudukan penampang dalam bidang vertikal. Hal ini merupakan akibat pemadaman cahaya oleh lapisan tajuk atas sehingga laju fotosintesis daun-daun di lapisan tajuk bawah semakin rendah. Lapisan daun pada bagian atas tajuk dapat menahan sebagian besar cahaya yang datang dan mendapatkan kuanta cahaya melebihi tingkat kejenuhan cahaya sedangkan lapisan daun bawah menerima cahaya jauh di bawah tingkat kejenuhan cahaya, bahkan dapat berada pada titik kompensasi. Daun yang berada di bawah kondisi ini akan bersifat parasit karena karbohidrat yang dihasilkan lebih kecil dari yang dikonsumsi untuk pemeliharaannya.
12
Sumbangan keempat komponen cahaya di atas terhadap proses fotosintesis pada suatu tanaman tergantung jumlah ketebalan dan tipe daun dalam kanopi. Ketebalan kanopi dapat dinilai dari indeks luas daun (LAI) yang menunjukkan luas permukaan daun yang menutupi satu satuan luas tanah. Hubungan antara kecepatan pengurangan cahaya yang melewati suatu kanopi dengan LAI dapat disederhanakan dengan rumus : IL = Io.e-kLAI; ………...………..(1)
dimana Io dan IL masing- masing adalah cahaya yang mengalir di atas kanopi pada titik
yang bersesuaian dengan LAI lapisan-lapisan daun dan k adalah koefisien peredaman (Atwell et al. 1999). Sitompul dan Guritno (1995) juga menyebutkan bahwa pendekatan sederhana untuk menghitung kuanta cahaya yang diintersepsi adalah menghitung selisih antara kuanta cahaya datang dengan cahaya yang direfleksikan dan yang ditransmisikan.
June (2003) menjelaskan bahwa fotosintesis bersih kanopi yang merupakan integrasi dari laju fotosintesis dan respirasi seluruh daun yang ada di dalam kanopi dipengaruhi oleh kapasitas fotosintesis di tingkat daun, intersepsi cahaya oleh kanopi, status nitrogen kanopi, dan faktor fisik lingkungan lainnya. Lebih lanjut disebutkan bahwa laju fotosintesis di dalam daun dapat dijelaskan oleh persamaan mekanistik dengan asumsi bahwa laju fotosintesis dikendalikan oleh jumlah enzim Rubisco yang aktif, laju regenerasi RuBP (yang ditentukan oleh transpor elektron dari cahaya yang ditangkap oleh daun), serta tekanan parsial CO2 (ci) dan O2 di lokasi dimana CO2
difiksasi. Pada kondisi lingkungan tertentu, laju fotosintesis A (µmol.m-2.s-1) dapat dinyatakan sebagai laju yang dikendalikan ole h Rubisco Av atau dikendalikan oleh laju
transpor elektron Aj (untuk regenerasi RuBP) yang mempunyai nilai terkecil pada ci
tertentu. Pernyataan tersebut dapat disederhanakan dalam bentuk persamaan-persamaan sebagai berikut (June 2003) :
Ai = R c c J i i − Γ + Γ − * * 2 4 ………..(2) Av = R c K O K c V i c i c − + + Γ − 0 * max 1 ………...(3) A = min (Aj, Av) ………...(4)
ci = tekanan parsial CO2 di dalam daun (µbar); ?* = titik kompensasi CO2 (Pa); R =
Michaelis-Menten untuk carboxylation dan oxygenation oleh Rubisco (Pa); Vc max = laju
maksimum aktivitas Rubisco di dalam daun; dan J = laju transpor elektron (µmol.m-2.s-1).
Selanjutnya, hubungan antara fotosintesis daun (A, µmol.m-2.s-1) dengan cahaya yang diterima tanaman (I, µmol.m-2.s-1) dapat dirumuskan sebagai berikut :
A = Ia A Ia A Ia A −R Θ Θ − + − + 2 4 ) ( 2 max 2 2 max max 2 …………..……..(5)
Amax = laju fotosintesis pada kondisi jenuh cahaya (µmol.m-2.s-1), T = pembengkokan
kurva respon A terhadap I (curvature factor) yang nilainya bervariasi dari 0 (rectangular hyperbola) sampai 1 (two straight lines quasi Blackman), a2 = quantum yield dari
fotosintesis pada cahaya rendah (efisiensi fotosintesis). Pada level cahaya rendah, A ≈ a2I
sehingga a2 dapat diduga dari slope kurva hubungan A dan I (Thornley & Johnson 1990
dalam June 2003).
Dari persamaan 2, A dapat diubah menjadi J sehingga hubungan antara laju transpor elektron dengan cahaya yang diterima (I, µmol.m-2.s-1), dapat dirumuskan sebagai berikut (June 2003) :
J =
(
)
Θ Θ − + − + 2 4 2 max 2 max 2 max 2 J Ia J Ia J Ia ………(6) Jmax = laju transpor elektron maksimum (pada kondisi jenuh cahaya) pada daun (µmol.m -2.s-1), dan J = laju transpor elektron aktual. Hasil- hasil penelitian terdahulu menyebutkan bahwa T tidak dipengaruhi oleh suhu, tetapi nilainya lebih dipengaruhi oleh distribusi cahaya dalam daun (June 2002 dalam June 2005a).
Efisiensi penggunaan cahaya (e), disebut juga efisiensi kanopi didefenisikan sebagai jumlah mol CO2 yang diasimilasikan (Ac) per satuan mol cahaya yang diserap
(Ic); jadi e = Ac/Ic. ……….………..(7)
Nilai e menunjukkan seberapa efisien kanopi menggunakan PAR untuk asimilasi CO2
(June 2003).
Mekanisme Penangkapan dan Penggunaan Cahaya
Kemampuan tanaman dalam mengatasi cekaman intensitas cahaya rendah pada umumnya tergantung pada kemampuannya melanjutkan fotosintesis dalam kondisi intensitas cahaya rendah tersebut. Kemampuan tersebut pada dasarnya dapat melalui dua cara, yaitu melalui : (a) peningkatan luas daun sebagai cara meningkatkan luas bidang tangkapan, dan (b) mengurangi jumlah cahaya yang ditransmisikan dan yang
14
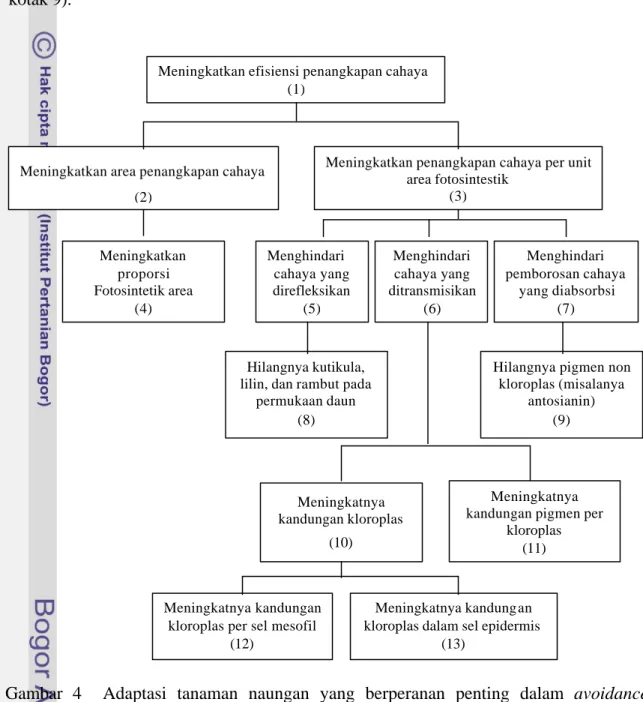
direfleksikan (Hale dan Orchut 1987). Sebelumnya, Levitt (1980) telah membuat hipotesis bahwa adaptasi terhadap intensitas cahaya rendah dicapai melalui mekanisme penghindaran (avoidance) (Gambar 3) dan mekanisme toleransi (tolerance) (Gambar 4).
Mekanisme penghindaran. Dalam mekanisme penghindaran, tersedia dua cara
yaitu : (i) meningkatkan total intersepsi caha ya melalui peningkatan luas daun, dan (ii) meningkatkan persentase cahaya yang digunakan dalam fotosintesis melalui penurunan jumlah cahaya yang direfleksikan dan yang ditransmisikan (Levitt 1980, Lawlor 1987). Penghindaran intensitas cahaya rendah dilakukan dengan cara tidak mengembangkan kutikula, lilin, dan bulu-bulu rambut pada permukaan daun serta meniadakan pigmen antosianin (Levitt 1980).
Beberapa mekanisme penghindaran intensitas cahaya rendah yang dihipotesiskan Levitt (1980) telah terbukti pada kedelai, seperti : (1) meningkatnya luas daun (Khumaida 2002, Sopandie et al. 2003a dan 2003b), dan (2) meningkanya pigmen fotosintesis (Khumaida 2002, Sopandie et al. 2003a dan 2003b, Handayani 2003). Meskipun demikian terdapat beberapa mekanisme penghindaran intensitas cahaya rendah yang belum diteliti terutama yang terkait dengan penurunan jumlah cahaya yang direfleksikan (Gambar 3 kotak 5) dan pemborosan penangkapan cahaya (Gambar 3 kotak 7) serta perubahan efisiensi fotosintesis.
Pada daun kedelai terdapat bulu-bulu rambut (trikoma) yang kepadatannya tergantung genotipe (Rosario et al. 2004). Trikoma memiliki peranan penting antara lain menurunkan suhu daun dengan cara merefleksikan kelebihan cahaya (Velasco et al. 2001). Gardner et al. (1991) juga menyebutkan bahwa daun kedelai cenderung menggulung daunnya ke atas sehingga trikoma pada permukaan bawah daun dapat merefleksikan kelebihan cahaya. Berdasarkan informasi tersebut, dapat dihipotesiskan bahwa kedelai tertentu akan memiliki mekanisme pengindaran intensitas cahaya rendah dengan cara mengurangi atau menghilangkan trikomanya (Gambar 3 kotak 8).
Hilangnya pigmen non kloroplas seperti antosianin juga belum diteliti. Diketahui bahwa pigmen yang berperanan untuk memanen cahaya untuk proses fotosintesis adalah pigmen-pigmen yang terdapat dalam kloroplas seperti klorofil a, b, dan karotenoid (Salisbury dan Ross 1992, Taiz dan Zeiger 2002). Pigmen lain yang tidak terdapat dalam kloroplas seperti antosianin juga menyerap cahaya tetapi tidak terkait atau tidak digunakan dalam proses fotosintesis. Tanaman menghasilkan antosianin terutama dalam kaitan dengan penciptaan sistem perlindungan diri terhadap kerusakan oleh radiasi UV dan serangan cendawan (Lo dan Nicholson 1998). Harran (2003) juga menyebutkan
bahwa antosianin merupakan kelompok senyawa flavonoid yang terletak dalam sel-sel epidermis dan berperanan sebagai pelindung sel-sel di bawahnya terhadap kerusakan oleh sinar UV. Informasi tersebut menunjukkan bahwa adanya antosianin dalam kondisi intensitas cahaya rendah akan merugikan tanaman, sehingga dapat diperkirakan kedelai yang adaptif terhadap intensitas cahaya rendah akan mengurangi antosianin (Gambar 4 kotak 9).
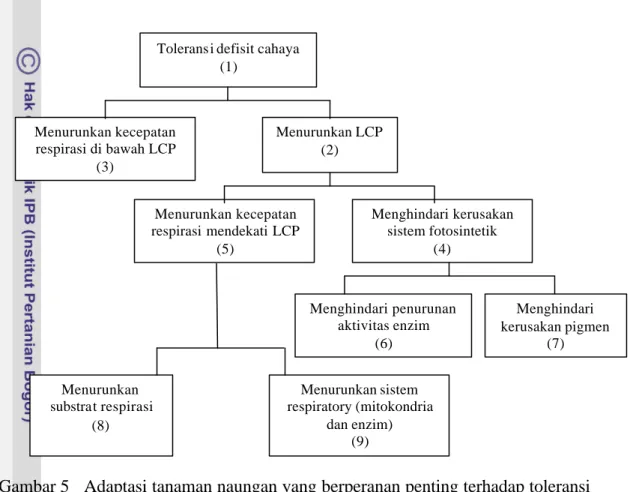
Mekanisme toleran. Toleransi terhadap intensitas cahaya rendah dilakukan
dengan menurunkan titik kompensasi cahaya dan respirasi (Gambar 5). Pada titik kompensasi cahaya (LCP) yaitu cahaya pada permukaan daun yang menginduksi kecepatan asimilasi CO2 aktua l sama dengan kecepatan evolusi O2 respirasi, dalam
Meningkatkan efisiensi penangkapan cahaya (1)
Meningkatkan area penangkapan cahaya (2)
Meningkatkan penangkapan cahaya per unit area fotosintestik (3) Meningkatkan proporsi Fotosintetik area (4) Menghindari cahaya yang direfleksikan (5) Menghindari cahaya yang ditransmisikan (6) Menghindari pemborosan cahaya yang diabsorbsi (7) Hilangnya kutikula, lilin, dan rambut pada
permukaan daun (8)
Hilangnya pigmen non kloroplas (misalanya antosianin) (9) Meningkatnya kandungan kloroplas (10) Meningkatnya kandungan pigmen per
kloroplas (11)
Meningkatnya kandungan kloroplas per sel mesofil
(12)
Meningkatnya kandungan kloroplas dalam sel epidermis
(13)
Gambar 4 Adaptasi tanaman naungan yang berperanan penting dalam avoidance terhadap defisit cahaya (Levitt 1980)
16
kond isi demikian asimilasi CO2 bersih sama dengan nol (zero). Tanaman naungan
ditandai oleh rendahnya titik kompensasi cahaya sehingga dapat mengakumulasi produk fotosintetik pada tingkat cahaya yang rendah dibandingkan tanaman cahaya penuh. Disamping itu tanaman naungan juga memperlihatkan kejenuhan cahaya pada level cahaya rendah.
Titik kompensasi cahaya pada tanaman gandum yang adaptif terhadap intensitas cahaya rendah adalah sekitar 10 W/m2 sedangkan yang peka sekitar 18 W/m2. Penurunan cahaya dari 90 ke 45 W/m2 menurunkan titik kompensasi cahaya dari 11.1 menjadi 1.9 W/m2. Adaptasi ini membutuhkan waktu sekitar 8 hari (Levitt 1980). Titik kompensasi cahaya pada daun gandum dewasa juga meningkat selama siang hari; berkorelasi dengan kecepatan respirasi. Hubungan ini mengisyaratkan bahwa respirasi merupakan komponen utama titik kompensasi cahaya (Azcon-bieto dan Osmond, 1983). Namun demikian, informasi yang spesifik tentang fisiologi daya adaptasi tanaman yang toleran dan peka terhadap intensitas cahaya rendah masih sangat sedikit.
Pada kedelai, mekanisme toleransi intensitas cahaya rendah yang telah dipelajari baru sebatas “menghindari penurunan aktivitas enzim fotosintesis” (Gambar 4 kotak 6)
Gambar 5 Adaptasi tanaman naungan yang berperanan penting terhadap toleransi defisit cahaya ; LCP = light compensation point (Levitt 1980)
Toleransi defisit cahaya (1) Menurunkan LCP (2) Menurunkan kecepatan respirasi di bawah LCP (3) Menghindari kerusakan sistem fotosintetik (4) Menurunkan kecepatan respirasi mendekati LCP (5) Menghindari penurunan aktivitas enzim (6) Menurunkan sistem respiratory (mitokondria dan enzim) (9) Menurunkan substrat respirasi (8) Menghindari kerusakan pigmen (7)
(Khumaida 2002, Sopandie et al. 2003a dan 2003b). Masih banyak kotak-kotak hipotesis yang belum dipelajari. Dalam penelitian ini, selain ingin memperkuat hasil- hasil penelitian terdahulu seperti aktivitas enzim rubisco (kotak 6), juga akan dilengkapi dengan pengamatan aktivitas enzim SPS (kotak 6), laju respirasi dan aktivitas enzim respirasi MDH dan AI (kotak 3), serta kandungan sukrosa dan pati (kotak 8).
Fotosintesis pada Kondisi Intensitas Cahaya Rendah
Aklimasi fotosintetik pada kondisi cahaya rendah memiliki karakteristik tertentu. Daun yang dikembangkan pada kondisi cahaya rendah menunjukkan peningkatan jumlah klorofil (Evans 1987) dan rendahnya akumulasi karbohidrat (Makino et al. 1997). Tanaman yang memperoleh naungan mengandung klorofil a dan b per unit volume kloroplas 4 hingga 5 kali lebih banyak dan mempunyai nisbah klorofil a/b lebih rendah daripada tanaman cahaya penuh sebab memiliki kompleks pemanen cahaya yang meningkat (Lawlor 1987). Daun yang ternaungi memperlihatkan perkembangan grana yang lebih intensif tetapi kapasitas transpor elektron cenderung berkurang. Sebagai contoh, transpor elektron melalui ke dua fotosistem 14 kali lebih tinggi pada kloroplas yang diekstrak dari daun cahaya penuh dibandingkan tanaman naungan. Sitokrom f dan b yang merupakan bagian transpor elektron juga berkurang pada tanaman ternaungi (Jones 1992).
Tanaman yang memperoleh cahaya penuh yang terdiri dari berbagai tanaman di daerah tropis, mencapai kecepatan fotosintesis maksimum lebih besar dari 30 µmol CO2.m-2.det-1 dan kecepatan respirasi gelap 2 µmol CO2.m-2.det-1. Tanaman naungan
mempunyai kecepatan fotosintesis lebih kecil dari 10 µmol CO2.m-2.det-1 pada intensitas
cahaya sekitar 1/10 dari spesies cahaya penuh dan mungkin mengalami kerusakan oleh intensitas cahaya di atas ½ dari cahaya penuh (Lawlor 1987).
Hubungan antara kecepatan fotosintesis dan konduktans stomata memperlihatkan bahwa kecepatan fotosintesis pada 20oC lebih tinggi 20-25% pada tanaman yang ditumbuhkan pada intensitas cahaya rendah dibandingkan tanaman yang ditumbuhkan pada intensitas cahaya tinggi. Konduktans stomata yang diukur pada 25oC dan 20oC lebih rendah pada tanaman yang ditumbuhkan dalam intensitas cahaya rendah (Ohashi et al. 1998).
Tanaman yang ditumbuhkan pada intensitas cahaya rendah dapat memacu kapasitas regenerasi RuBP sehingga pada level CO2 yang normal laju fotosintesis relatif
18
intensitas cahaya rendah mungkin disebabkan oleh modifikasi atau perubahan enzim atau komponen yang berhubungan dengan regenerasi RuBP dan perubahan dalam level metabolit fotosintetik.
Pada spesies tanaman yang beradaptasi terhadap naungan atau daun yang tumbuh dalam naungan, fotosintesis neto mencapai kejenuhan pada PAR kurang dari 100 µmol.m-2.det-1 atau mendekati 5% cahaya penuh. Titik kompensasi cahaya juga bervariasi dari 0.5–2.0 µmol.m-2.det-1 pada spesies yang ternaungi seperti Allocasia macrorhiza hingga lebih dari 40 µmol.m-2.det-1 pada tanaman yang beradaptasi pada cahaya penuh (Jones 1996). Salisbury dan Ross (1992) menyimpulkan bahwa spesies toleran naungan memiliki ciri khas : (1) mempunyai laju fotosintesis yang jauh lebih rendah pada cahaya penuh, (2) laju fotosintesis mencapai jenuh pada tingkat radiasi yang jauh lebih rendah, (3) pada tingkat cahaya yang sangat rendah mampu berfotosintesis dengan laju yang lebih tinggi, dan (4) memiliki titik kompensasi cahaya sangat rendah.
Pembentukan Klorofil
Prekursor dalam pembentukan klorofil adalah senyawa organik yang merupakan senyawa intermediet. Prekursor tersebut adalah glutamat yang mengalami deaminasi menghasilkan a-ketoglutarat, kemudian direduksi menjadi ?,d-dioxovalerate dan mengalami transaminasi menjadi d-amino- laevulinic; sintesis ini memerlukan ATP dan NADPH (Malkin dan Niyogi 2000).
Pelepasan air dari 2 molekul asam amino- laevulinic menghasilkan prophobili-nogen yang mengandung struktur cincin pyrrole. Reaksi selanjutnya adalah pelepasan NH3 dan CO2 yang kemudian membentuk protoporphyrinogen. Penambahan Mg2+ dan
adenosylmethionine pada protoporphyrin menghasilkan Mg-protoporphyrin mono-methylester. Mg pada klorofil berfungsi sebagai pengatur absorbsi spektrum. Mg-porphyrin monomethylester mengalami dehidrasi dan reduksi menghasilkan proto-chlorophylide. Penambahan proton H+ akan menghasilkan chlorophylide a. Cahaya yang diabsorbsi oleh protochlorophylide akan mereduksi chlorophylide a menjadi klorofil a. Jadi, pembentukan klorofil a sangat dipengaruhi cahaya (Lawlor 1987). Klorofil b merupakan bentuk spesial dari klorofil a yang dalam reaksinya membutuhkan O2 dan
NADPH2. Klorofil menyusun sekitar 4% bobot kering kloroplas, dan klorofil b
berjumlah 1/3 dari klorofil a (Hall dan Rao 1999).
Berdasarkan sejumlah penelitian dapat disimpulkan bahwa paling kurang terdapat tiga lintasan reaksi dalam sintesis klorofil yang dikendalikan oleh gen-gen dalam nukleus
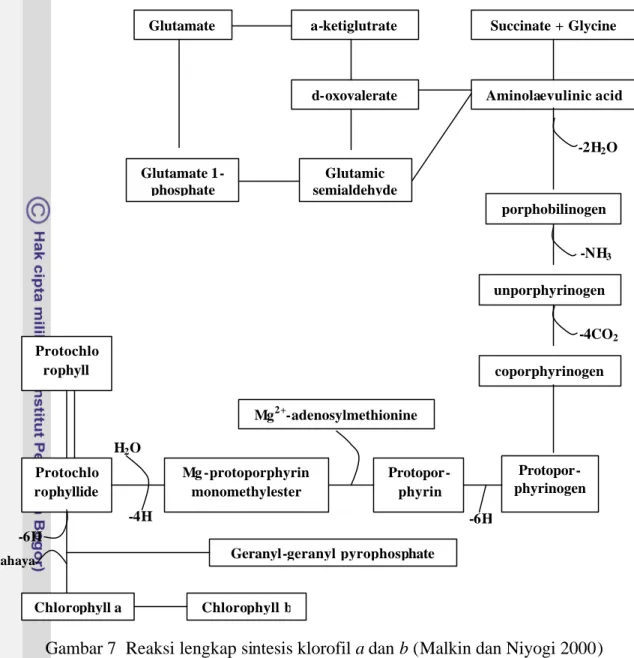
yaitu : (1) lintasan reaksi antara protoporphyrin 9 dan protochlorophyllide (Rissler et al. 2002, Nagata et al. 2005), (2) konversi protochlorophyllide menjadi chlorophyllide (Heyes et al. 2006), dan (3) lintasan sintesis chlorophyll b (Tanaka et al. 1998, Espineda et al. 1999, Malkin dan Niyogi 2000). Kendali gen-gen nukleus terhadap sintesis klorofil tersebut dapat diringkas seperti dalam Gambar 6. Reaksi-reaksi yang terlibat dalam sintesis klorofil secara lengkap disajikan pada Gambar 7 sedangkan struktur kimia klorofil a dan b disajikan pada Gambar 8.
Prekursor klorofil Mg-protoporhyrin 9 dan monomethylesternya (Gambar 7) merupakan kandidat untuk molekul plastid-derived dalam memberi isyarat cahaya dari kloroplas ke nukleus; ukuran pool porphyrin yang mengandung Mg dan protoporphyrin 9 meningkat jika kultur Chlamydomonas dipindahkan dari gelap ke cahaya; peningkatan ini bersamaan dengan akumulasi mRNA yang dikode oleh gen-gen nukleus HSP70A dan HSP70B (Kropat et al. 2000). Precursor Protoporphyrin 9 Nuclear gen Protochlorophyllide Nuclear gen Chlorophyllide a Chlorophyll a Nuclear gen Chlorophyll b
Gambar 6 Kendali inti terhadap pembentukan klorofil
Suzuki et al. (1997) telah mengidentifikasi gen-gen pada tanaman, alga, dan bakteri yang mengkode enzim-enzim untuk lintasan biosintesis percabangan Mg-tetrapyrrol dalam sintesis klorofil atau bakterioklorofil. Klorofil a dibedakan dari klorofil b oleh adanya gugus methyl (CH3) atau aldehid (CHO) pada Mg-tetrapyrrol
(Gambar 7). Klorofil a memiliki gugus methyl pada pyrrol nomor 2, dan bila posisi methyl digantikan oleh gugus aldehid maka akan berubah menjadi klorofil b. Perubahan klorofil a menjadi klorofil b atau sebaliknya dikendalikan oleh gen nukleus CAO.
20
Gambar 7 Reaksi lengkap sintesis klorofil a dan b (Malkin dan Niyogi 2000)
Perbedaan utama antara tanaman yang tidak ternaungi dengan tanaman ternaungi terletak pada kloroplasnya. Daun tanaman ternaungi memiliki tumpukan grana yang lebih besar, sekitar 100 tilakoid per granum yang terletak tidak teratur dalam kloroplas. Proporsi lamella pembentuk grana lebih besar dan nisbah tilakoid /stroma lebih tinggi sehingga kandungan klorofil per unit luas daun lebih tinggi serta nisbah kloroplas per unit luas daun lebih rendah (Halle dan Orcutt 1987). Khumaida (2002) menyatakan bahwa kedelai toleran (Pangrango dan B613) yang ditumbuhkan pada naungan 50% memperlihatkan grana yang lebih berkembang dengan tilakoid yang lebih banyak dalam masing- maisng grana, jumlah stroma lebih sedikit dan ukuran kloroplas lebih besar.
Glutamate a-ketiglutrate Succinate + Glycine
d-oxovalerate Aminolaevulinic acid
Glutamate 1-phosphate Glutamic semialdehyde porphobilinogen unporphyrinogen coporphyrinogen Protopor-phyrinogen Protopor-phyrin Mg -protoporphyrin monomethylester Protochlo rophyllide Protochlo rophyll Chlorophyll a Chlorophyll b Geranyl-geranyl pyrophosphate -4H H2O Mg2+-adenosylmethionine -6H -4CO2 -NH3 -2H2O -6H Cahaya
Klorofil merupakan suatu komponen integral kompleks protein pemanen cahaya, klorofil a/b (LHC) dan klorofil a/b-binding protein pada kompleks pusat reaksi PS I dan PS II yang ada pada membran tilakoid. Jadi pengurangan klorofil menunjukkan pemecahan (breakdown) kompleks protein atau degradasi membran tilakoid (Okada et al. 1992). Pemecahan klorofil pada daun padi dapat ditekan secara komplit dengan 1 µM Cyclohexamide. Degradasi dari protein membran tilakoid juga sangat kuat dihambat oleh cyclohexamide pada konsentrasi tersebut. Okada et al. (1992) menjelaskan bahwa selain pengaruh temperatur rendah yang memperlambat penurunan klorofil, kehilangan klorofil pada kondisi ternaungi dihambat oleh adanya Cyclohexamide. Kehilangan klorofil sedikit dirangsang oleh adanya chloramphe nicol.
Gambar 8 Struktur kimia klorofil a dan b (Beecker et al. 2000)
Pembentukan Antosianin
Selain pigmen fotosintetik seperti klorofil dan karotenoid, tanaman juga memiliki pigmen non fotosintetik yaitu antosianin. Antosianin merupakan produk metabolisme sekunder, termasuk golongan flavonoid dan dikenal sebagai pigmen yang menyebabkan warna merah jambu, ungu dan biru. Menurut Buchanan et al. (2000), antosianin dibentuk dari asam amino phenylalanine melalui lintasan sikimat di sitoplasma dan ditimbun dalam vakuola sel parenkim dewasa (Gambar 9). Antosianin merupakan bentuk glikosida dari berbagai jenis antosianidin yang dibentuk dari dihidroflavonol (Salisbury dan Roos 1992). Phenylalanine ammonia lyase (PAL) merupakan enzim
1 2
22
kunci dalam metabolisme antosianin. Aktivitas enzim tersebut meningkat bersamaan dengan bertambahnya umur daun (Buchanan et al. 2000), adanya cahaya ultra violet dan cahaya tampak, cekaman hara terutama nitrogen dan fosfor, cekaman kekeringan, serta cekaman suhu rendah (Hoch et al. 2003).
Gambar 9 Lintasan pembentukan antosianin. Enzim yang terlibat adalah PAL (Phenylalanine Ammonia Lyase); CHS (Chalcone synthase); CHI (Chalcone Isomerase); F3H (Flavanone-3-hydroxylase); dan DR (Dihydroflavonol 4-reductase) (Buchanan et al. 2000)
Berdasarkan sejumlah penelitian diketahui bahwa antosianin mempunyai distribusi yang luas pada daun, dapat ditemukan pada sel epidermis bagian atas atau bawah, atau sel-sel mesofil dan biasanya mempunyai absorbsi pada panjang gelombang 270-290 nm (UV) dan 500-550 nm (visible spectrum) (Woodall dan Stewart 1998). Acylasi antosianin dengan asam organik aromatik meningkatkan penyerapan pada daerah UV di panjang gelombang 310-320 nm. Hal ini memperlihatkan fungsi antosianin untuk mencegah kerusakan asam nukleat, protein, dan apparatus fotosintesis akibat radiasi UV.
Shikimat Siklus Calvin Phenylalanine Cinnamate Naringenin chalcone Flavan-3,4-diols Anthocyanin 4-Coumarate Metabolisme Primer Metabolisme Sekunder 4-Coumaryl-CoA 3 malonyl-CoA Naringenin 3-hydroxyflavones PAL1 PAL2 PAL3 CHS CHI F3H DFR
Hopkins dan Huner (2004) juga menjelaskan bahwa antosianin menyerap cahaya antara 475 nm dan 560 nm dan mentransmisikan cahaya biru dan merah.
Respirasi
Semua sel hidup aktif melakukan respirasi. Secara umum reaksi respirasi dapat dirangkum sebagai : C6H12O6 + 6O2 → 6CO2 + 6H2O + energi, tetapi biasanya hanya
beberapa substrat respirasi yang dioksidasi secara lengkap menjadi CO2 dan H2O,
sisanya digunakan dalam proses sintesis, terutama dalam sel yang sedang tumbuh. Energi yang ditangkap dari proses oksidasi sempurna beberapa senyawa digunakan untuk sintesis molekul lain yang dibutuhkan untuk pertumbuhan. Bila tumbuhan sedang tumbuh aktif, laju respirasi meningkat sebaga i akibat permintaan pertumbuhan. Beberapa senyawa yang hilang dialihkan ke dalam reaksi sintesis dan tidak pernah muncul sebagai CO2. Atom karbon dalam senyawa yang sedang terespirasi dapat diubah menjadi CO2
atau menjadi molekul besar lainnya [seperti asam amino untuk protein, nukleotida untuk asam nukleat, prazat karbon untuk pigmen porfirin (seperti klorofil dan sitokrom), lemak, sterol, karotenoid, flavonoid (seperti antosianin), dan senyawa aromatik tertentu lainnya (seperti lignin)], tergantung pada sel yang terlibat, lokasinya dalam tumbuhan, dan apakah tumbuhan sedang tumbuh cepat atau tidak. Jadi, total respirasi = pertumbuhan + pemeliharaan. Pertumbuhan tergantung pada tipe biomassa dan pertumbuhan baru sedangkan pemeliharaan tergantung pada faktor lingkungan yang mempengaruhi respirasi dan eksistensi biomassa (Taiz dan Zeiger 2002).
Glikolisis. Glikolisis merupakan urutan reaksi yang mengubah glukosa,
glukosa-1-P, atau fruktosa menjadi asam piruvat di sitosol dan merupakan tahap pertama dari tiga fase respirasi yang sangat berkaitan; diikuti oleh siklus Krebs dan pengangkutan elektron yang berlangsung di mitokondria. Sukrosa, pati, dan fruktan merupakan sumber utama substrat untuk glikolisis. Umumnya, jika heksosa melimpah, glikolisis dan tahap lain respirasi berlangsung lebih cepat dibandingkan dengan bila heksosa sedikit (Salisbury dan Ross 1992).
Tumbuhan yang kekurangan pati, fruktan, atau gula melakukan respirasi dengan laju yang rendah (Salisbury dan Ross 1992). Kandungan pati pada daun kedelai yang dinaungi mengalami penurunan (Thorne dan Koller 1974) yang berarti bahwa kecepatan respirasinya juga akan menurun. Pada padi, persentase penurunan pati lebih besar pada genotipe peka dibandingkan toleran naungan (Lautt et al. 2000). Fenomena kekurangan
24
substrat ini dapat pula diamati melalui jumlah daun bagian bawah yang mati lebih cepat (Salisbury dan Ross 1992).
ATP- fosfofruktokinase (ATP-PFK) dapat bertindak sebagai enzim pertama glikolisis yang mengkatalisis pembentukan fruktosa-1,6-bisfosfat. Heksosa fosfat yang terbentuk dalam reaksi ini tidak dapat digunakan untuk membentuk sukrosa atau pati, sehingga titik ini menjadi titik pengendalian keseluruhan lintasan glikolisis. Aktivitas ATP-PFK dihambat oleh ATP, PEP, dan asam sitrat, tetapi ditingkatkan oleh Pi (Salisbury dan Ross 1992). Dengan demikian, kandungan ATP, asam sitrat, dan Pi dapat dijadikan indikator tinggi- rendahnya respirasi yang berlangsung pada suatu tanaman. Kandungan ATP dan asam sitrat yang tinggi akan menyebabkan kecepatan respirasi berkurang, demikian pula kandungan Pi yang rendah. Pada padi, terdapat kecenderungan peningkatan kandungan ATP akibat naungan, dan peningkatan yang relatif tinggi terjadi pada genotipe toleran naungan (Lautt 2000).
Siklus Kre bs. Salah satu enzim pengatur pada tahap pertama daur Krebs adalah
kinase yang menggunakan ATP untuk memfosforilasi gugus hidroksil dari berbagai gugus residu asam amino treonin pada bagian tertentu dan enzim pyruvat dehydrogenase. Fosforilasi ini segera menon-aktifkan enzim sehingga daur Krebs terhenti. Enzim pengatur kedua adalah fosfatase, menghidrolisis fosfat agar lepas dari treonin dan mengaktifkan kembali enzim tersebut sehingga daur Krebs dapat mengoksidasi lagi pyruvat. Karena itu jika tingkat ATP di mitokondria tinggi dan jika kinase aktif maka daur Krebs terhenti atau lambat sehingga melambatkan semua proses respirasi berikut-nya di mitokondria (Salisbury dan Ross 1992). Dengan demikian, kandungan ATP yang tinggi, dapat dijadikan indikator tinggi-rendahnya respirasi dalam tanaman.
Hal penting lain adalah bila asam organik pada daur Krebs diambil dengan mengubahnya menjadi, misalnya asam aspartat, asam glutamat, dan sitokrom, maka pembentukan kembali asam oksaloasetat akan dihambat. Karena itu, pengeluaran asam organik dari daur krebs akan segera menyebabkan daur terhenti jika tidak ada mekanisme lain untuk mengganti oksaloasetat. Pada semua tumbuhan, baik siang maupun malam, terdapat penambatan CO2 (HCO3-) menjadi oksaloasetat oleh PEP karboksilase dan
malatdehidrogenase (MDH). Hasil reaksi ini mengganti asam organik yang diubah menjadi molekul lebih besar dan memungkinkan daur Krebs terus belangsung. Berdasarkan penjelasan tersebut dapat diduga bahwa aktivitas enzim MDH dapat dijadikan sebagai penciri laju respirasi. Tanaman yang memiliki aktivitas MDH rendah akan memiliki laju respirasi yang lebih rendah.
Tanaman memperoleh energi dari oksidasi gula menjadi CO2 dan H2O selain
melalui glikolisis dan siklus Krebs, juga melalui lintasan pentosa fosfat. Lintasan pentosa fosfat menghasilkan : (1) NADPH yang kemudian dioksidasi oleh mitokondria untuk menghasilkan ATP, (2) eritrosa-4-fosfat yang sangat penting sebagai prazat dalam pembentukan berbagai senyawa fenol seperti antosianin dan lignin, dan (3) ribulosa-5-fosfat yang merupakan prazat dalam pembentukan unit ribosa dan deoksiribosa di nukleotida, termasuk yang ada di RNA dan DNA (Salisbury dan Ross 1992). Berdasar-kan penjelasan tersebut, dapat diduga bahwa rendahnya produksi antosianin pada suatu tanaman dapat menjadi indikator terhadap rendahnya aktivitas pemecahan gula melalui lintasan pentosa fosfat. Hal tersebut akan menguntungkan bagi tanaman yang beradaptasi pada kondisi cahaya rendah karena selain memungkinkan penimbunan cadangan makanan yang lebih tinggi, juga dapat menghindari pemborosan penyerapan cahaya oleh antosianin karena intensitas cahaya yang diserapnya tidak dimanfaatkan dalam proses fotosintesis (Levitt 1980).
Respirasi pada Intensitas Cahaya Rendah
Cahaya mempengaruhi kecepatan respirasi tanaman dan spesies toleran cahaya rendah memiliki kecepatan respirasi yang lebih rendah daripada tanaman cahaya penuh (Levitt 1980). Lebih lanjut disebutkan bahwa salah satu strategi tanaman agar toleran terhadap cahaya rendah adalah mengurangi kecepatan respirasinya untuk menurunkan titik kompensasi. Taiz dan Zeiger (2002) juga mengemukakan bahwa laju respirasi yang rendah merupakan dasar adaptasi tanaman naungan agar tetap dapat tumbuh pada kondisi lingkungan cahaya rendah (terbatas). Bila respirasi lambat, daun memerlukan lebih sedikit cahaya untuk berfotosintesis untuk mengimbangi CO2 yang dilepaskan oleh
respirasi, sehingga titik kompensasi cahaya menjadi lebih rendah pula (Salisbury dan Ross 1992). Kecepatan respirasi pada spesies ternaungi merupakan sesuatu yang kritikal agar terjadi keseimbangan karbon yang positif (Fitter dan Hay 1989).
Kecepatan respirasi pada jaringan dewasa tanaman tingkat tinggi dapat dipengaruhi oleh : (i) kapasitas mesin respirasi (enzim dan transporter), (ii) konsentrasi substrat respirasi (seperti pati, fruktan, gula), atau (iii) kecepatan penggunaan ATP dan NAD(P)H. Bjorkman (1981) mengisyaratkan bahwa daun cahaya penuh mungkin membutuhkan lebih banyak energi (ATP) untuk memelihara tingginya fotosintesis sehingga memiliki kecepatan respirasi yang tinggi. ATP yang dihasilkan oleh respirasi
26
digunakan untuk translokasi metabolit, sintesis kembali struktur yang ada (protein dan membran) dan transpor intraseluler (Amthor 1994).
Kecepatan respirasi gelap juga dipengaruhi oleh radiasi; di bawah kisaran 4 µg.m-2.det-1 pada tanaman ternaungi dibandingkan 50–150 µg.m-2.det-1 pada daun yang memperoleh cahaya penuh. Perbedaan ini memberikan kontribusi terhadap fotosintesis neto yang menguntungkan pada intensitas cahaya rendah yang sering diperlihatkan oleh daun ternaungi (Jones 1996).
Respon Tanaman Terhadap Intensitas Cahaya Rendah Perubahan Karakter Morfologi dan Anatomi Daun
Dari sudut anatomi dan morfologi, karakteristik tanaman yang beraklimasi terhadap intensitas cahaya rendah telah dijelaskan oleh Bjorkman (1981), Anderson (1986). Evans (1988) dan Anderson et al. (1995). Intensitas cahaya akan mempengaruhi bentuk dan anatomi daun termasuk sel epidermis dan tipe sel mesofil (Vogelmann dan Martin, 1993). Perubahan tersebut sebagai mekanisme untuk pengendalian kualitas dan jumlah cahaya yang dapat dimanfaatkan oleh kloroplas daun. Daun tanaman yang ternaungi akan lebih tipis dan lebar daripada daun yang ditanam pada areal terbuka, yang disebabkan oleh pengurangan lapisan palisade dan sel-sel mesofil (Taiz dan Zeiger, 2002, Atwell et al. 1999 ). Pada genotipe padi gogo dan kedelai toleran naungan, terjadi pengurangan lapisan palisade yang lebih besar akibat cekaman naungan dibandingkan dengan genotipe yang peka, yang menyebabkan daun menjadi lebih tipis (Khumaida 2002, Sopandie et al. 2003a dan 2003b). Lapisan palisade dapat berubah sesuai kondisi cahaya, yang menyebabkan tanaman menjadi efisien dalam menyimpan energi cahaya untuk perkembangannya (Taiz dan Zeiger 2002).
Perubahan Kloroplas
Cahaya terbukti mempengaruhi orientasi kloroplas tanaman. Pada intensitas cahaya rendah kloroplas akan mengumpul pada dua bagian, yaitu pada kedua sisi dinding sel terdekat dan terjauh dari cahaya (Salibury dan Ross 1992). Hal ini sering menyebabkan warna daun lebih hijau, karena posisi kloroplas yang terkonsentrasi pada permukaan daun. Intensitas cahaya rendah juga menyebabkan peningkatan jumlah kloroplas per sel, volume kloroplas dan membran tilakoid serta grana (stack granum), seperti pada Gusmania monostachia (Maxwell et al. 1999). Respon kloroplas terhadap perubahan intensitas cahaya tergantung kepada skala waktu perubahan tersebut. Respon
jangka pendek terjadi dalam beberapa detik sampai menit yang melibatkan penyusunan kembali struktur dan fungsi komponen kloroplas. Regulasi jangka pendek ini termasuk pada saat transisi dan penyesuaian fotosistem stoikiometrik pada fosforilasi protein tilakoid (Allen 1995), regulasi untuk efisiensi PSII (Horton et al. 1996), serta perubahan aktivitas rubisko (Salvucci dan Ogren 1996). Aklimatisasi jangka panjang terhadap cahaya melibatkan sintesis yang selektif dan degradasi komponen kloroplas untuk menyusun komposisi dan fungsi organ fotosintesis.
Perubahan Kandungan Klorofil Daun
Pada keadaan normal, aparatus fotosintetik termasuk klorofil mengalami proses kerusakan, degradasi dan perbaikan. Proses perbaikan ini bergantung pada cahaya sehingga bila tanaman dinaungi kemampuan ini akan menjadi terbatas (Richter et al. 1990). Kemampuan melawan degradasi ini sangat penting bagi daya adaptasi terhadap naungan, yaitu dengan meningkatkan jumlah kloroplas per luas daun (Hale dan Orchut 1987) dan dengan peningkatan jumlah klorofil per kloroplas (Okada et al. 1992). Hal ini ditunjukkan juga oleh genotipe toleran padi gogo yang memiliki kadar klorofil a dan b yang lebih tinggi serta nisbah klorofil a/b lebih rendah dibanding peka (Chowdury et al. 1994; Sulistyono et al. 1999; Sopandie et al. 2003b). Hal yang sama juga dijumpai pada kedelai toleran naungan (Khumaida 2002, Sopandie et al. 2003a). Hidema et al. (1992) melaporkan bahwa intensitas cahaya. rendah menurunkan nisbah klorofil a/b, yang disebabkan oleh peningkatan klorofil b, dan berkaitan dengan peningkatan protein klorofil a/b pada LHC II. Membesarnya antena pada PSII ini mempertinggi efisiensi pemanenan cahaya. Walaupun kandungan klorofil tinggi, rendahnya laju fotosintesis sering dihubungkan dengan tingginya resistensi stomata dan rendahnya. aktivitas Ribulose bifosfat (RuBP) (Mur ty dan Sahu 1987). Selain itu, walaupun kandungan klorofil meningkat namun terjadi penurunan klorofil per luas area karena daun menjadi lebih tipis (Nilsen dan Orcutt 1996).
Perubahan Karakter Fisiologi dan Biokimia
Hubungan antara enzim rubisco dan fotosintesis tela h diketahui dengan sangat baik, jumlahnya pada daun secara relatif merefleksikan 20-30% dari total N daun (Makino et al. 1984, Evans 1987). Naungan menyebabkan perubahan fisiologi dan biokimia, antara lain perubahan kandungan N daun, serta kandungan dan aktivitas
28
rubisco. Rubisco merupakan enzim yang memegang peranan penting dalam fotosintesis, mengikat C02 dan RuBP dalam siklus Calvin untuk menghasilkan 3-PGA.
Intensitas cahaya mempengaruhi aktivitas rubisco (Portis 1992), dan dalam keadaan intensitas cahaya rendah aktivitas rubisco menjadi rendah (Bruggeman dan Danborn 1993), tergantung genotipe. Diperkirakan genotipe kedelai toleran naungan akan memiliki aktivitas rubisco yang lebih tinggi dibandingkan dengan genotipe peka, seperti dilaporkan pada padi gogo (Sopandie et al. 2003b).
Pada padi, intensitas cahaya rendah saat pembungaan menyebabkan penurunan kandungan karbohidrat dan menyebabkan gangguan dalam pengisisan biji (Chaturvedi et al. 1994). Hubungan antara cekaman intensitas cahaya rendah dengan terjadinya penurunan karbohidrat dapat dijelaskan dalam beberapa hal. Pengurangan fotosintat pada intensitas cahaya rendah dapat dihubungkan dengan tingginya resistensi stomata dan sel-sel mesofil terhadap pertukaran C02. Pada kondisi cahaya rendah aktivitas
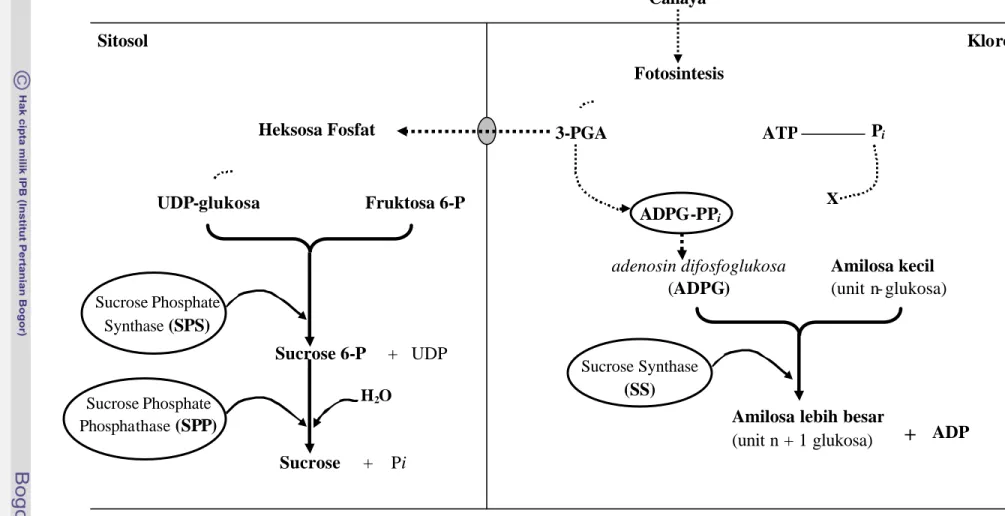
karboksilase dan RuBP menurun (Thorne dan Koller 1974). Reaksi pembentukan pati dikatalisis oleh enzim ADP-glukosa pyrofosforilase yang mengartur aliran karbon (Gambar 10). Intensitas cahaya rendah menyebabkan rendahnya pembentukan pati, karena terjadi penghambatan kerja enzim ADP-glukosa pyrofosfatase oleh ketersediaan Pi yang tinggi. Soverda (2002) menunjukkan bahwa cekaman intensitas cahaya rendah menurunkan aktivitas PGA-kinase, penurunan yang lebih kecil dijumpai pada. genotipe padi gogo yang toleran naungan dibandingkan genotipe yang peka.
Thorne dan Koller (1974) menunjukkan bahwa pemberian naungan menyebabkan penurunan kandungan pati pada daun kedelai, sementara sukrosa mengalami kenaikan. Perimbangan pati dan sukrosa berubah kembali seperti semula setelah perlakuan naungan dihentikan. Pada intensitas cahaya rendah terjadi gangguan translokasi karbohidrat. Pada kondisi ini gula total (sebagian besar gula non reduksi dan pati) secara nyata menurun pada seluruh bagian tanaman. Murty dan Sahu (1987) melaporkan peningkatan kandungan total amino-N dan N terlarut pada varietas padi yang peka, yang menyebabkan terganggunya sintesis protein dan rendahnya ketersediaan karbohidrat dan tingginya kehampaan. Penelitian Lautt et al. (2000) pada padi gogo menunjukkan bahwa galur toleran padi gogo memperlihatkan kandungan pati pada daun dan batang yang lebih tinggi daripada yang peka ketika dinaungi 50 % saat vegetatif aktif. Kenaikan sukrosa pada saat vegetatif aktif hanya terjadi pada galur yang toleran yang sejalan dengan naiknya aktivitas enzim SPS (Sucrose phosphate synthase). Pada. kedelai,
29
adenosin difosfoglukosa (ADPG)
Amilosa kecil
(unit n- glukosa)
Amilosa lebih besar
(unit n + 1 glukosa)
+
ADPSucrose Synthase (SS) ADPG-PPi 3-PGA ATP Pi Cahaya Fotosintesis Kloroplas Sitosol Heksosa Fosfat UDP-glukosa Fruktosa 6-P Sucrose Phosphate Synthase (SPS) Sucrose 6-P + UDP X Sucrose Phosphate Phosphathase (SPP) Sucrose + Pi H2O
Gambar 10 Hubungan antara cahaya, fotosintesis, dan enzim (diberi lingkaran) yang berperanan dalam mengkatalisis proses pembentukan pati di kloroplas dan sukrosa di sitosol; ADPG-PPi = adenosine difosfoglukosa pirofosforilase (dirangkum dari Salisbury dan Ross 1992, Dennis dan Blakeley 2000, Hopkins dan Huner 2004)
30
informasi tentang hubungan antara daya adaptasi dan perimbangan karbohidrat seperti pati-sukrosa pada kondisi intensitas cahaya rendah belum diperoleh.
Sucrose phosphate synthase merupakan salah satu enzim kunci dalam pembentukan sukrosa (Babb dan Haigler 2001). SPS mengkatalisis pembentukan sukrosa fosfat, kemudian oleh sucrose phosphate phosphatase (SPP) sukrosa fosfat diubah menjadi suk rosa (Gambar 10). Gambar 10 menunjukkan bahwa tersedianya substrat heksosa fosfat hasil fotosintesis dalam jumlah yang banyak akan meningkatkan aktivitas SPS sehingga memungkinkan akumulasi sukrosa yang lebih tinggi.
Pewarisan Sifat Tolerans terhadap Intensitas Cahaya Rendah
Upaya perbaikan sifat tanaman sangat tergantung pada pemahaman pemulia terhadap pola pewarisan sifat yang diminati. Sebelum melangkah lebih jauh, pemulia perlu memahami apakah karakter yang sedang dipelajari: (1) merupakan karakter kualitatif atau kuantitatif, (2) diwariskan dengan heritabilitas tinggi atau rendah, (3) menyebar pada tetua yang dimiliki atau terdapat pada tetua tertentu, (4) aksi gen pengendalinya aditif, dominan, atau epistasis, dan (5) seberapa besar kemajuan genetiknya. Informasi tersebut akan mengarahkan pemulia untuk memilih metode pemuliaan yang sesuai sehingga tingkat keberhasilannya akan menjadi lebih tinggi.
Pewarisan suatu sifat atau karakter kepada keturunannya dapat merupakan sifat kualitatif ataupun sifat kuantitatif. Keragaman sifat kualitatif bersifat diskontinue, dikendalikan oleh satu atau dua gen sedangkan sifat kuantitatif bersifat kontinue, dikendalikan oleh banyak gen (Mangoendidjojo 2003). Suatu sifat akan diwariskan apabila sifat tersebut lebih banyak ditentukan oleh faktor genetik daripada faktor non-genetik, karena itu informasi tentang mudah-tidaknya suatu sifat diwariskan dari tetua kepada keturunannya sangat penting bagi pemulia.
Mudah-tidaknya suatu sifat diwariskan dari tetua kepada keturuna nnya dapat diduga berdasarkan tinggi-rendahnya nilai heritabilitas (h2). Heritabilitas merupakan perbandingan atau proporsi ragam genetik terhadap ragam total atau ragam fenotipe. Berdasarkan pengertian tersebut, heritabilitas yang tinggi merupakan petunjuk bahwa peranan faktor genetik terhadap karakter yang diamati lebih besar dibandingkan dengan peranan faktor non-genetik sehingga karakter tersebut akan lebih mudah diwariskan. Sebaliknya, nilai duga heritabilitas rendah mengindikasikan bahwa peranan faktor non-genetik terhadap ekspresi suatu karakter lebih besar dibandingkan dengan peranan faktor genetik ; karakter demikian sulit diwariskan.
Niliai duga heritabilitas dinyatakan dalam persen (%) dan tergolong tinggi apabila h2 > 50, sedang apabila 20 ≤ h2 ≥ 50, dan rendah apabila h2 < 20 (Mangoendidjojo 2003). Berdasarkan komponen penyusun ragam genetik, dikenal heritabilitas dalam arti luas (broad sense heritability = h2bs) yang merupakan proporsi
ragam genetik (σ2G) terhadap ragam total atau ragam fenotipe (σ2P) (h2bs = σ2G/σ2P) dan
heritabilitas dalam arti sempit (narrow sense heritability = h2ns) yang merupakan
proporsi ragam aditif (σ2A) terhadap ragam fenotipe (σ2P) (h2ns = σ2A/σ2P).
Selain heritabilitas, informasi lain yang ingin diperoleh dari suatu studi pewarisan adalah aksi gen yang mengendalikan ekspresi suatu karakter. Ekspresi suatu karakter kuantitatif dapat dikendalikan oleh aksi gen aditif, dominan, atau epistasis (Poehlman dan Sleeper1996, Roy 2000, Chahal dan Gosal 2003). Informasi tentang heritabilitas dan aksi gen dapat digunakan untuk menduga kemajuan genetik atau kemajuan seleksi dan penentuan kriteria efektivitas seleksi (Roy 2000). ). Nilai duga heritabilitas dan aksi gen dapat diperoleh antara lain melalui analisis dialel.
Silang dialel merupakan suatu rancangan persilangan genetik yang banyak digunakan untuk memisahkan pengaruh genetik dari pengaruh lingkungan yang mengendalikan suatu karakter kuantitatif (Murtaza 2005). Teknik persilangan dialel dkembangkan untuk memperoleh informasi tentang mekanisme genetik yang terlibat dalam generasi awal (Khan dan Habib 2003) atau dalam generasi segregasi (Salem et al. 2005). Dengan silang dialel juga dimungkinkan untuk memilih tetua dan memberikan informasi tentang daya gabung tetua dalam hibrida (de Sousa dan Maluf 2003) sehingga dapat membantu pemulia untuk meningkatkan dan menyeleksi populasi segregan.
Pada persilangan dialel, semua genotipe disilangkan dalam semua kombinasi (Roy 2000). Masing- masing genotipe mempunyai kesempatan untuk disilangkan dengan genotipe lain, termasuk persilangan sendiri genotipe itu. Dalam penerapan persilangan dialel, dibutuhkan asumsi (Singh dan Chaundhary 1979, Roy 2000) sebagai beriktut : (1) merupakan segregasi diploid, (2) tidak terdapat pengaruh tetua (tidak terdapat perbedaan resiprok), (3) aksi gen beda alel bersifat independen, (4) tidak terdapat peristiwa multiple allel, (5) tetua bersifat homosigot, (5) gen-gen terdistribusi secara bebas di antara tetua, dan (6) koefisien inbriding sama dengan satu.
Terdapat beberapa macam dialel yang mungkin untuk dianalisis. Jumlah kombinasi tergantung dari macam persilangan tetua yakni (Roy 2000): (1) p2 kombinasi atau kombinasi lengkap, terdiri dari F1, resiproknya, dan penyerbukan sendiri tetuanya;
32
(2) p(p-1) kombinasi, terdiri dari F1 dan resiproknya; (3) ½p(p-1) kombinasi, terdiri dari
F1 saja; dan (4) ½p(p+1) kombinasi, terdiri dari F1 dan penyerbukan sendiri tetuanya.
Penggunaan salah satu macam dialel tergantung dari tujuan analisisnya atau dihubung-kan dengan penyederhanaan analisisnya. Misalnya, untuk menguji tetua sejumlah 20, maka bila menguji kombinasi lengkap akan diperoleh 400 kombinasi. Bila diketahui tidak ada pengaruh resiprok dan tetuanya maka cukup dianalisis ½p(p-1) kombinasi atau 190 kombinasi. Analisis dialel untuk setiap macam persilangan di atas telah dirumuskan oleh Griffing (1956) dalam Singh dan Chaundhary (1979) dan dikenal dengan nama analsisi dialel metode I, II, III, dan IV.
Beberapa karaketer efisiensi penangkapan dan penggunaan intensitas cahaya rendah pada genotipe kedelai telah dipelajari, tetapi belum banyak yang mengkaitkan dengan pemuliaan tanaman. Apabila di dalam populasi terdapat keragaman genetik karakter efisiensi penangkapan dan penggunaan intensitas cahaya rendah, maka terdapat peluang untuk menyeleksi genotipe-genotipe yang mempunyai mekanisme efisiensi penangkapan dan penggunaan intensitas cahaya rendah. Tanaman menyerbuk sendiri seperti kedelai, perbaikan populasinya diarahkan untuk pembentukan galur murni. Dalam hal demikian aksi gen aditif menjadi penting karena mudah difikasi. Menurut Allard (1960) ragam aditif dan aditif x aditif merupakan aksi gen yang responsif terhadap seleksi.
Pewarisan Sifat
Selain ketersediaan keragaman genetik yang luas, keberhasilan program pemulia-an juga tergpemulia-antung pada pengetahupemulia-an tentpemulia-ang pola pewarispemulia-an dari karakter ypemulia-ang akpemulia-an diperbaiki. Suatu karakter dapat diwariskan secara kualitatif ataupun secara kuatitatif. Karakter kualitatif dikendalikan oleh gen-gen sederhana (gen mayor = mono genik). Disebut gen mayor karena pengaruhnya yang besar dan pengaruh lingkungan kecil walaupun ada segregasi pada lain lokus dan ada ragam non genetik (Soemartono et al. 1992). Sebaran frekuensi populasi dapat diketahui dengan melakukan uji normalitas; menyebar tidak normal menunjukkan bahwa karkter yang dipelajari dikendalikan oleh satu atau beberapa gen mayor. Pola pewarisan karakter seperti ini dapat dipelajari menggunakan analisis genetik Mendel (Allard 1960, Wagner 1980, Roy 2000)
Karakter kuantitatif dikendalikan oleh banyak gen minor atau poligenik (Roy 2000). Disebut gen minor karena pengaruh satu gen lebih kecil dari pengaruh lingkungan (Soemartono et al. 1992). Menurut Poehlman dan Sleeper (1996), pewarisan
kuantitatif berhubungan dengan pewarisan karakter multigenik atau poligenik dengan ciri-ciri : (1) setiap multigen memperlihatkan pengaruh yang kecil pada fenotipe relatif terhadap ragam total; secara normal tidak mungkin diidentifikasi sebagai pengaruh individu gen, (2) banyak gen, 10 atau lebih pada lokus yang berbeda memberikan sumbangan terhadap penampakan suatu karakter kuantitatif; nisbah segregasi tidak teramati; rekombinasi dan segregasi dipelajari berdasarkan pengaruh kuantitatif dari gen-gen pada fenotipe, (3) pengaruh individu gen-gen bersifat kumulatif, pengaruh netonya dapat diukur dari nilai fenotipe; dalam populasi kawin acak nilai fenotipe memperlihatkan ragam kontinue dari nilai sangat rendah ke nilai sangat tinggi, (4) pengaruh multigen ditunjukkan melalui aksi gen yang berbeda: aditif, dominan, epistasis, atau overdominan, dan (5) dengan pewarisan multigen, dapat diperoleh “transgressive segregates” yakni suatu karakter kuantitatif yang berada di luar selang nilai kedua induk; suatu fenomena yang banyak digunakan pemulia untuk memperoleh kultivar superior.
Ragam. Bila individu- individu dalam populasi tanaman diklasifikasikan menurut
salah satu karakternya, misalnya tinggi maka tidak akan ditemukan hanya dua kelompok yakni tinggi atau rendah saja, karena ada variasi dalam segala tingkat; variasi demikian disebut variasi atau ragam kontinue. Karakter yang menunjukkan adanya ragam kontinue disebut karakter kuantitatif. Ragam pada dasarnya diskontinue tetapi menjadi kontinue karena : (1) adanya segregasi simultan dari banyak gen yang mempengaruhi sifat yang sama, dan (2) ragam yang sebenarnya tidak begitu kontinue diperhalus lagi oleh adanya faktor non genetik (Soemartono et al. 1992, Falconer 1985). Cara mempelajari ragam kontinue harus melalui pengukuran, tidak hanya menghitung, menggunakan prosedur statistik tertentu termasuk selang, rata-rata, ragam, standar deviasi, dan koefisien ragam. Bagi pemulia tanaman yang terpenting adalah rata-rata dan ragam (Poehlman dan Sleeper 1996). Selanjutnya dijelaskan bahwa ragam dan standar deviasi yang kecil untuk suatu sampel populasi menunjukkan bahwa nilai pengamatan berada sangat dekat dengan rata-rata populasi, sebaliknya ragam dan standar deviasi yang besar menunjukkan bahwa nilai pengamatan sangat berpencar dan jauh dari rata-rata populasi.
Analisis ragam dilakukan dengan memecah ragam menjadi beberapa komponen : (1) ragam fenotipik (VP=σ2P) dari nilai fenotipe, (2) ragam genotipik (VG=σ2G) dari nilai
genotipe, (3) ragam aditif (VA=σ2A) dari nilai pemuliaan, (4) ragam dominansi (VD=σ2D)
34
ragam lingkungan (VE=σ2E) dari simpangan lingkungan (Soemartono et al. 1992,
Poehlman dan Sleeper 1996). Pemisahan pertama nilai fenotipe (P) adalah menjadi nilai genotipe (G) dan simpangan lingkungan (E); P = G + E. Pemecahan ragam menjadi komponen genetik (σ2G) dan lingkungan (σ2E) berarti merumuskan masalah antara
kebakaan (hereditas) dengan lingkungan, atau menentukan mana yang lebih penting secara nisbi antara genotipe dan lingkungan dalam me mpengaruhi nilai fenotipe. Seberapa besar pentingnya genotipe secara nisbi sebagai penentu nilai fenotipe ditunjukkan oleh nisbah ragam genotipe dengan ragam fenotipe; σ2G/σ2P yang sering
disebut sebagai heritabilitas arti luas (h2bs) (Poehlman dan Sleeper 1996,
Mangoendidjojo 2003).
Ragam genotipe dan ragam fenotipe dapat diduga dari populasi eksperimental, bila salah satu komponen dapat dieliminasi maka ragam fenotipe sisanya merupakan taksiran komponen lainnya. Ragam lingkungan tidak dapat dieliminasi karena menurut definisinya, ragam lingkungan terdiri dari semua ragam non genetik, tetapi secara eksperimental ragam genotipe dapat dieliminasi, misalnya pada galur inbred derajat tinggi atau F1 dari persilangan galur inbred akan terdiri dari genotipe yang identik sehingga ragam genotipe sama dengan nol. Bila genotipe demikian diuji pada lingkungan yang kisarannya normal maka ragam fenotipe seluruhnya akan mencerminkan ragam lingkungan σ2E.
Ragam genotipe lebih jauh dapat dipecah sesuai dengan pemecahan nilai genotipe menjadi nilai pemuliaan, simpangan interaksi : G = A + D + I(Fehr 1987). Ragam aditif (σ2A) yang merupakan ragam nilai pemuliaan adalah komponen yang penting sebagai
penyebab utama kemiripan antar kerabat (resemblance between relative), dan merupakan penentu utama sifat genetik yang dapat diamati dari populasi serta penentu respon populasi terhadap seleksi (Falconer 1985, Soemartono et al. 1992, Chahal dan Gosal 2003). Dalam praktik, pembagian yang biasa dilakukan adalah menjadi ragam genetik aditif dan ragam sisa yaitu ragam genetik non aditif dan ragam lingkungan. Pemisahan tersebut dinyatakan sebagai nisbah ragam genetik aditif dengan ragam fenotipe; σ2A/σ2P
yang sering disebut sebagai heritabilitas arti sempit (h2ns). Ragam interaksi didasarkan
atas banyak lokus yang tersangkut; interaksi 2 faktor dan 3 faktor bila menyangkut 2 lokus dan 3 lokus, untuk 4 lokus pengaruh interaksinya kecil dan diabaikan. Pada 2 lokus terdapat 3 macam interaksi yaitu aditifi-aditif, aditif-dominan, dan dominan-dominan (Falconer 1985, Chahal dan Gosal 2003).
Aksi Gen. Dengan multigen, dikenal empat macam aksi gen : additif, dominan,
epistasis, dan overdominan (Poehlman dan Sleeper1996, Chahal dan Gosal 2003). Pengaruh aditif menunjukkan aksi gen- gen yang mempengaruhi suatu karakter genetik dengan cara setiap gen meningkatkan atau menurunkan penampakan karakter genetik tersebut. Jika dalam penampakan suatu karakter kuantitatif (misalnya hasil), pengaruh satu gen menambah satu unit peningkatan hasil, dua gen menambah dua unit, dan seterusnya, apakah gen-gen tersebut merupakan alel-alel pada satu lokus atau gen-gen yang independent pada beberapa lokus. Pengaruh dominansi adalah simpangan dari aditivitas, bersifat heterosigot dan lebih condong ke salah satu induk. Pada aksi gen dominan penuh, heterosigot, dan homosigot dominan memiliki pengaruh yang sama. Pengaruh epistasis adalah hasil dari interaksi gen-gen non alelik, interaksi gen-gen pada lokus yang berbeda. Dalam epistasis, pengaruh dua buah gen secara individu tidak ada, kecuali keduanya berkombinasi. Pengaruh overdominan terjadi jika masing- masing alel memberikan sumbangan secara terpisah dan kombinasi alel-alel tersebut memberikan sumbangan yang lebih besar dibanding sumbangan masing-amsing alel secara terpisah
Sejauh ini belum banyak informasi yang diperoleh tentang dasar genetik dan pewarisan sifat toleransi terhadap intensitas cahaya rendah pada kedelai. Dari penelitian pendahuluan diperoleh informasi bahwa dalam keadaan tercekam intensitas cahaya rendah, karakter agronomi kedelai menunjukkan keragaman kont inyu. Karakter daya hasil dalam keadaan tercekam naungan 50% diwariskan dengan tingkat heritabilitas yang rendah (0.29), namun karakter jumlah polong per tanaman diwariskan denga n heritabilitas mencapai 0.87 (Trikoesoemaningtyas et al. 2003). Dalam penelitian ini juga diperoleh informasi adanya pengaruh tetua betina dalam pewarisan karakter tinggi tanaman, luas daun, jumlah polong dan jumlah biji per polong dalam keadaan ternaungi. Hal ini menunjukkan adanya kendali dari gen-gen di sitoplasma baik dalam interaksinya dengan gen- gen pada inti maupun tidak (Matter dan Jinks 1982). Pada karakter kandungan khlorofil a, khlorofil b, dan kandungan karoten, tidak terdapat pengaruh tetua betina (Handayani 2003). Beberapa sifat morfologi daun kedelai dikendalikan oleh gen-gen major.
Berdasarkan berbagai penjelasan di atas dapat disimpulkan bahwa, informasi lebih lengkap mengenai kendali genetik terhadap toleransi intensitas cahaya rendah pada kedelai belum diketahui.
36
Pewarisan Kloroplas dan Klorofil
Ekspresi gen kloroplas dalam tanaman tingkat tinggi diregulasi pada level yang berbeda dan diyakini ekspresi tersebut dikoordinasi oleh gen-gen kloroplas dan nukleus (Singhal et al. 1999). Koordinasi berlangsung karena sequences mitokondria dan kloroplas ada dalam nukleus, demikian juga sequence kloroplas ditemukan dalam mitokondria. Hal ini menjelaskan bahwa kendali genetik dari fungsi biokimia tertentu dilepaskan (atau diambil dari) ke sel-sel progenitor. Alur informasi genetik antar organel dalam sel tanaman diilustrasikan pada Gambar 11 sebagai berikut (Anonim 2005):
Nucleus
Mitochondria Chloroplast
Gambar 11 Alur informasi genetik dari satu organel ke organel lain dalam sel tanaman
Inti atau nukleus hanyalah sebagian kecil dari sel, di luar inti terdapat sitoplasma, mitokondria, plastida, dan sebagainya sehingga tidak mengherankan jika induk betina memberikan pengaruh yang besar terhadap keturunannya. Selain itu, volume gamet betina lebih besar dari volume gamet jantan, dan bagian terbesar dari gamet betina adalah sitoplasma, beserta arganel-organel seperti mitokondria, plastida, dan sebagainya. Jadi induk betina dapat memberikan pengaruh maternal (bila genotipe nuklear induk betina menentukan fenotipe keturunan) dan pewarisan maternal (jika faktor yang menentukan sifat keturunan terdapat di luar nukleus dan pemindahan faktor itu hanya berlangsung melalui sitoplasma (Suryo 1995).
Studi klasik pewarisan maternal ditunjukkan oleh Correns pada tanaman pukul empat (Anonim 2005). Tanaman ini memiliki daun yang dapat berwana hijau, variegated (putih dan hijau), atau putih. Ketika Correns membuat persilangan, keturunan yang dihasilkan selalu menggambarkan warna daun dari tetua betina. Pewarisan secara maternal dibuktikan pula pada persilangan spesifik antara tanaman tomat dengan spesis liar menggunakan teknik RFLP (Anonim 2005). Namun demikian, pewarisan plastid tidak selalu bersifat maternal. Saat ini diketahui lebih dari 40 contoh pewarisan plastid yang bersifat paternal. Penelitian pada alfalfa (Medicago sativa) yang dilakukan sejak pertengahan tahun 1980-an memperlihatkan bahwa pewarisan plastid (dan DNA plastid) bersifat biparental dengan kecondongan yang lebih kuat ke arah paternal (Smith dan
Mogensen 2005). Data yang dikumpulkan sejak tahuan 1950-an menggunakan genotipe defisien-klorofil dari Medicago truncatula menunjukkan bahwa pewarisan plastid tidak memperlihatkan pola pewarisan maternal.
Ryder (1996) mempelajari pewarisan enam mutan defisiensi klorofil pada Lactuca sativa dan menyimpulkan bahwa dalam pewarisan tersebut dikendalikan oleh gen-gen nukleus. Studi klorofil pada kedelai juga sudah banyak dilakukan. Kultivar Williams mutan defisienssi-klorofil bersifat alelik terhadap y9 dan terpaut terhadap pb (Thorson et al. 1989). Kumudini (2005) melaporkan adanya kendali alel-alel dominan gen-E terhadap konsentrasi klorofil dalam NILs kedelai, sedangkan Zou et al. (2003) menjelaskan bahwa paling kurang terdapat 19 gen resesif tunggal dan satu gen resesif ganda dalam mutan daun kuning kedelai.
MEKANISME EFISIENSI PENANGKAPAN CAHAYA PADA KEDELAI TOLERAN DAN PEKA INTENSITAS CAHAYA RENDAH
ABSTRAK
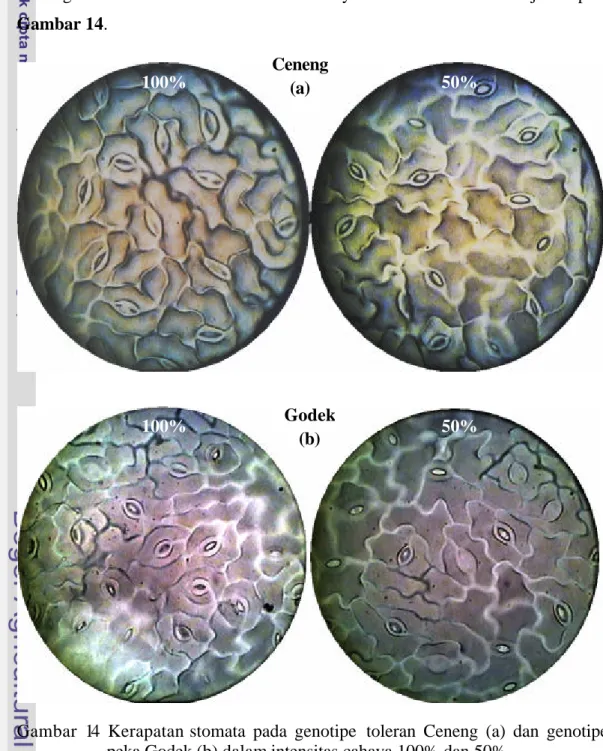
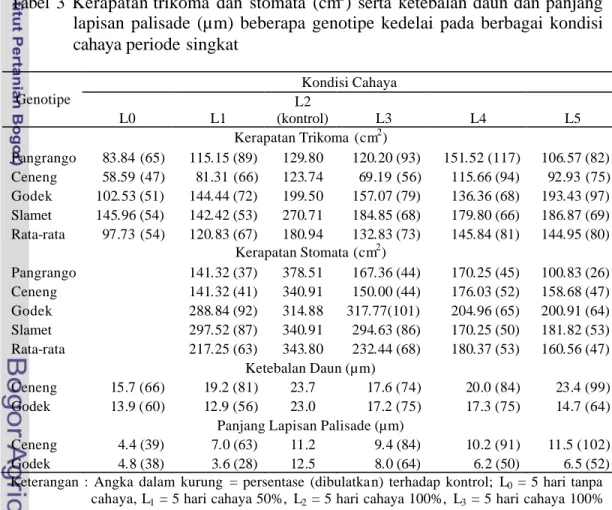
Keberhasilan tanaman untuk tumbuh dan berkembang dalam intensitas cahaya rendah tergantung pada efisiensi penangkapan dan penggunaan cahaya. Efisiensi penangkapan cahaya dapat diperoleh melalui adaptasi morfo-anatomi daun dan kandungan pigmen. Studi mekanisme efisiensi penangkapan cahaya dilakukan dalam dua tahap: (1) percobaan untuk mempelajari mekanisme efisiensi penangkapan cahaya pada intensitas caha ya 50% dan 100% dalam periode waktu yang lama (long-term exposure), dan (2) percobaan dengan perlakuan perbedaan kondisi intensitas cahaya periode singkat (short-term exposure) untuk mempelajari perubahan karakter efisiensi penangkapan cahaya. Bahan tanaman yang digunakan terdiri dari dua genotipe toleran (Ceneng dan Pangrango) dan dua genotipe peka (Godek dan Slamet). Hasil penelitian menunjukkan bahwa pada intensitas cahaya 50%, genotipe toleran Ceneng memiliki kemampuan yang lebih tinggi untuk menghasilkan karakter yang mendukung efisiensi penangkapan cahaya (daun lebih luas dan lebih tipis, trikoma lebih sedikit, klorofil a dan b yang lebih tinggi, serta nisbah klorofil a/b yang lebih rendah) sehingga bobot biji/tanaman juga lebih tinggi dibandingkan dengan genotipe peka terutama Godek. Dalam berbagai kondisi intensitas cahaya periode singkat, perubahan karakter efisiensi penangkapan cahaya pada genotipe toleran Ceneng mengikuti kondisi cahaya yang terakhir kali diterima. Sebaliknya, genotipe peka Godek memperlihatkan pola perubahan yang kurang seiring dengan pola perubahan intensitas cahaya.
Kata kunci : efisiensi penangkapan cahaya, genotipe toleran, genotipe peka
LIGHT CAPTURE EFFICIENCIES MECHANISM UNDER LOW LIGHT INTENSITY OF TOLERANT AND SENSITIVE SOYBEAN GENOTYPE
ABSTRACT
Plant can grow and develop under low light intensity depend on their efficient capture and use of limiting light. They adjusted light capture efficiencies by leaves morfo-anatomycal and pigment content rearangement. Study on light capture efficiencies mechanism held in two step: (1) Long term exposure experiment to study the light capture efficiencies under 50% and 100% light intensity, and (2) Short term exposure experiment to examine the flexibility of light capture efficiencies character. We used two tolerant genotype (Ceneng and Pangrango) and two sensitive genotype (Godek and Slamet). The result showed that under 50% light intensity, Ceneng developed its characters more efficient than sensitive genotype, especially Godek. Ceneng has wider and thinner leaves, fewer trichoma, higher chlorophyll a,b and lower chlorophyl a/b ratio. So, Ceneng has higher seed weight per plant. Under several short term exposure condition, regulation of efficiencies characters in Ceneng is following the recent light condition. But in Godek is less responsive.