3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2011 hingga September 2012. Ekstraksi kolagen dilakukan di Laboratorium Pengujian Mutu Hasil Perikanan, Politeknik Negeri Pontianak; pembuatan nanopartikel kolagen dilakukan di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan IPB; analisis logam berat di Balai Riset dan Standarisasi Industri Pontianak; analisis ukuran partikel dengan Particle Size Analyzer (PSA) di Laboratorium Analisa Bahan, Departemen Fisika IPB; analisis proksimat dan asam amino di Laboratorium Saraswanti Indo Genetech; analisis gugus fungsi dengan Fourier Transform Infrared Spectroscopy (FTIR) dan analisis pH di Laboratorium Pusat Studi Biofarmaka IPB; analisis berat molekul dengan metode Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) di Laboratorium Mikrobiologi dan Biokimia PAU-IPB; analisis termal, derajat putih, viskositas, dan solubilitas di Laboratorium Pengolahan Pangan, Departemen Ilmu Teknologi Pangan IPB; dan analisis struktur permukaan dengan Scanning Electron Microscopy (SEM) di Laboratorium Geologi Kuarterner, Pusat Penelitian dan Pengembangan Geologi Kelautan, Bandung.
3.2 Alat dan Bahan
Peralatan yang digunakan untuk ekstraksi kolagen dan pembuatan nanopartikel kolagen diantaranya stirring hot plate merek Favorit, magnetic stirrer ukuran 5 cm, spektrofotometer UV-VIS merek Hitachi U-2800, freeze dryer merek Labconco, rotary evaporator merek Heidolph WB2000, dan Particle Size Analyzer merek Vasco. Sementara alat-alat yang digunakan untuk analisis diantaranya Atomic Absorption Spectrophotometer (AAS), High Performance Liquid Chromatography (HPLC) merek waters coorporation USA, Viscometer Brookfield LV, Bruker Tensor 37 Fourier Transform Infrared Spectrophotometer, Scanning Electron Microscopy (SEM) merek JEOL JSM-6360-LA, Differential Scanning Calorimetry (DSC-60) merek Shimadzu, dan Whiteness meter C-100.
Bahan utama yang digunakan pada penelitian ini adalah kulit ikan pari (Pastinachus solocirostris). Ikan pari (Pastinachus solocirostris) diperoleh dari
pasar Flamboyan Pontianak. Bahan-bahan yang digunakan untuk ekstraksi kolagen dan pembuatan nanopartikel kolagen terdiri dari NaOH serbuk, asam asetat (CH3COOH), akuades, dan etanol. Bahan-bahan lain meliputi bahan untuk
analisis karakteristik kolagen dan nanopartikel kolagen.
3.3 Metode
Penelitian ini dilakukan dalam empat tahap, yaitu 1) karakterisasi bahan baku kulit ikan pari; 2) optimasi ekstraksi kolagen; 3) pembuatan nanopartikel kolagen; 4) karakterisasi kolagen dan nanopartikel kolagen. Tahap pertama dilakukan dengan tujuan untuk menilai kelayakan kulit ikan sebagai bahan baku kolagen. Tahap kedua bertujuan mendapatkan metode ekstraksi kolagen terbaik. Tahap ketiga bertujuan untuk mendapatkan metode pembuatan nanopartikel kolagen. Tahap keempat bertujuan untuk mendapatkan karakteristik fisik dan kimia kolagen dan nanopartikel kolagen yang dihasilkan dari metode terbaik pada tahap sebelumnya.
3.3.1 Karakterisasi bahan baku
Kulit ikan pari yang akan digunakan dikarakterisasi terlebih dahulu dengan malakukan analisis komposisi kimia kulit yang meliputi kadar air, abu, protein, lemak, dan logam berat (Hg, Pb, dan As).
3.3.2 Optimasi ekstraksi kolagen
Ekstraksi kolagen dilakukan dengan tiga tahap, yaitu deproteinasi menggunakan larutan NaOH, perendaman dalam larutan asam asetat (CH3COOH), dan ekstraksi dengan air. Proses deproteinasi dengan larutan NaOH
dan proses perendaman dalam asam asetat dilakukan pada suhu kamar. Tahap pertama adalah proses deproteinasi yaitu perendaman kulit dalam larutan NaOH dengan tujuan untuk menghilangkan protein non kolagen. Rasio antara kulit dengan larutan NaOH adalah 1:10 (w/v). Pada tahap ini digunakan tiga variasi konsentrasi NaOH yaitu 0,05; 0,1; dan 0,2 M dengan lama waktu perendaman selama 8 jam. Setiap 2 jam sekali dilakukan penggantian pelarut dan larutan NaOH sisa perendaman kulit yang dihasilkan diuji kandungan protein secara
kuantitatif dengan uji biuret untuk menentukan konsentrasi NaOH dan lama waktu perendaman terbaik.
Kulit hasil proses deproteinasi dengan konsentrasi NaOH dan lama waktu perendaman terbaik dicuci dengan air mengalir sampai mencapai pH netral sebelum dilanjutkan pada tahap kedua yaitu perendaman dalam larutan asam asetat (CH3COOH). Pada tahap ini digunakan variasi dua faktor perlakuan yaitu
konsentrasi asam asetat dan lama waktu perendaman. Konsentrasi asam asetat yang digunakan terdiri dari 0,05; 0,1; dan 0,2 M; sedangkan waktu perendaman
adalah 1 dan 2 jam. Rasio antara kulit dengan larutan asam asetat adalah 1:6 (w/v). Parameter uji yang digunakan pada tahap ini adalah pengukuran
derajat pengembangan (DP) dari kulit dan uji kelarutan kolagen dalam larutan asam asetat dengan menggunakan NaCl 5 M.
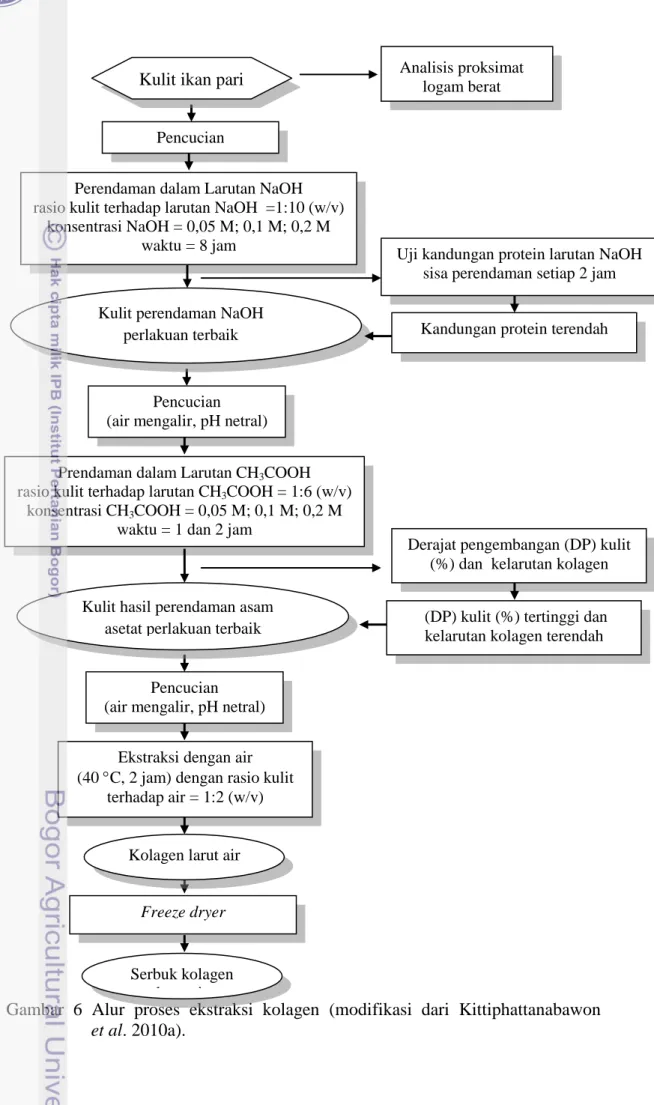
Kulit hasil perendaman asam asetat dengan perlakuan terbaik dicuci dengan air mengalir sampai mencapai pH netral sebelum dilanjutkan pada tahap ketiga yaitu ekstraksi dengan air pada suhu 40 C selama 2 jam dengan rasio antara kulit dan air adalah 1:2 (w/v). Hasil ekstrak berupa kolagen larut air, selanjutnya dikeringkan dengan freeze dryer untuk memperoleh kolagen dalam bentuk serbuk. Alur proses ekstraksi kolagen dari kulit ikan pari dapat dilihat pada Gambar 6.
3.3.3 Pembuatan nanopartikel kolagen
Proses pembuatan nanopartikel kolagen diawali dengan pembuatan kolagen larut air dengan prosedur berdasarkan perlakuan terbaik yang diperoleh pada tahap optimasi ekstraksi kolagen, selanjutnya kolagen larut air diproses lebih lanjut untuk membentuk partikel berukuran kecil yaitu dalam bentuk nanopartikel. Pengecilan ukuran dilakukan dengan proses pengadukan pada kecepatan tinggi menggunakan stirer pada suhu 40 C selama 1 jam. Nanopartikel kolagen yang terbentuk selama proses pengadukan terdispersi dalam larutan dan distabilkan dengan penambahan etanol dingin. Pada tahap ini, digunakan variasi rasio larutan kolagen terhadap etanol, yaitu 1:1, 1:2, dan 1:3. Analisis ukuran partikel kolagen yang dihasilkan pada setiap perlakuan dilakukan menggunakan alat Particle Size Analyzer (PSA). Prosedur pembuatan nanopartikel kolagen dapat dilihat pada Gambar 7.
Gambar 6 Alur proses ekstraksi kolagen (modifikasi dari Kittiphattanabawon et al. 2010a).
Analisis proksimat logam berat
Pencucian
Perendaman dalam Larutan NaOH rasio kulit terhadap larutan NaOH =1:10 (w/v)
konsentrasi NaOH = 0,05 M; 0,1 M; 0,2 M waktu = 8 jam
Uji kandungan protein larutan NaOH sisa perendaman setiap 2 jam
Pencucian (air mengalir, pH netral)
Prendaman dalam Larutan CH3COOH rasio kulit terhadap larutan CH3COOH = 1:6 (w/v)
konsentrasi CH3COOH = 0,05 M; 0,1 M; 0,2 M waktu = 1 dan 2 jam
Derajat pengembangan (DP) kulit (%) dan kelarutan kolagen
Ekstraksi dengan air (40 C, 2 jam) dengan rasio kulit
terhadap air = 1:2 (w/v)
Freeze dryer
Pencucian (air mengalir, pH netral)
Kulit ikan pari
Kulit hasil perendaman asam asetat perlakuan terbaik
Kolagen larut air
Serbuk kolagen larut air
Kulit perendaman NaOH
perlakuan terbaik Kandungan protein terendah
(DP) kulit (%) tertinggi dan kelarutan kolagen terendah
Gambar 7 Alur proses pembuatan nanopartikel kolagen (modifikasi dari Coester et al. 2000).
3.3.4 Karakterisasi kolagen dan nanopartikel kolagen
Tahap ini bertujuan untuk mendapatkan karakteristik kolagen maupun nanopartikel kolagen yang dihasilkan dari perlakuan terbaik pada penelitian tahap kedua dan ketiga yang mencakup karakteristik fisik maupun kimia. Karakteristik fisik yang diukur antara lain analisis termal, viskositas, derajat putih, struktur permukaan dengan SEM, berat molekul dengan SDS-PAGE, gugus fungsi dengan FTIR, dan solubilitas; sedangkan karakteristik kimia meliputi proksimat, jenis asam amino, dan pH.
3.4 Pengamatan
3.4.1 Derajat pengembangan (DP)
Derajat pengembangan (DP) kulit diperoleh dari selisih berat kulit setelah perendaman dengan sebelum perendaman asam asetat dibandingkan dengan berat kulit awal (sebelum perendaman asam asetat). Rumus derajat pengembangan (DP) adalah sebagai berikut:
DP (%) = (B – A) x 100% A
keterangan: A = berat kulit sebelum perendaman asam asetat B = berat kulit setelah perendaman asam asetat
Stirer (40 C, 1 jam)
Pemberian etanol sedikit demi sedikit
(rasio larutan kolagen terhadap etanol = 1:1, 1:2, dan 1:3)
Uji PSA Ekstrak kolagen
larut air
3.4.2 Rendemen (AOAC 1995)
Rendemen kolagen diperoleh dari perbandingan berat kering kolagen yang dihasilkan dengan berat bahan kulit (yang telah dibersihkan dari sisa daging dan lapisan lemak). Rendemen dapat diperoleh dengan rumus:
Rendemen kolagen (%) = Berat kering kolagen x 100% Berat bahan baku kulit
Rendemen nanopartikel kolagen diperoleh dari perbandingan berat kering nanopartikel kolagen yang dihasilkan dengan berat bahan kulit (yang telah dibersihkan dari sisa daging dan lapisan lemak). Rendemen dapat diperoleh dengan rumus:
Rendemen nanopartikel kolagen (%) = Berat kering nanopartikel kolagen x 100% Berat bahan baku kulit
3.4.3 Analisis kadar air (AOAC 2005)
Prinsip analisis kadar air adalah mengetahui kandungan atau jumlah air yang terdapat pada suatu bahan. Cawan porselin dikeringkan dalam oven dengan suhu 105 C selama satu jam. Cawan porselin yang sudah dikeringkan dalam oven dimasukkan dalam desikator (kurang lebih 15 menit) dan kemudian ditimbang (A). Sampel ditimbang sebanyak 1 g dan dimasukkan ke dalam cawan porselin yang sudah kering serta diketahui beratnya. Cawan berisi sampel dimasukkan dalam oven dengan suhu 102-105 C selama 5-6 jam atau sampai beratnya konstan. Cawan dimasukkan dalam desikator (30 menit) kemudian ditimbang (C). Kadar air dihitung dengan rumus:
Kadar air (%) = B – C x 100% B – A
keterangan: A = Berat cawan kosong (g)
B = Berat cawan yang diisi dengan sampel (g)
C = Berat cawan dengan sampel yang sudah dikeringkan (g)
3.4.4 Analisis kadar abu (AOAC 2005)
Prinsip analisis kadar abu adalah mengetahui jumlah abu yang terdapat pada suatu bahan terkait dengan mineral dari bahan yang dianalisis. Cawan abu porselen dibersihkan kemudian dikeringkan dalam oven bersuhu sekitar 105 C
selama 30 menit. Cawan abu porselen yang telah dikeringkan dalam oven dimasukkan dalam desikator (30 menit) dan kemudian ditimbang (A). Sampel sebanyak 5 g (C) ditimbang kemudian dimasukkan ke dalam cawan abu porselen. Cawan abu berisi sampel dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan dengan suhu 600 C selama 7 jam. Cawan abu berisi sampel hasil pengabuan dimasukkan dalam desikator (30 menit) kemudian ditimbang (B). Kadar abu dihitung dengan rumus:
Kadar abu (%) = B – A x 100% C
keterangan: A = Berat cawan abu porselen kosong (g)
B = Berat cawan abu porselen + sampel setelah dikeringkan (g) C = berat sampel (g)
3.4.5 Analisis kadar protein (AOAC 2005)
Prinsip analisis protein adalah mengetahui kandungan dari protein kasar (crude protein) pada suatu bahan. Sebanyak 0,5 g sampel dimasukkan ke dalam labu kjeldahl, kemudian ditambahkan sebutir kjeltab dan 10 mL H2SO4. Labu
yang berisi larutan tersebut dimasukkan ke dalam alat pemanas dengan suhu 410 C dan ditambahkan air sebanyak 10 mL. Proses ini dilakukan sampai
larutan menjadi jernih. Larutan yang telah jernih didinginkan, kemudian ditambahkan 50 mL akuades dan 20 mL NaOH 40% dan didestilasi. Hasil destilasi ditampung dalam erlenmeyer 125 mL yang berisi 25 mL asam borat (H3BO3) 2% yang mengandung indikator campuran dari bromocresol green 0,1%
dan methyl red 0,1% dengan perbandingan 2:1. Destilasi dilakukan dengan menambahkan 50 mL larutan NaOH-Na2S2O3 ke dalam alat destilasi hingga
tertampung 40 mL destilat di dalam erlenmeyer dengan hasil destilat berwarna hijau kebiruan. Destilat yang dihasilkan dititrasi dengan HCl 0,09 N sampai warna larutan berubah warna menjadi merah muda. Volume titran dibaca dan dicatat. Perhitungan kadar protein adalah sebagai berikut:
% Nitrogen = (mL HCl sampel – mL HCl blanko) x N HCl x 14 x 100% mg sampel
3.4.6 Analisis kadar lemak (AOAC 2005)
Labu lemak yang akan digunakan dikeringkan dalam oven bersuhu 110 C, dimasukkan dalam desikator, dan ditimbang (W1). Sampel ditimbang sebanyak 5 g (W2), dibungkus dengan kertas saring dan dimasukkan ke dalam alat ekstraksi (soxhlet) yang telah berisi pelarut dietil eter. Proses reflux dilakukan sampai larutan jernih dan pelarut yang ada di dalam labu lemak berwarna jernih. Labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu 105 ºC hingga beratnya konstan, dimasukkan dalam desikator dan ditimbang (W3). Kadar lemak dihitung dengan rumus:
Kadar lemak (%) = W3 – W1 x100%
W2
keterangan: W1 = Berat labu lemak kosong (g) W2 = Berat sampel (g)
W3 = Berat labu lemak dengan lemak (g)
3.4.7 Uji biuret (Apriyantono et al. 1989)
Uji Biuret dilakukan untuk menentukan konsentrasi protein suatu sampel dengan Bovine Serum Albumin (BSA) sebagai standar. Pereaksi biuret yang
digunakan dibuat dengan mencampurkan sebanyak 3 g CuSO4.5H2O, 9 g
Na-K-tartat, dan 5 g KI dalam 1000 mL larutan NaOH 0,2 M. Sebanyak 4 mL sampel cair dimasukkan ke dalam tabung reaksi yang bersih dan kering, kemudian ditambahkan pereaksi Biuret sebanyak 6 mL. Campuran dibiarkan pada suhu kamar selama 30 menit atau diinkubasi pada suhu 37 C selama 10 menit sampai warna ungu terbentuk sempurna. Pengukuran absorbansi campuran dilakukan pada panjang gelombang 520 nm. Prosedur pengukuran absorbansi larutan standar BSA dilakukan dengan cara yang sama seperti larutan sampel dengan konsentrasi BSA 0-1,5 mg/mL dari larutan stok BSA 5 mg/mL dengan komposisi disajikan pada Tabel 5.
Tabel 5 Pembuatan larutan BSA konsentrasi 0-1,5 mg/mL Konsentrasi BSA (mg/mL) Volume larutan stok BSA (mL) Volume akuades (mL) Volume perekasi biuret (mL) 0 0 4 6 0,02 0,04 3,96 6 0,04 0,08 3,92 6 0,12 0,24 3,76 6 0,4 0,8 3,2 6 0,8 1,6 2,4 6 1 2 2 6 1,5 3 1 6
Nilai absorbansi yang diperoleh kemudian dimasukkan ke dalam kurva standar (Lampiran 1) untuk menentukan konsentrasi protein yang terkandung dalam sampel uji.
3.4.8 Analisis pH (AOAC 2005)
Sampel sebanyak 1 g dilarutkan dalam 20 mL akuades, ditambahkan 50 mL akuades, dan dihomogenkan. Suhu sampel diukur untuk digunakan sebagai suhu pH meter yang akan digunakan. pH meter dinyalakan dan dibiarkan hingga stabil. Elektroda dicelupkan ke dalam sampel beberapa saat sampai diperoleh nilai pH yang stabil.
3.4.9 Analisis logam berat
Kandungan logam berat (Hg, Pb, dan As) dianalisis menggunakan Atomic Absorption Spectrophotometer (AAS). Metode analisis logam berat didasarkan pada SNI 01-2354.6-2006 untuk Hg, SNI 01-2354.7-2006 untuk Pb, dan SNI 01-4866-1998 untuk As. Penentuan kandungan logam berat terbagi atas tiga tahap, yaitu destruksi, pembacaan absorbans contoh, dan perhitungan kandungan logam berat.
a. Tahap destruksi
Sampel sebanyak 1 g dimasukkan ke dalam erlenmeyer 100 mL, kemudian ditambahkan 5 mL HNO3 (p), dan kemudian didiamkan selama 1 jam pada suhu
ruang di ruang asam. Sampel dipanaskan di atas hot plate dengan temperatur rendah selama 46 jam, kemudian dibiarkan 24 jam dengan kondisi tertutup.
Sampel ditambah dengan 0,4 mL H2SO4 dan dipanaskan kembali selama 1 jam di
atas hot plate sampai larutan berkurang (lebih pekat). Selama proses pemanasan berlangsung ditambahkan 2-3 tetes larutan HClO4: HNO3 (2:1) ke dalam sampel
sampai terjadi perubahan warna dari coklat menjadi kuning tua dan menjadi kuning muda. Pemanasan masih terus dilajutkan sekitar 10-15 menit setelah terjadi perubahan warna. Sampel diangkat dan didinginkan, kemudian ditambah 2 mL akuades dan 0,6 mL HCl (p). Sampel dipanaskan kembali selama 15 menit. Sampel disaring dengan kertas saring untuk memisahkan endapan yang terbentuk. Sampel siap untuk dianalisis kandungan logam beratnya dengan Atomic Absorption Spectrophotometer (AAS).
b. Pembacaan absorban
Pembacaan absorbansi logam berat Hg dilakukan dengan spektrofotometer penyerapan atom tanpa nyala pada panjang gelombang 253,7 nm, logam berat Pb ditentukan dengan spektrofotometer graphite furnace-argon pada panjang gelombang 228,8 nm dan logam berat As ditentukan dengan lampu katode As dengan panjang gelombang 193,7 nm. Absorbansi larutan blanko dan larutan standar untuk masing-masing logam berat juga diukur dengan cara yang sama. c. Perhitungan
Konsentrasi logam berat sampel dihitung berdasarkan kurva regresi linier dari standar masing-masing logam berat. Selanjutnya kadar logam berat dihitung dengan rumus:
Kadar logam berat (mg/kg) = (D-E) x Fp x V (mL) x 1 ℓ 1000 mL W
Keterangan:
D adalah kadar contoh μg/L dari hasil pembacaan AAS
E adalah kadar blanko contoh μg/L dari hasil pembacaan AAS W adalah berat contoh (g)
V adalah volume akhir larutan contoh yang disiapkan (mL ) Fp adalah faktor pengenceran
3.4.10 Analisis asam amino (AOAC 1995)
Komposisi asam amino ditentukan dengan High Performance Liquid Chromatography (HPLC). Perangkat HPLC dibilas dahulu dengan eluen yang akan digunakan selama 2-3 jam. Syringe yang akan digunakan juga harus dibilas dengan akuades. Analisis asam amino menggunakan HPLC terdiri atas 4 tahap, yaitu (1) tahap pembuatan hidrolisat protein; (2) tahap pengeringan; (3) tahap derivatisasi; dan (4) tahap injeksi serta analisis asam amino. Khusus untuk pengujian asam amino bebas, tidak dilakukan proses hidrolisis dengan asam dan pemanasan.
(a) Tahap pembuatan hidrolisat protein
Sampel ditimbang sebanyak 0,2 g dan dihancurkan. Sampel yang telah hancur ditambahkan dengan HCl 6 N sebanyak 5-10 mL, kemudian dipanaskan dalam oven pada suhu 100 C selama 24 jam. Proses pemanasan dilakukan untuk menghilangkan gas atau udara yang ada pada sampel agar tidak mengganggu kromatogram yang dihasilkan dan untuk mempercepat reaksi hidrolisis. Hidrolisat protein yang diperoleh disaring dengan milipore berukuran 45 mikron. (b) Tahap pengeringan
Hidrolisat protein ditambah dengan 30 μL larutan pengering. Larutan pengering dibuat dari campuran antara metanol, natrium asetat, dan trietilamim dengan perbandingan 2:2:1. Proses pengeringan dibantu menggunakan gas nitrogen untuk mempercepat pengeringan dan mencegah oksidasi.
(c) Tahap derivatisasi
Sebanyak 30 μL larutan derivatisasi ditambahkan pada hasil pengeringan. Larutan derivatisasi dibuat dari campuran antara larutan metanol, pikoiotisianat, dan trietilamin dengan perbandingan 3:3:4. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel, kemudian dilakukan pengenceran dengan cara menambahkan 10 mL asetonitil 60% atau buffer fosfat 0,1 M lalu dibiarkan selama 20 menit. Hasil pengenceran disaring kembali menggunakan milipor berukuran 0,45 mikron.
(d) Injeksi ke HPLC
Hasil saringan diambil sebanyak 20 μL untuk diinjeksikan ke dalam HPLC. Penghitungan konsentrasi asam amino dilakukan dengan cara
membandingkan kromatogram sampel dengan standar. Pembuatan kromatogram standar menggunakan asam amino yang mengalami perlakuan yang sama dengan sampel. Kandungan masing-masing asam amino pada bahan dapat dihitung dengan rumus:
Konsentrasi asam amino = luas area contoh x C x FP x BM x 100 luas area standar bobot contoh (g)
Keterangan:
C = konsentrasi standar asam amino FP = faktor pengenceran
BM = bobot molekul dari masing-masing asam amino
Kondisi alat HPLC saat berlangsungnya analisis asam amino: Merek : waters coorporation, USA
Kolom : accQtag column (3,9 x 150 mm) Temperatur : 37 oC
Fase gerak : acetonitril 60% - AccqTag Eluent A, sistem komposisi gradien
Laju alir : 1,0 mL per menit
Detektor : fluorescense, Eksitasi = 250 nm, emisi = 395 nm Volume penyuntikan : 5 L
Nama standar : Amino acid standard produksi Thermo Scientific
3.4.11 Analisis derajat putih
Analisis warna dilakukan menggunakan Whiteness meter C-100. Prinsip pengujian menggunakan alat ini adalah membandingkan derajat putih sampel dengan derajat putih standar yang telah ditentukan berdasarkan jenis sampel yang diuji. Alat dikalibrasi dengan lempengan kalibrasi berwarna putih berupa MgO (Magnesium Oksida) dengan tingkat derajat putih 110%, kemudian dilakukan pengukuran derajat putih dari sampel uji. Derajat putih sampel dihitung dengan rumus:
Derajat putih sampel = Derajat putih pembacaan alat x 100% Derajat putih standar
3.4.12 Analisis termal dengan DSC (Martianingsih dan Atmaja 2009)
Analisis termal dilakukan menggunakan alat DSC untuk mengetahui karakteristik termal dari kolagen dan nanopartikel kolagen yang dihasilkan. Sampel sebanyak 5-10 mg ditempatkan dalam wadah aluminium lalu ditutup. Sampel kemudian dianalisis pada suhu antara 20 C hingga 300 C dengan laju pemanasan 10 C/menit.
3.4.13 Analisis gugus fungsi dengan FTIR (Munyonga et al. 2004b)
Analisis FTIR digunakan untuk mengetahui gugus-gugus fungsi khas dari kolagen dan nanopartikel kolagen yang dihasilkan. Sampel uji terlebih dahulu dibentuk pelet dengan campuran KBr. Sebanyak 100 mg Kbr dan 2 mg sampel uji dicampurkan, kemudian ditumbuk sampai halus dan tercampur rata dalam mortar agate. Campuran tersebut dicetak dalam cetakan pelet. Kadar air yang terkandung dalam campuran diminimalkan dengan meletakan cetakan pelet pada pompa hidrolik yang diberi tekanan sampai tanda 80. Tekanan dalam cetakan diturunkan dengan membuka kran udara. Pelet yang dihasilkan dilepaskan dari cetakan, kemudian diletakan pada tablet holde untuk dilakukan pengukuran dengan alat FTIR. Pengukuran sampel uji dilakukan pada bilangan gelombang antara 4000-500 cm-1. Spektra FTIR yang dihasilkan menunjukkan puncak-puncak serapan bilangan gelombang dari sampel uji. Gugus-gugus fungsi sampel uji ditentukan berdasarkan puncak serapan bilangan gelombang yang terdeteksi dengan wilayah serapan untuk gugus fungsi protein (Coates 2000; Kong dan Yu 2007)
3.4.14 Analisis berat moekul dengan SDS-PAGE (Kittiphattanabawon et al. 2010a)
Sampel dilarutkan dalam 5% SDS dan campuran diinkubasi pada suhu 85 C selama 1 jam dalam Water bath yang suhunya terkontrol. Campuran disentrifugasi pada 8500 g selama 5 menit pada suhu kamar. Supernatan yang diperoleh dicampur dengan buffer (Tris HCl 60 mM, pH 6,8, mengandung 2% SDS dan 25% gliserol) dengan rasio 1:10 (v/v) dan mengandung 10% β-merkaptoetanol (β-ME). Campuran dipanaskan dalam air mendidih selama
terdiri dari 8% running gel dan 4% stacking gel dan dielektroforesis pada arus konstan 50 mA/gel selama 2 jam. Setelah elektroforesis selesai, gel ditandai dengan 0,05% (b/v) Coomassie biru R-250 dalam 15% (v/v) metanol dan 5% (v/v) asam asetat selama 1 jam, kemudian sampel ditandai dengan campuran 30% (v/v) metanol dan 10% (v/v) asam asetat selama 1 jam. Destained dilakukan kembali selama 30 menit. Berat molekul protein sampel diperkirakan berdasarkan berat molekul marker. Marker yang digunakan adalah spektra multicolor broad range protein ladder dari permentos.
3.4.15 Analisis struktur permukaan dengan SEM
Sampel ditaburkan pada specimen holder yang dilapisi double sticky tape, kemudian dibersihkan dengan hand blower untuk menghilangkan debu-debu pengotor. Sampel yang telah menempel pada double sticky tape kemudian dilapisi emas-pladium setebal 400 Ǻ dengan mesin ion Sputter JFC-1100. Coating tersebut dimaksudkan agar benda uji yang akan dilakukan pemotretan menjadi penghantar listrik. Sampel yang telah dilapisi emas-pladium selanjutnya dimasukkan ke dalam specimen chamber pada mesin SEM untuk dilakukan pemotretan pada perbesaran 20.000x dan 40.000x.
Sumber elektron dipancarkan menuju sampel untuk memindai permukaan sampel, kemudian emas sebagai konduktor akan memantulkan elektron ke detector pada mikroskop SEM. Hasil pemindaian akan diteruskan ke detektor.
3.4.16 Analisis solubilitas (Tabarestani et al. 2012)
Solubilitas kolagen dan nanopartikel kolagen ditentukan pada rentang pH 1-12 dengan tujuan untuk mengetahui pengaruh pH terhadap solubilitas kolagen dan nanopartikel kolagen. Sebanyak 8 mL larutan kolagen (3 mg/mL) dimasukan ke dalam wadah dan pH larutan diatur pada rentang pH 1-12 menggunakan HCl atau NaOH, kemudian volume larutan ditepatkan menjadi 10 mL dengan penambahan akuades. Larutan disentrifuse dingin (4 C) pada kecepatan 20000g selama 30 menit. Konsentrasi protein dalam supernatan ditentukan dengan uji Biuret dengan Bovine Serum Albumin (BSA) sebagai standar. Solubilitas ditentukan dengan rumus:
Solubilitas = Kandungan protein supernatan Total protein sampel
Solubilitas relatif = Solubilitas pada pH tertentu Solubilitas tertinggi
3.5 Rancangan Percobaan dan Analisis Data (Steel dan Torrie 1993)
Rancangan yang digunakan untuk tahap perendaman dalam larutan NaOH adalah Rancangan Acak Lengkap (RAL). Perlakuan merupakan kombinasi antara konsentrasi NaOH dengan waktu perendaman (Tabel 6). Semua perlakuan dilakukan sebanyak 3 kali ulangan.
Tabel 6 Perlakuan kombinasi konsentrasi NaOH dan waktu perendaman
Waktu peremdaman Konsentrasi NaOH 0,05 M (K1) 0,1 M (K2) 0,2 M (K3) 2 jam (W2) K1W2 K2W2 K3W2 4 jam (W4) K1W4 K2W4 K3W4 6 jam (W6) K1W6 K2W6 K3W6 8 jam (W8) K1W8 K2W8 K3W8
Model rancangan adalah:
Yij = μ + τi + εij
Keterangan:
i = 1,2,3,..., dan 12; j = 1,2,3
Yij = respon pengaruh perlakuan ke-i ulangan ke-j μ = nilai tengah umum
τi = pengaruh perlakuan ke-i
εij = pengaruh acak pada perlakuan ke-i ulangan ke j
Rancangan yang digunakan untuk tahap perendaman dalam asam asetat adalah Rancangan Acak Lengkap Faktorial dengan dua faktor yaitu konsentrasi asam asetat sebanyak 3 taraf (0,05; 0,1; 0,2 M) dan faktor lama waktu
perendaman dengan 2 taraf (1 dan 2 jam). Semua perlakuan dilakukan sebanyak 2 kali ulangan. Model rancangan adalah:
Yijk = μ + τi + βj+ (τ β)ij + εijk Keterangan:
i = 1,2,3; j = 1, 2, dan k = 1, 2
Yijk = respon pengaruh perlakuan konsentrasi asam asetat ke-i dan lama perendaman ke-j pada ulangan ke-k
μ = nilai tengah umum
τi = pengaruh konsentrasi asam asetat ke-i βj = pengaruh lama waktu perendaman ke-j
(τβ)ij = pengaruh interaksi perlakuan konsentrasi asam asetat ke-i dengan lama waktu perendaman ke-j
εijk = faktor galat
Data yang diperoleh dianalisis dengan analisis ragam (ANOVA) dan apabila ada beda nyata dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) pada taraf kepercayaan 95%.