59
Bab IV
Data dan Pembahasan
4.1. Umum
Bab ini menampilkan data-data yang diperoleh selama penelitian disertai pembahasan mengenai hasil yang didapat. Data ditampilkan dalam bentuk tabel dan gambar. Penyajian data diawali dengan karakterisasi limbah cair, diteruskan dengan tahap seeding dan aklimatisasi (yang juga sekaligus merupakan penelitian awal untuk menentukan rasio substrat:kosubstrat maksimal untuk operasional), dan dilanjutkan dengan kinerja dan kinetika reaktor pada saat running dengan memvariasikan waktu reaksi sehingga diketahui penyisihan limbah cair Perusahaan Security Printing X yang dapat dilakukan dengan sistem ASBR pada penelitian ini. Running dilakukan dengan satu kali siklus untuk masing-masing variasi dengan tiga buah duplikasi reaktor.
Kinetika reaksi yang terjadi ditinjau pada bagian akhir. Tinjauan ini diharapkan dapat memberikan gambaran fenomena yang terjadi selama proses degradasi limbah cair Perusahaan Security Printing X tersebut.
4.2. Karakteristik Limbah Cair
Beberapa parameter penting hasil pengujian karakterisasi limbah cair Perusahaan Security Printing X ditunjukkan pada Tabel IV.1. Tabel tersebut hanya memuat informasi parameter-parameter yang melampaui ambang batas baku mutu limbah cair bagi kegiatan industri (Kep-51/MENLH/10/1995) bukan keseluruhan parameter. Dari Tabel IV.1. terlihat bahwa limbah cair bersifat sangat basa, hal ini dimungkinkan karena digunakannya natrium hidroksida pada larutan penyapu pada proses cetak yang terbuang sebagai limbah cair. Nilai COD dan BOD limbah cair tersebut sangat jauh melebihi baku mutu dengan nilai penyimpangan terbesar dibandingkan parameter lain. Parameter amoniak bebas, MBAS, minyak lemak, cobalt, dan fenol secara berurutan memiliki nilai penyimpangan dari baku mutu diatas 800%.
60
Keberadaan amoniak bebas (NH3) dalam konsentrasi yang cukup tinggi bersifat
racun untuk bakteri metanogenik. Hasil uji karakteristik menunjukkan konsentrasi amoniak bebas (sebagai NH3-N) adalah sebesar 77,6 mg/l. Nilai ini hampir
mendekati ambang batas sifat racun untuk proses anaerob, yaitu sebesar 100 mg/l sebagai NH3-N (McCarty & McKinney, 1961 dikutip dari Metcalf & Eddy,
2004). Sedangkan adanya fenol dengan konsentrasi 26 milimol dilaporkan mengurani 50% aktivitas proses anaerob Metcalf & Eddy, 2004).
Tabel IV.1. Karakteristik Limbah Cair
No. Parameter Analisa Satuan Nilai
Rata-rata
Baku Mutu A. F i s i k a
1. Temperatur oC 25 Maks. 38
2. Zat padat terlarut mg/L 19.535 2.000 3. Zat padat tersuspensi mg/L 3.538 200
B. K i m i a 1. pH - 12,12 6,0 – 9,0 2. Kobalt (Co) mg/L 10,03 0,4 3. Amoniak bebas (NH3-N) mg/L 77,60 1 4. BOD mg/L 34.550 50 5. COD mg/L 66.707,13 100 6. Fenol mg/L 7,14 0,5 7. MBAS mg/L 182,79 5
8. Minyak & Lemak mg/L 170,89 5
9. VSS* mg/L 1.988 -
*Pengujian tambahan (tidak ada dalam baku mutu limbah cair) (Sumber : Hasil rata-rata dari Laporan Lab Air ITB, 2006)
4.3. Tahap Seeding dan Aklimatisasi
Tahap seeding dan aklimatisasi merupakan tahap pendahuluan yang harus dilakukan sebelum penelitian utama. Tujuan dari tahap seeding ini adalah untuk memperoleh mikroorganisme yang akan digunakan pada penelitian utama. Benih biomasa diperoleh dari tangki septik yang berlokasi di sekitar jurusan Teknik Lingkungan ITB. Pembenihan dilakukan pada dalam reaktor CBR anaerob secara batch. Pada permulaan seeding, pada awalnya digunakan 100% glukosa sebagai substrat. Tahapan selanjutnya adalah aklimatisasi, yaitu substrat yang menjadi obyek penelitian (limbah cair dari sebuah perusahaan security printing, Perusahaan Security Printing X) ditambahkan secara gradual. Kemudian secara bertahap konsentrasi limbah cair ditingkatkan hingga mencapai 100%, melalui tahapan penambahan limbah cair 20%, 60%, 80% dan 100%.
61
Seeding dan aklimatisasi dilakukan dengan menggunakan beban organik kurang lebih 20.000 mg/l. Agar kondisi anaerobik terjaga, dilakukan pengaliran gas nitrogen selama kurang lebih 30 menit kedalam reaktor untuk mengusir keberadaan gas oksigen dari dalam reaktor pada saat memasukkan substrat dan penambahan mikroorganisme.
Gambar IV.1. Tahapan Seeding dengan menggunakan Reaktor CBR
Reaktor yang digunakan terbuat dari plexyglass dengan volume operasi 22 L. Dimensi reaktor adalah 23,5 cm diameter dan 66 cm tinggi dengan volume operasi 22 L. Pada proses pengolahan limbah cair ini, pengadukan dilakukan dengan cara sirkulasi gas yang ada di dalam sistem (Gambar IV.1).
Dari uji karakteristik, limbah cair yang akan diolah bersifat sangat basa (pH 12). Masalah terjadi pada saat pengaturan pH dengan penambahan asam klorida, yaitu timbul endapan dalam jumlah yang cukup signifikan, sehingga pengaturan pH tidak dilakukan, namun pemeriksaan pH dilakukan setiap hari. Hasil pengukuran pH disajikan pada Gambar IV.2.
Tampak bahwa terjadi penurunan pH seiring dengan berjalannya reaksi. Pada seluruh variasi perbandingan substrat:kosubstrat pH awal lebih dari 11. Pola
62
penurunan pH hampir sama untuk seluruh variasi, yaitu terjadi penurunan yang signifikan pada awal hingga pertengahan awal jalannya reaksi dan disusul dengan keadaan konstan dimana tidak terjadi penurunan pH secara nyata. Pada masa konstan tersebut beberapa variasi mencapai nilai pH 6 – 7. Namun hal tersebut tidak terjadi pada perbandingan substrat:kosubstrat = 100:10. Pada perbandingan tersebut nilai akhir yang dicapai berada pada kisaran 8,4 – 8,56.
Disamping itu terdapat kecenderungan penurunan pH lebih cepat terjadi pada persentase penambahan substrat limbah cair yang lebih kecil, dan semakin melambat pada perbandingan substrat:kosubstrat yang lebih besar.
6 7 8 9 10 11 12 1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 39 41 43 Hari ke-pH pH LC0% pH LC20% pH LC60% pH LC80% pH LC100%
Gambar IV.2. Profil pH pada Berbagai % Konsentrasi Substrat Limbah Cair
Pada tahap seeding dan aklimatisasi ini sekaligus dilakukan evaluasi dan penentuan perbandingan substrat:kosubstrat maksimal yang nantinya akan digunakan saat running.
63
4.3.1. Pencapaian Kondisi Tunak dan Persentase Penyisihan Senyawa Organik untuk Masing-Masing Variasi Penambahan Kosubstrat
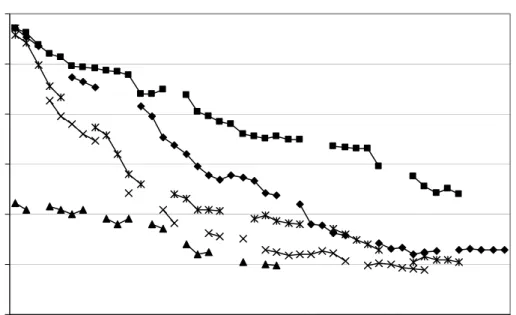
Gambar IV.3. memperlihatkan profil COD dan VSS dari proses pengolahan tanpa penambahan limbah cair Perusahaan Security Printing X (atau dengan kata lain penggunaan kosubstrat 100%). Pada gambar tersebut kondisi tunak tercapai pada hari ke-17. Persentase penyisihan nilai kandungan organik pada tahap ini mencapai 78,58%.
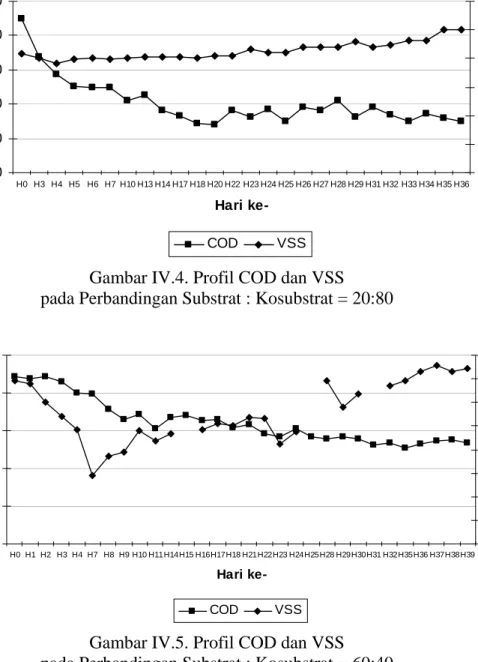
Sedangkan pada penambahan kosubstrat 80%, persentase penyisihan senyawa organik mencapai 66,6% dan kondisi tunak dicapai pada hari ke-34 (Gambar IV.4.). Pada penambahan kosubstrat 40%, persentase penyisihan senyawa organik adalah sebesar 38,63%. Kondisi tunak dicapai setelah menginjak hari ke-36 (Gambar IV.5.). Pencapaian waktu tunak untuk penambahan kosubstrat 20% hampir sama dengan penambahan kosubstrat 80% maupun 40%, yaitu pada hari ke-35 (Gambar IV.6.). Persentase penyisihan yang dicapai adalah 39,72%. Pada percobaan dengan menggunakan seluruh volume berupa limbah cair Perusahaan Security Printing X nampak bahwa hingga pada hari ke-40, kondisi tunak belum tercapai (Gambar IV.7.). Pada saat itu, penyisihan senyawa organik mencapai 30,1%. 0 5000 10000 15000 20000 25000 H0 H1 H2 H3 H6 H7 H8 H9 H10H12H15H16H17H20H22H23H24H25H27H28H29H30H31H32H33H34H35H36H37H38H39H40 Hari ke-CO D (m g /l ) 0 500 1000 1500 2000 2500 3000 VSS ( m g /l ) COD VSS
Gambar IV.3. Profil COD dan VSS pada Perbandingan Substrat : Kosubstrat = 0:100
64 0 5000 10000 15000 20000 25000 H0 H3 H4 H5 H6 H7 H10 H13 H14 H17 H18 H20 H22 H23 H24 H25 H26 H27 H28 H29 H31 H32 H33 H34 H35 H36 Hari ke-CO D (m g /l ) 0 500 1000 1500 2000 2500 3000 V SS ( m g /l ) COD VSS
Gambar IV.4. Profil COD dan VSS pada Perbandingan Substrat : Kosubstrat = 20:80
0 5000 10000 15000 20000 25000 H0 H1 H2 H3 H4 H7 H8 H9 H10 H11H14H15 H16H17H18 H21H22H23 H24H25H28 H29H30H31 H32H35H36 H37H38H39 Hari ke-CO D (m g /l ) 2360 2380 2400 2420 2440 2460 2480 2500 2520 VSS ( m g /l) COD VSS
Gambar IV.5. Profil COD dan VSS pada Perbandingan Substrat : Kosubstrat = 60:40
65 0 5000 10000 15000 20000 25000 H0 H1 H2 H5 H6 H7 H11 H12 H13 H14 H15 H16 H17 H18 H19 H20 H21 H22 H23 H24 H26 H27 H28 H29 H30 H32 H33 H34 H35 H36 H37 H39 H40 H41 H42 H43 Hari ke-CO D (m g /l ) 2460 2470 2480 2490 2500 2510 2520 2530 2540 2550 VSS ( m g /l) COD VSS
Gambar IV.6. Profil COD dan VSS pada Perbandingan Substrat : Kosubstrat = 80:20
0 5000 10000 15000 20000 25000 H0 H1 H2 H3 H4 H5 H6 H7 H8 H9 H10H11H12H13H14H15H16H17H18H19H20H21H22H23H24H25H28H29H30H31H32H35H36H37H38H39 Hari ke-CO D (m g /l ) 2528 2530 2532 2534 2536 2538 VS S ( m g /l) COD VSS
Gambar IV.7. Profil COD dan VSS pada Perbandingan Substrat : Kosubstrat = 100:0
4.3.2. Kinetika Laju Penyisihan dan Laju Pertumbuhan Biomasa pada Masing-Masing Perbandingan
Tabel IV.2. menunjukkan hasil perhitungan laju penyisihan substrat (dS/dt) dan laju pertumbuhan biomasa (dX/dt). Dari hasil tersebut terdapat kecenderungan penurunan konsentrasi substrat yang tersisihan per satuan waktu seiring dengan penambahan persentase substrat ke dalam sistem. Demikian pula halnya dengan penambahan konsentrasi biomasa di dalam sistem. Dengan meningkatnya perbandingan substrat:kosubstrat, laju pertumbuhan biomasa semakin kecil.
66
Namun pada perbandingan substrat:kosubstrat = 80:20, kecenderungan tersebut tidak terlihat.
Dengan persamaan 2.15. dan 2.16 diperoleh data yang tercantum di dalam sebagaimana Tabel IV.3. Data tersebut memberikan informasi bahwa laju penyisihan substrat spesifik pada penggunaan limbah cair Perusahaan Security Printing X mengalami penurunan seiring dengan berkurangnya penambahan glukosa sebagai kosubstrat. Terjadi penurunan yang cukup tajam, yaitu sebesar 46,097% dari penggunaan substrat 20% menuju substrat 60%. Sedangkan dari penambahan substrat 60% menuju 80%, nilai laju penyisihan substrat spesifik mengalami sedikit kenaikan (8,056%). Hal tersebut dimungkinkan karena penambahan substrat dari 20% menjadi 60% adalah penambahan yang cukup besar dibandingkan dengan penambahan substrat dari 60% menjadi 80%. Sehingga biomassa yang ada di dalam sistem lebih dapat beradaptasi dan tumbuh dengan baik pada penambahan substrat dari 60% menjadi 80%. Hal tersebut berbanding lurus dengan nilai laju pertumbuhan biomasa spesifik (μ), dimana pada penambahan substrat dari 20% menjadi 60%, nilai μ mengalami penurunan cukup besar (88,2%) sedangkan pada penambahan substrat dari 60% menjadi 80% nilai μ mengalami kenaikan (27,38%).
Tabel IV.2. Tabel Laju Penyisihan Substrat (dS/dt) dan Laju Pertumbuhan Biomasa (dX/dt)
Penambahan Substrat (%) dS/dt (mg/L.hari) dX/dt (mg/L.hari) 0 954.7647 83.88235 20 440.7647 6.705882 60 237.5833 0.861111 80 258.4 1.2 100 175.7 0.075
(Sumber : hasil perhitungan)
4.3.3. Kinetika Laju Kematian Biomasa dan Faktor Hasil
Gambar IV.8. menunjukkan nilai koefisien hasil (yield), Y = 0,1062 mg VSS/mg COD dan nilai laju kematian biomasa, Kd = 0,0107 hari-1.
Nilai koefisien hasil yang diperoleh dari penelitian ini, Y = 0,1062 mgVSS/mgCOD mendekati dan sedikit lebih besar dari nilai Y pada penelitian
67
limbah cair artifisial (glukosa) dengan proses anaerob tahap metanogenesa dengan reaktor SBR yang dilakukan oleh Chaerul, 2001, yaitu 0,0961 g VSS/g COD. Kennedy et. al., 1988 (dikutip dari Chaerul, 2001) menghasilkan nilai Y pada kisaran = 0,05 – 0,09 g VSS/g COD. Sedangkan penelitian Harper & Pohland, 1986 (dikutip dari Chaerul, 2001) pada penelitian pengolahan glukosa pada CSTR fase metana menghasilkan Y = 0,04 g VSS/g COD. Hasil koefisien hasil jika dibandingkan dengan data dari Metcalf & Eddy, 2004, lebih mendekati pada nilai koefisien kinetika untuk proses pertumbuhan tersuspensi anaerob pada fase fermentasi, yaitu Y = 0,1 g VSS/g COD.
Tabel IV.3. Tabel Kinetika Laju Penyisihan Substrat Spesifik (q) dan Laju Pertumbuhan Biomasa Spesifik (μ)
Penambahan Substrat (%) q Hari-1 µ Hari-1 0 0.480 0.0422 20 0.191 0.0029 60 0.095 0.0003 80 0.102 0.0005 100 0.069 2.96E-05
(Sumber : hasil perhitungan)
Nilai laju kematian biomasa, Kd = 0,0107 per hari = 0,000446 per jam mendekati hasil penelitian yang dilakukan oleh Chaerul, 2001, yaitu Kd = 0,0005 per jam.
y = 0,1062x - 0,0107 R2 = 0,9556 -0,02 0 0,02 0,04 0,06 0 0,1 0,2 0,3 0,4 0,5 0,6 q (hari-1) μ (h a ri -1 )
68 4.4. Pengoperasian SBR
Untuk mengetahui pengaruh waktu reaksi pada perbandingan substrat:kosubstrat 80:20 dan beban influen 20.000 mg/l COD pada pengolahan limbah cair Perusahaan Security Printing X dengan sistem ASBR baik dari sisi kinerja reaktor maupun kinetika reaksinya maka dilakukan penelitian dengan 3 variasi waktu reaksi yaitu 12 jam, 36 jam, 54 jam, dan 125 jam.
Pengoperasian SBR merupakan penelitian utama dan merupakan kelanjutan dari proses seeding dan aklimatisasi. Perbandingan substrat:kosubstrat 80:20 diperoleh dari penelitian awal pada saat seeding dan aklimatisasi. Jalannya tahapan SBR dilakukan sebagaimana pada Tabel III.3. dalam satu buah siklus. Tahap Running ini dilakukan dengan menggunakan tiga buah reaktor untuk masing-masing variasi waktu. Pengambilan sampel pH, COD, VSS, dan TAV dilakukan setiap interval waktu tertentu yang berbeda untuk masing-masing variasi waktu. Analisa gas O2,
CO2, N2, CH4, dan H2 dilakukan pada akhir reaksi. Sedangkan analisa identifikasi
mikroorganisme dilakukan setelah selesainya pengoperasian SBR. Analisa terhadap influen dan efluen dilakukan untuk mengetahui kandungan beberapa senyawa yang signifikan dari hasil karakterisasi yaitu meliputi: fenol, surfaktan, minyak lemak dan amonia bebas.
Sub bab berikut ini membahas hasil-hasil yang diperoleh selama penelitian pengoperasian SBR.
4.4.1. Kinerja SBR
Sub bab ini menyajikan data-data hasil penelitian yang terkait dengan kinerja SBR terutama yang meliputi efisiensi penyisihan senyawa organik maupun profil konsentrasi biomasa dari waktu ke waktu.
4.4.1.1. Pengaruh Variasi Waktu Reaksi pada Penyisihan Senyawa Organik Data yang diperoleh mengenai profil COD dan efisiensi penyisihan senyawa organik disajikan dalam bentuk tabel dan gambar, yaitu Gambar IV.9. – IV.12.
69
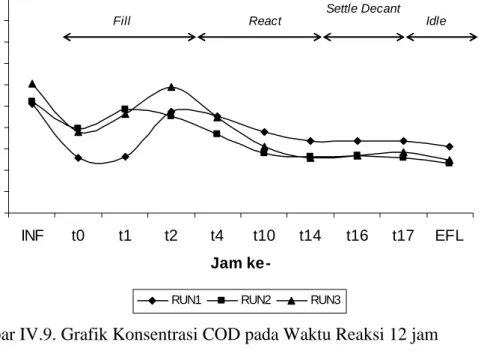
Gambar IV.9.-IV.12. menunjukkan profil COD pada masing-masing waktu reaksi. Terdapat kecenderungan penurunan konsentrasi COD pada titik IFL (influen) hingga t0 yang kemudian meningkat pada t1 hingga t2 [(berakhirnya tahap
pengisian (fill)]. Hal ini menjelaskan terjadinya efek pemekatan konsentrasi senyawa organik karena pada pada saat t0 bisa dikatakan belum ada konsentrasi
substrat maupun kosubstrat yang masuk ke dalam sistem. Pada saat t1, sebagian
influen telah berada di dalam sistem dan bereaksi dengan mikroorganisme yang ada hingga selesainya proses fill. Pada keadaan tersebut relatif tidak terjadi penyisihan senyawa organik sebagaimana diperkuat dengan Gambar IV.13. yang menunjukkan bahwa pada seluruh variasi waktu reaksi, pada tahap pengisian efisiensi penyisihan senyawa organik memiliki nilai minus (-).
Gambar IV.13. menjelaskan bahwa penyisihan senyawa organik pada tahap reaksi (react) menunjukkan kecenderungan yang lebih besar dibanding dengan penyisihan pada saat pengisian maupun stabilisasi, dengan nilai kontribusi antara 90,35% hingga 97%. 0 5000 10000 15000 20000 25000 30000 35000 40000 45000 50000 INF t0 t1 t2 t4 t10 t14 t16 t17 EFL Jam ke-CO D ( m g /l )
RUN1 RUN2 RUN3
Settle Decant
Fill React Idle
70 5000 10000 15000 20000 25000 30000 35000 40000 45000 50000 INF t0 t1 t2 t4 t8 t12 t18 t36 t38 t39 EFL Jam ke-CO D ( m g /l )
RUN4 RUN5 RUN6
React Fill
Settle
Decant Idle
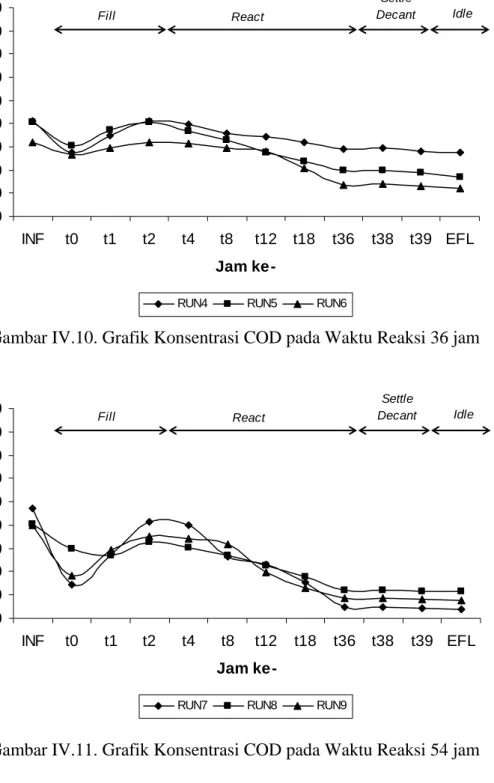
Gambar IV.10. Grafik Konsentrasi COD pada Waktu Reaksi 36 jam
5000 10000 15000 20000 25000 30000 35000 40000 45000 50000 INF t0 t1 t2 t4 t8 t12 t18 t36 t38 t39 EFL Jam ke-CO D ( m g /l )
RUN7 RUN8 RUN9
React Fill
Settle
Decant Idle
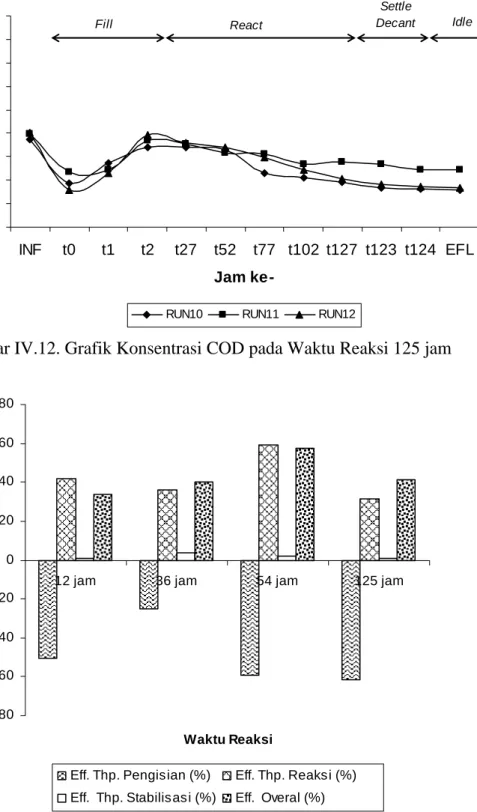
71 5000 10000 15000 20000 25000 30000 35000 40000 45000 50000 INF t0 t1 t2 t27 t52 t77 t102 t127 t123 t124 EFL Jam ke-CO D ( m g /l )
RUN10 RUN11 RUN12
React Fill
Settle
Decant Idle
Gambar IV.12. Grafik Konsentrasi COD pada Waktu Reaksi 125 jam
-80 -60 -40 -20 0 20 40 60 80
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi % E fis ie ns i
Eff. Thp. Pengisian (%) Eff. Thp. Reaksi (%) Eff. Thp. Stabilisasi (%) Eff. Overal (%)
Gambar IV.13. Efisiensi Penyisihan Substrat Tahap Pengisian, Reaksi, Stabilisasi dan Overal
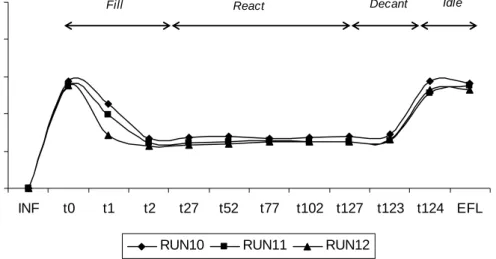
Grafik pada Gambar IV.13. memperlihatkan bahwa efisiensi penyisihan senyawa organik keseluruhan (overal) terbesar terjadi pada waktu reaksi 54 jam dengan besaran 57,38%. Pada waktu reaksi 12 jam penyisihan senyawa organik overal
72
yang terjadi adalah sebesar 33,61%, nilai ini merupakan nilai terkecil. Efisiensi penyisihan senyawa organik overal pada waktu reaksi 36 jam (40,36%) hampir sama dengan nilai yang dihasilkan pada reaksi dengan waktu reaksi 125 jam, yaitu 41,11%. Efisiensi penyisihan senyawa organik yang paling dominan adalah pada tahap reaksi dengan kisaran hasil 31,58% - 59,35%. Pada tahap pengisian karena tidak terjadi penurunan konsentrast COD, maka nilai efisiensi penyisihan adalah negatif hal ini menunjukkan saat pengisian seluruh variasi terjadi penambahan konsentrasi substrat.
Sebagai pembanding, dilakukan pengoperasian reaktor kontrol yang hanya berisi larutan glukosa dengan konsentrasi yang sama dengan larutan glukosa yang ditambahkan pada pengoperasian SBR tersebut, yaitu sebesar kurang lebih 6000 mg/l. Penurunan COD pada reaktor kontrol pada masing-masing variasi waktu reaksi 12; 36; 54 dan 125 jam adalah 33,56%; 67,12%; 88,43% dan 98,32%.
4.4.1.2.Pengaruh Variasi Waktu Reaksi pada Konsentrasi Biomasa
Profil konsentrasi biomasa dalam VSS untuk masing-masing variasi waktu reaksi ditunjukkan pada Gambar IV.14.-IV.17. Terlihat adanya kecenderungan yang similar yaitu pada tahap pengisian dan tahap pengendapan-pengurasan terjadi lonjakan konsentrasi VSS yang besarnya bervariasi untuk masing-masing RUN. Hal ini menunjukkan adanya pengenceran maupun pemekatan karena masuknya influen ke dalam sistem pada tahap pengisian maupun keluarnya efluen dari dalam sistem pada tahap pengurasan.
73 0 2000 4000 6000 8000 10000 INF t0 t1 t2 t4 t10 t14 t16 t17 t19
RUN1 RUN2 RUN3
React Fill
Settle
Decant Idle
Gambar IV.14. Grafik Konsentrasi VSS pada Waktu Reaksi 12 jam
0 2000 4000 6000 8000 10000 INF t0 t1 t2 t4 t8 t12 t18 t38 t40 t41 t43
RUN4 RUN5 RUN6
React Fill
Settle
Decant Idle
Gambar IV.15. Grafik Konsentrasi VSS pada Waktu Reaksi 36 jam
0 2000 4000 6000 8000 10000 INF t0 t1 t2 t13 t25 t36 t47 t56 t58 t59 t61
RUN7 RUN8 RUN9
React Fill
Settle
Decant Idle
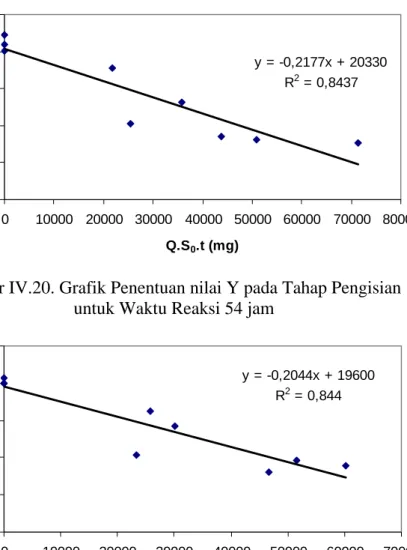
74 0 2000 4000 6000 8000 10000 INF t0 t1 t2 t27 t52 t77 t102 t127 t123 t124 EFL
RUN10 RUN11 RUN12
React Fill
Settle
Decant Idle
Gambar IV.17. Grafik Konsentrasi VSS pada Waktu Reaksi 125 jam 4.4.2. Kinetika ASBR
Pengoperasian ASBR merupakan suatu siklus yang terdiri dari beberapa tahap yaitu pengisian (fill), reaksi (react), pengendapan (settle), pengurasan (decant) dan stabilisasi (idle). Setiap tahap memiliki peran dalam menyisihkan bahan-bahan pencemar yang ada dalam air limbah. Penentuan kinetika reaksi ditentukan untuk tahap pengisian, reaksi dan stabilisasi. Tahap pengisian memiliki karakteristik yang berbeda dibandingkan dengan tahap reaksi dan stabilisasi dimana pada tahap pengisian terjadi terdapat aliran masuk ke dalam sistem namun tidak ada pengeluaran. Sedangkan dalam pada tahap reaksi dan stabilisasi reaktor beroperasi secara batch (tidak ada input ataupun output dari dan keluar sistem). Karena perbedaan sifat tersebut diatas penyajian data dan pembahasan dilakukan secara terpisah.
Oleh karena penyisihan senyawa organik sangat dipengaruhi oleh pertumbuhan biomasa maka studi kinetika yang diakukan meliputi pula penyisihan bahan organik dan pertumbuhan biomasa. Disamping itu, laju penyisihan total asam volatil yang dinyatakan sebagai asam asetat menjadi salah satu bahasan dalam bab ini karena pada proses anaerob keberadaan senyawa asam volatil memiliki arti penting.
75 4.4.2.1. Kinetika pada Tahap Pengisian
Sepanjang berlangsungnya tahap pengisian, kinetika reaksi mengacu pada sistem fed batch dimana umpan dimasukkan secara terus menerus tanpa terjadinya pengeluaran sama sekali dari sistem. Koefisien Yield pada tahap pengisian menunjukkan hubungan kuantitatif antara konsumsi substrat dengan pertumbuhan biomasa. Koefisien yield dapat ditentukan dengan menggunakan persamaan 2.8.
Dengan menempatkan nilai Q.S0.t dalam satuan mg pada sumbu-x dan Xt pada
sumbu-y dalam grafik maka akan diperoleh persamaan garis dimana slope garis tersebut merupakan nilai koefisien yield. Grafik penentuan yield pada masing-masing variasi waktu reasksi dapat dilihat pada Gambar IV.18.-IV.21.
y = -0,1356x + 18096 R2 = 0,8264 0 5000 10000 15000 20000 25000 0 10000 20000 30000 40000 50000 60000 70000 80000 Q.S0.t (mg) Xt (m g )
Gambar IV.18. Grafik Penentuan nilai Y pada Tahap Pengisian untuk Waktu Reaksi 12 jam
y = -0,1818x + 21019 R2 = 0,8485 0 5000 10000 15000 20000 25000 0 10000 20000 30000 40000 50000 60000 70000 80000 Q.S0.t (mg) Xt (m g )
Gambar IV.19. Grafik Penentuan nilai Y pada Tahap Pengisian untuk Waktu Reaksi 36 jam
76
Empat buah persamaan yang diperoleh dari plotting Q.S0.t versus Xt pada grafik
(Gambar IV.18. – IV.21) memberikan hasil koefisien yield dengan kecenderungan sama untuk keempat variasi waktu reaksi, yaitu memiliki nilai negatif. Hal ini memperlihatkan bahwa pada tahap pengisian, efek pengenceran konsentrasi biomasa yang ada dalam reaktor karena masuknya influen ke dalam reaktor lebih dominan dibandingkan dengan terjadinya pemakaian substrat oleh mikroorganisme. Nilai koefisien yield yang diperoleh berada pada rentang -0,162 hingga -1,092 mg VSS/mg COD. Nilai koefisien yield untuk masing-masing variasi waktu reaksi ditabulasikan pada Tabel IV.4.
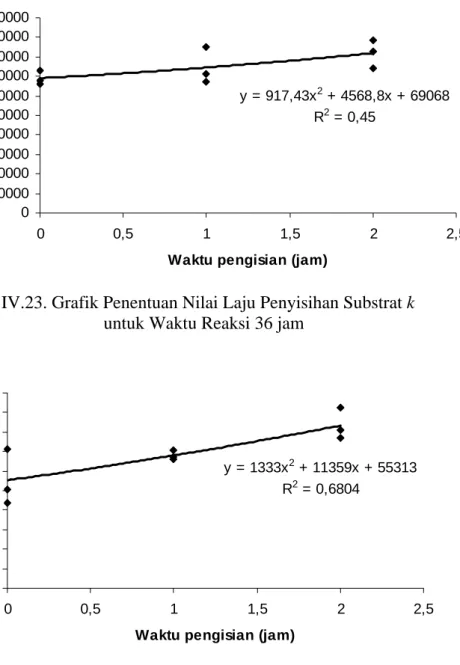
y = -0,2177x + 20330 R2 = 0,8437 0 5000 10000 15000 20000 25000 0 10000 20000 30000 40000 50000 60000 70000 80000 Q.S0.t (mg) Xt (m g )
Gambar IV.20. Grafik Penentuan nilai Y pada Tahap Pengisian untuk Waktu Reaksi 54 jam
y = -0,2044x + 19600 R2 = 0,844 0 5000 10000 15000 20000 25000 0 10000 20000 30000 40000 50000 60000 70000 Q.S0.t (mg) Xt (m g )
Gambar IV.21. Grafik Penentuan nilai Y pada Tahap Pengisian untuk Waktu Reaksi 125 jam
77
Laju penyisihan substrat pada tahap pengisian dapat ditentukan dengan persamaan (2.11.). Nilai k diperoleh dengan memplotkan nilai jumlah substrat (S’) dalam satuan mg terhadap waktu pengisian, t, dengan satuan jam pada grafik. Hasil plot grafik tersebut dituangkan dalam Gambar IV.23. – IV.26. dan nilai k pada Tabel IV.5.
Dari grafik pada Gambar IV.22. – IV.25. nilai laju penyisihan substrat k didapatkan dengan cara interpretasi hasil persamaan garis yang diperoleh dari grafik dengan persamaan (2.12.) Dari hasil perhitungan tersebut nampak bahwa nilai k negatif untuk semua variasi waktu reaksi, berkisar antara (-0,1356 jam-1) hingga (-0,2177 jam-1). Nilai k yang negatif ini menunjukan bahwa laju pemakaian substrat selama periode pengisian jauh lebih kecil dibandingkan laju penambahan substrat. Hal ini disebabkan karena konsentrasi senyawa organik yang dimasukkan ke dalam sistem sangat tinggi sehinga selama tahap pengisian jumlah susbtrat tidak mengalami penurunan tetapi justru mengalami kenaikan hingga akhir pemasukan substrat.
y = 4607,9x2 + 6068,1x + 62248 R2 = 0,4709 0 20000 40000 60000 80000 100000 120000 0 0,5 1 1,5 2 2,5
Waktu pengisian (jam)
Xt
(m
g
)
Gambar IV.22. Grafik Penentuan Nilai Laju Penyisihan Substrat k untuk Waktu Reaksi 12 jam
78 y = 917,43x2 + 4568,8x + 69068 R2 = 0,45 0 10000 20000 30000 40000 50000 60000 70000 80000 90000 100000 0 0,5 1 1,5 2 2,5
Waktu pengisian (jam)
Xt
(m
g
)
Gambar IV.23. Grafik Penentuan Nilai Laju Penyisihan Substrat k untuk Waktu Reaksi 36 jam
y = 1333x2 + 11359x + 55313 R2 = 0,6804 0 10000 20000 30000 40000 50000 60000 70000 80000 90000 100000 0 0,5 1 1,5 2 2,5
Waktu pengisian (jam)
Xt
(m
g
)
Gambar IV.24. Grafik Penentuan Nilai Laju Penyisihan Substrat k untuk Waktu Reaksi 54 jam
79 y = 5928,4x2 + 3885,4x + 52800 R2 = 0,9004 0 10000 20000 30000 40000 50000 60000 70000 80000 90000 100000 0 0,5 1 1,5 2 2,5
Waktu pengisian (jam)
Xt
(m
g
)
Gambar IV.25. Grafik Penentuan Nilai Laju Penyisihan Substrat k untuk Waktu Reaksi 125 jam
Tabel IV.4. Perolehan Nilai Y dan k pada Tahap Pengisian
Waktu Reaksi Y (mg VSS/mg COD) k (jam-1) 12 jam -1,092 -0,1356 36 jam -0,162 -0,1818 54 jam -0,221 -0,2177 125 jam -1,099 -0,2044
(Sumber : hasil perhitungan)
Nilai k yang semakin mendekati nol menunjukkan proses penyisihan substrat yang terjadi di dalam reaktor selama tahap pengisian oleh mikroorganisme semakin efektif. Kondisi tersebut menggambarkan bahwa penambahan substrat ke dalam sistem pada tahap pengisian dapat diimbangi dengan pemanfaatan substrat oleh biomasa yang ada di dalam reaktor. Dari Tabel IV.4. terlihat bahwa aktivitas biomasa dalam memanfaatkan substrat selama tahap pengisian terjadi paling optimal pada variasi waktu reaksi 12 jam dengan harga k = -0,1356 jam-1.
80 -50,63 -24,89 -59,39 -61,71 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi (m gV S S /m gC O D ) (j a m -1) -70 -60 -50 -40 -30 -20 -10 0 E fis ie n s i ( % )
Y (mg VSS/mg COD) k (jam-1) Efisiensi Fill
Gambar IV.26. Nilai Y, k dan Efisiensi Penyisihan Substrat pada Variasi Waktu Reaksi 12, 36, 54 dan 125 jam.
Gambar IV.26. membandingkan nilai-nilai Y, k, dan efisiensi untuk waktu reaksi 12, 36, 54, dan 125 jam. Dalam hal ini, nilai yang besarannya semakin mendekati nol adalah yang dianggap menunjang pada terjadinya reaksi yang baik di dalam reaktor. Dengan pertimbangan tersebut maka waktu reaksi 36 jam adalah variasi waktu yang mempunyai hasil Y, k dan efisiensi penyisihan substrat tahap pengisian yang cukup baik dibandingkan tiga waktu reaksi yang lain. Hasil Y, k dan efisiensi yang mendekati nilai pada waktu reaksi 36 jam adalah waktu reaksi 54 jam
4.4.2.2. Kinetika pada Tahap Reaksi
Dengan selesainya tahap pengisian maka tahap reaksi langsung dimulai. Begitu tahap reaksi dimulai, tidak ada lagi pemasukan umpan sehingga kinetika yang dikembangkan adalah berdasarkan sistem tertutup. Kinetika pada tahap reaksi dilakukan untuk melihat laju pemanfaatan substrat dan laju pertumbuhan biomasa rata-rata. Karena tahap reaksi dimulai setelah pengisian dihentikan, maka parameter yang digunakan adalah parameter akhir pengisian sebagai parameter awal reaksi.
81
4.4.2.2.1. Kinetika Laju Penyisihan Senyawa Organik Spesifik
Laju senyawa organik yang digunakan sebagai substrat oleh biomasa pada tahap reaksi dihitung dengan persamaan (2.13.).
Hasil perhitungan laju pemanfaatan substrat untuk berbagai variasi waktu reaksi dapat dilihat pada Tabel IV.5. Dari tabel tersebut dapat diketahui laju pemakaian spesifik sangat bervariasi dari 0,0137 jam-1 hingga 0,31037 jam-1. Laju pemakaian substrat spesifik rata-rata untuk masing-masing waktu reaksi adalah 0,2647 jam-1 (waktu reaksi 12 jam); 0,0841 jam-1 (waktu reaksi 36 jam); 0,0822 jam-1 (waktu reaksi 54 jam) dan 0,0216 jam-1 (waktu reaksi 125 jam).
Tampak bahwa pada waktu reaksi 12 jam laju pemakaian substrat spesifik mempunyai nilai yang paling tinggi dibanding dengan nilai pada waktu reaksi yang lain. Hal ini dimungkinkan karena pada waktu reaksi 12 jam, penyisihan yang dominan adalah pemakaian kosubstrat glukosa. Hal ini ditunjukkan dari uji glukotest yang dilakukan pada saat penelitian dengan menggunakan test strip glukotest pada akhir reaksi masih terdeteksi kandungan glukosa secara kualitatif. Untuk waktu reaksi 36 jam nilai q hampir sama dengan hasil pada waktu reaksi 54 jam. Sedangkan pada waktu reaksi 125 jam, nilai q yang diperoleh adalah yang paling kecil.
4.4.2.2.2. Kinetika Laju Pertumbuhan Biomasa Spesifik
Laju senyawa organik yang digunakan sebagai substrat oleh biomasa pada tahap reaksi dihitung dengan persamaan (2.14.).
Hasil perhitungan laju pertumbuhan biomasa spesifik dengan menggunakan persamaan diatas dapat dilihat pada Tabel IV.6.
Laju pertumbuhan biomasa spesifik rata-rata pada waktu reaksi 36 jam dan 54 jam hampir sama, yaitu pada rentang 0,0036 – 0,0038 jam-1. Sedangkan pada waktu reaksi 12 jam dan 125 jam diperoleh nilai laju pertumbuhan substrat spesifik yang lebih kecil, yaitu berturut-turut 0,0089 jam-1 dan 0,000454 jam-1. Pada waktu
82
reaksi 125 jam terjadi penurunan nilai μ. Hal ini dimungkinkan karena perpanjangan waktu reaksi dapat menyebabkan kondisi lingkungan menjadi tidak lagi mendukung bagi pertumbuhan karena adanya kemungkinan terbentuknya produk-produk metabolit yang bisa menjadi inhibitor bagi pertumbuhan biomasa.
Tabel IV.5. Laju Pemakaian Substrat Spesifik Tahap Reaksi
Waktu Reaksi RUN COD0 CODx X Q
12 jam RUN 1 23650 16846,00 2585,29 0,2193 RUN 2 24091,47 13185,47 2928,19 0,3104 RUN 3 22605,26 13022,26 3017,90 0,2646 0,2648 36 jam RUN 4 25542 19532,00 3112,48 0,0536 RUN 5 25337,84 14948,84 2965,51 0,0973 RUN 6 21052,63 11805,63 2534,43 0,1013 0,0841 54 jam RUN 7 25652,51 7422,22 3256,64 0,1000 RUN 8 21354,67 11065,73 2634,20 0,0697 RUN 9 22462,41 9254,08 3061,66 0,0770 0,0822 125 jam RUN 10 22046,32 14658,76 2785,12 0,0212 RUN 11 23498,12 18999,23 2625,50 0,0137 RUN 12 24692,22 15255,10 2523,31 0,0299 0,0216
(Sumber : Hasil perhitungan)
4.4.2.2.3. Penentuan Koefisien Yield (Y) dan Laju Kematian Biomasa (Kd) pada Tahap Reaksi
Koefisien Yield dan laju kematian biomasa dihitung dengan cara menempatkan q pada sumbu X dan μ pada sumbu Y pada diagram Cartersian. Hasil plot nilai q dan μ disajikan pada Gambar IV.27. – IV.30. Dari kelima gambar tersebut didapatkan persamaan y = 0,0404x – 0,0017 untuk variasi waktu reaksi 12 jam; y = 0,0572x – 0,0012 untuk waktu reaksi 36 jam; y = 0,0584x – 0,001 pada waktu reaksi 54 jam; dan y = 0,0473x – 0,0006 untuk waktu reaksi 125 jam.
Hal tersebut menunjukkan bahwa pada waktu reaksi 12 jam, nilai koefisein yield = 0,0404 mg VSS/mg COD dan Kd = 0,0017 jam-1, sedangkan pada waktu reaksi 36 jam, 54 jam dan 125 jam berturut-turut nilai Y = 0,0572 mg VSS/mg COD;
83
0,0584 mg VSS/mg COD; 0,0473 mg VSS/mg COD dan nilai Kd = 0,0012 jam-1, 0,001 jam-1, 0,0006 jam-1.
Tabel IV.6. Laju Pertumbuhan Biomasa Spesifik Tahap Reaksi
Waktu Reaksi RUN dX X μ
12 jam RUN 1 2585,29 2585,29 0,0078 RUN 2 2928,19 2928,19 0,0114 RUN 3 3017,90 3017,90 0,0078 0,0090 36 jam RUN 4 3112,48 3112,48 0,0018 RUN 5 2965,51 2965,51 0,0047 RUN 6 2534,43 2534,43 0,0043 0,0036 54 jam RUN 7 3256,64 3256,64 0,0049 RUN 8 2634,20 2634,20 0,0034 RUN 9 3061,66 3061,66 0,0031 0,0038 125 jam RUN 10 2785,12 2785,12 0,0003 RUN 11 2625,50 2515,50 0,0002 RUN 12 2523,31 2523,31 0,0009 0,0005
(Sumber : Hasil perhitungan)
y = 0,0404x - 0,0017 R2 = 0,7507 0 0,002 0,004 0,006 0,008 0,01 0,012 0,014 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 q (jam-1) μ (ja m -1 )
Gambar IV.27. Penentuan Y dan Kd untuk Waktu Reaksi 12 jam Beban COD 20.000 mg/l Tahap Reaksi
84 y = 0,0572x - 0,0012 R2 = 0,9638 0 0,001 0,002 0,003 0,004 0,005 0 0,02 0,04 0,06 0,08 0,1 0,12 q (jam-1) μ (j a m -1 )
Gambar IV.28. Penentuan Y dan Kd untuk Waktu Reaksi 36 jam Beban COD 20.000 mg/l Tahap Reaksi
y = 0,0584x - 0,001 R2 = 0,8559 0 0,001 0,002 0,003 0,004 0,005 0,006 0 0,02 0,04 0,06 0,08 0,1 0,12 q (jam-1) μ (j a m -1 )
Gambar IV.29. Penentuan Y dan Kd untuk Waktu Reaksi 54 jam Beban COD 20.000 mg/l Tahap Reaksi
y = 0,0473x - 0,0006 R2 = 0,947 0 0,0002 0,0004 0,0006 0,0008 0,001 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 q (jam-1) μ (j a m -1 )
Gambar IV.30. Penentuan Y dan Kd untuk Waktu Reaksi 125 jam Beban COD20.000 mg/l Tahap Reaksi
85
Hasil penentuan nilai Y menunjukkan bahwa koefisein yield percobaan cenderung lebih kecil dari nilai Y yang direkomendasikan oleh Metcalf & Eddy (2004) untuk proses anaerob tahap fermentasi (yaitu 0,1 mg COD/ mg VSS) maupun proses overall (yaitu 0,08 mg COD/ mg VSS). Nilai tersebut juga lebih kecil dibandingkan dengan hasil percobaan Chaerul, 2001 yang memperoleh nilai 0,0669 - 0,2123 mg COD/ mg VSS untuk pengolahan ASBR dengan substrat sintetis. Demikian pula apabila hasil tersebut dibandingkan dengan penelitian yang dilakukan oleh Helard, 2003 yang mendapatkan nilai Y = 0,3934 mg COD/mg VSS untuk pengolahan Anaerob pada beban 1500 mg/l dan 0,6677 mg COD/mg VSS untuk beban 3500 mg/l.
Gambaran mengenai koefisien faktor hasil (Y), laju kematian biomasa dan efisiensi penyisihan materi organik untuk masing-masing variasi waktu reaksi ditunjukkan pada Gambar IV.31. Dari grafik tersebut terlihat bahwa waktu reaksi 54 jam memiliki nilai Y maupun efisiensi penyisihan substrat terbesar dengan Kd yang cukup rendah dibandingkan dengan variasi waktu reaksi yang lain. Pada waktu reaksi 125 jam meskipun diperoleh nilai Kd paling kecil namun Y dan efisiensi penyisihan substrat lebih rendah dibandingkan dengan nilai pada waktu reaksi 36 jam dan 54 jam. Untuk waktu reaksi 36 jam, meskipun nilai Y hampir sama tinggi dan nilai Kd sedikit lebih tinggi dari variasi waktu reaksi 54 jam namun efisiensi penyisihan substrat tergolong rendah. Dengan mempertimbangkan data-data tersebut, pada tahap reaksi waktu reaksi 54 jam menghasilkan kinetika reaksi yang paling menonjol.
38,81 36,15 59,35 30,29 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07
12 jam 36 jam 54 jam 125 jam Waktu Reaksi (m g VSS /m g C O D ) (j a m -1) 0 10 20 30 40 50 60 70 E fis ie n s i ( % ) Y Kd (x10-1 jam-1) Efisiensi
Gambar IV.31. Nilai Y, Kd dan Efisiensi Penyisihan pada Tahap Reaksi untuk Setiap Variasi Waktu Reaksi
86
4.4.2.2.4. Kinetika Laju Penyisihan Asam Volatil
Hipotesa untuk proses anaerob pada penelitian ini adalah bahwa proses anaerob akan melalui tiga tahap yaitu hidrolisa, fermentasi (asidogenesa), dan metanogenesa. Salah satu cara untuk mengetahui apakah proses telah berjalan hingga tahap metanogenesa adalah dengan mengamati laju penyisihan asam volatil. Asam volatil sebagai asam asetat merupakan substrat yang seharusnya dikonsumsi oleh bakteri metanogens untuk dikonversi menjadi gas metana dan karbon dioksida. Laju penyisihan asam volatil sebagai asam asetat dinyatakan sebagai dt dC r A A =− − sebagimana persamaan (2.12.).
Hasil perhitungan laju penyisihan asam volatil disajikan pada Tabel IV.7. Besaran nilai laju penyisihan asam volatil untuk masing-masing RUN cukup bervariasi dengan rentang (-1,0492) sampai dengan (-15,6714) mg/l/jam. Nilai negatif pada laju penyisihan asam volatil menunjukkan bahwa tidak terjadi penyisihan tetapi justru terjadi penambahan konsentrasi total asam volatil. Hasil rata-rata laju pembentukan asam volatil untuk setiap variasi waktu reaksi menunjukkan nilai yang hampir sama, yaitu pada kisaran (-6,74) mg/l/jam hingga (-10,02) mg/l/jam.
Tabel IV.7. Laju Penyisihan Asam Volatil pada Tahap Reaksi
Waktu Reaksi RUN TAV0 TAVt dTAV/dt Rata-rata
12 jam RUN 1 780,67 940,47 -13,32 -6,74 RUN 2 796,12 808,71 -1,05 RUN 3 480,81 550,94 -5,84 36 jam RUN 4 780,86 1020,63 -6,66 -9,53 RUN 5 600,23 825,65 -6,26 RUN 6 617,49 1181,66 -15,67 54 jam RUN 7 765,71 1559,18 -14,69 -9,88 RUN 8 643,97 914,64 -5,01 RUN 9 763,16 1299,34 -9,93 125 jam RUN 10 517,07 1654,48 -11,50 -10,02 RUN 11 637,72 1596,18 -9,27 RUN 12 756,65 1816,87 -9,28
87
Secara keseluruhan terlihat adanya kecenderungan kenaikan laju pembentukan asam volatil dengan makin panjangnya waktu reaksi (Gambar IV.32.). Namun kenaikan yang cukup signifikan terlihat pada saat waktu reaksi 12 jam menjadi 36 jam. Sedangkan pada kenaikan waktu reaksi 36 jam menjadi 54 jam, maupun 54 jam menjadi 125 jam kenaikan laju pembentukan asam volatil kurang dari 5%.
6,00 7,00 8,00 9,00 10,00 11,00
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi La ju P e m be nt uk a n A s a m V o la til ( m g /l/ja m)
Gambar IV.32. Profil Laju Pembentukan Asam Volatil pada Berbagai Variasi Waktu Reaksi
4.4.2.3. Kinetika pada tahap Stabilisasi
Setelah berakhirnya tahap reaksi, sistem SBR memasuki tahap selanjutnya yaitu tahap sedimentasi. Tahap ini dilakukan selama 1 jam yang diteruskan dengan tahap pengurasan. Pada tahap pengurasan, dilakukan pembuangan air buangan hingga tersisa biomasa di dalam reaktor. Reaktor kemudian siap memasuki tahapan Stabilisasi (Idle) selama 2 jam untuk setiap variasi waktu reaksi.
Pada tahap stabilisasi tidak terjadi pemasukan influen ke dalam sistem. Perhitungan kinetika reaksi yang meliputi laju penyisihan substrat, laju pertumbuhan biomasa, koefisien hasil dan laju kematian biomasa mengacu pada persamaan (2.13) – (2.18.).
Hasil perhitungan laju penyisihan senyawa organik ditunjukkan pada Tabel IV.8. Hasil perhitungan laju pemakaian substrat menunjukkan bahwa pada tahap stabilisasi cenderung terjadi penyisihan senyawa organik kecuali pada salah satu
88
RUN yang menghasilkan nilai negatif (RUN11). Laju pemakaian substrat rata-rata terbesar adalah pada variasi waktu reaksi 36 jam sebesar 0,047 jam-1. Selanjutnya nilai laju pemakaian substrat berturut-turut 0,037 jam-1; 0,017 jam-1; 0,011 jam-1 untuk waktu reaksi 12 jam, 54 jam, dan 125 jam.
Tabel IV.8. Laju Pemakaian Substrat Tahap Stabilisasi (t = 2 jam)
Waktu Reaksi RUN COD0 CODt X q (jam-1)
12 jam RUN1 16745,00 16492,54 4648,66 0,027 RUN2 12769,03 12654,23 3900,64 0,015 RUN3 14092,74 13456,67 4550,04 0,070 Rata-rata: 0,037 36 jam RUN4 18954,23 18753,98 5235,50 0,019 RUN5 14326,65 13458,84 5753,35 0,075 RUN6 11540,76 11025,39 5431,32 0,047 Rata-rata: 0,047 54 jam RUN7 7054,17 6939,47 5666,00 0,010 RUN8 10882,45 10774,76 5329,03 0,010 RUN9 9188,32 8840,73 5462,07 0,032 Rata-rata: 0,017 125 jam RUN10 13129,76 12987,00 5694,37 0,013 RUN11 17134,40 17213,30 5316,65 -0,007 RUN12 13572,61 13277,43 5289,40 0,028 Rata-rata: 0,011
(Sumber : hasil perhitungan)
Pada Tabel IV.9. disajikan hasil perhitungan laju pertumbuhan biomasa (μ). Tampak bahwa kurang lebih 50% dari seluruh RUN mempunyai nilai μ bertanda negatif merata pada semua variasi waktu reaksi. Hasil μ yang negatif menunjukkan bahwa pertumbuhan biomasa pada RUN tersebut lebih kecil dibandingkan dengan kematian biomasa.
Penentuan kinetika koefisien faktor hasil dan laju kematian biomasa pada tahap stabilisasi dilakukan dengan cara yang sama dengan pada tahap reaksi. Plotting nilai q dan μ yang telah diperoleh pada perhitungan sebelumnya ditunjukkan pada Gambar IV.33. – IV.36.
89
Tabel IV.9. Laju Pertumbuhan Biomasa Spesifik Tahap Stabilisasi
Waktu Reaksi RUN dX X μ (jam-1)
12 jam RUN1 12,77 4648,66 0,001 RUN2 131,86 3900,64 0,017 RUN3 -147,32 4550,04 -0,016 36 jam RUN4 -213,56 5235,50 -0,020 RUN5 -17,69 5753,35 -0,002 RUN6 290,44 5431,32 0,027 54 jam RUN7 -333,54 5666,00 -0,029 RUN8 109,05 5329,03 0,010 RUN9 -158,18 5462,07 -0,014 125 jam RUN10 -120,61 5694,37 -0,011 RUN11 393,51 5316,65 0,037 RUN12 45,4 5289,40 0,004
(Sumber : hasil perhitungan)
Persamaan yang diperoleh pada grafik Gambar IV.33. hingga IV.36. memberikan nilai Y dan Kd yang bervarisi. Beberapa persamaan menghasilkan nilai Y ataupun
Kd yang negatif, yaitu Y = -0,551 mg VSS/mg COD (12 jam) ; Y = -0,2259 mg
VSS/mg COD (54 jam) ; Y = 0,9972 mg VSS/mg COD (125 jam) dan Kd = -0,0212 jam-1 (12 jam); Kd = - 0,0073 jam-1 (54 jam); Kd = -0,0212 jam-1 (125 jam).
Hal ini memperlihatkan bahwa pada tahap stabilisasi efek pengenceran konsentrasi substrat yang ada dalam reaktor karena dikeluarkannya efluen dari dalam reaktor sangat dominan dibandingkan dengan kemampuan mikroba dalam penyisihkan substrat yang ada. Nilai Kd yang negatif dapat dimungkinkan
diantaranya karena pada tahap stabilisasi ini sebenarnya merupakan ’perolehan kembali’ volume biomasa dari rangkaian proses, setelah substrat maupun kosubstrat dikeluarkan dari sistem. Sehingga seolah-olah terjadi pemekatan konsentrasi dan oleh karenanya laju kematian biomasa menjadi tidak terwakili.
90 y = -0,551x + 0,0212 R2 = 0,928 -0,02 -0,01 0,00 0,01 0,02 0,00 0,02 0,04 0,06 0,08 q (jam-1) m ( ja m -1 )
Gambar IV.33. Penentuan Y dan Kd Tahap Stabilisasi
pada Waktu Reaksi 12 jam
y = 0,3377x - 0,0144 R2 = 0,1606 -0,03 -0,02 -0,01 0,00 0,01 0,02 0,03 0,00 0,02 0,04 0,06 0,08 q (jam-1) m ( ja m -1 )
Gambar IV.34. Penentuan Y dan Kd
91 y = -0,2259x - 0,0073 R2 = 0,02 -0,04 -0,03 -0,02 -0,01 0,00 0,01 0,02 0,00 0,01 0,01 0,02 0,02 0,03 0,03 0,04 q (jam-1) m ( ja m -1 )
Gambar IV.35. Penentuan Y dan Kd Tahap Stabilisasi pada Waktu Reaksi 54 jam
y = -0,9972x + 0,0212 R2 = 0,5261 -0,02 -0,01 0,00 0,01 0,02 0,03 0,04 -0,01 -0,01 0,00 0,01 0,01 0,02 0,02 0,03 0,03 q (jam-1) m ( ja m -1)
Gambar IV.36. Penentuan Y dan Kd Tahap Stabilisasi pada Waktu Reaksi 125 jam Tabel IV.10. Nilai Y dan Kd Tahap Stabilisasi (t = 2 jam)
Waktu Reaksi Y (mg VSS/mg COD) Kd (jam-1) 12 jam -0,551 -0,0212 36 jam 0,3377 0,0144 54 jam -0,2259 0,0073 125 jam -0,9972 -0,0212
92 2,307 3,860 2,133 0,934 -1,2 -0,8 -0,4 0,0 0,4 0,8
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi (m g VSS /m g C O D ) ( j a m -1 ) -7 -6 -5 -4 -3 -2 -1 0 1 2 3 4 5 E fis ie n s i ( % )
Y (mg VSS/mg COD) Kd (x10-1 jam-1) Efisiensi
Gambar IV.37. Nilai Y, Kd dan Efisiensi Penyisihan Tahap Stabilisasi Waktu Reaksi 12, 36, 54, dan 125 jam
Hasil perhitungan nilai Y, Kd dan efisiensi penyisihan senyawa organik pada tahap stabilisasi disajikan dalam grafik (Gambar IV.37.) untuk mempermudah perbandingan antara variasi waktu reaksi yang dilakukan dalam penelitian ini. Terlihat bahwa hanya pada waktu reaksi 36 jam, nilai Y, Kd dan efisien penyisihan substrat bernilai positif. Pada waktu reaksi tersebut efisiensi penyisihan substrat adalah yang paling tinggi, yaitu 3,86%.
4.4.3. Hasil Analisa Identifikasi Mikroorganisme
Hasil analisa mikroorganisme menunjukkan bahwa jenis bakteri yang teridentifikasi di dalam sistem adalah Peptococcus sp. dan Lactobacillus sp. Sebagaimana dicantumkan dalam Tabel II.1. kedua jenis bakteri tersebut berperan pada tahap fermentasi pada proses anaerob. Produk yang dihasilkan dari aktivitas bakteri tersebut adalah butirat, propionat, laktat, suksinat, etanol, asetat, H2, CO2
dari proses dengan (Presscott, 2005). Tidak diperoleh informasi mengenai keberadaan bakteri metanogenik seperti Methanosarcina, Methanobrevibacter, Methanomicrobium, Methanogenium, Methanobacterium, Methanococcus, dan Methanospirillum. Bakteri-bakteri tersebut menghasilkan CH4 dan CO2 pada
proses pengolahan limbah cair secra anaerob (Presscott, 2005). Tidak diketemukannya jenis bakteri metanogenik dalam penelitian ini dimungkinkan salah satunya karena keberadaan amoniak bebas yang menjadi senyawa
93
penghambat di dalam sistem. Hasil identifikasi tersebut dapat dijadikan salah satu petunjuk bahwa proses anaerob yang terjadi di dalam reaktor belum memasuki tahap metanogenesa. Tentu hal tersebut harus didukung dengan hasil uji analisa gas maupun hasil uji analisa senyawa-senyawa yang dihasilkan oleh tahap fermentasi dan asetogenik.
4.4.4. Hasil Analisa Komposis Gas
Hasil analisa gas sebagaimana Gambar IV.38. menunjukkan bahwa pada seluruh variasi waktu reaksi, konsentrasi gas CH4 tidak terdeteksi. Hal ini menunjukkan
bahwa tidak terjadi pembentukan gas CH4 pada seluruh variasi waktu reaksi.
Dimungkinkan reaksi yang terjadi belum mencapai tahap metanogenesa. Hal ini bisa disebabkan karena suasana lingkungan di dalam reaktor tidak mendukung pertumbuhan bakteri ataupun adanya gangguan dari senyawa yang bersifat racun pada saat berlangsungnya reaksi.
Gambar IV.38. menunjukkan bahwa nilai konsentrasi gas H2 berkisar antara
0,0026 hingga 0,0095 %v/v., dan rentang konsentrasi CO2 adalah 0,0468 – 0,0692
%v/v. Konsentrasi CO2 tersebut jauh lebih kecil dari hasil pengukuran komposisi
gas yang diperoleh dari penelitian ASBR tahap metanogenesa dengan menggunakan substrat sintetis (Chaerul, 2001) yaitu sebesar kurang lebih 6,5622 %v/v. Pada penelitian tersebut dihasillkan komposisi CH4 sebesar 13,8479 %v/v.
0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 RUN 1 RUN 2 RUN 3 RUN 4 RUN 5 RUN 6 RUN 7 RUN 8 RUN 9 RUN 10 RUN 11 RUN 12
12 jam 36 jam 54 jam 125 jam
H2 CO2 CH4
94
Salah satu faktor yang mendukung suasana lingkungan adalah pH dan temperatur. Meskipun tidak dilakukan pengukuran suhu secara spesifik namun dapat diinformasikan bahwa reaksi selama penelitian berlangsung pada temperatur kamar. Sedangkan pH selama percobaan diukur dengan hasil pada rentang 6,15 – 8,47. Adapun pH yang mendukung untuk reaksi metanogenesa menurut beberapa sumber adalah sebagaimana Tabel IV.11. Dari data tersebut dapat disimpulkan bahwa kondisi pH percobaan masuk dalam rentang optimal.
Tabel IV.11. Kondisi pH Optimum untuk Reaksi Anaerob Tahap Metanogenesa
Rentang pH Keterangan
6,8 – 7,2 karena rentang derajat keasaman tersebut pembentukan metana akan berlangsung baik 6.6 - 7.6, dengan pH
optimum mendekati 7
dimana organisme metana bekerja dengan baik (Eckenfelder, 2000)
6,5 – 8,5 adalah kondisi optimum pembentukan metana (Speece, 1996, dikutip dari Chaerul, 2001).
4.4.5. Hasil Analisa Konsentrasi Fenol, Surfaktan, Minyak-Lemak, Amonia Bebas
Sebagai pengujian tambahan, dilakukan analisa kandungan fenol, surfaktan, minyak lemak, dan amonia bebas pada influen dan efluen. Hasil pengujian tersebut digambarkan pada grafik IV.39. – IV.42.
93,25 5,69 86,90 71,43 0 5 10 15 20 25
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi K ons e nt ra s i Fe nol ( m g/ l) 0 10 20 30 40 50 60 70 80 90 100 E fis ie n s i P e n y is ih a n ( % )
Influen Efluen Efisiensi
Gambar IV.39. Profil konsentrasi Fenol pada Influen dan Efluen Masing-Masing Variasi waktu Reaksi
95 0,00 -7,90 -78,05 -75,57 0 10 20 30 40 50 60
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi K ons e nt ra s i S ur fa k ta n (m g /l) -90 -80 -70 -60 -50 -40 -30 -20 -10 0 Ef is ie n s i P e n y is ih a n ( % )
Influen Efluen Efisiensi
Gambar IV.40. Profil konsentrasi Surfaktan pada Influen dan Efluen Masing-Masing Variasi waktu Reaksi
-39,23 -137,69 -82,32 -69,99 0 20 40 60 80 100 120 140 160 180
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi K o n s en tr as i M in y ak Le m a k ( m g/ l) -160 -140 -120 -100 -80 -60 -40 -20 0 E fis ie n s i Pe n y is ih a n ( % )
Influen Efluen Efisiensi
Gambar IV.41. Profil konsentrasi Minyak Lemak pada Influen dan Efluen Masing-Masing Variasi waktu Reaksi
Dari keempat grafik tersebut terlihat bahwa degradasi yang paing signifikan adalah degradasi fenol. Pada waktu reaksi yang lebih besar, persen penurunan konsentrasi fenol semakin besar. Sedangkan grafik surfaktan, minyak-lemak dan amonia bebas menunjukkan kecenderungan kenaikan konsentrasi. Surfaktan pada konsentrasi 10 mg/l bersifat menghambat proses anaerob sebagian sedangkan
96
pada konsetrasi diatas 100 mg/l, surfaktan menghambat secara total terjadinya tahapan metanogenesa (Speece, 1996).
-1572,56 -5539,70 -5076,96 -4961,27 0 20 40 60 80 100 120
12 jam 36 jam 54 jam 125 jam
Waktu Reaksi K ons e nt ra s i A m oni a k B e ba s ( m g/ l) -6000 -5000 -4000 -3000 -2000 -1000 0 E fis ie n s i P e n y is ih a n ( % )
Influen Efluen Efisiensi
Gambar IV.42. Profil konsentrasi Amonia Bebas sebagai N pada Influen dan Efluen Masing-Masing Variasi waktu Reaksi
4.4.6. Hasil Pengujian Angka Tembus Pandang Warna
Hasil scanning panjang gelombang menunjukkan bahwa panjang gelombang maksimal limbah cair adalah 300 nm. Angka tembus pandang wrana (DFZ) untuk masing-masing variasi waktu reaksi adalah sebagaimana sebagaimana ditunjukkan pada Gambar IV.43. – IV.46.
0 50 100 150 200 250 300 INFL t0 t1 t2 t6 t8 t12 t14 EFL Sequence D FZ ( m -1 )
RUN1 RUN2 RUN3
97 0 50 100 150 200 250 300 INFL t0 t1 t2 t11 t20 t30 t38 EFL Sequence D FZ ( m -1 )
RUN4 RUN5 RUN6
Gambar IV.44. Profil Angka Tembus Pandang (DFZ) pada Waktu Reaksi 36 jam
0 50 100 150 200 250 300 INFL t0 t1 t2 t16 t30 t44 t56 EFL Sequence D FZ ( m -1 )
RUN7 RUN8 RUN9
Gambar IV.45. Profil Angka Tembus Pandang (DFZ) pada Waktu Reaksi 54 jam
4.4.7. Perhitungan Nerasa Masa
Dari hasil analisa identifikasi bakteri dan analisa gas CO2, H2, O2, N2, dan CH4
dimana tidak ditemukan konsentrasi gas metana serta didukung dengan analisa identifikasi mikroorganisme yang hanya menemukan bakteri Lactobaccilus dan Peptococcus, maka diasumsikan bahwa tahapan reaksi proses anaerob pada penelitian ini adalah tahap fermentasi atau asidogenesa. Pada tahap ini terjadi proses degradasi dari senyawa yang lebih kompleks menjadi glukosa, yang
98
kemudian terdegradasi menjadi asam asetat, CO2 dan H2 maupun glukosa
terdegradasi terlebih dahulu menjadi melalui produk antara etanol, asam laktat, asam butirat dan propionat sebelum akhirnya membentuk CO2 dan H2.
0 50 100 150 200 250 300 INFL t0 t1 t2 t12 t24 t48 t96 t127 EFL Sequence D FZ ( m -1 )
RUN10 RUN11 RUN12
Gambar IV.46. Profil Angka Tembus Pandang Warna (DFZ) pada Waktu Reaksi 125 jam
Volume gas yang dihasilkan pada saat percobaan tidak terdeteksi pada saat pengukuran dengan menggunakan flowmeter udara ataupun dengan menggunakan barometer udara. Hal ini dimungkinkan karena volume gas yang terbentuk sangat kecil sehingga tidak terdeteksi oleh alat tersebut. Oleh karenanya data massa gas tidak dapat dimasukkan dalam perhitungan neraca masa.
Perhitungan dilakukan dalam basis COD, dimana faktor konversi TAV sebagai asam asetat menjadi COD adalah sebesar 1,067 g COD/g asam Asetat.
Substrat Glukosa Asam Asetat + CO2 + H2
Etanol asam laktat asam butirat asam propionat
99
Tabel IV.12. Perhitungan Neraca Masa (sebagai COD)
Waktu
Reaksi RUN Influen Efluen Tersisihkan
Total TAV Non TAV Total TAV Non TAV Total TAV Non TAV
mg mg mg mg mg mg mg mg mg 12 jam RUN 1 81151,20 1394,39 79756,81 59373,14 3681,14 55692,00 21778,06 -2286,76 24064,81 RUN 2 72621,60 1337,40 71284,20 45555,23 3500,89 42054,34 27066,37 -2163,49 29229,86 RUN 3 76547,37 914,62 75632,75 48444,01 3129,01 45315,00 28103,36 -2214,40 30317,75 36 jam RUN 4 91951,20 762,66 91188,54 67514,33 4022,03 63492,30 24436,87 -3259,37 27696,24 RUN 5 91216,22 1541,95 89674,26 48451,82 3791,74 44660,09 42764,39 -2249,78 45014,18 RUN 6 75789,47 1242,61 74546,86 39691,40 4621,68 35069,72 36098,07 -3379,07 39477,14 54 jam RUN 7 103227,41 762,66 102464,75 24982,09 5833,58 19148,51 78245,32 -5070,92 83316,24 RUN 8 91020,28 1620,11 89400,17 38789,14 3754,37 35034,77 52231,14 -2134,26 54365,40 RUN 9 89808,19 1214,71 88593,48 31826,63 4936,32 26890,31 57981,56 -3721,61 61703,17 125 jam RUN 10 85579,49 798,41 84781,08 46753,20 6957,72 39795,48 38826,29 -6159,31 44985,60 RUN 11 89580,24 1441,15 88139,09 61967,88 6974,75 54993,13 27612,36 -5533,60 33145,96 RUN 12 90409,39 1265,29 89144,10 47798,75 7138,48 40660,27 42610,64 -5873,18 48483,83
Hasil perhitungan neraca masa adalah sebagaimana Tabel IV.13. Pada tabel tersebut terlihat bahwa pada nilai TAV pada kolom ’Tersisihkan’ bernilai negatif. Hal itu berarti bahwa selama proses penyisihan asam-asam volatil lebih kecil apabila dibandingkan dengan pembentukan TAV. Dalam hal ini TAV mewakili keberadaaan asam-asam volatil seperti asam asetat, asam propionat, dan asam butirat.