1
Ria Rahmaningsih, Prayitno, Yahmin Jurusan Kimia FMIPA Universitas Negeri Malang
E-mail: riarahmaningsih@yahoo.co.id
ABSTRAK: Penelitian ini bertujuan untuk menggali pemahaman konsep dan miskonsepsi siswa Madrasah Aliyah tentang keperiodikan unsur menggunakan instrumen diagnostik two-tier. Penelitian ini bersifat deskriptif dengan subjek penelitian 60 siswa kelas XI IPA. Hasil penelitian menunjukkan bahwa pemahaman sebagian besar siswa pada keperiodikan unsur tergolong sangat rendah. Selain itu, ditemukan juga beberapa miskonsepsi. Diantaranya yaitu afinitas elektron unsur-unsur dalam satu golongan dari atas ke bawah selalu semakin kecil.
Kata-kata kunci: pemahaman konsep, two-tier, keperiodikan unsur
ABSTRACT: The purpose of this study was to determine student’s conceptual understanding and misconceptions of Islamic Senior High School for elements periodicity using two-tier diagnostic instrument. This study was descriptive design with subjects were 60 students of Grade XI of Science Classes. The result of this study indicates that most of student’s understanding for elements periodicity which is grouped into very low. Beside that, in this study was found some misconceptions. One of them was the electron affinity of the elements in a group from the top to the bottom is always decrease.
Key words: conceptual understanding, two-tier, elements periodicity
Ilmu kimia adalah ilmu yang mempelajari materi dan sifatnya, perubahan materi, dan energi yang menyertai perubahan tersebut (Silberberg, 2009:4). Menurut Nahum (2004:301), ilmu kimia berkaitan dengan sifat dan reaksi suatu zat. Effendy (2007:1) mendefinisikan ilmu kimia sebagai ilmu pengetahuan yang berkaitan dengan sifat, struktur, perubahan materi, hukum atau prinsip yang menggambarkan materi dan konsep serta teori yang menginterpretasikannya. Menurut Ben-zvi, Eylon, dan Silberstein (dalam Pinarba dan Canpolat, 2003:1328) ilmu kimia dianggap sulit oleh siswa. Ilmu kimia memiliki kesulitan yang cukup tinggi karena karakteristik ilmu kimia yang bersifat abstrak dan berjenjang (Kean dan Middlecamp, 1985:5). Disamping itu, menurut Johnstone (dalam Smith dan Nakhleh, 2011:398) dalam mempelajari kimia, siswa dituntut untuk memahami tiga representasi pemahaman yang meliputi makroskopik, submikroskopik, dan simbolik.
Gabel (1999:548) menyatakan bahwa konsep yang sulit dalam kimia menyebabkan siswa mengalami miskonsepsi. Miskonsepsi yaitu konsep yang berbeda dengan pemahaman ilmiah yang diterima secara umum dan ketika telah menjadi struktur kognitif siswa, maka akan menyebabkan siswa kesulitan dalam menghubungkan dengan informasi baru (Nakhleh,1992:191). Latar belakang, kemampuan, dan pengalaman siswa yang kurang memadai dalam memahami suatu konsep juga menyebabkan siswa menciptakan konsep sendiri yang berbeda dengan yang dimiliki masyarakat ilmiah sehingga terjadi miskonsepsi (Barke, Hazari, dan Yitbarek, 2009:2). Pemahaman yang berbeda ini juga disebabkan oleh siswa membangun konsep sains secara terbatas (Treagust, 2006:1).
Konfigurasi elektron dan sifat periodik unsur (meliputi: jari-jari atom atau ion, energi ionisasi, afinitas elektron, dan keelektronegatifan) merupakan salah satu pokok bahasan dalam kimia SMA. Pokok bahasan ini berisi konsep-konsep yang bersifat abstrak dan dianggap sulit
oleh siswa. Konsep tersebut menjadi prasyarat bagi konsep berikutnya, misalnya konsep ikatan kimia (Taber, 2003)
Untuk menggali konsep siswa, menurut Tüysüz (2009:626) dapat dilakukan dengan beberapa metode, antara lain metode peta konsep (Novak), wawancara (Carr), dan tes diagnostik two-tier (Treagust). Instrumen diagnostik two-tier yang dikembangkan oleh Treagust ini berupa tes pilihan ganda dengan dua tier (tahap) pemilihan jawaban. Tier (tahap) pertama berisi pertanyaan atau pernyataan dengan dua sampai empat jawaban, sedangkan tier (tahap) kedua berisi alasan untuk jawaban yang dipilih tersebut. Jawaban siswa akan dianggap benar hanya ketika siswa memilih jawaban dan alasan yang benar. Jika jawaban benar tapi alasan salah, maka jawaban siswa tersebut dianggap salah. Oleh karena itu, untuk dapat menjawab tes ini siswa harus benar-benar memahami konsepnya (Treagust, 2006). Instrumen ini dikembangkan karena adanya keterbatasan yang dimiliki oleh instrumen pilihan ganda yang tidak dapat mengetahui alasan pemilihan jawaban oleh siswa (Odom dan Barrow, 1995:46).
Berdasarkan uraian di atas maka dilakukan penelitian dengan judul “Menggali Pemahaman Konsep Siswa Madrasah Aliyah X tentang Keperiodikan Unsur Menggunakan Instrumen Diagnostik Two-Tier. Penelitian ini bertujuan untuk menggali pemahaman konsep siswa Madrasah Aliyah X tentang keperiodikan unsur dan menggali miskonsepsi yang dialami siswa Madrasah Aliyah X tentang keperiodikan unsur.
METODE
Penelitian yang dilakukan bersifat deskriptif. Subjek dalam penelitian ini adalah dua dari enam kelas XI IPA yang ada di Madrasah Aliyah X tahun ajaran 2012/2013 dengan jumlah 60 siswa. Penelitian dilakukan pada bulan Mei 2013. Data penelitian diperoleh dengan menggunakan instrumen diagnostik two-tier. Instrumen tersebut merupakan tes pilihan ganda dengan dua tier (tahapan). Setiap soal yang dikembangkan pada tier pertama berisi pertanyaan dengan 2-4 pilihan jawaban, sedangkan tier kedua berisi 3-4 pilihan alasan yang menyediakan pembenaran jawaban pada pilihan tier pertama. Instrumen yang dikembangkan sebanyak 20 item soal (10 soal berpasangan).
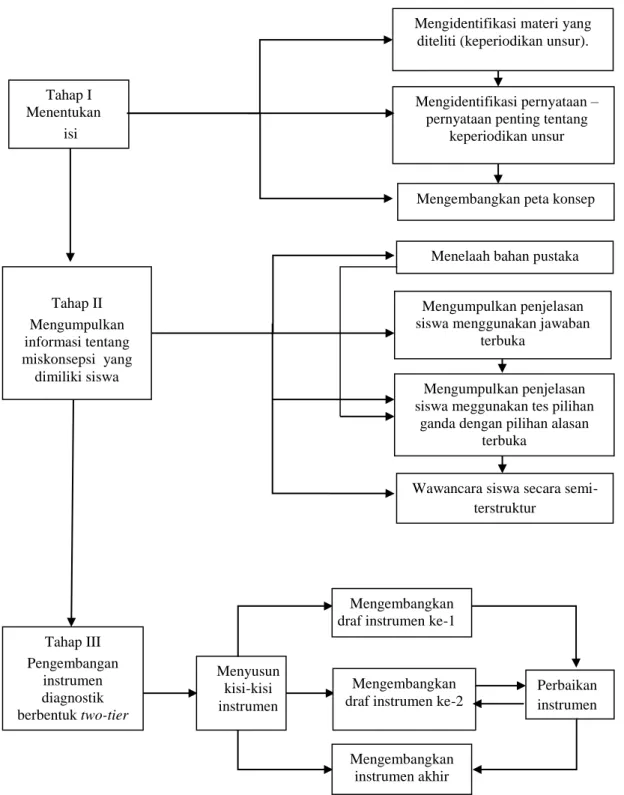
Tahap pengembangan instrumen diagnostik two-tier ini disajikan dalam Gambar 1 berikut.
(dikutip dari Chandrasegaran, Treagust, dan Mocerino, 2007:296). Gambar Bagan Pengembangan Instrumen Diagnostik Two-Tier
Analisis data untuk pemahaman konsep dilakukan dengan menentukan besarnya persentase siswa yang menjawab benar dan analisis data untuk miskonsepsi yang dialami
Tahap III Pengembangan instrumen diagnostik berbentuk two-tier Perbaikan instrumen Mengembangkan
draf instrumen ke-1
Menyusun kisi-kisi instrumen
Wawancara siswa secara semi-terstruktur
Mengumpulkan penjelasan siswa meggunakan tes pilihan
ganda dengan pilihan alasan terbuka
Mengumpulkan penjelasan siswa menggunakan jawaban
terbuka
Menelaah bahan pustaka
Tahap II Mengumpulkan informasi tentang miskonsepsi yang
dimiliki siswa
Mengembangkan peta konsep Mengidentifikasi pernyataan – pernyataan penting tentang
keperiodikan unsur Tahap I
Menentukan isi
Mengembangkan draf instrumen ke-2
Mengembangkan instrumen akhir
Mengidentifikasi materi yang diteliti (keperiodikan unsur).
siswa dapat dilakukan dengan cara menghitung besarnya persentase kombinasi pemilihan jawaban dan alasan yang konsisten salah untuk setiap pasangan soal.
HASIL DAN PEMBAHASAN
Pemahaman Siswa pada Keperiodikan Unsur
Pemahaman siswa dalam konsep keperiodikan unsur disajikan dalam Tabel 1 berikut. Tabel 1 Pemahaman Siswa
Berdasarkan Tabel 1, sebagian besar siswa (45,0%) memiliki pemahaman yang sangat rendah, 38,3% siswa memiliki pemahaman yang rendah dan 13,3% siswa memiliki pemahaman yang sedang. Selanjutnya sebanyak 3,3% siswa memiliki pemahaman yang tinggi dan tidak ada siswa yang memiliki pemahaman sangat tinggi.
Pemahaman Aspek-Aspek dalam Konsep Keperiodikan Unsur
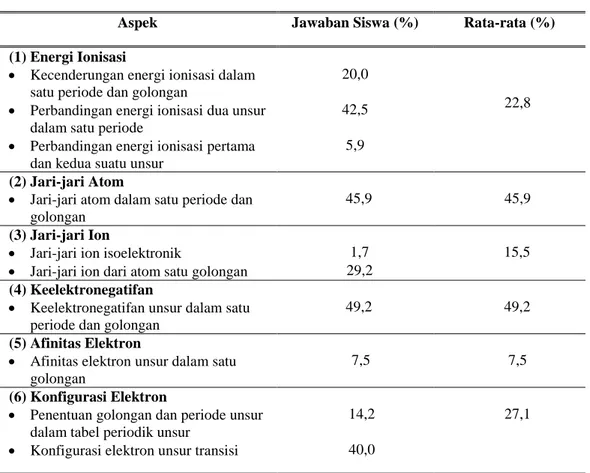
Persentase siswa yang memahami aspek-aspek dalam konsep keperiodikan unsur disajikan pada Tabel 2 berikut.
Tabel 2 Persentase Pemahaman Apek-Aspek Energi Ionisasi
Aspek Jawaban Siswa (%) Rata-rata (%) (1) Energi Ionisasi
22,8
Kecenderungan energi ionisasi dalam satu periode dan golongan
20,0
Perbandingan energi ionisasi dua unsur dalam satu periode
42,5
Perbandingan energi ionisasi pertama dan kedua suatu unsur
5,9
(2) Jari-jari Atom
Jari-jari atom dalam satu periode dan golongan
45,9 45,9
(3) Jari-jari Ion
Jari-jari ion isoelektronik 1,7 15,5
Jari-jari ion dari atom satu golongan 29,2 (4) Keelektronegatifan
Keelektronegatifan unsur dalam satu periode dan golongan
49,2 49,2
(5) Afinitas Elektron
Afinitas elektron unsur dalam satu golongan
7,5 7,5
(6) Konfigurasi Elektron
Penentuan golongan dan periode unsur dalam tabel periodik unsur
14,2 27,1
Konfigurasi elektron unsur transisi 40,0
Pemahaman Siswa Persentase (%) Sangat tinggi 0,0
Tinggi 3,3
Sedang 13,3
Rendah 38,3
Berdasarkan Tabel 2 diketahui persentase siswa yang memiliki pemahaman tentang aspek-aspek dalam konsep energi ionisasi tergolong rendah yaitu 22,8%. Hal ini menunjukkan sebagian besar siswa belum memahami tentang energi ionisasi pertama serta energi ionisasi kedua suatu unsur.
Selanjutnya, persentase siswa yang memahami konsep jari-jari atom dalam satu periode dan golongan adalah 45,9% sehingga persentase siswa yang memiliki pemahaman tentang konsep ini tergolong sedang. Pada konsep jari-jari ion, persentase siswa yang memiliki pemahaman tentang aspek-aspek pada konsep jari-jari ion tergolong sangat rendah yaitu 15,5%. Hal ini menunjukkan bahwa sebagian besar siswa belum memahami jari-jari ion, baik jari-jari ion isoelektronik maupun jari-jari ion dalam satu golongan.
Persentase siswa yang memiliki pemahaman tentang konsep keelektronegatifan tergolong sedang yaitu 49,2%. Persentase pemahaman siswa pada konsep ini adalah yang paling tinggi diantara keenam konsep di atas. Pada konsep afinitas elektron, persentase siswa yang memahami konsep afinitas elektron adalah 7,5% sehingga tergolong sangat rendah. Persentase pemahaman siswa pada konsep afinitas elektron adalah yang paling rendah diantara keenam konsep di atas.
Pada konsep konfigurasi elektron, persentase siswa yang memiliki pemahaman tentang aspek-aspek pada konsep konfigurasi elektron tergolong rendah yaitu 27,1%.
Miskonsepsi yang Dialami Siswa pada Konsep Keperiodikan Unsur
Selain pemahaman siswa, dalam penelitian ini juga diperoleh miskonsepsi yang dialami siswa. Miskonsepsi-miskonsepsi tersebut disajikan
dalam Tabel 3 berikut.
Tabel 3 Miskonsepsi yang Dialami Siswa pada Konsep Keperiodikan Unsur
Miskonsepsi Konsisten Salah
(%) (1) Konsep Energi Ionisasi
Energi ionisasi unsur dalam satu periode dari kiri ke kanan semakin kecil seiring dengan jari-jari yang semakin besar. Dalam satu golongan dari atas ke bawah energi ionisasi semakin besar seiring dengan jari-jarinya yang semakin kecil.
18,6
Energi ionisasi unsur dalam satu periode dari kiri ke kanan semakin kecil seiring dengan gaya tarik inti terhadap elektron terluar yang semakin lemah, sedangkan dalam satu golongan dari atas ke bawah energi ionisasi semakin besar seiring dengan gaya tarik inti terhadap elektron terluar yang semakin kuat.
28,3
Energi ionisasi unsur dalam satu periode maupun dalam satu
golongan sama (tidak berubah) 5,0
Energi ionisasi kedua suatu unsur lebih kecil daripada energi
ionisasi pertamanya. 3,3
Energi ionisasi kedua suatu unsur lebih besar daripada energi ionisasi pertamanya karena elektron kedua yang akan dilepas terletak lebih dekat dengan inti.
30,0
Energi ionisasi kedua suatu unsur sama dengan energi
ionisasi pertamanya. 18,3
Pada periode 3 energi ionisasi unsur dari kiri ke kanan selalu
(2) Jari-jari Atom
Jari-jari atom dalam satu periode dari kiri ke kanan semakin besar, sedangkan dalam satu golongan dari atas ke bawah jari-jari atom semakin kecil.
15,0
Jari-jari atom dalam satu periode dari kiri ke kanan semakin besar seiring dengan energi ionisasi yang semakin kecil, sedangkan dalam satu golongan jari-jari atom semakin kecil seiring dengan energi ionisasi yang semakin besar.
11,7
Jari-jari atom dalam satu periode maupun satu golongan sama
(tidak berubah) 10,0
(3) Jari-jari Ion
Jari-jari ion isoelektronik dipengaruhi oleh jumlah elektron yang dilepas atau diterima oleh atom. Semakin banyak elektron yang diterima suatu atom maka jari-jari anionnya makin besar. Semakin banyak elektron yang dilepas suatu atom maka jari-jari kationnya makin kecil.
21,7
Jari-jari ion isoelektronik berbanding terbalik dengan harga
energi ionisasinya. 11,7
Jari-jari ion yang berasal dari atom satu golongan dari atas ke bawah semakin besar karena energi ionisasi dalam satu golongan dari atas ke bawah semakin kecil.
43,3
Jari-jari ion yang berasal dari atom satu golongan dari atas ke
bawah semakin kecil. 15,0
(4) Keelektronegatifan
Keelektronegatifan unsur-unsur dalam satu periode dari kiri ke kanan semakin kecil, sedangkan dalam satu golongan dari atas ke bawah, keelektronegatifan unsur-unsur semakin besar.
23,3
Keelektronegatifan unsur ditentukan oleh mudah tidaknya unsur dalam melepas pasangan elektron. Dalam satu periode semakin mudah unsur-unsur melepas pasangan elektron, semakin elektronegatif, sedangkan dalam satu golongan semakin sulit unsur-unsur melepas elektron, semakin berkurang keelektronegatifannya.
10,0
Keelektronegatifan unsur-unsur dalam satu periode maupun
satu golongan sama. 8,3
(5) Afinitas Elektron
Afinitas elektron unsur-unsur dalam satu golongan dari atas
ke bawah selalu semakin kecil 48,3
(6) Konfigurasi Elektron
Penentuan periode dan golongan dari ion-ion pada tabel periodik didasarkan pada muatannya, jika bermuatan positif akan melepaskan elektron sejumlah muatannya dan
sebaliknya.
26,7
Konfigurasi ion suatu unsur sama dengan konfigurasi elektron
unsur tersebut 21,7
Konfigurasi elektron unsur Cu dan Cr dapat distabilkan oleh kombinasi dari 3d yang tidak terisi penuh (tidak penuh maupun setengah penuh) dan orbital 4s yang terisi penuh
28,3
Konfigurasi elektron yang stabil dari unsur Cu dan Cr sesuai dengan pengisian elektron awal tanpa dipengaruhi orbital penuh setengah penuh
Pada konsep kecenderungan energi ionisasi dalam satu periode dan golongan ini ditemukan miskonsepsi yaitu sebanyak 18,6% siswa beranggapan bahwa energi ionisasi unsur dalam satu periode dari kiri ke kanan semakin kecil seiring dengan jari-jari yang semakin besar. Dalam satu golongan dari atas ke bawah energi ionisasi semakin besar seiring dengan jari-jarinya yang semakin kecil. Miskonsepsi ini juga ditemukan pada penelitian yang dilakukan oleh Devinta (2011) yaitu “unsur-unsur yang memiliki jumlah kulit sama, tetapi jumlah kulit elektron valensi bertambah energi ionisasinya akan selalu makin turun”.
Miskonsepsi lainnya yaitu sebanyak 28,3% siswa beranggapan bahwa energi ionisasi unsur dalam satu periode dari kiri ke kanan semakin kecil seiring dengan gaya tarik inti terhadap elektron terluar yang semakin lemah, sedangkan dalam satu golongan dari atas ke bawah energi ionisasi semakin besar seiring dengan gaya tarik inti terhadap elektron terluar yang semakin kuat. Konsep yang benar menurut Jespersen, Brady, dan Hyslop (2012:345) adalah energi ionisasi dalam satu golongan dari atas ke bawah cenderung menurun, sedangkan dalam satu periode dari kiri ke kanan cenderung naik. Hal ini disebabkan dalam satu periode, nilai n tetap namun muatan inti bertambah sehingga tarikan inti terhadap elektron terluar meningkat yang mengakibatkan elektron tersebut sulit untuk lepas. Sebaliknya, dalam satu golongan, nilai n naik dan jarak antara inti dengan elektron terluar menjadi makin jauh sehingga tarikan inti terhadap elektron menjadi semakin lemah yang membuat elektron lebih mudah terlepas. Pada konsep perbandingan energi ionisasi kedua dengan energi ionisasi pertama suatu unsur ditemukan miskonsepsi yaitu sebanyak 30% siswa beranggapan bahwa energi ionisasi kedua suatu unsur lebih besar daripada energi ionisasi pertamanya karena elektron kedua yang akan dilepas terletak lebih dekat dengan inti. Hasil ini sesuai dengan yang pernah dilaporkan oleh Taber (2003: 158) yaitu “a large majority (84%) recognised the related point that after the atom is ionised, it then requires more energy to remove a second electron because the second electron is nearer the nucleus”. Selain itu, 18,3% siswa lainnya beranggapan bahwa elektron kedua yang akan dilepas suatu unsur terletak pada kulit yang sama dengan elektron pertama sehingga energi ionisasi kedua unsur tersebut sama dengan energi ionisasi pertamanya. Konsep yang lebih tepat yaitu energi ionisasi kedua suatu unsur lebih besar daripada energi ionisasi pertamanya karena setelah satu elektron terlepas maka tarikan inti terhadap elektron yang tersisa menjadi lebih kuat (Chang, 2011:262). Dengan kata lain, mengambil muatan negatif (elektron) dari muatan positif lebih sulit daripada mengambil muatan negatif (elektron) dari atom netral sehingga energi ionisasi kedua unsur lebih besar daripada energi ionisasi pertama. Miskonsepsi lain yang juga ditemukan adalah sebanyak 30% siswa beranggapan bahwa energi ionisasi unsur pada periode 3 dari kiri ke kanan selalu makin besar. Miskonsepsi ini juga pernah dilaporkan oleh Tan, dkk (2005: 186) yang menyebutkan bahwa “The first ionisation energy of phosphorus is less than that of sulfur because of the effect of an increase in nuclear charge”. Konsep yang benar yaitu energi ionisasi dari kiri ke kanan cenderung semakin besar, namun tidak selalu. Hal ini terbukti pada periode 3 energi ionisasi mengalami ketidakteraturan (Chang, 2011:264). Pada energi ionisasi terdapat ketidakteraturan dalam satu periode, seperti pada unsur periode 3 yaitu energi ionisasi unsur P lebih besar daripada unsur S. Penyebabnya adalah pada orbital p unsur S terisi empat elektron, sedangkan pada orbital p unsur P terisi tiga elektron. Pelepasan elektron dari np4 menyebababkan terbentuknya orbital np setengah penuh dan mengurangi tolakan
antar elektron sehingga elektron dari S lebih mudah terlepas (Silberberg, 2009:264).
Dalam konsep jari atom ditemukan sebanyak 15% siswa beranggapan bahwa jari-jari atom dalam satu periode dari kiri ke kanan semakin besar, sedangkan dalam satu golongan dari atas ke bawah jari-jari atom semakin kecil. Konsep yang benar menurut
(Jespersen, Brady, dan Hyslop, 2012:341) adalah dalam satu periode dari kiri ke kanan jari-jari atom semakin menurun. Hal ini disebabkan muatan inti bertambah sedangkan jumlah kulit tetap sehingga tarikan inti terhadap elektron lebih kuat. Sedangkan dalam satu golongan meskipun muatan inti bertambah namun pengaruh jumlah kulit lebih mendominasi sehingga jarak antara inti dengan elektron terluar lebih jauh dan jari-jari atom semakin besar.
Pada konsep jari-jari ion ditemukan miskonsepsi yaitu sebanyak 21,7% beranggapan bahwa jari-jari ion isoelektronik dipengaruhi oleh jumlah elektron yang dilepas atau diterima oleh atom. Semakin banyak elektron yang diterima suatu atom maka jari-jari anionnya makin besar. Semakin banyak elektron yang dilepas suatu atom maka jari-jari kationnya makin kecil. Konsep yang benar menurut Chang (2011:260) yaitu pada jari-jari anion atau kation isoelektronik bergantung pada jumlah proton dalam inti. Semakin banyak jumlah proton dalam inti, maka semakin kuat tarikan inti terhadap elektron terluar sehingga jari-jari ion menjadi lebih kecil. Dalam satu periode, jari-jari kation dan anion isoelektronik cenderung turun. Miskonsepsi lain yang ditemukan yaitu sebanyak 43,3% siswa beranggapan bahwa jari-jari ion yang berasal dari atom satu golongan dari atas ke bawah semakin besar karena energi ionisasi dalam satu golongan dari atas ke bawah semakin kecil. Konsep yang benar seperti yang disampaikan oleh Effendy (2007a:7) yaitu dalam satu golongan jari-jari ion cenderung meningkat dari atas ke bawah. Hal ini disebabkan oleh peningkatan jumlah kulit atom. Jadi, meskipun muatan inti bertambah, namun jarak antara inti dengan elektron terluar menjadi semakin jauh sehingga dari atas ke bawah dalam satu golongan, jari-jari ion cenderung meningkat.
Miskonsepsi yang ditemukan pada konsep keelektronegatifan yaitu sebanyak 23,3% siswa beranggapan bahwa keelektronegatifan unsur-unsur dalam satu periode dari kiri ke kanan semakin kecil, sedangkan dalam satu golongan dari atas ke bawah, keelektronegatifan unsur-unsur semakin besar. Menurut Effendy (2007a:20) konsep yang benar adalah dalam satu periode dari kiri ke kanan keelektronegatifan unsur-unsur semakin meningkat, dan sebaliknya dalam satu golongan dari atas ke bawah keelektronegatifan unsur semakin kecil. Unsur-unsur dengan keelektronegatifan yang tinggi memiliki kemampuan menarik pasangan elektron lebih kuat dibandingkan unsur-unsur dengan keelektronegatifan yang rendah.
Pada konsep afinitas elektron miskonsepsi yang ditemukan adalah sebanyak 48,3% siswa beranggapan bahwa afinitas elektron unsur-unsur dalam satu golongan selalu semakin kecil. Konsep yang benar yaitu pada tabel periodik unsur afinitas elektron dalam satu golongan cenderung menurun, namun tidak selalu seperti itu. Pada golongan 13 sampai 17, afinitas elektron dalam satu golongan dari unsur-unsur yang terletak pada periode teratas ke periode selanjutnya justru semakin besar. Hal ini disebabkan oleh tolakan-tolakan antara elektron yang dimiliki atom tersebut dengan elektron yang ditambahkan lebih kuat daripada tarikan inti pada elektron yang ditambahkan tersebut (Effendy, 2007a:18).
Miskonsepsi yang ditemukan pada konsep konfigurasi elektron yaitu sebanyak 26,7% siswa beranggapan bahwa penentuan periode dan golongan dari ion-ion pada tabel periodik didasarkan pada muatannya, jika bermuatan positif akan melepaskan elektron sejumlah muatannya dan sebaliknya. Selain itu, 21,7% lain siswa beranggapan bahwa konfigurasi ion sama dengan konfigurasi elektron unsur. Penentuan periode dan golongan dari konfigurasi ion dilakukan dengan mengubah konfigurasi ion tersebut menjadi konfigurasi elektron unsur tersebut. Menurut Silberberg (2009:270) penentuan periode dan golongan dilihat dari n tertinggi dan elektron valensinya. Untuk golongan utama maupun transisi periode diperoleh dari n tertinggi. Penentuan golongan untuk unsur golongan utama ditentukan oleh elektron valensinya yang sama dengan elektron terluarnya, namun pada unsur transisi elektron terluar
tidak sama dengan elektron valensinya. Pada unsur transisi elektron valensinya yaitu ns dan (n-1)d. Miskonsepsi lain yang ditemukan yaitu sebanyak 28,3% siswa menganggap bahwa konfigurasi elektron unsur Cu dan Cr dapat distabilkan dengan kombinasi dari 3d yang tidak terisi penuh (tidak penuh maupun setengah penuh) dan orbital 4s yang terisi penuh. Selain itu, sebanyak 21,7% siswa menganggap bahwa konfigurasi elektron yang stabil dari unsur Cu dan Cr sesuai dengan pengisian elektron awal tanpa dipengaruhi orbital penuh setengah penuh. Konsep yang benar menurut Effendy (2007b:198) bahwa tidak semua unsur transisi memiliki konfigurasi yang sama dengan pengisian awalnya, misalnya unsur Cu dan Cr. Hal ini disebabkan adanya faktor untuk mencapai kestabilan. Unsur Cu akan lebih stabil jika konfigurasinya mengikuti aturan penuh setengah penuh. Begitu juga dengan unsur Cr yang konfigurasinya berisi setengah penuh. Konfigurasi penuh setengah penuh ini lebih stabil dibandingkan konfigurasi tidak penuh dan penuh.
PENUTUP Kesimpulan
Berdasarkan uraian hasil penelitian dan pembahasan yang telah dikemukakan, maka dapat disimpulkan sebagai berikut.
1. Pemahaman siswa pada keperiodikan unsur yang tergolong sangat rendah sebanyak 45,0%, rendah sebanyak 38,3%, cukup sebanyak 13,3%, dan tinggi sebanyak 3,3%. Tidak ada siswa yang memiliki pemahaman sangat tinggi pada keperiodikan unsur.
2. Pemahaman siswa terhadap aspek-aspek dalam konsep keperiodikan unsur dinyatakan sebagai berikut.
a) Pemahaman siswa terhadap aspek-aspek dalam konsep energi ionisasi dan konfigurasi elektron tergolong rendah.
b) Pemahaman siswa terhadap aspek-aspek dalam konsep jari-jari atom dan keelektronegatifan unsur tergolong sedang.
c) Pemahaman siswa terhadap aspek-aspek dalam konsep jari-jari ion dan afinitas elektron tergolong sangat rendah.
3. Miskonsepsi yang dialami siswa pada konsep keperiodikan unsur adalah sebagai berikut. a) Energi ionisasi unsur dalam satu periode dari kiri ke kanan semakin kecil seiring dengan
jari-jari yang semakin besar. Dalam satu golongan dari atas ke bawah energi ionisasi semakin besar seiring dengan jari-jarinya yang semakin kecil.
b) Energi ionisasi unsur dalam satu periode dari kiri ke kanan semakin kecil seiring dengan gaya tarik inti terhadap elektron terluar yang semakin lemah, sedangkan dalam satu golongan dari atas ke bawah energi ionisasi semakin besar seiring dengan gaya tarik inti terhadap elektron terluar yang semakin kuat.
c) Energi ionisasi kedua suatu unsur lebih besar daripada energi ionisasi pertamanya karena elektron kedua yang akan dilepas terletak lebih dekat dengan inti.
d) Energi ionisasi kedua suatu unsur sama dengan energi ionisasi pertamanya. e) Energi ionisasi unsur pada periode 3 dari kiri ke kanan selalu makin besar.
f) Jari-jari atom dalam satu periode dari kiri ke kanan semakin besar, sedangkan dalam satu golongan dari atas ke bawah jari-jari atom semakin kecil.
g) Jari-jari ion isoelektronik dipengaruhi oleh jumlah elektron yang dilepas atau diterima oleh atom. Semakin banyak elektron yang diterima suatu atom maka jari-jari anionnya makin besar. Semakin banyak elektron yang dilepas suatu atom maka jari-jari kationnya makin kecil.
h) Jari-jari ion yang berasal dari atom satu golongan dari atas ke bawah semakin besar karena energi ionisasi dalam satu golongan dari atas ke bawah semakin kecil.
i) Keelektronegatifan unsur-unsur dalam satu periode dari kiri ke kanan semakin kecil, sedangkan dalam satu golongan dari atas ke bawah, keelektronegatifan unsur-unsur semakin besar.
j) Afinitas elektron unsur-unsur dalam satu golongan dari atas ke bawah selalu semakin kecil.
k) Penentuan periode dan golongan dari ion-ion pada tabel periodik didasarkan pada muatannya, jika bermuatan positif akan melepaskan elektron sejumlah muatannya dan sebaliknya.
l) Konfigurasi ion suatu unsur sama dengan konfigurasi elektron unsur tersebut.
m) Konfigurasi elektron unsur Cu dan Cr dapat distabilkan oleh kombinasi dari 3d yang tidak terisi penuh (tidak penuh maupun setengah penuh) dan orbital 4s yang terisi penuh. n) Konfigurasi elektron yang stabil dari unsur Cu dan Cr sesuai dengan pengisian elektron
awal tanpa dipengaruhi orbital penuh setengah penuh. Saran
Berdasarkan hasil penelitian yang diperoleh, maka dapat diuraikan saran-saran sebagai berikut.
1. Guru hendaknya memilih metode pembelajaran dan merancang LKS (Lembar Kerja Siswa) yang sesuai dengan kondisi di kelas serta berpusat pada siswa sehingga siswa berperan aktif dalam pembelajaran di kelas.
2. Guru hendaknya mengambil tindakan untuk memperbaiki miskonsepsi siswa. Salah satunya yaitu menggunakan strategi konflik kognitif untuk memperbaiki miskonsepsi yang dialami siswa.
3. Siswa diharapkan lebih aktif dalam mengikuti pelajaran, bertanya kepada guru, dan berdiskusi dengan guru.
4. Untuk peneliti selanjutnya disarankan untuk lebih banyak melakukan kajian literatur dan wawancara sehingga instrumen yang dihasilkan lebih baik dalam menggali miskonsepsi siswa.
DAFTAR RUJUKAN
Barke, H-D., Hazari, A. & Yitbarek, S. 2009. Misconception in Chemistry. Adressing Perception in Chemical Education. Germany: Springer.
Chandrasegaran, A. L., Treagust D. F. & Mocerino, M. 2007. The Development of a Two-tier Multiple-Choice Diagnostic
Instrument for Evaluating Secondary School Students’ Ability to Describe and Explain Chemical Reactions Using Multiple Levels of
Representation. Chemistry Education Research and Practice, 8 (3). (Online), (http://pubs.rsc.org), diakses 27 Agustus 2012.
Chang, R. 2011. General Chemistry: The Essential Concepts (sixth edition). New York: McGraw-Hill Companies.
Devinta, A. 2011. Identifikasi Persepsi Konsep Sukar dan Salah Konsep Sifat Periodik Unsur pada Siswa SMA Negeri 8 Malang. Skripsi tidak diterbitkan. Malang: Jurusan Kimia Universitas Negeri Malang
Effendy. 2007a. A-Level Chemistry for Senior High School Students (volume 1B). Malang: Bayumedia Publishing.
Effendy. 2007b. A-Level Chemistry for Senior High School Students (volume 2B). Malang: Bayumedia Publishing.
Gabel, D. 1999. Improving Teaching and Learning through Chemistry Education Research: A Look to the Future. Journal of Chemical Education, 76 (4): 548-554.
Jespersen, N. D., Brady, J.E, Hyslop, A. 2012. Chemistry: The Molecular Nature of Matter (sixth edition). USA: Courier Kendallville.
Kean, E. & Middlecamp, E. 1985. Panduan Belajar Kimia Dasar. Jakarta: Gramedia.
Nahum, T. L., Hosfein, A., Naaman, R. M. & Dov, Z. B. 2004. Can Final Examination Amplify Student`s Misconceptions in Chemistry. Chemistry Education Research and Practice, 5 (3). (Online), (http://pubs.rsc.org), diakses 14 September 2012.
Nakhleh, M.B. 1992. Why Some Students Don’t Learn Chemistry Chemical Misconceptions. Journal of Chemical Education, 69 (3): 191 – 196.
Odom, A.L & Barrow L.H. 1995. Development and Application of a Two-Tier Diagnostic Test Measuring College Biology Students’ Understanding of Diffusion and Osmosis after a Course of Instruction. Journal of Research in Science Teaching, 32 (1): 45-6. Pinarba,T. & Canpolat, N. 2003. Student’s Understanding of Solution Chemistry Concepts.
Journal of Chemical Education, 80 (11): 1328.
Silberberg, M. S. 2009. Chemistry The Molecular Nature of Matter and Change (fifth edition). New York: McGraw-Hill Companies.
Smith, K.C & Nakhleh, M.B. 2011. University Students’ Conceptions of Bonding in Melting and Dissolving Phenomena. Chemistry Education Research and Practice. 12 (398). (Online), (http://pubs.rsc.org), diakses 01 Mei 2012.
Taber, K. S. 2003. Understanding Ionisation Energy: Physical, Chemical and Alternative Conceptions. Chemistry Education Research And Practice, 4 (2). (Online), (http://pubs.rsc.org), diakses 30 April 2013.
Tan, K.C. D., Taber, K. S., Goh, N.K. & Chia, L. S. 2005. The Ionisation Energy Diagnostic Instrument:A Two-Tier Multiple-Choice Instrument to Determine High School Students’ Understanding of Ionisation Energy. Chemistry Education Research And Practice, 6 (4). (Online), (http://pubs.rsc.org), diakses 27 Agustus 2012.
Treagust, D. F. 2006. Diagnostic Assessment in Science as a Means to
Improving Teaching, Learning and Retention. Makalah disajikan pada UniServe Science Assessment SymposiumProceedings, 2006, (Online), (http://sydney.du.au/science/uniserve_science/pubs/procs/2006/
treagust/pdf.), diakses 28 Sepetember 2012.
Tüysüz, C. 2009. Development of Two-Tier Instrument and Assess Students` Understanding in Chemistry. Scientific Research and Essay, 4 (6). (Online), (http://www.academicjournals.org/SRE), diakses 24 September 2012.