PENETAPAN KADAR PARASETAMOL DALAM TABLET DENGAN SPEKTROFOTOMETRI UV-VIS
I. Tujuan :
1. Tujuan Umum
Mahasiswa mampu melakukan penetapan kadar parasetamol dalam tablet menggunakan spektrofotometri uv-vis
2. Tujuan Khusus
a. Dapat membuat kurva hubungan konsentrasi parasetamol dan absorbansi pada panjang gelombang maksimum.
b. Dapat membuat persamaan regresi linier.
c. Dapat menentukan kadar parasetamol dalam tablet dengan spektrofotometri UV-Vis dengan kurva kalibrasi regreasi dan persamaan garis regresi linier. II. Pendahuluan
Zat aktif yang memiliki kompresibilitas buruk akan tetapi dikehendaki dalam takaran yang besar harus dibuat dengan cara granulasi basah. Apabila dibuat dengan cetak langsung akan dibutuhkan banyak bahan tambahan, sehingga volume tablet menjadi terlalu besar (Hoover, 1975).
Pemilihan parasetamol sebagai model disebabkan parasetamol adalah salah satu obat analgetik-antipiretik yang banyak digunakan khususnya di fasilitas pelayanan kesehatan pemerintah (DepKes RI, 1990). Parasetmol memiliki kompresibilitas yang buruk sementara itu jumlah parasetamol dalam satu tablet cukup besar yaitu 500 mg, sehingga untuk menghasilkan tablet dengan mutu fisik yang memuaskan harus dibuat dengan metode granulasi basah.
Penelitian ini dilaksanakan untuk mengetahui jumlah fines yang optimum yang dapat menghasilkan kualitas tablet parasetamol yang baik.
III. Dasar Teori Parasetamol
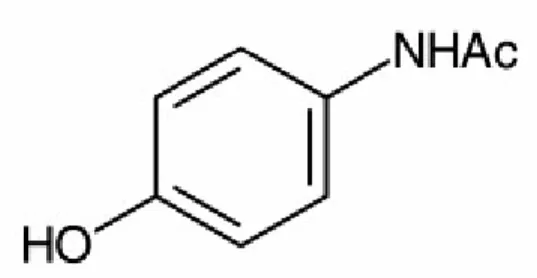
Parasetamol (asetaminofen) merupakan senyawa turunan sintetis dari paminofenol yang memberikan efek analgetik dan antipiretik. Senyawa ini mempunyai rumus kimia N-asetil-p-amonofenol atau p-asetamidofenol atau 4’-hidroksiasetalinid, bobot molekul 151,16 gram/mol dengan rumus kimia C8H9NO2 dan mempunyai struktur molekul sebagai berikut :
Gambar 1. Struktur Kimia Parasetamol
Parasetamol bila diukur absorbansinya pada spektrofotometri UV akan memperlihatkan absorbansi maksimum pada panjang gelombang 245 nm untuk larutan asam dan 257 nm untuk larutan basa.
Sifat Fisiko Kimia
Tablet parasetamol mengandung asetaminofen C8H9NO2, tidak kurang dari 95,0 % dan tidak lebih dari 105,0 %, dari jumlah yang tertera pad etiket. Parasetamol berupa hablur atau serbuk hablur putih, tidak berbau dan berasa pahit yang larut dalam 70 bagian air, 7 bagian etanol 95 % P, 13 bagian aseton P, 40 bagian gliserol P,9 bagian propilemglikol P, dan larut dalam alkali hidroksida (Anonim, 1979).
Parasetamol memiliki pKa 9,5 (25oC), kisien partisi 0,5 dan titik leleh 169o-170,5oC. Larutan jenuh parasetamol memiliki pH antara 5,3-6,5 (Moffat.,2005).
Parasetamol memenuhi uji identifikasi secara Kromatografi Lapis Tipis (KLT) dengan menggunakan 1 mg per ml dalam methanol P dan fase gerak diklorometana P-methanol (4:1).
Farmakokinetika
Parasetamol diberikan secara oreal. Penyerapan dihubungkan dengan tingkat pengosongan perut dan konsentrasi darh puncak biasanya tercapai dalam 30-60 menit.
Parasetamol mikrosomal hati dan diubah menjadi sulfat dan glukorida acetaminopen, yang secara farmakologis tidak aktif. Kurang dari 5 % diekskresikan dalam keadaan tidak berubah. Metabolit minor, tetapi sangat aktif (N-acetyl-p-benzoquinone) adalah penting dalam dosis besar karena efek toksinya terhadap hati danginjal. Waktu paruh parasetamol adalah 2-3 jam dan relatif tidak berpengaruh oleh fungsi ginjal. Dengan kualitas toksik atau penyakit hati, waktu paruhnya dapat meningkat dua kali lipat atau lebih.
Efek-efek yang Tidak Diinginkan
Dalam dosis terapetik sedikit peningkatan enzim-enzim hati kihentikan. Dengan dosis yang lebihadang-kadang bisa terjadi tanpa adanya ikterus: keadaan ini revesibel bila obat dihentikan. Dengan dosis yang lebih besar, pusing-pusing, ketegangan dan disorientasi bisa terlihat. Menelan 15 gram acetaminophen bias fatal, kematian disebabkan oleh hepatotoksik yang hebat dengan nekrosis lobules sentral, kadang-kadang dikaitkan dengan nekrosis tubular ginjal akut. Gejala-gejala awal dari kerusakan hati meliputi mual, muntah-muntah, diare dan nyeri perut. Data baru juga menunjukkan acetaminophen dalam kasus kerusakan ginjal hati yang langka dari kerusakan. Kerusakan ini telah terjadi bahkan sesudah pemberian acetaminophen dosis biasa. Terapi tidak sangat memuaskan dari pada terapi untuk overdosis aspirin. Di samping terapi suportif, tindakan-tindakan yang terbukti sangat berguna adalah pemberian grup-grup sulfhydryl untuk menetralisir metabolit-metabolit yang toksik. Acetylcysteine dipakai untuk tujuan ini. Anemia hemolitik dan metemoglobinemia, pernah dilaporkan dengan pemakaian phenacetyn, jarang terlihat dengan pemakaian acetaminophen. Nefritis interstisial dan nekrosis papilla yang merupakan komplikasi serius dari phenacetyn, namun dengan pemakaian acetaminophen kronis yang luas tidak terjadi, padahal kenyataannya kurang lebih 80 % dari phenacetyn dengan cepat dimetabolisme menjadi acetaminophen. Pendarahan gastrointestinal tidak terjadi. Harus berhati-hati pada penderita sakit hati.
SPEKTROFOTOMETRI
Spektrofotometer UV-Vis (Ultra Violet-Visible) adalah salah satu dari sekian banyak instrumen yang biasa digunakan dalam menganalisa suatu senyawa kimia. Spektrofotometer umum digunakan karena kemampuannya dalam menganalisa begitu banyak senyawa kimia serta kepraktisannya dalam hal preparasi sampel apabila dibandingkan dengan beberapa metode analisa.
Spektrofotometri uv-vis adalah pengukuran serapan cahaya di daerah ultraviolet (200 – 350 nm) dan sinar tampak (350 – 800 nm) oleh suatu senyawa. Serapan cahaya uv atau cahaya tampak mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi. Panjang gelombang cahaya uv atau cahaya tampak bergantung pada mudahnya promosi elektron. Molekul-molekul yang memerlukan lebih banyak energi untuk promosi elektron, akan menyerap pada panjang gelombang yang lebih pendek. Molekul yang memerlukan energi lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya dalam daerah tampak (senyawa berwarna) mempunyai elektron yang lebih mudah dipromosikan dari pada senyawa yang menyerap pada panjang gelombang lebih pendek.
http://faulampung-sahabatlabkimia.blogspot.com/2009/10/laporan-praktikum-pengujian-paracetamol.html
Analisis kuantitatif dengan metode spektrofotometri UV-Vis dapat digolongkan atas tiga macam pelaksanaan pekerjaan, yaitu : (1) analisi zat tunggal atau analisis satu kompenen; (2) analisia kuantitatif campuran dua macam zat atau analisis dua kompenen; dan (3) analisis kuantitatif campuran tiga macam zat atau lebih (analisis multi kompenen).
1. Analisis Kompenen Tunggal
Jika absorpsi suatu seri konsentrasi larutan diukur pada panjang gelombang, suhu, kondisi pelarut yang sama; dan absorbansi masing-masing larutan diplotkan terhadap konsentrasinya maka suatu garis lurus akan teramati sesuai dengan persamaan Hukum Lambert Beer. Grafik ini disebut dengan plot hukum Lambert Beer dan jika garis yang dihasilkan merupakan suatu garis lurus maka dapat dikatakan bahwa hukum
Lambert Beer dipenuhi pada kisaran konsentrasi yang teramati. Cara lain untuk menetapkan kadar sampel adalah dengan menggunakan perbandingan absorbansi sampel dengan absorbansi baku atau dengan menggunakan persamaan regresi linier yang menyatakan hubungan konsentrasi baku dengan absorbansinya. Persamaan kurva baku digunakan untuk menghitung kadar dalam sampel.
Data spektra UV-Vis secara tersendiri tidak dapat digunakan untuk identifikasi kualitatif obat atau metabolitnya. Sedangkan pada aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi yang diserap oleh cuplikan ditentukan dengan membandingkan intensitas sinar yang diteruskan dengan intensitas sinar yang diserap jika tidak ada spesies penyerap lainnya. Intensitas atau kekuatan radiasi cahaya sebanding dengan jumlah foton yang melalui satu-satuan luas penampang per detik. Besarnya intensitas energi REM yang diabsorpsi proporsional dengan jumlah kromofornya (konsentrasinya), dan hubungan proporsional ini dirumusan jumlah foton yang melalui satu-satuan luas penampang per detik. Besarnya intensitas energi REM yang diabsorpsi proporsional dengan jumlah kromofornya (konsentrasinya), dan hubungan proporsional ini dirumuskan dalam bentuk persamaan Hukum Limbert Beer : A = є b c Keterangan : A = Absorbansi € = Absorptivitas molar (cm mg/mL) b = Tebal kuvet (cm) c = Konsentrasi (mg/mL)
Dengan mengetahui nilai absorbansi dari larutan sampel, melaui kurva kalibrasi dapat ditentukan konsentrasinya. Penetapan kadar parasetamol juga dapat ditentukan melalui persamaan regresi linier :
y = bx + a Keterangan : y = Absorbansi x = Konsentrasi
Ada beberapa hal yang harus diperhatikan dalam analisa dengan spektrofotometri UV-Vis terutama untuk senyawa yang semula tidak berwarna yang akan dianalisis dengan spektrofotometri visible karena senyawa tersebut harus diubah terlebih dahulu menjadi senyawa yang berwarna.
a. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Hal yang perlu dilakukan jika senyawa yang dianalisis tidak menyerap pada daerah tersebut. Cara yang digunakan adalah dengan merubah menjadi senyawa lain atau direaksikan dengan pereaksi tertentu. Pereaksi yang digunakan harus memenuhi beberapa persyaratan tertentu yaitu :
1. Reaksinya reaktif dan sensitif
2. Reaksinya cepat, kuantitatif, dan reprodusibel 3. Hasil reaksi stabil dalam jangka waktu yang lama
Keselektifan dapat dinaikkan dengan mengatur pH, pemakaian masking agent, atau penggunaan teknik ekstraksi.
b. Waktu operasional (operating time)
Cara ini biasa digunakan untuk pengukuran hasil reaksi atau pembentukan warna. Tujuan untuk mengetahui waktu pembentukan yang stabil. Waktu operasional ditentukan dengan hubungan antara waktu pengukuran dengan absorbansi larutan. Pada saat awal terjadi reaksi, absorbansi senyawa yang berwarna ini meningkat sampai waktu tertentu hingga diperoleh absorbansi yang stabil. Semakin lama waktu pengukuran, mak ada kemungkinan senyawa yang berwarna tersebut menjadi rusak atau terurai sehingga intensitas warnanya turun akibatnya absorbansinya juga turun. Karena alasan inilah, maka untuk pengukuran senyawa berwarna (hasil suatu reaksi kimia) harus dilakukan pada saat waktu operasional.
c. Pemilihan panjang gelombang
Panjamg gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Untuk memilih panjang
gelombang maksimal, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatau larutan baku pada konsentrasi tertentu.
Ada beberapa alasan mengapa harus menggunakan panjang gelombang maksimal, yaitu :
1. Pada panjang gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang maksimal tersebut, perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar.
2. Di sekitar panjang gelombang maksimal, bentuk kurva absorbansi datar dan pada kondisi tersebut hukum Lambert Beer akan terpenuhi.
3. Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil seketika digunakan panjang gelombang maksimal.
d. Pembuatan kurva baku
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi (y) dengan konsentrasi (x). Kurva baku sebaiknya sering diperiksa ulang. Penyimpangan dari garis lurus biasanya dapat disebabkan oleh : (i) kekuatan ion yang tinggi; (ii) perubahan suhu; dan (iii) reaksi ikutan yang terjadi.
e. Pembacaan absorbansi sampel atau cuplikan
Absorban yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,8 atau 15 % sampai 70 % jika dibaca sebagai transmitan. Anjuran ini berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau 0,5 % (kesalahan fotometrik).
http://id.scribd.com/doc/43395375/laporan-TOKSIKOLOGI-DIYAH IV. Alat dan Bahan
1 Alat : a. Spekrofotometer UV-Vis b. Corong gelas c. Kuvet d. Sendok tanduk e. Labu takar 10 mL f. Labu takar 25 mL g. Labu takar 100 mL
h. Batang pengaduk i. Sudip
j. Timbangan
k. Pipet volume 1 mL l. Mortar dan stamper m. Pipet volume 2 mL n. Pipet volume 5 mL o. Pipet volume 10 ml p. Tisuue q. Lap r. Kertas perkamen s. Gelas beaker t. Kertas saring u. Botol vial v. Sudip w. Pipet tetes 2. Bahan : a. Tablet parasetamol 500 mg b. Parasetamol sebuk c. NaOH padat d. Aquadest V. Prosedur Kerja
a. Pembuatan Larutan NaOH 0,1 N
1. Ditimbang sebanyak 2,00 gram NaOH padat 2. Dilarutkan dengan sedikit aquadest bebas CO2. 3. Dimasukkan ke dalam labu ukur 500 mL
4. Ditambahkan aquadest bebas CO2 hingga tanda batas 5. Dikocok hingga larut homogen.
Perhitungan : NaOH Na+ + Cl- M = N X e = 0,1 grek/L X 1 mol/grek = 0,1 mol/L M = n V n = M X V
= 0,1 mol X 1 mol/grek = 0,1 mol n = m Mr m = n X Mr = 0,05 mol X 40 gram/mol = 2 gram
b. Pembuatan Larutan Stok Baku Parasetamol 1. Ditimbang 1,0 mg parasetamol
2. Dimasukkan ke dalam labu ukur 100 ml
3. Ditambahkan larutan NaOH 1 N hingga tanda batas 4. Dikocok hingga homogen
Perhitungan Pengenceran :
1. 10 mg dalam 10 ml NaOh → konsentrasi 1 mg/ml (1000 μg/ml) 2. Untuk mendapatkan dengan kadar 10 μg/ml, maka dilakukan
pengenceran : V1 X M1 = V2 X M2
V1 X 103 μg/ml = 100 ml X 10 μg/ml V1 = 1 ml
Dari larutan dengan kadar 1000 μg/ml dipipet sebanyak 1 ml
kemudian diadd NaOH sampai 100 ml untuk mendapatkan kadar larutan baku 10 μg/ml (0,01 mg/ml).
c. Pengukuran Panjang Gelombang Maksimum Parasetamol
1. Dibuat larutan dari larutan baku dengan konsentrasi yang memberikan absorbansi 0,434
2. Larutan diukur pada panjang gelombang 220 – 300 nm
3. Dibaca absorbansinya dan ditentukan panjang gelombang maksimum yang memberikan absorbansi maksimum.
A = € b c
0,434 = 715. 1. C c = 0,434/715 c = 6,07 x 10-4 % c = 6,07 μg/ml
Untuk mendapatkan larutan dengan konsentrasi 6,07 μg/ml, maka dilakukan perhitungan larutan yang harus dipipet dari larutan stok baku parasetamol 10 μg/ml.
Perhitungan :
V1 X N1 = V2 X N2
V1 X 10 μg/ml = 10 ml X 6,07 μg/ml V1 = 6,07 ml
Sehingga, dari larutan dengan kadar 10 μg/ml dipipet sebanyak 6,07 ml larutan kemudian diadd NaOh sampai 10 ml untuk mendapatkan kadar larutan 6,07 μg/ml. Larutan ini kemudian diukur dari panjang gelombang 220-300 nm. d. Pembuatan Larutan Standar untuk Uji Linieritas
1. Dipipet larutan baku parasetamol 0,01 mg/ml masing-masing 3 ml; 4 ml; 5 ml; 6 ml; 7 ml; 8 ml; 9 ml; 10 ml.
2. Masing-masing dimasukkan ke dalam labu ukur 10 ml 3. Ditambahkan larutan NaOH 0,1 N hingga tanda batas
4. Dikocok hingga homogen dan dipindahkan ke dalam botol vial. Perhitungan :
1. Larutan induk parasetamol 10 μg/ml = 0,01 mg/ml 2. Rentang konsentrasi : Absorbansi minimum = 0,2 A = € b c 0,2 = 715. 1. c c = 0,2 / 715 c = 2,8 μg/ml → 0,0028 mg/ml = 0,003 mg/ml Absorbansi maksimum = 0,8 A = € b c
0,8 = 715. 1. c c = 0,8 / 715
c = 11 μg/ml → 0,011 mg/ml = 0,01 mg/ml Untuk larutan standar 0,003 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,003 mg/ml = 10 ml X 0,01 mg/ml V1 = 3 ml
Untuk larutan standar 0,004 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,004 mg/ml = 10 ml X 0,01 mg/ml V1 = 4 ml
Untuk larutan standar 0,005 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,005 mg/ml = 10 ml X 0,01 mg/ml V1 = 5 ml
Untuk larutan standar 0,006 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,006 mg/ml = 10 ml X 0,01 mg/ml V1 = 6 ml
Untuk larutan standar 0,007 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,007 mg/ml = 10 ml X 0,01 mg/ml V1 = 7 ml
Untuk larutan standar 0,008 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,008 mg/ml = 10 ml X 0,01 mg/ml V1 = 8 ml
Untuk larutan standar 0,009 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,009 mg/ml = 10 ml X 0,01 mg/ml V1 = 9 ml
Untuk larutan standar 0,01 mg/ml maka dipipet : V1 X M1 = V2 X M2
V1 X 0,01 mg/ml = 10 ml X 0,01 mg/ml V1 = 10 ml
e. Membuat Kurva Kalibrasi
1. Masing-masing kurva standar dibaca absorbansinya pada panjang gelombang maksimum
2. Hasil absorbansi tersebut diplot dalam kurva konsentrasi vs absorbansi 3. Dihitung persamaan regresi linier dengan rumus Y = bx + a
f. Ekstraksi Parasetamol dari Tablet
1. Ditimbang dan dilarutkan 3 tablet parasetamol
2. Ditimbang seksama sejumlah serbuk tablet setara dengan lebih kurang 12,5 mg parasetamol
3. Dimasukkan ke dalam labu ukur 25 ml 4. Dilarutkan dengan NaOH sampai tanda batas 5. Dikocok dan disaring dengan kertas saring
6. Dipipet sebanyak 0,2 ml dan dimasukkan ke dalam labu ukur 10 ml
7. Diadd dengan NaOH 0,1 N sampai tanda batas dan dikocok hingga homogen. Perhitungan :
500 mg serbuk ∞ 12,5 ng parasetamol 3 tablet = 500 mg
X 12,5 mg X = 0,041 mg
Ditimbag serbuk parasetamol sebanyak 0,041 mg sebanyak 3 kali. Konsentrasi parasetamol yang dibuat :
V1 X N1 = V2 X N2
0,2 ml X 12,5 mg = 10 ml X N2 25 ml
N2 = 0,01 mg/ml
1. Larutan hasil ekstraksi parasetamol dimasukkan ke dalam kuvet
2. Kemudian dibaca absorbansi dnya pada panjang gelombang maksimum
3. Dimasukkan nilai absorbansinya yang dihasilkan ke dalam persamaan regresi linier sebagai fungsi Y
4. Dihitung konsentrasi parasetamol.
VI. Skema Kerja
1. Pembuatan Larutan NaOH 0,1 N
2. Pembuatan Larutan Stok Baku Parasetamol (10 μg/mL) Ditimbang 2,00 g NaOH padat
Dilarutkan => aquadest
Dimasukkan ke dalam labu takar 500 mL
+ aquadest sampai tanda batas
dikocok hingga homogen
Dibuat larutan dengan kadar 1 mg/ml
Dipipet 1 ml larutan dengan kadar 1 mg/ml
Di add dengan NaOH dalam labu ukur 100 ml sampai tanda batas