35 PROFIL DISOLUSI TABLET IBUPROFEN MENGGUNAKAN VARIASI
DISINTEGRAN SHEFFIELDTM TABLETTING SYSTEM DTHV, SHEFFIELDTM TABLETTING SYSTEM DTFD, DAN AVICEL PH 102
Revika Rachmaniar, Dradjad Priambodo, Maulana Hakim Fakultas Farmasi, Universitas Padjadjaran
Abstrak
Ibuprofen merupakan zat aktif yang memiliki khasiat sebagai analgesik, antipiretik, mengobati gejala rheumatoid arthritis, osteoarthritis, dan dysmenorrhea. Penelitian tentang formulasi tablet ibuprofen bertujuan untuk memperoleh sediaan tablet ibuprofen menggunakan disintegran SheffieldTM Tabletting System DTHV dan DTFD dengan metode kempa langsung yang memenuhi persyaratan Farmakope Indonesia dan United States Pharmacopeia. Tablet ibuprofen dibuat dengan metode kempa langsung menggunakan SheffieldTM Tabletting System DTHV dan DTFD serta Avicel PH 102 sebagai disintegran pembanding dengan variasi konsentrasi masing-masing disintegran sebesar 50%, 55%, dan 60%. Evaluasi tablet meliputi keseragaman bobot, diameter, ketebalan, kekerasan, friabilitas, keseragaman kadar, dan disolusi. Pengujian disolusi in vitro menggunakan alat disolusi tipe II (dayung) dengan medium larutan dapar fosfat (pH 7,2). Hasil pengujian waktu hancur dan disolusi tablet menunjukkan bahwa pada tablet ibuprofen yang menggunakan SheffieldTM Tabletting System DTHV memiliki waktu hancur dan zat aktif terlarut yang memenuhi persyaratan Farmakope Indonesia dan United States Pharmacopeia.
Kata Kunci: Avicel PH 102, Disintegran, SheffieldTM Tabletting System DTFD, SheffieldTM Tabletting System DTHV, Tablet Ibuprofen.
Abstract
Ibuprofen is the active substance which has properties as an analgesic, antipyretic, treat the symptoms of rheumatoid arthritis, osteoarthritis, and dysmenorrhea. Research on ibuprofen tablet formulation has aims to obtain tablets of ibuprofen using SheffieldTM Tabletting System
DTF
D and DTHV by direct compression method that meets the requirements of the Indonesian Pharmacopeia and the United States Pharmacopeia. Ibuprofen tablets prepared by direct compression method using SheffieldTM Tabletting System DTFD and DTHV and Avicel PH 102
as well as the comparison disintegrant with the variation of the concentration. The concentration of each disintegrant are 50%, 55%, and 60%. Evaluation of tablets include weight uniformity, diameter, thickness, hardness, friability, content uniformity and dissolution. In vitro dissolution test using a dissolution type II (paddle) with phosphate buffer solution medium (pH 7.2). Tablet disintegration and dissolution testing results show ibuprofen tablet that use SheffieldTM Tabletting System DTHV has disintegration time and active substance dissolved meet the requirements of the Indonesian Pharmacopeia and the United States Pharmacopeia.
Keyword: Avicel PH 102, Disintegrant, Ibuprofen tablet, SheffieldTM Tabletting System DTFD, SheffieldTM Tabletting System DTHV.
36 PENDAHULUAN
Selama seperempat abad terakhir uji disolusi telah muncul sebagai cara yang berharga untuk pengembangan formulasi, memantau proses manufaktur, menilai kualitas produk, dan dalam beberapa kasus untuk memperkirakan kerja in vivo sediaan oral bentuk padat. Uji disolusi ternyata menjadi uji penting untuk mengukur kerja produk obat (Dressman and Kramer, 2005). Disolusi secara optimal dapat diperoleh apabila tablet dapat hancur menjadi partikel dengan cepat. Secara umum telah dikenal beberapa tahun lalu bahwa sebelum absorpsi terjadi, suatu obat padat harus mengalami disintegrasi ke dalam partikel-partikel kecil dan melepaskan zat aktif (Gibson, 2004). Disintegrasi adalah hilangnya kohesi bentuk sediaan padat karena aksi suatu cairan yang menghasilkan dispersi sediaan tersebut atau isinya menjadi granul agregat (Priambodo, 2007).
Agar suatu tablet dapat mengalami disintegrasi maka dalam komponen tablet harus terdapat zat yang berfungsi sebagai disintegran atau zat penghancur. Penting diketahui bahwa adanya disintegran yang cukup dalam tablet akan menghasilkan disolusi yang ideal. Disintegran ditambahkan untuk memudahkan pecahnya atau hancurnya tablet ketika berkontak dengan cairan saluran pencernaan. Disintegran dapat berfungsi menarik air ke dalam tablet, mengembang, dan menyebabkan tablet pecah menjadi fragmen-fragmen. Fragmen-fragmen tablet
itu sangat menentukan kelarutan obat selanjutnya dan tercapainya bioavaibilitas yang diharapkan (Lachman, et al., 2008).
SheffieldTM Tabletting System DTHV dan DTFD merupakan suatu disintegran yang dirancang untuk pembuatan tablet yang membutuhkan disolusi yang cepat. Disintegran ini diharapkan dapat memperbaiki disintegrasi tablet yang dibuat dengan metode kempa langsung. SheffieldTM Tabletting System DTHV merupakan zat yang memiliki komposisi lactose anhydrate, crospovidone, dan mannitol, sedangkan SheffieldTM Tabletting System DTFD merupakan zat yang memiliki komposisi lactose monohydrate, crospovidone, dan mannitol. Pada penelitian ini dibuat tablet ibuprofen dengan metode kempa langsung menggunakan disintegran SheffieldTM Tabletting System DTHV dan DTFD serta Avicel PH 102 sebagai disintegran pembanding.
METODOLOGI Alat
Pengayak; timbangan analitis (mettler toledo); mesin tablet single punch (Korsch); alat ukur kecepatan aliran dan sudut istirahat; Alat uji susut pengeringan; hardness tester (Erweka); friabilator; disintegrator; alat disolusi tipe II (Sotax); pH meter; spektrofotometer UV (Analytic Jena); stopwatch; jangka sorong; penangas air; mortir dan stamper serta alat-alat gelas yang biasa digunakan dalam laboratorium.
37 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah Ibuprofen (Holi Pharma), Laktosa (Brataco chemistry), Magnesium Stearat (Brataco chemistry), SheffieldTM Tabletting System DTHV (Lawsim Zecha), SheffieldTM Tabletting System DTFD (Lawsim Zecha), Avicel PH 102 (Holi Pharma), Kalium dihidrogen fosfat (Quadran Lab), Natrium hidroksida (Brataco chemistry), dan Aquadest.
Metode
1. Penyiapan Bahan Baku
Penyiapan zat aktif berdasarkan literatur Farmakope Indonesia. Penyiapan zat tambahan berdasarkan literatur Handbook of Pharmaceutical Excipient. 2. Formulasi Tablet
Pada penelitian ini dibuat sembilan formulasi tablet ibuprofen, yaitu tablet ibuprofen dengan variasi konsentrasi Avicel PH 102, SheffieldTM Tabletting System DTFD, dan SheffieldTM Tabletting System DTHV.
Tabel 1. Formula Tablet Ibuprofen
Komposisi Formula (%) Avicel PH 102 Sheffield TM Tabletting System DTHV SheffieldTM Tabletting System DTFD 50% 55% 60% 50% 55% 60% 50% 55% 60% Ibuprofen 38.46 38.46 38.46 38.46 38.46 38.46 38.46 38.46 38.46 Laktosa 10.54 5.54 0.54 10.54 5.54 0.54 10.54 5.54 0.54 Magnesium stearat 1 1 1 1 1 1 1 1 1 Avicel PH 102 50 55 60 - - - - SheffieldTM Tableting System DTHV - - - 50 55 60 - - - SheffieldTM Tableting System DTFD - - - 50 55 60 3. Pembuatan Tablet
Tablet dibuat menggunakan metode kempa langsung. Bahan-bahan diayak dan ditimbang sesuai yang diperlukan. Ibuprofen ditambahkan disintegran yang akan dipakai, dicampur hingga homogen selama 15 menit lalu ditambahkan magnesium stearat, dicampur hingga homogen selama 5 menit. Massa kempa kemudian dikempa.
4. Evaluasi Massa Cetak a. Susut Pengeringan
Susut pengeringan adalah banyaknya bagian zat yang mudah menguap, termasuk air, ditetapkan dengan cara pengeringan, kecuali dinyatakan lain, dilakukan pada suhu 105o hingga bobot tetap (Depkes, 1979)
b. Laju Alir dan Sudut Istirahat
Massa kempa diletakkan dalam corong alat uji laju alir yang bagian bawahnya ditutup. Massa kempa yang
38 keluar dari alat tersebut dihitung laju
alirannya dengan menghitung waktu yang diperlukan oleh sejumlah serbuk untuk turun melalui corong alat penguji dengan menggunakan stopwatch. Penghitungan
dimulai pada saat tutup bagian bawah corong dibuka hingga semua massa kempa mengalir keluar dari alat. Hubungan antara laju aliran dengan sifat aliran serbuk dapat dilihat pada Tabel 2. (Aulton, 2002).
Tabel 2. Laju Alir dan Sifat Aliran Serbuk (Aulton, 2002)
Laju Alir (g/detik) Sifat Aliran
>10 Sangat Baik
4-10 Baik
1.6-4 Sukar
<1.6 Sangat Sukar
Timbunan Massa Kempa dapat digunakan untuk menghitung sudut istirahat. Diameter rata-rata timbunan dan tinggi puncak timbunan diukur. Hubungan
antara sudut istirahat dengan sifat aliran serbuk dapat dilihat di Tabel 3 (Aulton, 2002).
Tabel 3. Sudut Istirahat dan Sifat Aliran (Aulton, 2002)
Sudut Istirahat (o) Sifat Aliran
<20 Sangat Baik
20-30 Baik
30-34 Cukup
>40 Sangat Sukar
c. Kerapatan Nyata, Kerapatan Mampat, dan Kompresibilitas
Kerapatan nyata ditetapkan dengan menempatkan sejumlah tertentu massa cetak ke dalam gelas ukur lalu diukur volumenya dan dihitung kerapatannya dengan rumus (Aulton, 2002):
(g/mL)
Kerapatan nyata ditetapkan seperti pada kerapatan nyata, tetapi volume serbuk dimampatkan dengan cara mengetukkan gelas ukur tersebut dengan kecepatan satu
ketukan setiap detik sampai volume serbuk konstan, lalu dihitung dengan rumus (Aulton, 2002):
(g/mL)
Daya kempa dapat dilihat dari harga indeks kompresbilitas Carr yang sangat bergantung pada kerapatan nyata dan kerapatan mampat. Hubungan antara indeks kompresibilitas Carr dengan sifat aliran serbuk dapat dilihat pada tabel 4.
39 Tabel 4. Hubungan antara Sifat Aliran Serbuk dengan Kompresibilitas (Aulton, 2002)
Kompresibilitas (%) Sifat Aliran Serbuk
5 – 12 Sangat Baik
12 – 18 Baik
18 – 23 Cukup
23 – 28 Buruk
28 – 35 Sangat Buruk
> 38 Sangat buruk sekali
5. Evaluasi Tablet a. Keseragaman Ukuran
Kecuali dinyatakan lain, diameter tablet tidak lebih dari tiga kali dan tidak kurang dari empat per tiga tebal tablet (Depkes, 1979). Pemeriksaan dilakukan dengan menggunakan dua puluh tablet. Pemeriksaan dilakukan terhadap diameter dan tebal masing-masing tablet. Kemudian rata-rata diameter dan tebal tablet dihitung.
b. Keseragaman Bobot
Tablet tidak bersalut harus memenuhi syarat keseragaman bobot yang ditetapkan sebagai berikut : ditimbang 20 tablet, hitung bobot rata-rata tiap tablet. Jika ditimbang
satu persatu, tidak boleh lebih dari 2 tablet yang masing-masing bobotnya menyimpang dari bobot rata-rata lebih besar dari harga yang ditetapkan kolom A, dan tidak satu tablet pun yang bobotnya menyimpang dari bobot rata-ratanya lebih dari harga yang ditetapkan kolom B. Jika tidak cukup 20 tablet, dapat digunakan 10 tablet; tidak satu tablet pun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan kolom A dan tidak satu tablet pun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan kolom B (Depkes, 1979). Penyimpangan bobot rata-rata tablet dapat dilihat pada Tabel 5.
Tabel 5. Penyimpangan bobot rata-rata tablet (Depkes, 1979)
Bobot Rata-Rata (mg) Penyimpangan bobot rata-rata (%)
A B <25 15 30 26-150 10 20 151-300 7.5 15 >300 5 10 c. Kekerasan Tablet
Sebanyak dua puluh tablet diambil secara acak dan diukur kekerasannya menggunakan alat uji kekererasan (Hardness tester) kemudian dihitung rata-ratanya (Aulton, 2002).
d. Friabilitas Tablet
Alat penguji friabilitas untuk laboratorium dikenal sebagai friabilator Roche. Alat ini memperlakukan sejumlah tablet terhadap gabungan pengaruh goresan dan guncangan dengan memakai sejenis kotak plastik yang berputar pada kecepatan
40 25±1 rpm. Biasanya tablet yang telah
ditimbang diletakkan di dalam alat itu, kemudian dijalankan sebanyak 100 putaran. Tablet kemudian dibersihkan dan ditimbang ulang. Kehilangan bobot yang diizinkan 1.0% (USP 30, 2007). Tablet yang masih utuh ditimbang kemudian dihitung kehilangan bobotnya dan dinyatakan dalam presentase menggunakan rumus sebagai berikut:
x 100% Keterangan:
W1 = berat tablet awal
W2 = berat tablet setelah uji kerapuhan
e. Uji Waktu Hancur
Dimasukkan satu tablet pada masing-masing tabung dari keranjang kemudian dimasukkan suatu cakram pada tiap tabung dan jalankan alat, digunakan air bersuhu 37oC ± 2oC sebagai media kecuali dinyatakan menggunakan cairan lain dalam masing-masing monografi. Pada akhir batas waktu seperti yang tertera dalam monografi, keranjang diangkat dan semua tablet diamati. Semua tablet harus hancur sempurna. Bila 1 tablet atau 2 tablet tidak hancur sempurna, diulangi pengujian dengan 12 tablet lainnya : tidak kurang 16 dari 18 tablet yang diuji harus hancur sempurna (Depkes, 1995).
f. Keseragaman Kadar
Sepuluh tablet diambil secara acak, dihaluskan, dan dilarutkan pada dapar
fosfat pH 7.2. Larutan ditetapkan kadarnya menggunakan alat spektrofotometer UV. Kecuali dinyatakan lain, tablet memenuhi syarat keseragaman kadar jika sepuluh tablet yang diperiksa masing-masing memberikan batas kadar antara 90%-110% dari persyaratan rata-rata yang tertera pada uraian masing-masing monografi. Jika hanya satu tablet yang memberikan hasil di luar batas, dilakukan penetapan menggunakan 20 tablet sisa satu per satu. Tablet memenuhi persyaratan keseragaman kadar jika hanya satu tablet dari 30 tablet di atas memberikan hasil di luar batas 90%-110% (Depkes, 1995).
g. Uji Disolusi o Alat disolusi
Alat terdiri dari sebuah wadah tertutup yang terbuat dari kaca atau bahan transparan lain yang inert, suatu motor, suatu batang logam yang digerakan sebuah motor dan sebuah dayung yang terdiri dari daun dan batang sebagai pengaduk. Dayung memenuhi spesifikasi jarak 25 mm ± 2 mm antara daun dan bagian dalam wadah dipertahankan selama pengujian berlangsung. Sediaan dibiarkan tenggelam ke dasar wadah sebelum dayung mulai berputar (Depkes, 1995)
o Media Disolusi
Media disolusi yang digunakan dapar fosfat pH 7.2. Dapar ini dibuat dengan mencampurkan 50 ml kalium
41 fosfat monobasa 0.2M dengan 34.7
ml natrium hidroksida 0.2M dan diencerkan dengan air hingga 200 ml (USP 30, 2007).
o Disolusi tablet
Ke dalam bejana disolusi dimasukkan medium disolusi sebanyak 900 ml kemudian dipanaskan hingga suhu 37o±0.5°C. Tablet ibuprofen dimasukkan ke dalam bejana disolusi kemudian diputar dengan kecepatan 50 rpm. Sampel diambil sebanyak 5 ml pada selang waktu 5, 10, 15, 20, 30, 45, dan 60 menit. Setiap sampel yang diambil lalu digantikan dengan medium disolusi sebanyak 5 ml. Sampel yang diambil diukur absorbansinya dan ditentukan kadarnya (USP 30, 2007)
o Penetapan kadar
Penetapan kadar ibuprofen yang terlarut dengan menggunakan spektrofotometri ultraviolet pada panjang gelombang maksimum sekitar 221 nm. Dalam waktu 60 menit harus larut tidak kurang 80% C13H18O2 dari jumlah yang tertera (USP 30, 2007).
6. Analisis Data
Analisis data uji disolusi digunakan metode desain blok acak sempurna (DBAS) dengan kepercayaan 95% di mana digunakan blok dan kelompok. Pada analisis ini perlakuan waktu bertindak sebagai blok dan variasi disintegran sebagai kelompok. Uji lanjut menggunakan uji rentang Newman-Keuls.
HASIL DAN PEMBAHASAN 1. Penyiapan Bahan Baku
Penyiapan zat aktif ibuprofen berdasarkan literatur Farmakope Indonesia. Pemeriksaan zat tambahan seperti Avicel PH 102, laktosa, magnesium stearat berdasarkan literatur Handbook of Pharmaceutical Excipient. Pemeriksaan DTHV dan DTFD berdasarkan Certificate of analysis.
2. Formulasi Tablet
Pada penelitian ini telah dibuat sembilan formula tablet ibuprofen dengan menggunakan tiga jenis disintegran, yaitu SheffieldTM Tabletting System DTHV dan DTFD serta Avicel PH 102 sebagai disintegran pembanding. Formula uji disajikan dalam tabel 6.
42 Tabel 6. Formula Tablet
Komposisi Formula (mg)
Avicel PH 102 SheffieldTM Tabletting System DTHV SheffieldTM Tabletting System DTFD 50% 55% 60% 50% 55% 60% 50% 55% 60% Ibuprofen 250 250 250 250 250 250 250 250 250 Laktosa 68.5 36 3.5 68.5 36 3.5 68.5 36 3.5 Magnesium stearat 6.5 6.5 6.5 6.5 6.5 6.5 6.5 6.5 6.5 Avicel PH 102 325 357.5 390 - - - - SheffieldTM Tabletting System DTHV - - - 325 357.5 390 - - - SheffieldTM Tabletting System DTFD - - - 325 357.5 390
Total bobot tablet 650 650 650 650 650 650 650 650 650
3. Pembuatan Tablet
Pada formula ini, massa kempa dibuat dengan mencampur zat aktif, disintegran, dan pengisi selama 15 menit agar massa kempa menjadi homogen. Pelincir lalu ditambahkan ke dalam massa kempa dan kembali dicampur selama 5 menit agar pelincir dapat menyelimuti seluruh permukaan partikel dalam massa
kempa. Bobot tablet yang diproduksi adalah 650 mg dan jumlah tablet yang diproduksi adalah 200 tablet.
4. Evaluasi Massa Kempa
Evaluasi massa kempa dilakukan sebelum proses pencetakan tablet.
a. Susut Pengeringan
Tabel 7. Hasil Uji Susut Pengeringan
% Susut Pengeringan (%)
Avicel PH 102 DTHV DTFD
50 1.4109 0.7019 0.2191
55 1.6484 0.3974 0.2672
60 1.6743 0.5534 0.4296
Gambar 1. Hasil Uji Susut Pengeringan Hasil uji susut pengeringan, Massa kempa yang menggunakan Avicel PH 102
menunjukan susut pengeringan 1-2%. Berdasarkan hasil uji susut pengeringan, diharapkan massa kempa tersebut tidak terlalu basah dan tidak terlalu kering sehingga massa kempa dapat dikempa. Massa kempa yang menggunakan DTHV dan DTFD menunjukan susut pengeringan kurang dari 1%.
43 b. Laju alir dan Sudut istirahat
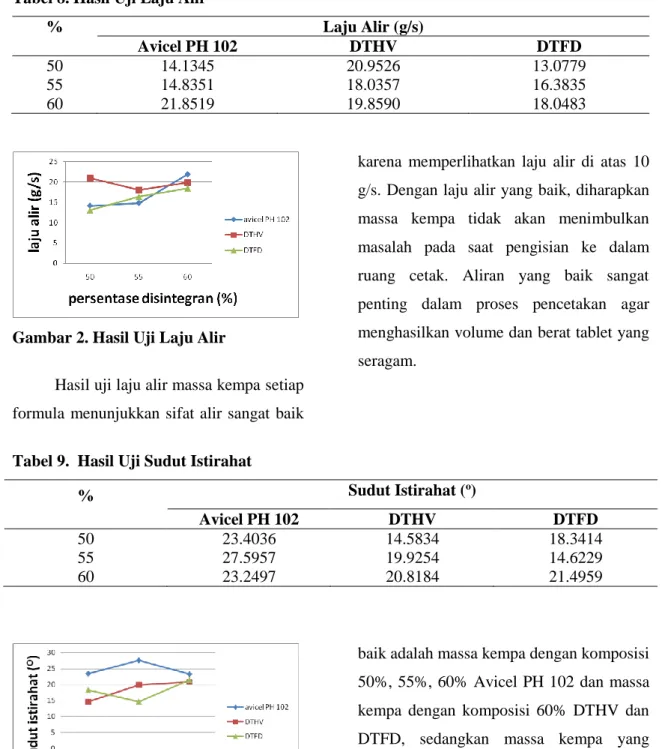
Tabel 8. Hasil Uji Laju Alir
% Laju Alir (g/s)
Avicel PH 102 DTHV DTFD
50 14.1345 20.9526 13.0779
55 14.8351 18.0357 16.3835
60 21.8519 19.8590 18.0483
Gambar 2. Hasil Uji Laju Alir
Hasil uji laju alir massa kempa setiap formula menunjukkan sifat alir sangat baik
karena memperlihatkan laju alir di atas 10 g/s. Dengan laju alir yang baik, diharapkan massa kempa tidak akan menimbulkan masalah pada saat pengisian ke dalam ruang cetak. Aliran yang baik sangat penting dalam proses pencetakan agar menghasilkan volume dan berat tablet yang seragam.
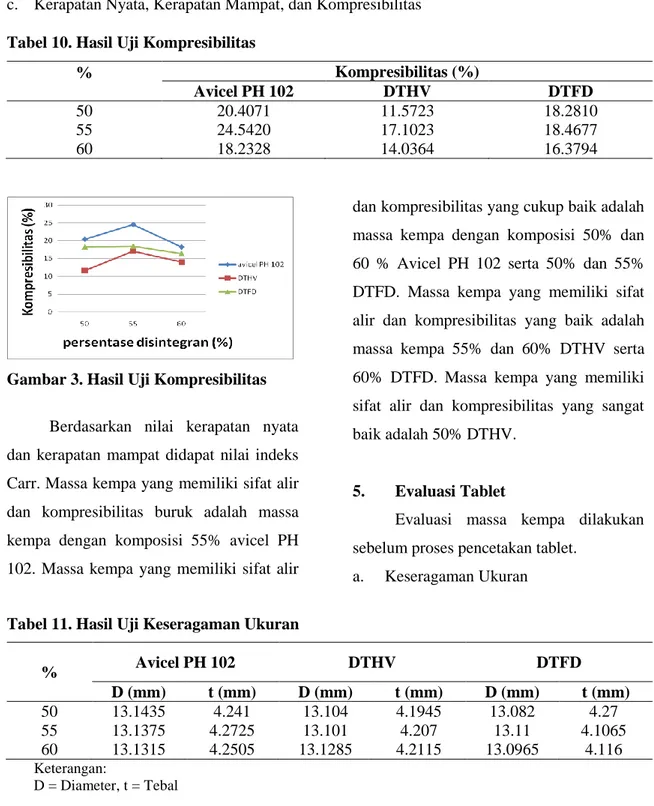
Tabel 9. Hasil Uji Sudut Istirahat
% Sudut Istirahat (o)
Avicel PH 102 DTHV DTFD
50 23.4036 14.5834 18.3414
55 27.5957 19.9254 14.6229
60 23.2497 20.8184 21.4959
Gambar 2. Hasil Uji Sudut Istirahat Berdasarkan hasil uji sudut istirahat, massa kempa yang memiliki sifat alir yang
baik adalah massa kempa dengan komposisi 50%, 55%, 60% Avicel PH 102 dan massa kempa dengan komposisi 60% DTHV dan DTFD, sedangkan massa kempa yang memiliki sifat alir yang sangat baik adalah massa kempa dengan komposisi komposisi 50% dan 55% DTHV dan DTFD.
44 c. Kerapatan Nyata, Kerapatan Mampat, dan Kompresibilitas
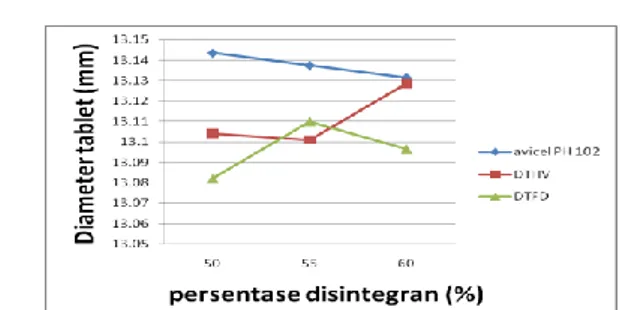
Tabel 10. Hasil Uji Kompresibilitas
% Kompresibilitas (%)
Avicel PH 102 DTHV DTFD
50 20.4071 11.5723 18.2810
55 24.5420 17.1023 18.4677
60 18.2328 14.0364 16.3794
Gambar 3. Hasil Uji Kompresibilitas Berdasarkan nilai kerapatan nyata dan kerapatan mampat didapat nilai indeks Carr. Massa kempa yang memiliki sifat alir dan kompresibilitas buruk adalah massa kempa dengan komposisi 55% avicel PH 102. Massa kempa yang memiliki sifat alir
dan kompresibilitas yang cukup baik adalah massa kempa dengan komposisi 50% dan 60 % Avicel PH 102 serta 50% dan 55% DTFD. Massa kempa yang memiliki sifat alir dan kompresibilitas yang baik adalah massa kempa 55% dan 60% DTHV serta 60% DTFD. Massa kempa yang memiliki sifat alir dan kompresibilitas yang sangat baik adalah 50% DTHV.
5. Evaluasi Tablet
Evaluasi massa kempa dilakukan sebelum proses pencetakan tablet.
a. Keseragaman Ukuran
Tabel 11. Hasil Uji Keseragaman Ukuran
% Avicel PH 102 DTHV DTFD D (mm) t (mm) D (mm) t (mm) D (mm) t (mm) 50 13.1435 4.241 13.104 4.1945 13.082 4.27 55 13.1375 4.2725 13.101 4.207 13.11 4.1065 60 13.1315 4.2505 13.1285 4.2115 13.0965 4.116 Keterangan: D = Diameter, t = Tebal
45 Gambar 4. Hasil Uji Keseragaman
Diameter
Gambar 5. Hasil Uji Keseragaman Tebal
Pemeriksaan keseragaman ukuran tablet setiap formula memiliki ukuran diameter tiga kali ukuran tebal. Pada Farmakope Indonesia edisi III disebutkan bahwa diameter tidak lebih dari tiga kali dan tidak kurang dari 4/3 tebal tablet.
b. Keseragaman Bobot
Tabel 12. Hasil Uji Keseragaman Bobot
% Keseragaman Bobot (mg)
Avicel PH 102 DTHV DTFD
50 661.345 660.325 667
55 654.17 667.92 656.375
60 662.285 661.955 637.88
Gambar 6. Hasil Uji Keseragaman Bobot
Hasil uji keseragaman bobot tablet dari setiap formula tablet menunjukan bahwa bobot tablet ini memenuhi rentang bobot rata-rata tablet antara 617.5 mg sampai dengan 682.5 mg.
46 c. Kekerasan
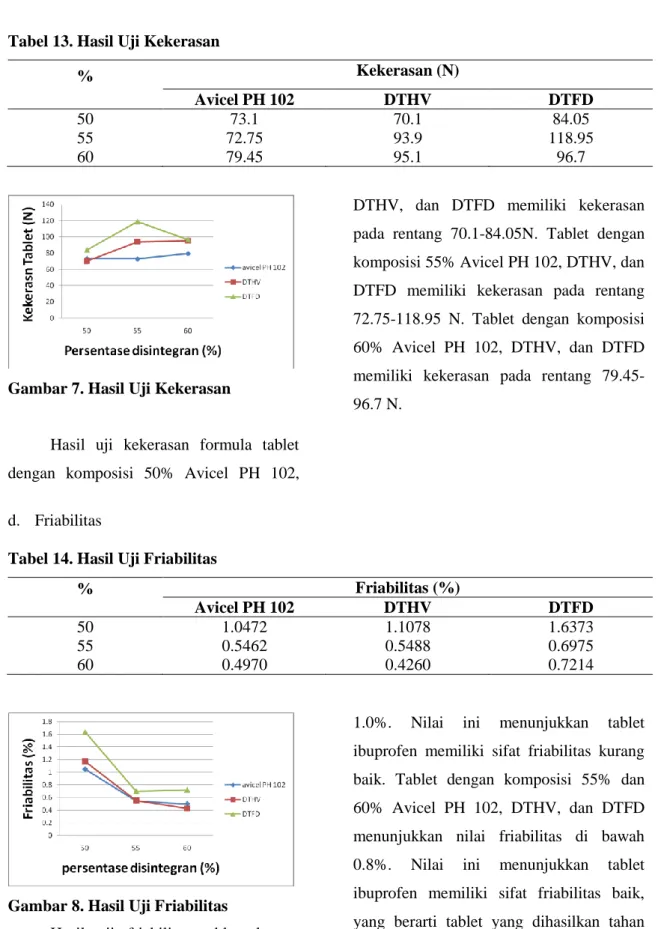
Tabel 13. Hasil Uji Kekerasan
% Kekerasan (N)
Avicel PH 102 DTHV DTFD
50 73.1 70.1 84.05
55 72.75 93.9 118.95
60 79.45 95.1 96.7
Gambar 7. Hasil Uji Kekerasan
Hasil uji kekerasan formula tablet dengan komposisi 50% Avicel PH 102,
DTHV, dan DTFD memiliki kekerasan pada rentang 70.1-84.05N. Tablet dengan komposisi 55% Avicel PH 102, DTHV, dan DTFD memiliki kekerasan pada rentang 72.75-118.95 N. Tablet dengan komposisi 60% Avicel PH 102, DTHV, dan DTFD memiliki kekerasan pada rentang 79.45-96.7 N.
d. Friabilitas
Tabel 14. Hasil Uji Friabilitas
% Friabilitas (%)
Avicel PH 102 DTHV DTFD
50 1.0472 1.1078 1.6373
55 0.5462 0.5488 0.6975
60 0.4970 0.4260 0.7214
Gambar 8. Hasil Uji Friabilitas
Hasil uji friabilitas tablet dengan komposisi 50% Avicel PH 102, DTHV, dan DTFD menunjukkan nilai friabilitas di atas
1.0%. Nilai ini menunjukkan tablet ibuprofen memiliki sifat friabilitas kurang baik. Tablet dengan komposisi 55% dan 60% Avicel PH 102, DTHV, dan DTFD menunjukkan nilai friabilitas di bawah 0.8%. Nilai ini menunjukkan tablet ibuprofen memiliki sifat friabilitas baik, yang berarti tablet yang dihasilkan tahan terhadap guncangan atau kerusakan dalam penanganan, pengemasan dan distribusi.
47 e. Waktu Hancur
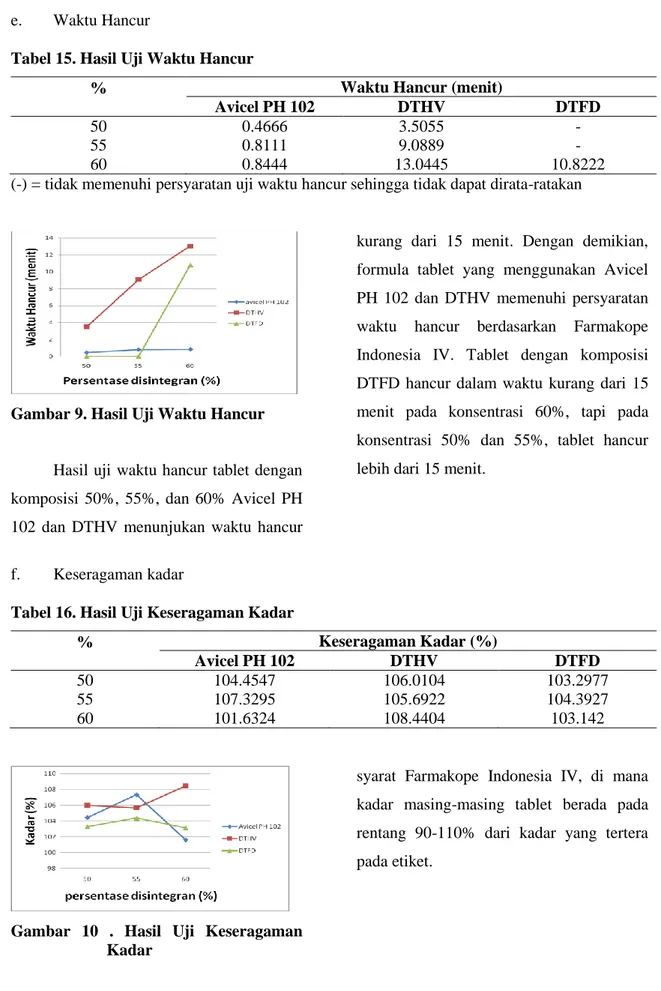
Tabel 15. Hasil Uji Waktu Hancur
% Waktu Hancur (menit)
Avicel PH 102 DTHV DTFD
50 0.4666 3.5055 -
55 0.8111 9.0889 -
60 0.8444 13.0445 10.8222
(-) = tidak memenuhi persyaratan uji waktu hancur sehingga tidak dapat dirata-ratakan
Gambar 9. Hasil Uji Waktu Hancur
Hasil uji waktu hancur tablet dengan komposisi 50%, 55%, dan 60% Avicel PH 102 dan DTHV menunjukan waktu hancur
kurang dari 15 menit. Dengan demikian, formula tablet yang menggunakan Avicel PH 102 dan DTHV memenuhi persyaratan waktu hancur berdasarkan Farmakope Indonesia IV. Tablet dengan komposisi DTFD hancur dalam waktu kurang dari 15 menit pada konsentrasi 60%, tapi pada konsentrasi 50% dan 55%, tablet hancur lebih dari 15 menit.
f. Keseragaman kadar
Tabel 16. Hasil Uji Keseragaman Kadar
% Keseragaman Kadar (%)
Avicel PH 102 DTHV DTFD
50 104.4547 106.0104 103.2977
55 107.3295 105.6922 104.3927
60 101.6324 108.4404 103.142
Gambar 10 . Hasil Uji Keseragaman Kadar
Nilai keseragaman kadar dari kesembilan formula tersebut memenuhi
syarat Farmakope Indonesia IV, di mana kadar masing-masing tablet berada pada rentang 90-110% dari kadar yang tertera pada etiket.
48 g. Uji Disolusi
Uji disolusi dilakukan terhadap tiga tablet pada masing-masing formula, yaitu semua formula dengan komposisi Avicel PH 102, semua formula dengan komposisi DTHV, dan formula dengan komposisi
60% DTFD. Hal ini disebabkan tablet dengan formula 50% dan 55% DTFD tidak memenuhi persyaratan uji waktu hancur. Hasil uji disolusi rata-rata dari tablet ibuprofen dapat dilihat pada tabel 17.
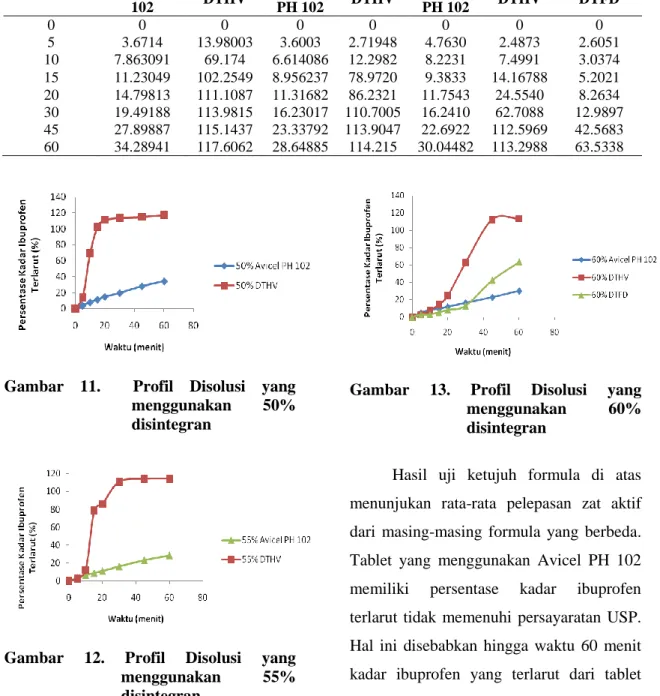
Tabel 17. Hasil Disolusi Tablet
Menit Ke- 50% 55% 60% Avicel PH 102 DTHV Avicel PH 102 DTHV Avicel PH 102 DTHV DTFD 0 0 0 0 0 0 0 0 5 3.6714 13.98003 3.6003 2.71948 4.7630 2.4873 2.6051 10 7.863091 69.174 6.614086 12.2982 8.2231 7.4991 3.0374 15 11.23049 102.2549 8.956237 78.9720 9.3833 14.16788 5.2021 20 14.79813 111.1087 11.31682 86.2321 11.7543 24.5540 8.2634 30 19.49188 113.9815 16.23017 110.7005 16.2410 62.7088 12.9897 45 27.89887 115.1437 23.33792 113.9047 22.6922 112.5969 42.5683 60 34.28941 117.6062 28.64885 114.215 30.04482 113.2988 63.5338
Gambar 11. Profil Disolusi yang menggunakan 50% disintegran
Gambar 12. Profil Disolusi yang
menggunakan 55%
disintegran
Gambar 13. Profil Disolusi yang
menggunakan 60%
disintegran
Hasil uji ketujuh formula di atas menunjukan rata-rata pelepasan zat aktif dari masing-masing formula yang berbeda. Tablet yang menggunakan Avicel PH 102 memiliki persentase kadar ibuprofen terlarut tidak memenuhi persayaratan USP. Hal ini disebabkan hingga waktu 60 menit kadar ibuprofen yang terlarut dari tablet yang menggunakan Avicel PH 102 tidak mencapai 80%. Tablet dengan komposisi
49 DTHV memiliki persentase kadar ibuprofen
terlarut yang memenuhi persyaratan USP yaitu bahwa dalam 60 menit ibuprofen yang terlarut minimal 80%. Tablet yang menggunakan DTFD memiliki persentase kadar ibuprofen terlarut tidak memenuhi persyaratan USP.
Perbedaan persentase kadar ibuprofen terlarut antara tablet dengan komposisi DTHV dan DTFD disebabkan oleh laktosa yang terkandung DTHV dan DTFD berbeda. laktosa yang terkandung DTHV adalah laktosa anhidrat, sedangkan laktosa yang terkandung dalam DTFD adalah laktosa monohidrat. Kedua laktosa ini mempengaruhi crospovidon yang berfungsi sebagai disintegran. Laktosa anhidrat lebih mudah terlarut dalam dapar dibandingkan dengan laktosa monohidrat sehingga membantu tablet terlarut lebih cepat dan menyebabkan ibuprofen terlarut lebih cepat pula. Kadar Ibuprofen pada tablet yang mengandung DTHV terlarut lebih besar daripada kadar ibuprofen yang telah ditetapkan pada keseragaman kadar. Hal ini disebabkan cara pengambilan sampel disolusi secara manual sehingga sampel yang diambil kurang tepat.
6. Analisis Data
Analisis data uji disolusi digunakan metode desain blok acak sempurna (DBAS) dengan α = 0,05 di mana digunakan blok dan kelompok. Pada analisis ini perlakuan waktu bertindak sebagai blok dan variasi disintegran sebagai kelompok.
Tablet dengan komposisi Avicel PH 102, DTHV, dan DTFD berbagai variasi konsentrasi yang digunakan untuk uji disolusi menunjukan F hitung lebih besar dari F tabel berdasarkan tabel anava. Hal ini menunjukan bahwa hipotesis nol, yaitu tidak terdapat perbedaan ibuprofen terlarut yang signifikan di antara formula yang menggunakan berbagai variasi disintegran, ditolak. Dengan derajat kepercayaan 95% dapat disimpulkan bahwa terdapat perbedaan ibuprofen terlarut yang signifikan dari ketiga formula tablet ini selama selang waktu pengambilan 60 menit.
Pengujian dilanjutkan menggunakan uji Rentang Newman-Keuls untuk melihat perbedaan ibuprofen terlarut dari ketujuh formula. Dari hasil uji tersebut, dapat disimpulkan dengan perlakuan disintegran yang berbeda terdapat perbedaan ibuprofen terlarut yang signifikan. Terdapat perbedaan signifikan antara formula yang menggunakan Avicel PH 102 terhadap formula yang menggunakan DTHV pada konsentrasi 50%, 55%, dan 60%. Terdapat perbedaan signifikan pula antara formula yang menggunakan DTHV dengan formula yang menggunakan DTFD pada konsentrasi 60%. Namun, tidak terdapat perbedaan yang signifikan antara formula yang menggunakan Avicel PH 102 dengan formula yang menggunakan DTFD pada konsentrasi 60%.
50 SIMPULAN
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa SheffieldTM Tabletting System DTHV dapat dijadikan alternatif disintegran dalam pembuatan tablet ibuprofen secara kempa langsung. Hasil evaluasi uji waktu hancur, tablet dengan komposisi SheffieldTM Tabletting System DTHV memiliki waktu hancur yang memenuhi persyaratan Farmakope Indonesia, yaitu waktu hancur kurang dari 15 menit.. SheffieldTM Tabletting System DTHV memiliki efektifitas lebih baik dibandingkan Avicel PH 102 dan SheffieldTM Tabletting System DTFD dalam pembuatan tablet ibuprofen secara kempa langsung. Hasil evaluasi uji disolusi, Ibuprofen yang terlarut pada tablet dengan komposisi SheffieldTM Tabletting System DTHV memenuhi persyaratan United States of Pharmacopeia, karena pada menit ke-60 telah terlarut lebih dari 80%.
DAFTAR PUSTAKA
Aulton, M.E. 2002. Pharmaceutics: The Science of Dosage Form Design. New York: Longmann Group Churchill Livingstone. P. 133, 134, 207, 411, 418-419, 612-614.
Departemen Kesehatan Republik Indonesia. 1979. Farmakope Indonesia. Edisi III. Jakarta : Departemen Kesehatan Republik Indonesia. Hal. 4.
Departemen Kesehatan Republik Indonesia. 1995. Farmakope Indonesia. Edisi
IV. Jakarta : Departemen Kesehatan Republik Indonesia. Hal. 6, 7, 449, 488, 999, 1085, 1086.
Dressman, J and J. Kramer. 2005. Pharmaceutical Dissolution Testing. Boca Raton : Taylor and Francis Grpoup. P. 81-82.
Gibson, M. 2004. Pharmaceutical Preformulation and Formulation. Florida : CRC Press. P. 417-418, 420-421, 424.
Priambodo, D. 2007. Buku Ajar Farmasetika Komponen Pembentuk Tablet. Bandung : Universitas Padjadjaran. Hal. 29.
Lachman, L., H.A. Lieberman dan J.L. Kanig. 2008. Teori dan Praktek Farmasi Industri. Edisi II. Penerjemah : Siti Suyatmi. Jakarta : Universitas Indonesia Press. Hal : 645-663, 680-712.
United States Pharmacopeial Convetion. 2007. The United States Pharmacopeia 30. Twinbrook Parkway MD: United States Pharmacopeial Convention, Inc. P. 674, 1085, 2327.