HASIL DAN PEMBAHASAN
Karakterisasi Serum Kuda Anti Rabies
Serum kuda anti rabies berbentuk cairan tak berwarna dalam kemasan utuh dengan nomor bacth RSM 013, diproduksi tanggal 18 Maret 2003. Waktu daluwarsa produk selama dua tahun. Kemasan dalam bentuk vial 10 ml, disimpan pada suhu 2 – 8 oC.
Reidentifikasi SAR
Reidentifikasi SAR (Ab1) dengan uji imunodifusi Agar Gel Presipitation
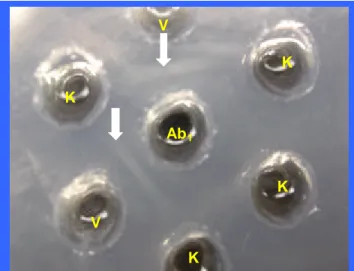
Test (AGPT) menunjukkan reaksi positif dengan vaksin rabies, ditunjukkan dengan terbentuknya garis presipitasi (Gambar 6). Hal ini berarti bahwa terjadi reaksi serologi yang homolog antara Ab1 dengan vaksin virus rabies karena Ab1
merupakan antibodi spesifik terhadap virus rabies.
Gambar 6. Garis presipitasi (tanda panah) pada uji imunodifusi (AGPT) menunjukkan adanya reaksi homolog antara serum anti rabies (Ab1) dengan vaksin rabies (V).
Pemotongan Imunoglobulin Kuda Anti Rabies
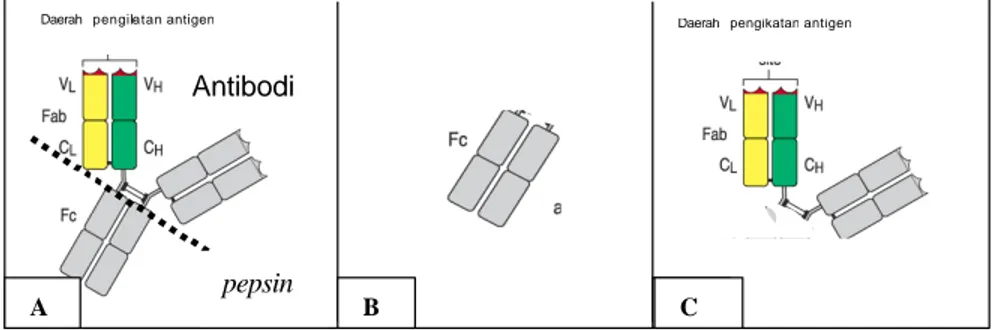
Hasil pemotongan imunoglobulin dengan enzim pepsin, diperoleh fragmen Fc dan F(Ab)2, seperti yang terlihat pada skema Gambar 7. Fragmen F(Ab)2
V K K Ab1 K V K
selanjutnya disebut dengan antibodi 1 (Ab1), digunakan untuk mengimunisasi
ayam dalam produksi antibodi anti-idiotipe (Ab2).
Gambar 7. Skema pemotongan imunoglobulin (A) dengan enzim pepsin, menghasilkan fragmen Fc (B) dan fragmen F(Ab)2 (C).
Penggunaan fragmen F(Ab)2 dari antibodi sebagai Ab1 dapat
meningkatkan spesifisitas dan mengurangi heterogenitas antibodi yang akan terbentuk dari hasil imunisasi menggunakan Ab1 sebagai antigen. Adanya satu
antigen dalam campuran antigen dapat menghilangkan respon imun terhadap antigen yang lain secara jelas. Hal ini juga terjadi pada epitop dalam satu molekul; misalnya respon terhadap epitop pada imunisasi dengan fragmen Fab IgG menunjukkan respon yang lebih besar dibandingkan imunisasi dengan IgG yang disebabkan sifat menghambat bagian Fc. Mekanisme dari efek ini merupakan hasil persaingan antara peptida antigen yang telah diproses untuk berikatan dengan lekuk MHC. Kemampuan ini tergantung pada perbedaan kesempatan untuk bertemu dengan protease pada saat molekul membuka, dan ada atau tidak adanya susunan asam amino tertentu untuk memecahnya dan menghasilkan peptide dalam jumlah besar dengan afinitas yang relatif tinggi untuk lekuk MHC. Kemungkinan bahwa antigen tertentu dalam campuran atau epitop tertentu dari antigen tertentu, dapat menghambat respon imun yang bersifat protektif (Roitt 2003).
Segre et al. (1992) menyatakan, bahwa afinitas dan heterogenitas dari antibodi idiotipe berpengaruh terhadap afinitas dan heterogenitas antibodi anti- idiotipe yang dihasilkan pada mencit yang sama. Hal ini menunjukkan, bahwa antibodi idiotipe dan antibodi anti- idiotipe saling mempengaruhi satu sama lain secara mutualisme melalui efek imunoregulasi internal.
pepsin
A B C
Daerahpengikatanantigen
Antibodi
Uji Potensi SAR (Ab1)
Pengenceran yang digunakan pada serum uji (SAR) dan serum referensi adalah pengenceran 10-2,9, 10-3,2, 10-3,5, 10-3,8 dan 10-4,1. Masing-masing serum enceran dinetralisasi dengan 31,6-316 LD50/0,03 ml Virus Rabies Standar (CVS).
Data hasil uji potensi SAR dan Serum Referensi pada uji netralisasi menggunakan hewan percobaan mencit disajikan pada Tabel 1 dan 2. Nilai Efective Dose (ED)50
Serum Rabies Uji-CVS, Serum Referensi Rabies -CVS dan Kontrol CVS dihitung berdasarkan end-point proteksi 50% populasi ( = kematian 50% populasi = X50)
sesuai dengan rumus Spearman – Karber (Atanasiu 1960).
Tabel 1. End -point proteksi 50% populasi mencit dari SAR
Pengenceran Jumlah
Hewan model
10-2,9 10-3,2 10-3,5 10-3,8 10-4,1
Positif (ri) 5 5 0 1 0
Per pengenceran (ni) 5 5 5 4 5
Dari data pada Tabel 1, diperoleh nilai X0 = 3,2 dan d = 1,0 sehingga
diperoleh nilai Log X50 = - 3,95.
Tabel 2. End -point proteksi 50% populasi mencit dari Serum Referensi
Pengenceran Jumlah
Hewan model
10-2,9 10-3,2 10-3,5 10-3,8 10-4,1
Positif (ri) 5 2 1 1 0
Per pengenceran (ni) 5 5 5 5 5
Dari data pada Tabel 2, diperoleh nilai X0 = 2,9 dan d = 1,0 sehingga
diperoleh nilai Log X50 = - 4.
Selanjutnya, perhitungan menggunakan rumus Spearman – Karber, diperoleh nilai ED50 SAR = 10
-3,95
dan ED50 Serum Referensi = 10 -4
. Potensi serum referensi sesuai standar internasional untuk serum anti rabies ad alah 86,6 IU/ml (Atanasiu 1960). Dari nilai ED50 serum uji dan serum referensi yang
dibandingkan dengan potensi serum referensi, diperoleh nilai potensi SAR adalah 10-3,95 : 10-4 X 86,6 IU/ml =97,2 IU/ml. Jadi, setiap 1 ml SAR mengandung
sekitar 97,2 IU imunoglobulin anti rabies. Serum yang diuji dikatakan memenuhi syarat atau lolos uji apabila memiliki potensi sama atau lebih tinggi dibandingkan dengan potensi serum referensi (International Standard Serum), yaitu sama atau lebih tinggi dari 86,6 IU/ml (Atanasiu 1960). Dosis pemakaian imunoglobulin kuda anti rabies untuk pengobatan terhadap rabies adalah 40 IU per kilogram berat badan (Gamble 2002).
Produksi Antibodi Anti -Idiotipe (Ab2) pada Ayam
Satu minggu setelah diimunisasi dengan 0,5 ml Ab1 secara intravena
selama 3 minggu, serum ayam diperiksa dengan teknik AGPT. Hasil uji serum menunjukkan reaks i serologi negatif terhadap Ab1, terlihat dari tidak terbentuknya
garis presipitasi pada media agarose. Serum ayam mulai menunjukkan reaksi positif satu minggu setelah vaksinasi ulangan (booster) menggunakan Ab1 yang
diemulsikan dalam Freund’s incomplete adjuvant (FIA). Adjuvan membantu imunogen yang kurang imunogenik dalam menggertak sistem imun tubuh. Selain itu, ajuvan juga dapat berfungsi sebagai pembawa antigen menuju lokasi sistem imun dan melepaskannya sedikit demi sedikit (sebagai depot antigen), sehingga masa pembentukan antibodi berlangsung lebih lama (Leenaars et al. 1997).
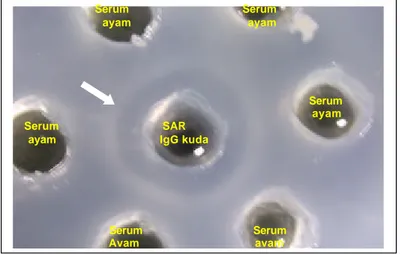
Gambar 8. Garis presipitasi (tanda panah) pada uji imunodifusi (AGPT) menunjukkan adanya reaksi homolog antara antiserum ayam (Ab2) dengan SAR (Ab1).
Hasil uji serum ayam yang mengandung antibodi anti-idiotipe (Ab2)
dengan Ab1 menunjukkan adanya reaksi homolog, ditandai dengan terbentuknya
Serum Serum ayam ayam Serum ayam Serum SAR
ayam IgG kuda
Serum Serum Ayam ayam
garis presipitasi pada AGPT (Gambar 8). Migliorini dan Schwartz (1988) menyatakan, bah wa daerah variabel suatu antibodi atau bagian dari molekul yang mengikat antigen bersifat antigenik dan dapat menggertak terbentuknya antibodi terhadap daerah variabel itu sendiri jika disuntikkan pada hewan yang berbeda spesiesnya atau bahkan pada hewan yang sama spesiesnya. Uji antara Ab2 dengan
vaksin rabies menunjukkan reaksi negatif, karena epitop dari antigen virus rabies tidak homolog dengan paratop Ab2. Untuk menghasilkan kekuatan ikatan antara
antigen dan antibodi diperlukan struktur yang cocok antara keduanya (Kennedy 1985).
Antigen yang diimunisasikan pada hewan akan menginduksi terbentuknya antibodi sekitar satu minggu pasca vaksinasi (Tizard 1988). Beberapa faktor yang berpengaruh terhadap pembentukan antibodi, di antaranya adalah umur hewan, ukuran molekul antigen, kerumitan struktur kimiawi antigen, konstitusi genetik, metode pemasukan antigen dan dosis antigen (Liddell dan Weeks 1995). Pada Tabel 3 disajikan hasil uji AGPT antibodi terhadap Ab1 dalam serum ayam.
Tabel 3. Titer antibodi anti-idiotipe pada serum ayam diuji dengan AGPT
Titer antibodi pada serum ayam pada minggu No. Ayam 0 1 2 3 4 5 6 7 8 9 10 1 20 23 24 24 23 23 23 23 23 22 22 2 20 22 23 24 23 23 23 23 23 23 23 3 20 21 22 23 23 23 23 23 23 23 22 4 20 23 24 24 23 23 23 23 23 22 22 5 20 22 23 24 26 25 24 23 23 23 23 K 20 20 20 20 20 20 20 20 20 20 20 K 20 20 20 20 20 20 20 20 20 20 20 K 20 20 20 20 20 20 20 20 20 20 20
Keterangan : K (kontrol negatif).
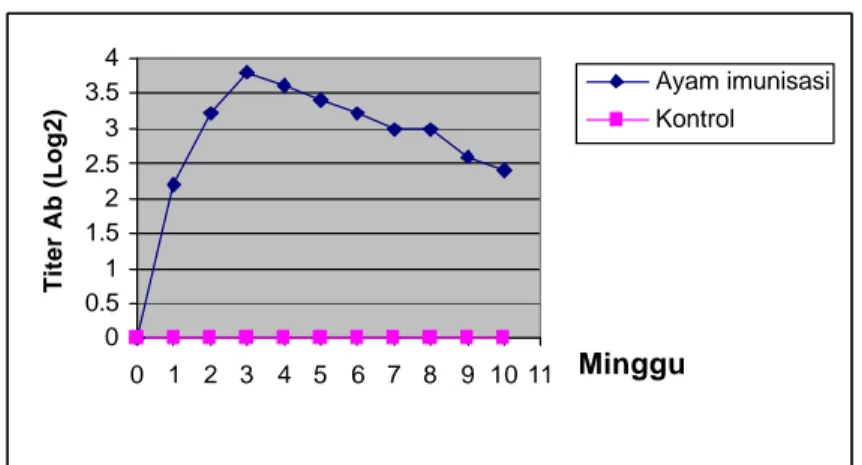
Dengan metode AGPT, reaksi positif masih terdeteksi sampai dengan 10 minggu setelah vaksinasi dan titer puncak terjadi pada minggu ketiga pasca vaksinasi. Selanjutnya terjadi penurunan kadar antibodi dalam serum seperti yang terlihat pada grafik Gambar 9. Penurunan kadar antibodi dalam serum merupakan cermin dari hilangnya populasi sel plasma penghasil antibodi spesifik. Sekali berdiferensiasi penuh, sel plasma mati setelah tiga sampai enam hari dan
imunoglobulin yang dihasilkan ini menurun perlahan-lahan karena proses katabolisme (Tizard 1988).
Gambar 9. Grafik Titer Antibodi terhadap Ab1 pada Serum Ayam.
Terbentuknya garis presipitasi pada uji AGPT menunjukkan bahwa pada serum ayam telah terjadi respon imun (Ab2) terhadap F(Ab)2 imunoglobulin kuda
anti rabies (Ab1). Imunoglobulin Y (Ab2) akan ditransfer dari serum menuju
kuning telur dengan proses yang analog dengan proses transfer antibodi melalui plasenta pada mamalia, selanjutnya IgY dalam kuning telur akan terserap pada saat embrio berkembang menjadi anak ayam (Narat 2003). Antibodi yang terbentuk ini merupakan antibodi anti-idiotipe yang diharapkan mempunyai karakteristik serologis yang sama dengan antigen aslinya dan dapat digunakan sebagai antigen pen gganti dalam imunisasi.
Kemampuan meniru struktur antigen aslinya (internal image) merupakan landasan penggunaan antibodi anti-id iotipe sebagai antigen pengganti. Antibodi anti-id iotipe digunakan untuk menggertak antibodi yang mempunyai spesifisitas sama dengan penggunaan vaksin virus rabies pada spesies hewan yang sama atau berbeda. Sebagaimana halnya antigen, antibodi anti-idiotipe mempunyai kemampuan berikatan secara kompetitif dengan antibodi spesifik terhadap antigen aslinya (Fields et al. 1995).
Sebagian antibodi yang terbentuk pada ayam mempunyai karakteristik antigenik yang sama dengan antigen aslinya. Antibodi ini disebut dengan antibodi anti-id iotipe (Wise et al. 2005). Hipotesis Jerne (1985) menyatakan, bahwa
0 0.5 1 1.5 2 2.5 3 3.5 4 0 1 2 3 4 5 6 7 8 9 10 11 Minggu Titer Ab (Log2) Ayam imunisasi Kontrol
daerah hipervariabel dari suatu imunoglobulin (antibodi) dapat bersifat sebagai antigen dan antibodi yang terbentuk dari antigen tersebut merupakan antibodi anti-id iotipe yang dapat berikatan secara langsung dengan paratope atau daerah pengikatan antigen (antigen binding site) dari antibodi pertama (Ab1). Dengan
demikian, antibodi anti-id iotipe juga dapat menghambat pengikatan antigen aslinya secara kompetitif (Liddell dan Weeks 1995).
Purifikasi dan Karakterisasi Imunoglobulin Ayam (IgY)
Tahap pertama pemurnian imunoglobulin ayam (IgY) melalui pengendapan protein dengan amonium sulfat jenuh diperoleh endapan protein berwarna putih, sebagaimana terlihat pada Gambar 10. Menurut Harlow dan Lane (1988), ketika suatu larutan garam dengan konsentrasi tinggi dan mengandung banyak ion seperti ion amonium ((NH4)+) dan ion sulfat (SO42-) ditambahkan ke
dalam larutan yang mengandung protein, maka larutan garam tersebut akan bersaing dengan protein untuk mengikat molekul air. Molekul air akan berpindah dan berikatan dengan garam, sehingga kelarutan protein menjadi berkurang, menyebabkan protein mengendap . Protein yang mengendap mempunyai afinitas yang lebih baik terhadap molekul protein lain daripada dengan molekul air.
Gambar 10. Proses pengendapan protein dengan amonium sulfat (A), diperoleh endapan berwarna putih (B).
Faktor-faktor yang berpengaruh terhadap pengendapan protein, di antaranya adalah jumlah dan posisi grup polar, berat molekul protein, pH larutan dan temperatur ketika pengendapan terjadi. Kebanyakan antibodi akan mengendap pada kondisi 50% jenuh. Kelemahan pengendapan dengan amonium sulfat adalah
protein yang diinginkan, misalnya antibodi, tidak didapatkan dalam keadaan murni, terkontaminasi oleh protein-protein dengan berat molekul tinggi lainnya. Oleh karena itu, pengendapan dengan amonium sulfat tidak dapat digunakan sebagai metode tunggal, tetapi harus dikombinasikan dengan metode yang lain (Beynon et al. 1981).
Endapan protein selanjutnya dilarutkan dengan NaCl fisiologis. Untuk menghilangkan garam yang terdapat pada larutan protein dilakukan dialisis menggunakan PBS pH 8,0 selama 24 jam pada suhu 2 – 8 oC. Tabung dialisis direndam dalam larutan buffer, maka molekul-molekul garam akan keluar melalui pori-pori tabung secara bertahap hingga konsentrasi garam di dalam dan di luar tabung dialisis menjadi sama (Gambar 11).
Gambar 11. Proses dialisis larutan protein menggunakan PBS pH 8,0.
Pada prinsipnya, dialisis merupakan proses pertukaran ion (buffer exchanges). Meskipun bukan merupakan suatu metode untuk mendapatkan protein murni, tetapi buffer exchanges memegang peran penting dalam proses purifikasi dikombinasikan dengan metode lainnya. Misalnya, pada proses pengendapan menggunakan amonium sulfat, endapan protein berada pada lingkungan konsentrasi garam tinggi. Maka untuk menghilangkan kadar garam, dapat dilakukan proses buffer exchanges yang dapat dilakukan dengan membran permeabel yang bersifat selektif. Salah satu contohnya adalah penggunaan tabung dialisis. Tabung dialisis mempunyai lubang (pori-pori) yang sangat kecil, dimana hanya molekul-molekul yang sangat kecil (< 5.000 Da) yang dapat lolos,
sedangkan molekul protein yang mempunyai ukuran lebih besar tidak dapat melewatinya (Ford 2004).
Uji AGPT pada protein yang telah didialisis menunjukkan reaksi serologi yang homolog terhadap Ab1. Hal ini berarti bahwa protein mengandung antibodi
(Ab2) terhadap Ab1. Namun, setelah dilakukan analisis pita protein dengan metode
Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) dengan pewarnaan comassie blue (Hames dan Rickwood 1987), menunjukkan masih terdapat banyak pita protein dengan berat molekul yang beragam. Oleh karena itu, maka dilakukan pemurnian tahap berikutnya sehingga dapat diperoleh antibodi dengan tingkat kemurnian yang lebih tinggi.
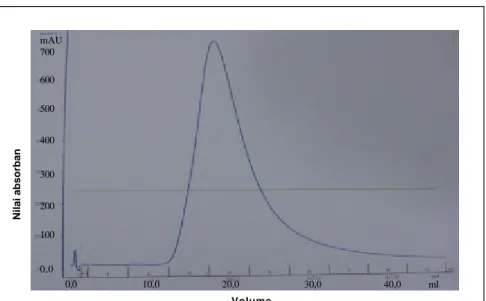
Gambar 12. Pemurnian dengan kromatografi afinitas spesifik , IgY terdeteksi pada panjang gelombang 280 nm.
Pemurnian selanjutnya dilakukan pada kolom kromatografi menggunakan matriks afinitas spesifik terhadap IgY (HiTrap IgY Purification, Amersh am Pharmacia Biotech). Prosedur ini didasarkan pada medium yang mempunyai afinitas spesifik terhadap protein yang akan dimurnikan, sehingga matriks hanya akan mengikat protein yang diinginkan (Blaber 1998). Matriks terdiri dari thiophilic adsorption medium, 2-mercaptopyridine yang diikatkan dengan sepharose high perfomance. Interaksi matriks dengan IgY terjadi karena adanya kombinasi donor elektron dan penerimaan aksi dari matriks atau merupakan
Volume Nilai absorban mAU 700 600 500 400 300 200 100 0,0 0,0 10,0 20,0 30,0 40,0 ml
gabungan antara interaksi hidrofilik dan hidrofobik. Hasil kro matografi afinitas yang dilihat dengan spektrofotometer disajikan pada grafik Gambar 12. Fraksi protein terbaca optimal pada panjang gelombang 280 nm. Ini membuktikan bahwa hasil pemurnian merupakan protein.
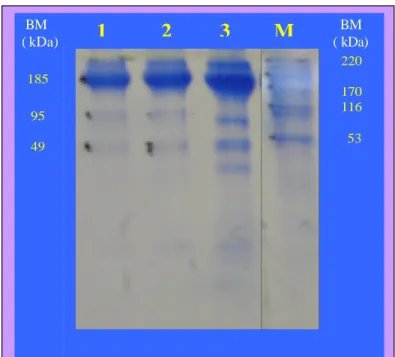
Tingkat kemurnian protein setelah pemurnian dapat dilihat dari analisis pita protein menggunakan metode SDS -PAGE yang disajikan pada Gambar 13. Metode SDS-PAGE biasanya hanya digunakan untuk mendeteksi keberadaan protein dalam suatu proses purifikasi. SDS merupakan detergen anionik yang dapat berinteraksi dengan bagian hidrofobik dari protein. Jika dipanaskan, maka seluruh polipeptida akan terselimuti sehingga menjadi tidak bermuatan. Atas dasar ini, maka perpindahan protein ditentukan oleh ukurannya, bukan oleh muatan ionnya (Hames dan Rickwood 1987).
Gambar 13. Profil pita protein yang dimurnikan dengan kromatografi afinitas (1 dan 2) menunjukkan pita protein dengan berat molekul 185, 95 dan 49 kDa dan hasil pengendapan dengan amonium sulfat (3) dibandingkan dengan marker (M).
Pemurnian dengan kromatografi afinitas spesifik IgY menghasilkan protein dengan berat molekul 185.000 dalton. Protein dengan berat molekul 185.000 dalton diduga merupakan imunoglobulin Y (IgY). Narat (2003)
220 170 116 53 185 95 49
1 2 3 M
BM BM (kDa) (kDa)menyatakan, bahwa IgY mempunyai berat molekul yang lebih besar dibandingkan dengan IgG, yaitu sekitar 180.000 dalton atau lebih besar. Selain itu, juga diperoleh protein dengan berat molekul 95.000 dalton dan 49.000 dalton yang diduga merupakan fragmen Fc dan Fab dari IgY yang belum terakit menjadi imunoglobulin utuh. Sun et al. (2001) menyatakan, bahwa degradasi IgY akan menghasilkan fragmen Fc dan Fab, dimana berat molekul Fab sekitar 45.000 dalton.
Proses pemurnian dengan kolom kromatografi menyebabkan volume larutan IgY bertambah, sehingga perlu dilakukan pem ekatan dengan cara menarik air dalam larutan IgY menggunakan Polyethylen Glycol (PEG) 6000. Larutan IgY dimasukkan ke dalam tabung dialisis, selanjutnya ditaburkan PEG 6000 di sekeliling tabung (Gambar 14) hingga volume larutan di dalam tabung dialisis mencapai volume yang diinginkan.
Gambar 14. Pemekatan larutan IgY menggunakan tabung dialisis dan PEG 6000 di sekeliling tabung.
Prinsip kerja PEG adalah dengan mengubah muatan elektrik konstan dari larutan, PEG kering mengabsorpsi air dalam tabung dialisis melalui membran semipermeabelnya, sehingga larutan yang terkandung di dalamnya terkonsentrasi. Larutan IgY hasil pemekatan selanjutnya didialisis kembali untuk menghilangkan garam-garam yang kemungkinan masih ada dalam larutan.
Rangkaian proses pemurnian yang telah dilakukan, menghasilkan IgY sebagai antibodi poliklonal yang mengandung antibodi dengan spesifisitas, afinitas dan isotipe yang berbeda. Hanya sekitar satu persen jumlah total imunoglobulin diarahkan untuk melawan antigen yang dipakai untuk imunisasi. Antibodi poliklonal relatif stabil, sehingga secara keseluruhan aktivitasnya tidak begitu berpengaruh walaupun titernya sedikit menurun. Dan karena antibodi poliklonal bereaksi dengan sejumlah antigen determinan yang berbeda pada antigen, maka reaktivitas multipel ini dapat mengakibatkan terbentuknya kompleks antigen-antibodi yang besar. Ini mempunyai aplikasi praktis dalam presipitasi antigen. Antibodi monoklonal, karena sifatnya yang monospesifik, kurang mempresipitasi antigen (Burgess 1995).
Selanjutnya, IgY poliklonal yang telah dimurnikan disiapkan sebagai imunogen pengganti antigen virus rabies untuk imunisasi kelinci. Dalam penelitian ini digunakan IgY utuh. Roitt (2003) mengatakan, adanya satu antigen dalam campuran antigen dapat menghilangkan respon imun terhadap antigen yang lain secara jelas, termasuk adanya fragmen Fc pada imunoglobulin yang digunakan untuk imunisasi yang disebabkan sifat menghambat regio Fc. Oleh karena itu, penggunaan imunoglobulin tanpa fragmen Fc atau penggunaan imunogen yang hanya mengandung fragmen Fab atau F(ab)2 untuk imunisasi
memberikan respon imun yang lebih baik dibandingkan dengan pemakaian imunoglobulin utuh. Tetapi, bertolak dari pernyataan Carlender (2002 ) yang mengatakan, bahwa regio Fc pada IgY berbeda dengan IgG mamalia karena IgY tidak berikatan dengan reseptor Fc mamalia , tidak berikatan dengan antibodi mamalia (faktor rheumatoid) dan tidak mengaktifkan sistem komplemen , maka penggunaan IgY utuh relatif tidak memberikan respon imun yang berbeda dibandingkan dengan penggunaan fragmen Fab atau F(ab)2 saja.
Selain itu, Sun et el. (2002) menyatakan, degradasi IgY dengan enzim pepsin akan menghasilkan fragmen Fc dan Fab, bukan F(ab)2 seperti hasil
degradasi IgG dengan perlakuan yang sama. Dijelaskan pula, bahwa Fab dari IgY mempunyai berat molekul sekitar 45 kDa. Molekul ini kurang imunogenik apabila digunakan sebagai imunogen dalam vaksinasi.
Pengukuran Konsentrasi Antibodi Anti -idiotipe (Ab2)
Untuk mengetahui konsentrasi Ab2, dilakukan pemeriksaan kandungan
IgY menggunakan spektrofotometer. Dengan melakukan empat kali pengukuran, diperoleh konsentrasi protein rata-rata 0,940 mg/ml larutan. Hasil pengukuran disajikan pada Tabel 4.
Tabel 4. Hasil pengukuran kandungan imunoglobulin yang telah dimurnikan. No. pengukuran Konsentrasi protein (mg/ml) 1 1,070 2 0,839 3 0,802 4 1,049 Rata -rata 0,940
Pengukuran konsentrasi IgY (Ab2) perlu dilakukan untuk penentuan dosis
imunisasi yang akan diberikan pada hewan coba karena dosis antigen berpengaruh terhadap pembentukan antibodi. Telah diketahui bahwa bila jumlah molekul antigen cukup terikat pada reseptor antibodi pada permukaan sel dan seterusnya dipresentasikan pada sel T, limfosit dapat distimulasi untuk berkembang menjadi klon penghasil antibodi. Bila hanya sejumlah kecil antigen yang ada, hanya limfosit dengan reseptor antibodi afinitas tinggi yang dapat mengikat antigen untuk dapat terjadinya stimulasi dan juga menghasilkan antibodi dengan afinitas tinggi. Jadi, pada dosis antigen tinggi, limfosit dengan reseptor afinitas rendah juga terstimulasi dan biasanya jumlahnya berlimpah dibandingkan reseptor afinitas tinggi. Selanjutnya, kemungkinan besar bahwa sel dengan afinitas tertinggi akan mengikat begitu banyak antigen sehingga menjadi toleran (Roitt 2003).
Liddell dan Weeks (1995) menyatakan, bahwa pembentukan antibodi dengan afinitas tinggi dapat diinduksi melalui imunisasi dengan antigen dosis relatif rendah. Tergantung pada hewan yang diimunisasi, dosis imunogen berkisar antara 10 – 100 µg. Untuk imunisasi endotoksin pada sapi dan hewan kecil laboratorium, diperlukan dosis optimal yang sama, yaitu kira-kira sebanyak 50 µg (Leenaars et al. 1997). Namun, untuk sebagian besar antigen protein, karbohidrat
dan asam nukleat dianjurkan memakai dosis antara 50 – 1000 µg (Leenaars et al. 1994).
Imunisasi Kelinci dengan Antibodi Anti-idiotipe (Ab2)
Setelah dilakukan proses pemurnian dan pengukuran konsentrasi IgY yang merupakan antibodi anti-idiotipe (Ab2) terhadap rabies , selanjutnya Ab2 yang
diemulsikan dalam ajuvan digunakan untuk menginduksi respon imun pada kelinci. Penggunaan ajuvan bertujuan untuk meningkatkan reaksi imun pada kelinci, karena bentuk emulsi dari FCA dapat menyimpan antigen dalam waktu lama sehingga pembentukan antibodi berlangsung secara terus-menerus.
Ajuvan berperan dalam aktivasi makrofag. Di bawah pengaruh sisipan ajuvan, makrofag membentuk granuloma yang menjadi tempat interaksi dengan sel penghasil antibodi. Konsentrasi sel yang konsisten karena adanya depot, khususnya di permukaan makrofag, menjamin sel yang peka antigen membelah dalam granuloma, keturunannya sangat mungkin dirangsang lebih lanjut oleh antigen. Akhirnya, semua ajuvan merangsang makrofag yang diperkirakan berperan meningkatkan imunogenisitas melalui peningkatan konsentrasi antigen pada permukaan dan efisiensi presentasi ke limfosit (Leenaars et al. 1997).
Komponen aktif FCA adalah muramyl dipeptide larut (MBP; N-acetyl-muranyl-L-alanyl-D-isoglutamine) yang bekerja pada makrofag, sel B dan sel T, merangsang terbentuknya berbagai sitokin. MDP hidrofilik analog dengan antigen yang larut dalam air, terutama merangsang reaksi antibodi, bila diberikan dalam lingkungan hidrofobik seperti minyak mineral atau dimasukkan dalam liposom, terutama menghasilkan imunitas seluler.
Pengamatan terhadap ketiga kelompok kelinci yang diimunisasi menunjukkan seluruh kelinci terlihat sehat, nafsu makan tidak berubah dengan perilaku normal. Berat badan kelinci mengalami kenaikan secara normal. Namun, kelinci pada kelompok II, yaitu kelinci yang diimunisasi dengan Ab2 yang
diemulsikan dalam FCA, mengalami abses pada tempat penyuntikan. Keadaan ini terlihat mulai hari kedua setelah penyuntikan. Abses tampak sebagai nodul granulomatosa dengan warna kemerah -merahan dan akhirnya membentuk keropeng kering (Gambar 15). Abses dapat disebabkan oleh efek samping dari
FCA karena mengandung mikobakteri. Efek imunopotensi dan efek lain dari komponen mikobakteri dari FCA, yaitu terjadinya hipersensitivitas tipe lambat, produksi granuloma yang menetap dan provokasi penyakit autoimun cukup menyolok, menyebabkan penggunaannya pada manusia tidak disetujui (Roitt 2003). Tetapi Amyx (1987) menyatakan, berbagai efek samping yang timbul akibat pemakaian FCA dapat dikurangi dengan memperhatikan lokasi dan volume penyuntikan.
Gambar 15. Pembentukan abses steril di tempat penyuntikan pada kelinci yang diimunisasi dengan Ab2 yang diemulsikan dalam FCA.
Keadaan abses juga terlihat pada kelompok III, tetapi terlihat lebih ringan dibandin gkan dengan kelompok II. Vaksin rabies yang diimunisasikan pada kelompok III mengandung aluminium hidroksida, yang juga dapat menyebabkan abses steril pada tempat penyuntikan.
Pengujian Serum Kelinci dengan Metode AGPT
Antibodi yang diperoleh dari serum kelinci merupakan antibodi anti-idiotipe (Ab3). Serum kelinci dikoleksi mulai satu minggu sampai dengan empat
minggu setelah imunisasi terakhir. Selanjutnya dilakukan pengujian terhadap Ab3
dengan metode AGPT.
Hasil uji AGPT serum kelinci (Ab3) mulai minggu pertama sampai
dengan minggu keempat menunjukkan reaksi spesifik antara Ab3 dengan Ab2
(IgY) dan juga dengan antigen virus rabies, ditandai dengan adanya garis presipitasi (Gambar 16). Roitt dan Delvas (2001) menyatakan, bahwa presipitasi
merupakan reaksi sekunder sebagai akibat dari interaksi primer antara antigen dan antibodi spesifik. Interaksi yang terjadi antara antigen dan antibodi spesifik melibatkan berbagai interaksi nonkovalen antara determinan antigen, epitop antigen dan region hipervariabel pada molekul antibodi.
Reaksi spesifik antara Ab3 dengan antigen virus rabies merupakan indikasi
bahwa pada serum kelinci telah terbentuk antibodi yang mirip atau sama dengan Ab1 dan mampu berikatan secara spesifik dengan antigen asli (Saha et al. 2004).
Hal ini menunjukkan bahwa Ab2 mengandung internal image atau merupakan
mimikri dari virus rabies yang dapat menginduksi antibodi Ab3 spesifik terhadap
antigen aslinya, sehingga Ab3 mampu mengenali dan berikatan secara spesifik
dengan virus rabies. Guancheng et al. (2001) telah membuktikan, bahwa Ab2
monoklonal mengandung internal image dari epitope antigen yang terkait dengan nasopharyngeal carcinoma (NPC) dan mampu menginduksi respon imun spesifik baik humoral maupun selular.
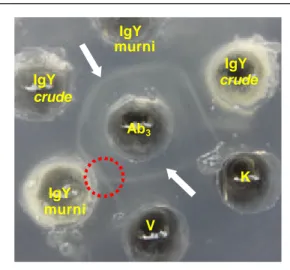
Gambar 16. Serum kelinci (Ab3) bereaksi spesifik dengan
virus rabies (V) dan Ab2, ditunjukkan dengan
garis presipitasi (tanda panah) yang membentuk pola reaksi identitas sebagian (tanda lingkaran) antara Ab2 dan virus rabies.
Garis presipitasi pada Gambar 16 juga memperlihatkan pola reaksi identitas sebagian (partial identity) antara Ab2 dan virus dengan pembentukan
garis presipitasi berbentuk tapal kuda. Pola reaksi identitas sebagian juga mengindikasikan bahwa Ab2 dan virus rabies memiliki determinan bersama.
IgY murni IgY IgY crude crude Ab3 K IgY murni V
Guancheng et al. (2001) menyatakan, hanya sebagian Ab2 yang terbentuk akibat
responnya terhadap Ab1 dapat mengekspresikan determinan idiotipe yang meniru
antigen aslinya. Imunisasi dengan Ab1 tidak hanya menghasilkan subset Ab2ß,
tetapi juga menginduksi Ab2a dan Ab2?. Antibodi Ab2 dapat menginduksi
terbentuknya Ab3 yang sangat kompleks. Hal ini terjadi terutama bila digunakan
Ab2 poliklonal (Hiernaux 1988).
Hipotesis Jerne (1985) juga menjelaskan, bahwa antibodi anti-idiotipe tertentu mengekspresikan bentuk tiga dimensi yang menyusun struktur antigen eksternal. Antibodi anti-idiotipe yang dikenal sebagai beta-Ab2 (Ab2ß), dapat
menginduksi respon imun spesifik yang sama dengan respon imun yang diinduksi oleh antigen aslinya. Selanjutnya Luo et al. (2000) menyatakan, bahwa antibodi anti-id iotipe (Ab2) kemungkinan mempunyai spesifisitas yang berbeda, beberapa
diantaranya mungkin dapat mengenali daerah pengikatan antigen pada antibodi dan mengekspresikan internal image antigen asli (Ab2ß), sedangkan lainnya
mengenali bagian-bagian lain di sekitar daerah hipervariabel (Ab2? dan Ab2a).
Hal ini dapat menyebabkan kemungkinan terbentuknya Ab3 yang heterogen, yaitu
Ab3 spesifik dan yang tidak spesifik terhadap antigen aslinya.
Secara kuantitatif, jumlah atau konsentrasi Ab2 spesifik yang terbentuk
kemungkinan menjadi rendah sehingga kemampuannya menginduksi Ab3 juga
rendah karena dosis imunogen berpengaruh terhadap produksi antibodi (Liddell dan Weeks 1995). Konsentrasi antibodi (Ab3) yang rendah menyebabkan garis
presipitasi antara Ab3 dan antigen pada teknik AGPT menjadi kurang jelas atau
tidak sejelas garis presipitasi yang terbentuk antara Ab3 dengan Ab2. Hal ini juga
didukung oleh hasil penelitian Goldbaum et al. (1997), bahwa respon antibodi terhadap antibodi anti-idiotipe dari hewan yang berbeda mempunyai afinitas lebih tinggi terhadap antibodi anti-id iotipe itu sendiri dibandingkan terhadap antigen asli.
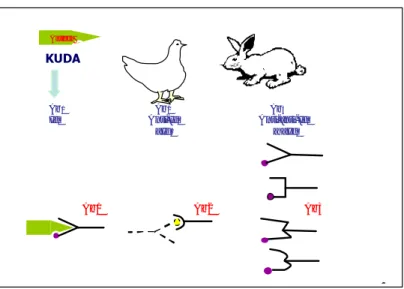
Pada Gambar 17 dapat dilihat ilustrasi Ab1 yang dihasilkan oleh
rangsangan antigen dan disuntikkan pada binatang kedua untuk menghasilkan Ab2. Selanjutnya Ab2 dimurnikan dan disuntikkan ke binatang 3 dan seterusnya.
Ab2 dan Ab4 masing -masing bereaksi dengan idiotipe pada Ab1 dan Ab3 tetapi
antigen asal. Idiotipe pengatur yang umum atau Id1 yang dikenal oleh banyak antibodi selain yang bereaksi dengan antigen asal, juga dihasilkan oleh suntikan anti-Id1 (Ab2) yang merangsang berbagai limfosit yang reseptornya mengandung
idotipe umum atau berikatan silang. Atas dasar ini dapat dimengerti, bahwa tidak semua molekul imunoglobulin yang mengandung idiotipe tertentu hasil reaksi terhadap antigen dapat berfungsi sebagai antibodi spesifik karena mereka termasuk dalam perangkat untuk reaksi non-spesifik. Adanya idiotipe dalam jumlah banyak dalam Ab3 juga menunjukkan bahwa hubungan linier melalui
idiotipe ikatan silang adalah dominan. Beberapa peneliti juga menemukan adanya kemungkinan terjadi reaksi silang idiotop di antara antibodi monoklonal pada daerah antigenik yang sama (Reagan et al. 1983).
Gambar 17. Ilustrasi pembentukan Ab3, dimana hanya sebagian Ab3
saja yang mempunyai spesifisitas sama dengan serum asal.
Untuk meningkatkan spesifisitas antibodi yang dihasilkan, dapat digunakan antibodi anti-id iotipe (Ab2) monoklonal. Namun, penggunaan Ab2
monoklonal dalam imunisasi mempunyai kelemahan karena hanya menginduksi antibodi yang sangat terbatas, tidak sebanyak variasi yang diinduksi oleh antigen asli. Pada kasus antigen yang mempunyai lebih dari satu faktor virulensi, apabila digunakan Ab2 monoklonal, maka antibodi yang dihasilkan hanya dapat
menetralkan satu faktor virulensi saja, sehingga tidak mampu melindungi individu dari serangan penyakit. Beberapa pen eliti juga menyatakan, bahwa pada proses
Antigen
Ab1 Ab2 Ab3
Id1 Anti-Id1 Anti-anti-Id1
αId1 α αId1
KUDA
pemurnian glikoprotein virus rabies atau fragmen peptida dari glikoprotein seringkali terhambat oleh adanya sifat hidrofobisitas dan kerusakan konformasi glikoprotein (Reagan et al. 1983). Perubahan konformasi glikoprotein akan berpengaruh terhadap antibodi dan antibodi anti-idiotipe yang terbentuk, sehingga penggunaan Ab2 monoklonal tidak menjamin terbentuknya antibodi yang mampu
menetralisasi virus.
Pengujian Antibodi Kelinci terhadap Virus Rabies dengan metode ELISA
Hasil pembacaan OD dari pengujian serum kelinci terhadap titer antibodi rabies yang diuji dengan metode ELISA dapat dilihat pada Lampiran Tabel 5. Secara umum, nilai OD pada kelinci yang diimunisasi dengan Ab2 lebih tinggi
dibandingkan dengan kelo mpok kontrol, namun lebih rendah apabila dibandingkan dengan kadar antibodi kelinci yang diinduksi dengan vaksin rabies. Pola nilai OD pada masing-masing kelompok kelinci yang diimunisasi, disajikan pada Gambar 18. Dari pola ini, dapat dilihat bahwa pembentukan antibodi yang diinduksi oleh Ab2 mempunyai nilai OD yang lebih rendah bila dibandingkan
dengan antibodi hasil imunisasi dengan vaksin rabies pada minggu pertama sampai minggu keempat setelah vaksinasi.
Gambar 18. Pola nilai OD serum kelinci terhadap titer antibodi rabies yang diuji dengan metode ELISA
Sesuai hasil penelitian Reagan et al. (1983), bahwa hanya sebagian dari fraksi anti-id iotipe (Ab2) yang mempunyai struktur mirip dengan antigen asli dan
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 Nilai OD 1 2 3 4 Minggu Kontrol Ab2 Vaksin
dapat berikatan pada antigen binding site Ab1. Idiotop yang diekspresikan oleh
anti-Ab2 dapat berbeda dari idiotop asli (Ab1),sehingga gagal berikatan dengan
antigen. Ketidakmampuan antibodi anti-idiotipe menginduksi antibodi yang dapat menetralisasi antigen asli diantaranya dapat disebabkan oleh adanya stimulasi sel T suppressor, delesi sel B yang mempunyai idiotipe yang relevan, atau karena antibodi yang terbentuk merupakan antibodi dengan aviditas rendah untuk menetralisasi virus. Induksi atau penekanan terhadap sel B positif dapat tergantung dari kelas antibodi dan dosis antibodi anti-idiotipe. Namun, penelitian pada mencit menunjukkan bahwa kegagalan Ab3 untuk menetralisasi virus bukan
disebabkan oleh jumlah internal image yang kurang, tapi lebih disebabkan oleh tidak adanya sel B pada m encit yang mempunyai idiotop relevan.
Namun, ketika suatu antibodi internal image terbentuk, maka antibodi tersebut memiliki struktur yang mirip atau sama dengan epitop pada antigen, sehingga dapat merangsang ekspresi idiotipe spesifik pada populasi sel B. Kemampuan suatu antibodi anti-id iotipe dalam menginduksi antibodi spesifik terhadap antigen aslinya terjadi karena struktur internal image yang diekspresikan pada permukaan molekul antibodi. Struktur yang diekspresikan pada lingkungan molekuler yang berbeda dapat menghentikan efek imunosupresif pada inang dengan cara menstimulasi klon-klon tersembunyi dan atau dengan mengaktivasi sel T sehingga seluruh sistem imun menjadi lebih aktif. Antibodi anti-idiotipe dapat menginduksi respon imun humoral dan seluler melalui aktivasi sel T CD4+ dan induksi respon CTL spesifik (Saha et al. 2004).
Analisis statistika dari hasil uji ELISA (Tabel 5) mulai minggu pertama sampai minggu setelah imunisasi terakhir, menunjukkan kadar antibodi spesifik terhadap rabies yang terbentuk pada kelinci yang diimunisasi dengan Ab2 nyata
lebih tinggi (P<0.05) dibandingkan dengan kelompok kontrol. Bahkan pada minggu pertama, kedua dan keempat setelah vaksinasi menunjukkan perbedaan sangat nyata (P<0,01). Namun apabila dibandingkan dengan kadar antibodi kelinci yang diimunisasi dengan vaksin rabies, menunjukkan kadar yang sangat nyata lebih rendah (P<0.01) pada minggu pertama sampai minggu ketiga pasca vaksinasi. Hal ini menunjukkan bahwa antibodi anti-idiotipe tidak mampu
menginduksi kadar antibodi yang sama dengan yang diinduksi oleh antigen aslinya.
Tabel 5. Hasil pengujian serum kelinci (Ab3) terhadap antibodi rabies yang
diuji dengan metode ELISA
Keterangan : Huruf yang berbeda ke arah kolom menunjukkan berbeda nyata (P<0,05) dan berbeda sangat nyata (P<0,01) pada uji jarak berganda Duncan .
Kondisi ini sejalan dengan pernyataan Roitt (2003), bahwa secara konsisten ditemukan bahwa Ab2 (anti-idotipe) mengenal idiotipe pada Ab1 yang
juga jelas ditemukan pada Ab3. Meskipun Ab1 dan Ab3 sama-sama idiotipe, hanya
fraksi kecil Ab3 bereaksi dengan antigen asal. Hasil ini terlihat bila idiotipe
tersebut merupakan idiotipe yang bereaksi silang atau idiotipe umum (IdX) yang berada pada sejumlah antibodi yang bervariasi dengan spesifisitas berbeda. Antibodi anti-idiotipe (Ab2) akan menginduksi antibodi yang mampu berikatan
secara lebih optimum dengan Ab2 dibandingkan dengan antigen karena struktur
Ab3 yang berperan untuk berikatan dengan Ab2 mirip, tetapi tidak sama dengan
struktur Ab1 yang berperan untuk berikatan dengan antigen (Goldbaum et al.
1997). Persaingan antara antigen dengan anti-idiotipe (Ab2) untuk berikatan
dengan Ab1 dapat juga disebabkan oleh hambatan sterik, bukan karena konformasi
yang homolog. Stimulasi sel B dapat terjadi bukan karena adanya antibodi internal image, tapi dapat terjadi karena induksi oleh Ab2 spesifik terhadap daerah
framework (Reagan et al. 1983).
Pembacaan nilai OD selanjutnya dikonversikan ke dalam nilai International Unit (IU), sehingga dapat diketahui apakah suatu serum
Rata-rata hasil uji Elisa (OD/ml) pada minggu PERLAKUAN (jenis imunogen) 1 2 3 4 NaCl fisiologis 0,217 a a 0,239 a a 0,240 a a 0,166 a a (kontrol) ± 0,011 ± 0,029 ± 0,009 ± 0,140 Antibodi Anti- idiotipe (Ab2) 0,865 b b ± 0,130 0,798 b b ± 0,160 0,901 b a ± 0,145 0,874 b b ± 0,118 Vaksin Rabies 1,689 c c ± 0,166 1,879 c c ± 0,237 1,682 c b ± 0,404 1,584 c b ± 0,346
mengandung kadar antibodi yang memenuhi syarat untuk melindungi hewan dari serangan penyakit. Hasil uji ELISA rata-rata yang telah dikonversi ke dalam satuan IU disajikan pada Tabel 6. Dapat dilihat bahwa kadar antibodi kelinci (Ab3) terhadap antigen virus rabies mulai minggu pertama sampai dengan minggu
keempat pasca vaksinasi rata-rata lebih besar dari 0,5 IU/ml.
Tabel 6. Hasil pengujian serum kelinci (Ab3) terhadap antibodi rabies
dengan metode ELISA
PERLAKUAN (Jenis imunogen) Waktu (Minggu) Rata-rata Hasil Uji (IU/ml) KETERANGAN
NaCl fisio logis 1 0,027 Negatif
(kontrol) 2 0,036 Negatif
3 0,035 Negatif
4 0,034 Negatif
Antibodi anti- idiotipe 1 1,187 Protektif
(Ab2) 2 1,488 Protektif
3 2,395 Protektif
4 1,986 Protektif
Vaksin Rabies 1 2,425 Protektif
2 4,466 Protektif
3 2,853 Protektif
4 2,231 Protektif
Keterangan : - Titer Antibodi Negatif : < 0,1
- Titer Antibodi Positif : 0,1 s.d. < 0,5 - Titer Antibodi Protektif : > 0,5
Dengan kadar antibodi lebih besar dari 0,5 IU/ml, menunjukk an Ab2
mampu menginduksi antibodi protektif terhadap virus rabies. Hal ini sesuai dengan rekomendasi WHO, bahwa kadar antibodi protektif rabies terendah adalah 0,5 IU/ml apabila diuji dengan metode indirect ELISA. Artinya, bahwa hewan atau orang yang telah divaksinasi rabies paling tidak harus mempunyai kadar antibodi rabies 0,5 IU/ml untuk dapat terlindung dari penyakit rabies (OIE 2004).
Mala et al. (2005) juga menyebutkan, bahwa tingkat antibodi yang diukur dengan teknik ELISA menunjukkan hasil yang sejalan dengan tingkat antibodi yang diukur dengan flourescent antibody virus neutralization test (FAVNT). Telah dibuktikan, bahwa tingkat antibodi yang diukur dengan ELISA dan FAVNT mempunyai korelasi yang baik dengan tingkat proteksi antibodi terhadap
tantangan virus rabies. Pada sampel yang sama, pengujian dengan immunoperoxidase virus neutralization (IPVN) menunjukkan tingkat antibodi netralisasi yang lebih tinggi dibandingkan dengan hasil uji menggunakan ELISA (Cardoso et al. 2004).
Pada Gambar 19 disajikan pola kadar antibodi Ab3 kelinci yang mampu
bereaksi homolog dengan virus rabies. Kadar antibodi yang diinduksi oleh Ab2
mengalami penurunan pada minggu kedua setelah vaksinasi dan kadar tertinggi diperoleh pada minggu ketiga untuk selanjutnya mengalami penurunan pada minggu keempat pasca vaksinasi, namun masih pada kadar antibodi protektif. Berbeda dengan kadar antibodi yang diinduksi oleh vaksin rabies yang mengalami puncaknya pada minggu kedua pasca vaksinasi.
Gambar 19. Grafik kadar antibodi spesifik terhadap virus rabies pada serum kelinci.
Perbedaan pola kadar antibodi yang terlihat sangat dipengaruhi oleh adanya perbedaan imunogen. Virus mempunyai berat molekul yang jauh lebih besar (sekitar 200 X 106 kDa) dibandingkan IgY (Ab2), sehingga vaksin virus
dapat menggertak respon imun lebih cepat dan menginduksi tingkat antibodi lebih tinggi. Selain itu, derajat keasingan suatu antigen juga berpengaruh terhadap respon imun. Virus yang diinduksikan pada suatu individu akan segera mendapat respon oleh sistem imun dibandingkan dengan antibodi (Ab2), karena antibodi
merupakan komponen tubuh normal pada suatu individu. Oleh karena itu, perlu dipertimbangkan penggunaan bahan lain yang digandengkan pada Ab2 untuk
meningkatkan sifat imunogeniknya.
0 1 2 3 4 5 0 1 2 3 4 5 Minggu Kadar Ab (IU/ml) Kontrol Ab2 Vaksin Rabies
Meskipun antibodi anti-id iotipe (Ab2) menginduksi kadar antibodi yang
lebih rendah bila dibandingkan dengan vaksin virus, tetapi penggunaanya sebagai vaksin perlu dipertimbangkan. Selain dapat menginduksi tingkat kekebalan yang protektif, vaksin antibodi anti-id iotipe dapat mengatasi berbagai resiko yang mungkin timbul akibat penggunaan virus rabies sebagai bahan vaksin. Beberapa resiko yang dapat dihindari bila menggunakan vaksin antibodi anti-idiotipe, adalah : bahaya dari agen infeksius yang sangat ganas pada penggunaan virus sebagai vaksin dan resiko efek samping berupa reaksi neurologik yang mungkin timbul akibat penggunaan jaringan otak untuk membiakkan virus.
Secara lebih luas lagi, dengan semakin banyak daerah di Indonesia yang dinyatakan sebagai daerah bebas rabies, merupakan suatu pilihan yang tepat apabila digunakan vaksin antibodi anti-id iotipe dalam program vaksinasi rabies karena penggunaan vaksin virus dapat beresiko tersebarnya kembali agen virus infektif dan bahkan dapat menimbulkan wabah. Dibandingkan dengan vaksin rekombinan yang berpotensi mengalami perubahan secara genetik, vaksin antibodi anti-id iotipe relatif lebih stabil dan aman.
Antibodi anti-id iotipe rabies yang diproduksi pada ayam dapat digunakan sebagai vaksin yang diberikan per oral karena menurut Coleman (2000), pemberian IgY per oral memberikan dampak sistemik sehingga mampu menggertak sistem imun humoral dan seluler. Hal ini dapat mengatasi kesulitan pelaksanaan vaksinasi yang sering ditemukan di lapangan, menyangkut penanganan hewan yang pada umumnya divaksinasi secara per injeksi. Demikian juga pada program vaksinasi hewan liar, akan lebih mudah apabila dilakukan vaksinasi per oral melalui vaksin yang dikemas berupa makanan.
Selain untuk vaksin, antibodi anti-idiotipe rabies juga dapat digunakan sebagai reagen dalam pemeriksaan serologis terhadap rabies, terutama di daerah -daerah yang dinyatakan sebagai -daerah bebas rabies . Penggunaan antibodi anti-idiotipe juga dapat mengatasi masalah adanya resiko bahaya agen infeksius bagi petugas di laboratorium dan lapangan.