PEMERIKSAAN NARKOTIKA, PSIKOTROPIKA DAN ALKOHOL SECARA KUALITATIF
A. Persiapan Sampel
1. Sampel berbentuk serbuk atau tablet
Satu tablet sampel (50 mg serbuk) larutkan dalam 10 mL metanol, bila perlu saring.
2. Sampel Ganja
Tanaman ganja (Cannabis plant, Cannabis herba)
± 400 mg cuplikan yang telah diserbuk haluskan, masukkan ke dalam Erlenmeyer bertutup, tambah 10 ml petroleum eter atau toluen, dan kocok selama 1 jam, kemudian saring. Bila perlu tambahkan lagi pelarut hingga diperoleh volume 10 ml
Damar ganja (Cannabis resin)
± 100 mg damar ganja dalam mortir, gerus dengan ± 2 ml toluen sampai terbentuk pasta. Dengan bantuan 8 ml toluen masukkan ke dalam Erlenmeyer bertutup, kocok selama 1 jam dan saring.
Hasis (Hasis oil, Cannabis oil)
± 50 mg hasis larutkan dalam 10 ml toluen.
3. Sampel cuplikan berbentuk cairan
Ambil minimal 10 mL cairan, tanpa penambahan zat lain.
4. Spesimen darah/serum/plasma
Persiapan spesimen dengan cara ekstraksi adalah sebagai berikut :
a. Prinsip
Pemisahan/isolasi spesimen dengan pelarut organik pada pH tertentu dari zat-zat yang mengganggu berdasarkan dengan kelarutannya. Hasil ekstraksi disaring dan dikeringkan sehingga didapat residu yang dapat dianalisis.
b. Peralatan 1) Vortex mixer 2) Shaker 3) Sentrifus 4) Tapered tube 5) Corong pisah 6) Corong
c. Reagen
1) Pelarut organik (CHCl3) 2) Natrium sulfat anhidrat 3) Natrium hidroksida 4) Asam sulfat pekat 5) Buffer fosfat 6) Amonia
7) Natrium bikarbonat (NaHCO3)
d. Cara kerja
1) Ke dalam 4 mL spesimen tambahkan 2 mL buffer fosfat (pH 7,4)
dan 40 mL kloroform (CHCl3) kocok, kemudian tambahkan 2g Na2SO4 anhidrat kocok kembali untuk menghasilkan masa yang
padat.
2) Tuangkan CHCl3 melalui saringan.
3) Ekstraksi kembali masa padat tersebut dalam 20 mL CHCl3 campur kedua hasil ekstraksi fraksi CHCl3.
4) Simpan masa padat yang ada.
5) Apabila terdapat salisilat, fraksi CHCl3 (fraksi A) ekstraksi dengan NaHCO3 untuk menghilangkan salisilat yang dapat menghambat penentuan selanjutnya.
6) Pada fraksi CHCl3 tambahkan 8 mL NaOH 0,45 M (setara dengan 2 kali volume spesimen yang diambil).
7) Kocok selama 2 menit kemudian sentrifus. Larutan NaOH kemungkinan mengandung barbiturat dan senyawa asam lemah lainnya (fraksi B).
8) Cuci fraksi CHCl3 dengan sedikit air, buang air cucian, keringkan fraksi CHCl3 dengan Na2SO4 anhidrat, uapkan sampai kering. Residu kemungkingan mengandung obat-obat netral dan beberapa obat yang bersifat basa (fraksi C) seperti klordiazepoksid, diazepam dan nitrazepam.
9) Apabila spesimen masih ada, basakan dengan larutan ammonia, lalu ekstraksi 2 kali, masing-masing dengan 10 mL CHCl3 kemudian keringkan dengan Na2SO4 anhidrat. Uapkan larutan sampai kering.
Residu kemungkingan mengandung obat golongan basa (fraksi D).
10) Jika tidak tersedia sisa spesimen awal maka fraksi C yang telah diperiksa larutkan dengan CHCl3 dan ekstraksi dengan H2SO4 0,5 M.
Tambahkan ekstrak ke masa padat H2SO4 pada butir 3 di atas. Basakan dengan larutan ammonia, ekstraksi 2 kali dengan 10 mL CHCl3.
Residu kemungkinan mengandung obat golongan basa (fraksi D).
Ekstraksi tersebut di atas dapat dilihat pada skema IV.I di bawah ini :
Skema IV.1
Ekstraksi Darah/Serum/Plasma
Ekstraksi dengan NaOH Ekstraksi Dengan H2SO4 0,5 M
Masa padat Sulfat
Basakan dengan ammonia
Ekstraksi dengan CHCl3
CHCl3 (bila ada salisilat
Ekstraksi dengan NaHCO3 (Fraksi A) Ekstraksi dengan CHCl3
Spesimen (pH 7,4)
Spesimen
Fraksi NaOH Asam lemah (Fraksi B)
Fraksi CHCl3 Obat netral
(Fraksi C)
Fraksi CHCl3 Obat Gol Basa
5. Ekstraksi urin/cairan lambung b. Prinsip
Pemisahan/isolasi spesimen dengan pelarut organik pada pH tertentu dari zat-zat yang mengganggu berdasarkan kelarutannya. Hasil ekstraksi disaring dan dikeringkan sehingga didapat residu yang dapat dianalisis.
c. Peralatan 1) Vortex mixer 2) Shaker 3) Sentrifus 4) Tapered tube 5) Corong pisah 6) Corong
7) Batang Pengaduk 8) Penangas air 9) Sonikator
d. Reagen
1) Pelarut organik (Eter) 2) Natrium sulfat anhidrat 3) Natrium hidroksida 4) Asam sulfat pekat
5) Asam tartrat atau asam fosfat 6) Amonium sulfat
7) Kloroforom (CHCl3)
e. Cara Kerja
1) Tambah 10 mL urin dengan asam fosfat atau asam tartrat untuk membuat pH = 3
2) Ekstraksi 2 kali, masing-masing dengan 30 mL eter, campur hasil ekstraksi.
3) Cuci dengan 5 mL air dan tambahkan air cucian ke dalam spesimen
4) Simpan fraksi air untuk ekstraksi selanjutnya
5) Fraksi eter di atas ekstraksikan dengan 5 mL larutan natrium bikarbonat jenuh
6) Fraksi eter ekstraksi kembali dengan 5 mL NaOH 0,45 N dan simpan sebagian hasil ekstraksi untuk pemeriksaan barbiturat dan beberapa substansi asam lemah lainnya, misalnya klordiazepoksid (Fraksi B)
Residu kemungkinan mengandung obat-obat netral (Fraksi C)
7) Fraksi air pada butir 3) tambah dengan amonia untuk membuat pH = 8
8) Ekstraksi sebanyak 2 kali masing-masing dengan 10 mL CHCl3 9) Cuci campuran ekstrak fraksi CHCl3 dengan air, kemudian saring
dan tambahkan dengan sedikit asam tartrat untuk menghindari hilangnya zat-zat yang mudah menguap.
10) Uapkan sampai kering, residu kemungkinan mengandung antara lain golongan benzodiazepin : klordiazepoksid, diazepam, nitrazepam (Fraksi D).
Untuk ekstraksi cairan lambung dilakukan seperti ekstraksi pada urin dengan tambahan cara kerja spesimen yang akan diekstraksikan sebagai berikut :
Tambahkan ke dalam spesimen ammonium sulfat (padat berlebihan) bersama-sama dengan beberapa tetes asam fosfat 10 %, panaskan, kocok dan saring.
Fitrat dilakukan seperti cara kerja di atas
Ekstraksi di atas dapat dilihat pada skema IV.2 di bawah ini :
Skema IV.2
Ekstraksi Cairan Lambung
Bikarbonat As. Kuat (Fraksi A)
Ekstraksi dengan Na. Bikarbonat
Ekstraksi dengan CHCl3 Fraksi eter Fraksi air (pH 8)
Ekstraksi dengan eter Spesimen (pH 3)
Fraksi eter diekstraksi Dengan NaOH
Fraksi CHcl3
Fraksi NaOH (Fraksi D)
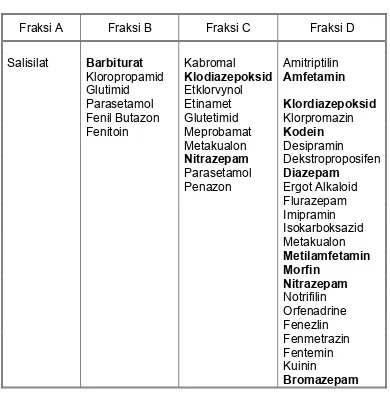
Isi dari Fraksi A, B, C dan D dapat dilihat pada table IV.1 di bawah ini :
Tabel IV.1
Isi dari Fraksi A, B, C dan D
Fraksi A Fraksi B Fraksi C Fraksi D
Salisilat Barbiturat Kabromal Amitriptilin Kloropropamid Klodiazepoksid Amfetamin
Glutimid Etklorvynol
Parasetamol Etinamet Klordiazepoksid
Fenil Butazon Glutetimid Klorpromazin
Fenitoin Meprobamat Kodein
Metakualon Desipramin
Nitrazepam Dekstroproposifen
Parasetamol Diazepam
Penazon Ergot Alkaloid
Flurazepam
Imipramin
Isokarboksazid
Metakualon
Metilamfetamin Morfin
Nitrazepam
Notrifilin
Orfenadrine
Fenezlin
Fenmetrazin
Fentemin
Kuinin
Bromazepam Keterangan. :
Nama obat yang hurufnya dicetak tebal yang dibahas dalam buku ini.
B. Pemeriksaan Skrining
Pemeriksaan pendahuluan (Screening Test) adalah pemeriksaan laboratorium sebagai upaya penyaring untuk mengetahui ada/tidaknya dan jenis obat yang menimbulkan efek toksis atau efek gangguan kesehatan.
Penafsiran hasil
Analisis kualitatif dari sampel biologik akan memberikan informasi apakah subyek yang bersangkutan menggunakan obat terlarang atau tidak. Adanya metabolit menunjukkan bahwa zat/obat tersebut telah dikonsumsi dan termetabolisme dalam badan.
Pemeriksaan skrining positif berarti suatu obat/metabolitnya terdapat dalam urin sebanyak/lebih banyak dari batas deteksi alat. Pengeluaran dari badan dan konsentrasinya dalam urin bergantung pada faktor-faktor sebagai berikut : cara pemakaian, lama dan seringnya penggunaan, fungsi organ, kecepatan metabolisme obat, kondisi fisik dari subyek, umur, jenis kelamin, waktu pengambilan sampel, pengenceran dll.
1. Tes Immunoassay (Card/Strip Test) a. Prinsip
Adanya zat tertentu dalam urin ditentukan secara Rapid Immunoassay (antigen-antibodi)
b. Alat Pipet
c. Reagen Card/Strip Test
d. Cara kerja
Siapkan Card/Strip Test untuk pemeriksaan masing-masing obat 1) Card Test
a) Teteskan 3 tetes spesimen urin pada lubang spesimen yang terdapat dalam masing-masing card test
b) Tunggu beberapa saat sesuai dengan petunjuk manual 2) Strip Test
a) Celupkan strip test ke dalam urin sampai batas yang ditentukan b) Tunggu beberapa saat sesuai dengan petunjuk manual
e. Pembacaan hasil 1) Card Test
a) Hasil - (negatif) bila tampak 2 garis pada huruf C dan T b) Hasil + (positif) bila tampak 1 garis pada huruf C
c) Atau sesuai petunjuk manualnya 2) Strip Test
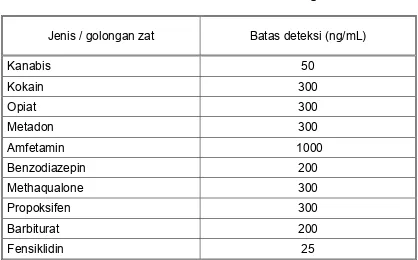
Pemilihan metode, peralatan serta reagen untuk skrining haruslah yang mempunyai batas deteksi sama atau lebih rendah dari batas deteksi/ cut off yang direkomendasikan pada Tabel IV.2 di bawah ini :
Tabel IV.2
Batas Deteksi Pemeriksaan Skrining
Jenis / golongan zat Batas deteksi (ng/mL)
Kanabis 50 Kokain 300 Opiat 300 Metadon 300
Amfetamin 1000
Benzodiazepin 200 Methaqualone 300 Propoksifen 300 Barbiturat 200 Fensiklidin 25
Menurut UK Laboratory Guidelines for Legally Defensible Workplace Drug Testing dan SAMHSA (Substance Abuse and Mental Health Services Administration) dari Amerika Serikat.
• Pemeriksaan skrining yang memberikan hasil negatif tidak dilanjutkan dengan pemeriksaan konfirmasi.
• Bila hasil pemeriksaan Card/Strip Test Positif belum menjamin + (positif) untuk spesimen yang diperiksa, pemeriksaan harus dilanjutkan dengan pemeriksaan Konfirmasi.
• Untuk pemeriksaan penyidikan/penegakan hukum, pemeriksaan konfirmasi yang diakui adalah yang menggunakan metoda GCMS/HPLC.
2. Reaksi warna
Pemeriksaan pendahuluan (Screening Test) dengan Reaksi Warna dapat dilakukan dengan beberapa metode sebagai berikut :
Untuk Golongan Narkotika dan Psikotropika a. Metode Marquis
b. Metode Mecke c. Metode Frohde d. Metode Simon
e. Metode Bratton Marshall f. Metoda Liebermann g. Metode Fast Blue B h. Tes Duquenois
Untuk pemeriksaan alkohol a. Kalium bikromat
b. Mikrodifusi c. Metanol d. Aseton
Pemeriksaan hanya untuk mengarahkan kemungkinan jenis zat yang terdapat dalam sampel, sehingga hasilnya harus dilanjutkan dengan tes konfirmasi karena zat selain Narkoba juga mempunyai kemungkinan memberikan hasil yang sama (false positif).
Untuk golongan benzodiazepin reaksi warna tidak dianjurkan untuk dipakai karena jenis zat dalam golongan ini yang sangat beragam, pemeriksaan skrining yang dianjurkan adalah Kromatografi Lapis Tipis (KLT). Zat yang digunakan untuk pereaksi harus dijaga mutunya untuk menjamin bahwa zat yang digunakan tidak mengalami dekomposisi, yang dapat merubah warnanya dan mengacaukan hasil pemeriksaan.
a. Metode Marquis 1) Prinsip
Pembentukan senyawa berwarna antara zat yang diperiksa dengan formaldehid dalam suasana asam sulfat pekat
2) Alat
a) Pipet tetes b) Pipet
3) Reagen
a) Pereaksi Marquis
8-10 tetes formaldehid 40 % diteteskan ke dalam 10 mL asam sulfat pekat
b) Eter
c) Natrium hidroksida (NaOH) 4 N d) Etanol 95 %
4) Cara Kerja
Untuk pemeriksaan urin
a) Masukkan 3 mL urin ke dalam tabung sentrifus b) Tambahkan NaOH 4 N sampai pH 9-10
c) Ekstraksi dengan 5 mL eter, masukkan dalam vortex mixer dan sentrifus
d) Ekstrak eter pisahkan dan uapkan sampai kering
e) Residu larutkan dalam 1 mL etanol 95 % (secukupnya), keringkan lagi
f) Tambahkan 1 tetes larutan pereaksi Untuk pemeriksaan sampel obat/makanan
Letakkan 1-2 mg sampel bubuk/1-2 tetes bila berbentuk cairan ke dalam lekukan plat tetes, tambahkan pereaksi, tak lebih dari 3 tetes.
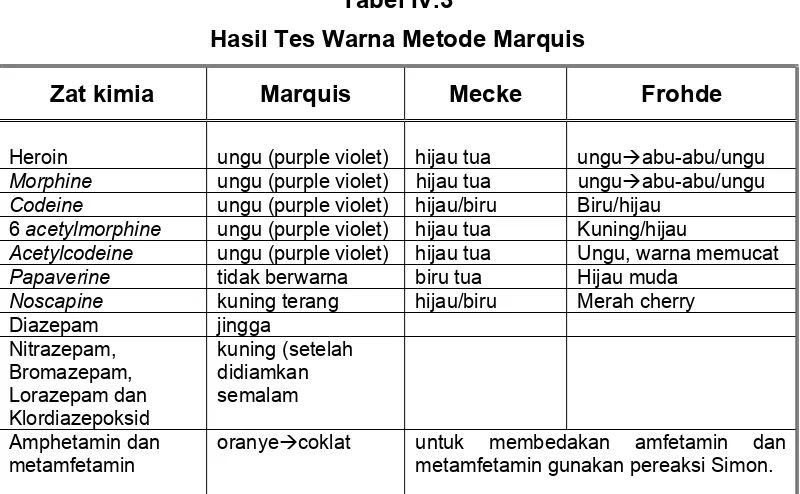
5) Pembacaan Hasil
Tabel IV.3
Hasil Tes Warna Metode Marquis
Zat kimia Marquis Mecke Frohde
Heroin ungu (purple violet) hijau tua unguÆabu-abu/ungu
Morphine ungu (purple violet) hijau tua unguÆabu-abu/ungu
Codeine ungu (purple violet) hijau/biru Biru/hijau 6 acetylmorphine ungu (purple violet) hijau tua Kuning/hijau
Acetylcodeine ungu (purple violet) hijau tua Ungu, warna memucat
Papaverine tidak berwarna biru tua Hijau muda
Noscapine kuning terang hijau/biru Merah cherry Diazepam jingga
Nitrazepam, Bromazepam, Lorazepam dan Klordiazepoksid
kuning (setelah didiamkan semalam
Amphetamin dan metamfetamin
b. Metode Mecke 1) Prinsip
Pembentukan senyawa berwarna antara zat yang diperiksa dengan asam selenius dalam suasana asam sulfat pekat
2) Alat
a) Pipet tetes b) Pipet
c) Vortex mixer (untuk urin) d) Sentrifus(untuk urin)
3) Reagen
a) Pereaksi Mecke : 0,25 gram asam selenius larutkan dalam 25 mL asam sulfat pekat panas
b) Eter (untuk urin)
c) Natrium hidroksida (NaOH) 4 N (untuk urin) d) Etanol 95 % (untuk urin).
4) Cara kerja
Lihat Metode Marquis
5) Pembacaan Hasil Lihat Metode Marquis
c. Metode Frohde 1) Prinsip
Pembentukan senyawa berwarna antara zat yang diperiksa dengan asam molibdat/natrium molibdat dalam suasana asam sulfat pekat
2) Alat
a) Pipet tetes b) Pipet
3) Reagen
a) Pereaksi Frohde :
1,0 gram asam molibdat/natrium molibdat larutkan dalam 100 mL asam sulfat pekat panas, larutan akhir haruslah tak berwarna
b) Eter (untuk urin)
c) Natrium hidroksida (NaOH) 4 N (untuk urin) d) Etanol 95 % (untuk urin).
4) Cara Kerja
Lihat Metode Marquis
5) Pembacaan Hasil Lihat Metode Marquis
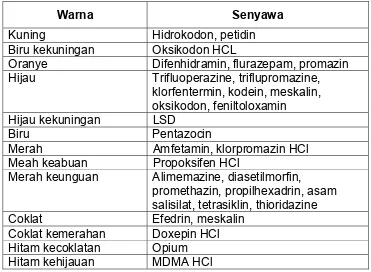
Tabel IV.4
Hasil Tes Warna Reagen Frohde
Warna Senyawa
Kuning Hidrokodon, petidin
Biru kekuningan Oksikodon HCL
Oranye Difenhidramin, flurazepam, promazin Hijau Trifluoperazine, triflupromazine,
klorfentermin, kodein, meskalin, oksikodon, feniltoloxamin
Hijau kekuningan LSD
Biru Pentazocin Merah Amfetamin, klorpromazin HCl Meah keabuan Propoksifen HCl
Merah keunguan Alimemazine, diasetilmorfin,
promethazin, propilhexadrin, asam salisilat, tetrasiklin, thioridazine
Coklat Efedrin, meskalin
Coklat kemerahan Doxepin HCl Hitam kecoklatan Opium Hitam kehijauan MDMA HCl
d) Metode Simon 1) Prinsip
2) Alat
a) Pipet tetes b) Pipet
c) Vortex mixer (untuk urin) d) Sentrifus (untuk urin)
3) Reagen
a) Pelarut I = 20 % larutan sodium karbonat akuos Pelarut II = 50 % larutan asetaldehida etanolik Pelarut III = 1 % larutan sodium nitroprusida akuos b) Eter (untuk urin)
c) Natrium hidroksida (NaOH) 4 N (untuk urin) d) Etanol 95 % (untuk urin).
4) Cara Kerja
1) Untuk pemeriksaan urin lakukan dulu seperti pada metode Marquis, langkah a-e
2) Letakkan sejumlah kecil sampel pada
lekukan plat tetes dan campurkan dengan larutan I satu tetes, lalu tambahkan 2 tetes larutan II, kemudian tambahkan beberapa tetes larutan III memberikan warna biru untuk metamfetamin dan amin sekunder lain. Amfetamin dan amin primer lain memberikan warna merah muda perlahan sampai merah cherry. Tes ini dapat membedakan amfetamin dan metamfetamin.
5) Pembacaan Hasil
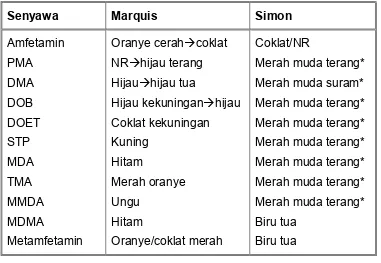
Tabel IV. 5
Reaksi Warna Untuk Derivat Amfetamin
Senyawa Marquis Simon
Amfetamin Oranye cerahÆcoklat Coklat/NR PMA NRÆhijau terang Merah muda terang*
DMA HijauÆhijau tua Merah muda suram*
DOB Hijau kekuninganÆhijau Merah muda terang* DOET Coklat kekuningan Merah muda terang*
STP Kuning Merah muda terang*
MDA Hitam Merah muda terang*
TMA Merah oranye Merah muda terang*
MMDA Ungu Merah muda terang*
MDMA Hitam Biru tua
Metamfetamin Oranye/coklat merah Biru tua
NR = no reaction/tidak bereaksi * = warna reagen, dianggap negatif e. Metode Bratton Marshall
1) Prinsip
Pembentukan senyawa berwarna violet dengan natrium nitrit dan asam sulfamat dalam suasana asam
2) Alat.
a) Tabung reaksi b) Pipet tetes
3) Reagen
a) Asam sulfat (H2SO4) 10 %
b) Natrium nitrit (NaNO2) 0,1 % harus dibuat baru c) Asam sulfamat 0,5 %
4) Cara Kerja
a) Ke dalam tabung reaksi masukkan 4 mL urin
b) Tambahkan 1 tetes H2SO4 10 % dan 1 tetes natrium nitrit 0,1 % c) Biarkan selama 0,5 menit
d) Tambahkan 1 tetes larutan asam sulfamat 0,5 % dan biarkan 0,5 menit
e) Teteskan larutan N-1 naftilendiamin dihidroklorid 0,1 %
5) Pembacaan Hasil
f. Metode Liebermann 1) Prinsip
Sampel yang diperiksa setelah diekstraksi dengan eter pada pH 3-4 (HCl 2 N), bereaksi dengan NaNO2 dalam suasana H2SO4 pekat membentuk senyawa berwarna. Tes dilakukan untuk memberi warna jelas pada fenol.
2) Alat
a) Tabung reaksi b) Sentrifus c) Waterbath d) Pipet tetes e) Pipet ukur
3) Reagen a) HCl 2 N b) Eter
c) Pereaksi Liebermann
d) 1g NaNO2 atau KNO2 dalam 10 mL H2SO4 pekat
4) Cara Kerja
a) Ke dalam tabung reaksi masukkan 2 mL urin kemudian tambahkan HCl 2 N sampai pH 3-4
b) Ekstraksi dengan 5 mL eter selama 15 menit c) Kemudian sentrifus selama 5 menit
d) Keringkan ekstrak di waterbath
5) Pembacaan Hasil
Contoh pada tabel berikut (lengkapnya baca Clarke’s Analysis of Drugs and Poisons)
Warna Senyawa MerahÆoranye Phenylmethylbarbituric acid
Coklat Haloperidol Hitam Diamorfin/heroin
g. Metode Garam Fast Blue B (1) 1) Prinsip
Sampel diekstraksi dengan petroleum eter, kemudian direaksikan dengan Garam Fast Blue B membentuk senyawa berwarna
2) Alat
a) Kertas saring b) Spatel
c) Pipet tetes
3) Reagen
a) Reagen padat : Garam Fast Blue B (di-o-anisidinetetrazolium klorida)
encerkan Garam Fast Blue B dengan natrium sulfat anhidrous (1 :100)
b) Larutan I : Petroleum eter
Larutan II : Larutan cair dari natrium bikarbonat 10 % (w/w)
4) Cara Kerja
a) Lipat 2 kertas saring menjadi seperempat, buka sebagian untuk membentuk corong
b) Letakkan sejumlah kecil bubuk tanaman kanabis atau resin atau setetes kecil kanabis cair pada bagian tengah kertas sebelah atas
c) Tambahkan 2 tetes larutan 1
d) Biarkan cairan sampai menembus kertas sebelah bawah e) Pisahkan kedua kertas saring
f) Buang kertas bagian atas dan biarkan kertas bagian bawah mengering
5) Pembacaan Hasil
Warna noda merah keunguan pada bagian tengah kertas saring menunjukkan adanya kanabis, warna ini adalah kombinasi bermacam warna dari berbagai kanabinoid yang berbeda yang adalah komponen mayor dari kanabis; THC=merah, CBN = ungu, CBD = oranye.
Catatan :
1. Reagen padat berwarna putih/putih kekuningan saat baru dibuat. Simpan reagen dalam kantong plastik pada tempat kering dingin, dianjurkan di dalam freezer. Jika reagen terdekomposisi, ia akan berubah warna menjadi keabuan dan harus dibuang.
2. Fast Blue B bersifat potensial karsinogenik, dianjurkan menggantinya dengan dye Fast blue B.
3. Untuk meningkatkan spesifisitas tes, sangatlah penting untuk menggunakan materi yang diperiksa sesedikit mungkin, tak lebih dari ujung korek api dan menggunakan 2 kertas saring. Kertas saring sebelah atas yang dibuang sebelum terjadinya warna, mencegah ekstraksi kembali dyes yang ada pada materi tanaman sebelum mencapai kertas saring bawah dan menghasilkan reaksi positif palsu.
4. Larutan 2 menghasilkan kondisi basa yang akan meningkatkan intensitas reaksi warna antara kanabinoid dan garam Fast Blue B.
g. Metode Garam Fast Blue B (2) 1) Prinsip
Sampel diekstraksi dengan kloroform, kemudian direaksikan dengan Garam Fast Blue B membentuk senyawa berwarna
2) Alat
a) Tabung reaksi b) Spatel
c) Pipet tetes d) Pipet ukur
3) Reagen
a) Reagen padat : Garam Fast Blue B (di-o-anisidinetetrazolium klorida)
Encerkan Garam Fast Blue B dengan natrium sulfat anhidrous (2,5 :100)
b) Larutan I : Kloroform
4) Cara Kerja
a) Letakkan sejumlah kecil zat yang akan diperiksa dalam tabung reaksi
b) Tambahkan sedikit sekali reagen padat dan 1 mL larutan I c) Kocok tabung selama 1 menit
d) Tambahkan 1 mL larutan II
e) Kocok tabung reaksi selama 2 menit f) Tegakkan tabung rekasi selama 2 menit
5) Pembacaan Hasil
Warna, seperti pada metode I, pada lapisan cairan kloroform bagian bawah menunjukkan hasil positif. Warna dari lapisan atas diabaikan.
Catatan :
Perhatikan catatan di atas.
i. Tes Duquenois 1) Prinsip
Cuplikan bereaksi dengan asetaldehid/vanilin dalam suasana asam sehingga terjadi perubahan warna yang larut dalam kloroform.
2) Alat
a) Tabung reaksi b) Pipet tetes c) Vorteks Mixer
3) Reagen
a) Larutan I: Lima tetes asetaldehida dan 0,4 g vanilin dilarutkan dalam 20 mL etanol 95 %
b) Larutan II : Asam Hidroklorida pekat c) Larutan III : Kloroform
Catatan
Larutan I harus disimpan dalam tempat gelap dan dingin, buang bila ada perubahan warna menjadi kuning tua
4) Cara kerja
a) Masukkan sedikit zat yang akan diperiksa ke dalam tabung reaksi
d) Biarkan selama 10 menit, jika muncul warna, tambahkan 2 mL larutan III.
5) Pembacaan Hasil
Jika lapisan bagian bawah (kloroform) menjadi berwarna ungu violet, menunjukkan adanya produk kanabis.
j. Kalium Bikromat 1) Prinsip
Terbentuknya warna hijau hasil oksidasi antara etanol dalam spesimen urin dengan kalium bikromat dalam suasana asam.
2) Alat
a) Kertas saring Whatman (Glass-Fibre filter paper) b) Tabung reaksi
c) Penangas air
3) Reagen
a) Larutan kalium bikromat (K2Cr2O7) 2,5 % b) Asam sulfat (H2SO4) 50 %
4) Cara Kerja
a) Masukkan 5 mL spesimen urin dalam tabung reaksi, lalu tutup b) Pada kertas saring teteskan K2Cr2O7 tambahkan H2SO4 c) Masukkan kertas saring tersebut dibagian atas leher tabung d) Sumbat mulut tabung dengan gabus dan panaskan pada
penangas air suhu 100° C selama 2 menit
5) Interpretasi Hasil
a) Perubahan warna dari kuning menjadi hijau menandakan alkohol positif.
b) Etanol memberikan reaksi positif bila kadarnya lebih dari 40 mg %.
k. Mikrodifusi 1) Prinsip
2) Alat
a) Cawan Conway b) Pipet ukur
3) Reagen
Kalium bikromat
0,5 g Kalium bikromat dalam 100 ml asam sulfat 60 %
4) Cara Kerja
a) Tempatkan spesimen di bagian tepi cawan sampai tertutup dasarnya
b) Tambahkan beberapa ml kalium bikromat di sekitar tempat spesimen tersebut.
c) Tutup rapat cawan tersebut dan inkubasi pada suhu 37° C selama 1 jam
5) Interpretasi Hasil
Warna kalium bikromat akan berubah dari kuning menjadi hijau selanjutnya menjadi biru.
l. Metanol
1) Prinsip
Terbentuknya warna hijau hasil oksidasi antara etanol dengan kalium bikromat dalam suasana asam.
3) Alat
a) Tabung reaksi b) Pipet tetes
4) Reagen
a) Larutan kalium bikromat (K2Cr2O7) 2,5 % dalam asam sulfat (H2SO4) 50 %
b) Asam kromotropat c) Etanol
4) Cara Kerja
1) Ke dalam 1 ml urin, tambahkan 1 tetes K2Cr2O7 2,5 % dalam (H2SO4) 50 %
2) Biarkan pada suhu kamar selama 5 menit
3) Tambahkan 1 tetes etanol dan beberapa mg asam kromotropat 4) Tambah H2SO4 sehingga timbul suatu lapisan pada dasar
5) Interpretasi hasil
Warna ungu pada lapisan pemisah menunjukkan adanya metanol. Catatan : formaldehid akan memberikan reaksi positif pada uji ini. m. Aseton (spesimen darah, urin dan cairan tubuh lain)
1) Prinsip
Terbentuknya warna violet
2) Alat
Tabung reaksi
3) Reagen
Tablet acetest (ames Co) atau produk lain yang sejenis
4) Cara Kerja
Teteskan beberapa tetes darah dan urin pada tablet acetest biarkan selama 1-10 menit
5) Interpretasi Hasil
Warna violet menandakan aseton positif, dengan sensitivitas reaksi = 100 ppm
3. Uji kelarutan /Anion tes Prinsip :
Menggunakan kelarutan dikombinasi dengan beberapa reaksi tertentu di mana hasilnya ditentukan dengan adanya presipitat/endapan.
Tes anion dapat dilakukan untuk sampel opiat dengan pengecualian opium mentah. Morfin biasa didapat dalam bentuk garam hidroklorida, garam sulfat, basa bebas, terkadang garam tartrat. Heroin biasa terdapat dalam bentuk basa bebas atau garam hidroklorida.
Basa
Basa Heroin larut dalam CCl4, tetapi garam heroin jenis lain tidak larut sama sekali. Basa morfin tidak larut dalam air dan larut sedikit dalam benzene dan kloroform.
Garam hidroklorida
benzene, basanya larut sebagian dalam kedua pelarut. Jika klorida larut air di reaksikan dengan pelarut perak nitrat dan setelah endapan dicuci dengan air, menjadi larut dalam larutan ammonia encer yang lalu dapat diendapkan kembali dengan penambahan asam nitrit.
Garam Sulfat
Morfin sulfat larut dalam air. Ketika garam sulfar yang telah dicampur air direaksikan dengan larutan barium klorida terbentuk endapan putih yang tidak larut dalam HCl.
Garam Tartrat
Heroin tartrat tidak larut dalam metilen klorida atau kloroform tetapi larut dalam metanol. Morfin tartrat larut dalam air sedangkan asam morfin tartrat hanya sedikit larut dalam air. Perak nitrat akan membentuk endapan putih ketika dicampur dengan larutan air bercampur asam tartarik bebas atau garam tartrat. Endapan larut dalam asam nitrit. Merah kongo akan memberikan hasil negatif dengan garam tartrat tetapi membentuk warna biru bila terdapat asam bebas (merah kongo akan memberikan hasil positif juga bila terdapat asam salisilat.)
Garam sitrat
Heroin sitrat tidak larut dalam metilen klotida atau kloroform tetapi larut dalam metanol. Perak nitrat akan Perak nitrat akan membentuk endapan putih ketika dicampur dengan larutan air bercampur asam sitrat bebas atau garam sitrat. Endapan larut dalam asam nitrit. Asetik anhidrida dapat digunakan untuk pemeriksaan sitrat dan asam sitrat bebas. Pemeriksaan melibatkan penambahan 0,5 mL asetik anhidrida pada sedikit sampel dalam tabung tes dan memanaskan tabung pada 80O C selama 10 menit. Warna ungu akan terjadi bila terdapat garam sitrat dan asam sitrat bebas bersama amin tertier, misalnya heroin.
4. Analysis Melting Point/titik lebur
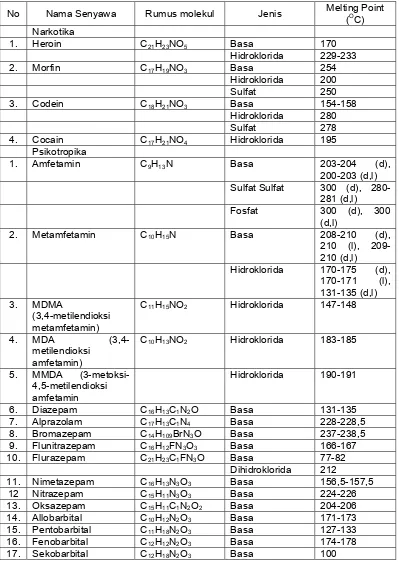
Tabel IV.6
Titik Lebur (Melting Point)
Senyawa Yang Tergolong Narkotika Dan Psikotropika
No Nama Senyawa Rumus molekul Jenis Melting Point (OC)
Narkotika
1. Heroin C21H23NO5 Basa 170
Hidroklorida 229-233
2. Morfin C17H19NO3 Basa 254
Hidroklorida 200
Sulfat 250
3. Codein C18H21NO3 Basa 154-158
Hidroklorida 280
Sulfat 278
4. Cocain C17H21NO4 Hidroklorida 195
Psikotropika
1. Amfetamin C9H13N Basa 203-204 (d),
200-203 (d,l) Sulfat Sulfat 300 (d),
280-281 (d,l)
Fosfat 300 (d), 300
(d,l)
2. Metamfetamin C10H15N Basa 208-210 (d), 210 (l),
209-210 (d,l)
Hidroklorida 170-175 (d),
170-171 (l), 131-135 (d,l) 3. MDMA
(3,4-metilendioksi metamfetamin)
C11H15NO2 Hidroklorida 147-148
4. MDA (3,4-metilendioksi
amfetamin)
C10H13NO2 Hidroklorida 183-185
5. MMDA (3-metoksi-4,5-metilendioksi amfetamin
Hidroklorida 190-191
6. Diazepam C16H13C1N2O Basa 131-135 7. Alprazolam C17H13C1N4 Basa 228-228,5 8. Bromazepam C14H109BrN3O Basa 237-238,5 9. Flunitrazepam C16H12FN3O3 Basa 166-167 10. Flurazepam C21H23C1FN3O Basa 77-82
Dihidroklorida 212
*sumber: Recommended Methods for Testing Manual for Use By National Narcotics Laboratories, United Nations 1989
5. Pemeriksaan fraksi-fraksi dengan metode pemeriksaan KLT a. Prinsip
Residu hasil ekstraksi dielusi dengan eluen tertentu sehingga terbentuk noda (spot) dengan warna khas yang akan dibandingkan Rfnya berdasarkan perbandingan Rf spesimen terhadap Rf Standar.
b. Peralatan 1) Alat KLT
a) Plat KLT (20 x 20 cm, 10 x 10 cm, 10 x 5 cm) b) Bejana Kromatografi
c) Pipa Kapiler, pipet mikro d) Botol semprot sprayer 2) Oven
3) Lampu UV 4) pH meter 5) Sentrifus
c. Reagen
1) Eluen : dipilih salah satu dari berbagai campuran sistem eluen. 2) Larutan penampak noda : dipilih sesuai dengan hasil ekstrak dari
spesimennya.
Hasil ekstrak basa (spesimen darah/serum plasma) menggunakan salah satu reagen di bawah ini :
a) Mandelin’s Reagen
Larutan 0,59 g amonium vanadat dalam 1,5 mL akuades dan encerkan sampai 100 mL dengan H2SO4. Saring larutan dengan glass wool
b) Larutan asam iodoplatinat
Larutkan 0,25 g reagen platina klorida dan 5 g kalium iodida dalam 100 mL akuades, tambahkan 2 mL asam klorida. Campur baik-baik.
Hasil ekstrak asam dan netral (spesimen urin/cairan lambung) menggunakan salah satu reagen di bawah ini:
a) Merkuro nitrat
Ke dalam larutan merkuro nitrat tambah natrium bikarbonat sampai busa berhenti dan endapan berwarna kuning.
Endapan akan berubah warna menjadi warna biscuitvii). Reagen disiapkan harus dalam keadaan segar, kocok sebelum digunakan dan simpan tidak boleh lebih dari 1 jam.
b) Merkuri klorida-diphenilkarbason
d. Cara kerja
1) Ekstrak basa
a) Ekstrak dari fraksi B, C, D larutkan masing-masing pada 100 µL CHCl3. Buat larutan standar dari zat yang diduga. Kemudian ambil 10 µL larutan standar dan 25 µL larutan spesimen, totolkan dengan jarak 2 cm pada plat dengan menggunakan pipet kapiler (dalam satu plat dapat ditotolkan beberapa spesimen dan beberapa standar).
b) Plat setelah ditotolkan elusi dalam bejana menggunakan elusi sistem A, B atau C.
- Sistem A : - Metanol - Amonia pekat
100 1,5 - Sistem B : - Sikloheksan
- Toluen - Dietilamin
75 15 10 - Sistem C : - kloroform
- Metanol
90 10
c) Keluarkan plat dari bejana elusi, kemudian plat dikeringkan sebelum disemprot dengan larutan penampak noda
d) Plat dapat dikeringkan pada suhu kamar atau pada oven dengan suhu 120° C selama 10 menit atau menggunakan udara panas dari blower.
e) Plat disemprot dengan penampak noda yang sesuai dengan table IV.7
f) Plat dikeringkan pada udara terbuka 2) Ekstrak asam dan netral
a) Ekstrak dari fraksi A, B, C larutkan masing-masing pada 100 µL CHCl3. Buat larutan standar dari zat yang diduga. Kemudian ambil 10 µL larutan standar dan 25 µL larutan spesimen, totolkan dengan jarak 2 cm pada plat dengan menggunakan pipet kapiler (dalam satu plat dapat ditotolkan beberapa spesimen dan beberapa standar)
b) Plate setelah ditotolkan dielusi dalam bejana elusi menggunakan elusi sistem D, E atau F.
- Sistem D : - Chloroform - Aseton
4 1 - Sistem E : - Etil Asetat
- Metanol - Amonia pekat
85 10 5 - Sistem F : Etil Asetat
c) Keluarkan plat dari bejana elusi, kemudian plat keringkan semprot dengan larutan penampak noda.
e) Plat disemprot dengan penampak noda yang sesuai dengan Tabel IV.8 .
f) Plat dikeringkan pada udara terbuka
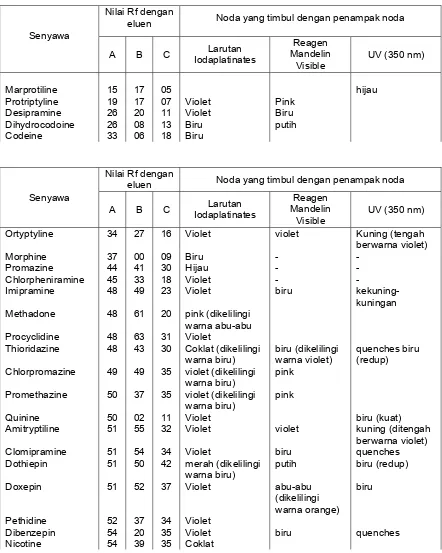
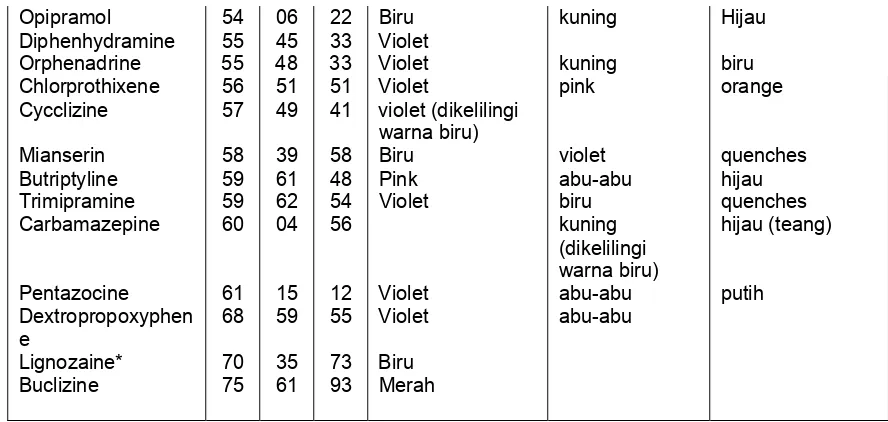
Tabel IV.7
Data Hasil KLT Untuk Hasil Ekstrak Dalam Suasana Basa Nilai Rf dengan
eluen Noda yang timbul dengan penampak noda Senyawa
A B C Larutan Iodaplatinates
Reagen Mandelin
Visible
UV (350 nm)
Marprotiline 15 17 05 hijau
Protriptyline 19 17 07 Violet Pink Desipramine 26 20 11 Violet Biru Dihydrocodoine 26 08 13 Biru putih Codeine 33 06 18 Biru
Nilai Rf dengan
eluen Noda yang timbul dengan penampak noda Senyawa
A B C Larutan Iodaplatinates
Reagen Mandelin
Visible
UV (350 nm)
Ortyptyline 34 27 16 Violet violet Kuning (tengah berwarna violet)
Morphine 37 00 09 Biru - -
Promazine 44 41 30 Hijau - -
Chlorpheniramine 45 33 18 Violet - - Imipramine 48 49 23 Violet biru
kekuning-kuningan Methadone 48 61 20 pink (dikelilingi
warna abu-abu Procyclidine 48 63 31 Violet
Thioridazine 48 43 30 Coklat (dikelilingi warna biru)
biru (dikelilingi warna violet)
quenches biru (redup) Chlorpromazine 49 49 35 violet (dikelilingi
warna biru)
pink
Promethazine 50 37 35 violet (dikelilingi warna biru)
pink
Quinine 50 02 11 Violet biru (kuat)
Amitryptiline 51 55 32 Violet violet kuning (ditengah berwarna violet) Clomipramine 51 54 34 Violet biru quenches Dothiepin 51 50 42 merah (dikelilingi
warna biru)
putih biru (redup)
Doxepin 51 52 37 Violet abu-abu (dikelilingi warna orange)
biru
Pethidine 52 37 34 Violet
Opipramol 54 06 22 Biru kuning Hijau Diphenhydramine 55 45 33 Violet
Orphenadrine 55 48 33 Violet kuning biru Chlorprothixene 56 51 51 Violet pink orange Cycclizine 57 49 41 violet (dikelilingi
warna biru)
Mianserin 58 39 58 Biru violet quenches Butriptyline 59 61 48 Pink abu-abu hijau Trimipramine 59 62 54 Violet biru quenches Carbamazepine 60 04 56 kuning
(dikelilingi warna biru)
hijau (teang)
Pentazocine 61 15 12 Violet abu-abu putih Dextropropoxyphen
e
68 59 55 Violet abu-abu
Lignozaine* 70 35 73 Biru Buclizine 75 61 93 Merah
* Lignocaine digunakan sebagai anastesi local pada kateter, spesimen urin bias terkontaminasi.
Tabel IV.8
Data Hasil KLT Untuk Hasil Ekstrak Dalam Suasana Asam dan Netral Nilai Rf dengan
eluen Sistem Larutan Penampak Noda Senyawa
D E F
Merkuri klorid diphenil carbazone
Merkuri nitrat spray
Primadone 08 39 26 + +
Meprobamate* 09 60 34 - -
Parasetamol 15 45 34
Phenytoin 33 36 53 + +
Salicylamide 38 46 55
Barbitone 41 31 61 + +
Phenobarbitone 47 28 65 + +
Cyclobarbitone 50 35 64 + +
Butobarbiton 50 38 65 + +
Heptabarbitone 50 30 65 + +
Amylobarbitone 52 36 65 + +
Pentabarbitone 55 45 66 + +
Quinalbarbitone 56 44 68 + +
Glutethimide+ 63 78 62 + +
Methaqualone++ 63 - - - -
6) Pembacaan hasil
• Bandingkan warna, bentuk noda (spot) dan nilai Rf hasil ekstrak dengan Standar.
C. Pemeriksaan Konfirmasi
Pemeriksaan konfirmasi adalah suatu pemeriksaan lanjutan yang lebih akurat karena hasil yang dikeluarkan sudah definitif menunjukkan jenis zat narkotika psikotropika yang terkandung di dalam sampel tersebut. Pemeriksaan dilakukan apabila hasil pemeriksaan pendahuluan (screening test) memberi hasil positif.
Batas Deteksi Pemeriksaan Konfirmasi
Jenis / golongan zat Jenis zat Batas deteksi (ng/mL)
Kanabis Delta-9- Asam THC 15
Kokain Benzoylecgonine 150
Opiat Kodein 300
Morfin 300
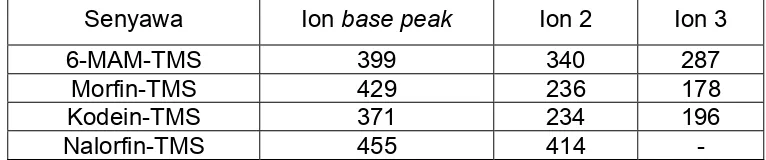
6-MAM (Heroin) 10
Dihydrokodein 300
Metadon Metadon 250
EDDP 250
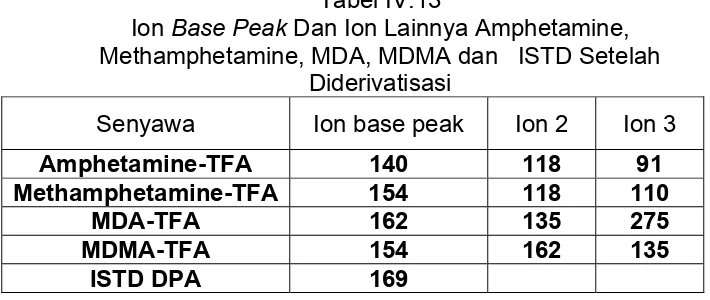
Amfetamin Amfetamin 500
Metil Amfetamin 500
MDA,MDMA,MDEA 200
Benzodiazepin Oxazepam 100
7-Amino Nitrazepam 100
Temazepam 100
Nordiazepam 100
Methaqualone Methaqualone 300
Propoksifen Propoksifen 300
Nor propoksifen 300
Barbiturat Barbiturat 150
Fensiklidin Fensiklidin 25
1. Pemeriksaan ganja dalam cuplikan
a. Kromatografi Lapis Tipis (KLT)
1) Prinsip
Sampel diekstraksi dengan metanol, elusi menggunakan eluen tertentu, sehingga terbentuk noda dengan Rf tertentu. Noda
discanning dengan spektrodensitometer, sehingga terbentuk
spektrum serapan sinar ultraviolet sebelum akhirnya noda pada pelat disemprot menggunakan penyemprot tertentu. Rf spektrum serapan sinar ultraviolet dan warna noda hasil penyemprotan dari sampel dibandingkan terhadap baku pembanding.
2) Alat
a) Peralatan kromatografi lapis tipis (KLT) terdiri dari : - Pipet kapiler
- Plat KLT dilapisi silika gel berfluoresensi pada λ 254 nm dengan ketebalan 0,25 mm
- Tabung elusi (developing tank) - Lampu UV λ 254 nm
b) Spektrofotodensitometer
3) Reagen
a) Pelarut organik : toluen, petroleum eter, dietil eter, sikloheksan, diisopropil eter, dietilamin.
b) Larutan Sampel
Tanaman ganja (Cannabis plant, Cannabis herba)
± 400 mg cuplikan yang telah diserbuk haluskan, masukkan ke dalam Erlenmeyer bertutup, tambah 10 mLpetroleum eter atau toluen, dan kocok selama 1 jam, kemudian saring. Bila perlu tambahkan lagi pelarut hingga diperoleh volume 10 mL (A1) Damar ganja (Cannabis resin)
± 100 mg damar ganja dalam mortir, gerus dengan ± 2 mL toluen sampai terbentuk pasta. Dengan bantuan 8 mL toluen masukkan ke dalam Erlenmeyer bertutup, kocok selama 1 jam dan saring (A2).
Hasis (Hasis oil, Cannabis oil)
± 50 mg hasis larutkan dalam 10 mL toluen (A3).
c) Larutan Baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
- ∆9 tetrahidrokanabinol 0,5 mg/mL (B1)
- Kanabinol 0,5 mg/mL (B2)
Alternatif lain : buat ekstrak dari tanaman ganja pembanding, damar ganja pembanding atau hasis pembanding yang disiapkan seperti larutan sampel.
d) Penampak noda Fast Blue B Penampak noda Fast Blue B
50 mg garam Fast Blue B kocok dalam 1 mL air, tambah 20 mL metanol, kocok kembali sehingga semua garam larut.
4) Cara Kerja
Larutan A, B1, B2 dan B3 masing-masing ditotolkan pada pelat
secara terpisah dan dilakukan kromatografi lapis tipis dengan kondisi sebagai berikut :
Fase diam : Silika gel GF 254 Fase gerak : 1. Toluen
2. Petroleum eter – dietil eter (80 : 20) 3. Sikloheksan–diisopropileter–dietilamin (52 : 40 : 8)
Volume penotolan : 1. Larutan A dilakukan 2 kali penotolan masing-masing 20 µl dan 50 µL
2. Larutan B1, B2 dan B3 masing-masing
10 µL
3. Apabila digunakan tanaman ganja pembanding, damar ganja pembanding atau hasis pembanding, masing-masing totokan 20 µL
Jarak rambat : 15 cm
Penampak noda : 1. Sinar ultraviolet λ 254 nm, noda berwarna ungu
2. Larutan garam Fast Blue B, noda berwarna ungu kemerahan
Interpretasi Hasil :
Cuplikan mengandung ganja bila larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan B1, B2 dan atau B3.
Catatan :
Gunakan salah satu fasa gerak yang tercantum dalam metode, fasa gerak yang lain gunakan sebagai konfirmasi.
b. Kromatografi Gas (KG)
1) Prinsip
waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding
2) Alat
Kromatografi gas
3) Reagen
a) Pelarut toluen b) Larutan sampel
Tanaman ganja (Cannabis plant, Cannabis herba)
± 400 mg cuplikan yang telah diserbukhaluskan, masukkan ke dalam Erlenmeyer bertutup, tambah 10 mL petroleum eter atau toluen, dan kocok selama 1 jam, kemudian saring. Bila perlu tambahkan lagi pelarut hingga diperoleh volume 10 mL (A1)
Damar ganja (Cannabis resin)
± 100 mg damar ganja dalam mortir, gerus dengan ± 2 mL toluen sampai terbentuk pasta. Dengan bantuan 8 mL toluen masukkan ke dalam Erlenmeyer bertutup, kocok selama 1 jam dan saring (A2).
Hasis (Hasis oil, Cannabis oil)
± 50 mg hasis larutkan dalam 10 mL toluen (A3)
c) Larutan baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
- ∧9 tetrahidrokanabinol 0,5 mg/mL (B1)
- Kanabinol 0,5 mg/mL (B2)
- Kanabidiol 0,5 mg/mL (B3)
Alternatif lain : buat ekstrak dari tanaman ganja pembanding, damar ganja pembanding atau hasis pembanding yang disiapkan seperti larutan sample
4) Cara Kerja
Suntikkan masing-masing larutan A1, A2, A3, B1, B2 dan B3 secara
terpisah ke dalam kromatografi gas dengan kondisi sebagai berikut :
Kolom : Kaca, panjang 2 m, diameter dalam 2 mm, isi kolom 3 % OV-17 atau yang sesuai, ukuran isi kolom 80/100, kolom penyangga kromosorb.
Detektor : Ionisasi nyala (FID)
Suhu : Detektor 2800 C, injektor 2800 C, kolom 2400 C
Gas pembawa : Nitrogen
Laju aliran fase gerak : 40 - 60 mL/menit
1- 3 µL
Interpretasi hasil
Cuplikan mengandung ganja jika pada larutan A terdapat spektrum dengan waktu retensi yang sama dengan waktu retensi larutan baku (B1, B2 atau B3). Jika larutan A dicampur dengan larutan B1
atau B2 atau B3 dan diinjeksikan ke sistem kromatografi maka akan
terbentuk satu spektrum utama yang sama.
2. Pemeriksaan Heroin dalam cuplikan
a. Kromatografi Lapis Tipis (KLT)
1) Prinsip :
Sampel diekstraksi dengan metanol, elusi menggunakan eluen tertentu, sehingga terbentuk noda dengan Rf tertentu. Noda
discanning dengan spektrodensitometer, sehingga terbentuk
spektrum serapan sinar ultraviolet sebelum akhirnya noda pada pelat disemprot menggunakan penyemprot tertentu. Rf spektrum serapan sinar ultraviolet dan warna noda hasil penyemprotan dari sampel dibandingkan terhadap baku pembanding.
2) Alat
a) Peralatan kromatografi lapis tipis (KLT) terdiri dari : (1) Pipet kapiler
(2) Plat KLT dilapisi silika gel berfluoresensi pada λ 254 nm dengan ketebalan 0,25 mm
(3) Tabung elusi (developing tank) (4) Lampu UV λ 254 nm
b) Spektrofotodensitometer
3) Reagen
a) Pelarut organik : metanol, amoniak, benzen, dioksan, asam asetat.
b) Larutan Sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku
Buat larutan baku pembanding heroin dalam metanol dengan konsentrasi 1 mg/mL (B)
d) Penampak noda iodoplatinat asam
0,25 g platina klorida dan 5 g kalium iodida larutkan dalam 100 mL air, kemudian tambah 5 mL asam klorida.
(1) 2 g bismuth subnitrat campur dengan 25 mL asam asetat dan 100 mL air.
(2) 40 g kalium iodida larutkan dalam 100 mL air.
10 mL larutan (1) dan 10 mL larutan (2) campur dengan 20 mL asam asetat glasial dan 100 mL air.
4) Cara Kerja
Larutan A dan B masing-masing ditotolkan secara terpisah pada pelat dan dilakukan kromatografi lapis tipis dengan kondisi sebagai berikut :
Fase diam : Silika gel GF 254
Fase gerak : 1. Metanol : amoniak (100 : 1,5)
2. Amoniak – benzen – dioksan (50 : 40 : 5) 3. Asam asetat – metanol – air (30 : 60 : 10) Volume penotolan : Larutan A dan B masing-masing 20 µL Jarak rambat : 15 cm
Penampak noda : 1. Sinar ultraviolet λ 254 nm, noda berwarna ungu
2. Larutan iodoplatinat asam, noda berwarna ungu
3. Larutan Dragendorff, noda berwarna jingga.
Konfirmasi :
Sebelum pelat disemprot dengan penampak noda, lakukan pengukuran spektrum serapan ultra violet terhadap noda sampel yang mempunyai harga Rf atau tinggi noda yang sama dengan salah satu noda baku menggunakan alat spektrodensitometer. Interpretasi Hasil :
Cuplikan mengandung heroin bila :
- Larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan baku heroin (B).
- Profil spektrum serapan ultraviolet noda sampel sesuai dengan spektrum serapan ultraviolet noda baku heroin serta panjang gelombang serapan maksimum noda sampel dan baku berimpit. Catatan :
- Gunakan salah satu fasa gerak yang tercantum dalam metode, fasa gerak yang lain gunakan sebagai konfirmasi.
b. Kromatografi Gas (KG)
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi gas, kemudian deteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding
2) Alat
Kromatografi gas
3) Reagen a) Metanol
b) Larutan sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku Larutan Baku
Baku pembanding heroin larutkan dalam metanol hingga diperoleh kadar 1 mg/mL (B)
4) Cara Kerja
Suntikkan masing-masing larutan A dan B secara terpisah ke dalam kromatografi gas dengan kondisi sebagai berikut :
Kolom : Kaca, panjang 2 m, diameter dalam 2 mm, isi kolom 5 % OV-1 atau yang sesuai, ukuran isi kolom 80/100, kolom penyangga kromosorb.
Detektor : Ionisasi nyala (FID)
Suhu : Detektor 2750 C, injektor 2750 C, kolom 2100 C
Gas pembawa : Nitrogen
Laju aliran fase gerak : 40 - 60 mL/menit Volume penyuntikkan
: Larutan A dan Bmasing-masing 1 µL
Interpretasi hasil
c. Kromatografi Cair Kinerja Tinggi (KCKT))
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi cair kinerja tinggi, kemudian dideteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding.
2) Alat
Kromatografi Cair Kinerja Tinggi (KCKT)
3) Reagen
a) Metanol
b) Ammonium asetat 0,045 M c) Larutan sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
d) Larutan Baku Larutan Baku
Baku pembanding heroin larutkan dalam metanol hingga diperoleh kadar 1 mg/mL (B)
4) Cara Kerja
Suntikkan masing-masing larutan A dan B secara terpisah ke dalam HPLC dengan kondisi sebagai berikut :
Kolom : C-18
Fasa gerak : Asetonitril – air – trietilamin (60 : 40 : 0,1)
Detektor : Ultra violet λ 254 nm Laju aliran fase gerak : 1,0 mL/menit
Volume penyuntikkan : Larutan A dan B masing-masing 20 µL
Interpretasi Hasil
3. Pemeriksaan Kokain dalam cuplikan
a. Kromatografi Lapis Tipis (KLT)
1) Prinsip
Sampel diekstraksi dengan metanol, elusi menggunakan eluen tertentu, sehingga terbentuk noda dengan Rf tertentu. Noda
discanning dengan spektrodensitometer, sehingga terbentuk
spektrum serapan sinar ultraviolet sebelum akhirnya noda pada pelat disemprot menggunakan penyemprot tertentu. Rf spektrum serapan sinar ultraviolet dan warna noda hasil penyemprotan dari sampel dibandingkan terhadap baku pembanding.
2) Alat
a) Peralatan kromatografi lapis tipis (KLT) terdiri dari : (1) Pipet kapiler
(2) Plat KLT dilapisi silika gel berfluoresensi pada λ 254 nm dengan ketebalan 0,25 mm
(3) Tabung elusi (developing tank) (4) Lampu UV λ 254 nm
b) Spektrofotodensitometer
3) Reagen
a) Pelarut organik : metanol, kloroform, aseton, sikoloheksan, toluen, dietiamin.
b) Larutan Sampel
Satu dosis sampel (atau lebih kurang 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku
Buat larutan baku pembanding kokain hidroklorida dalam metanol dengan konsentrasi 1 mg/mL (B).
d) Penampak noda iodoplatinat asam
0,25 g platina klorida dan 5 g kalium iodida larutkan dalam 100 mL air, kemudian tambah 5 mL asam klorida.
e) Penampak noda Dragendorff
(1) 2 g bismuth subnitrat campur dengan 25 mL asam asetat dan 100 mL air.
(2) 40 g kalium iodida larutkan dalam 100 mL air.
10 mL larutan (1) dan 10 mL larutan (2) campur dengan 20 mL asam asetat glasial dan 100 mL air.
4) Cara Kerja
Fase diam : Silika gel GF 254
Fase gerak : 1. Metanol - amoniak (100 : 1,5) 2. Etil asetat - metanol – amoniak (85 : 10 : 5)
3. Kloroform - metanol (9 : 1)
Volume penotolan : Larutan A dan B masing-masing 20 uL. Jarak rambat : 15 cm
Penampak noda : 1. Sinar ultraviolet λ 254 nm, noda berwarna ungu.
2. Larutan iodoplatinat asam, noda berwarna ungu
3. Larutan Dragendorff, noda berwarna jingga.
Konfirmasi :
Sebelum pelat disemprot dengan penampak noda, dilakukan pengukuran spektrum serapan ultra violet terhadap noda sampel yang mempunyai harga Rf atau tinggi noda yang sama dengan salah satu noda baku menggunakan alat spektrodensitometer.
Interpretasi Hasil :
Cuplikan mengandung kokain bila :
- Larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan baku kokain (B1).
- Profil spektrum serapan ultraviolet noda sampel sesuai dengan spektrum serapan ultraviolet noda baku kokain serta panjang gelombang serapan maksimum noda sampel dan baku berimpit.
Catatan :
- Gunakan salah satu fasa gerak yang tercantum dalam metode, fasa gerak yang lain gunakan sebagai konfirmasi.
- Sebagai penampak noda gunakan sinar ultra violet λ 254 nm dan salah satu penyemprot, penyemprot yang lain dapat gunakan untuk mempertegas hasil yang diperoleh. Kokain Hidroklorida dalam cuplikan
b. Kromatografi Gas
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi gas, kemudian deteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding
2) Alat
3) Reagen a) Metanol
b) Larutan sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku
Baku pembanding kokain larutkan dalam metanol hingga diperoleh kadar ± 1 mg/mL (B)
4) Cara Kerja
Suntikkan masing-masing larutan A dan B secara terpisah ke dalam kromatografi gas dengan kondisi sebagai berikut :
Kolom : Kaca, panjang 2 m, diameter dalam 2 mm, isi kolom 5 % OV-1 atau yang sesuai, ukuran isi kolom 80/100, kolom penyangga kromosorb.
Detektor : Ionisasi nyala (FID)
Suhu : Detektor 2750 C, injektor 2750 C, kolom 2100 C
Gas pembawa : Nitrogen
Laju aliran fase gerak : 40 - 60 mL/menit
Volume penyuntikkan : Larutan A dan Bmasing-masing 1 µL
Interpretasi hasil
Cuplikan mengandung kokain bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutan baku kokain (B). Jika larutan A dan B dicampur dan diinjeksikan ke sistem kromatografi maka akan terbentuk satu spektrum utama yang sama
c. Kromatografi Cair Kinerja Tinggi (KCKT)
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi cair kinerja tinggi, kemudian dideteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding.
2) Alat
Kromatografi cair kinerja tinggi
3) Reagen
a) Metanol
b) Ammonium Asetat 0,045 M c) Larutan sampel
d) Larutan Baku Larutan Baku
Baku pembanding kokain larutkan dalam metanol hingga diperoleh kadar ± 1 mg/mL (B)
4) Cara Kerja
Suntikkan masing-masing larutan A dan B secara terpisah ke dalam kromatografi cair kinerja tinggi dengan kondisi sebagai berikut :
Kolom : C-18
Fasa gerak : Ammonium Asetat 0,045 M – metanol - asetonitril (80 : 10 : 10) Detektor : Ultra violet λ 254 nm
Laju aliran fase gerak : 1,0 mL/menit Volume penyuntikkan
: Larutan A dan B masing-masing 20 µL
Interpretasi Hasil
4. Amfetamin, Metamfetamin dan MDMA dalam cuplikan
a. Kromatografi Lapis Tipis (KLT)
1) Prinsip
Sampel diekstraksi dengan metanol, elusi menggunakan eluen tertentu, sehingga terbentuk noda dengan Rf tertentu. Noda
discanning dengan spektrodensitometer, sehingga terbentuk
spektrum serapan sinar ultraviolet sebelum akhirnya noda pada pelat disemprot menggunakan penyemprot tertentu. Rf spektrum serapan sinar ultraviolet dan warna noda hasil penyemprotan dari sampel dibandingkan terhadap baku pembanding
2) Alat
a) . Peralatan kromatografi lapis tipis (KLT) terdiri dari - Pipet kapiler
- Plat KLT dilapisi silika gel berfluoresensi pada λ 254 nm dengan ketebalan 0,25 mm
- Tabung elusi (developing tank) - Lampu UV λ 254 nm
b) Spektrofotodensitometer
3) Reagen
a) Pelarut organik : metanol, etil asetat, amoniak b) Penampak noda ninhidrin
0,5 g ninhidrin ditambahkan pada 10 mL asam klorida dan diencerkan hingga 100 mL dengan aseton0,5 g ninhidrin ditambahkan pada 10 mL asam klorida dan diencerkan hingga 100 mL dengan aseton
c) Penampak noda Fast Black K - Larutan Fast Black K
1 g garam Fast Black K larutkan dalam 100 mL - Larutan Natrium hidroksida 1 N
4 g NaOH larutkan dalam 100 mL air d) Larutan sampel Larutan sampel
Satu dosis sampel (atau 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A).
e) Larutan baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
- Amfetamin 5 mg/mL (B1)
- Metamfetamin 5 mg/mL (B2)
4) Cara Kerja
Larutan A, B1, B2 dan B3 masing-masing ditotolkan pada pelat
secara terpisah dan dilakukan kromatografi lapis tipis dengan kondisi sebagai berikut :
Fase diam : Silika gel GF 254
Fase gerak : 1. Metanol - amoniak (100 : 1,5) 2. Etil asetat - metanol - amoniak (85 :10 : 5)
Volume penotolan : Larutan A dan B masing-masing 20 µL. Jarak rambat : 15 cm
Penampak noda : 1. Sinar ultraviolet λ 254 nm, noda berwarna ungu,
2. Penampak noda ninhidrin
- Angkat lempeng, diamkan sampai kering
- Semprot dengan larutan penampak noda
- Panaskan lempeng pada suhu 1200 C selama 15 menit
Noda berwarna ungu 3. Penampak noda Fast Black K
- Angkat lempeng, diamkan sampai kering
- Semprot dengan larutan Fast Black K - Semprot dengan larutan Natrium
hidroksida 1 N
- Semprot dengan larutan Fast Black K Noda berwarna ungu (amfetamin, metamfetamin)
Noda berwarna jingga (MDMA)
Konfirmasi :
Sebelum pelat disemprot dengan penampak noda, dilakukan pengukuran spektrum serapan ultra violet terhadap noda sampel yang mempunyai harga Rf atau tinggi noda yang sama dengan salah satu noda baku menggunakan alat spektrodensitometer.
Interpretasi Hasil :
Cuplikan mengandung amfetamin bila :
- Larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan baku amfetamin (B1).
panjang gelombang serapan maksimum noda sampel dan baku berimpit.
Cuplikan mengandung metamfetamin bila :
- Larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan baku metamfetamin (B2).
- Profil spektrum serapan ultraviolet noda sampel bersesuaian dengan spektrum serapan ultraviolet noda baku metamfetamin serta panjang gelombang serapan maksimum noda sampel dan baku berimpit.
Cuplikan mengandung MDMA bila :
- Larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan baku MDMA (B3).
- Profil spektrum serapan ultraviolet noda sampel bersesuaian dengan spektrum serapan ultraviolet noda baku MDMA serta panjang gelombang serapan maksimum noda sampel dan baku berimpit.
Catatan :
1) Gunakan salah satu fasa gerak yang tercantum dalam metode, fasa gerak yang lain gunakan sebagai konfirmasi.
2) Sebagai penampak noda gunakan sinar ultra violet λ 254 nm dan salah satu penyemprot, penyemprot yang lain dapat gunakan untuk mempertegas hasil yang diperoleh
b. Kromatografi Gas
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi gas, kemudian deteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding
2) Alat
Kromatografi gas
3) Reagen
a) Metanol
b) Larutan sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
- Amfetamin 1 mg/mL (B1)
4) Cara Kerja
Suntikkan masing-masing larutan A, B1, B2 dan B3 secara terpisah
ke dalam kromatografi gas dengan kondisi sebagai berikut :
Kolom : Kaca, panjang 2 m, diameter dalam 2 mm, isi kolom 5 % OV-1, ukuran isi kolom 80-100, kolom penyangga kromosorb.
Detektor : Ionisasi nyala (FID)
Suhu : Detektor 2550 C, injektor 2550 C, kolom 1800 C
Gas pembawa : Nitrogen
Laju aliran fase gerak : 40-60 mL/menit Volume penyuntikkan
: Larutan A, B1, B2 dan B3
masing-masing 2 µL
Interpretasi Hasil :
- Cuplikan mengandung amfetamin bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutan baku amfetamin (B1). Jika larutan A dan B1 dicampur dan diinjeksikan
ke sistem kromatografi maka akan terbentuk satu spektrum utama yang sama.
- Cuplikan mengandung metamfetamin bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutam baku metamfetamin (B2). Jika larutan A dan B2 dicampur dan
diinjeksikan ke sistem kromatografi maka akan terbentuk satu spektrum utama yang sama.
- Cuplikan mengandung MDMA bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutam baku MDMA (B3). Jika larutan A dan B3 dicampur dan diinjeksikan ke sistem
c. Kromatografi Cair Kinerja Tinggi (KCKT)
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi cair kinerja tinggi, kemudian dideteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding.
2) Alat
Kromatografi cair kinerja tinggi
3) Reagen
a) Pelarut metanol b) Larutan Sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
- Amfetamin 1 mg/mL (B1)
- Metamfetamin 1 mg/mL (B2)
- MDMA 1 mg/mL (B3)
4) Cara Kerja
Suntikkan masing-masing larutan A, B1, B2 dan B3 secara terpisah
ke dalam kromatografi cair kinerja tinggi dengan kondisi sebagai berikut :
Kolom : C-18
Fasa gerak : Asetonitril - amonium asetat 1 % - dietilamin 2,5 % (40 : 45 : 15)
Detektor : Ultra violet λ 254 nm Laju aliran fase gerak : 1,0 mL/menit
Volume penyuntikkan
: Larutan A, B1, B2 dan B3
masing-masing 20 µL
Interpretasi Hasil
- Cuplikan mengandung amfetamin bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutan baku amfetamin (B1). Jika larutan A dan B1 dicampur dan diinjeksikan
ke sistem kromatografi maka akan terbentuk satu spektrum utama yang sama.
diinjeksikan ke sistem kromatografi maka akan terbentuk satu spektrum utama yang sama.
- Cuplikan mengandung MDMA bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutam baku MDMA (B3). Jika larutan A dan B3 dicampur dan diinjeksikan ke sistem
kromatografi maka akan terbentuk satu spektrum utama yang sama.
5. Barbital dan Fenobarbital dalam cuplikan
a. Kromatografi Lapis Tipis (KLT)
1) Prinsip
Sampel diekstraksi dengan metanol, elusi menggunakan eluen tertentu, sehingga terbentuk noda dengan Rf tertentu. Noda
discanning dengan spektrodensitometer, sehingga terbentuk
spektrum serapan sinar ultraviolet sebelum akhirnya noda pada pelat disemprot menggunakan penyemprot tertentu. Rf spektrum serapan sinar ultraviolet dan warna noda hasil penyemprotan dari sampel dibandingkan terhadap baku pembanding.
2) Alat
a) Peralatan kromatografi lapis tipis (KLT) terdiri dari : (1) Pipet kapiler
a. Plat KLT dilapisi silika gel berfluoresensi pada λ 254 nm dengan ketebalan 0,25 mm
b. Tabung elusi (developing tank) (4) Lampu UV λ 254 nm
b) Spektrofotodensitometer
3) Reagen
a) Pelarut organik : metanol, etil asetat, amoniak, kloroform, aseton, isopropanol, uap amoniak.
b) Larutan Sampel
Satu dosis sampel (atau lebih kurang 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
(1) Barbital 1 mg/mL (B1)
4) Cara Kerja
Totolkan masing-masing larutan A, B1, dan B2 pada pelat secara
terpisah dan lakukan kromatografi lapis tipis dengan kondisi sebagai berikut :
Fase diam : Silika gel GF 254
Fase gerak : 1. Etil asetat - metanol - amoniak (85 : 10 : 5)
2. Kloroform - aseton (80 : 20)
3. Kloroform - isopropanol - amonium hidroklorida (50 : 50 : 10)
Volume penotolan : Larutan A, B1 dan B2 masing-masing
20 µL. Jarak rambat : 15 cm
Penampak noda : Sinar ultraviolet λ 254 nm, noda berwarna ungu, kemudian lempeng diuapi dengan uap amonia dan diamati lagi dibawah Sinar ultraviolet λ 254 nm.
Konfirmasi :
Sebelum pelat disemprot dengan penampak noda, dilakukan pengukuran spektrum serapan ultra violet terhadap noda sampel yang mempunyai harga Rf atau tinggi noda yang sama dengan salah satu noda baku menggunakan alat spektrodensitometer.
Interpretasi Hasil :
Cuplikan mengandung barbital bila :
- Larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan baku barbital (B1).
- Profil spektrum serapan ultraviolet noda sampel bersesuaian dengan spektrum serapan ultraviolet noda baku barbital serta panjang gelombang serapan maksimum noda sampel dan baku berimpit.
Cuplikan mengandung fenobarbital bila :
- Larutan A memberi harga Rf dan warna noda yang sama dengan harga Rf dan warna noda larutan baku fenobarbital (B2).
- Profil spektrum serapan ultraviolet noda sampel bersesuaian dengan spektrum serapan ultraviolet noda baku fenobarbital serta panjang gelombang serapan maksimum noda sampel dan baku berimpit.
Catatan :
c) Sebagai penampak noda gunakan sinar ultra violet 254 nm dan salah satu penyemprot, penyemprot yang lain dapat gunakan untuk mempertegas hasil yang diperoleh
b. Kromatografi Gas
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi gas, kemudian deteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding
2) Alat
Kromatografi gas
3) Reagen a) Metanol
b) Larutan sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku Larutan Baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
(1) Barbital 1 mg/mL (B1)
(2) Fenobarbital 1 mg/mL (B2)
4) Cara Kerja
Suntikkan masing-masing larutan A, B1 dan B2 secara terpisah ke
dalam kromatografi gas dengan kondisi sebagai berikut :
Kolom : Kaca, panjang 2 m, diameter dalam 2 mm, isi kolom 3 % OV-17, ukuran isi kolom 80/100, kolom penyangga kromosorb.
Detektor : Ionisasi nyala (FID)
Suhu : Detektor 2750 C, injektor 2750 C, kolom 2000 C
Gas pembawa : Nitrogen
Laju aliran fase gerak : 40-60 mL/menit Volume penyuntikkan
: Larutan A, B1 dan B2 masing-masing
2 -3 µL
Interpretasi hasil
kromatografi maka akan terbentuk satu spektrum utama yang sama.
- Cuplikan mengandung fenobarbital bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutan baku fenobarbital (B2). Jika larutan A dan B2 dicampur dan diinjeksikan
ke sistem kromatografi maka akan terbentuk satu spektrum utama yang sama.
c. Kromatografi Cair Kinerja Tinggi (KCKT)
1) Prinsip
Pemisahan sampel dari zat lain menggunakan kromatografi cair kinerja tinggi, kemudian dideteksi dengan detektor menghasilkan spektrum dengan waktu retensi tertentu yang dapat dibandingkan dengan waktu retensi baku pembanding.
2) Alat
Kromatografi cair kinerja tinggi
3) Reagen
a) Pelarut metanol
b) Larutan NaH2PO4 0,1 M
11,998 g natrium dihidrogen fosfat larutkan dalam 1 liter air c) Larutan Sampel
Satu dosis sampel (± 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
d) Larutan Baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
- Barbital 1 mg/mL (B1)
- Fenobarbital 1 mg/mL (B2)
4) Cara Kerja
Suntikkan masing-masing larutan A, B1 dan B2 secara terpisah ke
dalam kromatografi cair kinerja tinggi dengan kondisi sebagai berikut :
Kolom : C-18
Fasa gerak : Larutan NaH2PO4 0,1 M - metanol
(60 : 40)
Detektor : Ultra violet λ 254 nm Laju aliran fase gerak : 1,0 mL/menit
Volume penyuntikkan
: Larutan A, B1 dan B2 masing-masing
Interpretasi Hasil
- Cuplikan mengandung barbital bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutan baku barbital (B1). Jika larutan A dan B1 dicampur dan diinjeksikan ke sistem
kromatografi maka akan terbentuk satu spektrum utama yang sama.
- Cuplikan mengandung barbital bila larutan A memberikan waktu retensi yang sama dengan waktu retensi larutan baku fenobarbital (B2). Jika larutan A dan B2 dicampur dan diinjeksikan ke sistem
kromatografi maka akan terbentuk satu spektrum utama yang sama.
6. Turunan Benzodiazepin dalam Cuplikan
a. Kromatografi Lapis Tipis (KLT)
1) Prinsip
Sampel diekstraksi dengan metanol, elusi menggunakan eluen tertentu, sehingga terbentuk noda dengan Rf tertentu. Noda discanning dengan spektrodensitometer, sehingga terbentuk spektrum serapan sinar ultraviolet sebelum akhirnya noda pada pelat disemprot menggunakan penyemprot tertentu. Rf spektrum serapan sinar ultraviolet dan warna noda hasil penyemprotan dari sampel dibandingkan terhadap baku pembanding.
2) Alat
a) Peralatan kromatografi lapis tipis (KLT) terdiri dari : (1) Pipet kapiler
(2) Plat KLT dilapisi silika gel berfluoresensi pada λ 254 nm dengan ketebalan 0,25 mm
(3) Tabung elusi (developing tank) (4) Lampu UV λ 254 nm
b) Spektrofotodensitometer
3) Reagen
a) Pelarut organik : metanol, kloroform, aseton, sikoloheksan, toluen, dietiamin.
b) Larutan Sampel
Satu dosis sampel (atau lebih kurang 50 mg cuplikan) larutkan dalam 10 mL metanol, bila perlu saring (A)
c) Larutan Baku
Buat masing-masing larutan baku pembanding dalam metanol sebagai berikut :
- Diazepam 1 mg/mL (B1)
- Nitrazepam 1 mg/mL (B3)
- Bromazepam 1 mg/mL (B4)
d) Larutan asam sulfat 2 N
5,5 mL asam sulfat pekat encerkan dengan air hingga 100 mL e) Penampak noda Dragendorff
(0) 2 g bismuth subnitrat campur dengan 25 mL asam asetat dan 100 mL air.
(1) 40 g kalium iodida larutkan dalam 100 mL air.
10 mL larutan (0) dan 10 mL larutan (1) campur dengan 20 mL asam asetat glasial dan 100 mL air.
4) Cara Kerja
Larutan A, B1, B2,B3 dan B4 masing-masing ditotolkan pada pelat
secara terpisah dan dilakukan kromatografi lapis tipis dengan kondisi sebagai berikut :
Fase diam : Silika gel GF 254
Fase gerak : 1. Kloroform-metanol (90 : 10) 2. Kloroform-aseton (80 : 20)
3. Sikloheksan-toluen-dietilamin (75 : 15 : 10)
Volume penotolan : Larutan A, B1, B2, B3 dan B4
masing-masing 20 µl. Jarak rambat : 15 cm
Penampak noda : 1. Sinar ultraviolet λ 254 nm, noda berwarna ungu.
2. Larutan asam sulfat 2 N, panaskan lempeng pada suhu 800 C salama 5 menit, kemudian amati di bawah sinar ultraviolet λ 366 nm, noda berfluoresensi biru.
3. Larutan Dragendorff, noda berwarna jingga.
Konfirmasi :
Sebelum pelat disemprot dengan penampak noda, dilakukan pengukuran spektrum serapan ultra violet terhadap noda sampel yang mempunyai harga Rf atau tinggi noda yang sama dengan salah satu noda baku menggunakan alat spektrodensitometer.