0
MODUL 1
PERSAMAAN KEADAAN GAS IDEAL
Oleh:
Evi Sapinatul Bahriah, S.Pd, M.Pd
Jurusan Pendidikan Kimia
Fakultas Ilmu Tarbiyah dan Keguruan
UIN Syarif Hidayatullah Jakarta
1
Gas memiliki sifat-sifat seperti struktur partikel berjauhan, memiliki bentuk dan volum berubah-ubah, memenuhi wadahnya, dan kumpulan molekul dengan gerakan acak berkesinambungan. Untuk mengetahui bagaimanakah cara balon gas bekerja dan memahami sifat gas secara mendalam, Anda harus mempelajari parameter gas, gas ideal, hukum-hukum gas ideal, penurunan persamaan keadaan gas ideal, hukum Dalton, teori efusi Graham, isoterm, isobar, dan isometrik gas ideal. Berikut pemaparannya.
A. Parameter Gas
Parameter gas memiliki hubungan tertentu, yang biasa dinyatakan sebagai suatu fungsi volume, yaitu:
𝑉 = 𝑉(𝑇, 𝑃, 𝑛)
Besarnya perubahan volume yang diakibatkan oleh perubahan-perubahan parameter tersebut secara matematika dituliskan sebagai berikut:
𝑑𝑉 = (𝜕𝑉𝜕𝑇)
𝑃,𝑛𝑑𝑇 + ( 𝜕𝑉
𝜕𝑃)𝑇,𝑛𝑑𝑃+ ( 𝜕𝑉 𝜕𝑛)𝑇,𝑃𝑑𝑛
Bagaimanakah Balon Gas
2
Persamaan tersebut memiliki 3 kuosien, yaitu: 1. (𝜕𝑉𝜕𝑇)
𝑃,𝑛 perubahan volume yang diakibatkan oleh berubahnya suhu pada tekanan dan jumlah mol yang sama
2. (𝜕𝑉𝜕𝑃)
𝑇,𝑛 perubahan volume yang diakibatkan oleh berubahnya tekanan pada suhu dan jumlah mol yang sama
3. (𝜕𝑉
𝜕𝑛)𝑇,𝑃 perubahan volume yang diakibatkan oleh berubahnya jumlah mol pada tekanan dan suhu yang sama
B. Definisi Gas Ideal
Pengukuran gas pada tekanan rendah memperlihatkan bahwa tekanan, temperatur, volume dan jumlah gas dihubungkan dengan pernyataan
𝑃𝑉 = 𝑛𝑅𝑇 Persamaan gas ideal
Gas pada suhu dan tekanan kamar (mendekati 25oC dan 1 atm). Semua gas semakin mematuhi persamaan tersebut ketika tekanan berkurang. Gas yang mematuhi persamaan diatas disebut gas ideal atau gas sempurna. Gas ideal tidak ditemukan dalam kehidupan sehari-hari. Kriteria gas ideal:
1. Molekul-molekul gas tidak mempunyai volume;
2. Tidak ada interaksi diantara molekul-molekulnya, baik Tarik menarik maupun tolak menolak
C. Hukum-hukum gas ideal 1. Hukum Boyle
Tekanan (P) berbanding terbalik dengan volume (V) pada temperatur tetap dan untuk sejumlah tertentu gas, yaitu:
𝑃∞1𝑉
PV = konstan 𝑃1𝑉1= 𝑃2𝑉2
Untuk mendapatkan kuosien pertama, persamaan PV = k diturunkan terhadap P, pada temperatur dan jumlah mol yang tetap diperoleh:
(𝜕𝑉𝜕𝑃) 𝑇,𝑛= −
𝑘 𝑃2 Setelah nilai K disubtitusikan diperoleh:
(𝜕𝑉𝜕𝑃) 𝑇,𝑛= -
𝑉 𝑃
3
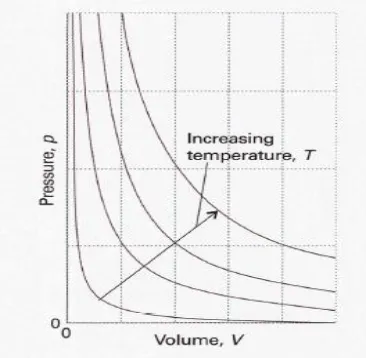
ideal pada 3 temperatur yang berbeda. Setiap kurva berbentuk hiperbola (𝑃∞ 1 𝑉⁄ ) dan disebut isoterm.
Gambar 1. Hubungan Tekanan dengan Volume
Hukum Boyle digunakan untuk meramalkan tekanan gas jika volumenya berubah (atau sebaliknya). Hukum Boyle bersifat universal, artinya berlaku terhadap gas apapun tanpa melihat komposisi kimianya. Hukum Boyle dipenuhi oleh gas nyata hanya pada tekanan yang mendekati nol dan suhu yang sangat tinggi. Hukum Boyle dipahami sebagai gambaran dari gas yang terdiri atas sejumlah besar molekul yang bergerak bebas, tidak ada antaraksi antar molekul-molekulnya. Tekanan yang ditimbulkan oleh gas diakibatkan oleh tumbukan dari molekul gas terhadap dinding. Penurunan volume mengakibatkan tumbukan molekul terhadap dinding menjadi semakin sering, Sehingga meningkatkan tekanan.
Contoh Soal
Hitung tekanan yang diperlukan untuk menekan 4,24 dm3 gas pada 412 torr menjadi 1,56 dm3 dalam keadaan isotermis. Ubahlah tekanan dalam satuan SI. PENYELESAIAN:
Dik: P1 = 412 torr V1 = 4,24 dm3 V2 = 1,56 dm3 Dit: P2 = …?
Jawab: 𝑃1𝑉1= 𝑃2𝑉2
𝑃2=𝑃1𝑉𝑉21=(412𝑡𝑜𝑟𝑟)(4,24𝑑𝑚 3) (1,56𝑑𝑚3) = 1119,795𝑡𝑜𝑟𝑟
4
Latihan
1. Sejumlah tertentu gas diekspansi dari tekanan 760 torr menjadi 250 torr Hg pada temperatur tetap. Bila volume mula-mula adalah 10 dm3, hitunglah volume akhir?
Penyelesaian:
2. Sejumlah gas ideal pada tekanan 101,325 kPa memuai dari 11,2 dm3 menjadi 22,4 dm3 pada suhu tetap 25oC. Berapakah tekanan akhir gas tersebut?
Penyelesaian:
2. Hukum Gay-Lussac
Sejumlah tertentu gas pada tekanan tetap (dalam keadaan isobar), volume (V) berbanding lurus dengan temperatur (T). Hubungannya adalah:
𝑉∞𝑇 𝑉
𝑇 = 𝑘𝑜𝑛𝑠𝑡𝑎𝑛
Dimana T adalah temperatur pada skala absolut: 𝑉1
Untuk mendapatkan kuosien pertama, persamaan 𝑉𝑇 = 𝑘 diturunkan terhadap T, pada tekanan dan jumlah mol yang tetap diperoleh:
(𝜕𝑉𝜕𝑇)
Gay-Lussac menemukan bahwa volume gas dalam keadaan isobar dapat dinyatakan sebagai 𝑉 = 𝑉0(1 + 𝛼0𝑡) dimana 𝑉0 adalah volume pada 0oC, t adalah temperatur pada skala derajat senti dan 𝛼0 adalah suatu konstanta. Hitung harga𝛼0 dengan menggunakan persamaan Hukum Gay-Lussac?
PENYELESAIAN:
Dik: 𝑉0 = volume pada 0oC
t = temperatur pada skala derajat senti 𝛼0 = suatu konstanta
5 Jawab:
𝑉 =𝑉0
𝑇0× 𝑇 = 𝑉0
(2730+𝑡)
2730 = 𝑉0(1 + 1 273𝑡) Bandingkan dengan 𝑉 = 𝑉0(1 + 𝛼0𝑡)
𝛼0 =2731 =3,66× 10−3𝑂𝐶−1
Latihan
1. 22,4 dm3 gas pada 50oC dibiarkan berekspansi menjadi 40,8 dm3 pada tekanan tertentu. Hitunglah temperatur baru?
Penyelesaian:
2. Sejumlah gas ideal pada tekanan tertentu memuai dari volume awal V hingga volumenya menjadi dua kali lipat. Apabila suhu awal gas tersebut 25oC, berapakah suhu akhirnya?
Penyelesaian:
3. Asas Avogadro
Menurut Asas Avogadro, pada suhu dan tekanan tetap, volume sejumlah tertentu gas berbanding lurus dengan jumlah molnya.
𝑉∞𝑛 𝑉∞𝑘𝑛
Artinya pada suhu dan tekanan yang tetap, jika jumlah mol berubah dari keadaan 1 ke keadaan 2 maka volumenya akan berubah dengan perbandingan V/n yang selalu tetap.
𝑉2 𝑛2 =
𝑉1 𝑛1
Turunan persamaan 𝑉∞𝑘𝑛 terhadap n, dan disubtitusikan dengan persamaan semula akan diperoleh:
(𝜕𝑉
𝜕𝑛)𝑇,𝑃= 𝑘 = 𝑉 𝑛
Asas Avogadro volume yang sama dari gas pada tekanan dan temperature sama mengandung jumlah molekul yang sama => volume molar (Vm).
6
D. Penurunan Gas Ideal
Hukum Boyle dan hukum Charles atau hukum Gay-Lussac dapat digabungkan bersama, yaitu untuk sejumlah massa tertentu dari gas.
𝑃𝑉
𝑇 = 𝑘𝑜𝑛𝑠𝑡𝑎𝑛
Kondisi sejumlah massa tertentu dapat dibandingkan dengan bantuan hipotesis Avogadro yang menyatakan bahwa pada kondisi temperatur dan tekanan yang sama, gas-gas dengan volume sama akan mengandung jumlah molekul yang sama. Maka persamaan di atas menjadi:
𝑃𝑉 𝑛𝑇 = 𝑅
Dimana n= banyaknya mol, R= konstanta gas. Banyaknya mol didefinisikan sebagai perbandingan massa (w) gas dengan berat molekulnya (M), yaitu 𝑤⁄ .𝑀
Untuk 1 mol gas, persamaan idealnya adalah: 𝑃𝑉̅ = 𝑅𝑇 Dimana 𝑉̅ = volume 1 mol gas
Tabel 1. Harga R dalam Satuan Lain Tipe Satuan Harga Satuan
Mekanik 0,082054 dm3 atom mol-1 K-1 Mekanik 82,054 ml atom mol-1 K-1 cgs 8,3144x107 erg mol-1 K-1 Listrik 8,3144 Joule mol-1 K-1 Panas 1,9872 Kal mol-1 K-1
Contoh Soal
Bila volume diukur dalam dm3, tekanan dalam atmosfer dan temperatur dalam derajat kelvin, apakah satuan untuk R dan hitunglah harganya?
PENYELESAIAN: 𝑃𝑉 = 𝑛𝑅𝑇
𝑅 =𝑃𝑉𝑛𝑇 𝑅 =𝑃𝑛𝑇0𝑉0
𝑅 =(1(1𝑎𝑡𝑚)(22,414𝑑𝑚𝑚𝑜𝑙)(273,15𝐾)3)
7
Latihan
1. Buktikan hubungan dari 𝑃1𝑇𝑉1 1 =
𝑃2𝑉2
𝑇2 dengan menggunakan hukum Boyle dan hukum Charles!
Penyelesaian:
2. Sebuah silinder berisi 100 g gas ideal (berat molekul 40 g/mol) pada 27oC dan tekanan 2 atm. Ketika dipindahkan, silindernya jatuh dan menimbulkan sebuah lekukan Sehingga terjadi penurunan volume silinder. Tetapi katup silinder tidak dapat menahan tekanan yang lebih besar dari 2 atm, Sehingga 10 g gas bocor keluar. a) Hitung volume silinder sebelum dan sesudah melekuk?
b) Bila katup sedikit kuat menahan tekanan, berapakah tekanan sesudah lekukan? Temperatur tetap konstan selama proses ini.
Penyelesaian:
3. Sejumlah tertentu gas ideal memiliki volume 2,56 dm3 pada tekanan 200 torr dan temperatur 40oC. Gas itu dikompresi dengan tekanan 400 torr hingga volumenya menjadi 1,6 dm3. hitunglah temperatur akhirnya?
Penyelesaian:
4. Sebanyak 4 g gas ideal dimasukkan kedalam suatu wadah dengan volume 10 dm3 pada tekanan P dan temperatur T. wadah ini diletakkan dalam thermostat dengan temperatur yang dipertahankan pada (T +125) K. jika 0,8 g dari gas ini dikeluarkan untuk menjaga tekanan tetap seperti mula-mula. Hitung P dan T berat molekul gas 40 g/mol?
Penyelesaian:
5. Sejumlah gas ideal yang tidak diketahui dengan volume 0,202 dm3 pada 625 torr dan 40oC mempunyai berat 0,2058x10-3 kg. Hitunglah berat molekulnya?
8
6. Sejumlah gas ideal yang memiliki volume 11,2 dm3 pada suhu 25oC dan tekanan 101,325 kPa memuai hingga volumenya menjadi 22,4 dm3. andaikan suhu gas naik menjadi 40oC, berapa tekanan akhir gas tersebut?
Penyelesaian:
E. Hukum Dalton
Hukum Dalton (Jhon Dalton, 1766-1844) tekanan yang dilakukan oleh campuran gas sempurna adalah jumlah tekanan yang dilakukan oleh masing-masing gas tersebut yang secara sendiri menempati volume yang sama.
𝑃𝐴 = 𝑛𝐴(𝑅𝑇𝑉 )
Hukum Dalton Tentang Tekanan Parsial
Tekanan total dari sebuah campuran gas ideal adalah sejumlah dari tekanan parsial masing-masing gas, yaitu:
𝑃 = 𝑃1+ 𝑃2+ ⋯ + 𝑃𝑖+ ⋯ = ∑ 𝑃𝑖
Dimana 𝑃𝑖= tekanan parsial gas ke-i dalam campuran. Tekanan parsial dari semua komponen dalam suatu campuran gas ideal dapat dihubungkan dengan tekanan totalnya dengan persamaan:
𝑃𝑖 = 𝑥𝑖𝑃
Dimana 𝑥𝑖 = fraksi mol dari gas ke-I dan didefinisikan sebagai: 𝑥𝑖 = 𝑗𝑢𝑚𝑙𝑎ℎ𝑚𝑜𝑙𝑔𝑎𝑠𝑘𝑒 − 𝑖
𝑗𝑢𝑚𝑙𝑎ℎ𝑠𝑒𝑙𝑢𝑟𝑢ℎ𝑚𝑜𝑙𝑠𝑖𝑠𝑡𝑒𝑚
Contoh Soal 1
Sebuah bejana mempunyai kapasitas 4 dm3. bila 4 g O2 dan 10 g N2 pada 27oC dimasukkan, hitung:
a) Fraksi mol dari masing-masing gas? b) Tekanan parsial gas masing-masing? c) Tekanan total campuran?
PENYELESAIAN:
9 berikut: N2=74,7%; O2=22,9%; Ar=1,3%; H2O=1,0%; dan CO2=0,1%. Tentukan massa jenis (udara), jika dianggap gas bersifat ideal?
Penyelesaian:
F. Teori Efusi Graham
Menurut teori efusi Graham, laju efusi (keluarnya gas melalui suatu lubang) dari gas-gas pada tekanan dan temperatur yang sama berbanding terbalik dengan akar kuadrat kerapatannya, yaitu bila V1 dan V2 adalah laju efusi dari kedua macam gas, d1 dan d2 adalah kerapatan, maka:
𝑉1
Persamaan umum ini diturunkan dengan bantuan persamaan di atas, yaitu pada temperatur dan teanan yang sama, kerapatan masing-masing gas sebanding dengan berat molekulnya. Sehingga:
𝑉1 𝑉2= √
𝑀2 𝑀1
10
Contoh Soal 1
Gas oksigen (1 dm3 pada 1 atm) membutuhkan waktu 2 menit untuk berefusi melalui sebuah lubang. Berapa waktu yang dibutuhkan gas N2, He dan uap SF6 untuk berefusi pada kondisi yang sama?
PENYELESAIAN:
Waktu yang dibutuhkan oleh He: 𝑉1 =𝑉𝑜𝑙𝑢𝑚𝑒𝑤𝑎𝑘𝑡𝑢 =12 = 0,5𝑑𝑚3/𝑚𝑒𝑛𝑖𝑡
Cara yang sama untuk menentukan waktu gas N2 dan uap SF6
G. Berat Molekul Gas Ideal
Persamaan gas ideal untuk n mol gas adalah: PV = nRT
Dimana d= kerapatan gas dan d/P untuk gas ideal tidak tergantung dari tekanan
Contoh Soal 1
Jika 1 dm3 udara sampel pada tekanan 1 atm dan 27oC mempunyai berat 0,0012 kg. hitunglah berat molekul efektif udara bila udara bersifat seperti gas ideal?
11
H. Isoterm, Isobar, dan Isometrik Gas Ideal
Untuk memudahkan pembahasan, persamaan gas ideal yang telah dipaparkan diawal variable volumenya (variable ekstensif, V) diubah menjadi variable intensif (volume molar, 𝑉̅), yakni volume untuk setiap mol zat, Sehingga persamaannya menjadi:
𝑃𝑉̅ = 𝑅𝑇
Jika sembarang nilai diberikan terhadap setiap dua variable dari tiga variable P, 𝑉̅,dan T, maka variable ketiga dapat dihitung dari persamaan gas ideal. Oleh karena itu, dua variable tesebut merupakan variable bebas sedangkan variable ketiga merupakan variable terikat.
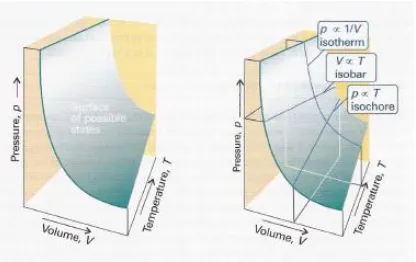
Gambar 2: Kurva Isoterm, Isobar, dan Isometrik gas ideal
Isoterm gas ideal menyatakan pada suhu yang sama, tekanan gas berbanding terbalik dengan volumenya artinya semakin besar tekanan, maka volume gas akan menjadi semakin kecil, dan sebaliknya. Kurva isotherm gas ideal berupa hiperbola ditentukan oleh hubungan:
𝑃 = (𝑅𝑇)𝑉̅1
P𝑉̅ = RT = k
Isobar gas ideal menyatakan pada tekanan tetap, volume molar gas berbanding lurus dengan suhunya. Artinya, semakin besar suhu gas maka volume molar akan semakin besar, dan sebaliknya. Isobar merupakan keadaan gas ideal pada tekanan sama. Kurva keadaan isobar gas nyata dijelaskan oleh hubungan:
𝑉̅ = (𝑅𝑃) 𝑇
Isometrik (Isokhor) gas ideal merupakan keadaan gas ideal yang terjadi pada volume molar sama. Dalam keadaan Isometrik, tekanan berbanding lurus dengan suhu. Artinya, semakin besar suhu maka tekanan semakin besar, dan sebaliknya
𝑃 = (𝑅 𝑉̅) 𝑇
Pemakaian persamaan gas ideal akan lebih akurat pada
12
tekanan kritis. Pada suhu yang rendah dan tekanan tinggi persamaan gas ideal sudah tidak berlaku lagi, karena hasil perhitungannya akan mengalami penyimpangan.
I. Soal Latihan
1. Pada suhu tinggi, persamaan keadaan yang cukup bagus adalah 𝑃(𝑉̅ − 𝑏) = 𝑅𝑇, dengan b adalah suatu tetapan. Carilah nilai (𝜕𝑉 𝜕⁄
𝑇)𝑃 dan (𝜕𝑉 𝜕⁄ 𝑃)𝑇untuk persamaan ini!
2. Suatu sampel udara menempati 1,0 L pada 25oC dan 1 atm. Berapa tekanan yang diperlukan untuk memampatkannya menjadi 100 cm3 pada temperature ini?
3. Gas ideal mengalami pemampatan isoterm, yang mengurangi volumenya sebesar 2,20 L. tekanan dan volume akhir gas adalah 3,78x103 torr dan 4,65 L. hitunglah tekanan awal gas dalam (a) torr, (atm)?
4. Pada 20oC, tekanan pada ban scooter diukur alat pengukur tekanan besarnya 15 psi, berapa tekanan dalam ban scooter bila setelah berjalan temperaturnya mencapai 45oC? Berapa banyak udara harus dikeluarkan sehingga tekanan pada temperatur barunya 15 psi? (catatan: tekanan yang dibaca alat pengukur selalu adalah kelebihan di atas tekanan atmosfer, yaitu 14,7 psi)
5. Labu dumas berukuran 2 L bersi n mol gas N2 pada tekanan 0,5 atm dan suhu T. pada penambahan 0,01 mol O2, perlu penurunan suhu labu hingga suhu 10oC agar dapat mempertahankan tekanan yang sama. Tentukan nilai n dan T?
6. Dua botol berisi gas saling dihubungkan dengan sebuah katup. Sebelum katup dibuka, bila tekanan pada botol A dengan volume VA adalah PA dan pada botol B dengan volume VB adalah PB, berapakah tekananya bila katup dibuka dan gas dibiarkan dalam keadaan setimbang?
7. Pada ketinggian permukaan air laut, yaitu tekanan sama dengan 7,55 torr, gas di dalam balon menempati 2,0 m3. Sampai volume berapa balon akan mengembang jika balon itu naik sampai ketinggian yang tekanannya: (a) 100 torr, (b) 10 torr? Anggaplah bahwa material balon dapat meluas tak terhingga
8. Tekanan di dalam ban mobil pada pagi hari (ketika belum dipakai) pada suhu 25oC adalah 5 atm. Setelah mobil dipakai jarak jauh, suhu ban menjadi 80oC. Jika diasumsikan volume ban tidak berubah, berapa tekanan yang terukur pada saat itu? 9. Sebuah tabung dengan volume 22,4 L berisi 2,0 mol H2 dan 1,0 mol N2 pada 273,15 K.
hitunglah: (a) fraksi mol setiap komponen, (b) tekanan parsialnya, (c) tekanan totalnya?
10. Sebanyak 4 g gas A bila dimasukkan ke dalam wadah pada 25oC mempunyai tekanan 0,85 atm. Ke dalam wadah yang sama ditambahkan 6 g gas B, dan tekanan naik menjadi 1,30 atm pada 25oC. Bila bobot molekul A adalah 40 g/mol, hitunglah bobot molekul B?
J. Daftar Pustaka
Atkins. P.W. Kimia Fisika Jilid 1 Edisi Keempat. 1994. Jakarta: Erlangga
Castellan, G.W. 1983. Physical Chemistry. Third Edition. Addison-Wesley Publishing Company: Amsterdam