4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Buah Bakau (R. mucronata)
Buah bakau terdiri dari dua bagian yaitu kelopak dan buah bakau. Kelopak buah bakau berbentuk seperti buah pir terbalik dan berwarna cokelat. Buah bakau memiliki penampakan berwarna hijau dan diselimuti oleh banyak lentisel pada lapisan permukaannya. Daging buah bakau memiliki tekstur keras dan berwarna cokelat serta dapat dilihat pada Lampiran 1. Pengukuran morfometrik buah bakau dapat dilihat pada Gambar 15.
Gambar 15 Pengukuran morfometrik buah bakau.
Data berat dan ukuran dari 30 sampel buah bakau yang digunakan dalam penelitian ini disajikan pada Lampiran 2. Adapun berat dan ukuran rata-rata buah bakau ini disajikan dalam Tabel 1.
Tabel 1 Berat dan ukuran buah bakau (R. mucronata)
No Parameter Nilai
1 Panjang (cm) 37,70 ± 0,10
2 Lebar (cm) 1,18 ± 0,01
3 Bobot (gram) 44,90 ± 0,05
Keterangan: Data diperoleh dari 30 sampel (Lampiran 2). Panjang Lebar
4.1.1 Rendemen buah bakau
Rendemen merupakan presentase perbandingan antara berat bagian bahan yang dapat dimanfaatkan dengan berat total bahan. Nilai rendemen digunakan untuk mengetahui keefektivan suatu bahan. Nilai rendemen yang semakin besar, maka semakin efektif bagian yang dapat dimanfaatkan. Rendemen buah bakau dihitung berdasarkan presentase perbandingan bobot daging buah terhadap buah bakau utuh. Rendemen daging buah yang didapatkan adalah sebesar 44,94%. Perhitungan rendemen buah bakau dapat dilihat pada Lampiran 3.
Buah bakau banyak dikonsumsi oleh orang-orang di wilayah Timor barat, Flores, Sumba, Sabu dan Alor. Masyarakat disekitar Taman Nasional Alas Purwo (TNAP) menggunakan buah bakau jenis R. mucronata sebagai pengganti beras dan jagung pada waktu bencana kelaparan melanda. Mamoribo et al. (2003) menyatakan bahwa masyarakat kampong Rayori, distrik Supriyori Selatan, Kabupaten Biak Numfor, Papua memanfaatkan buah bakau jenis B. gimnorhiza sebagai campuran lauk pauk pada saat musim paceklik tiba.
4.1.2 Komponen kimia buah bakau
Informasi mengenai kandungan gizi yang terdapat dalam bahan pangan dapat diketahui melalui analisis komposisi kimia atau proksimat. Analisis proksimat secara umum dilakukan untuk mengetahui unsur pokok berupa air, abu, protein dan lemak. Kandungan gizi yang terkandung dalam suatu bahan pangan berbeda-beda karena adanya perbedaan makanan, spesies, jenis kelamin, dan umur bahan (Kusumo 1997). Perhitungan analisis proksimat dapat dilihat pada Lampiran 4. Hasil analisis proksimat disajikan pada Tabel 2.
Tabel 2 Hasil uji proksimat buah bakau (n=2)
Parameter Rhizophora mucronata Rhizophora mucronata * Bruguiera parviflora* Kadar air 58,56 46,63 51,75 Kadar lemak 0,70 1,96 2,08 Kadar protein 2,53 0,41 0,12 Kadar abu 1,25 1,25 1,38 Kadar karbohidrat 36,96 22,29 22,14
Air merupakan komponen yang penting dalam bahan makanan, karena air sangat menentukan komponen lainnya (Andarwulan et al. 2011). Hasil pengujian kadar air buah bakau yang dilakukan dalam penelitian ini adalah sebesar 58,56%. Penelitian yang dilakukan oleh Bunyapraphatsara et al. (2002) pada tanaman
Rhizophora mucronata menghasilkan kadar air sebesar 46,63%.
Kandungan air dalam bahan makanan akan mempengaruhi daya tahan bahan tersebut terhadap serangan mikroba. Kadar air yang tinggi menyebabkan buah bakau mudah mengalami kerusakan. Bahan makanan umumnya memiliki nilai aw atau air bebas yang disukai oleh bakteri, kapang dan khamir sebagai
tempat berkembang biak. Organisme-organisme tersebut akan menyebabkan perubahan pada bahan makanan yang dapat mempercepat proses pembusukan (Winarno 2008).
Lemak merupakan sekumpulan senyawa biomolekul yang dapat larut dalam pelarut organik tetapi tidak dapat larut dalam air (Roswiem et al. 2006). Hasil pengujian kadar lemak yang dilakukan dalam penelitian ini adalah 0,70%. Utari (2012) melakukan uji proksimat terhadap buah lindur (Bruguiera gymnorrhiza) dan memperoleh kadar lemak sebesar 0,79%.
Lemak dan minyak terdapat hampir disemua bahan makanan dengan kandungan yang berbeda-beda. Secara umum lemak dibedakan menjadi lemak hewani dan lemak nabati. Lemak hewani banyak mengandung kolesterol yang disebut sterol. Lemak ini disusun oleh asam lemak jenuh sehingga berbentuk padat pada suhu kamar. Lemak nabati banyak mengandung kolesterol yang disebut fitosterol dengan asam lemak tak jenuh sebagai penyusunnya sehingga berbentuk cair pada suhu kamar. Anand et al. (2010) menyatakan bahwa asam lemak tak jenuh linoleat, linolenat, dan arakhidonat sangat diperlukan tubuh, antara lain untuk menjaga bagian struktural membran sel dan untuk membuat bahan-bahan hormon.
Protein merupakan makromolekul yang paling banyak ditemukan di dalam sel dan menyusun hampir sebagian berat kering tubuh mahluk hidup. Protein
merupakan komponen yang banyak terdapat pada sel tanaman dan hewan Andarwulan et al. (2011). Kadar protein yang dihasilkan dalam penelitian ini
pada tanaman Rhizophora mucronata menunjukkan kadar protein sebesar 0,41 %.
Protein dikenal sebagai zat pembangun yang berfungsi dalam pembentukan jaringan-jaringan baru yang terjadi ditubuh mahluk hidup. Protein akan mengganti jaringan yang rusak dan merombaknya menjadi jaringan baru. Protein juga digunakan sebagai sumber energi apabila kebutuhan energi dalam tubuh tidak terpenuhi oleh karbohidrat dan lemak. Secara umum protein dibedakan menjadi protein hewani dan protein nabati. Kandungan protein nabati cenderung lebih rendah dari pada protein hewani, kecuali pada kacang-kacangan dan produk olahannya sedangkan protein hewani lebih banyak menyediakan asam amino-asam amino esensial sehingga protein yang dihasilkan lebih bermutu tinggi. Kekurangan protein dalam waktu lama dapat mengganggu berbagai reaksi yang terjadi dalam tubuh dan menurunkan kemampuan tubuh dalam mengikat molekul tertentu (Roswiem et al. 2006).
Hampir sebagian besar bahan makanan terdiri dari bahan organik, misalnya lemak, protein, vitamin dan air. Sisanya berupa mineral yang berfungsi untuk menunjang reaksi-reaksi kimia di dalam tubuh. Mineral-mineral tersebut dikenal sebagai zat anorganik atau kadar abu. Proses pembakaran akan menyebabkan bahan organik terbakar habis, sedangkan zat anorganiknya tidak terbakar dan disebut abu (Winarno 2008). Hasil pengujian kadar abu dalam penelitian ini sebesar 1,25%. Helmy (2012) melakukan uji proksimat terhadap buah lindur, yang merupakan buah dari tanaman mangrove Bruguiera
gymnorrhiza, dan memperoleh kadar abu sebesar 1,29%.
Secara umum kadar abu erat kaitannya dengan kandungan mineral dalam suatu bahan makanan. Mineral tersebut digunakan tubuh sebagai zat pengatur dan pembangun. Tubuh dikenal membutuhkan unsur makro seperti Na, C, Ca, Mg dan unsur mikro misalnya Fe, I, Zn, Co, dan F. Besar kecilnya kandungan mineral dalam suatu bahan makanan dipengaruhi oleh beberapa faktor yaitu habitat dan kondisi lingkungan hidup yang berbeda-beda. Setiap lingkungan memberikan asupan mineral yang berbeda-beda bagi organisme yang hidup didalamnya. Kekurangan unsur mikro dan unsur makro dalam tubuh akan
menyebabkan terganggunya reaksi biologis dan proses fisiologis pada tubuh (Winarno 2008).
Karbohidrat merupakan salah satu nutrisi dasar yang paling banyak digunakan sebagai sumber energi utama karena menyumbang energi sebesar 4 kkal (Belitz et al. 2009). Perhitungan kadar karbohidrat dilakukan dengan metode by difference, yaitu penentuan kadar karbohidrat dalam suatu bahan pangan secara kasar. Kadar karbohidrat yang dihasilkan dalam penelitian ini
adalah sebesar 33,96%. Penelitian yang dilakukan oleh Bunyapraphatsara et al. (2002) memperoleh kadar karbohidrat pada tanaman
Rhizophora mucronata sebesar 22,29%.
Karbohidrat banyak ditemukan dalam bahan nabati, antara lain serealia, umbi-umbian dan batang tanaman. Karbohidrat dalam buah ditemukan dalam bentuk pati dan gula sederhana misalnya glukosa dan fruktosa. Secara umum pati digunakan sebagai tempat menyimpan cadangan energi. Selama proses pematangan, kandungan pati dalam buah akan diubah menjadi gula pereduksi. Pati yang masuk ke dalam saluran pencernaan akan diurai menjadi glukosa. Pati akan dioksidasi lebih lanjut didalam sel dan digunakan dalam menyediakan energi untuk membuat berbagai senyawa yang dibutuhkan tubuh diantaranya protein, lipid dan asam nukleat (Roswiem et al. 2006).
4.2 Ekstraksi Komponen Bioaktif Buah Bakau (R. mucronata)
Ekstraksi merupakan proses penarikan komponen zat aktif dalam suatu bahan dengan pelarut tertentu. Tujuan proses ini adalah untuk mendapatkan bahan aktif dari bagian tertentu suatu bahan (Harbone 1984). Proses ekstraksi dimulai dengan pemotongan sampel, penghancuran sampel menjadi ukuran yang lebih kecil (serbuk), maserasi, penyaringan dan proses evaporasi menggunakan
rotary vacuum evaporator.
Sampel yang digunakan dalam penelitian ini adalah bagian buah bakau yang telah dipisahkan kulitnya. Hal tersebut mengacu pada hasil penelitian Bunyapraphatsara et al. (2002) yang juga menggunakan buah dari tanaman
Rhizophora mucronata di Thailand. Proses ekstraksi pada penelitian ini
(polar). Proses maserasi dilakukan selama 24 jam yang mengacu kepada penelitian Tiwari et al. (2011) pada beberapa tanaman obat di India.
4.2.1 Ekstrak kasar
Hasil ekstraksi dari buah bakau memiliki warna yang berbeda-beda. Ekstrak metanol memiliki warna coklat kehitaman, etil asetat berwarna hijau tua, sedangkan ekstrak n-heksana memiliki warna hijau muda. Perbedaan tersebut tidak hanya dilihat dari warna sampel, akan tetapi dari sisi jumlah rendemen. Perhitungan rendemen ekstrak buah bakau dapat dilihat pada Lampiran 5.
Nilai rendemen ekstrak buah bakau tertinggi adalah ekstrak metanol sebesar 10,95 %, ekstrak etil asetat sebesar 0,25 % dan nilai ekstrak terkecil adalah ekstrak n-heksana sebesar 0,12 %. Perbedaan nilai rendemen yang dihasilkan dari ketiga pelarut tersebut disebabkan berbedanya sifat polaritas larutan-larutan tersebut. Hal ini sesuai dengan pendapat Salamah et al. (2008), bahwa rendemen ekstrak hasil maserasi dengan pelarut yang berbeda akan menghasilkan presentase rendemen yang berbeda. Nilai rendemen yang dihasilkan dari ekstrak metanol diduga dipengaruhi sifat larutan tersebut yang dapat melarutkan hampir semua komponen bahan aktif. Wasmund et al. (2006) menyatakan bahwa klorofil merupakan zat warna hijau yang dapat diekstrak dengan pelarut polar, misalnya metanol, aseton, dan etanol.
4.2.2 Komponen bioaktif pada ekstrak kasar
Ekstraksi bahan alam adalah ekstraksi komponen aktif yang terdapat pada bahan alam yang didasari pada prinsip perpindahan massa komponen zat ke dalam pelarut, dimana perpindahan mulai terjadi pada lapisan antar muka kemudian berdifusi ke dalam pelarut (Harbone 1984). Filtrat pekat tiga pelarut tersebut kemudian diuji komponen bioaktifnya melalui uji fitokimia, yang meliputi uji alkaloid, flavonoid, steroid, fenol hidroquinon, dan uji tanin. Hasil uji fitokimia pada masing-masing ekstrak kasar buah bakau dapat dilihat pada Tabel 3. Gambar uji fitokimia dapat dilihat di Lampiran 12.
Tabel 3 Hasil uji fitokima ekstrak kasar buah bakau Uji Fitokimia Ekstrak Standar (Warna) Hasil Metanol Etil Asetat N-heksana 1. Alkaloid
a. Dragendroff + – – endapan merah
atau jingga endapan jingga
b. Meyer – – – endapan putih
kekuningan
tidak terdapat endapan putih kekuningan c. Wegner + + – endapan coklat terbentuk endapan
coklat 2. Steroid + + + perubahan dari merah menjadi hijau/biru metanol dan n-hensana : hijau muda, etil asetat: hijau kebiruan 3. Flavonoid + + – lapisan amil alkohol berwarna merah/kuning/hi jau terbentuk amil alkohol berwarna kuning 4. Fenol Hidroquinon + + – warna hijau/hijau biru metanol: hijau kebiruan, etil asetat: hijau 5. Tanin + + – warna hijau kebiruan/hijau kehitaman metanol: terbentuk warna hijau
kebiruan, etil asetat: hijau kehitaman Hasil pengujian komponen bioaktif pada buah bakau ekstrak kasar metanol mengandung komponen bioaktif yang lebih banyak dibandingkan dengan ekstrak kasar etil asetat dan ekstrak kasar n-heksana. Komponen bioaktif pada ekstrak kasar metanol meliputi alkaloid, steroid, flavonoid, fenol hidroquinon, dan tanin. Komponen bioaktif pada ekstrak kasar etil asetat meliputi alkaloid, steroid, flavonoid, fenol hidroquinon, dan tanin. Komponen bioaktif pada ekstrak kasar n-heksana adalah steroid. Senyawa antioksidan alami umumnya adalah senyawa turunan fenolik atau polifenol dan turunan flavonoid misalnya flavon, isoflavon, katekin yang cenderung larut dalam pelarut polar. Hal ini sesuai dengan Atta-au-rahman et al. (2001) yang menyatakan bahwa senyawa yang berpotensi memiliki antioksidan umumnya adalah senyawa flavonoid, alkaloid dan fenolat yang larut dalam pelarut polar.
1) Alkaloid
Alkaloid merupakan golongan senyawa sekunder yang bersifat basa, mengandung satu atau lebih atom hidrogen (Harborne 1984). Pengujian alkaloid dilakukan menggunakan pereaksi pengendapan untuk memisahkan jenis alkaloid. Pereaksi yang umum digunakan adalah pereaksi Meyer yang mengandung kalium iodide dan merkuri klorida. Pereaksi Dragendorff mengandung bismuth nitrat dan merkuri klorida dalam nitrit berair. Pereaksi Bouchardat mirip dengan pereaksi Wagner dan mengandung kalium iodida dan yodium. Berbagai pereaksi digunakan untuk mengetahui perbedaan yang besar dalam hal sensivitas terhadap gugus alkaloid yang berbeda (Sastrohamidjojo 1996).
Hasil pengujian fitokimia menghasilkan nilai positif adanya alkaloid pada ekstrak metanol dan etil asetat. Pada ekstrak kasar n-heksana tidak mengandung senyawa alkaloid. Adanya endapan jingga pada pereaksi Dragendorf dan terbentuknya endapan cokelat dengan menggunakan pereaksi Wegner menandakan suatu bahan positif mengandung alkaloid. Hasil uji dengan pereaksi Meyer menghasilkan nilai negatif dengan tidak terbentuk endapan putih kekuningan pada ketiga ekstrak kasar tersebut.
Alkaloid dalam tanaman digunakan sebagai bentuk pertahanan diri tanaman terhadap pemangsa. Alkaloid sering dijumpai pada tumbuhan hijau pada biji, daun, ranting, buah dan kulit batang. Kadar alkaloid yang dihasilkan oleh tumbuhan hijau tidak sama pada semua jaringan dan pada setiap tahap pertumbuhan serta lokasi geografis yang mempengaruhinya (Robinson 1991).
Alkaloid dalam tanaman tidak dalam keadaan bebas akan tetapi berikatan dengan garam dan asam-asam organik terutama asam maleat, oralat, suksinat dan taurat. Struktur alkaloid memiliki elemen N dan elemen tanpa N dalam molekulnya. Elemen N terdiri atas monoterpena asiklik dan guanidine (komposisi pembentuk asam amino esensial arginina). Eleman tanpa N terdiri dari senyawa inti C5 dan senyawa aromatik tipe fenilpropana. Senyawa fenil
propana akan menurunkan metabolit sekunder dengan memperpendek rantai sampingnya. Senyawa aromatik dengan rantai samping C2 relatif jarang
ditemukan, tetapi sering ditemukan dalam bentuk C6-C2 pada alkaloid yang
dekarboksilasi dari asam alfa ketokarbon yang bersangkutan dan juga dilepas oleh oksidatif amoniak dari amin yang bersangkutan (feniletilamin). Reaksi ini merupakan reaksi pembentukan senyawa alkaloid awal (Sirait 2007).
Adanya gugus N dalam struktur alkaloid menyebabkan senyawa alkaloid memiliki potensi sebagai antioksidan. Alkaloid pada ekstrak buah bakau diduga memiliki sifat antioksidan yang cukup kuat, sama seperti jenis alkaloid yang ditemukan oleh Cheng et al. (2005) pada tanaman Sinomenium acutum, tanaman yang digunakan dalam pengobatan tradisional Cina. Ekstrak ethanol dari tanaman ini dimurnikan dengan kromatografi silika gel. Ekstrak tanaman tersebut menunjukkan hasil positif saat diberikan pereaksi Dragendorf sama dengan ekstrak metanol dalam penelitian ini yang menunjukkan nilai positif saat diberikan pereaksi Dragendorf.
2) Steroid/triterpenoid
Secara umum senyawa steroid banyak terdapat dalam tumbuhan dan berasal dari senyawa yang sama yaitu molekul isoprene. Steroid atau triterpenoid pada tumbuhan berbiji umumnya dalam bentuk triterpenoid nonglikosida dan pada tumbuhan primitif dalam bentuk triterpenoid pentasiklik (Robinson 1991). Hasil pengujian fitokimia diketahui bahwa ketiga ekstrak kasar positif mengandung senyawa steroid atau triterpenoid. Hasil ini dibuktikan dengan berubahnya warna merah dari ketiga ekstrak kasar menjadi berwarna hijau biru.
Senyawa turunan dari triterpenoid umumnya banyak ditemukan dalam daun dan buah yang digunakan sebagai pelindung terhadap serangga dan serangan mikroba. Senyawa ini juga terdapat dalam damar, kulit batang dan getah. Secara umum struktur steroid mempunyai struktur siklik dan mempunyai gugus hidroksil dan karbonil. Adanya gugus tersebut menyebabkan steroid mudah mengalami siklisasi dan oksidasi pada sintesis akhir. Oksidasi berkaitan dengan adanya aktivitas radikal bebas yang menyebabkan terjadinya oksidasi, seperti halnya turunan terpenoid yaitu alfa-karotena dan kriptoxantin yang sangat mudah teroksidasi (Harborne 1984).
3) Flavonoid
Flavonoid terdapat pada seluruh bagian tanaman termasuk pada buah, tepung sari, dan akar. Flavonoid berperan terhadap warna dalam organ tumbuhan, misalnya bunga, buah, dan daun. Flavonoid diketahui merupakan senyawa golongan polifenol yang dikelompokan menjadi 9 kelas yaitu, antosianin, proantosianin, flavonol, flavon, glikoflavon, biflavonil, chlacone, dan aurone, isoflavon dan flavonon. Pada tumbuhan flavonoid berguna untuk menarik serangga dan binatang lain untuk membantu proses penyerbukan dan penyebaran biji (Sirait 2007). Hasil dari pengujian flavonoid menghasilkan nilai positif pada ekstrak kasar metanol dan etil asetat yang ditunjukkan dengan terbentuknya warna kuning pada bagian amil alkohol dan negatif untuk ekstrak kasar n-heksana.
Senyawa flavonoid diketahui memiliki sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum UV dan spektrum sinar tampak. Flavonoid terdapat dalam semua tumbuhan dan berikatan dengan gula membentuk glikosida dan aglikon flavonoid. Turunan flavonoid yaitu kursetin memiliki sebuah gugus hidroksil pada posisi 8 menghasilkan gosipetin. Adanya gugus hidroksil dalam senyawa flavonoid menyebabkan mudah berikatan dengan radikal hidroksi dan superoksida. Flavonoid diketahui dapat digunakan sebagai penampung atau mencegah reaksi oksidasi enzimatis maupun oksidasi non-enzimatis hal ini berkaitan dengan aktivitas antioksidan yang tinggi pada senyawa flavonoid. Hal ini diperkuat oleh pernyataan Atta-au-rahman et al. (2001) yang menyatakan bahwa senyawa yang berpotensi memiliki antioksidan umumnya adalah senyawa flavonoid, alkaloid dan fenolat yang merupakan senyawa-senyawa polar. Bernardi et al. (2007) menyatakan bahwa tanaman
Hypercum ternum yang menunjukkan komponen flavonoid memiliki aktivitas
antioksidan.
4) Fenol hidrokuinon
Komponen fenolat memiliki struktur aromatik yang berikatan dengan satu atau lebih gugus hidroksil. Umumnya komponen fenolat larut dalam air (polar) dan banyak terdapat dalam vakuola sel tumbuhan (Harborne 1984). Hasil uji fitokima ekstrak kasar metanol dan etil asetat menunjukkan nilai positif yang ditandai dengan terbentuknya warna hijau atau biru. Pada sampel n-heksana tidak
mengandung senyawa fenol hidrokuinon. Hasil penelitian Yim et al. (2009) menyatakan bahwa fenol pada lima spesies jamur di Malaysia yang diekstrak dengan pelarut ethanol lebih tinggi daripada yang diekstrak dengan pelarut metanol dan aseton. Adanya gugus hidroksil pada cincin aromatiknya menyebabkan senyawa ini sangat peka terhadap oksidasi enzim. Enzim yang berperan dalam proses oksidasi fenolik adalah enzim fenolase yang secara umum banyak terdapat dalam tumbuhan. Senyawa fenolik erat kaitannya dengan aktivitas antioksidan pada suatu bahan tertentu. Hal ini diperkuat oleh penelitian Kiessoun et al. (2010) pada tanaman Malvaceae spesies Cienfuegosia digitata dan
Sida alba yang mengandung komponen polifenol, anti inflamasi, dan aktivitas
antioksidan yang tinggi. Chen dan Blumberg (2007) menyatakan bahwa mengkonsumsi senyawa fenol dipercaya dapat mengurangi resiko beberapa penyakit kronis karena senyawa ini bersifat sebagai antioksidan, anti inflamasi, detoksifikasi dan antikolesterol.
5) Tanin
Tanin merupakan substansi yang tersebar luas pada daun, buah, batang dan
kulit kayu. Senyawa tanin pada buah yang belum matang berada dalam bentuk
oksidasi tanin yang digunakan sebagai energi untuk proses metabolisme. Artati et al. (2007) menyatakan bahwa tanin merupakan senyawa fenolik yang
terdiri atas bermacam-macam kelompok oligomer dan polimer.
Pengujian fitokimia ekstrak kasar metanol dan etil asetat positif mengandung senyawa tanin yang ditandai dengan terbentuknya warna hijau kehitaman setelah ditambah larutan FeCl3. Ekstrak kasar n-heksana tidak
mengandung senyawa tanin yang ditandai dengan tidak terbentuknya warna hijau kehitaman setelah ditambahkan larutan FeCl3.
Umumnya komponen utama senyawa tanin adalah fenolik dalam bentuk polimerik fenol yang banyak terdapat pada teh dan tanaman mangrove. Senyawa ini akan memberi efek rasa sepat karena kemampuan tanin dalam menyambung silang protein yang rusak. Tanin terdiri dari dua macam yaitu tanin terkondensasi atau flavon yang dibentuk dari kondensasi katekin tunggal yang membentuk senyawa dimer dan kemudian senyawa oligomer yang lebih tinggi. Jenis tanin yang lain adalah tanin terhidrolisis yang terdiri dari depsida galoiglukosa.
Senyawa tanin yang sering dijumpai pada teh hijau adalah catechins, sedangkan pada teh hitam senyawa catechins diubah menjadi theaflavin dan thearubigins. Hal ini sesuai dengan pernyataan Das et al. (2008) bahwa senyawa yang terkandung di dalam teh hitam, (theaflavin) merupakan senyawa yang mendapatkan perhatian lebih karena fungsinya sebagai antioksidan, antipatogen, dan antikanker.
4.3 Aktivitas Antioksidan
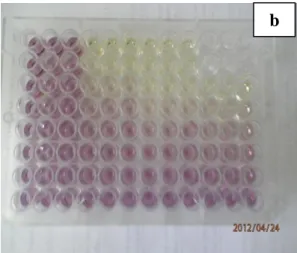
Adanya aktivitas antioksidan dari sampel mengakibatkan perubahan warna pada larutan DPPH yang semula berwarna ungu pekat menjadi kuning. Menurut Andayani et al. (2008) adanya aktivitas antioksidan dari sampel mengakibatkan perubahan warna pada larutan DPPH dalam etanol yang semula berwarna ungu pekat menjadi kuning pucat. Perhitungan pembuatan larutan stok dan pengencerannya disajikan pada Lampiran 6. Perubahan warna ekstrak kasar yang telah ditambahkan larutan DPPH dapat dilihat pada Gambar 16.
Gambar 16 Perubahan warna ekstrak kasar setelah penambahan DPPH Keterangan : a) Sebelum inkubasi 37 oC
b) Sesudah inkubasi 37 oC
Intensitas perubahan warna yang terjadi pada larutan asam askorbat dan larutan ekstrak kasar buah bakau diukur absorbansinya dengan menggunakan EpochTM Microplate Spectrophotometer dengan panjang gelombang 517 nm yang merupakan panjang gelombang maksimum DPPH. Nilai absorbansi tersebut selanjutnya digunakan untuk menentukan nilai persen inhibisi dan nilai IC50 dari
antioksidan asam askorbat dan antioksidan ekstrak buah bakau. Hasil uji aktifitas
antioksidan asam askorbat dan ekstrak kasar buah bakau dapat dilihat pada Tabel 4. Perhitungan persen inhibisi dan IC50 dapat dilihat pada Lampiran 7 dan 8.
Tabel 4 Hasil uji aktivitas antioksidan ekstrak kasar buah bakau
Sampel % Inhibisi IC50 (ppm) Asam Askorbat 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm 18,18 35,70 54,76 73,24 85,78 5,59 15,62 ppm 31,25 ppm 61,25 ppm 125 ppm 250 ppm 500 ppm Ekstrak Metanol 11,53 24,10 42,44 68,33 84,05 84,91 58,61 Ekstrak etil asetat 7,07 15,66 25,97 44,22 67,63 82,32 120,19 Ekstrak n-heksana -0,84 0,33 1,63 3,97 1,22 4,60 354,83 Nilai IC50 asam askorbat yang diperoleh dalam penelitian ini adalah 5,59
ppm. Penelitian yang dilakukan Banerjee et al. (2008) pada kulit batang tanaman
Rhizophora mucronata mendapatkan nilai IC50 asam askorbat sebesar 3,62 ppm.
Hasil tersebut menunjukkan bahwa antioksidan asam askorbat merupakan antioksidan dengan aktivitas sangat kuat, sesuai dengan pernyataan dari Molyneux (2004) bahwa suatu bahan dengan nilai IC50 < 50 ppm merupakan antioksidan
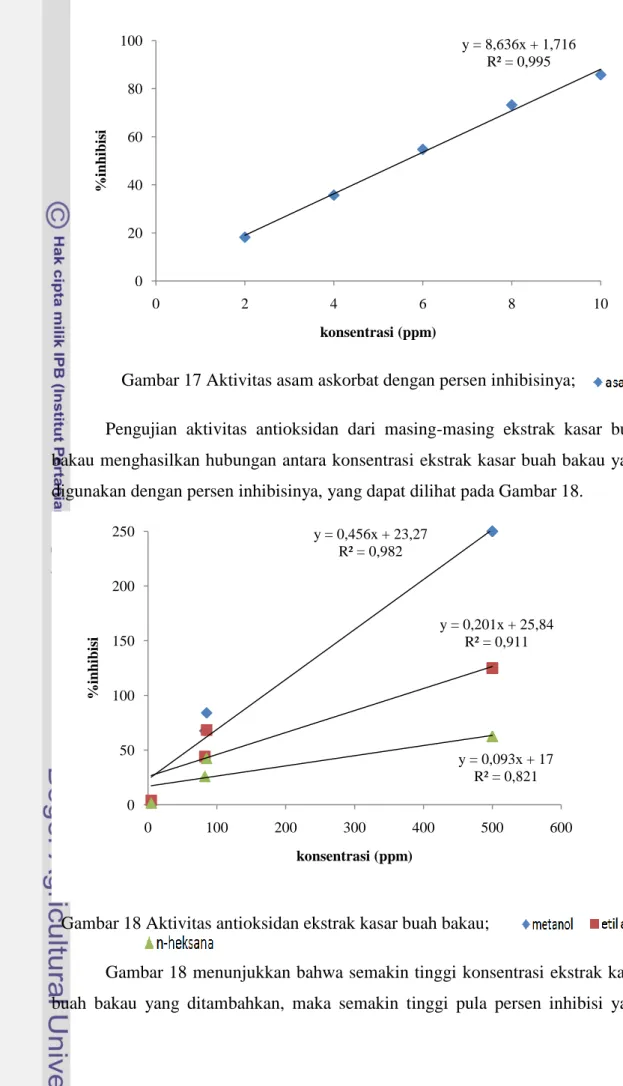
yang sangat kuat. Pengujian aktivitas antioksidan asam askorbat ini menghasilkan hubungan antara konsentrasi asam askorbat dengan persen inhibisinya, yang dapat dilihat pada Gambar 17.
Gambar 17 Aktivitas asam askorbat dengan persen inhibisinya;
Pengujian aktivitas antioksidan dari masing-masing ekstrak kasar buah bakau menghasilkan hubungan antara konsentrasi ekstrak kasar buah bakau yang digunakan dengan persen inhibisinya, yang dapat dilihat pada Gambar 18.
Gambar 18 Aktivitas antioksidan ekstrak kasar buah bakau; , , Gambar 18 menunjukkan bahwa semakin tinggi konsentrasi ekstrak kasar buah bakau yang ditambahkan, maka semakin tinggi pula persen inhibisi yang
y = 8,636x + 1,716 R² = 0,995 0 20 40 60 80 100 0 2 4 6 8 10 %inh ibi si konsentrasi (ppm) y = 0,456x + 23,27 R² = 0,982 y = 0,201x + 25,84 R² = 0,911 y = 0,093x + 17 R² = 0,821 0 50 100 150 200 250 0 100 200 300 400 500 600 %inh ibi si konsentrasi (ppm)
dihasilkan. Presentase inhibisi tertinggi dihasilkan oleh larutan yang mengandung konsentrasi ekstrak kasar terbanyak, yaitu larutan dengan konsentrasi 500 ppm pada masing-masing ekstrak kasar. Persen inhibisi terendah dihasilkan oleh larutan yang mengandung konsentrasi ekstrak kasar terkecil yaitu larutan dengan konsentrasi 15,62 ppm. Hal tersebut sesuai dengan penelitian yang dilakukan oleh Hanani et al. (2005) yang menyatakan bahwa presentase penghambatan ekstrak kasar terhadap aktivitas radikal bebas meningkat dengan meningkatnya konsentrasi ekstrak. Nilai rata-rata IC50 ekstrak kasar buah bakau dapat dilihat
pada Gambar 19.
Gambar 19 Diagram batang rata-rata nilai IC50 ekstrak kasar buah bakau;
angka-angka yang diikuti huruf berbeda menunjukkan hasil perlakuan yang berbeda nyata (p<0,05)
Hasil analisis ragam aktivitas antioksidan (Lampiran 10) menunjukkan jenis pelarut mempengaruhi aktivitas antioksidan ekstrak kasar buah bakau. Uji lanjut Duncan menunjukkan aktivitas antioksidan yang terdapat pada ekstrak methanol berbeda nyata dengan aktivitas antioksidan yang terdapat pada ekstrak etil asetat dan ekstrak n-heksana. Berdasarkan Gambar 19 dapat diketahui bahwa aktivitas antioksidan tertinggi adalah pada ekstrak kasar methanol dengan nilai IC50 sebesar 58,61 ppm. Penelitian yang dilakukan oleh Banerjee et al. (2009)
pada kulit batang tanaman Rhizophora mucronata yang diekstrak dengan pelarut metanol menghasilkan nilai IC50 sebesar 193,82 ppm. Tingginya aktivitas
antioksidan pada ekstrak kasar metanol berkorelasi dengan banyaknya senyawa 58,61a 120,19b 354,83c 0 50 100 150 200 250 300 350 400
metanol etil asetat n-heksana
Ra ta -ra ta I C50 (pp m ) Jenis pelarut
aktif yang dapat terdeteksi melalui uji fitokimia. Senyawa-senyawa bioaktif yang terdapat dalam ekstrak kasar metanol meliputi senyawa alkaloid, fenol hidrokuinon dan flavonoid. Senyawa tersebut memiliki aktivitas antioksidan. Hal ini sesuai dengan penelitiann dari Atta-au-rahman et al. (2001) bahwa senyawa yang berpotensi memiliki antioksidan umumnya adalah senyawa flavonoid, alkaloid dan fenolat yang merupakan senyawa-senyawa polar.
Aktivitas penghambatan oleh ekstrak etil asetat yang memiliki sifat semi polar diduga karena pelarut ini dapat mengekstrak senyawa antioksidan yang bersifat polar maupun non polar. Tensiska et al. (2007) berpendapat bahwa pelarut etil asetat mungkin lebih banyak mengandung senyawa isoflavon baik non polar (aglikon) maupun polar (glikon). Aktivitas antioksidan terkecil terdapat pada ekstrak n-heksana, yang nilai IC50 ekstrak tersebut berada pada nilai 354,83
ppm. Penelitian yang dilakukan oleh Suratmo (2009) pada daun sirih merah (Piper crocatum) menghasilkan filtrat n-heksana yang diketahui tidak memiliki aktivitas antioksidan, hal tersebut diduga karena filtrat n-heksana hanya mengandung senyawa non-polar saja seperti pada minyak atsiri, lemak, dan minyak yang tidak berpotensi antioksidan.
4.4 Aplikasi Ekstrak Terpilih dalam Menghambat Oksidasi
Ekstrak buah bakau yang memiliki aktivitas antioksidan terbaik selanjutnya diujikan pada emulsi minyak kelapa. Salah satu sifat antioksidan adalah dapat menghambat pembentukan peroksida pada minyak. Peroksida adalah hasil reaksi antara lemak tidak jenuh dengan oksigen yang dapat dijadikan indikator kerusakan minyak atau lemak. Uji ini bertujuan untuk mengukur tingkat penghambatan ekstrak dalam menghambat dan memperlambat terbentuknya peroksida yang terbentuk akibat proses oksidasi yang terjadi pada minyak selama inkubasi. Perhitungan bilangan peroksida merupakan salah satu cara untuk menentukan derajat kerusakan minyak atau lemak (Ketaren 1986). Ekstrak methanol yang dalam penelitian ini menghasilkan IC50 terbaik, dipilih untuk
diujikan pada emulsi minyak. Metode bilangan peroksida yang digunakan untuk mengevaluasi ekstrak terbaik adalah menggunakan emulsi minyak kelapa murni. Emulsi minyak kelapa dibuat dengan menghomogenkan 3% minyak kelapa
dengan 97% air yang mengandung 0,3% Tween 20 sebagai emulsifier menurut metode Santoso et al. (2004).
Aktivitas antioksidan terbaik diukur dengan cara menghitung nilai bilangan peroksida emulsi minyak yang diinkubasi pada suhu 37 oC selama 7 hari. Ekstrak kasar metanol yang ditambahkan diharapkan dapat menghambat oksidasi lemak sehingga nilai bilangan peroksida emulsi minyak akan lebih kecil. Konsentrasi ekstrak kasar metanol yang digunakan yaitu 0 ppm (tanpa penambahan ekstrak kasar), 15,62 ppm, 31,25 ppm, 61,25 ppm, 125 ppm, 250 ppm, 500 ppm, dan 1000 ppm. Pengujian dilakukan sebanyak 3 kali ulangan dan perhitungan bilangan peroksida dapat dilihat pada Lampiran 9. Hasil nilai bilangan peroksida pada emulsi minyak dengan penyimpanan selama 7 hari dapat dilihat pada Gambar 20.
Gambar 20 Diagram batang bilangan peroksida pada emulsi minyak dengan ekstrak kasar buah bakau; angka-angka yang diikuti huruf berbeda menunjukkan hasil perlakuan yang berbeda nyata (p<0,05)
Hasil analisis ragam bilangan peroksida (Lampiran 11) menunjukkan bahwa konsentrasi ekstrak kasar memberikan pengaruh terhadap bilangan peroksida buah bakau. Uji lanjut Duncan menunjukkan bahwa konsentrasi 31,25 ppm tidak berbeda nyata dengan konsentrasi ekstrak 0 ppm, 15,62 ppm, 61,25 ppm dan 125 ppm. Hal ini diduga disebabkan oleh kecepatan proses dan tipe lemak yang mempengaruhi proses oksidasi.
6,86a 4,32a 3,00ab 2,26ab 1,73bc 1,19c 0,79d 0,53e 0 1 2 3 4 5 6 7 8 0 15.62 31.25 61.25 125 250 500 1000 B ila ng a n pero k sida M eg /k g ba ha n Konsentrasi ekstrak (ppm)
Indikator utama kerusakan lemak dan minyak adalah terbentuknya ketengikan sebagai akibat reaksi oksidasi. Proses oksidasi akan menyebabkan lemak menjadi rusak dan menyebabkan perubahan bau, warna dan tekstur. Oksidasi terjadi secara spontan jika bahan berlemak dibiarkan kontak dengan udara, sedangkan kecepatan proses oksidasinya bergantung pada tipe lemak dan kondisi penyimpanan (Ketaren 1986).
Standar bilangan peroksida pada minyak kelapa yang diperbolehkan
berdasarkan Asian and Pasific Coconut Community (APCC) (2003) adalah ≤ 3 Meq/kg minyak selama 7 hari. Ekstrak kasar terbaik (metanol) dapat
menghambat oksidasi lemak pada batas yang diperbolehkan sebesar ≤ 3 Meq/kg minyak adalah pada konsentrasi 31,25 ppm selama 7 hari. Penggunaan ekstrak dengan konsentrasi 31,25 ppm lebih efisien dan efektif dibandingkan dengan penggunaan konsentrasi ekstrak yang lebih besar. Hal tersebut dikarenakan pada konsentrasi 31,25 ppm menggunakan sedikit ekstrak dan bilangan peroksida yang dihasilkan tidak berbeda nyata dengan konsentrai ekstrak 61,25 ppm dan 125 ppm. Konsentrasi ekstrak 61,25 ppm dan 125 ppm menghasilkan nilai bilangan peroksida yang lebih rendah tetapi membutuhkan ekstrak yang lebih banyak. Emulsi minyak dengan konsentrasi 0 ppm dan 15,62 ppm menghasilkan nilai bilangan perosida sebesar 6,68 Meq/kg minyak selama 7 hari dan 4,32 Meq/kg minyak selama 7 hari. Nilai tersebut melebihi standar yang telah ditentukan oleh APCC (2003) sehingga dapat disimpulkan bahwa emulsi minyak kedua konsentrasi tersebut sudah mengalami kerusakan dan sudah tidak layak digunakan.