A. Latar Belakang
Lele dumbo merupakan ikan ekonomis penting yang banyak dibudidayakan oleh petani ikan, tidak terkecuali di wilayah Banyumas. Beberapa keunggulan ikan ini ialah mudah dibudidayakan, pertumbuhannya relatif cepat, dan harga jualnya yang cukup tinggi (Santoso, 1994). Namun, keberhasilan budidaya ikan ini sering mendapat kendala karena adanya penyakit MAS (Motile Aeromonas Septicemia) yang disebabkan oleh bakteri Aeromonas
hydrophila. Penyakit MAS sampai saat ini merupakan penyakit terpenting yang menyerang ikan air tawar dan menimbulkan kerugian yang sangat besar. Pada ikan lele, tingkat kematian dapat mencapai 80%, bahkan 100% dalam waktu sekitar satu minggu. Penyebaran penyakit ini sangat luas dan cepat sejalan dengan meluasnya usaha budidaya dan meluasnya jaringan penyebaran benih dan ikan konsumsi, baik ikan segar maupun ikan hidup (Triyanto et al., 1997).
Penanggulangan penyakit MAS dengan obat-obatan dan antibiotik menimbulkan dampak negatif terhadap kualitas lingkungan, kesehatan konsumen, dan timbulnya mikroorganisme resisten (Mulia, 2003). Vaksinasi merupakan salah satu cara yang efektif dan efisien untuk mencegah penyakit MAS karena dengan vaksinasi dapat diperoleh kekebalan yang cukup lama meskipun hanya dengan 1-2 kali pemberian vaksin, tidak ada efek samping, dapat dilakukan pada berbagai ukuran ikan dari benih sampai induk (Triyanto et al., 1996; Kamiso, 1997).
Tingkat perlindungan yang ditimbulkan oleh vaksinasi sangat tergantung pada jenis dan kualitas vaksin, cara vaksinasi, kondisi ikan, dan lingkungan hidupnya (kualitas air) (Souter, 1984; Kamiso et al., 1998). Penggunaan vaksin dari satu strain A. hydrophila (monovalen) memberikan hasil bervariasi. Murtiningsih (2003) menggunakan vaksin sitoplasma sel A.
hydrophila strain Cangkringan, sintasan lele dumbo mencapai 66,7-100%. Vaksinasi dengan vaksin produk ekstraseluler dan intraseluler sel A. hydrophila strain Moyudan pada lele dumbo menghasilkan sintasan 58,67% (vaksin produk ekstraseluler) dan 85,33% (vaksin produk intraseluler) (Mulia & Purbomartono, 2007).
Pembuatan vaksin polivalen dari sel A. hydrophila yang diisolasi dari lele dumbo sakit di wilayah Banyumas dan sekitarnya belum pernah dilakukan, apalagi pengembangan vaksin polivalen plus dengan penambahan vitamin C dan adjuvant. Oleh karena itu, dalam penelitian ini akan dikembangkan pembuatan vaksin polivalen plus yang imunogenik dan protektif dari beberapa isolat A. hydrophila yang diperoleh dari tiga lokasi, yaitu Banyumas, Purbalingga, dan Banjarnegara serta uji vaksinasinya, baik skala laboratorium maupun lapangan.
BAB II. TINJAUAN PUSTAKA
A. Lele Dumbo (Clarias gariepinus)
Lele dumbo merupakan ikan air tawar hasil persilangan antara induk betina C. fuscus yang berasal dari Taiwan dengan induk jantan C. mossambicus dari Kenya. Ikan ini diintroduksi dari Taiwan sekitar bulan November 1986 (Santoso, 1994). Lele dumbo mempunyai bentuk badan memanjang, bagian kepala pipih ke bawah (depressed), sedangkan bagian tubuh ke arah belakang berbentuk pipih ke samping (compressed), batok kepala umumnya keras (Susanto, 1988). Berbeda dengan jenis ikan konsumsi lainnya yang mempunyai sisik, seluruh bagian tubuh lele dumbo mulai dari ujung mulut sampai bagian ekor tidak ditutupi sisik. Pada sirip dada dilengkapi dengan patil atau taji yang tidak beracun. Dibandingkan dengan lele lokal, patil lele dumbo lebih pendek dan tumpul (Santoso, 1994).
Genus Clarias mempunyai alat pernapasan tambahan untuk mengatasi perairan dengan kadar oksigen rendah, yaitu organ epibranchial atau organ arborescent (Lagler et al., 1977). Oleh karena itu, lele dumbo dapat bertahan pada kondisi lingkungan perairan yang buruk seperti kandungan oksigen terlarut yang rendah. Lele dumbo memiliki sifat nokturnal yaitu aktif bergerak dan mencari makan pada malam hari. Namun, pada kolam budidaya lele dumbo dapat dibiasakan diberi pakan pada siang hari (Santoso, 1994). Ikan ini termasuk karnivora, juga scavenger (pemakan bangkai). Di kolam-kolam budidaya, lele dumbo memakan segala jenis makanan (Mudjiman, 1989).
B. Bakteri Aeromonas hydrophila
Aeromonas hydrophila merupakan bakteri Gram negatif, berbentuk batang dengan ukuran 0,7-0,8 µm, bersifat fakultatif anaerob, kemoorganotrof, fermentatif, sitokrom oksidase positif, dan bersifat motil (Frerichs & Roberts, 1978). Bakteri ini resisten terhadap penisilin,
tumbuh optimum pada suhu 37°C dan dapat tumbuh pada suhu 4-45°C (Farmer et al., 2000). Bakteri A. hydrophila tidak membentuk kapsul maupun spora. Koloni berbentuk bulat, tepi rata, cembung dan berwarna kuning keputih-putihan (krem) (Post, 1983; Sarono et al., 1993). Dilihat dari cara hidupnya, A. hydrophila bersifat patogen oportunistik, selalu berada dalam air dan menyerang ikan pada waktu ikan lemah. Bakteri ini dapat hidup di air tawar, dan juga dapat hidup di perairan payau dan laut (Newman, 1982) dan mempunyai toleransi suhu yang lebar (Post, 1983). Perairan air tawar, khususnya yang mengandung banyak bahan organik merupakan habitat yang baik bagi perkembangan A. hydrophila (Frerichs & Roberts, 1978; Stevenson, 1988). A. hydrophila mempunyai sifat biokimia, genetik, serologi, dan fenotip yang beragam (Newman, 1982; Stevenson, 1988). Kemampuan A. hydrophila menimbulkan penyakit cukup tinggi. Tingkat keganasan yang diukur dengan LD50 cukup bervariasi, yaitu berkisar antara 104-106 sel/ml (Sarono et al., 1993). Penyakit bakterial yang disebabkan oleh bakteri A. hydrophila disebut dengan MAS (Motil Aeromonas Septicemia). Gejala eksternal yang muncul akibat penyakit MAS adalah adanya ulser yang berbentuk bulat atau tidak teratur dan berwarna merah keabu-abuan, inflamasi dan erosi di dalam rongga dan sekitar mulut seperti redmouth disease. Selain itu terjadi hemorrhagik pada sirip serta mata membengkak dan menonjol (eksophtalmia/popeye) (Sarono et al., 1993). Gejala internal dari penyakit MAS adalah pembengkakan ginjal tetapi tidak lembek, petikiae (bintik merah) pada otot daging dan peritoneum, usus tidak berisi makanan tetapi berisi cairan kuning. Gejala khas dari bakteri ini adalah adanya sejumlah besar cairan kuning pada rongga perut (Sarono et al., 1993). Di Indonesia A. hydrophila menyerang ikan tawes (Hardjautomo et al., 1981), ikan lele dan ikan karper (Djajadiredja & Cholik, 1982; Sarono et al., 1993), ikan gurami (Taufik, 1982; Supriyadi et al., 1995). Jenis ikan di daerah subtropik yang banyak terserang oleh bakteri ini antara lain rainbow trout dan Chinook salmon (Sarono et al., 1993). Selain menyerang ikan, A.
hydrophila juga dapat menyerang amphibia, reptil (ular dan kura-kura) (Post, 1983), buaya (Newman, 1982), bahkan berpotensi menyerang manusia (Newman, 1982; Post, 1983; Stevenson, 1988). A. hydrophila dapat menyebabkan diare pada manusia (Fraizier et al., 1988).
C. Sistem Pertahanan Tubuh
Sistem pertahanan tubuh pada ikan dipengaruhi oleh kondisi anatomis, fisiologis, spesies, umur, berat badan, dan lingkungan luar sehingga memungkinkan adanya tingkatan yang berbeda-beda (Schaperclaus, 1992). Sistem pertahanan tubuh ikan terdiri dari dua macam, yaitu sistem pertahanan nonspesifik dan spesifik (Davies, 1997).
1. Sistem Pertahanan Nonspesifik
Sistem pertahanan nonspesifik berfungsi untuk melawan segala jenis patogen, bersifat permanen, diturunkan kepada anakannya, dan tidak perlu adanya rangsangan (Schaperclaus, 1992). Pada ikan, pertahanan pertama untuk melawan patogen terdapat pada permukaan tubuh. Secara fisik, daerah permukaan tubuh dapat menghambat masuknya patogen ke dalam tubuh ikan (Atlas, 1997) meliputi mukus, kulit, insang, dan saluran gastrointestinal (Ellis, 1989). Sistem pertahanan nonspesifik kimiawi meliputi komponen-komponen dalam serum darah yang berfungsi menghambat pertumbuhan mikrobia. Komponen-komponen tersebut adalah komplemen, C-reaktif protein (CRP), interferon, lisozim, transferin, antiprotease (Ingram, 1980; Ellis, 1988; Ellis, 1989), dan asam (Schaperclaus, 1992; Atlas, 1997). Sistem pertahanan nonspesifik menggunakan mekanisme efektor seluler berupa aktivitas fagositosis yang melibatkan sel-sel organ dan sel motil. Sel-sel organ meliputi sel jaringan penghubung (fibroblast), jaringan lymphoid dari saluran pencernaan, sel reticuloendothelial, sel dinding kapiler, dan jaringan monosit. Sel motil terdiri atas makrofag, leukosit nongranular (monosit
dan limfosit), dan leukosit granular (neutrofil, eosinofil, dan basofil) (Ingram, 1980; Schaperclaus, 1982).
2. Sistem Pertahanan Spesifik
Sistem pertahanan spesifik berfungsi untuk mempertahankan diri terhadap penyakit tertentu dan pembentukannya memerlukan rangsangan terlebih dahulu. Rangsangan dapat terjadi secara alami dan buatan atau dengan vaksinasi (Ellis, 1989). Sistem pertahanan spesifik terdiri atas dua macam, yaitu sistem pertahanan seluler atau cell mediated immunity (CMI) dan sistem pertahanan humoral (produksi antibodi) (Ellis, 1988; Noble & Noble, 1989). Sistem pertahanan seluler dihasilkan oleh aktivitas limfosit yang disebut sel-sel T, yang berlangsung dalam kelenjar timus. Bila terjadi kontak dengan antigen spesifik, sel-sel T berdiferensiasi menjadi sel-sel yang mampu mengadakan interaksi langsung dengan sel atau jaringan asing dan kemudian merusaknya. Oleh karena itu, sel-sel T disebut sel pembunuh. Fungsi sel pembunuh ditingkatkan melalui kontak langsung antara sel-sel T efektor dengan membran permukaan sel sasaran, atau melalui pelepasan mediator yang bersifat larut nonspesifik dan nonantibodi yang disebut lymphokines (Noble & Noble, 1989).
Pertahanan humoral diprakarsai oleh golongan limfosit yang disebut sel-sel B, yang bila diaktivasi oleh pengenalan suatu benda atau substansi asing berusaha menjadi sel-sel plasma yang memproduksi antibodi (Noble & Noble, 1989), sedangkan pengenalannya dilakukan setelah antigen diproses oleh makrofag. Kemudian makrofag memberikan pesan kepada limfosit (Anderson, 1974). Antibodi ini dihasilkan di hati, ginjal, limpha, dan kelenjar timus (Lagler et al., 1977). Antibodi umumnya dikenal sebagai imunoglobulin, yakni protein yang Imunoglobin yang ditemukan dalam ikan termasuk dalam klas IgM (Davies, 1997). Respons imun terhadap suatu antigen tergantung pada dosis dan cara pemasukannya ke dalam tubuh. Pada umumnya, cara pemasukan antigen ke dalam tubuh dapat langsung melalui kulit, organ
pernapasan, saluran pencernaan, atau disuntikkan, dan masing-masing cara tersebut dapat menimbulkan respons imun yang berbeda intensitasnya (Subowo, 1993).
D. Vaksinasi dan Hasil Penelitian Terakhir
Vaksinasi adalah salah satu cara pemberian rangsangan atau antigen secara sengaja agar ikan dapat memproduksi antibodi terhadap suatu bibit penyakit atau patogen. Vaksin umumnya terdiri dari dua tipe, yaitu vaksin hidup yang merupakan patogen hidup dan tidak mempunyai tingkat keganasan atau tingkat keganasannya rendah dan vaksin mati yang merupakan patogen yang telah diinaktifkan (Ellis, 1988). Cara vaksinasi dapat dilakukan melalui injeksi, pakan, rendaman, hiperosmotik, celupan, dan semprotan (Smith, 1982).
Faktor-faktor yang mempengaruhi keberhasilan vaksinasi pada ikan adalah temperatur, umur, dan berat ikan, faktor pemeliharaan, dan sifat vaksin. Faktor pemeliharaan yang berpengaruh adalah kesehatan ikan, pakan (terutama vitamin C dan vitamin E), adanya polutan, antibiotik, dan lingkungan, sedangkan sifat vaksin yang berpengaruh adalah jenis antigen, dosis antigen, cara vaksinasi, dan pelarut antigen (Ellis, 1988). Bakteri mempunyai beberapa macam antigen yang bersifat imunogenik. Jenis antigen yang dimiliki bakteri patogen antara lain (Anonim, 1994) :
1. antigen H (whole cell) untuk mendiagnosa paling baik karena terdiri dari protein sehingga mampu bereaksi dengan antibodi secara kuat;
2. antigen O yaitu lipopolisakarida (LPS) yang merupakan dinding sel bakteri gram negatif, letaknya di bagian luar dari sel sehingga cepat bereaksi atau dikenal;
4. antigen Vi (faktor virulen) dapat untuk mengidentifikasi atau mendiagnosa, namun hasilnya bervariasi karena setiap spesies bakteri mempunyai faktor virulen atau keganasan yang berbeda.
Pemakaian vaksin A. hydrophila telah dicoba oleh berbagai peneliti, baik di luar negeri maupun di Indonesia. Pada Simposium of Fish Vaccination pada tahun 1984, Song et al. (1976) menyatakan keberhasilan vaksinasi pada ikan Japanese eel (Anguilla japonica) dengan vaksin monovalen A. hydrophila. Daya lindung vaksin tersebut adalah 89%, sedangkan pada ikan salmon, ia mendapatkan hasil yang berbeda-beda, namun tampak adanya respons kekebalan yang nyata. Selanjutnya, Thune (1980) melakukan vaksinasi ikan lele dengan cara merendam dan mencelupkan ke dalam antigen A. hydrophila, kemudian dilakukan uji tantang dengan bakteri yang sama. Hasil penelitian menunjukkan 45% ikan kontrol mati, sedangkan ikan yang divaksin dengan pencelupan 13% mati dan dengan perendaman ikan yang mati hanya 7,1%. Vaksinasi dengan menggunakan vaksin whole cell bakteri A. hydrophila pada ikan Tilapia
nilotica menunjukkan tidak ada mortalitas selama 5 minggu (Ruangapan et al., 1986 cit Stevenson, 1988). Kamiso et al. (1997a) mendapatkan sintasan benih lele dumbo beukuran 2-3 cm yang divaksin dengan vaksin whole cell bakteri A. hydrophila adalah sebesar 23-46,2%, pada benih ukuran 8-10 cm mencapai 47,85-93%. Pada benih yang dihasilkan dari induk yang telah divaksinasi dengan vaksin whole cell, sintasannya mencapai 63,1-85,2% (Triyanto et al., 1996). Aplikasi penggunaan vaksin di lapangan untuk mengendalikan penyakit MAS pada ikan lele telah dicoba dan sintasan yang diperoleh adalah 50-100% (Supriyadi & Rukyani, 1990). Menurut Nugroho et al. (1990) ikan karper yang diberi vaksin supernatan (produk ekstraseluler) sintasannya mencapai 54,76%, vaksin complete 47,62%, dan vaksin whole cell 42,86%, sedangkan kontrol dengan PBS steril sintasannya 9,52%. Kamiso et al. (1997b) membandingkan efektivitas antara vaksin whole cell dari A. hydrophila dan tetrasiklin dalam
menanggulangi penyakit MAS pada lele dumbo. Sintasan ikan yang divaksin adalah 69,55%, sedangkan yang menggunakan tetrasiklin adalah 61,76%.
Dalam penelitian-penelitian yang telah dilakukan sampai saat ini, vaksin yang digunakan umumnya adalah vaksin sel utuh (whole cell). Baru-baru ini telah dilakukan penelitian penggunaan vaksin protein sitoplasma dan debris sel pada lele dumbo. Mulia (2003) menggunakan vaksin protein debris sel A. hydrophila untuk menanggulangi penyakit MAS pada lele dumbo, sintasan mencapai 70-100%. Murtiningsih (2003) menggunakan vaksin sitoplasma sel A. hydrophila strain Cangkringan pada lele dumbo, sintasan mencapai 66,7-100%. Olga (2003) menggunakan vaksin protein sitoplasma dengan berat molekul berkisar antara 40-100 kDa pada lele dumbo, sintasan mencapai 42,22-75,56%. Mulia et al. (2004) menggunakan vaksin debris sel A. hydrophila secara suntikan dengan variasi cara booster, yaitu suntik, oral, dan rendaman pada lele dumbo, sintasan mencapai 100 % dibandingkan kontrol 45,56 %. Suryantinah et al. (2005) menggunakan vaksin debris sel A. hydrophila pada nila, sintasan mencapai 62,97-81,84 %. Mulia et al. (2006) menggunakan vaksin debris sel A.
hydrophila dengan cara oral dan beberapa cara booster, yaitu suntik, oral, dan rendaman pada lele dumbo. Sintasan dengan vaksinasi oral dan booster suntik adalah 100%, vaksinasi dan
booster oral adalah 70%, sedangkan vaksinasi oral dan booster rendaman adalah 80%.
Penggunaan bagian lain dari A. hydrophila juga telah diteliti. Mulia (2007) menggunakan vaksin A. hydrophila jenis antigen O (Ag O) dan antigen H (Ag H) pada gurami, sintasan mencapai 56,00-58,00%, dibandingkan kontrol 10,00%. Mulia & Purbomartono (2007) membandingkan efektivitas vaksin produk intraseluler dan ekstraseluler sel A.
hydrophila strain Moyudan pada lele dumbo. Ikan yang divaksinasi dengan vaksin produk ekstraseluler sintasannya mencapai 58,67%, sedangkan yang divaksinasi dengan vaksin produk intraseluler sintasannya mencapai 85,33%. Olga & Aisiah (2007) menggunakan vaksin produk
ekstraseluler A. hydrophila dengan dosis 2,5-10 µg pada ikan patin dan memberikan tingkat perlidungan 44,87-92,31 %.
Vaksin polivalen adalah vaksin yang dibuat dari dua atau lebih strain dari spesies mikroorganisme atau virus yang sama, atau biasa juga diistilahkan vaksin multivalen (Anonim, 2006). Kemampuan campuran antigen spesifik dalam menciptakan pertahanan dan memiliki tingkat imunogenitas yang baik tergantung pada strain patogen, parameter penyimpanan, dan metode vaksinasi. Hasil penelitian Lund et al. (2002) menunjukkan bahwa vaksin multivalen
Aeromonas salmonicida menghasilkan tingkat efikasi yang lebih tinggi daripada vaksin monovalen pada vaksinasi ikan spotted wolfish (Anarchicas minor O.) serta memberikan tingkat perlindungan yang lebih baik. Kamiso et al. (2005) telah berhasil menggunakan vaksin polivalen untuk mengendalikan vibriosis pada kerapu tikus secara suntik, oral, dan rendaman, sintasan mencapai 100 % dibandingkan kontrol 80 %.
E. Vitamin C
Vitamin C merupakan agen pereduksi. Hidroksilasi dan reduksi merupakan reaksi yang berhubungan dengan fungsi vitamin C. Dalam reaksi hidroksilasi lisin dan prolin, vitamin C berperan sebagai co-faktor. Lisin dan prolin merupakan komponen jaringan konektif yang merupakan dasar struktural anatomi hewan multisel (O’Keefe & Grout, 1991 cit Isansetyo, 1996).
Konsentrasi vitamin C yang dibutuhkan untuk meningkatkan potensi adaptif dan ketahanan terhadap penyakit lebih besar dibandingkan dengan kebutuhan untuk pertumbuhan dan konversi pakan yang optimal. Dengan demikian konsentrasi vitamin C yang normal pada pakan merupakan faktor pembatas untuk mengoptimalkan tanggap kebal dan mekanisme pertahanan non-spesifik lainnya (Ellis, 1988).
Vitamin C dapat meningkatkan ketahanan rainbow trout (Oncorhyncus mykiss) terhadap virus infectious hematopoetic (IHNV). Selain meningkatkan antibodi, vitamin C yang memadai juga meningkatkan aktivitas Cell Mediated Immunity (CMI) atau faktor-faktor non spesifik lainnya (Setyabudi et al., 1992). Pemberian vitamin C dengan dosis 500 dan 1000 mg/kg pakan dapat meningkatkan tanggap kebal dan tingkat perlindungan relatif serta menurunkan mortalitas pada vaksinasi lele dumbo dengan vaksin A. hydrophila (Isnansetyo, 1996). Johny & Roza (2007) menggunakan kombinasi vitamin C dengan imunostimulan (1000 mg vitamin C + 1 ml bakterin/kg pakan) untuk meningkatkan imunitas benih ikan kerapu lumpur. Penggunaan kombinasi vitamin C dan imunostimulan menghasilkan sintasan dan aktivitas fagositik tertinggi yaitu 76,7% dan 21,0% dibandingkan perlakuan dengan imunostimulan saja (68,3% dan 18,5%) dan kontrol (41,7% dan 9,5%). Mudjiutami et al. (2008) menggunakan vitamin C dan imunostimulan untuk meningkatkan daya tahan tubuh lele dumbo terhadap serangan penyakit. Vitamin C dicampurkan dalam pakan dengan dosis 500 mg/kg pakan, sedangkan immunostimulan yang diterapkan melalui pakan diberikan dengan dosis 0.1 %/kg pakan dan cara perendaman dengan dosis 100 ug/ml.
F. Adjuvant
Adjuvant adalah suatu unsur yang ditambahkan ke suatu vaksin untuk meningkatkan reaksi kebal. Adjuvant yang paling sederhana adalah senyawa yang berfungsi untuk memperlambat pengeluaran antigen ke dalam tubuh (Tizard, 1982).
Sistem kebal merupakan antigen terkendali. Sistem tersebut bereaksi terhadap kehadiran antigen dan berhenti bereaksi segera sesudah antigen disingkirkan. Memperlambat derajat penyingkiran antigen mungkin saja dengan cara pertama-tama mencampurkannya dengan antigen yang tidak terlarut sehingga terbentuk depo. Contoh adjuvant pembentuk depo
termasuk garam alumunium yang tidak larut seperti alumunium hidroksida, alumunium fosfat, alumunium kalium sulfat (alum). Bila antigen dicampurkan dengan salah satu garam ini dan disuntikkan pada hewan, granuloma yang kaya dengan makrofag akan terbentuk dalam jaringan. Antigen yang berada di dalam granuloma perlahan-lahan bocor keluar ke dalam tubuh dan dengan demikian akan menyediakan rangsangan antigenik yang lama. Antigen yang biasanya bertahan hanya untuk beberapa hari dapat dipertahankan dalam tubuh untuk beberapa minggu dengan cara teknik ini. Adjuvant tersebut hanya mempengaruhi tanggap kebal primer dan sedikt pengaruhnya terhadap tanggap kebal sekunder (Tizard, 1982). Retmonojati (2007) menyatakan bahwa dosis optimal adjuvant alumunium potassium sulfat pada vaksin polivalen vibrio adalah 2 ppm, sedangkan dosis optimal adjuvant alumunium hidroksida adalah 6 ppm.
BAB III. TUJUAN DAN MANFAAT PENELITIAN TAHUN KE-II
A. Tujuan Penelitian
Penelitian ini bertujuan untuk :
a. membuat vaksin polivalen dari antigen H sel A. hydrophila terpilih,
b. membuat vaksin polivalen plus A. hydrophila dengan penambahan vitamin C dan adjuvant c. mengetahui efikasi vaksin tersebut dalam mengendalikan penyakit MAS pada lele dumbo
skala laboratorium.
B. Manfaat Penelitian
Usaha budidaya lele dumbo sering mendapat kendala karena adanya penyakit MAS (Motile Aeromonas Septicemia) yang disebabkan oleh bakteri A. hydrophila. Penyakit MAS sampai saat ini merupakan penyakit terpenting yang menyerang ikan air tawar dan menimbulkan kerugian yang sangat besar. Pada ikan lele, tingkat kematian dapat mencapai 80%, bahkan 100% dalam waktu sekitar satu minggu. Penyebaran penyakit ini sangat luas dan cepat sejalan dengan meluasnya usaha budidaya dan meluasnya jaringan penyebaran benih dan ikan konsumsi, baik ikan segar maupun ikan hidup (Triyanto et al., 1997). Dinas Peternakan dan Perikanan Wilayah Banyumas (2005) melaporkan setidaknya ada sekitar 19.900 ekor lele dumbo dari jumlah total 72.000 ekor ikan air tawar yang terserang A. hydrophila pada tahun 2003, dan 13.100 ekor gurami dari jumlah total 43.000 ekor ikan air tawar pada tahun 2004.
Berbagai usaha penanggulangan telah diterapkan oleh petani ikan termasuk perbaikan pengelolaan dan penggunaan obat-obatan, tetapi hasilnya kurang memuaskan. Vaksinasi merupakan salah satu cara penanggulangan penyakit MAS yang efektif dan efisien, karena tingkat perlindungannya cukup tinggi dan dapat melindungi ikan dalam waktu yang lama, lebih dari 3 bulan (Kamiso et al., 1997). Vaksinasi tidak menimbulkan dampak negatif, baik pada ikan, lingkungan, maupun konsumen (Supriyadi & Rukyani, 1990; Kamiso, 1997)
dan dapat dilakukan pada berbagai ukuran ikan dari benih sampai induk (Triyanto et al., 1996). Oleh karena itu, penanggulangan penyakit melalui vaksinasi mempunyai prospek yang sangat baik di masa yang akan datang.
Tingkat perlindungan yang ditimbulkan oleh vaksinasi sangat tergantung pada jenis dan kualitas vaksin, cara vaksinasi, kondisi ikan, dan lingkungan hidupnya (kualitas air) (Kamiso et
al., 1998). Penelitian penggunaan bemacam-macam antigen A. hydrophila sebagai vaksin sudah banyak dilakukan dengan hasil yang bervariasi. Nugroho et al. (1990) menggunakan vaksin supernatan (produk ekstraseluler) pada ikan karper, sintasannya mencapai 54,76%, sedangkan vaksin complete 47,62%, dan vaksin whole cell 42,86%. Kamiso et al. (1998) menggunakan vaksin sel utuh dan vaksin antigen murni A. hydrophila dengan cara rendaman, oral, dan suntik. Uji tantang dilakukan dengan cara rendaman. Sintasan lele dumbo yang divaksinasi secara rendaman adalah 98,34%, secara oral adalah 94,64%, dan secara suntik adalah 94,23%. Suryantinah et al. (2005) menggunakan vaksin debris sel A. hydrophila pada nila, sintasan mencapai 62,97-81,84 %. Murtiningsih (2003) menggunakan vaksin sitoplasma sel A. hydrophila strain Cangkringan, sintasan mencapai 66,7-100%. Olga (2003) menggunakan vaksin protein sitoplasma dengan berat molekul berkisar antara 40-100 kDa pada lele dumbo, sintasan mencapai 42,22-75,56%.
Penelitian pembuatan vaksin dari sel A. hydrophila yang diisolasi dari lele dumbo sakit yang diambil dari wilayah Banyumas dan sekitarnya belum pernah dilakukan. Padahal, isolat bakteri yang berasal dari daerah yang berbeda umumnya virulensinya pun berbeda dan ini sangat berpengaruh terhadap imunogenisitas vaksin yang dihasilkan. Penelitian-penelitian sebelumnya melaporkan bahwa strain A. hydrophila cukup banyak dan berbeda antar wilayah, sifat antigeniknya pun juga berbeda. Kamiso et al. (1997a) melaporkan adanya perbedaan sifat antigenik dari isolat A. hydrophila yang diperoleh dari beberapa daerah, yaitu isolat PA 01, PA
05, PA 06, PA 07, dan BA 02. Hasil penelitian menunjukkan bahwa jenis antigen yang dapat menimbulkan titer antibodi tinggi tidak sama untuk semua isolat. Jenis antigen yang dapat menimbulkan titer antibodi tertinggi pada isolat PA 01, PA 05, dan BA 02 adalah H (whole
cell), sedangkan untuk isolat PA 06 dan PA 07 adalah antigen O (karbohidrat). Triyanto (1996) menggunakan isolat A. hydrophila yang berasal dari Magelang, Tulugagung, dan Muntilan untuk memvaksin lele dumbo. Sintasan dan tingkat perlindungan relatif (Relative Percent
Survival/RPS) yang dihasilkan bervariasi. Sintasan mencapai 66,67%, 80,84%, 48,34% dan RPS 42,86%, 67,15%, 11,43%.
Penelitian ini akan diarahkan untuk membuat vaksin polivalen (disebut juga vaksin multivalen, Anonim, 2006) dari beberapa isolat yang diambil dari beberapa tempat yang sudah teruji virulensinya. Penggunaan vaksin polivalen untuk penanggulangan penyakit perlu diujicobakan mengingat dalam suatu sistem budidaya, serangan penyakit tidak hanya disebabkan oleh satu tipe atau strain bakteri, tetapi disebabkan oleh banyak tipe (Wong et
al.,1990). Hasil penelitian Lund et al. (2002) menunjukkan bahwa vaksin multivalen
Aeromonas salmonicida menghasilkan tingkat efikasi yang lebih tinggi daripada vaksin monovalen pada vaksinasi ikan spotted wolfish (Anarchicas minor O.) serta memberikan tingkat perlindungan yang lebih baik.
Setelah diperoleh vaksin polivalen, tujuan utama penelitian ini adalah membuat vaksin polivalen plus dari sel A. hydrophila dengan penambahan vitamin C dan adjuvant. Penambahan vitamin C dan adjuvant diharapkan bisa lebih mendukung kualitas produk vaksin tersebut sehingga diharapkan bisa menanggulangi serangan penyakit tidak hanya penyakit yang disebabkan oleh bakteri A. hydrophila, akan tetapi mampu bertahan menghadapi serangan jenis penyakit/parasit lain. Hal ini dikarenakan di perairan banyak sekali dijumpai berbagai parasit
dan penyakit yang siap menyerang. Selain itu, dengan penambahan vitamin C, diharapkan daya tahan tubuh ikan yang divaksinasi akan lebih meningkat lagi.
Penelitian ini mengupayakan dampak negatif sekecil mungkin dan dapat diterapkan pada kalangan petani sehingga masalah utama budidaya lele dumbo yang selama ini dihadapi petani dapat teratasi. Selain itu, hasil penelitian ini bisa dijadikan acuan dalam pengendalian penyakit MAS pada ikan air tawar lainnya, sehingga apabila penelitian ini berhasil, akan dicobakan pada ikan air tawar lainnya, seperti gurami, karper, maupun tawes. sehingga pemakaian vaksin dapat efektif dan efisien untuk memberikan tingkat proteksi paling baik.
BAB IV. METODE PENELITIAN
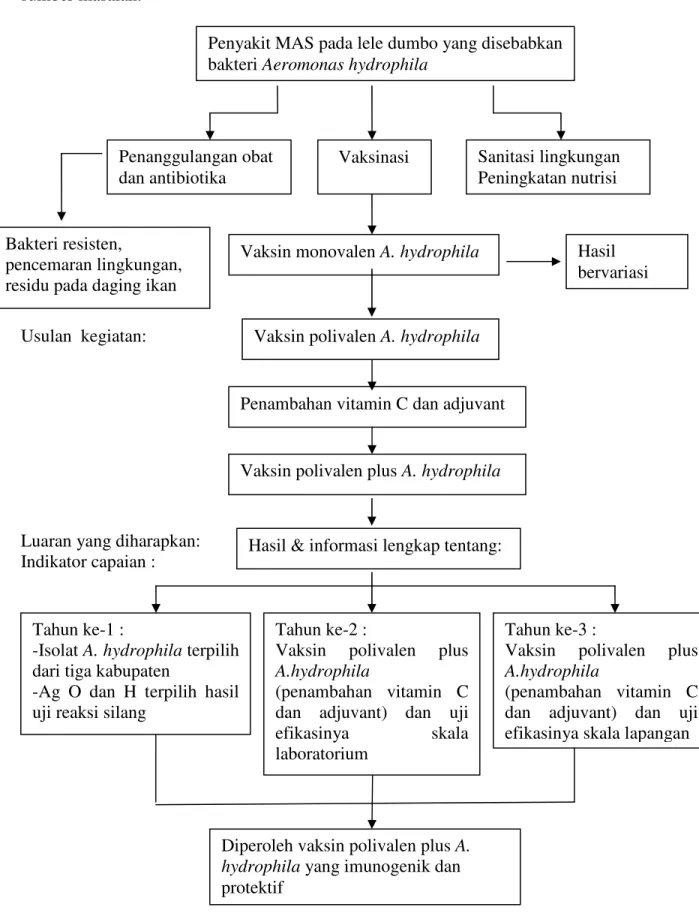
Penelitian ini merupakan penelitian berkelanjutan (multi years) yang berlangsung selama 3 tahun. Pada tahun 2009-2010, telah dilaksanakan penelitian tahun ke I dan ke II. Bagan alir penelitian tersaji pada Gambar 1.
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Prodi Pend. Biologi, FKIP dan Laboratorium Basah, UMP. Penelitian ini berlangsung selama 8 bulan.
B. Isolasi Bakteri Murni A. hydrophila
Kultur bakteri berasal dari isolat bakteri murni A. hydrophila yang didapatkan pada tahun ke-1. Setiap strain bakteri terpilih diisolasi pada medium GSP (Glutamat Starch Phenile) agar (Merck) dan diinkubasi pada suhu 37ºC selama 18-24 jam. Masing-masing satu koloni bakteri dikultur di dalam medium cair TSB dan diinkubasi pada suhu 37ºC selama 18-24 jam. Selanjutnya, bakteri dalam medium cair TSB digunakan untuk reinfeksi.
C. Mengembalikan Tingkat Virulensi Bakteri A. hydrophila
Reinfeksi dilakukan secara suntikan intramuskular dengan dosis 0,1 ml (1011cfu/ml) pada 5 ekor lele dumbo yang berukuran 10-12 cm. Reinfeksi pertama dilakukan untuk mengetahui apakah bakteri hasil isolasi dari stok merupakan bakteri patogen pada lele dumbo atau bukan. Lele dumbo yang telah diinfeksi dipelihara dalam ember bervolume 15 l dan diamati gejala penyakitnya setiap hari pada pagi dan sore hari. Isolat bakteri yang menimbulkan gejala penyakit seperti pendarahan berlebihan pada kulit, hyperplastik pada lamella insang, inflamasi pada rongga dan sekitar mulut dan berenang di permukaan adalah merupakan bakteri patogen. Setelah ada lele dumbo yang mati atau memiliki gejala penyakit yang parah maka dilakukan reisolasi. Reisolasi bakteri A. hydrophila dari sampel lele dumbo dilakukan secara aseptis dari organ ginjal menggunakan ose steril pada medium selektif GSP agar dan diinkubasi
sumber masalah:
Usulan kegiatan:
Luaran yang diharapkan:
Indikator capaian :
Gambar 1. Bagan Alir Penelitian Penanggulangan obat
dan antibiotika
Vaksinasi Sanitasi lingkungan Peningkatan nutrisi Penyakit MAS pada lele dumbo yang disebabkan
bakteri Aeromonas hydrophila
Vaksin monovalen A. hydrophila Hasil
bervariasi
Penambahan vitamin C dan adjuvant
Vaksin polivalen plus A. hydrophila Vaksin polivalen A. hydrophila
Hasil & informasi lengkap tentang:
Tahun ke-3 :
Vaksin polivalen plus
A.hydrophila
(penambahan vitamin C dan adjuvant) dan uji efikasinya skala lapangan
Diperoleh vaksin polivalen plus A.
hydrophila yang imunogenik dan protektif
Bakteri resisten,
pencemaran lingkungan, residu pada daging ikan
Tahun ke-2 :
Vaksin polivalen plus
A.hydrophila
(penambahan vitamin C dan adjuvant) dan uji
efikasinya skala
laboratorium Tahun ke-1 :
-Isolat A. hydrophila terpilih dari tiga kabupaten
-Ag O dan H terpilih hasil uji reaksi silang
pada suhu 37˚C selama 18-24 jam. Satu koloni bakteri dari medium selektif GSP agar dipindahkan ke dalam tabung reaksi yang berisi medium cair TSB 10 ml dan diinkubasi pada suhu kamar selama 24 jam. Kemudian, dilakukan reinfeksi dan reisolasi kedua dan ketiga untuk mengetahui gejala penyakit yang lebih lengkap dan spesifik serta untuk meningkatkan virulensi bakteri A. hydrophila. Cara yang digunakan sama dengan reinfeksi dan reisolasi pertama.
D. Pembuatan Ag H Bakteri A. hydrophila (strain GPl-04, GKj-01, GPw-01)
Kultur bakteri dari media TSB ketiga isolat masing-masing ditambahkan formalin 2 % dan digojog selama 24 jam. Selanjutnya disentrifuse dengan kecepatan 3000 rpm selama 20 menit. Cairan yang berada di bagian atas pada tabung reaksi (supernatan) dibuang. Pencucian dengan PBS dan sentrifugasi dilakukan 3 kali (Kamiso & Triyanto, 1990). Selanjutnya, dilakukan uji viabilitas pada medium selektif Aeromonas-Pseudomonas (GSP, Merck).
E. Pembuatan Vaksin Polivalen A. hydrophila
Vaksin polivalen dibuat dengan mencampur sama banyak antigen isolat terpilih. Terlebih dahulu antigen terpilih diukur kepadatannya dengan spektrofotometer. Selanjutnya, masing-masing antigen diencerkan dan dicampurkan dengan perbandingan 1:1. Satu ml vaksin polivalen yang telah ditambah gliserol 0,5 % dengan kepadatan 1011 cfu/ml dimasukkan ke dalam botol ampul steril. Setelah itu dimasukkan ke dalam shell freezer (Labconco) agar vaksin membeku pada suhu -40˚C. Selanjutnya vaksin dimasukkan ke dalam freeze dryer (Labconco) pada suhu -40 sampai -50˚C. Selanjutnya, vaksin disimpan dalam refrigerator sampai digunakan.
F. Pembuatan Vaksin Polivalen Plus A. hydrophila
Pembuatan vaksin polivalen plus dilakukan dengan cara menambahkan vaksin polivalen dengan vitamin C dan adjuvant. Vaksin polivalen dibuat dengan mencampur sama banyak antigen isolat terpilih. Terlebih dahulu antigen terpilih diukur kepadatannya dengan
spektrofotometer. Selanjutnya, masing-masing antigen diencerkan dan dicampurkan dengan perbandingan 1:1. Kemudian ditambahkan vitamin C dan adjuvant. Adjuvant yang ditambahkan adalah adjuvant alumunium potassium sulfat dan alumunium hidroksida. Dosis vitamin C yang ditambahkan adalah 1000 mg/kg atau setara dengan 1000 ppm yang diadopsi dari Isnansetyo (1996) dan Johny & Roza (2007), sedangkan dosis yang digunakan untuk adjuvant diadopsi dari penelitian Retmonojati (2007) yang menyatakan bahwa dosis optimal adjuvant alumunium potassium sulfat adalah 2 ppm, dan dosis optimal adjuvant alumunium hidroksida adalah 6 ppm.
Satu ml vaksin polivalen yang telah ditambah gliserol 0,5 % dengan kepadatan 1011 cfu/ml dimasukkan ke dalam botol ampul steril. Setelah itu dimasukkan ke dalam shell freezer (Labconco) agar vaksin membeku pada suhu -40˚C. Selanjutnya vaksin dimasukkan ke dalam freeze dryer (Labconco) pada suhu -40 sampai -50˚C. Selanjutnya, vaksin disimpan dalam refrigerator sampai digunakan.
G. Rancangan Penelitian
Penelitian ini menggunakan rancangan acak lengkap (RAL) pola faktorial, dengan 2 variabel, 2 kali ulangan. Variabel terdiri atas perlakuan A berupa jenis vaksin dan perlakuan B berupa cara vaksinasi, yang terdiri dari:
A. Jenis Vaksin :
A1 = Vaksin polivalen
A2 = Vaksin polivalen dengan Vit C dan adjuvant alumunium potassium sulfat A3 = Vaksin polivalen dengan Vit C dan adjuvant alumunium hidroksida A4 = Kontrol (vaksinasi dengan PBS pH 7,0)
B. Cara Vaksinasi
B2 = suntik intramuskular B1 = rendaman
Kombinasi jenis vaksin (A) dan cara vaksinasi (B) menghasilkan 12 perlakuan, yaitu : A1B1, A2B1, A3B1, A4B1, A1B2, A2B2, A3B2, A4B2, A1B3, A2B3, A3B3, dan A4B3. Berdasarkan desain penelitian tersebut, terdapat 24 unit sampel. Setiap unit sampel dipelihara lele dumbo dalam wadah pemeliharaan sebanyak 8 ekor, dengan ukuran panjang 10-13 cm.
Vaksinasi suntik intraperitoneal dan intramuskular dilakukan dengan dosis 0,1 ml/ikan dengan kepadatan bakteri 107 sel/ikan, sedangkan vaksinasi rendaman dilakukan dengan cara merendam ikan uji dalam emulsi vaksin dengan konsentrasi 107 sel/ml selama 30 menit. Satu minggu setelah vaksinasi dilakukan booster (vaksinasi ulangan/penguat) dengan dosis dan cara vaksinasi yang sama. Dua minggu kemudian dilakukan uji tantang (challenge test) dengan bakteri A. hydrophila.
H. Parameter Yang Diamati
Parameter utama yang diamati dalam penelitian ini adalah titer antibodi, sintasan, tingkat perlindungan relatif (RPS = relative percent survival), rerata waktu kematian (RWK). Parameter pendukung yang diamati adalah parameter kualitas air : suhu, pH, dan O2 terlarut.
1. Parameter Utama a. Titer Antibodi
Titer antibodi diamati dengan metode Anderson (1974) dan dilakukan 4 kali, yaitu yaitu sebelum ikan divaksinasi, pada saat akan dibooster, seminggu setelah booster, dua minggu setelah booster (pada saat akan uji tantang). Pengukuran titer antibodi dilakukan dengan cara sebagai berikut : darah lele dumbo diambil dengan jarum suntik (spuit) steril melalui arteri caudalis, kemudian darah ditampung dalam tabung eppendorf, didiamkan dalam
suhu kamar selama 1 jam, kemudian didiamkan dalam refrigerator pada suhu 4ºC selama 18-24 jam. Bagian supernatan yang merupakan serum darah diambil dengan mikropipet. Adanya endapan antigen-antibodi pada mikrotiter plate diamati dengan cara sebagai berikut :
1. sumur ke-2 sampai dengan ke-12 diisi dengan 25 µl PBS 2. sumur ke-1 sampai dan ke-2 diisi dengan 25 µl serum
3. serial pengenceran dilakukan dengan cara mengambil 25 µl larutan dengan menggunakan garpu mikrotiter dari sumur ke-2 sampai ke-11
4. sumur ke-1 sampai ke-12 ditambahkan 25 µl suspensi bakteri A. hydrophila (1011 CFU/ml) yang telah dilemahkan dengan 2% formalin
5. lempeng mikrotiter plate ditutup kemudian di goyang-goyangkan pelan-pelan selama 3 menit dengan gerakan memutar. Lalu, didiamkan pada suhu kamar selama 1 jam dan dimasukkan ke dalam refrigerator dengan suhu 4ºC selama 18-24 jam.
6. cara menghitung titer antibodi : ke-12 sumur pada mikrotiter plate diamati. Sumur paling kiri adalah kontrol positif, sedangkan sumur yang paling kanan adalah kontrol negatif. Terbentuknya titer antibodi ditandai dengan terjadinya aglutinasi antara antigen dengan antibodi yang tampak dari munculnya lapisan keruh seperti awan dalam sumur mikrotiter plate. Perhitungan titer antibodi dimulai dari 21 sampai 211 (dari sumur ke-2 sampai 12). Sebagai contoh : apabila terjadi aglutinasi sampai sumur ke-6, maka titer antibodi yang terbentuk adalah 25. Selanjutnya, angka tersebut ditransformasikan ke dalam bentuk logaritma (data log 2) agar bisa dilakukan analisis data.
b. Sintasan
Pengamatan dilakukan secara visual dengan melihat dan menghitung ikan yang hidup pada setiap unit perlakuan, dan diamati setiap hari. Nilai sintasan dihitung berdasarkan Zonneveld (1991), yaitu :
Nt
S = --- x 100 % No
Keterangan : S = sintasan
Nt = jumlah ikan yang hidup pada waktu t/akhir penelitian (ekor) No = jumlah ikan yang hidup pada awal penelitian (ekor)
c. Tingkat Perlindungan Relatif (Relative Percent Survival/RPS)
Pengamatan dilakukan secara visual dengan melihat dan menghitung ikan yang mati pada setiap unit perlakuan, dan diamati setiap hari. Nilai RPS dihitung sebagai berikut:
Persentase kematian ikan yang divaksin
RPS = ( 1 - --- ) x 100 % Persentase kematian ikan yang tidak divaksin
d. Rerata Waktu Kematian (RWK)
Pengamatan dilakukan secara visual dengan melihat dan menghitung ikan yang mati pada setiap unit perlakuan, dan diamati setiap hari. Nilai RWK dihitung sebagai berikut:
RWK = Σ ai.bi --- Σ bi Keterangan :
ai = waktu kematian (hari)
bi = jumlah kematian ikan setiap waktu pengamatan
2. Parameter Pendukung
Pengamatan kualitas air meliputi suhu maksimum-minimum air dan pH dilakukan setiap hari, sedangkan O2 terlarut (Dissolved Oxygen=DO) diamati setiap minggu. DO diamati dengan metode Winkler.
I. Analisis Data
Pengamatan titer antibodi dilakukan dengan metode deskriptif. Data yang terkumpul dari uji titer antibodi ditransformasikan ke dalam bentuk logaritma (data log 2). Selanjutnya, data titer antibodi, sintasan, RPS, RWK dianalisis dengan menggunakan analisis sidik ragam (Analysis of Variance/ANOVA) untuk mengetahui pengaruh masing-masing perlakuan. Apabila data yang telah dianalisis sidik ragam terdapat perbedaan yang nyata, maka dilanjutkan dengan uji Duncan Multiple Range Test (DMRT) pada taraf uji 5% (Steel & Torrie, 1993).
BAB V. HASIL DAN PEMBAHASAN A. Titer Antibodi
Vaksinasi merupakan cara efektif yang dapat ditempuh untuk meningkatkan sistem pertahanan tubuh suatu organisme. Keberhasilan suatu vaksinasi pada ikan salah satunya dapat dilihat dari meningkatnya sistem imun yang ditandai dengan meningkatnya produksi titer antibodi selama penelitian. Vaksinasi dengan vaksin polivalen dan polivalen plus sel A.
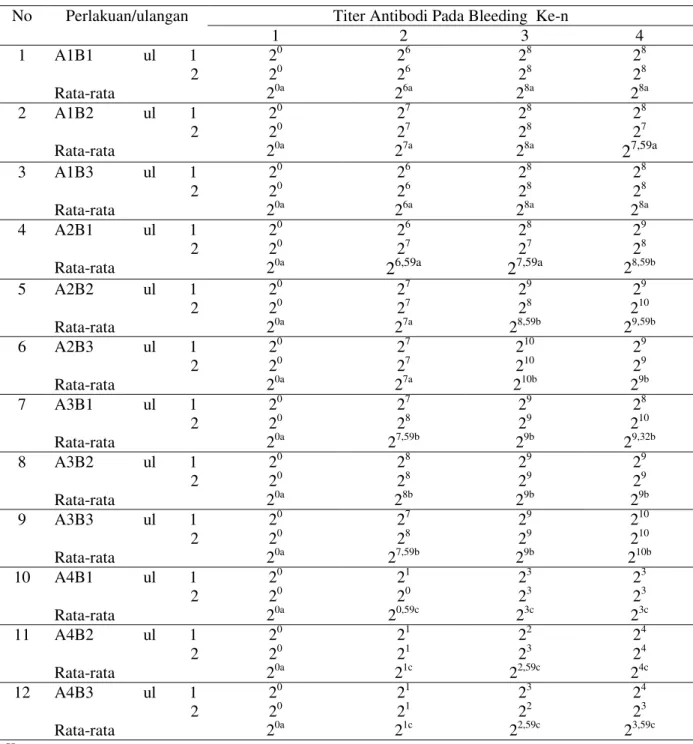
hydrophila pada lele dumbo menunjukkan adanya peningkatan sistem pertahanan spesifik berupa pembentukan titer antibodi. Bleeding ke-1 (sebelum vaksinasi), semua perlakuan belum memproduksi titer antibodi karena ikan belum diberi vaksin. Titer antibodi pada awal penelitian adalah 1 (20) (Tabel 1).
Bleeding ke-2 (satu minggu setelah vaksinasi), terjadi peningkatan titer antibodi pada semua perlakuan vaksinasi dibandingkan kontrol. Hasil pengamatan menunjukkan bahwa penggunaan vaksin polivalen dan vaksin polivalen plus A. hydrophila dapat meningkatkan titer antibodi (P<0,05), baik secara suntik intraperitoneal, suntik intramuskular, maupun rendaman. Hasil penelitian menunjukkan bahwa perlakuan A3B2 (penggunaan vaksin polivalen dengan vitamin C dan adjuvant alumunium hidroksida secara suntik intramuskular) memproduksi titer antibodi tertinggi, yaitu sebesar 28.
Bleeding ke-3 (satu minggu setelah booster), terjadi peningkatan titer antibodi pada semua perlakuan yang divaksin dan lebih tinggi dibandingkan pada bleeding ke-2. Peningkatan titer antibodi terjadi karena ikan uji telah mempunyai memori imunitas sehingga dengan
booster atau vaksinasi ulangan dapat menghasilkan respons imun yang lebih tinggi (Lamers et
al., 1985). Selain itu, hasil penelitian menunjukkan bahwa perlakuan yang diberi vaksin beradjuvant lebih tinggi titer antibodinya dibandingkan vaksin polivalen tanpa adjuvant dengan produksi titer antibodi sebesar 28,59 sampai 210.
Tabel 1. Titer antibodi lele dumbo pada masing-masing perlakuan
Titer Antibodi Pada Bleeding Ke-n
No Perlakuan/ulangan 1 2 3 4 1 A1B1 ul 1 2 Rata-rata 20 20 20a 26 26 26a 28 28 28a 28 28 28a 2 A1B2 ul 1 2 Rata-rata 20 20 20a 27 27 27a 28 28 28a 28 27 27,59a 3 A1B3 ul 1 2 Rata-rata 20 20 20a 26 26 26a 28 28 28a 28 28 28a 4 A2B1 ul 1 2 Rata-rata 20 20 20a 26 27 26,59a 28 27 27,59a 29 28 28,59b 5 A2B2 ul 1 2 Rata-rata 20 20 20a 27 27 27a 29 28 28,59b 29 210 29,59b 6 A2B3 ul 1 2 Rata-rata 20 20 20a 27 27 27a 210 210 210b 29 29 29b 7 A3B1 ul 1 2 Rata-rata 20 20 20a 27 28 27,59b 29 29 29b 28 210 29,32b 8 A3B2 ul 1 2 Rata-rata 20 20 20a 28 28 28b 29 29 29b 29 29 29b 9 A3B3 ul 1 2 Rata-rata 20 20 20a 27 28 27,59b 29 29 29b 210 210 210b 10 A4B1 ul 1 2 Rata-rata 20 20 20a 21 20 20,59c 23 23 23c 23 23 23c 11 A4B2 ul 1 2 Rata-rata 20 20 20a 21 21 21c 22 23 22,59c 24 24 24c 12 A4B3 ul 1 2 Rata-rata 20 20 20a 21 21 21c 23 22 22,59c 24 23 23,59c Keterangan :
Nilai rata-rata yang diikuti huruf superscript yang sama menunjukkan tidak berbeda nyata pada uji DMRT dengan taraf uji 5% B1 : bleeding sebelum vaksinasi
B2 : bleeding 1 minggu setelah vaksinasi (sebelum booster) B3 : bleeding 1 minggu setelah booster
B4 : bleeding 2 minggu setelah booster (sebelum uji tantang) A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 : : : : : : :
Vaksin polivalen secara suntik intraperitoneal (ip) Vaksin polivalen secara suntik intramuskular (im) Vaksin polivalen secara rendaman
Vaksin polivalen dengan Vit C& adj. alumunium potassium sulfat secara suntik intraperitoneal (ip) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara rendaman
A3B2 A3B3 A4B1 A4B2 A4B3 : : : : :
Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara rendaman
Kontrol (PBS pH 7,0) secara suntik intraperitoneal (ip) Kontrol (PBS pH 7,0) secara suntik intramuskular (im) Kontrol (PBS pH 7,0) secara rendaman
Bleeding ke-4 (dua minggu setelah booster), terjadi peningkatan titer antibodi (P<0,05) perlakuan yang divaksinasi dibandingkan kontrol. Perlakuan pemberian vaksin polivalen plus dengan vitamin C dan adjuvant alumunium potassium sulfat (A2) dan vaksin polivalen plus dengan vitamin C dan adjuvant alumunium hidroksida (A3) memiliki kemampuan yang sama dalam meningkatkan produksi titer antibodi.
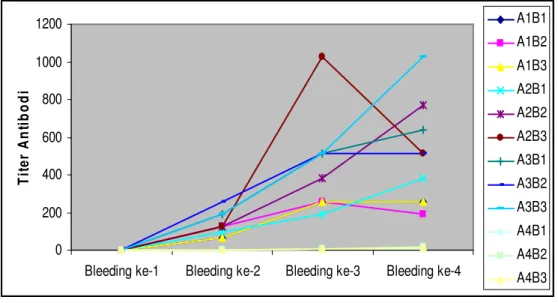
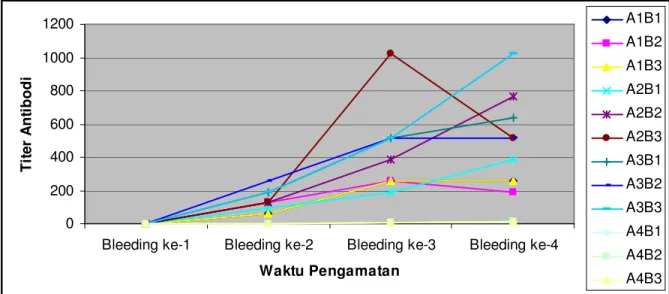
0 200 400 600 800 1000 1200
Bleeding ke-1 Bleeding ke-2 Bleeding ke-3 Bleeding ke-4
T it e r A n ti b o d i A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 A4B1 A4B2 A4B3
Gambar 2. Produksi titer antibodi lele dumbo selama penelitian
Gambar 2. menjelaskan bahwa terjadi peningkatan produksi titer antibodi yang signifikan untuk semua perlakuan yang diberi vaksin pada bleeding ke-2, yaitu satu minggu setelah vaksinasi dilakukan. Pada bleeding ke-3 (satu minggu setelah booster), perlakuan juga mengalami peningkatan produksi titer antibodi, demikian juga pada bleeding ke-4 (dua minggu setelah booster), secara umum meningkat, meskipun ada yang tetap dan menurun dibandingkan
bleeding sebelumnya. Namun, secara umum pengaruh vaksinasi dan booster signifikan dalam meningkatkan produksi titer antibodi perlakuan yang divaksinasi.
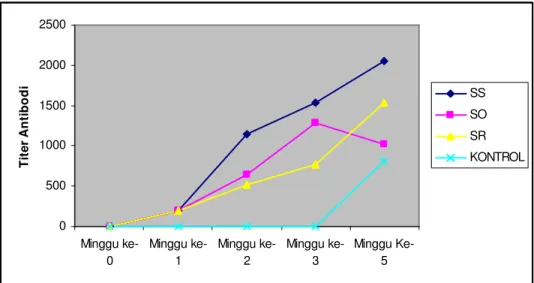
Mulia et al. (2004) telah melakukan penelitian penggunaan vaksin debris A. hydrophila secara suntik intramuskular dengan beberapa cara booster, yaitu suntik (im), oral, dan rendaman pada lele dumbo. Cara suntik dilakukan dengan menyuntikkan 0,1 ml vaksin ke dalam tubuh ikan dengan dosis 5 µg/ekor. Cara oral dilakukan dengan mencekok (memasukkan vaksin langsung ke dalam lambung dengan alat untuk mencekok) 0,1 ml vaksin dengan dosis 5 µg/ekor. Cara rendaman dilakukan dengan merendam ikan dalam larutan vaksin 50 mg/L selama 15 menit. Sintasan mencapai 100% dibandingkan kontrol 45,56%. Respons imun berupa produksi antibodi mengalami peningkatan sejak ikan divaksinasi untuk semua perlakuan, yaitu perlakuan vaksinasi suntik dengan booster suntik (SS), vaksinasi suntik dengan booster oral (SO), dan vaksinasi suntik dengan booster rendaman (SR), dan terus mengalami peningkatan titer antibodi sampai akhir penelitian, tetapi ada yang menurun, yaitu SO (Gambar 3). 0 500 1000 1500 2000 2500 Minggu ke-0 Minggu ke-1 Minggu ke-2 Minggu ke-3 Minggu Ke-5 T it e r A n ti b o d i SS SO SR KONTROL
Gambar 3. Produksi titer antibodi lele dumbo yang divaksinasi suntik intramuskular dengan beberapa cara booster, yaitu suntik, oral, dan rendaman
Vaksinasi merupakan suatu cara pemberian antigen secara sengaja agar ikan memproduksi antibodi terhadap suatu bibit penyakit atau patogen tertentu, sedangkan vaksin merupakan suatu antigen yang berasal dari jasad patogen yang telah dilemahkan atau dimatikan. Antibodi sangat diperlukan untuk menghadapi serangan dari bibit penyakit yang masuk ke dalam tubuh. Antigen yang digunakan dalam penelitian ini adalah antigen polivalen A. hydrophila yang berasal dari beberapa antigen yang bereaksi baik pada uji interaksi silang. Vaksin polivalen terdiri dari 3 antigen yang paling baik ketika diuji reaksi silang. Antigen H merupakan whole
cell yang dilemahkan dengan formalin, mengandung flagela dan protein yang memungkinkan adanya reaksi kuat dengan antibodi (Kamiso, 1990). Almendras (2001) menyatakan bahwa protein merupakan makromolekul yang imunogen. Pada bagian tertentu dari molekul ini dapat menentukan spesifitas reaksi antigen-antibodi dan sebagai penentu timbulnya respons imun. Menurut Subowo (1993), bagian tertentu dari molekul ini biasanya dinamakan epitop. Jumlah epitop dari molekul antigen tergantung pada ukuran dan kerumitan struktur molekulnya.
Pada akhir pengamatan (bleeding ke-4), tidak ditemukan adanya perbedaan yang signifikan antara ikan yang disuntik, baik secara intraperitoneal maupun secara intramuskular, dengan rendaman. Hal ini menguatkan dugaan bahwa vaksinasi dapat dilakukan dengan cara suntik atau pun rendaman dengan efektivitas yang sama, sehingga si pelaku vaksinasi dapat memilih cara vaksinasi yang mudah, cocok, dan tepat untuk sasarannya.
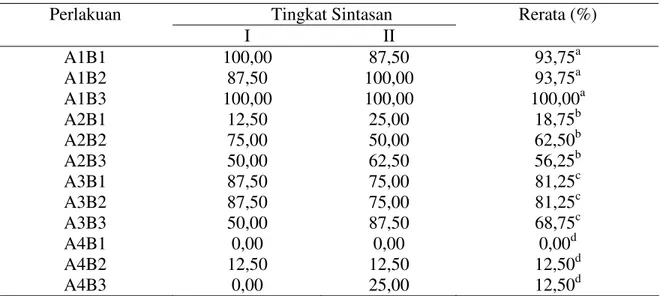
B. Sintasan
Sintasan lele dumbo yang dihasilkan pada setiap perlakuan menunjukkan seberapa besar daya tahan ikan tersebut setelah diuji tantang dengan bakteri A. hydrophila. Vaksinasi dengan vaksin polivalen dan vaksin polivalen plus dapat meningkatkan sintasan lele dumbo (P<0,05) (Tabel 2). Secara umum perlakuan yang divaksin memiliki sintasan yang lebih tinggi
dibandingkan dengan kontrol. Hasil analisis sidik ragam menunjukkan bahwa perlakuan jenis vaksin berbeda nyata (P<0,05), sedangkan perlakuan cara vaksin dan interaksi antara jenis vaksin dan cara vaksin tidak berbeda nyata (P>0,05). Hasil analisis uji lanjut menunjukkan bahwa perlakuan jenis vaksin A1, A2, A3, dan A4 masing-masing berbeda nyata (P<0,05). Tabel 2. Sintasan lele dumbo setelah uji tantang dengan bakteri A. hydrophila
Tingkat Sintasan Perlakuan I II Rerata (%) A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 A4B1 A4B2 A4B3 100,00 87,50 100,00 12,50 75,00 50,00 87,50 87,50 50,00 0,00 12,50 0,00 87,50 100,00 100,00 25,00 50,00 62,50 75,00 75,00 87,50 0,00 12,50 25,00 93,75a 93,75a 100,00a 18,75b 62,50b 56,25b 81,25c 81,25c 68,75c 0,00d 12,50d 12,50d Keterangan :
Nilai rata-rata yang diikuti huruf superscript yang sama menunjukkan tidak berbeda nyata pada uji DMRT dengan taraf uji 5% A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 A4B1 A4B2 A4B3 : : : : : : : : : : : :
Vaksin polivalen secara suntik intraperitoneal (ip) Vaksin polivalen secara suntik intramuskular (im) Vaksin polivalen secara rendaman
Vaksin polivalen dengan Vit C& adj. alumunium potassium sulfat secara suntik intraperitoneal (ip) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara rendaman
Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara suntik intraperitoneal (ip) Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara rendaman
Kontrol (PBS pH 7,0) secara suntik intraperitoneal (ip) Kontrol (PBS pH 7,0) secara suntik intramuskular (im) Kontrol (PBS pH 7,0) secara rendaman
Lele dumbo yang divaksinasi dengan vaksin polivalen (A1) mencapai nilai sintasan tertinggi, yaitu 93,75-100%, selanjutnya disusul oleh lele dumbo yang divaksin dengan vaksin polivalen dengan vitamin C dan adjuvant alumunium hidroksida (A3) mencapai nilai sintasan 68,75-81,25 %, kemudian lele dumbo yang divaksin dengan vaksin polivalen dengan vitamin C dan adjuvant alumunium potassium sulfat (A2) mencapai 18,75-62,50 %, dan kontrol (A4) dengan sintasan terendah, yaitu 0-12,5%.
Hasil penelitian vaksinasi pada lele dumbo telah membuktikan bahwa vaksinasi dapat meningkatkan sintasan. Hal ini erat kaitannya dengan meningkatnya sistem pertahanan tubuh pada ikan yang divaksin, sehingga ketika datang serangan bakteri A. hydrophila aktif, ikan-ikan yang divaksin lebih mampu bertahan hidup dibandingkan ikan yang tidak divaksin. Kondisi ini dipertegas dengan meningkatnya produksi titer antibodi pada ikan yang divaksin dibandingkan yang tidak divaksin, yang pada akhirnya mampu melindungi ikan terhadap serangan bakteri penyebab penyakit.
Mulia (2007) menggunakan vaksin A. hydrophila jenis antigen O (Ag O) dan antigen H (Ag H) pada gurami, sintasan mencapai 56,00-58,00%, dibandingkan kontrol 10,00%. Olga & Aisiah (2007) menggunakan vaksin produk ekstraseluler A. hydrophila dengan dosis 2,5-10 µg pada ikan patin dan memberikan tingkat perlidungan 44,87-92,31 %.
Penggunaan vaksin dari bagian sel yang lain, yaitu debris sel A. hydrophila secara suntikan dengan variasi cara booster, yaitu suntik, oral, dan rendaman pada lele dumbo, sintasan mencapai 100 % dibandingkan kontrol 45,56 % (Mulia et al., 2004). Suryantinah et al. (2005) menggunakan vaksin debris sel A. hydrophila pada nila, sintasan mencapai 62,97-81,84 %. Demikian pula Murtiningsih (2003) yang menggunakan vaksin sitoplasma sel A. hydrophila strain Cangkringan pada lele dumbo, sintasan mencapai 66,70-100%, dibandingkan kontrol 12,50 %.
Lund et al. (2002) menunjukkan bahwa vaksin multivalen Aeromonas salmonicida menghasilkan tingkat efikasi yang lebih tinggi daripada vaksin monovalen pada vaksinasi ikan spotted wolfish (Anarchicas minor O.) serta memberikan tingkat perlindungan yang lebih baik. Kamiso et al. (2005) telah berhasil menggunakan vaksin polivalen untuk mengendalikan vibriosis pada kerapu tikus secara suntik, oral, dan rendaman, sintasan mencapai 100 % dibandingkan kontrol 80 %.
Perlakuan cara vaksin tidak berbeda nyata (P>0,05) atau dengan kata lain dapat memberikan pengaruh yang sama dalam meningkatkan sintasan. Ellis (1988) mengemukakan ada 3 faktor utama yang saling mempengaruhi yang menentukan efektivitas suatu vaksin, yaitu sifat dan bentuk antigen, ukuran ikan, dan metode pemberian vaksin. Sampai saat ini metode suntikan intraperitoneal yang dianggap paling baik dalam merangsang sistem kekebalan humoral dan perlindungan (Horne & Ellis, 1988; Palm et al., 2000, Esreve-Gassent et al., 2004) dan merupakan metode pilihan untuk menentukan keimunogenan suatu calon vaksin (Rahman & Kawai, 2000, Rahman et al., 2002) karena dianggap mampu merangsang sistem kekebalan humoral dan seluler dengan baik. Namun, modifikasi dan peningkatan teknik yang digunakan pada metode perendaman (Yong-Can et al., 2002) memberikan efek imunogenisitas yang sama dengan metode suntikan.
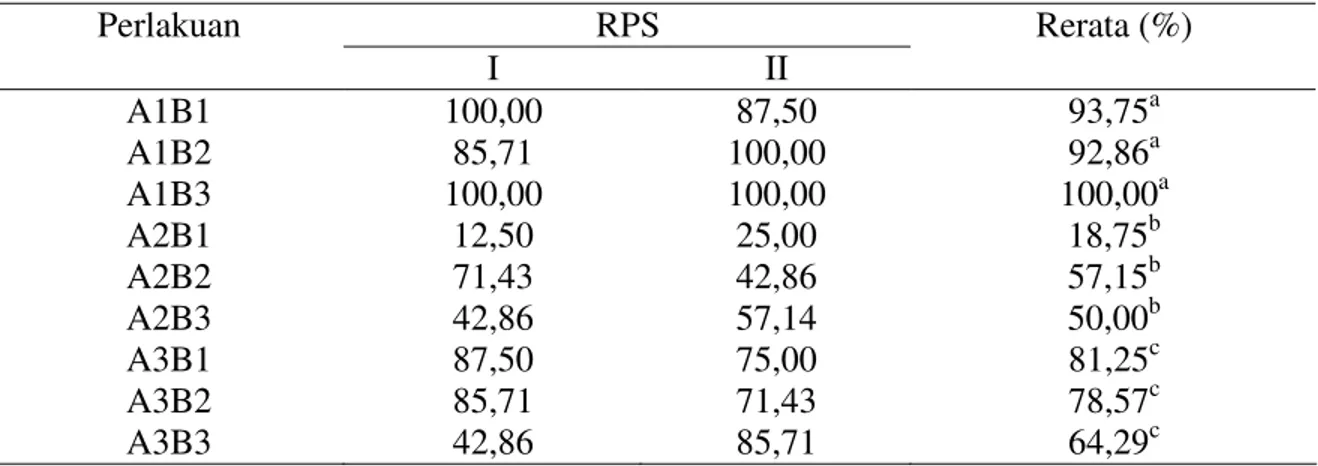
C. Tingkat Perlindungan Relatif (Relative Percent Survival/RPS)
Vaksinasi dengan vaksin polivalen dan vaksin polivalen plus A. hydrophila dapat memberikan perlindungan relatif pada lele dumbo (P<0,05). Hasil analisis sidik ragam menunjukkan bahwa perlakuan jenis vaksin berbeda nyata (P<0,05), sedangkan perlakuan cara vaksin dan interaksi antara jenis vaksin dan cara vaksin tidak berbeda nyata (P>0,05). Hasil analisis uji lanjut menunjukkan bahwa perlakuan jenis vaksin A1, A2, dan A3 masing-masing berbeda nyata (P<0,05).
Tingkat perlindungan relatif tertinggi dihasilkan oleh lele dumbo yang divaksinasi dengan vaksin polivalen (A1) mencapai 92,86-100 %, selanjutnya disusul oleh lele dumbo yang divaksin dengan vaksin polivalen dengan vitamin C dan adjuvant alumunium hidroksida (A3) mencapai RPS sebesar 64,29-81,25 %, yang terendah diperoleh oleh lele dumbo yang
divaksin dengan vaksin polivalen dengan vitamin C dan adjuvant alumunium potassium sulfat (A2) mencapai 18,75-57,15 % (Tabel 3).
Hasil penelitian ini menunjukkan bahwa vaksin polivalen dan vaksin polivalen plus A.
hydrophila yang diberikan pada lele dumbo mampu memberikan perlindungan relatif yang lebih baik, kecuali perlakuan A2B1 yang memiliki nilai RPS terendah. Kamiso & Triyanto (1996) menyatakan bahwa tingkat perlindungan relatif (RPS) yang baik dari suatu vaksin apabila bisa menghasilkan nilai RPS di atas 50 %. Berdasarkan nilai RPS yang diperoleh, vaksinasi menggunakan vaksin polivalen dan vaksin polivalen plus A. hydrophila terbukti efektif dengan efikasi dan tingkat perlindungan relatif yang tinggi, lebih dari 50 %, kecuali perlakuan A2B1.
Tabel 3. Tingkat perlindungan relatif (Relative Percent Survival/RPS) lele dumbo setelah uji tantang dengan bakteri A. hydrophila
RPS Perlakuan I II Rerata (%) A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 100,00 85,71 100,00 12,50 71,43 42,86 87,50 85,71 42,86 87,50 100,00 100,00 25,00 42,86 57,14 75,00 71,43 85,71 93,75a 92,86a 100,00a 18,75b 57,15b 50,00b 81,25c 78,57c 64,29c Keterangan :
Nilai rata-rata yang diikuti huruf superscript yang sama menunjukkan tidak berbeda nyata pada uji DMRT dengan taraf uji 5% A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 : : : : : : : : :
Vaksin polivalen secara suntik intraperitoneal (ip) Vaksin polivalen secara suntik intramuskular (im) Vaksin polivalen secara rendaman
Vaksin polivalen dengan Vit C& adj. alumunium potassium sulfat secara suntik intraperitoneal (ip) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara rendaman
Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara suntik intraperitoneal (ip) Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara rendaman
Secara umum pemberian vaksin memberikan perlindungan terhadap ikan dari serangan bakteri penyebab penyakit, akan tetapi dalam penelitian ini, perlindungan tertinggi dihasilkan
oleh perlakuan vaksin polivalen. Tujuan penambahan adjuvant pada suatu vaksin adalah untuk memperlambat masuknya vaksin ke dalam tubuh. Antigen yang biasanya bertahan hanya untuk beberapa hari dapat dipertahankan dalam tubuh untuk beberapa minggu dengan cara teknik ini. Diduga, vaksin dengan penambahan adjuvant baik alumunium potassium sulfat dan alumunium hidroksida kurang terlihat efektivitasnya apabila hanya dicobakan selama satu bulan, karena aktivitas masuknya vaksin ke dalam tubuh yang cenderung lebih perlahan-lahan dibandingkan vaksin polivalen saja (tanpa adjuvant) sehingga kemampuan dalam melindungi ikan kurang optimal. Berdasarkan hal tersebut, ada dugaan bahwa hasil ini akan berbeda apabila vaksinasi dicobakan dalam kurun waktu lebih dari satu bulan, mungkin 2-3 bulan, sehingga penambahan adjuvant dapat mempertahankan vaksin di dalam tubuh lebih lama, dan berpengaruh pada kemampuan melindungi ikan yan lebih lama pula, sehingga akan terlihat seberapa besar efektivitasnya.
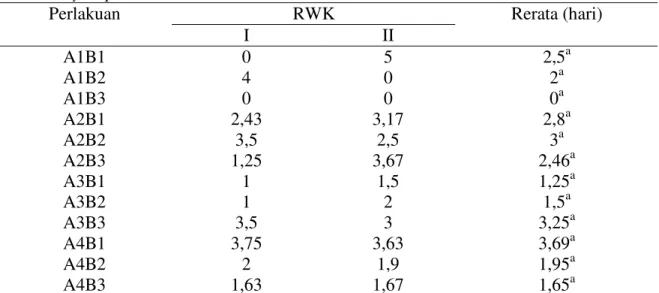
D. Rerata Waktu Kematian (RWK)
Vaksinasi dengan vaksin polivalen dan plovalen plus A. hydrophila tidak menimbulkan perbedaan yang nyata (P>0,05) pada RWK lele dumbo. Hal ini menunjukkan bahwa pemberian jenis vaksin, cara vaksin, dan interaksi keduanya tidak memperpanjang waktu kematian. RWK lele dumbo semua perlakuan sebesar 0-3,69 hari (Tabel 4).
Hasil penelitian yang dilakukan oleh Kamiso et al. (1992) menjelaskan bahwa vaksinasi hanya melindungi ikan dari serangan bakteri dan jika ikan yang divaksin dapat terserang maka perlakuan vaksinasi tidak berpengaruh nyata terhadap perkembangan penyakit. Akibatnya, rerata waktu kematian ikan yang divaksin tidak mempunyai perbedaan dengan ikan yang tidak divaksin.
Tabel 4. Rerata Waktu Kematian (RWK) lele dumbo setelah diuji tantang dengan bakteri A. hydrophila RWK Perlakuan I II Rerata (hari) A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 A4B1 A4B2 A4B3 0 4 0 2,43 3,5 1,25 1 1 3,5 3,75 2 1,63 5 0 0 3,17 2,5 3,67 1,5 2 3 3,63 1,9 1,67 2,5a 2a 0a 2,8a 3a 2,46a 1,25a 1,5a 3,25a 3,69a 1,95a 1,65a Keterangan :
Nilai rata-rata yang diikuti huruf superscript yang sama menunjukkan tidak berbeda nyata pada uji DMRT dengan taraf uji 5% A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 A4B1 A4B2 A4B3 : : : : : : : : : : : :
Vaksin polivalen secara suntik intraperitoneal (ip) Vaksin polivalen secara suntik intramuskular (im) Vaksin polivalen secara rendaman
Vaksin polivalen dengan Vit C& adj. alumunium potassium sulfat secara suntik intraperitoneal (ip) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium potassium sulfat secara rendaman
Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara suntik intraperitoneal (ip) Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara suntik intramuskular (im) Vaksin polivalen dengan Vit C & adj. alumunium hidroksida secara rendaman
Kontrol (PBS pH 7,0) secara suntik intraperitoneal (ip) Kontrol (PBS pH 7,0) secara suntik intramuskular (im) Kontrol (PBS pH 7,0) secara rendaman
E. Kualitas Air
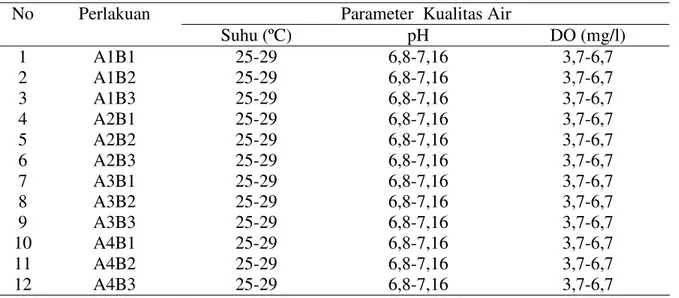
Parameter kualitas air yang diamati dalam penelitian ini adalah suhu air, pH, dan kadar oksigen terlarut (Dissolved Oxygen = DO). Parameter kualitas air dari setiap pengamatan hanya dianalisis secara deskriptif, yaitu dengan membandingkan antara hasil pengamatan dengan standar yang ada bagi kehidupan ikan pada umumnya (Alabaster & Lloyd, 1982). Data parameter kualitas air secara lengkap tersaji pada Tabel 5.
Tabel 5. Parameter kualitas air selama pengamatan
Parameter Kualitas Air
No Perlakuan Suhu (ºC) pH DO (mg/l) 1 2 3 4 5 6 7 8 9 10 11 12 A1B1 A1B2 A1B3 A2B1 A2B2 A2B3 A3B1 A3B2 A3B3 A4B1 A4B2 A4B3 25-29 25-29 25-29 25-29 25-29 25-29 25-29 25-29 25-29 25-29 25-29 25-29 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 6,8-7,16 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7 3,7-6,7
Parameter kualitas air selama penelitian tidak menunjukkan adanya variasi yang besar dan masih sesuai untuk kehidupan lele dumbo. Suhu berpengaruh pada pembentukan antibodi (Anderson, 1974). Pada suhu yang optimal maka pembentukan antibodi akan berjalan dengan baik demikian juga sebaliknya. Suhu air berkisar antara 25-290C, pH berkisar antara 6,8-7,16, dan DO berkisar antara 3,7-6,7 mg/l.Boyd (1990) menyatakan bahwa kisaran suhu 25-320C, pH 6,5-9 dan DO minimal 2 ppm dianggap masih normal dan baik untuk kehidupan ikan air tawar, termasuk lele dumbo. Dengan demikian, kualitas air bukan merupakan faktor penyebab kematian lele dumbo dalam penelitian ini. Kematian ikan kontrol pada saat uji tantang betul-betul disebabkan karena ikan terinfeksi.
BAB VI. KESIMPULAN DAN SARAN
A. KESIMPULAN
Kesimpulan dari hasil penelitian ini adalah : vaksin polivalen dan vaksin polivalen plus sel A. hydrophila efektif dalam mengendalikan penyakit MAS pada lele dumbo. Vaksin ini dapat meningkatkan produksi titer antibodi, sintasan, dan RPS, namun tidak berpengaruh nyata pada RWK. Cara vaksin suntik intrapertoneal, suntik intramuskular, dan rendaman dapat menjadi alternatif pilihan untuk vaksinasi, karena ketiganya memiliki efektivitas yang sama dalam meningkatkan efikasi vaksin.
B. SARAN
Saran dari penelitian ini adalah perlu dilakukan uji efikasi vaksin polivalen dan vaksin polivalen plus sel A. hydrophila skala lapangan dengan waktu penelitian yang lebih lama, misalkan 2-3 bulan untuk melihat sejauh mana efektivitas vaksin polivalen plus (vitamin C dan beradjuvant) maupun vaksin polivalen (tanpa vitamin C dan adjuvant) dalam penyakit MAS pada lele dumbo. Selanjutnya, penelitian ini disarankan untuk dicobakan pada ikan air tawar lain, seperti gurami, karper, tawes, maupun nila.
DAFTAR PUSTAKA
Anderson, D.P. 1974. “Fish Immunology”, dalam Diseases of Fishes, buku ke-4, Snieszko, S.F. & Axelrod, H.R. (ed.). T.F.H. Publications, Ltd. 239 p.
Anonim. 1994. Determinasi Bakteri Patogenik Penyebab Penyakit Ikan. Jurusan Perikanan. Fakultas Perikanan UGM. Yogyakarta.
Anonim 2006. Vaksin.http://id.wikipedia.org/wiki/Vaksin diakses tanggal 7 September 2006. Atlas, R. M. 1997. Principles of Microbiology, second edition. Wm. C. Brown Publishers.
Sydney.1298 p.
Davies, H. 1997. Introductory Immunobiology. Chapman and Hall. London. 394 p.
Dinas Peternakan dan Perikanan Wilayah Banyumas. 2005. Kegiatan Penyidikan Penyakit
Ikan. Laboratorium Kesehatan Ikan dan Lingkungan. Dinas Peternakan dan Perikanan Wilayah Banyumas. Banyumas.
Djajadiredja, R & Cholik, F. 1982. “Penanggulangan Wabah Penyakit Ikan”. J. Litbang Pert., I : 35-39.
Ellis, A.E. 1988. “Optimizing Factors For Fish Vaccination” dalam Fish Vaccination, A.E. Ellis (ed). Academic Press Ltd. London. 32-46 pp.
Ellis, A.E. 1989. “The Immunology of Teleost” dalam Fish Pathology, R.J. Roberts (ed.). Bailliere Tindall. London. 135-152 pp.
Esteve-Gassent, M.D., M.E. Nielsen & C. Amaro. 2004. The Kinetics of Antibody Production in Mucus and Serum of European Eel (Anguilla anguilla L) After Vaccination Against Vibrio vulnivicus. Development of a New Method for Antibody Quantification in Skin Mucus. Fish & Shellfish Immunology 15:51-61
Farmer, J.J. Arduino & M.J. Brenner-Hickman, F.W. 2000. “The Genera Aeromonas and Plesiomonas”dalam The Prokaryotes, second edition, Vol IV, Balows, A., Truper, H.G., Dworkin, M., Harder, W., Schileifet, K.H. (eds.). Springer-Verlag.
Fraizier, W. & Dennis C. Westholh. 1988. Food Microbiology, fourth edition. Mc Graw Hill Book. Singapore.
Frerichs, G.N. & R.J. Roberts. 1978. “The Bacteriology of Teleosts” dalam Fish Pathology, R.J. Roberts (ed.). Baiiliere Tindall. London. 289-319 pp.
Hardjautomo, S.P. Taufik & S. Koesoemadinata. 1981. “Isolasi dan Identifikasi Beberapa Bakteri Patogen dari Ikan Mas (Cyprinus carpio) dan Ikan tawes (Puntius goniotatus)”.
Horne, M.T. & Ellis, A.E. 1988. ”Strategies of Vaccination”. dalam Fish Vaccination, A.E. Ellis (ed). Academic Press Ltd. London. 55-56 pp.
Ingram, G.A. 1980. “Substances Involved in The Natural Resistance of Fish to Infection-A-Review”. J.Fish. Bio., 16:23-60.
Isnansetyo, A. 1996. Penambahan Vitamin C pada Pakan Lele Dumbo (Clarias gariepinus) untuk Meningkatkan Tanggap Kebal Terhadap Vaksin Aeromonas hydrophila. Jurnal
Perikanan UGM (GMU J. Fish. Sci) . I(1) : 35-41.
Johny, F. & D. Roza. 2007. Peningkatan Imunitas Benih Ikan Kerapu Lumpur Epinephelus coioides Terhadap Infeksi Virus Irido dengan Aplikasi Vitamin C dan Imunostimulan. Panduan Semnaskan UGM, Perikanan dan Kelautan UGM. 228 hal.
Jutono, Soedarsono, J., Hartadi, S., Kabirun, S., Suhadi, D. & Soesanto. 1980. Pedoman
Praktikum Mikrobiologi Umum. Fakultas Pertanian UGM. Yogyakarta. 181 hal.
Lagler, K.F., J.E. Bardach, R.R. Miller, & D.R.M. Passino. 1977. Ichtyology. John Willey & Sons. New York. 506 p.
Lamers, C. H. I. & W. B. Van Muiswinkel. 1985. Natural Aquidred to Aeromonas hydrophila in Carp (Cyprinus carpio). Canadian J. Fish Aquatic Science, 619-624.
Lund, V., J.A. Arnesen & G. Eggset. 2002. Vaccine Development for Atypical Furunculosis in Spotted Wolffish Anarchicas minor O.: Comparison of Efficacy of Vaccine Containing Different Strains of Atypical Aeromonas salmonicida. Aquaculture 204:33-44.
Kamiso, H. N. 1990. Vaksinasi Penyakit Bakterial pada Ikan. PAU Bioteknologi UGM. Yogyakarta.
Kamiso, H.N. & Triyanto. 1990. Sistem Pertahanan dan Diagnosis Serologi Penyakit Ikan. Pelatihan Karantina Ikan Ciawi-Bogor. 21 Mei-4 Agustus 1990. 29 hal.
Kamiso, H.N., Triyanto, & S. Hartati. 1992. Penanggulangan Penyakit Motil Aeromonas
Septisemia (MAS) pada Ikan Lele (Clarias sp.). ARM Project Tahun ke-1. Balitbang Pertanian, Deptan. Jakarta. 38 hal.
Kamiso, K.H. 1997. “Uji Lapang Penggunaan Vaksin Aeromonas hydrophila Pada Lele Dumbo (Clarias gariepinus)”. Jurnal Perikanan UGM (GMU J. Fish. Sci) . I(2) : 17-24.
Kamiso, K.H., Triyanto & S. Hartati. 1997a. Uji Antigenisitas dan Efikasi Aeromonas
hydrophila pada Lele Dumbo (Clarias gariepinus). Jurnal Perikanan UGM (GMU J.
Fish. Sci) . I(2) : 9-16.
Kamiso, K.H., Triyanto & S. Hartati. 1997b. “Efikasi Vaksin dan Kemangkusan Tetrasiklin untuk Penanggulangan Penyakit MAS pada Pendederan Lele Dumbo (Clarias