Puslitbang tekMIRA Jl. Jend. Sudirman No. 623 Bandung 40211
Telp : 022-6030483 Fax : 022-6003373 E-mail :Info@tekMIRA .esdm.go.id
LAPORAN AKHIR TAHUN ANGGARAN 2016 Kelompok Teknologi Pengolahan dan Pemanfaatan Mineral
PENGEMBANGAN SISTEM PROSES PRODUKSI UNSUR
LOGAM TANAH JARANG DAN LOGAM JARANG UNTUK MATERIALMAJU (1912.035.000) Oleh : Isyatun Rodliyah Suratman Maryono
Stefanus Suryo Cahyono Lili Tahli Azhari Nuryadi Saleh Suganal Tatang Wahyudi Dessy Amalia Yuhelda
Hasudungan Eric Mamby Andina Septiarani Siti Rochani Ngurah Ardha Muchtar Aziz Hadi Purnomo Sri Handayani Jejen Edi Suyatno
PUSAT PENETIAN DAN PENGEMBANGAN TEKNOLOGI MINERAL DAN BATU BARA BADAN PENELITIAN DAN PENGEMBANGAN KESDM
i
KATA PENGANTAR
Puji syukur kami panjatkan kehadirat Allah Yang Maha Esa, hanya karena Ridho-Nya laporan hasil penelitian ini dapat diselesaikan dengan baik.
Kegiatan berjudul “Pengembangan Sistem Proses Produksi Unsur Logam Tanah Jarang dan Logam Jarang untuk Material Maju” merupakan penelitian yang dilakukan bekerjasama dengan Pusat Sains dan Teknologi Akselerator (PSTA), Pusat Teknologi Bahan Galian Nuklir (PTBGN)-BATAN. Penelitian difokuskan pada reduksi logam neodimium dari neodimium oksida, pemisahan gadolinium oksida dari logam tanah jarang oksida, dan identifikasi serta karakterisasi benefisiasi mineral pembawa unsur lithium.
Penelitian dilakukan di Laboratorium Puslitbang Teknologi Mineral dan Batubara untuk proses reduksi logam dan pemisahan gadolinium oksida, sedangkan untuk pembuatan neodymium oksida dilakukan di Laboratorium PSTA, dan pembuatan LTJ-hidroksida dilakukan di Laboratorium PTBGN. Contoh bahan baku yaitu monasit yang digunakan berasal dari PT. Timah., Bangka. Penelitian ini dalam upaya mendukung pengembangan energi baru terbarukan yang berbasis pada sumber daya mineral sehingga diharapkan ke depan dapat memperkuat ketahanan energi nasional.
Kami mengucapkan terima kasih kepada segenap pihak yang membantu, hingga terselesaikannya penelitian ini. Harapan kami semoga penelitian ini dapat bermanfaat.
Bandung, Desember 2016
Kepala Puslitbang Teknologi Mineral dan Batubara,
Ir. Dede Ida Suhendra, M.Sc. NIP. 19571226 198703 1 001
SARI
Material maju merupakan material hasil modifikasi dari material yang sudah ada untuk memperoleh performa yang superior pada satu karakter atau lebih. Material maju berbasis mineral logam yang saat ini tengah dikembangkan dengan memanfaatkan logam tanah jarang sebagai komponen penting, di antaranya Ce dan Nd sebagai komponen magnet permanen dan juga Gd sebagai contrast agent MRI untuk aplikasi di bidang kesehatan. Selain berbasis logam tanah jarang, material maju yang dikembangkan adalah berbasis lithium untuk baterai. Sedangkan, material maju yang berbasis mineral non logam juga dapat diaplikasikan pada pemanfaatan energi baru terbarukan (EBT), salah satunya adalah bioetanol. Tujuan penelitian ini adalah penguasaan teknologi proses reduksi LTJ khususnya Ce dan Nd, penguasaan teknologi proses pemisahan Gd-oksida dari LTJ-hidrGd-oksida, serta menghasilkan m
membran silika mesopori yang memiliki sifat permselektivitas terhadap etanol. Dari hasil penelitian, dapat disimpulkan bahwa neodimium oksida dapat direduksi menjadi logam neodimium pada suhu 1100oC menggunakan reduktor Camenggunakan fluks campuran NaCl dan CaCl2 dengan diperoleh kadar logam Nd adalah 49,25%. Sementara dari produk Gd-oksida yang dihasilkan, perolehannya sebesar 60% berat Gd-oksida dan sudah dapat digunakan untuk bahan baku MRI. Untuk penelitian pembuatan membran, penelitian hanya sampai menghasilkan partikel nanosilika berpori sebagai bahan dasar pembuatan membran karena terkendala pemotongan anggaran.Dari hasil karakterisasi,ukuran partikel nanosilika yang dihasilkan memiliki ukuran 11,6 nm dengan diameter pori sekitar 2-5 nm dan masih mengandung pengotor garam.
Penelitian identifikasi dan karakterisasi mineral lithium dari deposit bijih timah difokuskan pada enam lokasi deposit pasir silika pada daerah bekas pengusahaan penambangan bijih timah di wilayah Bangka yaitu Pemali, Pompong, dan Binjai, dan Air Nangka (Lassar), Badau, Batu Besi (Damar) (Belitung Timur) di Belitung. Komposisi mineral pada konsentrat hasil proses konsentrasi yang teridentifikasi selain mineral lithium petalite(Li2O.Al2O3.8SiO2) terdapat mineral silika (SiO2) yangdominan, dan mineral silikat lainya fenaksite (K, Na)4Fe2Si8O20(OH, F).
Kata kunci: material maju, reduksi, neodimium, bioetanol, membran silika, pasir silika, lithium
DAFTAR ISI
Kata Pengantar………...i
Sari………... ii
DAFTAR ISI………..………….… iii
DAFTAR GAMBAR ………..……… vi
DAFTAR TABEL ……….….……….…. ix
I PENDAHULUAN ……….……… 1
1.1 Latar belakang ………... 1
1.2 Ruang lingkup kegiatan ………..………..……… 7
1.2.1 Logam tanah jarang untuk bahan baku material maju …..….….. 7
1.2.2 Logam jarang untuk bahan baku material maju ………... 7
1.2.3 Pembuatan membran silikauntukpemurnianbioetanol …..……… 7
1.3 Tujuan …………... 8
1.4 Sasaran ………...……. 8
II TINJAUAN PUSTAKA ………..………….….… 9
2.1. Pengertian logam tanah jarang ………..………..…..….…... 9
2.2. Pemanfaatan logam tanah jarang ……….………. 10
2.3. Logam tanah jaranguntukbahanbaku material maju ………...…….. 11
2.3.1. Reduksi oksida LTJ menjadi logam ……….…………. 12
2.3.2. Ekstraksi gadolinium oksida (Gd-oksida) dari LTJ-hidroksida ... 15
2.4. Logam jarang untuk material maju (lithium) ………..…. 18
2.5. Pembuatan membran silika untuk pemurnian bioetanol ……… 21
III PROGRAM KEGIATAN... 26
3.1 Persiapan……….…………... 26
3.2 Pengambilan contoh……...……….……….…….... 26
3.3 Proses penelitian ………..……… 27
3.3.1. Logam tanah jarang untuk bahan baku material maju ………... 27
3.3.3. Pembuatan membran silika berpori untuk pemurnian
bioetanol ……... 27
3.4 Sosialisasi penelitian (seminar dan media cetak) .………...…... 29
3.5 Pembuatan laporan akhir ……….……..……….... 29
IV METODOLOGI... 30
4.1 Logam tanah jarang untuk bahan baku material maju ………... 30
4.1.1 Peralatan ………...………... 30
4.1.2 Bahan………...………...……...….. 30
4.1.3 Metode ………... ………...…….. 30
4.2 Logam jarang untuk bahan baku material maju………..… ………..….… 32
4.2.1 Peralatan ………...………..…... 32
4.2.2 Bahan ………... ………...…. 32
4.2.3 Metode ………... …………... 32
4.3 Pembuatan membran silika untukpemurnianbioetanol ……... 34
4.1.1 Peralatan ………...……….. 34
4.1.2 Bahan ………...…...…..…...… 34
4.1.3 Metode ………...………. 34
V HASIL DAN PEMBAHASAN……….……….…. 35
5.1. Reduksioksida-LTJ (Ce- danNd-oksida) menjadilogam Ce danNd……... 35
5.1.1 Reduksi neodimium oksida (Nd-oksida) menjadi logam Nd .…37 5.1.2 Optimasi reduksi serium oksida (Ce-oksida) menjadi logam Ce ………..….…. 48
5.2. Pemisahan Gd-oksida dari LTJ-hidroksida ………...………….……..….. 50
5.3. Logamjaranguntukbahanbaku material maju ……….…... 57
5.3.1 Hasil kajian identifikasi karakteristik pasir silika ampas Pencucian bijih timah ………... 57
5.3.2 Pasir silika Pemali-Bangka ………..………... 57
5.3.3 Pasir silika Pompong-Bangka ………...….. 60
5.3.5 Pasir silika Air-Nangka Belitung ………..……….….….. 62
5.3.6 Pasir silika Badau-Belitung ………..………..…... 64
5.3.7 Pasir silika Batu-Besi Belitung Timur ………..………….…….…... 64
5.4. Pembuatan membran silika berpori untuk pemurnian biodiesel …………...….. 66
5.4.1 Karakterisasi bahan baku ………..…….….. 66
5.4.2 Proses pelindian dengan asam ……….……… 69
5.4.3 Sintesis nano partikel secara alkalifusion ……….……... 70
5.4.4 Karakterisasi partikel silika gel ……….….…...… 76
5.4.5 Sintesis dan karakterisasi membran ……… 83
VI KESIMPULAN DAN SARAN……….………..……….. 84
DAFTAR GAMBAR
Gambar 1.1 Roadmap penelitian………..………….……... 6
Gambar 2.1 Tabel susunan berkala (periodik) ………..…………... 9
Gambar 2.2 Beberapa produk industri berbasis REE ………..………... 11
Gambar 2.3 Jalur proses produksi LTJ dari bijih ……...………...………. 12
Gambar 2.4 Grafik titik leleh-didih logam tanah jarang………..…………...14
Gambar 2.5 Grafik titik didih- leleh LTJ berdasarkan kenaikan berat atomnya...14
Gambar 2.6 Tipe baterai dan kerapatan energinya ………. 18
Gambar 2.7 Perkembangan penelitian baterai berbasis lithium ……….…….……. 19
Gambar 2.8 Jenis deposit lithium global dan potensinya di beberapa negara …….… 20
Gambar 2.9 Kurva kondisi azeotrop ……….…...………...………... 22
Gambar 2.10 Skema proses distilasi azeotrop………...….…... 24
Gambar 2.11 Skema gabungan proses distilasi dan pervaporasi ……….……... 25
Gambar 4.1 Diagram alir proses reduksi LTJ ..………...….……..….... 31
Gambar 4.2 Diagram alir proses ekstraksi Gd ………..………... 31
Gambar 4.3 Tahapan preparasi percontoh dan karakterisasi mineral ampas pencucian timah ……….. 33
Gambar 5.1 Grafik energi bebas LTJ- dan logam-oksida terhadap suhu……..….……... 36
Gambar 5.2 Grafik energi bebas LTJ- dan logam- klorida terhadap suhu ………... 36
Gambar 5.3 Grafik energi bebas LTJ- dan logam- flourida terhadap suhu………...…… 36
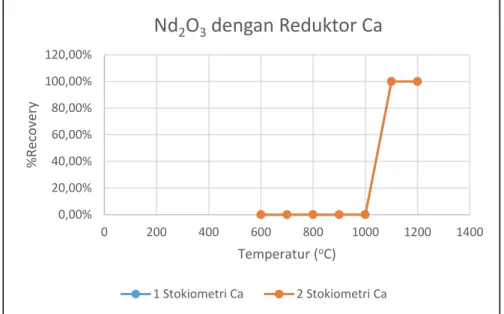
Gambar 5.4 Hubungan antara suhu dan perolehan Nd2O3 dengan reduktor Ca ……..39
Gambar 5.5 Hubunganantarasuhudanperolehan Nd2O3dengan reduktor Mg.…….….39
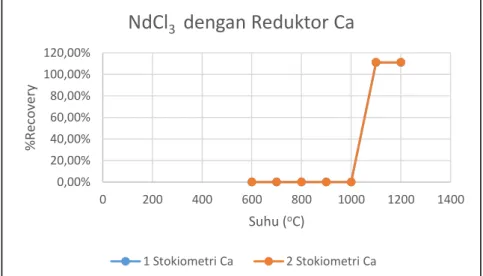
Gambar 5.6 Hubungan perolehan logam Nd dengan suhu pada sampel NdCl3 Dengan reduktor Ca ……….…….……….... 40
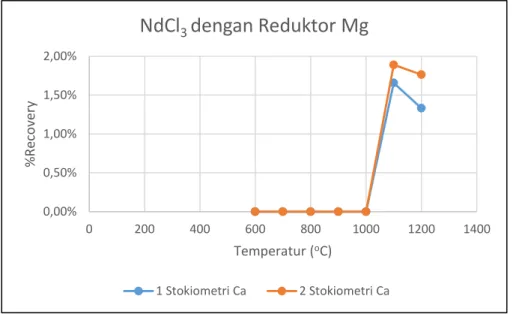
Gambar 5.7 Hubungan perolehan logam Nd dengan suhupada sampel NdCl3 Dengan reduktor Mg ………..……..……….. 41
Gambar 5.8 Hubungan perolehan logam Nd terhadap variasi sampel……….………... 43
Gambar 5.9 Logam neodimium pada sampel 1 gram Nd-oksida …………..…………...… 43
Gambar 5.11 Hasil analisis pada Sampel 3 (warnaterang: Nd, warnamerah: Nd)...44
Gambar 5.12 Hasil analisis pada Sampel 4 (warnaterang: Nd, warnamerah: Nd) ...45
Gambar 5.13 Hasil analisis pada Sampel 7 (warnaterang: Nd, warnamerah: Nd) ...45
Gambar 5.14 Hasil analisis pada Sampel 8 (warnaterang: Nd, warnamerah: Nd) …....46
Gambar 5.15 Hasil analisis pada Sampel 9 (warnaterang: Nd, warnamerah: Nd) ...46
Gambar 5.16 Hasil analisis pada Sampel 10 (warnaterang: Nd, warnamerah: Nd) …. 47 Gambar 5.17 Reduksi CeO2menggunakanreduktor Mg ………...…….…..….. 48
Gambar 5.18 Reduksi CeO2 menggunakanreduktor Al………...…………..… 49
Gambar 5.19 Reduksi CeO2menggunakanreduktor Ca ………...…... 49
Gambar 5.20 Diagram alir proses pemisahan Gd-oksida dari LTJ-hidroksida ….…….… 53
Gambar 5.21 Pola XRD untuk pasir kuarsa Pemali-Bangka, ukuran butiran -140# +200# ……….….... 58
Gambar 5.22 Pola XRD untuk pasir kuarsa Pemali-Bangka, ukuran butiran -200# +325# ………... 59
Gambar 5.23 Pola XRD untuk pasir kuarsa Pompong-Bangka ………. 60
Gambar 5.24 Pola XRD untuk pasir kuarsa Binjai-Bangka ………..… 61
Gambar 5.25 Pola XRD untuk pasir kuarsa Air-Nangka Belitung ………..………. 63
Gambar 5.26 Pola XRD untuk pasir kuarsa Badau-Belitung ………..……… 64
Gambar 5.27 Pola XRD untuk pasir kuarsa Batu-Besi Belitung Timur ……… 66
Gambar 5.28 Hasil XRD raw materal silika Tuban ……….……….. 67
Gambar 5.29 Foto SEM dan EDAX sampel pasir kuarsa ……….………. 69
Gambar 5.30 (a) Proses alkalifusion silika + Na2CO3 (b) Hasil alkalifusion Na2SiO3 ..… 71
Gambar 5.31 (a) Pencucian natrium silikat dengan aquades (b) Penyaringan natrium silikat(c)Filtrat alkalifusion hasil penyaringan natrium silikat ………..…… 72
Gambar 5.32 Grafik suhu terhadap persen ekstraksi hasil alkalifusion ………... 73
Gambar 5.33 Proses presipitasi ……….……… 74
Gambar 5.34 Hasil presipitasi ……….……….. 75
Gambar 5.35 (a) Silika gel (b) Filtrat presipitasi ………..……….. 75
Gambar 5.36 Grafik suhu terhadap persen ekstraksi presipitasi ……….. 76
Gambar 5.37 Grafik suhu terhadap ukuran partikel ………..……… 77
Gambar 5.38 Hasil XRD silika gel suhu 700°C ……….……... 78
Gambar 5.39 Hasil XRD silika gel suhu 800°C ……….………... 78
Gambar 5.40 Hasil XRD silika gel suhu 900°C ………..………….. 79
Gambar 5.42 (a) Hasil analisis SEM silika gel suhu 700°C (b) suhu 800°C
(c) suhu 900°C, dan (d) suhu 1000°C ………..…….. 80 Gambar 5.43 Kurva adsorpsi-desorpsi sampel nanosilika ………... 81 Gambar 5.44 Penentuan diameter pori dengan metode Barrett-Joyner-Halenda (BJH) ……….… 81 Gambar 5.45 Penentuan diameter pori dengan metode Dubinin-Astakhov …………... 82 Gambar 5.46 Foto hasil analisis TEM pada berbagai perbesaran …………..……….. 83
DAFTAR TABEL
Tabel 5.1 Hasil analisis bahan baku Nd-oksida PSTA ………...…………... 37
Tabel 5.2 Hasil analisis ICP bahan baku Nd-oksida komersial ………..……….…. 38
Tabel 5.3 Parameter percobaan ………..…………..…. 42
Tabel 5.4 Hasil komposisi unsur pada sampel 4 ……….……….... 47
Tabel 5.5 Hasil analisis ICP bahan baku LTJ-hidroksida PT. Timah ……….……….... 51
Tabel 5.6 Nilai pH untuk Pengendapan LTJ-berat, sedang dan ringan...52
Tabel 5.7 Hasil analisis oksida LTJ-berat ………..….... 54
Tabel 5.8 Hasil analisis oksida LTJ-sedang ………... 55
Tabel 5.9 Hasil analisis oksida LTJ-ringan ……….…………..….... 55
Tabel 5.10 Spesifikasi gadolinium oksida ……….….….. 56
Tabel 5.11 Komposisi mineral pasir silika Pemali-Bangka, ukuran butiran -140# +200# ………... 58
Tabel 5.12 Komposisi mineral pasir silika Pemali-Bangka, ukuran butiran -200# +325# ………... 58
Tabel 5.13 Komposisi kimia unsur kelumit untuk pasir silika Pemali-Bangka ……..….. 59
Tabel 5.14 Komposisi mineral pasir silika Pompong-Bangka ……….…………. 60
Tabel 5.15 Komposisi mineral pasir silika Binjai-Bangka ………..………..……...…. 61
Tabel 5.16 Komposisi kimia unsur kelumit untuk pasir silika Pompong-Bangka …….. 62
Tabel 5.17 Komposisi mineral pasir silika Air-Nangka Belitung …………..…….……...…... 62
Tabel 5.18 Komposisi kimia unsur kelumit untuk pasir silika Air-Nangka Belitung …. 63 Tabel 5.19 Komposisi mineral pasir silika Badau-Belitung …………..………... 64
Tabel 5.20 Komposisi kimia unsur kelumit untuk pasir silika Badau-Belitung …….….. 65
Tabel 5.21 Komposisi mineral pasir silika Langkat-Sumut …………..……….…………... 65
Tabel 5.22 Komposisi kimia unsur kelumit untuk pasir silika Batu-Besi Belitung Timur………. 66
Tabel 5.23 Analisis AAS raw material silika Tuban ……….……….….. 68
Tabel 5.24 Hasil analisis XRF residu hasil pelindian ……….…. 70
Tabel 5.26 Hasil pencucian natrium silikat dengan aquades ……….…...… 72
Tabel 5.27 Filtrat hasil alkalifusion analisis AAS ……….. 73
Tabel 5.28 Analisis AAS filtrat presipitasi ……….…..…. 75
1
I. PENDAHULUAN
1.1. Latar belakang
a. Undang– UndangNomor 4 Tahun 2009 tentang Pertambangan Mineral dan Batubara:
1. Pasal 95 huruf c: Pemegang IUP dan IUPK wajib meningkatkan nilai tambah;
2. Pasal 102: Pemegang IUP dan IUPK wajib meningkatkan nilai tambah dalam pelaksanaan penambangan, pengolahan/pemurnian, dan pemanfaatan minerba;
3. Pasal 103: Pemegang IUP dan IUPK wajib melakukan pengolahan/ pemurnian hasil penambangan di dalam negeri;
b. Undang– UndangNo. 30 Tahun 2007 tentang Energi
c. Peraturan Pemerintah Nomor 23 Tahun 2010 tentang Pelaksanaan Kegiatan Usaha Pertambangan Mineral dan Batubara:
1. Pasal 93: Pemegang IUP Operasi Produksi dan IUPK Operasi Produksi mineral wajib melakukan pengolahan/pemurnian untuk meningkatkan nilai tambah, langsung atau kerja sama dengan perusahaan pemegang IUP dan IUPK lainnya;
2. Pasal 94: Pemegang IUP Operasi Produksi dan IUPK Operasi Produksi batubara wajib melakukan pengolahan untuk meningkatkan nilai tambah, langsung atau kerja sama dengan perusahaan pemegang IUP dan IUPK lainnya;
3. Pasal 95: Komoditas tambang yang ditingkatkan nilai tambahnya adalah mineral logam, bukan logam, batuan, atau batubara;
4. Pasal 96 : Ketentuan tentang tata cara peningkatan nilai tambah mineral dan batubara diatur dengan Peraturan Menteri.
d. Peraturan Presiden Republik Indonesia Nomor 5 Tahun 2006 tentang Kebijakan Energi Nasional.
e. Peraturan Menteri ESDM No. 4 tahun 2010, tanggal 7 Januari 2010 tentang Renstra ESDM 2010-2014, a.l. memuat peningkatan nilai tambah pertambangan.
f. Kepmen Ristek No. 193/M/Kp/IV/2010 tanggal 30 April 2010 tentang Agenda Ristek Nasional 2010-2014.
g. Peraturan Menteri ESDM No. 8 Tahun 2015 tentang peningkatan nilai tambah mineral melalui kegiatan pengolahan dan pemurnian mineral khususnya pada Bab II pasal 5 ayat (2) yang menyatakan bahwa produk samping/sisa hasil pengolahan dan/atau pemurnian komoditas tambang mineral logam timah berupa zirkon, ilmenit, rutil, monasit, senotim, dan terak wajib dilakukan pengolahan dan/atau pemurnian di dalam negeri. Material maju menurut merupakan material hasil modifikasi dari material yang sudah ada untuk memperoleh performa yang superior pada satu karakter atau lebih. Material maju menunjukkan kekuatan yang lebih besar, rasio densitas kekuatan yang lebih tinggi, kekerasan yang lebih besar dan lebih unggul pada sisi termal, elektrikal, optikal atau ciri-ciri kimiawi ketika dibandingkan material tradisional.
Material maju dapat digolongkan menjadi delapan kelompok material: 1. Besi dan paduannya
Biasanya dipergunakan untuk pesawat terbang dan digunakan sebagai bahan dasar mobil di industri pertahanan. Selain itu dikembangkan juga pada besi amorf berdasar campuran (alloys) yang dikombinasikan dengan liquid metal yang menghasilkan kekuatan yang lebih besar, diestimasikan akan menjadi dua sampai tiga kali lebih kuat daripada besi terbaik. Paduan besi juga lebih ringan daripada aluminium atau titanium, tetapi lebih murah daripada material komposit.
2. Structural ceramic, jika keramik konvensional merupakan isolator maka keramik oksida menghasilkan superkonduktor contohnya intan dan silicon carbide memiliki konduktivitas termal yang tinggi daripada aluminium atau tembaga.
3. Polimer bermanfaat dalam mengurangi noise industri aerospace, transportasi, konstruksi, medis, marine.
4. Komposit maju merupakan perpaduan dari satu atau dua material yang berbeda baik dari sifat fisik dan kimiawinya dan menghasilkan material dengan sifat yang sangat berbeda. Biasanya, komposit ini digunakan untuk material bangunan yaitu semen. Umumnya juga digunakan untuk bangunan, jembatan dan struktur.
5. Elektronik, magnetic dan material optik seperti semikonduktor dimanfaatkan sebagai Integrated electronic circuit, devais optoelektronik dan juga untuk photovoltaic.
6. Medis dan dental material seperti alumina dan calcium phosphate glasses and carbon fibre reinforced polylactic acid composites
7. Material katalis
8. Material untuk bahan bangunan.
Penelitian pengolahan logam tanah jarang dan logam jarang untuk bahan baku material maju ini difokuskan untuk bahan baku material maju khususnya untuk:
1. EBT (energi baru terbarukan) yaitu sebagai energy storage; untuk magnet permanen LTJ (Ce dan Nd), dan pembuatan membran silika berpori untuk pemurnian bioetanol.
2. Bidang kesehatan, yaitu pembuatan gadolinium oksida dari logam tanah jarang untuk contrast agent.
Energi baru terbarukan sangat dibutuhkan pada saat ini karena sumber energi primer yaitu energi fosil dan nuklir akan habis ketika dieksploitasi. Saat ini, sumber energi fossil semakin menipis maka manusia kembali melirik sumber energi alternatif yang jumlahnya sangat banyak, murah dan alami yaitu energi baru terbarukan. Teknologi energi baru terbarukan yang sudah dikenal dan diterapkan adalah sel surya, turbin angin, PLTA, dan pompa panas geotermal. Selain teknologi energi baru terbarukan diatas, sudah saatnya dikembangkan pula energi baru terbarukan berbasis logam tanah jarang (LTJ) yaitu untuk magnet permanen.Magnet permanen berbasis LTJ yaitu Nd dan Ce dapat diaplikasikan untuk Pembangkit Listrik Tenaga Magnet (PLTMn). Keuntungan PLTMn ini adalah sumber aliran listrik stabil, ramah lingkungan tidak menimbulkan emisi gas dan kimia berbahaya, tidak terkendala cuaca pada saat pengoperasian dan bentuknya bisa kecil. Laboratorium Micasa (Swiss) telah melakukan penelitian PLTMn dengan menggunakan magnet berbasis neodimium. PLTMn juga dapat digunakan untuk menggerakkan roda kendaraan atau mesin pesawat. PLTMn 7 KW pernah dibuat oleh Troy Reed (Tulsa, Oklahoma (AS), dan telah dipasang di mobil (AS), yang menggunakan jasa tenaga magnet saja sebagai ‘bahan bakar’ penggerak mobil (tidak ada BBM/gas/lainnya). Mobil bermotor magnet (SURGE) dapat melaju hingga 137 km/jam.
Aplikasi energi bersih terbarukan memerlukan komponen pendukung seperti untuk pembangkit listrik tenaga surya dan kendaraan listrik memerlukan komponen pendukung berupa divais penyimpan energi, yang dikenal sebagai baterai. Salah satu baterai dengan kinerja terbaik di antara tipe baterai yang ada dan berkembang saat ini adalah baterai berbasis lithium( Kipouros dkk, 1998). Lithium merupakan komponen yang berasal dari sumber daya mineral dan dihasilkan oleh industri pertambangan melalui proses benefisiasi dan ekstraksi.Beberapa sumber daya mineral pembawa lithium yang sudah diketahui
dan secara komersial telah menjadi bahan baku untuk menhasilkan material prekursor baterai lithium sebagai lithium karbonat diantaranya seperti mineral lithium spodumeneLiAl(SiO3)2, amblygonite, LiAl(F,OH)PO4, dan pentalite, LiAl(Si2O5)2 (Kesler dkk, 2012). Mineral pembawa lithium tersebut diprediksi terdapat di deposit pasir mineral berat diantaranya seperti di deposit bijih timah. Penyelidikan dan penelitian sumber daya mineral lithium di deposit pasir mineral berat di wilayah Indonesia, terutama di daerah deposit bijih timah di wilayah Bangka-Belitung belum ada data menunjukkan kegiataan tersebut. Oleh karena itu, penelitian identifkasi dan karakterisasi mineral lithium di deposit bijih timah sebagai upaya untuk memastikan ketersediaan sumber daya lithium untuk pengembangan industri baterai lithium di dalam negeri.
Salah satu EBT selain yang telah disebutkan diatas adalah energi biofuel. Biofuel yang saat ini popular dikembangkan adalah bioetanol (C2H5OH). Bioetanol mampu menghasilkan angka oktan yang tinggi, sehingga ketika dicampurkan dengan bahan bakar fosil (gasoline) efisiensi bahan bakar meningkat dan dapat menutupi kepadatan energi yang rendah jika dibandingkan dengan bensin.Bioetanol lebih ramah lingkungan dibandingkan minyak bumi karena mempunyai rantai karbon yang lebih rendah dibandingkan bahan bakar fosil. Penggunaan energi ramah lingkungan juga menjadi perhatian pemerintah Indonesia, mengingat saat ini Indonesia menempati urutan ketiga setelah Amerika dan Cina dalam hal produksi emisi gas rumah kaca.
Dengan regulasi yang telah dibuat oleh pemerintah, diharapkan pemanfaatan bioetanol semakin meningkat. Mekanisme pemanfaatan bioetanol sendiri dilakukan dengan pencampuran bioetanol dan bensin dengan persentase tertentu hingga pada tahun 2025 ditargetkan komposisi campuran bensin dan bioetanol adalah 80:20. Namun, pelaksanaan regulasi tersebut melalui mandatori pemerintah terhadap penggunaan bioetanol nyaris tidak menunjukan realisasinya. Dalam hal ini, pemerintah masih kurang serius menerapkan kebijakan diversifikasi energi tersebut. Akibatnya, pangsa pasar bioetanol pun mengalami keterpurukan. Hal ini berakibat pada industri-industri bioetanol di Indonesia yang semakin terancam bangkrut, khususnya pada pabrik-pabrik skala rumahan.
Pada awalnya, industri beranggapan bahwa bioetanol yang dihasilkan akan diterima oleh Pertamina, atau lembaga lain yang bertugas sebagai pembeli siaga (off taker). Namun, karena kualitas bioetanol tidak memenuhi persyaratan yang ditetapkan Pertamina (kemurnian 99%), dimana bioetanol yang dihasilkan hanya memiliki kemurnian 90%. Hal ini disebabkan hanya perusahaan-perusahaan besarlah yang memiliki teknologi yang mampu menghasilkan kemurnian hingga 99%(full grade etanol).
Pemurnian bioetanol dapat dilakukan dengan cara distilasi atau menggunakan membran. Pemurnian bioetanol dengan cara distilasi memiliki kelemahan karena campuran air dan etanol dapat membentuk azeotrop, yaitu kondisi dimana air dan etanol tidak dapat dipisahkan lagi dengan cara distilasi biasa sehingga kemurnian etanol sulit ditingkatkan lagi. Kondisi ini dicapai pada fraksi mol etanol 89%. Selainitu, cara distilasi memiliki kelemahan pada efisiensi energi yang rendah, membutuhkan energi yang besar dan menghasilkan emisi karbondioksida.
Pemurnian bioetanol dengan menggunakan membran bisa menjadi solusi. Metode ini dapat menghasilkan etanol dengan kemurnian tinggi (>95%). Penggunaan membran berbasis mineral silikat atau aluminosilikat seperti pasir silika dan zeolit sudah dikembangkan di beberapa negara di dunia. Membran yang terbuat dari silika memiliki sifat permselektivitas yang baik terhadap etanol.
Penelitian mengenai penyiapan nano partikel silika sudah dilakukan dari tahun 2011 di Puslitbang Tekmira. Hasil dari penelitian ini adalah gel silika yang partikelnya berukuran 40-80 nm [Wahyudi, dkk., 2011]. Gel silika inilah yang merupakan bahan baku pembuatan membran silika.
Road map penelitian pemanfaatan LTJ dan LJ untuk bahan baku material maju dapat dilihat pada Gambar 1.1.
Gambar 1.1. Roadmappenelitian.
2012
2013
2014
2015
2016
2017
GOAL Paket teknologi ekstraksi Gd dan Ce logam (dokumen tekno-ekonomi, QC) Engineering Design ekstraksi logam Ce,Nd dan Gd Diperoleh kondisi reduksi optimumlogamCe dan Yperolehan>90%.
Kajian keekonomian difokuskan pada kelayakan proses ekstraksi monasit
kajian lingkungan proses ekstraksi metode asam dan basa
Diperolehnya kondisi optimum proses reduksi Y dan Ndperolehan>90%.
Diperolehnya kondisi optimum proses ekstraksi Gd skala 5kg umpan dengan kemurnian dan perolehan >95%
Identifikasi dan evaluasi LTJ dalam abu batubara
Kajian keekonomian difokuskan pada kelayakan proses reduksi Ce
Kajian upaya pengelolaan lingkungan proses reduksi
Diperolehnya optimasi proses reduksi Y, Ce dan Nd perolehan>90%
Diperolehnya kondisi optimum proses ekstraksi Gd skala 250gr umpan dengan kemurnian dan perolehan >95%
DED untuk produksi Gd dari monasit dan Ce logam dari Ce oksida
Ekstraksi LTJ dari abu batubara
Sintesis dan karakterisasi material berpori berbasis mineral silikat sebagai penyaring molekul
Diperolehnya proses pengolahan tailing timah menjadi monasit, ilmenit dan zirkon.
Profil investasi pembangunan pabrik pengolahan taling timah
Ekonomi lingkungan proses ekstraksi
EPC pilot plant Gd
Kajian keekonomian ekstraksi Gd
Kajian proses reduksi Ce dan Nd dalam tube vacuum furnace
Diperolehnya kondisi optimum proses reduksi Ce dan Nd perolehan>90% dalam
tube vacum furnace.
Optimalisasi pemisahan Gd-oksida hingga diperoleh produk Gd-oksida yang sesuia untuk MRI
Pembuatan membran berbasis silika untuk pemurnian bioetanol
1.2. Ruang lingkup kegiatan
1.2.1 Logam tanah jarang untuk bahan baku material maju
Pada tahun anggaran 2016, penelitian yang berkaitan dengan unsur logam tanah jarang difokuskan pada optimasi proses reduksi logam Ce dan Nd, dan optimalisasi pemisahan Gd-oksida dengan ruang lingkup kegiatan sebagai berikut: a) Pengambilan contoh LTJ-hidroksida;
b) Proses reduksi oksida logam tanah jarang menjadi logamnya; 1) Optimasi proses reduksi Nd2O3 menjadi logam Nd 2) Optimasi proses reduksi Ce2O3 menjadi logam Ce c) Optimasi pemisahan Gd-oksida dari LTJ-hidroksida;
d) Sosialisasi hasil penelitian melalui seminar dan media cetak terkait logam tanah jarang di Indonesia.
1.2.2 Logam jarang untuk bahan baku material maju
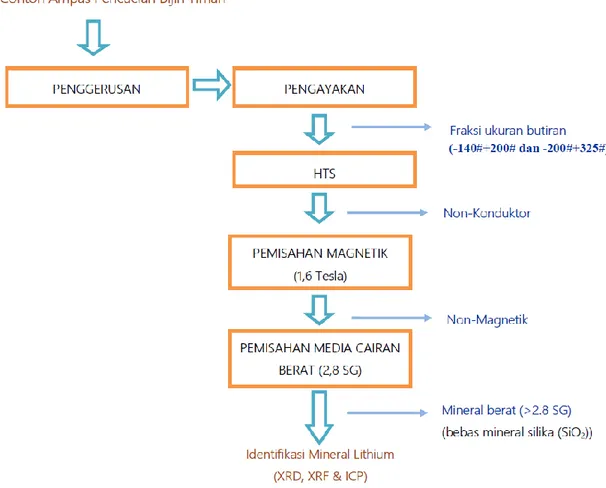
Kajian identifikasi dan karakterisasi benefisiasi mineral pembawa lithium dari deposit bijih timah mencakup:
- Studi literatur
- Pengambilan contoh bahan baku penelitian; - Karakterisasi bahan baku penelitian;
- Pemisahan dengan menggunakan metode konsentrasi: berat jenis, kemagnetan dan konduktivitas;
- Karakterisasi produk konsentrasi mineral bijih timah yang berupa konsentrat mineral silikat terdiri dari analisis mineralogi dan analisis komposisi kimia untuk menentukan kandungan unsur lithiumnya.
1.2.3 Pembuatan membran silika untuk pemurnian bioetanol
Ruang lingkup kegiatan penelitian untuk pembuatan membran silika, yaitu sintesis nanosilika, pembuatan membran silika dan uji pemisahan etanol dan air. Tahapan kegiatan yang dilakukan terdiri dari :
a) Pengambilan sampel silika;
b) Preparasi dan karakterisasi sampel ; c) Pemisahan sampel dari pengotor;
e) Pembuatan membran dengan metode dip coating; f) Karakterisasi membrane;
g) Analisis dan uji pemisahan etanol dan air.
1.3 Tujuan
Tujuan penelitian di tahun anggaran 2016 ini adalah:
1) Penguasaan teknologi proses reduksi LTJ khususnya Ce dan Nd.
2) Penguasaan teknologi proses pemisahan Gd-oksida dari LTJ-hidroksida
3) Mensinergikan aktivitas penelitian dan pengembangan LTJ guna mewujudkan industri LTJ di Indonesia
4) Mensosialisasikan kemajuan penelitian LTJ di Indonesia
5) Mengkarakterisasi sumber daya mineral lithium dalam deposit bijih timah dan pemilihan jalur benefisiasinya untuk memperoleh produk konsentrat bijih lithium dengan kadar ≥ 4%-LiO2.
6) Menghasilkan membran silika mesopori yang memiliki sifat permselektivitas terhadap etanol
1.4 Sasaran
Sasaran penelitian di tahun anggaran 2016 ini adalah:
a) Dihasilkannya kondisi proses pembuatan logam Ce dan Nd dengan perolehan >90%.
b) Diperolehnya kondisi proses pemisahan Gd-oksida dari LTJ hidroksida yang dihasilkan oleh pilot plant PT. Timah.
c) Tersosialisasikannya penelitian tentang pengolahan LTJ di media cetak dan seminar.
d) Diperolehnya informasi data karakteristik deposit mineral lithiumdan jalur benefisiasi untuk peningkatan kadar lithium sebagai konsentrat dengan kadar sekurang-kurangnya 4%-LiO2 dan mendapatkan gambaran mineralogi sumber daya mineral lithium berhubungan dengan mineral pengotor yang akan dipisahkan secara optimal sehingga memenuhi syarat untuk menjadi bahan umpan proses ekstraksi untuk menghasilkan lithium karbonat.
e) Diperoleh membran silika mesopori yang memiliki karakteristik nilai fluks >2 mol/m2 jam dan faktor pemisahan (α) >5.
II. TINJAUAN PUSTAKA
2.1. Pengertian logam tanah jarang
Logam tanah jarang (LTJ) atau rare earth elements (REE) beberapa referensi menyebutkan unsur tanah jarang (UTJ) atau rare earth adalah satu kelompok unsur-unsur logam yang memiliki kesamaan sifat secara fisikadan kimia yang berada pada kelompok lantanida di dalam sistem periodik unsur. Skandium dan yttrium dimasukkan ke dalam LTJ dengan pertimbangan kesamaan sifat kimia dan fisikanya terhadap kelompak lantanida.
Logam Tanah Jarang (LTJ) merupakan kelompok lantanida dalam sistem periodik unsur yang memiliki 14 unsur kimia, terdiri atas Ce-Pr-Nd-Pm-Sm-Eu-Gd-Tb-Dy-Ho-Tr-Tm-Yb-Lu (cerium, praseodymium, neodymium, prometium, samarium, europium, gadolinium, terbium, dysprosium, holmium, erbium, tulium, ytterbium, and lutetium). Logam grup lain yang sering berasosiasi dalam mineral yang sama adalah Sc-Y-La (scandium, yttrium dan lantanum). Keberadaan unsur logam tanah jarang dalam sistem tabel periodiksusunan berkala dan dikelompokkan lagi menjadi LTJ berat (heavy) dan ringan (light) yang diberi warna berbeda, masing masing jingga dan ungu, pada tabel periodik (Gambar 2.1).
Gambar 2.1. Tabel susunan berkala (periodik).
Unsur tanah jarang (REE) tidak seperti namanya, sebagaimana tulium (Tm) dan lutetium (Lu) merupakan dua unsur yang terkecil kelimpahannya di dalam kerak bumi tetapi 200 kali lebih banyak daripada kelimpahan emas (Au). Meskipun demikian unsur-unsur tersebut sangat sulit untuk diekspoitasi karena konsentrasinya tidak cukup tinggi untuk ditambang secara ekonomis.
REE yang paling melimpah di antaranya adalah cerium, yttrium, lantanum dan neodymium; kelimpahan rata-rata di dalam kerak bumi serupa dengan logam-logam kromium (Cr), nikel (Ni), seng (Zn), molibdenum (Mo), timah putih (Sn), tungsten (W) dan timbal (Pb). Semua REE merupakan logam dan kelompok ini
juga disebut sebagai logam tanah jarang (LTJ), memiliki sifat-sifat serupa dan sering ditemukan bersamaan di dalam cebakan-cebakan. LTJ tidak ditemukan di bumi sebagai unsur bebas melainkan dalam bentuk senyawa (mineral) kompleks karbonat ataupun fosfat.Mineral tersebut tidak bisa didapatkan dengan mudah karena jumlahnya yang sangat terbatas. Terlebih lagi, mineral tersebut tidak terpisah sendiritetapi tercampur dengan mineral lain.Mineral-mineral yang mendominasi dalam senyawa LTJdi atas adalah lanthanum (La), cerium (Ce), neodymium (Nd). Sehingga mineral ini menjadi ekonomis untuk dilakukan proses ekstraksi yang menyebabkan pemanfaatan ketiga mineral ini sangat tinggi bila dibanding dengan mineral LTJ lainnya.
2.2. Pemanfaatan logam tanah Jarang
LTJ sesuai dengan namanya merupakan senyawa mineral dengan REE yang sangat langka atau kelimpahannya sangat sedikit. Keterdapatan di alam berupa senyawa kompleks umumnya senyawa fosfat dan karbonat. Dengan perkembangan teknologi pengolahan material, LTJ semakin dibutuhkan umumnya pada industri teknologi tinggi.
LTJ banyak diburu bersama paduannya karena digunakan untuk banyak peralatan dalam kehidupan sehari-hari, di antaranya berupa: memori komputer, DVD, baterai isi ulang, telepon selular, konventer katalis kendaraan bermotor, magnet, lampu fluoresen dan lain-lain. Bahkan kegunaan untuk komputer dan DVD telah tumbuh lebih cepat daripada telepon selular. Berbagai tipe rechargeable batteries yang banyak mengandung cadmium (Cd) atau timbal, sekarang digantikan dengan batere rechargeable lanthanum-nickel-hydride (La-Ni-H). Demikian halnya pada baterai komputer, baterai mobil dan peralatan komunikasi banyakmenggunakanLTJ karena daya pakai yang lebih lama, mudah diisi ulang (recharge) dan mudah didaur ulang.
Bila melihat kondisi pasar REE setidaknya pada dekade terakhir ini, kebutuhan dunia terus meningkat terutama disebabkan kegunaannya dalam industri berteknologi tinggi. Pada teknologi tinggi berupa industri magnetic refrigeneration karena REE mempunyai daya magnet yang sangat kuat.
Untuk memenuhi kebutuhan dunia sudah sejak lama mengandalkan potensi yang ada di Tiongkok (China). Sekitar 90 % kebutuhan dunia dipasok dari Tiongkok. Akan tetapi akhir-akhir ini pemerintah Tiongkok mulai membatasi produksinya hingga 60% yang berdampak semakin mahal dan langkanya komoditas ini di pasaran global. Harganya pun sempat meroket meskipun belakangan harga ini mulai menurun. Sebagai gambaran pada bulan Agustus 2012 harga Nd (99%) mencapai lebih dari 450.000 dollar AS (sekitar 4,3 milyar rupiah) per ton dan Ce
oksida (99%) mencapai 150.000 dollar AS (sekitar 1,4 milyar rupiah) per ton FOB Tiongkok.
Pada kenyataannya, banyaknya permintaan baterai isi ulang yang dibuat dari senyawa LTJ sejalan dengan permintaan akan perangkat elektronik portabel telepon selular, komputer dan kamera. Beberapa senyawa LTJ digunakan untuk pembuatan baterai yang dibutuhkan sebagai pembangkit tenaga listrik pada kendaraan bermotor. Sejalan dengan perhatian terhadap ketidaktergantungan pemanfaatan energi, perubahan iklim dan isu-isu tentang penjualan kendaraan listrik yang menggunakan baterai, sehingga menyebabkan permintaan akan senyawa logam tanah jarang meningkat lebih cepat. Pemicu peningkatan permintaan senyawa-senyawa LTJ juga sejalan dengan peningkatan kebutuhan bahan pembuat katalis, fosfor, turbin angin, kendaraan hibrida, dan pemoles untuk pengendali pencemaran udara, layar iluminasi pada perangkat elektronik dan gelas optik (Gambar 2.2).
Gambar 2.2. Beberapa produk industri berbasis REE.
2.3. Logam tanah jarang untuk bahan baku material maju
Monasit merupakan sumber utama logam tanah jarang ringan, diperoleh sebagai produk samping dari penambangan dan pengolahan mineral berat seperti ilmenit, rutil, dan zirkon (Australia, Brazilia, Cina dan India); serta kasiterit, ilmenit dan zirkon (Malaysia, Thailand dan Indonesia).
Di Indonesia, berdasarkan hasil studi BATAN, terdapat beberapa daerah potensi deposit monasit, yaitu Bangka Belitung, Karimata/Ketapang, Rirang-Tanah Merah (Atmawinata, 2011).
Logam tanah jarang tidak ditemukan berupa unsur bebas dalam lapisan kerak bumi, tetapi berbentuk senyawa kompleks. Untuk mendapatkan unsurnya, perlu dilakukan proses pemisahan terlebih dahulu dari senyawa kompleks tersebut. Jalur proses produksi logam tanah jarang dari bijih dapat dilihat pada Gambar 2.3.
Gambar 2.3. Jalur proses produksi LTJ dari bijih (Iags, 2012).
Fokus penelitian yang dilakukan oleh Puslitbang Teknologi Mineral dan Batubara adalah pembuatan logam tanah jarang dari oksidanya.
2.3.1. Reduksi oksida LTJ menjadi logam
Logam-logam tanah jarang dapat dipisahkan dengan mereduksi oksidanya menjadi logam dengan kemurnian hampir 95% tergantung dari pengotornya. Metode untuk mereduksi oksida-LTJ dapat dilakukan melalui proses elektrolisis dan proses metalotermik.
1. Proses elektrolisis
Proses ini dibagi menjadi dua, yaitu:
Dekomposisi dari RE-Cl3 dengan melarutkannya dalam lelehan garam alkali atau alkali tanah.
Metode elektrolisis ini memiliki beberapa kelemahan, yaitu: penggunaan elektroda yang mahal dan cukup konsumtif, penggunaan garam klorida atau flourida untuk mencegah pembentukan garam REOCl yang tidak diinginkan, membutuhkan suhu yang tinggi (>1000oC), perolehan logam rendah (<40%), dan proses reduksi RE-Cl3 akan menghasilkan gas klorin yang sangat korosif. Sedangkan kelebihannya adalah proses ini dapat dilakukan secara kontinu. 2. Proses metalotermik
Proses ini dibagi menjadi dua, yaitu:
Reduksi RE-F3 dengan logam Ca (calciothermic process).
Reduksi RE-O2 dengan logam Ca.
Proses metalotermik ini memiliki kerugian yaitu: suasana proses non-oksidasi dan membutuhkan energi yang tinggi. Sedangkan kelebihannya perolehan logam yang dihasilkan >90%. Proses metalotermik yang sedang dikembangkan saat ini adalah Ames Process yang dikembangkan di Amerika. Ames Processditujukan untuk membuat logam tanah jarang dengan kemurnian yang tinggi dan mendapatkan uranium untuk “Proyek Manhattan” melalui reduksi metalotermik dari garam-logam menggunakan logam alkali tanah:
2RF3 + 3Ca 2R + 3CaF2
Dalam proses ini, tanah jarang flourida (RF3) direduksi dengan logam Ca menghasilkan logam tanah jarang dan terak kalsium flourida. RF3 dihasilkan dengan mereaksikan tanah jarang oksida (R2O3) dengan asam flourida (HF) sesuai dengan reaksi di bawah ini:
R2O3 + 6HF 2RF3 + 3H2O
Selain itu, prosesAmesjuga mencakupreduksi langsungdarioksidatanah jarangdengan lantanum untuk empatlogam tanah jarangyang memilikitekanan uap yang sangat tinggi, yaituSm, Eu, Tm, danYb.
R2O3 + 2La La2O3 + 2R(g)
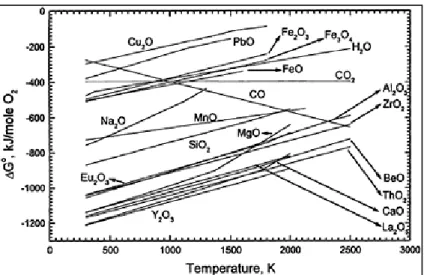
Penggunaaanlogamlantanum untuk mereduksi langsungoksida tanah jarang, spesiesyang memiliki tekanan uaptinggidipisahkan dengancara sublimasi, sehinggakeluar sebagai gasyangterkondensasi kemudian dipadatkandalam kondensor. Pemilihan metode untuk mereduksi oksida tanah jarang dapat ditentukan berdasarkan titik leleh-didih logam tanah jarang yang dapat dilihatpadagrafik di Gambar 2.4.
Gambar 2.4. Grafik titik leleh-didih logam tanah jarang(Riedenman, 2011).
Dari grafik terlihat jelas titik didih dan leleh dari tiap-tiap logam tanah jarang. Titik didih merupakan indikatortekananuaprelatif terhadapmasing-masing logam. Jika grafik tersebut disusun ulang berdasarkan kenaikan berat atomterhadap kenaikan titik didih,maka akan diperoleh grafik seperti pada Gambar 2.5.
Gambar 2.5. Grafik titik didih- leleh LTJ berdasarkan kenaikan berat atomnya(Riedenman, 2011).
Jalur proses untuk membuat logam tanah jarang dapat ditentukan berdasarkan 4 (empat) jalur proses seperti pada grafik diatas. Keempat jalur proses tersebut:
1. Titik leleh rendah ke titik leleh tinggi, sangat tinggi tekanan uap logam. • Reduksilangsung oksidanya/sublimasi.
• Pemurnian dilakukan dengan sublimasi.
2. Titik leleh tinggi, cukup tinggi tekanan uap logam.
• Vacuum casting untuk menghilangkan pengotor yang mudah menguap. • Sublimasi untuk menghilangkanspesi yang tidak menguap.
3. Titik leleh sedang ke titik leleh tinggi, tekanan uap logam sedang. • Reduksi dengan logam kalsium dari bentuk flouridanya.
• Vacuum casting untuk menghilangkan pengotor yang mudah menguap. • Distilasi untuk menghilangkan spesi yang tidak mudah menguap. 4. Titik leleh rendah, tekanan uap logam rendah.
• Reduksi dengan logam kalsium dari fluoridanya.
• Vacuum casting untuk menghilangkan pengotor yang mudah menguap. • Pengendapan tantalum (Ta).
Pada proses ke-4, tekanan uap menurun ke tingkat yang rendah sehingga tidak dapat dilakukan proses sublimasi atau distilasi. Neodimium (Nd) memiliki tekanan uap yang mendekati skandium (Sc). Namun, Nd memiliki kelarutan yang jauh lebih rendah dari Ta, sehingga kemurnian Nd tinggi untuk proses ke-4 ini.
2.3.2. Ekstraksi gadolinium oksida (Gd-oksida) dari LTJ-hidroksida
Batuan gadolinium yang berwarna merah delima digunakan dalam penerapan gelombang mikro dan senyawa gadolinium digunakan sebagai senyawa fosfor pada televisi berwarna. Pada konsentrasi1%, gadolinium bisa meningkatkan kemampuan alloy besi, krom, dan alloy yang terkait, juga meningkatkan ketahanan terhadap oksidasi. Gadolinium memiliki pergerakan magnet yang sangat tinggi dan unik, dan untuk suhu Curie (suhu di mana sifat feromagnetisme menghilang) hanyalah pada suhu kamar, yang artinya gadolinium bisa digunakan sebagai komponen magnet yang bisa mendeteksi panas dan dingin.
Sebagaimana unsur radioaktif lainnya, gadolinium memiliki warna putih keperakan, berkilau seperti logam, dan mudah ditempa. Pada suhu kamar, gadolinium mengkristal dalam bentuk heksagonal atau bentuk alfa dengan kerangka tertutup. Selama pemanasan hingga 1235oC, gadolinium alfa berubah menjadi bentuk beta yang memiliki struktur kubus berpusat badan.
Gadolinium (Gd) adalah elemen yang unik dan kuat dalam kimia dan biomedis yang dapat diterapkan secara bersamaan untuk Magnetic Resonance Imaging (MRI), X-ray Computed Tomography (CT), dan terapi menangkap neutron untuk kanker.
Proses pemisahan gadolinium dari dari logam tanah jarang terdiri dari dua tahapan proses yaitu tahap pengelompokkan logam tanah jarang dan tahap pemisahan unsur gadolinium. Gadolinium diperoleh dari proses pemisahan logam tanah jarang hidroksida (LTJ(OH)3) dalam bentuk gadolinium oksida (Gd-Oksida).
Proses pemisahan dilakukan pada 10 kg LTJ(OH)3 yang diperoleh dari PT. Timah Bangka.
LTJ(OH)3 atau UTJ(OH)3 yang bersumber dari PT. Timah Bangka memiliki kemurnian 96%. Untuk memurnikannya, diperlukan dua tahapan utama yaitu pelarutan dan pengendapan. Pelarutan dilakukan menggunakan asam kuat sedangkan pengendapan menggunakan ammonium oksalat.Pada tahap pelarutan, LTJ(OH)3 dan pengotornya dilarutkan secara sempurna dengan menggunakan larutan HNO3 65%. Proses pelarutan dilakukan pada sebuah tangki berpengaduk pada suhu 90oC dengan reaksi yang terjadi yaitu sebagai berikut:
UTJ(OH)3(s) + 3HNO3(aq) + 3H2O(l) → UTJ(NO3)3.6H2O(aq)
Setelah seluruh LTJ terlarut sempurna maka dilakukan penambahan ammonium oksalat 25% untuk mengendapkan unsur tanah jarang dari unsur non tanah jarang. Unsur tanah jarang diperoleh dalam bentuk endapan unsur tanah jarang oksalat berwarna putih kristal, sedangkan unsur non tanah jarang akan tetap larut dalam filtrat. Adapun reaksi yang terjadi saat penambahan ammonium oksalat ialah sebagai berikut:
2UTJ(NO3)3.6H2O (aq) + 3(NH4)2C2O4(aq) → UTJ2(C2O4)3,10H2O(s) + 6NH4NO3(aq) + 2H2O(l)
Pada reaksi tersebut terbentuk garam LTJ oksalat, kemudian larutan dicuci dengan menggunakan air dan ditambahkan ammonium hidroksida (NH4OH). Ciri terbentuknya LTJ oksalat ialah munculnya endapan-endapan berwarna putih. Penambahan air pencuci dan NH4OH bertujuanuntuk memaksimalkan perolehan endapan unsur tanah jarang. Proses ini dilakukan karena kelarutan LTJ oksalat dalam air sangat dipengaruhi oleh pH. Apabila pH larutan meningkat maka kelarutan LTJ oksalat akan menurun.
Endapan LTJ yang telah terbentuk akan disaring dengan menggunakan screw press filter. Endapan inilah yang akan diproses lebih lanjut sedangkan filtrat yang sebagian besar mengandung non-LTJ akan dibuang ketempat penampungan sementara.
Selanjutnya, dilakukan proses pengendapan selektifterhadap endapan yang terbentuk. Proses pengendapan selektif ini didasarkan pada pengelompokan LTJ. Menurut Shweet al. (2008), larutan unsur tanah jarang yang telah larut dipisahkan ke dalam unsur tanah jarang kelompok berat, sedang dan ringan. LTJ berat yang terdapat pada aliran proses ialah Dy (disprosium) sedangkan LTJ sedang yang terdapat pada aliran proses ialah europium (Eu), gadolinium (Gd), samarium (Sm) dan terbium (Tb). LTJ ringan yang terdapat pada aliran proses ialah serium (Ce), lantanum (La), neodimium (Nd) dan praseodimium (Pr). Pemisahan kelompok-kelompok ini ialah dengan cara mengatur pH operasi pada pengendapan. Nilai pH
operasi untuk mengendapkan LTJ berat ialah 6,50, LTJ sedang 7,08 dan LTJ ringan 8,30.
Proses awal pengendapan selektif ialah dengan melarutkan endapan LTJ oksalat menggunakan HNO3 65%. Setelah seluruh endapan larut dan menjadi homogen, kemudian larutan LTJ ini akan ditambahkan NH4OH hingga mencapai pH 6,5. Pada kondisi ini, LTJ berat mengendap kemudian disaring. Filtrat dari proses ini akan masuk pada tahap pengendapan LTJ sedang.Filtrat yang mengandung LTJ sedang dan LTJ ringan akan dinaikkan pH nya hingga 7,08 dengan penambahan air. Pada pH operasi ini, LTJ sedang mengendap kemudian disaring. Endapan inilah yang diproses ke tahap selanjutnya karena memiliki kandungan Gd.
Endapan LTJ sedang yang tersaring kemudian dilarutkan kembali agar dapat diekstraksi selektif. Pelarutan endapan LTJ sedang menggunakan HNO3 1%. Pelarutan ini bertujuan untuk meningkatkan pH dan mempermudah proses ekstraksi. pH operasi yang digunakan ialah pada pH 3.Setelah endapan terlarut dan diatur pH nya menjadi 3, Gd diekstraksi menggunakan ekstraktan DBDTP (di-butyl di-thio phosphate) dengan pelarutorganik berupa heksana. Ekstraksi Gd dilakukan melalui 5 tahapan,selain diekstrak menggunakan pelarut heksan, LTJ yang sudah terikat pada ligan DBDTP melepaskan LTJ apabila pH diatas 7. Proses ini disebut scrubbingkarena solute berpindah dari fase air ke fase organik. Proses scrubbing Gd dilakukan dengan 5 tahapan. Gd yang diambil sekarang berada pada fase air.
Logam Gd yang telah di-scrubbing oleh air ditambahkan ammonium oksalat agar mengendap. Hal ini bertujuan untuk mendapatkan endapan Gd oksalat. Gd oksalat inilah yang kemudian diubah menjadi Gd oksida menggunakan tungku peleburan. Garam Gd oksalat yang telah terbentuk disaring terlebih dahulu sebelum direaksikan di dalam tungku peleburan. Pada proses di dalam tungku peleburan, Gd oksalat terurai menjadi Gd oksida. Secara ringkas, reaksi penguraian Gd oksalat menjadi Gd oksida ialah sebagai berikut:
Gd2(C2O4)3.10H2O(s)→ Gd2O3(s) + 10 H2O(g) + 3 CO2(g) + 3 CO(g) Produk akhir yang diperoleh yaitu Gd2O3 yang diharapkan dapat diterapkan untuk Magnetic Resonance Imaging (MRI), X-ray Computed Tomography (CT), dan terapi menangkap neutron untuk kanker.
2.4. Logam jarang untuk material maju (lithium)
Baterai berbasis lithium merupakan baterai paling unggul dibandingkan tipe baterai lainnya hingga saat ini. Ada lima kriteria untuk kualitas unggul suatu baterai, yaitu kerapatan energi atau daya, lama waktu penggunaan, keselamatan,
kinerja dan biaya. Material prekursor berbasis lithium sebagai komponen baterai ditinjau dari kriteria kualitas unggul suatu baterai merupakan yang terbaik sehingga unsur lithium akan terus meningkat kebutuhan dan penggunaannya ke depan (Arai dkk, 2004; Ebenspenger dkk, 2005).
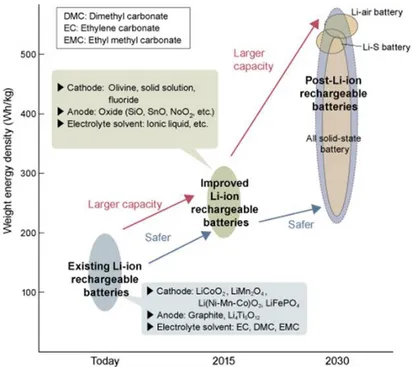
Pemanfaatan dan pengembangan baterai berbasis lithium sebagai energy storage saat ini paling mendominasi penggunaannya pada berbagai perangkat elektronik yang bersifat mobile, terutama menjadi krusial pada pengembangan mobil listrik. Baterai berbasis lithium penggunaannya pada kendaraan listrik sebagai energy storage menjadi salah satu kunci dalam pengembangan mobil listrik kedepan. Pada saat ini energy storage yang mempunyai kapasitas energi yang tinggi (Wh/kg) masih sangat tergantung pada komponen lithium (Oumellal dkk, 2008). Pada Gambar 2.6 menunjukkan perbandingan berbagai tipe baterai yang saat ini ada dipasaran.
Gambar 2.6. Tipe baterai dan kerapatan energinya (Ebensperger dkk, 2005).
Pengembangan baterai berbasis lithium akan mencapai kerapatan energi hingga 500 Wh/kg dan diprediksi pengembangannya terutama untuk penggunaan pada kendaraan listrik yang sangat memerlukan karakteristik seperti ini. Kemampuan baterai dengan karakteristik tersebutakan menentukan kemampuan jarak tempuh dan pengembangan kehandalannya kedepan untuk mobil listrik seperti digambarkan pada Gambar 2.7.
Gambar 2.7. Perkembangan penelitian baterai berbasis lithium (Kipouros dkk, 1998).
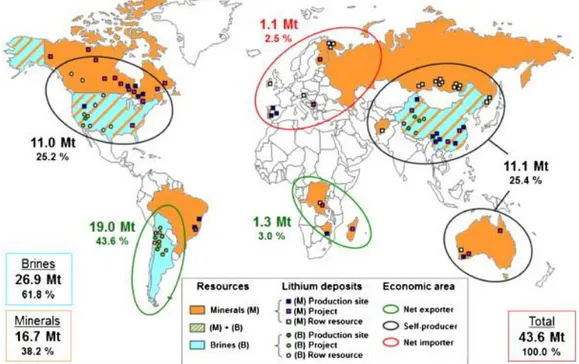
Produksi unsur lithium saat ini berasal dari tiga jenis sumber daya lithium yang secara global diperkirakan mencapai 43,6 juta metrik ton (MT),yaitu air asin (continental brine), batuan pegmatit (hard-rock) dan batuan sedimen (clay). Air asin benua (brine) dan pegmatit (atau bijih, hard-rock) adalah sumber utama untuk produksi lithium komersial saat ini. Pada Gambar 2.8 diperlihatkan negara dan tipe jenis deposit lithium yang saat ini telah diketahui data potensinya (Kesler dkk, 2012; Mohr dkk, 2012).
Gambar 2.8. Jenis deposit lithium global dan potensinya di beberapa negara.
Ada 13 mineral lithium yang diketahui dan hanya beberapa mineral lithium yang secara komersial penting (Samoilov dkk, 2008; Xu dkk, 2016), yaitu:
Spodumene LiAl(SiO3)2, dengan kandungan 4 – 8-% lithia (Li).
Amblygonite, LiAl(F,OH)PO4, dengan kandungan 8 – 10-% lithia (Li).
Lepidolite, lithium mica, KliAl (OH,F)2Al(SiO4)3, atau K2Li4Al2F4Si8O22 (komposisi kimia kompleks) dengan kandungan 2 – 4-% lithia (Li).
Zinnwaldite, lithium iron mica, Li2K2Fe2Al4Si7O24, dengan kandungan 2-3,5-% lithia (Li).
Petalite, LiAl(Si2O5)2, dengan kandungan 2 – 4-% lithia (Li).
Triphylite, Li(Fe, Mn)PO4, dengan kandungan 2 – 6-% lithia (Li).
Lithiophilite, Li(Mn, Fe)PO4, dengan kandungan 2 – 6-% lithia (Li).
Mineral bijih utama lithium yang terbentuk dari batuan, terutama dari deposit granite, pegmatite dan deposit placer, adalah mineral spodumene (LiAlSi2O6), petalite, LiAl(Si2O5)2, lepidolite (KLi2Al(Al,Si)3O10(F,OH)2 dan amblygonite (Li,Na)AlPO4(F,OH). Mineral lithium tersebut keterdapatannya berasosiasi dengan mineral cassiterite (bijih timah), columbite-tantalite, ilmenite, zircon, monazite, beryl, apatite, quartz, tourmaline, dan feldspar.
Beberapa usaha pertambangan penghasil konsentrat mineral lithium di global memberikan informasi terkait dengan cut off grade, salah satunya dari Australia’s
Economic Demonstrated Resources (EDR) untuk tambang bijih lithium di Mount Marion, Kalgoorlie; Mount Cattlin, Ravensthorpe bagian Utara;dan Pilgangoora, Port Hedland; semuanya di West Australia (WA) dengan nilai besaran rata-rata 1,1%-Li2O (nilai besaran secara umum antara 0.8%-5%-Li2O).
2.5. Pembuatan membran silika untuk pemurnian bioetanol
Bioetanol merupakan salah satu jenis biofuel (bahan bakar cair dari pengolahan tumbuhan) di samping biodiesel. Bioetanol adalah etanol yang dihasilkan dari fermentasi glukosa (gula) yang dilanjutkan dengan proses distilasi. Proses distilasi dapat menghasilkan etanol dengan kadar 95% volume, untuk digunakan sebagai bahan bakar (biofuel) perlu lebih dimurnikan lagi hingga mencapai 99% yang lazim disebut fuel-gradeetanol (FGE).
Secara umum, proses pengolahan bahan berpati seperti ubi kayu, jagung dan sagu untuk menghasilkan bioetanol dilakukan dengan beberapa urutan proses. Pertama adalah proses hidrolisis, yakni proses konversi pati menjadi glukosa. Prinsip dari hidrolisis pati pada dasarnya adalah pemutusan rantai polimer pati menjadi unit-unit dekstrosa (C6H12O6). Pemutusan rantai polimer tersebut dapat dilakukan dengan berbagai metode, misalnya secara enzimatis, kimiawi ataupun kombinasi keduanya.
Hidrolisis secara enzimatis memiliki perbedaan mendasar dibandingkan hidrolisis secara kimiawi dan fisik dalam hal spesifitas pemutusan rantai polimer pati. Hidrolisis secara kimiawi dan fisik akan memutus rantai polimer secara acak, sedangkan hidrolisis enzimatis akan memutus rantai polimer secara spesifik pada percabangan tertentu. Tahap kedua adalah proses fermentasi untuk mengkonversi glukosa (gula) menjadi etanol dan CO2. Fermentasi etanol adalah perubahan 1 mol gula menjadi mol etanol dan 2 mol CO2. Reaksi yang terjadi pada proses produksi etanol/bio-etanol secara sederhana ditujukkan pada reaksi 1 dan 2.
H2O + (C6H10O5)n nC6H12O6………. (1)
Enzim(pati) (glukosa)
(C6H12O6)n 2 C2H5OH + 2 CO2 ……… (2)
Ragi(glukosa) (etanol)
Pemurnian bioetanol
Setelah proses fermentasi selesai, dilakukan distilasi untuk memisahkan etanol. Distilasi merupakan pemisahan komponen berdasarkan titik didihnya. Titik didih etanol murni adalah 78oC sedangkan air adalah 100oC (Kondisi standar).Dengan memanaskan larutan pada suhu rentang 78 – 100oC akan mengakibatkan sebagian
besar etanol menguap, dan melalui unit kondensasi akan bisa dihasilkan etanol dengan konsentrasi 95% volume. Namun pada prakteknya proses distilasi biasa mengalami kendala pada terbentuknya kondisi campuran azeotrop.
Azeotrop adalah campuran dari 2 atau lebih komponen yang saling terikat sangat kuat dan sulit untuk dipisahkan dengan distilasi biasa, disamping itu campuran komponen tersebut memiliki titik didih yang konstan atau sama, sehingga ketika campuran azeotrop dididihkan, maka fasa uap yang dihasilkan memiliki titik didih yang sama dengan fasa cairnya. Campuran azeotrop ini sering disebut sebagai constant boiling mixture karena komposisinya yang senantiasa tetap jika campuran tersebut dididihkan, maka dari itu campuran azeotrop ini sulit untuk dipisahkan dengan metode distilasi biasa, sehingga hasil dari distilasi yang didapatkan yaitu etanol dengan campuran sedikit air, jadi etanolnya yang dihasilkan tidak murni. Kondisi azeotrop dapat dijelaskan melalui Gambar 2.9.
Gambar 2.9. Kurva kondisi azeotrop.
Titik A pada pada kurva merupakan titik didih campuran pada kondisi sebelum mencapai azeotrop. Campuran kemudian dididihkan dan uapnya dipisahkan dari sistem kesetimbangan uap cair (titik B). Uap ini kemudian didinginkan dan terkondensasi (titik C). Kondensat kemudian dididihkan, didinginkan, dan seterusnya hingga mencapai titik azeotrop. Pada titik azeotrop, proses tidak dapat diteruskan karena komposisi campuran akan selalu tetap. Pada gambar di atas, titik azeotrop digambarkan sebagai pertemuan antara kurva saturated vapor dan saturated liquid (ditandai dengan garis vertikal putus-putus).
Salah satu contoh azeotrop yaitu terdiri dari alkohol yang berkadar 96%, dimana sekitar 4%-nya adalah air membentuk suatu kondisi/campuran yang disebut azeotrop. Pada tahap ini, molekul alkohol dan air saling terikat dengan erat dan tidak bisa dipisahkan dengan distilasi biasa. Karena itu, untuk meningkatkan dari kadar 96% menjadi 99,5% dibutuhkan bantuan zeolit /molecular sieve /karbon aktif. Bahan-bahan tersebut mempunyai molekul dengan rongga yang sangat kecil
dan sangat banyak sehingga dapat menyerap molekul air yang lebih kecil daripada molekul alcohol. Sehingga hasil yang didapatkan nantinya adalah etanol murni. Distilasi Azeotrop
Distilasiazeotrop merupakan teknik pemisahan dari campuran azeotrop(terdiri dari alkohol yang berkadar 96%, dimana sekitar 4%-nya adalah air membentuk suatu kondisi/campuran). Campuran tersebut saling terikat dan sulit untuk dipisahkan dan salah satu cara untuk memisahkan 2 komponen tersebut yaitu dengan cara penambahan komponen lain untuk menghasilkan azeotrop heterogen yang dapat mendidih pada suhu lebih rendah, misalnya dengan penambahan benzenaatau dapat juga dengan garam, kedalam campuran air dan alkohol. Benzena berfungsi untuk memisahkan ikatan antara metanol dan air, sehingga ketika dipanaskan maka metanol akan menguap terlebih dahulu. Hal ini dikarenakan metanol memiliki titik didih yang rendah, sedangkan benzena dan air memiliki titik didih yang berdekatan dengan menggunakan distilasi bertingkat metanol, air dan benzena dapat dipisahkan secara sempurna. Hal ini disebabkan bentuk fisik kolom fraksional yang mampu menampung senyawa-senyawa yang mengalami penguapan dan pencairan dengan baik, sehingga ketika etanol menguap dan siap untuk dikondensasi, baik benzena maupun air dapat lebih dahulu dicairkan oleh kolom fraksional dan ditampung dengan baik di kolom ini, sehingga etanol yang didapat akan murni. Skema proses distilasi azeotrop dapat dilihat pada Gambar 2.10.
Terdapat dua tipe proses distilasi yang banyak diaplikasikan, yaitu continuous-feed distillation column system dan pot-type distillation system. Selain tipe tersebut, dikenal juga tipe distilasi vakum yang menggunakan tekanan rendah dan suhu yang lebih rendah untuk menghasilkan konsentrasi alkohol yang lebih tinggi. Namun teknologi ini sangat rumit dan hanya dapat dipakai pada pabrik skala besar.
Pervaporasi
Prinsip dasar pemisahan dengan teknologi membran pervaporasi adalah pemisahan berdasarkan metoda pervaporasi, dimana proses pemisahan suatu campuran dengan perubahan bentuk dari cair menjadi uap pada sisi membran. Cara kerjanya adalah etanol berkadar 95 % dipanaskan pada suhu 75 oC, air dalam etanol berubah menjadi uap air. Dengan tekanan vakum, etanol dan air masuk ke membran dengan kecepatan 1,5 x 10-4 m/s. Dalam teknik pervaporasi ini uap air akan melewati membran, sedangkan etanol ditolak. Selektivitas dan laju pemisahan pervaporasi sangat tergantung pada karakteristik membran, konfigurasi modul dan desain proses, itu artinya jenis membran yang digunakan mesti berkarakter mampu menyeleksi gas dan etanol yang masuk. Di ujung membran, uap air diserap oleh vakum, selanjutnya uap air dimasukkan dalam botol penampung yang berisi nitrogen cair. Nitrogen cair dipilih karena memiliki titik didih pada suhu -195,8 oC, dengan suhu yang sangat dingin, nitrogen cair mempunyai kemampuan membekukan bahan organik lebih efektif dari pada pendinginan berbahan ammonia ataupun freon. Saat menyentuh larutan nitrogen cair maka uap air kembali menjadi air, sedangkan etanol tidak melewati membran, cairannya langsung dialirkan ke botol penampung etanol murni.
Membran pervaporasi merupakan salah satu penerapan yang dapat digunakan untuk memisahan bioetanol. Didalam membran pervaporasi, proses pemisahan dilakukan berdasarkan ukuran partikel dengan driving force perbedaan tekanan. Ketika gaya dorong bekerja pada sisi umpan yang mengandung komponen pelarut dan zat terlarut, maka beberapa bagian padatan terlarut akan tertahan pada sisi membran disebut retentate, sedangkan pelarut akan lolos menembus membran disebut permeat. Hal ini menunjukkan bahwa membran yang kita gunakan mempunyai resistensi terhadap padatan sedangkan pelarut dapat lebih bebas menembus membran.
Untuk meningkatkan kadar etanol, teknologi membran lebih efektif. Dibandingkan dengan cara konvensional berupa distilasi dan dehidrasi. Ketika proses distilasi, bioetanol membentuk azeotrop. Artinya, antara etanol dan air yang terkandung sulit dipisahkan, sehingga perlu penambahan komponen senyawa kimia untuk memisahkan campuran azeotrop, senyawa tambahan tersebut seperti benzene dan garam. Distilasi dengan meninggikan kolom sekali pun, air sulit
diceraikan dari etanol. Memang masih ada sebuah cara untuk menarik air yaitu dengan menambahkan zat toluen. Toluen dikenal sebagai pelarut air. Ketika zat tersebut ditambahkan sesuai dengan kadar air yang terkandung, air akan tertarik. Namun, tetap saja masih ada air tersisa. Namun, sebagian zat toluen itu juga bercampur dengan bioetanol menjadi kontaminan.
Sebaliknya, teknologi membran mempunyai beberapa keistimewaan seperti menghasilkan bioetanol berkualitas tinggi, dalam proses pemisahannya pun tanpa bantuan tambahan dari komponen senyawa kimia lain, Selain itu produsen juga mudah mengoperasikan, ramah lingkungan, dan ukuran alat yang lebih kecil. Satu lagi keistimewaan membran: hemat energi. Alat berkapasitas 50 liter per hari, membran hanya membutuhkan energi listrik sebesar 1.000 watt. Contoh gabungan proses pervaporasi dan distilasi terlihat pada Gambar 2.11.
III. PROGRAM KEGIATAN
Kegiatan tahun 2016 terdiri dari 4 (empat) tahapan, yaitu persiapan, pengambilan contoh, proses penelitian, dan pembuatan laporan akhir. Rincian masing-masing tahapan sebagai berikut:
3.1. Persiapan
a. Studi literatur/koordinasi ke instansi terkait
Studi literatur dilakukan untuk memperoleh data sekunder tentang teknologi proses yang sudah ada serta penelitian yang sudah pernah dilakukan yang berkaitan dengan kegiatan. Sumber literatur diperoleh dari perpustakaan-perpustakaan instansi terkait, jurnal elektronik dan laman-laman jaringan elektronik. Koordinasi dilakukan dengan instansi-instansi yang telah melakukan penelitian LTJ dan membran silika berpori yaitu:PSTA-BATAN yogyakarta, PTBGN-BATAN Jakarta, Universitas Indonesia, BPPT, Balai Besar Logam dan Mesin, PT. Timah, Universitas Padjajaran dan Kemenperind.
b. Pembuatan Rencana Operasional
Pembuatan rencana operasional dilakukan dari hasil studi literatur dengan bantuan alat-alat tulis kantor.
c. Persiapan peralatan
Peralatan yang tersedia di laboratorium pengolahan mineral Puslitbang tekMIRA yang hendak digunakan disiapkan sehingga dalam kondisi siap pakai.Persiapan peralatan dilakukan oleh para anggota pelaksana kegiatan. Output dari tahap persiapan adalah tersusunnya Rencana Operasional yang berasal dari penelusuran literatur berupa buku teknis dan ekonomi, jurnal elekronik dan peralatan laboratorium siap pakai.
3.2. Pengambilan contoh
Pengambilan contoh bertujuan untuk memperoleh sampel LTJ-hidroksida yang akan dihasilkan oleh pilot plant PT. Timah bekerjasama dengan PTBGN-BATAN. Sedangkan pengambilan contoh oksida LTJ dilakukan di PSTA-BATAN Yogyakarta. Pasir silika yang diperlukan diperoleh dari Tuban, Jawa Timur, sementara lithium diambil dari mineral ikutan dari bijih timah di Pulau Bangka dan sekitarnya.Seluruh kegiatan lapangan dikoordinasikan langsung oleh ketuatim. Surat menyurat dan administrasi dilakukan oleh sekretaris tim.
Output dari kegiatan ini adalah diperolehnya bahan baku berupa contoh LTJ-hidroksida dan oksida LTJ, mineral pembawa lithium serta pasir silika.
3.3. Proses penelitian
3.3.1. Logam tanah jarang untuk bahan baku material maju 1. Karakterisasi bahan baku
Bahan baku yang berupa LTJ-hidroksidadan dikarakterisasi dengan melakukan analisis kimia dan fisika menggunakan ICP, XRF, dan SEM untuk mengetahui kandungan/komponen khususnya LTJ baik yang berkadar tinggi maupun yang sangat kecil yang terkandung dalam LTJ-hidroksida.
2. Karakterisasi oksida logam tanah jarang dari BATAN
Bahan baku untuk proses reduksi berupa oksida logam tanah jarang diperoleh dari PSTA-BATAN dikarakterisasi dengan melakukan analisis kimia dan fisika menggunakan ICP, XRF, dan SEM untuk mengetahui kandungan/komponen dalam oksida logam tanah jarang.
3. Proses reduksi oksida logam tanah jarang menjadi logam
Proses reduksi dilakukan dengan jalur pirometalurgi melalui proses reduksi dengan aluminium, natrium dan magnesium untuk mendapatkan logam tanah jarangnya.
3.3.2. Logam jarang untuk bahan baku material maju 1. Pemisahan berdasarkan perbedaan berat jenis
2. Pemisahan berdasarkan perbedaan kemagnetan 3. Pemisahan berdasarkan perbedaan kelistrikan 4. Kombinasi tahapan pemisahan
5. Karakterisasi produk benefesiasi
Output tahap ini adalah diperoleh kondisi proses yang optimum dan perolehan Ce, Nd dan Gd yang tertinggi, identifikasi LTJ dalam red mud dan pembuatan RE(OH) dari red mud serta kondisi proses benefisiasi mineral lithium.
3.3.3 Pembuatan membran silika berpori untuk pemurnian bioetanol Tahapan proses pembuatan membran silika berpori dibagi menjadi 2 tahapan utama, yaitu pengolahan dan analisis data hasil percobaan.
Tahapan I: Pengolahan
Karakterisasi sampel silika