RESPON IMUN SPESIFIK LARVA IKAN MAS (Cyprinus carpio) MELALUI IMUNITAS MATERNAL YANG DIBERI VAKSIN INAKTIF
WHOLE CELL Aeromonas salmonicida
Skripsi
Oleh
SYOHIBAHTTUL ISLAMIYAH BAHAR
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
BANDAR LAMPUNG 2017
ABSTRAK
RESPON IMUN SPESIFIK LARVA IKAN MAS (Cyprinus carpio) MELALUI IMUNITAS MATERNAL YANG DIBERI VAKSIN INAKTIF
WHOLE CELL Aeromonas salmonicida
OLEH
SYOHIBAHTTUL ISLAMIYAH BAHAR
Aeromonas salmonicida merupakan bakteri spesifik yang dapat menyebabkan penyakit infeksi dan kematian pada ikan mas (Cyprinus carpio) saat stadia larva. Pencegahan dapat dilakukan dengan pemberian vaksin, namun pemberian vaksin hanya dapat diberikan pada benih berumur lebih dari 3 minggu. Vaksinasi indukan perlu dilakukan untuk meningkatkan sistem imun larva dengan cara pemberian vaksin inaktif whole cell A. salmonicida pada indukan yang siap memijah. Tujuan dari pemberian vaksin yaitu untuk mengetahui efektivitas pemberian vaksin terhadap uji titer antibodi induk dan larva, serta Survival Rate
(SR) dan Relative Percent Survival (RPS) larva. Penelitian ini dilakukan dengan Rancangan Acak Lengkap, 4 perlakuan A (kontrol); B (0,3 ml/kg ikan); C (0,4 ml/kg ikan); D (0,5 ml/kg ikan) dan 3 kali ulangan. Hasil uji titer antibodi menunjukan bahwa dosis 0,3 ml/kg ikan mampu memberikan reaksi aglutinasi hingga pengenceran 64x pada indukan, dan dosis vaksin 0,4ml pada indukan mampu memberikan reaksi aglutinasi pada larva hingga pengenceran 32x. SR larva pada perlakuan tanpa vaksinasi jauh lebih rendah dari pada perlakuan dengan vaksinasi. Dosis 0,4 ml/kg ikan menghasilkan SR dan RPS tertinggi yaitu 96,11% dan 81,25%. Gejala kemerahan pada larva kontrol terlihat menyebar diseluruh tubuh sedangkan pada larva dengan perlakuan vaksin hanya dibagian tubuh tertentu.
Kata kunci: Vaksin, imunitas maternal, tingkat kelangsungan hidup, tingkat kelangsungan hidup relatif, titer antibodi
ABSTRACT
SPECIFIC IMMUNE RESPONSE OF COMMON CARP (Cyprinus carpio) LARVAE THROUGHT MATERNAL IMMUNITY WITH
ADMINITSTRATION OF INACTIVE WHOLE OFF CELL VACCINE Aeromonas salmonicida
By
SYOHIBAHTTUL ISLAMIYAH BAHAR
Aeromonas salmonicida is a specific bacterium that can cause infections and death to the common carp (Cyprinus carpio) during larval stage. Prevention can be done with the administration of the vaccine, but the vaccine can only be given to the seed over the age of 3 weeks. Maternal vaccination needs to be done to improve the immune system of the larvae by means of inactivated whole cell vaccine A. salmonicida on broodstock ready to spawn. Vaccine the administration aims to determine the effectiveness of vaccines on breeders carp to the parent antibody titer test and larvae, as well Survival Rate (SR) and the Relative Percent Survival (RPS) larvae. This research was conducted with a completely randomized design, 4 treatments A (control); B (0.3 ml/kg fish); C (0.4 ml/kg fish); D (0.5 ml/kg fish) and 3 repetitions. The results showed that the antibody titer of 0.3 ml/kg fish dose capable of providing agglutination reaction to 64x dilution in broodstock, and vaccine doses 0.4 ml/kg fish on broodstock able to give agglutination reaction to the larvae until 32x dilution. A dose of 0.4 ml/kg fish resulted the highest SR and RPS with 96.11% and 81.25% respectively. Clinical symptoms of redness in control larvae was spread throughout the body whereas on the vaccine treatment was only in certain body parts.
Keywords: Vaccine, maternal immunity, survival rate, relative percent survival, antibody titer
RESPON IMUN SPESIFIK LARVA IKAN MAS (Cyprinus carpio) MELALUI IMUNITAS MATERNAL YANG DIBERI VAKSIN INAKTIF
WHOLE CELL Aeromonas salmonicida
Oleh
SYOHIBAHTTUL ISLAMIYAH BAHAR
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA PERIKANAN
Pada
Jurusan Perikanan dan Kelautan Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
BANDAR LAMPUNG 2017
RIWAYAT HIDUP
Penulis dilahirkan di Mesuji, Lampung pada tanggal 25 Februari 1995 sebagai anak ke-1 dari pasangan Bapak M. Bakri Yanpuhan dan Hariyati. Penulis telah menyelesaikan jenjang pendidikan di Sekolah Taman Kanak-Kanak (TK) Yayasan Al-Qur’an Metro Lampung pada tahun 2000, SD Negeri 1 Suka Maju pada tahun 2006, SMP Negeri 1 Simpang Pematang pada tahun 2009, dan SMA Negeri 1 Tanjung Raya pada tahun 2012.
Penulis mendapatkan kesempatan untuk melanjutkan pendidikan ke perguruan tinggi Negeri di Universitas Lampung, Fakultas Pertanian, Jurusan Budidaya Perairan tahun 2012. Selama menempuh studi, penulis telah mengikuti magang kerja laboratorium di Loka Pemeriksaan Penyakit Ikan dan Lingkungan (LP2IL) Serang, Banten pada tahun 2014, penulis dipercaya mendapatkan hibah PKM –P dengan judul “Antibakteri Ekstrak Bunga Rosela (Hibiscus sabdariffa Linn) Terhadap Aeromonas Hydropilla Pada Ikan Lele (Clarias sp)” pada tahun 2014. Penulis melaksanakan praktik umum (PU) di PT. Centralpertiwi Bahari (CPB) dengan judul Analisa “Food Safety (Mikrobiologi) Udang Litopanaeus vannamei” di Laboratorium Animal Health Service (AHS) PT Centralpertiwi Bahari Tulang Bawang pada tahun 2015, dan penulis melaksanakan kegiatan Kuliah Kerja Nyata (KKN) selama 40 hari di Desa Kibang Yekti, Kabupaten Tulang Bawang Barat pada tahun 2015.
Penulis pernah menjadi asisten praktikum pada mata kuliah Ikhtiologi pada tahun 2013-2014, Plankton dan Tanaman Air pada tahun 2014, dan Manajemen Kesehatan Ikan pada tahun 2016. Penulis melakukan penelitian akhir pada bulan juni-agustus 2016 di Laboratorium Budidaya Perikanan Fakultas Pertanian Universitas Lampung dan Balai Benih Ikan Sentra (BBIS) Purbolinggo Lampung Timur dengan Judul “Respon Imun Spesifik Larva Ikan Mas (Cyprinus carpio) melalui Imunitas Maternal yang diberi Vaksin Inaktif Whole Cell Aeromonas salmonicida”.
Ku Persembahkan Karya Ku Ini Untuk:
Bapak Dan Ibu ku
Yang tidak pernah berhenti mendukung dan memberikan doa untuk keberhasilan ku. Adik ku satu-satunya, dan Keluarga Besar ku
Yang selalu memberikan dukungan dan semangat untuk keberhasilan ku
Sahabat-sahabat ku tercinta, dan teman –teman angkatan 2012 Budidaya Perairan, Unila yang selalu memberikan kecerian, dukungan, semangat dan motivasi selama kuliah hingga mendapatkan gelar sarjana
perikanan.
“Tanpa Kalian Aku hanya Sebutir Mutiara di dalam Kerang Berlumut”
(Cebong unyu, Ayu cantik, Weni imut, MB bro, Paul ulya, Desi dugong, Atik boncel, Heidy, Cung, Culis, Puji pardi, Palupi, Docan, Ambar tuyul, Ayi, Denti, dan semuanya)
Ibu dan Bapak Dosen Jurusan Budidaya Perairan, Unila. Dan Almamater Tercinta Universitas Lampung “Thank you for your gift of teaching with us”
(
Special for Mrs Esti Harpeni, S.T., M.AppSc
)TERIMAKASIH
BALAI BENIH IKAN SENTRA (BBIS) PURBOLINGGO
[Partisipasi, kerja keras, motivasi, ilmu pengetahuan & pengalaman, keceriaan,
kekeluargaan, persahabatan, kasih sayang]
“Suatu kesempatan langka dan memang tidak salah jika dianggap adalah takdir yang mempertemukan, berawal tidak saling mengenal dan akhirnya tinggal berbaur selama kurang lebih 2 bulan bersama, tidak ada kata menyesal hanya ada kata rindu dan ingin bersua kembali. Jangan lupa diri ini pernah singgah dan diri ini tidak akan pernah lupa. Semua terkenang bahkan masih hangat terasa; Asrama, Indor, Kolam,
Lab, dan Bapak-Bapak kece yang sangat berjasa THANK YOU”
(Bapak Surib, Bapak Wayan, Bapak Udin, Bapak Adit, Bapak Parjo, Bapak Juwoto, Bapak Umi, Bapak Zaenal, Bapak Harjo, Bapak Nto, Keluarga Besar Bapak Parjo, adik cantik ku
KATA PENGANTAR
Mengucap syukur kepada Allah SWT atas segala limpahan rahmat dan karunianya yang sehingga penulis dapat menyelesaikan skripsi yang berjudul “Respon Imun Spesifik Larva Ikan Mas (Cyprinus carpio) Melalui Imunitas Maternal yang diberi Vaksin Inaktif Whole Cell Aeromonas salmonicida” yang merupakan salah satu syarat untuk memperoleh gelar sarjana di Program Studi Budidaya Perairan, Universitas Lampung.
Dalam kesempatan ini penulis menyampaikan ucapan terimakasih kepada:
1. Bapak Prof. Dr. Ir. Irwan Sukri Banuwa, M.Si., selaku Dekan Fakultas Pertanian Universitas Lampung.
2. Ibu Ir. Siti Hudaidah, M.Sc., selaku ketua Jurusan Perikanan Dan Kelauatan Universitas Lampung.
3. Bapak Limin Santoso, S.Pi., M.Si selaku ketua Program Studi Budidaya Perairan Universitas Lampung.
4. Ibu Esti Harpeni, S.T., MAppSc selaku dosen pembimbing akademik serta pembimbing utama, yang telah membimbing, memberi dukungan, saran dan ilmu selama kuliah hingga proses penyelesaian skripsi ini.
5. Bapak Eko Efendi, S.T., M.Si selaku pembimbing dua yang telah membimbing, memberi saran dan ilmu dalam proses penyelesaian skripsi ini.
6. Bapak Deny Sapto Chondro Utomo, S.Pi., M.Si selaku pembahas yang telah memberikan, motivasi, saran dan ilmu dalam perbaikan skripsi ini. 7. Almamater terncinta Universitas Lampung.
Bandar Lampung, Januari 2017 Penulis
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR GAMBAR ... ii
DAFTAR TABEL ... iii
DAFTAR LAMPIRAN ... vi I. PENDAHULUAN ... 1 1.1Latar Belakang ... 1 1.2Tujuan Penelitian ... 2 1.3Manfaat Penelitian ... 2 1.4Kerangkan Pemikiran ... 3 1.5Hipotesis ... 4
II. METODE PENELITIAN ... 6
2.1Tempat dan Waktu Penelitian ... 6
2.2Alat dan Bahan Penelitian ... 6
2.3Rancangan Penelitian ... 7
2.3.1 Persiapan Penelitian... 7
a. Persiapan Alat dan Bahan ... 7
b. Persiapan Induk ... 8
c. Persiapan Media Kultur dan Vaksin ... 8
2.3.2 Pelaksanaan Penelitian ... 9
a. Vaksinasi Induk ... 9
b. Pemijahan dan Penetasan Telur ... 9
c. Pengukuran Titer Antibodi ... 9
d. Uji tantang ... 10
2.3.3 Rancangan Percobaan ... 10
2.3.4 Parameter Peneltian ... 12
2.3.5 Analisis Data ... 13
III. HASIL DAN PEMBAHASAN ... 14
3.1Vaksin dan Pemberian Vaksin ... 14
3.2Uji titer Antibodi ... 14
3.3Uji tantang Larva ... 18
IV. KESIMPULAN DAN SARAN ... 24
4.1Kesimpulan ... 24
4.2Saran ... 24 DAFTAR PUSTAKA
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka Pemikiran ... 4
2. Tata Letak Rancangan Penelitian ... 11
3. Tata Letak Pemeliharaan Larva ... 12
4. Hasil Uji Viabilitas ... 14
5. Hasil Titer Antibodi ... 15
6. Grafik Rataan Kelangsungan Hidup Larva Paca Uji Tantang Hari Ke-5 Pasca Penetasan dan Hari Ke-13 Pasca Penetasan ... 19
7. Grafik Rataan Kelangsungan Hidup Relatif Larva Paca Uji Tantang Hari Ke-5 Pasca Penetasan dan Hari Ke-13 Pasca Penetasan ... 19
8. Simulasi Microdulution plate 96 ... 35
9. Persiapan Serum Darah Induk dan Larva ... 36
10. Microdulution plate 96 ... 36
DAFTAR TABEL
Tabel Halaman
1. Alat Penelitian ... 6
2. Bahan Penelitian ... 7
3. Nilai Titer Antibodi pada Indukan yang Divaksinasi dengan Dosis yang Berbeda ... 16
4. Analisa Uji t pada Titer Antibodi Induk dan Larva ... 18
5. Gejala Klinis Pasca Uji Tantang ... 23
6. Kualitas Air selama Pemeliharaan Induk dan Larva ... 21
7. Perbandingan Komposisi BaCl2 dan H2SO4 1% dalam Mc.Farland ... 30
8. Standard Mc.Farland ... 31
9. Padat Tebar Larva Pada Uji Tantang ... 37
10. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan A dan B ... 40
11. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan A dan B .... 40
12. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan A dan C ... 41
13. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan A dan C .... 41
14. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan B dan A ... 41
15. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan B dan A ... 41
16. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan B dan C ... 41
17. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan B dan C ... 42
18. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan B dan D ... 42
19. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan B dan D ... 42
20. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan C dan A ... 42
21. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan C dan A ... 42
22. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan C dan B ... 43
23. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan C dan B ... 43
24. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan C dan D ... 43
25. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan C dan D ... 43
26. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan D dan B ... 43
27. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan D dan B ... 44
28. Perhitungan Uji t Titer Antibodi pada Induk antara Perlakuan D dan C ... 44
29. Hasil Analisis Uji t Titer Antibodi pada Induk antara Perlakuan D dan C ... 44
30. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan A dan B ... 45
31. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan A dan B ... 45
32. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan A dan C ... 45
33. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan A dan C ... 45
34. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan B dan A ... 45
35. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan B dan A ... 46
36. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan B dan C ... 46
37. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan B dan C ... 46
38. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan C dan A ... 46
39. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan C dan A ... 46
41. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan C dan B ... 47 42. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan C dan D ... 47 43. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan C dan D ... 47 44. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan D dan B ... 47 45. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan D dan B ... 48 46. Perhitungan Uji t Titer Antibodi pada Larva antara Perlakuan D dan C ... 48 47. Hasil Analisis Uji t Titer Antibodi pada Larva antara Perlakuan D dan C ... 48 48. Ringkasan Hasil Analisis Uji t pada Titer Antibodi Induk dan Larva ... 48 49. Perhitugan Uji Normalitas Lilifore pada Kelangsungan Hidup Larva
setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 50 50. Perhitugan Uji Homogenitas Bartlett pada Kelangsungan Hidup Larva
setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 51 51. Hasil Analisis Uji Homogenitas Bartlett pada Kelangsungan Hidup Larva
setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 52 52. Hasil Pengamatan Kelangsungan Hidup Larva setelah Diuji Tantang
pada Hari Ke-5 Pasca Menetas ... 52 53. Sidik Ragam Kelangsungan Hidup Larva setelah Diuji Tantang pada Hari
Ke-5 Pasca Menetas ... 52 54. Perhitungan Uji Beda Nyata Terkecil (BNT) pada Kelangsungan Hidup
Larva setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 53 55. Hasil Analisis Uji Beda Nyata Terkecil (BNT) pada Kelangsungan
Hidup Larva setelah Diuji Tantan pada Hari Ke-5 Pasca Menetas ... 53 56. Perhitugan Uji Normalitas Lilifore pada Kelangsungan Hidup Larva
setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 55 57. Perhitugan Uji Homogenitas Bartlett pada Kelangsungan Hidup Larva
setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 55 58. Hasil Analisis Uji Homogenitas Bartlett pada Kelangsungan Hidup Larva
setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 56 59. Hasil Pengamatan Kelangsungan Hidup Larva setelah Diuji Tantang
pada Hari Ke-13 Pasca Menetas ... 56 60. Sidik Ragam Kelangsungan Hidup Larva setelah Diuji Tantang pada Hari
Ke-13 Pasca Menetas ... 56 61. Perhitugan Uji Normalitas Lilifore pada Kelangsungan Hidup Relatif
Larva setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 58 62. Perhitugan Uji Homogenitas Bartlett pada Kelangsungan Hidup Relatif
Larva setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 59 63. Hasil Analisis Uji Homogenitas Bartlett pada Kelangsungan Hidup
Relatif Larva setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 59 64. Hasil Pengamatan Kelangsungan Hidup Relatif Larva setelah Diuji
Tantang pada Hari Ke-5 Pasca Menetas ... 60 65. Sidik Ragam Kelangsungan Hidup Relatif Larva setelah Diuji Tantang
pada Hari Ke-5 Pasca Menetas ... 60 66. Perhitugan Uji Normalitas Lilifore pada Kelangsungan Hidup Relatif
Larva setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 62 67. Perhitugan Uji Homogenitas Bartlett pada Kelangsungan Hidup Relatif
Larva setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 63
68. Hasil Analisis Uji Homogenitas Bartlett pada Kelangsungan Hidup Relatif Larva setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 63 69. Hasil Pengamatan Kelangsungan Hidup Relatif Larva setelah Diuji
Tantang pada Hari Ke-13 Pasca Menetas ... 64 70. Sidik Ragam Kelangsungan Hidup Relatif Larva setelah Diuji Tantang
pada Hari Ke-13 Pasca Menetas ... 64
DAFTAR LAMPIRAN
Lampiran Halaman
1. Roadmap Penelitian ... 28
2. Prosedur Pembuatan Vaksin inaktif Aeromonas salmonicida menggunakan formalin 1,5% ... 29
3. Prosedur Vaksinasi Induk Ikan Mas (Cyprinus carpio) ... 33
4. Prosedur Uji Titer Antibodi Pada Induk dan Larva ... 34
5. Prosedur Uji Tantang ... 37
6. Gejala Klinis Larva Ikan Mas (C. carpio) yang Diuji Tantang dengan Bakteri A. salmonicida ... 39
7. Analisis Statistik Hasil Uji Titer Antibodi Induk ... 40
8. Analisis Statistik Hasil Uji Titer Antibodi Larva ... 45
9. Analisis Statistika Kelangsungan Hidup Larva setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 49
10. Analisis Statistika Kelangsungan Hidup Larva setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 54
11. Analisis Statistika Kelangsungan Hidup Relatif Larva setelah Diuji Tantang pada Hari Ke-5 Pasca Menetas ... 57
12. Analisis Statistika Kelangsungan Hidup Relatif Larva setelah Diuji Tantang pada Hari Ke-13 Pasca Menetas ... 61
1 I. PENDAHULUAN
1.1 Latar Belakang
Penyakit infeksi pada ikan mas mulai mewabah tahun 2001 di Jawa Barat yang disebabkan oleh bakteri Aeromonas sp. seperti Aeromonas salmonicida.
Bakteri ini merupakan penyebab penyakit infeksi pada ikan-ikan salmonid yaitu penyakit furunculosis yang ditandai dengan munculnya hemoragi, luka berbentuk cekungan, mata menonjol dan warna tubuh menjadi gelap (Bernoth et al., 1997), namun laporan lain menunjukkan bahwa terdapat gejala infeksi bakteri A. salmonicida pada ikan–ikan cyprinid, yaitu penyakit carperytrodermatitis
(Irianto, 2005). Ikan yang terserang penyakit ini akan mengalami pendarahan pada bagian tubuh seperti dada, perut dan pangkal sirip, serta dapat menular dan dapat menyebabkan kematian pada ikan budidaya (Austin et al., 2007).
Penggunaan obat-obatan yang kadang tidak sesuai dengan dosis dapat menyebabkan dampak negatif seperti timbulnya resistensi pada bakteri, adanya residu dalam tubuh ikan, menyebabkan pencemaran, bahkan dapat menyebabkan penolakan ekspor oleh negara lain. Salah satu upaya pencegahan yang dapat dilakukan yaitu dengan pemberian vaksin (vaksinasi) (Astuti, 2015).
Vaksin adalah satu antigen yang biasanya berasal dari suatu jasad patogen yang telah dilemahkan atau dimatikan untuk meningkatkan ketahanan (kekebalan) ikan atau menimbulkan kekebalan aktif terhadap suatu penyakit tertentu. Vaksinasi merupakan proses pemberian vaksin ke dalam tubuh hewan (termasuk ikan) agar memiliki ketahanan terhadap serangan penyakit. Salah satu tujuan vaksinasi adalah untuk meningkatkan antibodi spesifik. Peningkatan antibodi tidak saja akan meningkatkan kemampuan pertahanan humoral tetapi juga pertahanan seluler. Respon humoral merupakan respon yang bersifat spesifik dilakukan oleh suatu substansi yang dikenal sebagai antibodi atau imunoglobulin, sedangkan respon seluler ikan bersifat non spesifik dilakukan oleh cell mediated immunity (Alifuddin, 2002; Soeripto, 2002).
Vaksin dapat diberikan sejak dini yaitu pada umur ikan minimal 3 minggu setelah menetas. (Tatang, 2014) menyatakan bahwa karena pada umur kurang dari
2 3 minggu, organ-organ yang berperan dalam sistem pembentukan antibodi belum sempurna. Organ-organ yang terlibat dalam sistem kekebalan tubuh ikan meliputi
reticulo endothelial (ginjal bagian depan, thymus, limfa, dan hati), limfosit, plasmosit dan fraksi serum protein tertentu. Dengan demikian bakteri patogen dapat menginfeksi ikan pada stadia larva.
Infeksi pada larva dapat dicegah melalui pemberian vaksin inaktif Whole cell A. salmonicida ke indukan yang siap memijah. Mor & Avtalion (1990) menyatakan bahwa pada golongan tilapia aktivitas antibodi yang terdapat pada embrio sama dengan induknya, sehingga dapat diasumsikan bahwa terdapat imunitas bawaan dari induk ke larva yang dihasilkan. Pernyataan tersebut sesuai dengan Davis et al., (2007) yang menyatakan bahwa vaksin yang disuntikkan ke indukan akan masuk ke dalam tubuh melalui darah dan ditransfer ke hati yang merupakan organ penting dalam pembentukan bakal kuning telur lalu terbawa ke dalam oosit dan terjadi proses vitelogenesis (pembentukan kuning telur). Penelitian sebelumnya membuktikan bahwa pemberian vaksin pada indukan dapat meningkatkan ketahanan tubuh benih ikan yang ditetaskan dengan SR mencapai 83% (Nur et al., 2004; Nur et al., 2006; Hadie et al., 2010)
1.2 Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengetahui pengaruh pemberian vaksin inaktif whole cell A. salmonicida
pada induk ikan mas (Cyprinus carpio) dengan dosis yang berbeda terhadap pembentukan titer antibodi pada induk dan larva.
2. Mengetahui pengaruh pemberian vaksin inaktif whole cellA. salmonicida
pada induk ikan mas (Cyprinus carpio) dengan dosis yang berbeda terhadap Survival rate (SR) dan Relative percent survival (RPS) larva dari hasil indukan yang divaksinasi
1.3 Manfaat Penelitian
Manfaat penelitian ini adalah sebagai langkah awal dalam pengembangan vaksin A. salmonicida serta diharapkan dapat memberi tambahan informasi ilmiah
3 kepada pembudidaya ikan, serta pihak-pihak yang memerlukan tentang vaksinasi ikan, khususnya pada ikan mas terhadap infeksi A. salmonicida.
1.4 Kerangka Pemikiran
Penyakit bakterial yang disebabkan oleh A. salmonicida masih menjadi masalah bagi pembudidaya ikan mas. Penyakit ini dapat menular bahkan menyebabkan kematian pada ikan budidaya, terutama golongan cyprinid (Irianto, 2005; Austin et al., 2007). Tatang (2014) menyatakan bahwa, pada umur kurang dari 3 minggu, organ-organ yang berperan dalam sistem pembentukan antibodi belum sempurna, sehingga patogen dengan mudah dapat menginfeksi benih ikan mas.
Penggunaan obat-obatan saat ini sebagai metode pengobatan juga sudah tidak dianjurkan karena menyebabkan dampak negatif seperti timbulnya resistensi pada bakteri, adanya residu dalam tubuh ikan, menyebabkan pencemaran, bahkan dapat menyebabkan penolakan ekspor oleh negara lain. Salah satu upaya pencegahan yang dapat dilakukan yaitu dengan pemberian vaksin (vaksinasi) (Astuti, 2015).
Aplikasi pemberian vaksin inaktif whole cell A. salmonicida pada indukan ikan mas yang sudah matang gonad pada tahap oosit primer dilakukan dalam penelitian ini sebagai bentuk pencegahan awal agar larva memiliki kekebalan spesifik bawaan dari induk yang divaksinasi (Gambar 1). Hal ini sesuai dengan pendapat (Davis et al., 2007; Mor & Avtalion, 1990).
Respon imun spesifik dapat dilihat pada uji titer antibodi induk maupun larva. Apabila terdapat reaksi antara antigen A. salmonicida dan antibodi (reaksi aglutinasi) pada uji titer antibodi induk maka dapat dipastikan larva yang dihasilkan juga memiliki imunitas spesifik sama dengan induknya. Respon lainnya dapat diamati dari tingkat kelangsungan hidup dan tingkat kelangsungan hidup relatif. Reaksi hasil uji dapat dilihat setelah uji tantang larva dengan bakteri
A. salmonicida. Gudkovs (1988) menjelaskan bahwa, tingkat kelangsungan hidup (SR) rata-rata ikan yang baik berkisar 73,50 - 86,60 %. Sedangkan untuk RPS yaitu > 60%.
4 1.5 Hipotesis
Adapun hipotesis dari penelitian ini adalah : Uji Titer Antibodi Induk dan Larva
H0 :µ1=µ2 Tidak ada perbedaan pengaruh pemberian dosis vaksin inaktif
whole cellA. Salmonicida yang berbeda pada induk ikan mas (C. carpio) terhadap titer antibody pada induk dan larva.
H1 :µ1 ≠ µ2 Sedikitnya ada satu perlakuan pemberian dosis vaksin inaktif whole
cell A. salmonicida yang berbeda pada induk ikan mas (C. carpio) yang berpengaruh terhadap peningkatan titer antibodi induk dan larva
Uji Tantang Larva
H0 : Tidak ada perbedaan pengaruh pemberian dosis vaksin inaktif whole cell A. salmonicida yang berbeda pada induk ikan mas (C. carpio) terhadap SR dan RPS larva.
Pemberian vaksin inaktif A.salmonicida pada indukan ikan mas yang siap memijah
Penurunan sifat kekebalan tubuh pada larva ikan mas
Penyakit bakterial A. salmonicida sering menyerang larva ikan mas
Peningkatan respon imun spesifik, SR dan RPS larva ikan mas Gambar 1. Kerangka Pemikiran
5 H1 : Ada pengaruh setidaknya satu pemberian dosis vaksin inaktif whole
cell A. salmonicida pada induk ikan mas (C. carpio) terhadap SR dan RPS larva.
6 II. METODE PENELITIAN
2.1 Tempat dan Waktu Penelitian
Penelitian telah dilaksanakan pada bulan Juli - Agustus 2016 bertempat di Balai Benih Ikan Sentra (BBIS) Purbolinggo Lampung Timur sebagai lokasi pemeliharaan induk, kegiatan vaksinasi, uji titer antibodi dan uji tantang larva.
Pembuatan vaksin dilakukan di Laboratorium Budidaya Perikanan, Jurusan Perikanan dan Kelautan, Program Studi Budidaya Perairan, Fakultas Pertanian Universitas Lampung. Alur kegiatan penelitian secara lengkap dapat dilihat pada Lampiran 1.
2.2 Alat dan Bahan Penelitian
Alat dan bahan yang digunakan untuk mendukung penelitian ini,disajikan pada (Tabel 1 dan Tabel 2):
Tabel 1.Alat Penelitian
No Alat Spesifikasi Alat Kuantitas
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 21 22 23 24 25 26 27 28 29 30 Kolam induk Kolam pemijahan Aquarium larva Petridish Tabung reaksi Erlenmeyer Bunsen Autoklaf Hot strirer plate Alumunium foil Timbangan digital Inkubator Refrigerator LaminarAir flow Bak Aerator Sentrifuge Jarum ose Spectofotometer Kakaban Spuit Microdulution Plate 96 Kertas saring Tabung eppendorf Mikropipet pH meter DO meter Termometer
- Induk betina: 1x1 mdengan hapa - Induk jantan: kolam besar.
1x1 m 60cm x 80cm x 40cm Diameter:120mm Tinggi : 20mm 10ml 250ml Spirtus WISERCLAVE STUART Klin Pak 8m x 45m EP 1200C MEMMERT FOC 2151 NUAIRE, Series 11 30 L
Air pump kit aRotina35 - Spectronik-20 Tali rapiah 26 G 1 ml IWAKI 50cm - SOCOREX - - - 12 2 12 12 10 10 3 2 1 1 2 1 1 1 1 4 4 1 2 1 12 30 4 1 30 1 1 1 1
7 Tabel 2. Bahan Penelitian
No Bahan Spesifikasi Bahan Kuantitas
1 2 3 4 5 7 8 9 10 11 12 13 14 15 16 17
Induk Ikan Mas betina
Induk ikan mas jantan
Formalin
Media TSA (trypcase soy
agar)
Media TSB (tryptone soya
borth) Aquades
Larutan PBS (phosphate
buffer saline)
Isolat Aeromonas salmonicida
Minyak cengkeh
Artemia sp Pellet Tissue Karet
Plastik tahan panas Kertas buram PBSTween
** bobot induk 1100gr, panjang tubuh ±30cm berumur ±18 bulan
** bobot induk 1000gr, panjang tubuh ±22cm berumur ±18 bulan)
15% Merck Merck - - * Sumber herbal INT
- 7.8.2 Passeo - Plastic 20cm x 15cm - 0,13 ml tween dalam 250 PBS 12 ekor 12 ekor 1 liter 10 cawan 10 tabung 7 liter 2 liter 1 isolat - 40 gram 25 kg 3 gulung 200 gram 1 pak 1 pak (60 lembar) 20 ml
* Stasiun Karantina Ikan Pengendalian Mutu Dan Keamanan Hasil Perikanan Kelas I Lampung ** Balai Benih Ikan Sentra (BBIS) Purbolinggo
2.3 Rancangan Penelitian 2.3.1 Persiapan Penelitian a. Persiapan Alat dan Bahan
Peralatan laboratorium yang digunakan dalam penelitian ini adalah cawan petri, erlenmeyer, tabung reaksi, microtube, aquades, yang telah disterilisasi dengan cara disusun rapi di dalam autoklaf dan disterilisasi pada suhu 121 ºC selama 15 menit. Persiapan alat dan bahan lainnya berupa persiapan wadah pemeliharaan induk dan larva. Wadah pemeliharaan induk betina berupa kolam dengan ukuran 1x1 m sebanyak 12 kolam (4 perlakuan dan 3 ulangan). Proses persiapan wadah terdiri dari pengeringan kolam, pemasangan hapa dan pengisian air ± 60 cm. Wadah pemeliharaan larva yang baru menetas berupa akuarium berukuran 80x40x60 cm. Proses persiapan wadah terdiri dari pencucian akuarium, pengeringan, dan pengisian air setinggi ¾ dari total tinggi akuarium. Alat dan bahan yang digunakan dalam penelitian secara lengkap dapat dilihat pada Lampiran 13.
8 b. Persiapan Induk
Induk yang digunakan adalah indukan ikan mas, sebanyak 12 pasang. Ciri-ciri induk yang digunakan sesuai dengan (Suseno, 1996) untuk induk betina yang digunakan adalah indukan yang sudah tahap matang gonad oosit primer ditandai dengan perutnya akan mengeluarkan cairan kuning seperti feses saat diurut. Indukan betina memiliki bobot ± 1100 g, panjang tubuh ± 30 cm, dan berumur ± 18 bulan. Induk jantan yang digunakan adalah indukan yang sudah matang gonad, diitandai dengan sudah keluarnya sperma pada saat perut diurut. Induk jantan yang dipakai yaitu memiliki bobot ± 1000 g, dan panjang badan ± 22 cm dan berumur ± 18 bulan.
c. Persiapan Media Kultur dan Vaksin
Media kultur bakteri yang digunakan dalam penelitian ini yaitu media TSA (Trycase soy agar) dan media TSB (Tryptone soya borth)
.
Media ditimbang sesuai takaran pada kemasan lalu dimasukan ke dalam labu erlenmeyer, ditambahkan aquades ke dalam erlenmeyer. Kemudian dihomogenisasi menggunakan hot stirrer plate. Media yang telah homogen disterilisasi di dalam autoklaf suhu 121 ºC selama 15 menit. Media TSB dituang ke dalam tabung reaksi sebelum sterilisasi, sedangkan media TSA dituangkan ke dalam cawan petri setelah sterilisasi. Proses penuangan dilakukan secara aseptis. Media disimpan dalam refrigerator atau inkubator sampai saat digunakan.Metode pembuatan vaksin inaktif whole cell A. salmonicida mengacu pada Setyawan et al., (2012) menggunakan isolat murni A. salmonicida yang diinaktif dengan formalin 1,5 %. Bakteri yang inaktif selanjutnya diuji Viabilitas untuk mengetahui kelayakan vaksin, dengan mengkultur kembali bakteri inaktif pada media TSA. Vaksin dikatakan layak ditandai dengan tidak adanya bakteri yang tumbuh saat dikultur pada media TSA. Langkah-langkah pembuatan vaksin secara lengkap dapat dilihat pada Lampiran 2.
9 2.3.2 Pelaksanaan Penelitian
a. Vaksinasi Induk
Induk dianestesi menggunakan minyak cengkeh (0,3 ml/l) sebelum vaksin diberikan (Hadie et al., 2010). Indukan divaksinasi dengan cara disuntik dibagian
Intra muscullar (IM) (Anderson, 1974) menggunakan vaksin inaktif whole cell A. salmonicida dengan kepadatan 107 CFU/ml (Setyawan et al., 2012). Pemberian vaksin diberikan sebanyak 2 kali, vaksinasi pertama dilakukan untuk membantu limfosit B dalam mengenal antigen (Tatang, 2014), dan pemberian vaksin yang kedua sebagai booster untuk meningkatkan limfosit B dalam pengenalaan terhadap antigen (Kamiso, 1999; Nur et al., 2004). Indukan yang divaksinasi diberi makan dengan FR 2%, untuk menekan perkembangan gonad (Bachtiar, 2002) (Lampiran 3).
b. Pemijahan dan Penetasan Telur
Indukan jantan dan betina diletakan ke dalam satu kolam yang telah berisi kakaban. Indukan tidak diberi makan selama pemijahan. Indukan dibiarkan sampai telur yang dibuahi menempel pada subtrat. Proses pemijahan berlangsung selama satu malam setelah indukan disatukan.
Telur yang berada pada subtrat dipindah ke wadah pemeliharaan larva. Penetasan telur mengacu pada Susanto (2007). Pakan yang diberikan yaitu berupa pakan alami Artemia sp., Daphnia sp, dan cacing sutra secara adlibitum.
c. Pengukuran Titer Antibodi
Pengukuran titer antibodi terdiri dari 2 pengukuran, yaitu titer antibodi pada indukan dan juga pada larva. Persiapan serum merupakan langkah awal dari proses pengukuran titer antibodi. Serum induk disiapkan dengan cara, indukan dianestesi menggunakan minyak cengkeh 0,3 ml/l. Darah diambil dengan menggunakan spuit 1 ml 26G pada vena caudal tidak terlalu dalam dengan sudut kemiringan ± 45º. Darah disentrifuge dengan 3500 rpm (selama 15 menit). Lapisan ke-2 diambil sebagai serum (Wintoko et al., 2012).
Serum larva disiapkan dengan larva berumur 10 hari pasca penetasan diambil masing-masing 30 ekor/perlakuan. Larva dicuci dengan akuades secara terpisah, dan dikeringkan dengan kertas saring. Larva dihomogenkan (dilarutkan) dalam
10 larutan PBStween (0,13 ml Tween dalam 250 PBS) dengan cara digerus dengan perbandingan 1:4 (v/v). Hasil gerusan disentrifuge 6000 rpm selama 15 menit. Hasil sentrifuge menghasilkan 3 lapisan ; lemak, koloid+PBS, pellet (jaringan ikan). Supernatan pada lapisan ke-2 (Koloid+PBS) diambil sebagai serum (Roberson, 1990; Nur et al., 2004). Proses titer antibodi secara lengkap dapat dilihat pada Lampiran 4.
d. Uji Tantang
Larva diuji tantang pada umur 5 hari pasca penetasan dan umur 13 hari pasca penetesan. Metode yang digunakan dalam uji tantang ini adalah dengan perendaman. Bakteri aktif A. salmonicida disiapkan pada wadah uji dengan kepadatan 107 CFU/ml. Larva diambil 10% dari total populasi larva pada akuarium penetasan, dan dipindah kan ke wadah uji untuk diuji tantang. Larva direndam selama 30 menit. Larva dikembalikan lagi ke akuarium dan dipelihara selama 7 hari. Kegiatan dilakukan selama pemeliharan pasca uji tantang adalah menghitung SR dan RPS nya selain itu diamati perubahan abnormal yang terjadi. Proses uji tantang secara lengkap dapat dilihat pada Lampiran 5.
2.3.3 Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) yang terdiri dari 4 perlakuan pemberian dosis vaksin yang berbeda (3 perlakuan dengan vaksinasi dan 1 perlakuan sebagai kontrol). Pada setiap perlakuan diulang sebanyak 3 kali, dengan kepadatan vaksin 107 CFU/ml. Penelitian ini memodifikasi, Nur et al., (2004); Nur et al., (2006); Hadie et al., (2010), sebagai berikut :
1. Perlakuan A : Kontrol (tanpa pemberian vaksin pada induk betina ikan mas).
2. Perlakuan B : Pemberian vaksin induk betina ikan mas dengan dosis 0,3 ml/kg ikan.
3. Perlakuan C : Pemberian vaksin induk betina ikan mas dengan dosis 0,4 ml/kg ikan.
11 4. Perlakuan D : Pemberian vaksin induk betina ikan mas dengan dosis 0,5
ml/kg ikan.
Model Rancangan Acak Lengkap dengan uji ANOVA yang digunakan adalah sebagai berikut:
Yij = μ + τi + ɛij
Keterangan:
i : Perlakuan A, B, C, dan D j : Ulangan 1, 2, 3
Yij : Nilai pengamatan dari pengaruh pemberian dosis vaksinasi induk ikan mas yang berbeda ke-i terhadap SR dan RPS pada larva ikan mas kelompok ke-j µ : Nilai Tengah umum
i : Pengaruh pemberian dosis vaksinasi induk ikan mas ke-i terhadap SR dan RPS larva
ɛij : Pengaruh acak dari galat perlakuan ke-i dan ulangan ke-j
Tata letak rancangan penelitian disusun secara acak dengan semua perlakuan mendapatkan peluang yang sama. Wadah pemeliharaan indukan disusun secara acak di dalam kolam besar disekat dengan happa (Gambar 2), dan wadah pemeliharaan larva menggunakan akuarium disusun seperti pada Gambar 3.
Gambar 2. Tata Letak Kolam Pemeliharaan Induk
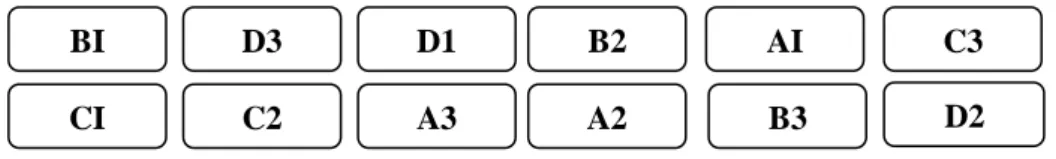
B2 A3 C2 D1 C3 A2 B3 B1 D3 C1 D2 A1
12
Gambar 3. Tata Letak Pemeliharaan Larva Keterangan : “A, B, C, D (Perlakuan)” “1,2,3 (Ulangan)”
2.3.4 Parameter yang Diamati
Parameter yang diamati pada penelitian ini terdiri dari parameter utama dan pendukung. Parameter utama terdiri dari dua parameter yaitu uji titer antibodi dan uji tantang. Sedangkan parameter pendukungnya adalah kualitas air.
Parameter uji titer antibodi dilihat berdasarkan ada tidaknya reaksi aglutinasi, yang ditandai dengan menyebarnya titik didasar sumuran, diberi keterangan (+), sedangkan apabila tidak ada aglutinasi ditandai dengan berpusatnya titik di dasar sumuran, diberi keterangan (-) (Hadie et al., 2010) .
Parameter uji tantang, dilihat berdasarkan tingkat kelangsungan hidup (SR) dan tingkat kelangsungan hidup (RPS). Dihitung menggunakan rumus menurut Effendi et al., (2006):
a. SR = Nt = Jumlah ikan yang hidup pada awal pengujian. N0 = Jumlah ikan yang hidup pada akhir pengujian.
b. RPS = ( ) Mv = Mortalitas larva denganperlakuan (%)
Mc = Mortalitas larva tanpa perlakuan (kontrol) (%)
Parameter uji tantang yang lain adalah gejala klinis yang disebabkan akbibat uji tantang. Hal ini dilakukan agar memastikan larva yang mati benar disebabkan oleh bakteri A. salmonicida.
Hasil yang baik menunjukan jika, nilai tingkat kelangsungan hidup (SR) ikan rata-rata yang berkisar 73,50 - 86,60 % (Gudkovs, 1988), sedangkan untuk RPS > 60% (Nur et al., 2004). BI A2 A3 C2 CI D3 D1 B2 AI B3 D2 C3
13 Pengukuran pendukung berupa kualitas air yang diukur yaitu, suhu, pH, dan DO. Kualitas air yang baik untuk pemeliharaan induk dan larva ditandai dengan nilai baku mutu, suhu (25 – 30 ºC) (Suseno, 1996), pH (6,5 - 9) (Afriyanto et al.,
1992), dan DO (>3 ppm) (Cholik et al., 1986). 2.3.5 Analisis Data
Data hasil uji titer antibodi dan uji tantang, dianalisis secara statistik. Analisis data untuk uji titer antibodi menggunakan uji dua perbandingan (uji t). Analisis data untuk SR dan RPS menggunakan ANOVA dengan tingkat kepercayaan 95%. Transformasi data menggunakan arcsin √ (Mattjik & Made, 2000), pengujian normalitas data menggunakan metode lilifore, dan homogenitas menggunakan Bartlet, untuk uji lanjut menggunakan BNT (Beda Nyata Terkecil) (Nazir, 2005).
24 IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Kesimpulan dari hasil penelitian ini adalah, pemberian vaksin inaktif A. salmonicida pada indukan dengan dosis yang berbeda, berpengaruh terhadap titer antibodi induk maupun larva, dengan hasil terbaik secara kualitatif ditunjukan oleh dosis vaksin induk 0,3 ml/kg ikan pada indukan, dan pemberian vaksin induk 0,4 ml/kg ikan terhadap titer antibodi larva sedangkan pemberian vaksin induk 0,5 ml/kg ikan tidak memberikan pengaruh terhadap titer antibodi induk dan larva.
Pemberian vaksin inaktif A. salmonicida pada indukan dengan dosis yang berbeda, berpengaruh terhadap tingkat kelangsungan hidup larva dengan hasil tertinggi diperoleh dari larva hasil induk yang divaksinasi dengan dosis 0,4 ml/kg ikan dengan SR 96,11% dan RPS 81,25%.
Dengan ini pemberian vaksin yang efektif pada indukan ikan mas, dapat diberikan dengan kisaran dosis vaksin 0,3 – 0,4 ml/kg ikan.
4.2 Saran
Saran yang dapat diberikan berdasarkan penelitian yang telah dilakukan, perlu dilakukannya penelitian lebih lanjut untuk mengetahui bagaimana kerja antibodi terbentuk saat vaksin masuk ke dalam tubuh induk maupun larva untuk melihat respon imun spesifik secara keseluruhan.
25 DAFTAR PUSTAKA
Afriyanto, E. & E. Liviawaty. 1992. Pengendalian Hama dan penyakit.
Yogyakarta: Kanisius.
Alifuddin, M. 2002. Imunostimulasi pada Hewan Akuatik. Jurnal Akuakultur Indonesia , 1(2): 87-92.
Anderson, D. P. 1974. Immunology of Fish Disease: Disease of Fish. Sniesko JF, Axelrod HR (eds) Book 4. New York: TFH publ. Neptune.
Astuti, S. P. 2015. Aplikasi Vaksin. Balai Pengembangan Teknologi Perikanan dan Kelautan. Jakarta: Laboratorium Kesehatan Ikan dan Lingkungan. Austin, A. & D. A. Austin. 2007. Bacterial Fish pathogen, Disease of Farm and
Wild Fish Fourt Edition. UK: Spinger-Praxis Publising.
Bachtiar, Y. 2002. Pembesaran Ikan di dalam Kolam Pekarangan. Jakarta: Agro Media Pustaka.
Bernoth, M. E, A. E. Ellis, P. J. Midtlyn., O. Giller, & P, Smith. 1997.
Furunculosis Mutidisciplinary Fish Disease Research. San Diego: Academic Press.
Bly, J. E, A. S. Grimm, & I. G. Morris. 1986. Transfer of Passive Immunity from Mother to Young in A Teleost Fish: Haemagglutinating Activity in the Serum and Eggs of Plaice, Pleuronectes platessa L. Comparative Biochemistry and Physiology Part A (84): 309-313.
Buller, N. B. 2004. Bacteria from Fish and Other Aquatic Animals: A paractical Identification Manual. Western Australia: CABI Publishing.
Cahyono, B. 2000. Budidaya Air Tawar. Yogyakarta: Kanisius.
Castro, R, D. Bernard, M. P. Lefranc, A. Six, A. Benmansour, P. Boudinot. 2011. T Cell Diversity in Teleost Fish. Fish & Sellfish Immunology, (31): 644-654. Cholik, F, Artanty, & Arifudin. 1986. Pengelolahan Kualitas Air Kolam. Jakarta:
Direktorat Jendral Perikanan.
Davis, K. L, N. Hiramatsu, K. Hiramatsu, B. J. Reading, T. Matsubara, & A. Hara, 2007. Induction of Three Vitellogenins by 17Beta-Estradiol with Concurrent Inhibition of the Growth Hormone-Insulin-Like Growth Factor
26 1 Axis in a Euryhaline Teleost, the Tilapia (Oroechomis mossambicus).
Biology of Reproduction (77): 614-625.
Effendi, I, N. J. Bugri, Wirdani. 2006. Pengaruh pada Penebaran terhadap Kelangsungan Hidup dan Pertumbuhan Benih Ikan Gurami Osphronemus guramy Ukuran 2 cm. Jurnal Akuakultur Indonesia, 5 (2): 127-135.
Fujaya, Y. 1999. Bahan Pengajaran Fisiologis Ikan. Ujung Pandang: Universitas Hasanudin.
Ghenghesh, S. K., F. Ahmed, A. El- Khalek, A. Al - Gendy, & J. Klena. 2008. Aeromonas - Associated Infections in Developing Countries. J. Infect Developing Countries , 81-98.
Gudkovs, N. 1988. Fish Immunology. Fish Disease Veterinarians , 531-544. Hadie, W., L. M. Angela, Sularto, & T. Evi. 2010. Imunitas Maternal Terhadap
Aeromonas hidrophila: Pengaruhnya Terhadap Fekunditas dan Daya Tetas Ikan Patin Siam (Pangasionodon hypothalamus). Jurnal Ris. Akuakultur , 5 (2): 229-235.
Irianto, A. 2005. Patologi Ikan Teleostei. Yogyakarta: Universitas Gajah Mada. Kamiso. 1999. Vaksinasi Induk Untuk Meningkatkan Bibit Lele Dumbo (Clarias
garepinus) Terhadap Serangan Aeromonas hydrophila. Jakarta: P4M Dirjen Dikti.
Matjjik, A. A, M. Sumertajaya. 2000. Perancangan Percobaan. Bogor: IPB Press. Mor, A, & R. R. Avtalion. 1990. Transfer of Antibody Activity from Immunized
Mother to Embryo in Tilapias. Journal Fish Biology (37): 249-255. Nakanishi, T, S. Yasuhiro, M. Yuta. 2015. T Cell in Fish. Biology, (4): 640-663. Nazir, M. 2005. Metode Penelitian. Jakarta: Ghalia indonesia.
Nur, Sukenda, & D. Dana. 2004. Ketahanan Benih Ikan Nila Gift (Oreochromis niloticus Linn) dari Hasil Induk yang Diberi Vaksin Terhadap Infeksi Buatan Streptococus iniae. Jurnal Akuakultur Indonesia , 3(1): 37-43. Nur, I. 2006. Respon Humoral Ikan Nila (Oreochromis niloticus Linne) yang
Divakasinasi dengan Konsentrasi Bakterin Aeromonas hydrophila yang Berbeda. WARTA-WIPTEK , 14(2): 60-66.
27 Nur, I, Halipa, & Yusnaini. 2006. Peningkatan Imunitas Benih Ikan Nila
(Oreochromis niloticus) Melalui Vaksinasi Induk. Warta-wiptek , 14(2): 60-66.
Olga, K. R. Rini, J. Akbar, A. Isnansetyo, & L. Sembiring. 2007. Protein
Aeromonas hydrophila Sebagai Vaksin untuk Pengendalian MAS (Motile Aeromonas Septicemia) pada Jambal Siam (Pangasius hypophthalamus).
Jurnal Perikanan , 9(1): 17-25.
Pasaribu, F. H., N. Dalimunthe. & M. Poeloengan. 1990. Pengobatan dan Pencegahan Penyakit Bercak Merah. Bogor: Balai Penelitian Perikanan Air Tawar.
Roberson, B. S. 1990. Bacterial Aglutination, In: Techniques in Fish Immunology 1st Ed. New York: SOS Publication, Fair Haven.
Sigel, M. M, J. C. Lee, E. C. McKinney, D. M. Lopez. 1978. Cellular Immunity in fish as Measured by Lympocyte Stimulation. Marine Fisheries Review. Miami: University of Miami School of Medicine
Setyawan, A., S. Hudaidah, Z. Z. Ranopati, & Sumino. 2012. Imunogenesitas Vaksin Inaktif Wholecell Aeromonas salmonicida pada Ikan Mas (Cyprinus carpio). Aquasains , 1: 17-21.
Soeripto. 2002. Pendekatan Konsep Kesehatan Hewan Melalui Vaksinasi. Jurnal Litbang Pertanian , 48-55.
Supriyadi, H. 2011. Sistem Pertahanan Tubuh pada Ikan. Balai Riset Perikanan Budidaya Air Tawar. Jakarta: Laboratorium Penyakit Ikan Pasar Minggu. Susanto. 2007. Pembenihan Ikan Mas. Yogyakarta: Kanisius.
Suseno, D. 1996. Pengelolahan Usaha Pembenihan Ikan Mas. Jakarta: Penebar Swadaya.
Tang, U. M. & R. Affandi. 2000. Biologi Reproduksi Ikan. Riau: UNRI PRESS. Tatang. 2014. Modul Praktek Vaksinasi Pada Ikan. Jakarta: Loka pemeriksaan
penyakit ikan dan lingkungan.
Wintoko, F., A. Setyawan, S. Hudaidah, & M. Ali. 2012. Imunogenitas Heat Killed Vaksin Inaktif Aeromonas hydrophila pada Ikan Mas (Cyprinus carpio). e-Jurnal Rekayasa Dan Teknologi Budidaya Perairan , 2(1): 205-210