(Activation and Fertilization of Rat Oocytes Injected with Isolated Sperm Head)
SYAHRUDDIN SAID1), TAKDIR SAILI2) DAN BAHARUDDIN TAPPA1)
1)Pusat Penelitian dan Pengembangan Bioteknologi-LIPI, Jalan Raya Bogor Km.46 Cibinong 16911 2) Fakultas Pertanian, Universitas Haluoleo, Kampus Tridharma Anduonuhu Kendari
Activation and fertilization of rat oocytes injected with different maturation stages of isolated sperm heads were observed. When injected oocytes were cultured for 4-6h, activation rates of injected oocytes was not different between oocytes injected with cauda epididymal spermatozoa (74.4%) and caput epididymal spermatozoa (83.3%). However, both of cauda and caput epididymal spermatozoa were significantly different (p<0.005) compared with testicular spermatozoa (38.0%). After 4-6h ICSI, normal fertilization rates (formation of 2 PN) of oocytes injected with cauda epididymal spermatozoa (27.6%) was lower (p<0.05) than caput epididymal spermatozoa (45.0%), but both of these spermatozoa were not different with oocytes injected with testicular spermatozoa (31.6). On the other hand, when injected oocytes were cultured for 9-11h, 82.1% of oocytes injected with cauda epididymal spermatozoa were activated. This result was not different when oocytes were injected with caput epididymal spermatozoa (73.8%), but significantly different (p<0.05) with testicular spermatozoa (55.4%). More over, normal fertilization of oocytes injected with cauda epididymal spermatozoa (81.3%) was not different with caput epididymal spermatozoa (67.7%), but significantly different (p<0.05) with testicular spermatozoa (58.1%). These results demonstrated that 1) all sperm heads (nuclei) isolated from different stages of spermatozoa maturation were capable to participate in normal fertilization, 2) intracytoplasmic sperm injection in the rat can be performed by using sperm head only.
Key words :maturation stages, epididymal and testicular spermatozoa, ICSI, sperm head.
PENDAHULUAN
Intracytoplasmic sperm injection atau lebih dikenal dengan istilah ICSI adalah suatu teknologi reproduksi bantuan (assisted reproductive technology, ART) yang memungkinkan kita dapat menyuntikkan/menginjeksikan spermatozoa tunggal ke dalam sitoplasma sel telur dengan bantuan alat mikromanipulator. Spermatozoa yang digunakan umumnya adalah spermatozoa testis atau hasil ejakulasi dari pria infertil. Proses ini diikuti oleh peristiwa fertilisasi antara spermatozoa dan sel telur. Hasil fertilisasi tersebut kemudian dibiakkan dan hasil biakan berupa embrio selanjutnya ditransfer ke resipien untuk menghasilkan anak. Keberhasilan pembuahan sel telur
dengan menginjeksi langsung hanya menggunakan kepala spermatozoa ke dalam sitoplasma oosit telah dilaporkan pada berbagai hewan percobaan seperti mencit, sapi, kelinci, dan manusia (Keefer 1989; Bourne et al. 1995; Mansour et al. 1995; Kuretake et al. 1996). Sedangkan laporan tentang ICSI yang dilakukan pada tikus dengan hanya menggunakan kepala spermatozoa masih sedikit. Besarnya ukuran kepala spermatozoa tikus merupakan faktor pembatas keberhasilan ICSI pada tikus (Thadani 1980). Dozortsev et al. (1998) melaporkan bahwa tingkat ketahanan hidup sel telur setelah ICSI sangat rendah pada tikus baik menggunakan jarum tajam yang runcing maupun yang tumpul. Hal ini disebabkan karena ukuran kepala spermatozoa tikus relatif besar sehingga jarum injeksi yang digunakan harus berdiameter besar pula. Kondisi ini pada akhirnya akan memperbesar peluang rusaknya sitoplasma sel telur karena ukurannya relatif lebih kecil dibandingkan dengan sel telur hewan mamalia lainnya.
Pada makalah ini dikemukakan hasil penelitian tentang persentase kejadian sel telur teraktivasi dan pembentukan pronukleus jantan dan betina sebagai indikator keberhasilan pembuahan setelah ICSI. Selain itu juga dikemukakan keberhasilan fertilisasi setelah ICSI menggunakan spermatozoa dengan berbagai tahap kematangan (spermatozoa dari kauda dan kaput epididimis serta spermatozoa testis).
BAHAN DAN METODE
Koleksi Sel Telur. Tikus Wistar betina (umur 8-12 minggu) disuperovulasi dengan menyuntikkan secara intra-peritoneal 25-30 IU Pregnant Mare Serum Gonadotropin (PMSG, serotropin, Teizo, Japan), diikuti dengan penyuntikan 25-30 IU human Chorionic Gonadotropin (hCG, puberogen, Sakyo, Japan) 48 jam kemudian. Sel telur dikoleksi dari oviduk antara 15-16 jam setelah penyuntikan hCG.. Pemisahan sel telur dari sel kumulus dilakukan dengan menggunakan Bovine Testicular Hyaluronidase (Sigma) 0.1% dalam Hepes-modified Rat 1-cell Embryo Culture Medium (Hepes-mR1ECM, Miyoshi et al. 1997). Sel telur yang dikoleksi disimpan dalam mR1ECM pada suhu 37°C sambil menunggu persiapan mikromanipulator.
Koleksi Spermatozoa dan Isolasi Kepala Spermatozoa. Spermatozoa dikoleksi dari kauda dan kaput epididimis serta testis tikus Wistar jantan (umur 4-8 bulan) berdasarkan metode Said et al. (1999). Pemisahan kepala spermatozoa dengan ekor dilakukan dengan sonikasi pada suhu 0°C menggunakan Branson Sonifier 250 pada 30 duty cycle dan 4 out-control selama 10 detik. Larutan spermatozoa yang telah disonikasi diencerkan dengan Hepes-mR1ECM dan dicuci dengan cara sentrifugasi pada 1000 g selama 3 menit. Endapan spermatozoa selanjutnya dipindahkan ke Hepes-mR1ECM yang mengandung 5 µg/ml sitokalasin B (Sigma).
Injeksi Spermatozoa ke dalam Oosit. Injeksi kepala spermatozoa ke dalam sitoplasma sel telur dilakukan dengan menggunakan jarum mikro yang dihubungkan dengan manipulator piezo-injeksi (PMM-150FU, Prime Tech LTD, Jepang). Secara jelas, spermatozoa dan sel telur ditempatkan bersama dalam satu drop Hepes-mR1ECM (5 µl) yang mengandung 5 µg/ml sitokalasin B dan ditutup dengan minyak mineral. Kepala spermatozoa diaspirasi ke dalam jarum injeksi, selanjutnya ujung jarum disentuhkan ke zona pellucida sel telur dengan posisi badan kutub pada jam 6 atau 12. Dengan cara menekan dan sedikit sentakan listrik dari alat piezo, zona akan terlubangi. Ujung jarum injeksi secara mekanik ditekan lebih dalam ke sel telur sehingga jarum akan menembus dinding plasma sel telur dengan memberikan sedikit sentakan listrik piezo. Kepala spermatozoa dikeluarkan dan masuk ke dalam sitoplasma sel telur bersama sedikit media manipulasi. Sel telur yang berhasil diinjeksi selanjutnya dicuci 4 kali dengan mR1ECM, kemudian dimasukkan ke dalam 100 µl media yang sama pada cawan biakan (35 x 10 mm; Falcon No. 1008), ditutup dengan minyak mineral dan dibiakkan di dalam inkubator CO2 (CO2 5% pada suhu 37°C). Sel telur teraktivasi dan bentuk kepala spermatozoa diamati menggunakan mikroskop fase kontras.
Pembuahan Sel Telur. Sel telur teraktivasi dan status inti kepala spermatozoa diamati masing-masing 4-6 jam dan 9-11 jam setelah ICSI dengan menempatkannya di atas slide glass, ditekan dengan kaca penutup dan difiksasi dengan glutaraldehida 2.5% Said et al. INTRACYTOPLASMIC SPERM INJECTION (ICSI) PADA TIKUS
dalam phosphate buffer saline (PBS) pH 7.4. Selanjutnya slide glass tersebut dicelup ke dalam formalin 10% selama 4-6 jam pada suhu ruangan. Setelah difiksasi, contoh didehidrasi menggunakan etanol 95%, diwarnai dengan lacmoid 0.25% dalam asam asetat 45%. Sitologi sel telur hasil ICSI secara terperinci diamati menggunakan mikroskop fase kontras pembesaran 400X (Nikon, optiphot, HFX-IIA, Jepang).
Rancangan Percobaan. Percobaan dilakukan dalam dua tahap yang berbeda berdasarkan periode kultur setelah ICSI dilakukan, masing-masing 4-6 jam dan 9-11 jam. Percobaan pertama terdiri atas tiga perlakuan dan enam ulangan, sedangkan percobaan kedua terdiri atas tiga perlakuan dan lima ulangan. Perlakuan yang digunakan dalam penelitian ini adalah sumber spermatozoa yang diinjeksi ke dalam sel telur yaitu spermatozoa kauda epididimis, kaput epididimis dan spermatozoa testis. Analisis Data. Data yang dikumpulkan selanjutnya dianalisis menggunakan sidik ragam dan uji Fisher dengan bantuan Program Statview (Abacus Concepts, Berkeley, CA). Perbedaan secara statistik ditentukan paling kurang p<0.05.
HASIL
Tabel 1 memperlihatkan bahwa setelah dibiakkan selama 4-6 jam, 74.4% sel telur yang diinjeksi dengan spermatozoa dari kauda epididimis dapat teraktivasi. Hasil ini tidak berbeda dengan hasil injeksi spermatozoa dari kaput epididimis (83.3%), tetapi keduanya lebih baik (p<0.005) daripada hasil injeksi dengan spermatozoa dari testis (38.0%). Terbentuknya pronukleus jantan dan betina (2PN) setelah 4-6 jam ICSI dengan spermatozoa dari kauda epididimis (27.6%) lebih rendah (p<0.05) daripada spermatozoa dari kaput epididimis (45.0%), akan tetapi kedua kelompok spermatozoa ini tidak berbeda dengan spermatozoa dari testis (31.6%). Pembentukan 3 atau lebih pronukleus hasil ICSI untuk spermatozoa dari kauda epididimis (3.4%) dan kaput epididimis (5.0%) tidak berbeda, akan tetapi keduanya lebih rendah (p<0.005) daripada dengan spermatozoa dari testis (21.1%).
Selanjutnya data yang dirangkum pada Tabel 2 memperlihatkan bahwa setelah Said et al. INTRACYTOPLASMIC SPERM INJECTION (ICSI) PADA TIKUS
biakan selama 9-11 jam, sel telur yang teraktifasi dari hasil ICSI dengan spermatozoa dari kauda epididimis (82.1%) tidak berbeda dengan spermatozoa dari kaput epididimis (73.8%) dan lebih baik (p<0.05) dari spermatozoa yang berasal dari testis (55.4%). Sedangkan untuk spermatozoa dari kaput epididimis tidak berbeda dengan spermatozoa dari testis. Demikian juga pada pembentukan 2 pronukleus dimana kauda (81.3%) dan kaput (67.7%) tidak berbeda, namun terhadap spermatozoa dari testis (58.1%) memperlihatkan perbedaan yang nyata (p<0.05). Spermatozoa dari caput dan testis tidak berbeda. Sedangkan untuk 3 pronukleus atau lebih dari ketiga kelompok spermatozoa tidak memperlihatkan perbedaan.
PEMBAHASAN
ICSI pada Tikus. Pada makalah ini diteliti kejadian sel telur teraktifasi dan pengaruh injeksi spermatozoa dengan berbagai tahap kematangan (spermatozoa dari kauda dan kaput epididimis serta spermatozoa dari testis) terhadap fertilisasi normal setelah ICSI pada tikus. Seperti yang telah dilaporkan sebelumnya oleh Dozortsev et al. (1998) yang melakukan ICSI pada tikus dengan berbagai macam teknik, baik menggunakan jarum injeksi yang tajam dan runcing maupun yang tumpul kurang memberikan hasil yang baik. Salah satu penyebab dari rendahnya hasil tersebut karena jarum injeksi yang digunakan cukup besar untuk mengakomodasi besarnya ukuran sel spermatozoa tikus. Data yang diperlihatkan pada makalah ini, dengan sedikit perbaikan teknik yaitu dengan menginjeksi hanya kepala spermatozoa (tanpa ekor) dan menggunakan sentakan listrik dari alat piezo serta perbaikan media manipulasi mampu memberikan hasil yang lebih baik.
Media Manipulasi. Dozortsev et al. (1998) melakukan ICSI pada tikus menggunakan media CZB-Hepes dengan 12% (w/v) polyvinilpyrolidone (PVP, 360 kDa). Namun pada penelitian ini media manipulasi yang digunakan adalah mR1ECM-PVA-Hepes dengan menurunkan konsentrasi NaHCO3 menjadi 5mM dan menambah konsentrasi NaCl
menjadi 110mM untuk meningkatkan tekanan osmosis yang berperan penting dalam proses fertilisasi normal. Penggunaan media ini didasarkan pada laporan Oh et al. (1998) bahwa medium biakan mR1ECM dapat dijadikan media fertilisasi (IVF) dengan mengganti polyvynil alcohol (PVA) dengan bovine serum albumin (BSA) serta meningkatkan tekanan osmosis medium menjadi 310 mOsM dengan menambah konsentrasi NaCl menjadi 110mM. Selanjutnya embrio tersebut mampu bertumbuh lebih baik sampai tahap blastosis setelah dibiakan pada medium mR1ECM. Akan tetapi pada penelitian ini kami menggunakan mR1ECM-PVA sebagai pengganti mR1ECM-BSA karena pertimbangan teknis, dimana PVA lebih mudah menghindari perlengketan spermatozoa dengan jarum injeksi, sedangkan dengan BSA spermatozoa dan sel debris (runtuhan sel) akan mudah lengket pada jarum injeksi sehingga menyulitkan pelaksanaan injeksi. Umumnya dalam pelaksanaan ICSI, medium manipulasi ditambahkan PVP untuk memudahkan penanganan spermatozoa, namun kami tidak menggunakan PVP mengingat spermatozoa yang digunakan sudah tidak bergerak lagi (tanpa ekor). Disamping itu untuk menghindari resiko masuknya material asing ke dalam sitoplasma pada saat ICSI, dimana resiko ini telah diungkapkan oleh Mansour (1998).
Kecepatan Pembentukan Pronukleus. Hasil penelitian ini memperlihatkan bahwa setelah biakan selama 4-6 jam kecepatan pembentukan pronukleus jantan dan betina pada oosit yang diinjeksi dengan spermatozoa testis lebih cepat dibanding oosit yang diinjeksi dengan spermatozoa kauda epididimis khususnya pada pembentukan >3PN (Tabel 1). Namun setelah dibiakkan 9-11 jam pembentukan pronukleus pada oosit yang diinjeksi spermatozoa testis menunjukkan angka yang lebih rendah. Fenomena ini mengindikasikan bahwa ada suatu faktor selama dalam proses pematangan spermatozoa di epididimis yang berperan penting dalam pembentukan pronukleus. Data ini sangat menarik untuk diteliti lebih jauh mengingat sinkronisasi pembentukan pronukleus jantan dan betina berperan penting dalam keberhasilan pembuahan normal.
Tabel 1. Aktifasi dan pembentukan pronukleus sel telur hasil ICSI dengan kepala spermatozoa setelah biakan selama 4-6 jam1.
1
Dilakukan sebanyak 6 kali ulangan; PN, Pronukleus; 2 huruf yang berbeda pada kolom yang sama berbeda nyata (p<0.005) untuk sel telur teraktifasi dan >3PN, dan (p<0.05) untuk PN.
Tabel 2. Aktifasi dan pembentukan pronukleus sel telur hasil ICSI dengan hanya kepala spermatozoa setelah biakan selama 9-11 jam1.
1
Dilakukan sebanyak 5 kali ulangan; PN, Pronukleus; 2Huruf yang berbeda pada kolom yang sama berbeda nyata (p<0.05). Asal Spermatozoa Berhasil diinjeksi (n) Degenera si n(%) Tidak terakti fasi n(%)
Status inti spermatozoa pada sel telur yang teraktifasi n (%) Total2 Kondensasi Dekondensasi 2PN2 >3PN2 Cauda epididymal spermatozoa 39 1(2.5) 9(23.1) 29(74.4) a 3(10.3) 17(58.6) 8(27.6)a 1(3.4)a Caput epididymal spermatozoa 24 2(8.3) 3(12.5) 20(83.3) a 1(5.0) 9(45.0) 9(45.0)b 1(5.0)a Testicular Spermatozoa 50 5(10.0) 26(52.0) 19(38.0) b 2(10.5) 7(36.8) 6(31.6)ab 4(21.1)b Asal Spermatozoa Berhasil diinjeksi (n) Degenera si n (%) Tidak terakti fasi n (%)
Status inti spermatozoa pada sel telur yang teraktifasi n (%)
Total2 Kondensasi Dekondensasi 2PN2 >3PN
Cauda epididymal spermatozoa 39 0 6(23.1) 32(82.1) a 3(9.4) 4(12.5) 26(81.3)a 1(3.1) Caput epididymal spermatozoa 42 1(2.4) 10(23.8) 31(73.8) ab 1(3.2) 9(29.0) 21(67.7)ab 2(6.5) Testicular Spermatozoa 56 2(3.8) 22(39.3) 31(55.4) b 1(3.2) 10(32.3) 18(58.1)b 2(6.5)
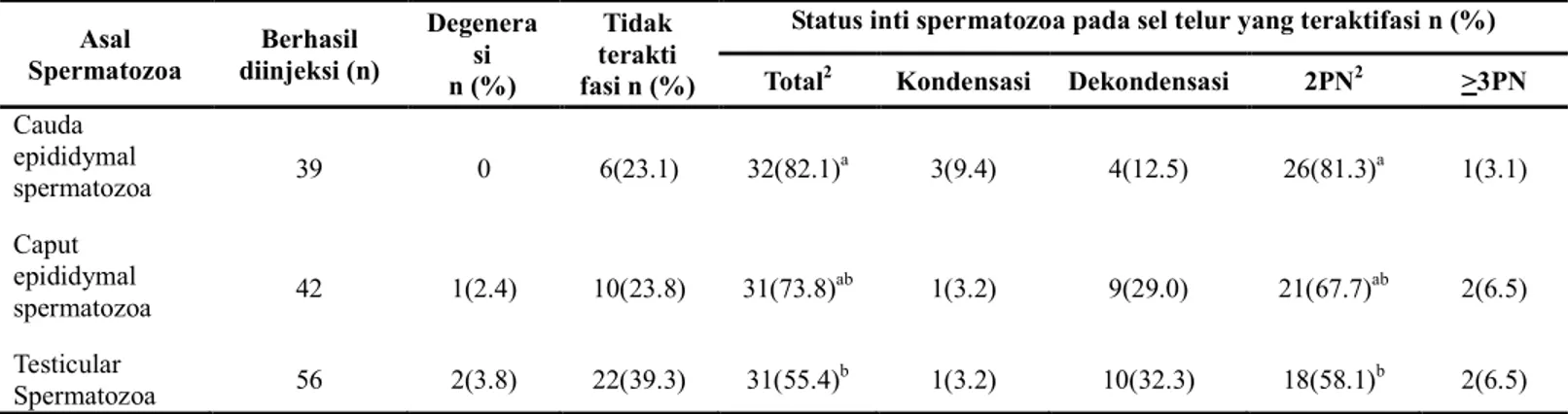
Gambar 1. Gambaran umum pelaksanaan ICSI. (A) Posisi awal sebelum melakukan ICSI, kepala spermatozoa berada pada ujung dalam jarum injeksi (tanda panah), (B) ujung jarum injeksi menyentuh dan menekan dinding zona pellucida, (C) jarum injeksi menembus dinding plasma, sejumlah kecil plasma terisap ke dalam jarum injeksi(tanda panah), (D) Kepala spermatozoa (tanda panah besar) dikeluarkan dan masuk kedalam plasma sel telur, biasanya sedikit plasma masih tersisa pada ujung jarum injeksi (tanda panah kecil). Bar menunjukkan skala 20 µm.
Gambar 2. Pembentukan pronukleus pada sel telur tikus setelah ICSI 9-11 jam. PB, polar bodi; MPN, male pronucleus, pronukleus jantan dan FPN, female pronucleus, pronukleus betina. Bar menunjukkan skala 20 µm.
Stabilitas Inti Spermatozoa. Pada saat transformasi spermatid menjadi spermatozoa, secara fisik dan kimiawi inti spermatozoa menjadi stabil dengan terbentuknya ikatan disulfide (-S-S-) pada inti protamin (Calvin & Bedford 1971). Pada penelitian ini, pemisahan kepala spermatozoa dengan ekor dilakukan dengan metode sonikasi selama 10 detik dengan tingkat keberhasilan sebesar 80-90%. Martin et al. (1988) melaporkan bahwa spermatozoa manusia lebih sering mengalami kejadian stres fisik pada inti akibat sonikasi. Sebagai contoh dengan sonikasi 2-10 detik menyebabkan struktur kromosom spermatozoa menjadi abnormal dan rusak. Namun demikian, pada penelitian ini diperoleh tingkat pembuahan normal yang cukup tinggi (Tabel 1 dan 2). Hal ini mungkin disebabkan bentuk spermatozoa tikus relatif besar dan kompak dibanding spermatozoa manusia yang menggambarkan DNA spermatozoa tikus relatif lebih tahan terhadap efek sonikasi. Kemungkinan lain adalah perbedaan derajat ikatan disulfide pada protamin spermatozoa. Perreault et al. (1988) melaporkan bahwa ikatan disulfide pada spermatozoa manusia lebih sedikit dibanding spermatozoa mamalia lainnya, begitu pula dengan struktur kromatinnya cukup berbeda. Meistrich (1989) melaporkan bahwa umumnya mamalia selama proses spermiogenesis seluruh inti histone diganti oleh protamin dengan ikatan yang sangat kuat. Akan tetapi pada manusia seperti laporan Choudhary et al. (1995) bahwa sekitar 10% DNA spermatozoa manusia tetap terikat pada histon. Hal inilah yang menyebabkan spermatozoa manusia menjadi kurang stabil. Komponen Spermatozoa yang dibutuhkan untuk Keberhasilan ICSI. Telah banyak laporan pembuahan normal dari hasil ICSI dengan hanya kepala spermatozoa. Keberhasilan pertama kali dilaporkan pada hamster (Uehara & Yanagimachi 1976) kemudian pada kelinci (Keefer 1989), manusia (Mansour et al. 1995) dan pada mencit (Kuretake et al. 1996).
Pada penelitian ini, hasil ICSI oosit tikus memperlihatkan pembuahan normal ditandai dengan terbentuknya pronukleus jantan dan betina (Tabel 1,2). Dari hasil ini terlihat bahwa sentrosom spermatozoa yang terdapat pada bagian leher (hilang setelah sonikasi) bukan merupakan komponen yang penting untuk pembuahan normal.
Schatten et al. (1986) melaporkan bahwa pada saat terjadinya pembuahan normal pada beberapa ternak percobaan, centrosome spermatozoa mengalami degenerasi setelah masuk di ooplasma. Akan tetapi umumnya mamalia lainnya centrosome berperan penting pada perkembangan dan penggabungan pronukleus jantan dan betina dan selanjutnya pembelahan (Schatten 1994).
Aktifasi sel telur dan pembentukan pronukleus setelah ICSI dengan spermatozoa testis memperlihatkan hasil yang rendah dibandingkan dengan spermatozoa kaput dan kauda epididimis. Hal ini kemungkinan disebabkan rendahnya kandungan sperm factor pada spermatozoa testis yang berfungsi mengaktivasi sel telur. Menurut Parrington et al. (1996), sperm factor adalah suatu protein berukuran 33-kDa terdapat pada daerah akrosome. Protein ini disebut oscillin yang dapat diekstrak dari spermatozoa yang matang dengan pembekuan (freezing) dan thawing. Disamping oscillin, pada spermatozoa yang matang mungkin terdapat sperm factor lain yang belum bisa diekstrak.
Dari hasil penelitian ini dapat disimpulkan bahwa melalui teknik ICSI, baik spermatozoa yang matang maupun yang belum matang mampu menghasilkan pembuahan normal. Data dari penelitian ini juga memperlihatkan bahwa paling tidak ICSI pada tikus, bisa dilakukan hanya dengan kepala spermatozoa (tanpa ekor). Rendahnya tingkat keberhasilan ICSI dengan spermatozoa testis mungkin disebabkan rendahnya kandungan sperm factor yang berperan mengaktifasi sel telur, untuk hal ini masih diperlukan penelitian lebih lanjut.
DAFTAR PUSTAKA
Bourne H, Richings N, Liu DY, Clarke G.N, Harari O, Baker HWG.. 1995. Sperm preparation for intracytoplasmic injection: Methods and relationship to fertilization results. Reprod Fertil Dev 7:177-183.
Calvin HI, Bedford JM. 1971. Formation and disulfide bonds in the nucleus and accessory structures of mammalian spermatozoa during maturation in the epididymis. J Reprod Fertil Suppl 13:45-75.
Choudhary SK, Wykes SM, Mohamed AK, Koppitch F, Nelson JE, Krawetz SA. 1995. A haploid expressed gene cluster exists as a single chromatin domain in human Said et al. INTRACYTOPLASMIC SPERM INJECTION (ICSI) PADA TIKUS
sperm. J Biol Chem 270: 8755-8762.
Dozortsev D, Wakayama T, Ermilov A, Yanagimachi R. 1998. Intracytoplasmic sperm injection in the rat. Zygote 6:143-147.
Keefer CL. 1989. Fertilization by sperm injection in the rabbit. Gamete Res 22:59-69. Kuretake S, Kimura Y, Hoshi K, Yanagimachi R. 1996. Fertilization and development of
mouse oocytes injected with isolated sperm heads. Biol Reprod 55:789-795. Mansour R. 1998. Intracytoplasmic sperm injection: a state of the art technique. Hum
Reprod Update 4(1):43-56.
Mansour RT, Aboulghar MA, Serour G.I, Salah I. 1995. Intracytoplasmic sperm injection of sperm head only. J Assist Reprod Gamet 12(suppl):193. Abst.
Martin RH, Ko E, Rademaker A. 1988. Human sperm chromosome complements after microinjection of hamster eggs. J Reprod Fertil 84:179-186.
Meistrich ML. 1989. Histon and basic nuclear protein transitions in mammalian spermatogenesis: Hnilica CS, Stein GS, Stein JL. (ed.), Histones and other basic nuclear proteins. Boca Raton, FL: CRC Press; Hlm165-182.
Miyoshi K, Kono T, Niwa K. 1997. Stage-dependent development of rat 1-cell embryos in a chemically defined medium after fertilization in vivo and in vitro. Biol Reprod 56: 180-185.
Oh SH, Miyoshi K, Funahashi H. 1998. Rat oocytes fertilized in modified Rat 1-cell embryo culture medium containing a high sodium chloride concentration and bovine serum albumin maintain developmental ability to the blastocyst stage. Biol Reprod 59:884-889.
Parrington J, Swann K, Schevchenko VI, Sesai AK, Lai FA. 1996. Calcium oscillations in mammalian eggs triggered by a soluble sperm protein. Nature 379:364-368. Perreault SD, Barbee RR, Elstein KH, Zucker RM, Keefer CL. 1988. Interspecies
differences in the stability of mammalian sperm nuclei assessed in vitro by sperm microinjection and in vitro by flow cytometry. Biol Reprod 39:157-167. Said S, Funahashi H, Niwa K. 1999. DNA stability and thiol-disulphide status of rat
sperm nuclei during epididymal maturation and penetration of oocytes. Zygote 7: 249-254.
Schatten H, Schatten G., Mazia D, Balczon R, Simerly C. 1986. Behavior of centrosomes during fertilization and cell division in mouse oocytes an in sea urchin eggs. Proc Natl Acad Sci USA 83:105-109.
Schatten G. 1994. The centrosome and its mode of inheritance: the reduction of the centrosome during gametogenesis and its restoration during fertilization. Dev Biol 165:299-335.
Thadani VM. 1980. A study of hetero-specific sperm-egg interactions in the rat, mouse, and deer mouse using in vitro fertilization and sperm injection. J Exp Zool 212:435-53.
Uehara T, Yanagimachi R. 1976. Microsurgical injection of spermatozoa into hamster eggs with subsequent transformation of sperm nuclei into male pronuclei. Biol Reprod 15:467-470.