Mikrobiologi Praktik
SITUS PEMBELAJARAN PERHITUNGAN MIKROORGANISME
Most Probable Number (MPN) / Angka Paling Mungkin (APM)
January 26, 2014 Posted by indra pradhika 1. Sejarah perkembangan MPN 2. Prinsip metode MPN 3. Cara kerja metode MPN 3.1. Uji pendugaan 3.2. Uji penegasan untuk Coliform 3.3. Uji penegasan untuk Fecal Coliform 3.4. Uji pelengkap untuk E.coli 4. Pemilihan jumlah seri tabung MPN 5. Peluang dalam metode MPN 6. Persyaratan pemilihan kombinasi tabung positif dan pelaporannya 7. Batasbatas perhitungan nilai MPN 8. Menghitung MPN tanpa tabel 9. Aplikasi lain MPN dalam perhitungan bakteri 10. Perhitungan MPN secara otomatis 11. Hubungan MPN dan CFU 11.1. Perbandingan antara MPN dan CFU 11.2. Perbedaan antara MPN dan CFU 11.3. Pengkonversian satuan MPN ke CFU 12. Kesalahan umum MPN 12.1. Kombinasi seri tabung diluar tabel 12.2. Tabung negatif palsu dan positif palsu 13. Tabel MPN Referensi Bab ini membahas secara dalam bagaimana metode MPN/APM tersebut bekerja sehingga dapat menghitung mikroorganisme dari data positif atau negatif tanpa menghitung koloni yang tumbuh. Metode Angka Paling Mungkin (APM) disebut sebagai metode Most Probable Number (MPN) dalam penamaan selanjutnya tanpa mengabaikan kaidah penyerapan dalam bahasa Indonesia.1. Sejarah perkembangan MPN
Metode MPN muncul sekitar awal abad 20 sehingga dikenal sudah sangat lama di dalam ilmu mikrobiologi. Estimasi akurat dari tabel MPN di publikasikan oleh Mc Crady pada tahun 1915 kemudian dasar statistik dari metode MPN dikemukakan oleh Halvorson dan Ziegler (1933), Eisenhart dan Wilson (1943) dan Cochran (1950). Pada tahun 1957 Woodward menyarankan tentang pengabaian hasil positif (banyak tabung positif pada pengenceran tinggi dan sebaliknya) yang dapat meningkatkan kesalahan laboratorium dalam tabel MPN. Kemudian De Mann pada tahun 1983 mempublikasikan tentang metode perhitungan tingkat kepercayaan (convidence interval) dalam tabel MPN. Sampai sekarang metode MPN telah menjadi salah satu metode standard untuk menghitung jenis Coliform, Fecal Coliform, Escherichia coli, dan S. aureus. 2. Prinsip metode MPN MPN adalah suatu metode perhitungan mikroorganisme berdasarkan data kualitatif hasil pertumbuhan mikroorganisme pada medium cair spesifik dalam seri tabung untuk memperoleh kisaran data kuantitatif jumlah mikroorganisme tersebut (MPN/ml (g)). MPN merupakan suatu metode uji pengenceran bertingkat (serial dilution) untuk mengukur konsentrasi mikroorganisme target dengan perkiraan. SNI 012332.1 (2006:7) mendeskripsikan MPN sebagai metode untuk menghitung jumlah mikroba dengan menggunakan medium cair pada tabung reaksi yang pada umumnya setiap pengenceran menggunakan 3 atau 5 seri tabung dan perhitungan yang dilakukan merupakan tahap pendekatan secara statistik. Prinsip utama metode ini adalah mengencerkan sampel sampai tingkat tertentu sehingga didapatkan konsentrasi mikroorganisme yang pas/sesuai
dan jika ditanam dalam tabung menghasilkaan frekensi pertumbuhan tabung positif “kadangkadang tetapi tidak selalu”. Semakin besar jumlah sampel yang dimasukkan (semakin rendah pengenceran yang dilakukan) maka semakin “sering” tabung positif yang muncul. Semakin kecil jumlah sampel yang dimasukkan (semakin tinggi pengenceran yang dilakukan) maka semakin “jarang” tabung positif yang muncul. Semua tabung positif yang dihasilkan sangat tergantung dengan probabilitas sel yang terambil oleh pipet saat memasukkannya ke dalam media. Oleh karena itu, homogenisasi sangat mempengaruhi metode ini. Kombinasi kemunculan positif (ya) atau negatif (tidak) ini menggambarkan perkiraan konsentrasi mikroorganisme pada sampel sebelum diencerkan. Perubahan dari data positif atau negatif sampai menghasilkan angka dilakukan dengan proses perhitungan statistik. Jadi nilai MPN adalah suatu angka yang menggambarkan jumlah mikroorganisme yang memiliki kemungkinan paling tinggi. Gambar 1. Kombinasi tabung positif yang didapat adalah 3 tabung positif dari pengenceran 1/10, 2 tabung positif dari pengenceran 1/100 dan 1 tabung positif dari pengenceran 1/1000. Angka MPN yang dihasilkan setelah dicocokkan dengan tabel adalah 150 MPN/g. Asumsi yang diterapkan dalam metode MPN adalah : Bakteri terdistribusi sempurna dalam homogenat sampel. Sel bakteri terpisahpisah secara individual, tidak dalam bentuk rantai atau kumpulan (bakteri Coliform termasuk E. coli terpisah sempurna tiap selnya dan tidak membentuk rantai). Media yang dipilih telah sesuai untuk pertumbuhan bakteri target dalam suhu dan waktu inkubasi tertentu sehingga minimal satu sel hidup mampu menghasilkan tabung positif selama masa inkubasi pada media tersebut. Jumlah yang didapatkan menggambarkan bakteri yang hidup (viable) saja. Sel yang terluka dan tidak mampu menghasilkan tabung positif tidak akan terdeteksi. Setiap individu tabung memiliki data yang berdiri sendiri (independen). Metode MPN dinilai berdasarkan perkiraan unit tumbuh (Growth Unit / GU) seperti CFU, bukan dari sel individu. Meskipun begitu baik nilai CFU atau MPN dapat menggambarkan seberapa banyak sel individu yang tersebar dalam sampel. FDA BAM appendix 2 (2001) menyatakan bahwa jika dalam MPN menggunakan target mikroorganisme yang dalam preparasi sampel dan pengencerannya tetap menunjukkan sel yang tidak terpisah dan berkelompok, maka nilai MPN sebaiknya dapat dinyatakan dalam perkiraan GU (Growth Units) atau CFU (Colony Forming Units). Namun sebagian besar metode MPN digunakan untuk menghitung mikroorganisme target yang benarbenar terpisah individunya seperti Coliform dan E.
coli.
Pemilihan media sangat berpengaruh terhadap metode MPN yang dilakukan. Umumnya media yang digunakan mengandung bahan nutrisi khusus untuk pertumbuhan bakteri tertentu. Misalnya dalam mendeteksi kelompok Coliform dapat menggunakan media Brilliant Green Lactose 2% Bile (BGLB) broth. Di dalam media ini mengandung lactose dan garam empedu (bile salt) yang hanya mengizinkan untuk tumbuh. Jika terdapat ketidaksesuaian jenis media dan bakteri yang diinginkan maka metode ini akan menghitung bukan bakteri yang dituju. Untuk menghitung Coliform pada tahap pendugaan umumnya menggunakan Lauryl Sulphate Tryptose (LST) broth, sedangkan untuk menghitung E.coli pada tahap konfirmasi diperlukan media EC (Escherichia coli) broth.
USDA/FSIS (2008:1) menyebutkan bahwa nilai MPN sangat berguna untuk menentukan jumlah mikroorganisme dengan konsentrasi rendah (<100/g). Metode ini umumnya dipakai untuk menganalisa susu, pangan, air atau tanah yang dimana pada jenis sampel ini terdapat kemungkinan bahan partikulat sampel mampu mengganggu pertumbuhan koloni pada agar.
Beberapa kelebihan metode MPN yang diambil berdasarkan Oblinger dan Korburger (1975:541) adalah (1) Akurasi dapat ditingkatkan dengan memperbanyak tabung yang digunakan setiap pengencerannya. (2) Ukuran (volume) sampel yang cukup besar (dibanding plate count). (3) Sensitivitas umumnya cenderung lebih baik pada konsentrasi mikroorganisme yang sedikit daripada plate count. (4) Recovery umumnya lebih baik karena menggunakan media cair, tetapi tetap tergantung partikel sampel yang mungkin dapat mengganggu. (5) Jika medium spesifik yang sesuai dengan pertumbuhan bakteri target dapat dibuat maka perkiraan perhitungan MPN dapat dilakukan berdasarkan medium tersebut.
3. Cara kerja metode MPN
MPN umumnya dilakukan tidak hanya sampai menghasilkan tabungtabung positif saja, melainkan dilanjutkan dengan berbagai macam uji untuk mengkonfirmasi tabung positif. Prosedur konfirmasi tersebut bertujuan untuk meyakinkan bahwa data positif tersebut memang ditimbulkan oleh mikroorganisme target. Meskipun media awal yang dipakai di dalam tabung sudah berfungsi sebagai media selektif. Terdapat tiga tahap dalam prosedur lengkap metode MPN yaitu uji penduga (presumptive test), uji penegasan (confirmed test) dan uji pelengkap (completed test). Uji penduga dilakukan untuk memperoleh kombinasi tabung positif awal, kemudian uji penegasan digunakan untuk memastikannya. Nilai akhir yang diambil adalah dari hasil uji penegasan dan pelengkap sehingga dimungkinkan mengubah kombinasi tabung yang diperoleh pada uji penduga. Umumnya hanya uji E.coli saja yang sampai tahap uji pelengkap. Uji E.coli yang sesuai standar harus dilakukan sampai tahap akhir yang memerlukan waktu berharihari. Jika analisa tidak dilakukan sampai akhir maka belum dapat dinyatakan pasti bahwa tabung positif tersebut mengandung E. coli. Berikut adalah Metode MPN Coliform, Fecal Coliform dan E. coli untuk analisa sampel pangan yang diinterpretasikan berdasarkan FDA BAM Ch.4 (2002).
3.1. Uji penduga
§ Larutkan dengan akuades sampai 1L, stok pelarut simpan dalam refrigerator. Larutkan 1,25 ml dari stok pelarut ke dalam 1L H2O lalu sterilisasi menggunakan autoklaf.
§ Cairkan sampel beku pada suhu 25°C selama ≤18 jam atau suhu 45°C selama 15 menit pada waterbath dengan agitasi. Timbang secara aseptis sebanyak 50g.
§ Masukkan sampel ke dalam kontainer blender yang telah disterilisasi. Tambahkan 450 ml butterfield phosphate diluent (dihitung pengenceran pertama ; 50:450 atau 1:9). Kemudian hancurkan selama 2 menit. Volume total yang terdapat pada wadah blender harus menutupi pisau blender. Jika sampel tersedia kurang dari 50g (x) maka pengenceran pertamanya adalah x.9 ml. § Ambil 1 ml homogenat sampel (pengenceran 1/10) dari preparasi sampel lalu masukkan ke 9 ml diluent (pengenceran 1/100). Ambil 1 ml dari tabung pengenceran 1/100 untuk dimasukkan ke 9 ml diluent (pengenceran 1/1000). Pada setiap transfer sampel yang dilakukan, tabung dikocok berayun 25 kali dengan ketinggian ayunan pengocokan 30 cm atau vorteks selama 7 detik. § Siapkan 3 seri tabung MPN berisi masingmasing 10 ml Lauryl Sulphate Tryptose (LST) broth dengan tabung durham didalamnya (total 9 tabung yang dibagi menjadi 3 seri). § Masukkan 1 ml dari pengenceran 1/10 ke 3 tabung pertama, masukkan 1 ml dari pengenceran 1/100 ke 3 tabung kedua, dan masukkan 1 ml dari pengenceran 1/1000 ke 3 tabung ketiga. § Inkubasi semua tabung pada suhu 35±0,5 oC selama 24±2 jam. Amati terbentuknya gas pada tabung durham lalu catat hasilnya. Inkubasi lagi menjadi 48±3 jam tabung yang tidak terbentuk gas. § Interpretasi hasil positif jika media keruh dan terbentuk gas (harus keduaduanya) pada inkubasi 24±2 jam atau 48±3 jam. Interpretasi hasil negatif jika tidak terdapat pertumbuhan dan tidak terbentuk gas. Gas yang diproduksi dapat terjebak dalam tabung durham ataupun berbentuk buih (effervescence) yang timbul saat dikocok. § Perkiraan konsentrasi berdasarkan tabel yang didapat adalah nilai dugaan adanya Coliform, Fecal Coliform atau E.coli. 3.2. Uji penegasan untuk Coliform § Siapkan tabung berisi 10 ml Brilliant Green Lactose Bile (BGLB) broth dengan tabung durham didalamnya. § Masukkan satu ulasan inokulum dari tiap tabung LST broth yang menghasilkan uji positif ke dalam tiap tabung BGLB broth. § Inkubasi semua tabung pada suhu 35±0,5 oC selama 48±3 jam. § Interpretasi hasil positif jika media keruh dan terbentuk gas (harus keduaduanya). Interpretasi hasil negatif jika tidak terdapat pertumbuhan dan tidak terbentuk gas. § Tentukan jumlah Coliform (MPN/g atau ml) dengan menghitung tabung positif kemudian cocokkan dengan tabel MPN (tabel 10) berdasarkan dari perhitungan uji dugaan. Perkiraan konsentrasi berdasarkan tabel yang didapat adalah nilai penegasan adanya Coliform. 3.3. Uji penegasan untuk Fecal Coliform dan E.coli § Siapkan berisi masingmasing 10 ml EC broth dengan tabung durham didalamnya § Masukkan satu ulasan inokulum dari tiap tabung LST broth yang menghasilkan uji positif ke dalam tiap tabung EC broth.
§ Inkubasi semua tabung pada suhu 45,5 oC (Fecal Coliform untuk pangan dilakukan pada 45,5±0,2 oC, uji air, kerangkerangan 44,5±0,2 oC)
selama 24±2 jam. Amati terbentuknya gas pada tabung durham lalu catat hasilnya. Inkubasi lagi menjadi 48±2 jam tabung yang tidak terbentuk gas. § Interpretasi hasil positif jika media keruh dan terbentuk gas (harus keduaduanya). Interpretasi hasil negatif jika tidak terdapat pertumbuhan dan tidak terbentuk gas.
§ Tentukan jumlah Fecal Coliform (MPN/g atau ml) dengan menghitung tabung positif kemudian cocokkan dengan tabel MPN (tabel 10) berdasarkan dari perhitungan uji dugaan. Perkiraan konsentrasi yang didapat berdasarkan tabel adalah nilai penegasan adanya Fecal Coliform dan E. coli. Untuk mengetahui apakah pada tabung EC broth adalah Fecal Coliform atau E. coli maka dilanjutkan uji penegasan untuk E. coli. 3.4. Uji pelengkap untuk E.coli § Tabung positif yang mengandung gas dari EC broth dikocok kemudian inokulasikan ke dalam cawan LEMB agar dan inkubasi pada 35±0,5 oC selama 1824 jam. § Interpretasikan sebagai dugaan E.coli jika memiliki ciriciri koloni datar, berwarna hitam di tengah koloni dengan atau tanpa warna kilat logam
(metallic sheen). Inokulasikan sampai 5 koloni tersangka ke PCA dan inkubasi pada 35±0,5 oC selama 1824 jam untuk kultur uji penegasan
selanjutnya. § Satu dari lima koloni yang teridentifikasi positif E. coli cukup untuk menyatakan bahwa tabung EC broth tersebut terkonfirmasi positif E. coli. § Uji kultur dugaan dengan uji pewarnaan gram dan morfologi sel. Semua kultur yang mencirikan gram negatif dan sel berbentuk batang pendek selanjutnya diuji dengan tahap selanjutnya. Inokulasikan kembali kultur dugaan tersebut ke media LST lalu inkubasi pada 35±0,5 oC selama 48±2 jam untuk mengkonfirmasi ulang terbentuknya gas. Kemudian kultur sangkaan yang sama dilakukan uji IMViC. § Uji IMViC (uji produksi indole, uji Methyl Red, uji VogesProskauer, uji penggunaan Citrate). o Uji produksi indole; uji ini akan membedakan bakteri yang mampu atau tidak mampu memproduksi indole dari Tryptone.
terbentuk cincin merah pada bagian atas tabung maka bakteri dapat memproduksi indol (indol positif) dan bila terbentuk cincin kuning maka disimpulkan sebagai indol negatif. Jika kultur dugaan adalah E. coli maka seharusnya menunjukkan hasil positif dan sel berbentuk batang pendek. o Uji VogesProskauer; uji ini dapat membedakan bakteri yang mampu memproduksi acetylmethylcarbinol atau tidak. Senyawa tersebut dideteksi dengan penambahan potassium hydroxide yang akan membentuk diacetyl yang bereaksi dengan peptone menghasilkan warna merah. Inokulasikan kultur sangkaan ke MRVP broth lalu inkubasi pada 35±0,5 oC selama 48±2 jam. Setelah waktu 24 jam pindahkan 1 ml ke dalam tabung kosong (13×100 mm) lalu tambahkan 0,6 ml larutan larutan αnaphthol dan 0.2 ml 40% KOH. Tambahkan beberapa kristal creatine. Kocok kemudian biarkan selama 2 jam. Uji VP dinyatakan positif bila warna berubah menjadi merah. Jika kultur dugaan adalah E. coli maka seharusnya menunjukkan hasil tidak ada perubahan warna / negatif. o Uji Methyl Red; uji ini akan membedakan bakteri yang mampu memproduksi asam dari glukosa dan Methyl Red sebagai indikator penurunan pH .
Inkubasi kembali tabung MRVP pada 35±0,5 oC selama 48±2 jam. Tambahkan 5 tetes larutan Methyl Red ke dalam tabung MRVP broth.
Terbentuknya warna merah menandakan hasil uji positif, sedangkang berwarna kuning menunjukkan hasil negatif. Jika kultur dugaan adalah E. coli maka seharusnya menunjukkan hasil positif.
o Uji penggunaan Citrate ; uji ini akan membedakan bakteri yang mampu menggunakan Citrate sebagai sumber nutrisinya.
Inokulasikan kultur sangkaan ke medium Koser’s Citrate broth lalu inkubasi pada 35±0,5 oC selama 96 jam. Reaksi positif jika terdapat
pertumbuhan media yang berwarna hijau berubah menjadi biru, reaksi negatif jika tidak ada pertumbuhan dan media tetap hijau. Jika kultur dugaan adalah E. coli maka seharusnya menunjukkan hasil tidak ada perubahan warna / negatif.
Interpretasikan hasil uji IMViC dengan tabel berikut.
Kriteria Biotipe 1 Biotipe 2
Morfologi dan gram Batang pendek tidak
berspora Batang pendek tidakberspora
Sifat gram Gram negatiif Gram negatif
Gas pada tabung LST + + Uji indole + Uji MR + + Uji VP Uji Citrate Tabel 1. Karakteristik E. coli pada uji morfologi sel, gram, produksi gas dan IMViC untuk biotipe 1 dan 2.
Hasil yang mencirikan biotipe 1 dan biotipe 2 disimpulkan sebagai E.coli (positif). Tentukan jumlah E. coli (MPN/g atau ml) berdasarkan tabung EC positif yang terkonfirmasi dari uji penegasan berdasarkan tabel MPN (tabel 10).
Uji IMViC juga dapat dilakukan menggunakan test kit seperti API20E.
Uji MPN untuk Coliform dan E.coli selengkapnya dapat mengacu langsung ke BAM dengan alamat : (http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm064948.htm)
4. Pemilihan jumlah seri tabung MPN
Telah diketahui bahwa MPN memiliki beberapa pilihan cara dalam perhitungannya berdasarkan jumlah tabung setiap serinya sesuai tabel yang tersedia yaitu 3, 5, 8 dan 10 seri tabung. Inti dari metode MPN adalah mendapatkan tingkat pengenceran yang kadangkadang tapi tidak selalu mengandung mikroorganisme hidup. Alasan inilah yang sangat mempengaruhi pemilihan jumlah seri tabung pada metode MPN tersebut. Menurut ISO 7218 (2007:45) pemilihan konfigurasi seri tabung ini juga dipengaruhi oleh jumlah mikroorganisme yang diperkiraan, persyaratan peraturan yang berlaku, presisi yang dibutuhkan dan pertimbangan praktik lainnya.
Sistem metode MPN yang paling banyak digunakan adalah Symmetric dilution system yaitu metode MPN yang menggunakan banyak tabung secara paralel setiap pengencerannya. Semakin banyak jumah tabung yang digunakan setiap serinya maka semakin presisi nilai yang dihasilkan. Disarankan untuk menggunakan 5 atau lebih tabung setiap serinya jika menginginkan presisi yang lebih baik (ISO 7218, 2007:45). FDA BAM Ch.4 (2002) menyatakan bahwa 3 seri tabung umumnya digunakan untuk sampel pangan, 5 seri tabung untuk sampel air dan kerang, sedangkan 10 seri tabung dipakai untuk menguji air dalam kemasan (bottled water) atau sampel lain yang diperkirakan jarang terkontaminasi (mengandung sedikit mikroorganisme).
Untuk pengujian air dalam kemasan (bottled water) digunakan metode 10 tabung. Diambil 100 ml sampel air dan inokulasikan masingmasing 10 ml sampel yang tidak diencerkan ke dalam 10 tabung 2x LST (double strength) dan tiap tabung berisi 10 ml media. Tabung diinkubasi pada 35°C. selama 24±2 jam. Jika hasil negatif maka tabung diinkubasi lagi selama 24 jam. Semua tabung positif diuji dengan tahap konfirmasi yaitu dengan menanamkannya pada BGLB menggunakan jarum inokulasi. Kemudian tabung diinkubasi pada 35°C. selama 48±2 jam. Hasil MPN diketahui menggunakan tabel MPN 10 tabung (tabel 14) (FDA BAM Ch.4, 2002). UNEP/WHO (1996:7) menyarankan jumlah sampel yang diinokulasikan dan jumlah seri tabung yang dipakai untuk analisa berbagai jenis sampel air pada tabel berikut. Jenis sampel 50 ml 10 ml 1 ml 0,1ml 0,01ml Air minum olahan (treated dinking water) 1 5 Air minum olahan sebagian (partially treated dinking water) 5 5 5 Air yang dimungkinkan terjadinya kontak langsung (Recreational water) 5 5 5 Sumber air yang dilindungi (Protectedsource water) 5 5 5
Air permukaan (Surface water) 5 5 5 Tabel 2. Tabel seri tabung dan volume sampel yang digunakan untuk analisa MPN berbagai jenis sampel air (UNEP/WHO, 1996:7) Menurut USDA/FSIS (2008:3) untuk mengantisipasi jika jumlah mikroorganisme dalam sampel >10 Growth Unit/g (ml) maka disarankan menanam sampel 10 ml pada 3 seri tabung, 1 ml pada 3 seri tabung lalu selanjutnya dilakukan pengenceran sampai 1/104 dan tiap pengenceran ditanam 1 ml pada 3 seri tabung. Gambar 2. Skema penanaman metode MPN yang disarankan oleh USDA/FSIS (2008:3). Jika mengikuti petunjuk ini maka kemungkinan memperoleh tabung positif yang “kadangkadang tapi tidak selalu” semakin besar. Banyak metode lain yang dapat diacu untuk analisa MPN Coliform dan atau E.coli. Umumnya terdiri dari beberapa tahap pengujian. Berikut tabel perbandingan metode analisa MPN.
Referensi metode ISO 4831:2006 ISO 7251:2005 AOAC OM966.24 APHA, AWWA,WEF 9221
Uji Coliform E.coli Coliform danE.coli Coliform danE.coli
Matriks Pangan dan pakan Pangan dan pakan Pangan Air
Inokulasi dan jumlah seri tabung Padat : 3×3 seri tabung : 10 ml dari 1/10 pada 3 seri tabung DS 1 ml dari 1/10 pada 3 seri tabung SS 1 ml dari 1/100 pada 3 seri tabung SS Cair : Dari 1,1/10,1/100 Padat : 3×3 seri tabung : 10 ml dari 1/10 pada 3 seri tabung DS 1 ml dari 1/10 pada 3 seri tabung SS 1 ml dari 1/100 pada 3 seri tabung SS Cair : Dari 1,1/10,1/100 3×3 seri tabung : 1 ml dari 1/10 pada 3 seri tabung 1 ml dari 1/100 pada 3 seri tabung 1 ml dari 1/1000 pada 3 seri tabung Air minum : 1×10 seri tabung : @ 10 ml 1×5 seri tabung : @ 20 ml 1×1 seri botol : @ 100 ml Bukan air minum : Sampel diencerkan terlebih dahulu. Uji penduga Coliform dan E.coli LST (DS); 30/37oC ; 24±2 jam LST (SS); 30/37oC ; 24+24±2 jam LST (DS+SS); 37oC ; 24+24±2 jam LST; 35±0,5oC ; 24+24±2 jam LST (DS); 35±0,5oC ; (24±2)+(24±3) jam Uji penegasan Coliform BGLB; 30/37 oC ; 24+24±2 jam () BGLB; 35±0,5 oC ; 48±2 jam BGLB; 35±0,5oC ; 48±3 jam atau LES Endo Agar Mc Conkey Pewarnaan gram LST
Uji penegasan Fecal Coliform () EC broth; 44oC ; 24+24±2 jam EC broth; 45,5±0,02oC ; 48±2 jam EC broth; 45,5±0,2oC ; 24±2 jam Uji pelengkap E.coli () Uji indol : peptone water; 44oC ;48±2 jam Pewarnaan Gram Penanaman LST Uji indol Uji methyl red Uji Voges Proskauer Uji penggunaan citrate ECMUG; 45,5±0,2oC ; 24±2 jam atau Uji GAD (glutamate decarboxylase) Uji Indol Tabel yang digunakan Tabel MPN 3 seri tabung dengan inokulum 0,1 g, 0,01 g, dan 0,001 g. atau 1 g, 0,1 g dan 0,01 g. Tabel MPN 3 seri tabung dengan inokulum 0,1 g, 0,01 g, dan 0,001 g. atau 1 g, 0,1 g dan 0,01 g. Tabel MPN 3 seri tabung dengan inokulum 0,1 g, 0,01 g, dan 0,001 g. Tabel MPN 10 tabung dengan inokulum 10 ml; Tabel MPN 5 tabung dengan inokulum 20 ml; Interpretasi P/A. Catatan : SS : single strength DS : double strength P/A : presence / absence Tabel 3. Tabel perbandingan metode MPN untuk Coliform dan atau E.coli berdasarkan beberapa standard internasional (ISO 4831 (2006), ISO 7251 (2005), AOAC OM 966.24 (2005) dan APHA, AWWA, WEF 9221 (2006)).
Jika pengujian Coliform dan E.coli dilakukan sesuai standar baku maka memang diperlukan tahap konfirmasi yang bertingkat dan seringkali membutuhkan waktu yang panjang. Çakir et al. (2002:1049) membuktikan bahwa tidak perlunya dilakukan beberapa uji konfirmasi saat perhitungan Coliform dan E.coli. Konfirmasi yang dapat diabaikan adalah uji pada BGLB untuk mengkonfirmasi Coliform setelah uji LST dan uji indol untuk mengkonfirmasi E.coli setelah uji MUG. Uji konfirmasi ini tidak memberikan dampak yang signifikan terhadap hasil akhir hitungan. 5. Peluang dalam metode MPN Brown (2001:224) memberi permisalan pembacaan tabung positif untuk kombinasi 310. Kombinasi ini menghasilkan indeks MPN sebesar 4,3. Angka ini menunjukkan sampel memiliki perkiraan 4,3 ‘organisme’ per gram dengan 95% kemungkinan keberadaannya dengan rentang 0,9 sampai 18,1 ‘organisme’ dengan menggunakan tabel MPN 3 seri. Angka 4,3 hanyalah nilai kemungkinan secara statistik. Gambar 3. Bagan distribusi normal salah satu nilai MPN. FDA BAM appendiks 2 (2001) memberikan informasi bahwa hasil dari metode MPN memiliki derajat kepercayaan karena proses perhitungannya merupakan hasil dari peluang. Arti dari 95% confidence intervals dalam tabel MPN adalah kemungkinan paling tidak 95% rentang derajat kepercayaan dari hasil akhir adalah sesuai dengan konsentrasi yang sebenarnya. Di dalam tabel MPN terdapat kolom derajat kepercayaan (confidence interval) 95% dengan batas bawah (lower limit) dan batas atas (upper limit). Angka ini menunjukkan batas derajat kepercayaan tersebut. Nilai indeks MPN dan derajat kepercayaan dalam tabel dinyatakan dalam dua digit signifikan, misalnya nilai 400 adalah hasil pembulatan antara 395 dan 405. Tidak diberikannya batas nilai MPN untuk semua tabung positif (333) yang ditandai dengan tanda “>” adalah menggambarkan konsentrasi lebih dari nilai MPN untuk kombinasi paling tidak ada satu tabung negatif pada pengenceran tertinggi (332). Ketidakpastian ini juga dijumpai pada indeks MPN untuk semua kombinasi tabung negatif. (+) (+) (+) Conf. limit Conf. limit 0,1 0,01 0,001 MPN/ml Batas bawah Batas atas 5 3 0 79 22 220 5 3 1 110 34 250 5 3 2 140 52 400 5 3 3 180 70 400 5 3 4 210 70 400
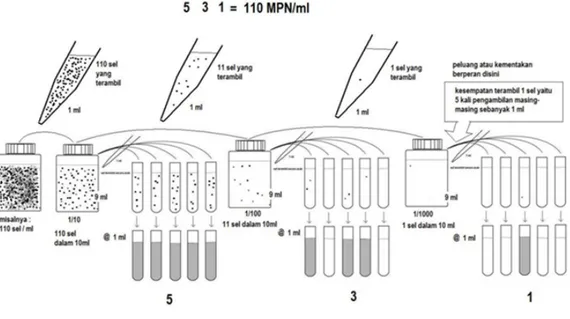
Tabel 4. Contoh potongan tabel MPN 5 seri tabung dengan inokulum 0,1g (ml), 0,01 g (ml) dan 0,001 g (ml). Untuk memahami peranan peluang dalam mendistribusikan sel sehingga menghasilkan tabung positif maka jumlah tabung positif (531) pada tabel dicoba untuk dirunut dan diilustrasikan kembali dalam proses penanamannya pada gambar berikut (dianggap bahwa nilai MPN/ml sama dengan ‘sel’/ml (GU/ml)). Namun perlu diingat, jumlah sel yang terambil tidak selalu seperti itu, semuanya adalah peluang dan angka yang didapat adalah angka yang kemungkinannya paling besar. Gambar 4. Ilustrasi peluang saat penanaman dan pengenceran pada metode MPN. Satu titik menggambarkan satu ‘sel’ atau growth unit. 6. Persyaratan pemilihan kombinasi tabung positif dan pelaporannya
Seperti metode hitungan cawan, di dalam MPN juga memiliki konsep pemilihan jumlah yang masuk dalam ‘kisaran hitung’ yaitu berdasarkan frekuensi kemunculan tabung positif yang sebaiknya kadangkadang tapi tidak selalu. Kombinasi tersebut dipilih dari tiga tingkat pengenceran tertentu yang disebut tiga tingkat pengenceran yang signifikan. Syarat umum yang dipakai dalam pemilihan tabung positif adalah : Pilih pengenceran yang memiliki kombinasi tabung kategori 1, jika tidak ada maka pilih kombinasi dari kategori berikutnya yang lebih rendah berturutturut (2 dan 3) (tabel 9). Atau dengan ketentuan : Pilih pengenceran terendah yang tidak semua tabung menghasilkan tabung positif. Pilih pengenceran tertinggi yang paling tidak memiliki satu tabung positif. Pilih semua pengenceran diantaranya. Kalikan setiap seri tabung yang dipilih dengan pengenceran yang diambil. Misalnya : dari inokulum 1, 0,1, 0,01, 0,001 dan 0,0001 menghasilkan kombinasi tabung positif 54310 maka dipilih 54310 bukan 54310 atau bukan 54310 sehingga didapat nilai MPN 33/g.
1 g 0,1 g 0,01 g 0,001 g 0,0001 g Kombinasi tabungpositif Nilai MPN/g
5 4 3 1 0 431 33
Tabel 5. Tabel contoh pemilihan tabung positif berdasarkan syarat yang berlaku.
Gambar 5. Bagan pemilihan tabung untuk kombinasi tabung 54310.
Tidak semua keadaan menggambarkan kondisi seperti diatas. Dimungkinkan juga mendapatkan semua seri tabung menghasilkan tabung positif dan tidak semua pengenceran menghasilkan tabung positif.
Berikut contoh penentuan tabung positif pada beberapa kasus tertentu berdasarkan interpretasi peraturan SNI 012332.1 (2006:8) dan ISO 7218 (2007:48).
Gambar 6. Bagan pemilihan tabung untuk contoh A. Dipilih kombinasi tabung 5(1/10)1(1/100)0(1/1000). Jika terdapat lebih dari satu seri pengenceran yang memiliki seluruhnya tabung positif, maka pilih pengenceran tertinggi yang menghasilkan seluruh tabung positif dan dua pengenceran berikutnya. Contoh A: 55100. Jika pada pengenceran tertentu memiliki tabung positif seluruhnya dan pengenceran sebelumnya tidak memiliki seluruh tabung positif, maka dipilih pengenceran yang memiliki semua tabung positif dan dua pengenceran berikutnya. Contoh B: 45100. Bukan diambil 451 karena pada pengenceran 1/1 tidak semua tabung positif. Jika pada tingkat pengenceran yang lebih tinggi (dari dua pengenceran berikutnya setelah pengenceran yang memiliki semua tabung positif) masih menghasilkan tabung positif maka yang dijadikan pengenceran paling tinggi yang diambil adalah tingkat pengenceran tertinggi tersebut dan dua pengenceran sebelumnya.
Contoh C: 54410. Bukan dipilih 410 karena pada 1/101 tidak seluruh tabung positif. Bukan dipilih 544 karena pada 1/103 masih terdapat satu
tabung positif. Jika pada tingkat pengenceran tertentu semua menghasilkan tabung negatif tetapi pengenceran selanjutnya masih terdapat tabung positif, maka yang dinyatakan tabung positif (dari pengenceran selanjutnya tersebut) adalah tingkat pengenceran sebelumnya (tabung positif bergeser ke pengenceran sebelumnya). Contoh D. 54401. Jika pada tingkat pengenceran tertinggi yang dilakukan masih terdapat tabung positif, maka pilih pengenceran tersebut dan dua tingkat pengenceran sebelumnya. Contoh E. 55552.
Jika tingkat pengenceran tertentu menghasilkan tabung positif sedangkan pengenceran sebelumnya tidak, maka pilih dua tingkat pengenceran sebelumnya dari pengenceran yang memiliki tabung positif tersebut.
Contoh F. 00100.
Jika pada pengenceran yang lebih tinggi dari pengenceran tertinggi yang ditentukan masih menghasilkan tabung positif, maka tambahkan tabung positif tersebut ke tingkat pengenceran sebelumnya (bergeser menambahkan jumlah tabung positif pengenceran sebelumnya).
Contoh G. 44110 dipilih menjadi 442.
Pelaporan MPN/g didapat dari angka indeks MPN yang harus disesuaikan dengan seri tabung dari mana tingkat pengenceran tersebut diambil. Misalnya pada contoh E angka indeks MPN untuk kombinasi 552 (inokulum 0,1, 0,01 dan 0,001) adalah 540 tetapi karena diambil pengenceran signifikan 0,01, 0,001 dan 0,0001 maka nilai harus dikalikan 10. Begitu pula sebaliknya untuk contoh G yang diambil dari pengenceran signifikan 1, 0,1 dan 0,01 maka nilai 47 harus dibagi 10 menjadi 4,7.
contoh 1 g 0,1 g 0,01 g 0,001 g 0,0001 g Kombinasitabung positif Angkaindeks MPN NilaiMPN/g
A 5 5 1 0 0 510 33 33 B 4 5 1 0 0 510 33 33 C 5 4 4 1 0 441 40 40 D 5 4 4 0 1 441 40 40 E 5 5 5 5 2 552 540 5400 F 0 0 1 0 0 001 1,8 0,18 G 4 4 1 1 0 442 47 4,7 Tabel 6. Tabel contoh pemilihan tabung positif pada beberapa kasus berdasarkan syarat yang berlaku. Angka indeks MPN diambil dari tabel MPN 5 seri tabung dengan inokulum 0,1 g, 0,01 g, dan 0,001 g (SNI 012332.1, 2006:8). Sedangkan contoh pemilihan tabung positif untuk 3 seri tabung dapat dilihat pada tabel berikut.
contoh 1 g 0,1 g 0,01 g 0,001 g 0,0001 g Kombinasitabung positif Angkaindeks MPN NilaiMPN/g
A 3 3 2 1 0 332 110 110
B 3 3 3 0 330 24 240
C 2 2 1 1 0 110 0,74 74
E 2 2 0 1 0 220 2,1 2,1 Tabel 7. Tabel contoh pemilihan tabung positif pada beberapa kasus berdasarkan syarat yang berlaku. Angka indeks MPN diambil dari tabel MPN 3 seri tabung dengan inokulum 1 g, 0,1 g, dan 0,01 g (ISO 7218, 2007:49). 7. Batasbatas perhitungan nilai MPN Batas batas perhitungan MPN ditentukan untuk menghasilkan data yang dapat dipercaya dan presisi. Presisi dari metode MPN dipengaruhi oleh jumlah tabung paralel tiap pengenceran dan koefisien pengencerannya.
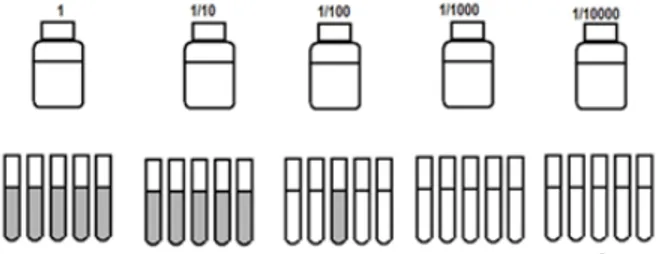
Batas praktik bawah dan atas dari prosedur MPN adalah jika hanya satu tabung dalam set deteksi (jumlah seri tabung, jumlah tabung, pengencerannya dll.) adalah positif atau negatif. Kisaran nyata dari 3 x 5 seri tabung adalah 1,8 sampai 1600 partikel / unit volume (dengan inokulum 0,1 g, 0,01 g, dan 0,001 g; tabel 11). Pada konsentrasi partikel yang sangat rendah suatu metode kuantitatif akan menjadi seperti metode
presence/absence yang menghasilkan data ya atau tidak saja ISO 1348 (2011:25).
Batas atas metode MPN dilampaui jika semua tabung dari semua pengenceran, misalnya 333 menghasilkan >1100. Namun ini tidak menggambarkan batas atas dari metode itu sendiri karena hanya kesalahan tingkat pengenceran yang dilakukan. Pengenceran yang cocok dapat disesuaikan (digeser). Oleh karena itu tidak ada batas atas yang dapat diatur karena alasan statistik sebab presisi tidak tergantung pada jumlah partikel (sel) yang dimasukkan ke dalam set deteksi. Hal ini merupakan karakteristik prosedur MPN yaitu presisinya dapat ditingkatkan dengan mengubah konfigurasi set deteksi (ISO 13483, 2011:20). 8. Menghitung MPN tanpa tabel Metode yang telah dijelaskan sebelumnya adalah metode penentuan nilai MPN berdasarkan tabel. Selain menggunakan tabel, FDA BAM apendiks 2 (2010) dan ISO 7218 (2007:46) menyatakan bahwa nilai MPN dapat dicari dengan rumus berikut (Thomas formula) : MPN/g = (∑ gj) / (∑ tjmj ∑ (tjgj)mj) (½) ∑ gj : jumlah tabung positif pada pengenceran yang dipilih ∑ tjmj : jumlah (g/ml) dari sampel dalam semua tabung pada pengenceran yang dipilih ∑ (tjgj)mj : jumlah (g/ml) dari sampel dalam tabung negatif pada pengenceran yang dipilih Contoh 1 : Didapatkan hasil kombinasi tabung (10/10, 10/10, 4/10, 2/10, 0/10) dari 10 seri tabung dengan inkokulum 0,1, 0,01, dan 0,001. Jika digunakan tabel maka dipilih (10/10, 10/10, 4/10, 2/10, 0/10) yaitu kombinasi 1042 = 70 MPN/g. Namun dalam perhitungan hanya gunakan (10/10, 10/10, 4/10, 2/10, 0/10). Gambar 7. Bagan tabung positif dan negatif 10 seri tabung untuk contoh 1. ∑ gj = 6 6 didapatkan dari 4 tabung positif +2 tabung positif ∑ tjmj = (10 x 0,01) + (10 x 0,001) = 0,11 10 adalah jumlah seri tabung 0,01 dan 0,001 adalah sampel yang dimasukkan (g) ∑ (tjgj)mj = (6 x 0,01) + (8 x 0,001) = 0,068 6 adalah jumlah tabung negatif pada pengenceran 0,01 8 adalah jumlah tabung negatif pada pengenceran 0,001 MPN/g = 6/(0,068 x 0,11) ½ = 6/0,086 = 70/g
Contoh 2 : Didapatkan hasil kombinasi tabung (5/5, 3/5, 1/5, 0/5) dari 5 seri tabung dengan inkokulum 0,1, 0,01, dan 0,001. Jika digunakan tabel maka dipilih (5/5, 3/5, 1/5, 0/5) yaitu kombinasi 531 = 110/g. Namun dalam perhitungan hanya gunakan (5/5, 3/5, 1/5, 0/5). Dengan cara yang sama maka MPN/g. = 4 / (0,024 x 0,055)1/2 = 4 / 0,0363 = 110/g 9. Aplikasi lain MPN dalam perhitungan bakteri Prinsip MPN umumnya dikenal di berbagai metode standar adalah sebagai metode fermentasi tabung seri bertingkat. Selain yang telah disebutkan
diatas konsep MPN juga diterapkan dalam perhitungan bakteri dengan nama Simplate® (BioControl Systems). Metode Simplate® menggunakan
binary detection technology untuk menghitung mikroorganisme berdasarkan pertumbuhannya pada sumuran (wells) pada permukaan cawan plastik
khusus yang telah disediakan. Kisaran perhitungan normal menggunakan 84 sumuran. Sebagian volume sampel (10 ml) yang disebarkan pada cawan akan mengisi sumuran sedangkan sisa volume sampel dapat disingkirkan di kapas penyerap yang terletak di bagian pinggir cawan. Pertumbuhan yang terdapat di sumuran yang diindikasikan perubahan warna (tergantung media spesifik yang digunakan) akan menggambarkan jumlah mikroorganisme pada sampel. Hasil yang diperoleh adalah adanya sumur positif atau negatif. Jumlah angka positif kemudian dibandingkan dengan tabel sehingga diperoleh nilai CFU/g(ml) sampel. Pada prinsipnya metode ini tetap mengadopsi perhitungan kemungkinan dari metode MPN yaitu positif atau negatifnya setiap unit fermentasi. Peningkatan jumlah unit (sumuran) tersebut tentu dapat mempertinggi akurasi dan presisi metode ini. Data akhir juga bukan dilaporkan sebagai MPN/ml(g) tapi diubah menjadi CFU/ml(g) walaupun dalam praktiknya tidak akan dijumpai perhitungan koloni pada cawan. Penggunaan metode ini telah divalidasi, contoh salah satunya tedapat di AOAC OM 2005.03 (AOAC,2005 Ch.17, p.36) Detection and Confirmed Quantitation of Coliform and E.coli in Foods. SimPlate Coliform and E.coli Color Indicator. Selain itu, TEMPO® (bioMérieux) juga menggunakan MPN dalam memperoleh hasil perhitungannya. MPN terotomatisasi ini terdiri dari vial yang mengandung medium pada sebuah kartu. Kartu mengandung tiga seri (set) sumuran (wells/vial) yaitu kecil, menengah dan besar masingmasing 16 sumuran dan semua berjumlah total 48 sumuran. Setiap seri diinokulasikan sampel dengan perbedaan setiap setnya 1/10, seperti halnya metode 3 seri tabung. Artinya metode ini menggunakan seri ‘tabung’ lebih banyak yaitu 161616 yang tentunya dapat meningkatkan akurasi dan presisi hasil perhitungannya. 10. Perhitungan MPN secara otomatis Nilai MPN jika dihitung secara manual akan sangat merepotkan. Oleh karena itu dibangun suatu perhitungan MPN yang telah diprogram pada suatu perangkat lunak. Food and Drug Administration (FDA) menyediakan file perhitungan MPN yang dapat diunduh di: (http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm109656.htm). Beberapa pehitungan otomatis lainnya dengan nama MPN
Calculator juga dapat di temui di alamat : (http://www.i2workout.com/mcuriale/mpn/). Environmental Protection Agency (EPA) juga membangun
software untuk perhitungan MPN (MPN Calculator Version 3.0) dengan mempelajari manual pengoperasian dan instalasinya di alamat :
(http://www.epa.gov/microbes/MPN_User_Manualvs3.pdf). Perhitungan MPN otomatis ini tentu dapat meniadakan penggunaan tabel dan kombinasi tabung yang tidak terdapat pada tabel (kombinasi jarang, misalnya 103) juga dapat diketahui melalui perhitungan ini. Namun perlu diketahui bahwa sebagian besar metode standar umum MPN (misalnya, FDA BAM, AOAC, ISO, SNI) sampai sekarang masih menggunakan tabel MPN dalam tahap prosedurnya. Gambar 8. Tampilan perhitungan MPN secara otomatis Spreadsheet MPN FDA BAM, Spreadsheet MPN Calculator, dan software MPN Calculator (VB6 version). Contoh perhitungan 3 seri tabung (inokulum 0,1, 0,01 dan 0,001) dengan kombinasi 321.
11. Hubungan MPN dan CFU CFU dan MPN adalah satuan yang asalnya perhitungannya terpisah walaupun menggambarkan tujuan yang sama yaitu memperkirakan jumlah sel sebenarnya. Kedua satuan ini tidak berhubungan langsung, yang artinya tidak selalu x CFU/ml adalah x MPN/ml walaupun data antara CFU/ml dan MPN/ml menunjukkan korelasi positif. 11.1. Perbandingan antara MPN dan CFU Berikut adalah beberapa hasil perbandingan antara metode hitungan cawan (spread/pour plate pada media agar selektif atau membran filtrasi) dan metode fermentasi tabung berseri/MPN yang diambil dari beberapa publikasi penelitian sebelumnya.
Hildebrandt dan Schott (2001:453) melaporkan bahwa metode MPN menghasilkan data positif Listeria spp. dan L.monocytgenes lebih banyak dibandingkan dengan metode hitungan cawan sehingga dapat disimpulkan bahwa MPN lebih sensitif dibanding CFU dalam uji Listeria. Namun metode hitungan cawan lebih dipilih digunakan secara rutin karena memiliki produktivitas yang sedikit lebih baik dan variasi hasil lebih kecil. meskipun begitu metode MPN dapat dipilih untuk studi epidemiologi karena memiliki detection limit (LOD) yang jauh lebih rendah dibanding hitungan cawan yaitu sekitar 66% dari batas deteksi hitungan cawan.
Paulsen et al. (2008:376) menyatakan bahwa metode MPN (terotomatisasi) menghasilkan data ratarata lebih rendah dibandingkan hitungan cawan dengan metode yang bersumber dari ISO dan hitungan cawan dengan petrifilm untuk menghitung kelompok Enterobacteiaceae. Jadi dapat disimpulkan bahwa metode hitungan cawan lebih banyak mendeteksi Enterobacteiaceae (lebih sensitif) daripada MPN.
Cho et al. (2010:846) menyebutkan bahwa hasil perhitungan E.coli dalam menentukan kualitas air menggunakan metode MPN menghasilkan konsentrasi lebih besar dibanding hitungan cawan. Namun berbeda dengan perhitungan Enterococci yang menghasilkan metode MPN lebih rendah daripada hitungan cawan.
Kodaka et al. (2006:115) telah membuktikan bahwa metode hitungan cawan dengan penanaman pada dry rehydratable film media (Compact Dry) tidak memiliki variasi/perbedaan yang signifikan jika dibandingkan dengan metode MPN yang bersumber dari AOAC untuk menguji bakteri Coliform pada daging mentah. Curiale et al. (1991:635) menyatakan bahwa metode penanaman pada dry rehydratable film mempunyai tingkat reprodusibilitas dan repeatabilitas yang sama atau lebih baik jika dibandingkan dengan metode MPN yang bersumber dari AOAC untuk menghitung Coliform dan E.coli. Penelitian ini dilakukan pada berbagai sampel pangan yang diuji oleh 14 laboratorium dalam rangka studi kolaboratif untuk mengadopsi metode ini menjadi metode resmi AOAC. Prosedur MPN mempunyai tingkat keberagaman (variable) data lebih besar dibandingkan dengan hitungan cawan menggunakan membran filtrasi untuk menganalisa jumlah Coliform sehingga metode MPN menghasilkan jumlah ratarata Coliform lebih besar daripada metode hitungan cawan. Keberagaman tersebut tidak ditentukan oleh kesalahan analis (human error) tetapi lebih dipengaruhi oleh dasar perhitungan metode MPN yaitu probabilitas (Gronewold dan Wolpert, 2010:3327). Pada analisa perhitungan bakteri rumen didapatkan data ratarata jumlah bakteri rumen (pemfermentasi xylane, starch dan pectin) cenderung sama antara metode CFU maupun MPN. Namun metode hitungan cawan memberikan variabel yang lebih kecil yaitu antara 45 kali dari metode MPN sehingga nilai CFU memberikan presisi data yang lebih baik (Kajikawa et al. 1990:810). Wohlsen et al. (2006:350) telah melakukan perbandingan berbagai metode resmi untuk mengevaluasi setiap metodenya. Metodemetode yang diuji adalah spread dan pour plate (standard plate count), filtrasi membran, MPN, dan petrifilm untuk menghitung E.coli dan Coliform lain. Dari studi tersebut dihasilkan metode yang paling baik dan konsisten adalah metode pour plate dan metode petrifilm. Metode lainnya mengindikasikan tingginya keberagaman data antar perulangan dan rendahnya recovery.
Beberapa literatur diatas menyebutkan hitungan cawan (CFU) menghasilkan data yang lebih presisi (Kajikawa et al. (1990:810), Wohlsen et al. (2006:350) dan Gronewold dan Wolpert (2010:3327)). Kemungkinan kurangnya presisi pada MPN ini disebabkan oleh terkumpulnya hasil pada tabel MPN dengan pembulatan (dua angka signifikan) yang cukup besar dibandingkan perhitungan koloni. Variabilitas data metode MPN yang lebih besar dapat diperparah jika kehomogenan sampel tidak diperhatikan dengan baik (sel target masih menggerombol dalam partikel besar sampel) atau adanya tabung positif palsu. Gambar 9. Grafik diatas dapat menjelaskan bahwa metode MPN memiliki keberagaman data yang lebih besar dan hasil ratarata MPN lebih tinggi dibanding CFU sehingga menjadikan presisi metode MPN lebih rendah. Grafik A adalah data hasil metode MPN (MPN/100ml) yang dibandingkan dengan data jumlah mikroorganisme target yang sebenarnya sedangkan grafik B adalah untuk metode filtrasi membran (CFU/100 ml) (Gronewold dan Wolpert, 2008:3329). 11.2 Perbedaan antara MPN dan CFU
Perbedaan antara CFU dan MPN dapat diringkas pada tabel berikut.
Pembeda MPN CFU (hitungan cawan)
Objek yang dihitung Tabung positif Setiap koloni
Jenis metode Semi kuantitatif Kuantitatif
Metode yang dilingkupi Metode MPN : 3 seri, 5 seri, 8 seri, atau 10 seri tabung. Metode MPN terotomatisasi. Spread/pour plate pada media agar, membran filtrasi, penanaman pada dry rehydratable film, spiral plate count. Dasar perhitungan Teori probabilitas berdasarkan positifnegatif. Presisi kurang. Satu koloni menggambarkan satu “sel” (unit tumbuh). Lebih presisi. Dasar pemilihan
pengenceran Frekuensi tabung positif yangkadangkadang tetapi tidak selalu. Kisaran jumlah koloni yang memenuhi syarat statistik (25250, 30300, <150 dll.) Media pertumbuhan Broth/cair pada tabung. lebih banyak membutuhkan media. Agar/padat pada cawan. lebih sedikit membutuhkan media. Mikroorganisme target Sel bersifat terpisah seperti Coliform, E.coli, enterococci, S.aureus dan Listeria. Mikroorganisme target yang terluka dapat lebih terrecovery Semua jenis mikroorganisme tergantung media selektif yang dipakai. Penyebab kesalahan atau
positif palsu Bakteri non target yang memilikiciri metabolisme yang sama. Koloni tidak terhitung atauterhitung ganda, antagonisme, kompetisi. Inokulum 10 ml (double strength), 1 ml (single strength) 1 ml (pour plate), 0,1 ml (spread plate) 100 ml (membrane filter) Pengaruh waktu inkubasi Tidak mengubah hasil jika diinkubasi melebihi waktu yang ditentukan. Koloni dapat terus tumbuh jika terlalu lama diinkubasi. Tabel 8. Ringkasan perbedaan MPN dan hitungan cawan (CFU). 11.3 Pengkonversian satuan MPN ke CFU
Apakah nilai MPN dapat diubah menjadi CFU? Cukup sulit untuk menjawab pertanyaan tersebut karena terbatasnya sumber. Berikut adalah penjelasan yang diperoleh dari beberapa referensi.
Cho et al. (2010:846) telah mempelajari dan mengevaluasi mengenai korelasi metode MPN (colilert dan enterolert) dan CFU (mE agar dan mTEC agar) untuk analisa E.coli dan Enterococci yang diukur pada setiap musim yang berbeda dengan membuat persamaan regresi linier. Hasil uji perhitungan kemudian dianalisa dan dikelompokkan berdasarkan musim pengambilan sampel. Bentuk persamaan dasar tersebut adalah MPNestimates = a + b x CFUestimates, atau bentuk persamaan lainnya yaitu MPNestimates = a + CFUbestimates dimana a dan b adalah koefisien regresi. Hasil pengolahan data menunjukkan bahwa MPN dan CFU mempunyai korelasi positif dengan nilai a dan b berbedabeda di setiap musimnya.
Begitu pula dengan nilai r2 masingmasing persamaan di setiap musimnya. Namun studi ini tidak menjelaskan mengenai suatu rumus universal
untuk mengubah satuan MPN ke CFU.
Pada metode AOAC 983.25 (2005:40) untuk uji total Coliform, Fecal Coliform dan E. coli di pangan menggunakan metode filtrasi membran (Hydrophobic Grid Membrane Filter) disebutkan bahwa hasil akhir jumlah transek membran filter yang ditumbuhi koloni target dapat diubah
menjadi MPN dengan rumus MPN = {N loge [N/(Nx)]}, dimana N adalah jumah total transek (kotak) pada membran filter dan x adalah jumlah
transek yang terdapat koloni bakteri target (transek positif). Cara ini mengindikasikan bahwa dari sebaran koloni pada transek membran yang seharusnya dinyatakan sebagai CFU/ml dapat diubah ke MPN/ml. Namun rumus ini hanya telah tervalidasi untuk metode HGMF sesuai rujukan referensi tersebut. Selain itu ditemukan juga rumus yang sama dengan diatas dan dilengkapi tabel pengkonversinya pada apendiks C untuk metode penghitungan Coliform menggunakan metode HGMF (MFHPB17) yang diterbitkan badan kesehatan dan pangan kanada (Health Product and Food Branch, Canada).
3M (2004) merilis tabel dan rumus konversi untuk data yang diperoleh menggunakan petrifilm EC plate dalam analisa E.coli dan Coliform. Disebutkan bahwa satuan MPN dapat diubah ke CFU atau sebaliknya dengan rumus (log CFU) = 0,37 + 0,9 x (log MPN). Namun rumus ini juga tidak dapat merepresentasikan semua keadaan dan jenis sampel, dan diperlukan verifikasi lebih lanjut untuk aplikasi yang lebih spesifik. Rumus ini diperoleh saat studi prekolaboratif AOAC dengan menggunakan sampel pangan. Sedangkan metode penggunaan petrifilm (CFU) ini sendiri telah tervalidasi oleh AOAC (AOAC, OM 991.14) yang digunakan sebagai rujukan pengenalan metode dalam rumus tersebut. Namun sama sekali tidak dicantumkan rumus konversi ini dalam metode resmi AOAC 991.14 yang telah diterbitkan, begitu pula dengan jurnal sumber metode tersebut (J.AOAC vol.74, p.635). Jadi rumus konversi diatas tidak valid jika digunakan untuk semua sampel dan semua kondisi.
perubahan itu dengan suatu rumus yang telah tervalidasi. Jika memang antara CFU dan MPN dapat diubah dengan hasil yang pasti, maka akan dapat ditemukan rumus pengkonversinya dengan mudah di referensi metode resmi internasional. Baik MPN atau CFU sebaiknya diperoleh secara terpisah sesuai metodenya masingmasing. Seperti analogi menembak dengan busur panah tidak dapat disamakan dan diubah seperti menembak dengan pistol mengenai tingkat akurasi dan presisinya, karena setiap cara memiliki kelebihan dan kekurangannya sendiri.
12. Kesalahan umum MPN
12.1. Kombinasi seri tabung diluar tabel
Berdasarkan prinsip pengenceran pada MPN maka seharusnya atau sebaiknya jumlah tabung positif pada pengenceran lebih pekat akan semakin banyak (1/10>1/100>1/1000), misalnya 531. Hal ini dikarenakan setiap pengenceraan mengurangi jumlah mikroorgansime target dan akibatnya semakin kecil kesempatannya untuk membuat tabung menjadi positif. Namun seringkali hasil yang didapat tidak sesuai dengan logika peluang, seperti kombinasi 534 yang menghasilkan nilai 210. Bisa saja banyak sel tidak sengaja terambil dan memperbanyak tabung positif di pengenceran selanjutnya atau homogenisasi tidak berlangsung sempurna. USDA/FSIS (2008:2) menyarankan untuk mengulangi analisa jika diperoleh kombinasi tabung yang tidak terdapat dalam tabel (misalnya untuk 3 seri tabung : 023, 123, 213 dll.). Diasumsikan bahwa hasil tersebut mencurigakan karena kontaminasi atau kesalahan praktik lainnya.
Dalam tabel MPN dalam metode MPN yang diterbitkan AOAC (AOAC OM 966.24, 2005:Ch.17,p5) mengenai kombinasi tabung seperti ini diberikan catatan khusus. Misalnya untuk kombinasi 012, 132, 203 dll. Catatan ini menyarankan bahwa terdapat aspek ketidakemungkinan yang tinggi jika mendapatkan kombinasi ini yang mengindikasikan bahwa nilai MPN yang diperoleh dapat lebih rendah dibandingkan konsentrasi sebenarnya.
ISO 7218 (2007:61) menjabarkan tentang pembagian kategori kemungkinan nilai MPN berdasarkan kombinasi tabung positif dari tabel MPN. Nilai MPN yang diperoleh dibagi menjadi empat kategori yaitu kategori 1, kategori 2, kategori 3 dan kategori 0. Kategori 1 memiliki kemungkinan paling tinggi untuk diperoleh, berturutturut menurun sampai kategori 0. Disarankan untuk ditentukan terlebih dahulu kategori mana yang dinyatakan diterima (acceptable), misalnya hanya kategori 1, 1 dan 2 atau 1,2,dan 3. Jika hasil MPN digunakan untuk menentukan keputusan yang lebih penting maka sebaiknya dipakai kategori 1 atau 1 dan 2 saja sebagai batas keberterimaan. Sedangkan kategori 0 dapat dipertimbangkan sebagai nilai yang mencurigakan. Tedapat pola mengenai kombinasi tabung dan pengelompokan kategorinya. Semakin baik kategori nilai MPN maka kombinasi tabung positif yang terjadi akan semakin logis (mendekati kenyataan). 12.2. Tabung negatif palsu dan positif palsu Tabung negatif palsu mungkin terjadi jika mikroorganisme target yang terdapat pada tabung gagal menghasilkan indikasi yang disyaratkan metode untuk dinyatakan sebagai tabung positif. Beberapa sebab yang dapat diidentifikasi diantaranya adalah : (1) Terdapat bahan yang dapat mematikan dan menghambat mikroorganisme atau berinterferensi dengan media, misalnya Chlorine pada air. (2) Gagalnya uji penegas dan pelengkap dalam mengidentifikasi mikroorganisme terkait karena tidak semua (100%) strain mampu dideteksi metabolismenya dengan prosedur tertentu sehingga tabung penduga yang semula positif dinyatakan menjadi negatif, misalnya pada metode ISO 7251: 2005 terdapat catatan bahwa strain patogen E.coli tidak mampu tumbuh pada suhu 44°C saat dikonfirmasi dengan pada EC broth. (3) Tabung durham dilingkupi atau tenggelam oleh substrat sampel padat dari homogenat sampel sehingga gas tidak mampu terperangkap. Disarankan tetap melihat pembentukan gas dengan menggoyang tabung sehingga timbul buih (effervescence).
Sedangkan tabung positif palsu dapat disebabkan oleh (1) Terjadinya tabung positif oleh mikroorganisme non target, misalnya menurut Hussong et
al. (1981:35) beberapa strain Bacillus spp. dan Aeromonas spp. mampu pada membentuk gas pada tahap penduga. Oleh karena itu pellicle
(substansi lengket bakteri; film) tidak boleh terambil saat diinokulasikan lagi pada tahap penegas dan Coliform umumnya tidak membentuk pellicle. (2) Kontaminasi oleh bakteri lain termasuk oleh isolat kontrol uji, sehingga disarankan penanaman isolat kontrol dilakukan setelah analisa. (3) Kontaminasi silang dari tabung yang lain. Oleh karena itu lebih tepat menggunakan inoculation stick sekali buang saat uji penegas jika pembakaran jarum inokulum berkalikali dirasa kurang menjamin sterilisasi. (4) Masih terdapatnya udara pada tabung durham karena kesalahan preparasi media. Jika terdapat udara pada durham dan tidak timbul buih maka umumnya adalah reaksi negatif. 13. Tabel MPN Tabel MPN berbagai seri tabung dapat dilihat pada tautan berikut : http://mikrobiologipraktik.com/tabelmpn/ Disusun oleh : Indra Pradhika, 2014 Referensi :
AOAC (Asociation of Official Analytical Chemistry). 2005. AOAC OM 966.24. Coliform Group and Escherichia coli Microbiological (MPN) Method. AOAC Official Method of Analysis Microbiological Methods Ch.17:5.
AOAC. 2005. AOAC OM 983.25. Total Coliforms, Fecal Coliforms and E. coli in Foods, Hydrophobic Grid Membrane Filter Method. AOAC Official Method of Analysis Microbiological Methods Ch.17:40.
AOAC. 2005. AOAC OM 991.14. Coliform and Escherichia coli Count in Food, Dry Rehydratable Film (PetrifilmTM E.coli/Coliform Count Plate
TM and PetrifilmTM Coliform Count Plate TM) Methods. AOAC Official Method of Analysis Microbiological Methods Ch.17:32.
AOAC. 2005. AOAC OM 2005.03. Detection and Confirmed Quantitation of Coliform and E.coli in Foods. SimPlate Coliform and E.coli Color Indicator. AOAC Official Method of Analysis Microbiological Methods Ch.17:36.
APHA (American Public Health Association), AWWA (American Water Works Association) dan WEF (Water Environtment Federation). 2006. Standard Method for Examination of Water and Wastewater 9221 : Multipletube fermentation technique for members of the Coliform group. Brown, AE, 2001. Benson : Microbiological Application, Laboratory Manual in General Microbiology, Ed ke8. New York: Mc Graw Hill Companies.
produk perikanan.
Çakir, I, HB Doğan, E Başpinar, F Kiven, dan AK Halkman. 2002. The need for confirmation in Coliform and E.coli enumeration in food. Turk J Vet & Ani Sci 26:10491053.
Cho, KH, Han D, Park Y, Lee SW, Cha SM, Kang JH, dan Kim JH. 2010. Evaluation of the relationship between two different methods for enumeration fecal indicator bacteria: colonyforming unit and most probable number. J Env Sci (China) 22(6):846850.
Curiale, MS, T Sons, D McIver, JS McCallister, B Hasley, D Roblee, dan TC Fox. 1991. Dry rehydratable film for enumeration total Coliform and
Escherichia coli in foods : collaborative study. JAOAC Intl 74(4):635648.
FDA (Food and Drug Administration). 2001. Bacteriological Analytical Manual Appendix 2: Most probable number from serial dilution. FDA. 2002. Bacteriological Analytical Manual Chapter 4: Enumeration of Escherichia coli and the Coliform bacteria.
Hildebrandt, G dan W Schott. 2001. Comparison of direct colony count methods and the MPNmethod for quantitative detection of Listeria in model and field conditions. Berliner und Münchener tierärztliche Wochenschrift 114(1112):45364. Hussong, D, JM Damaré, RM Weiner, dan RR Colwell. 1981. Bacteria associated with falsepositive mostprobablenumber Coliform test results for shellfish and estuaries. Appl Environ Microbiol 41(1): 35–45. ISO (International Standard Organization). 2001. ISO/TR 13843:2001. Water quality – guidance on validation of microbiological methods. ISO. 2005. ISO 7251:2005. Microbiology of food and animal feeding stuffs – horizontal methods for the detection and enumeration of presumptive Escherichia coli – most probable number techniques. ISO. 2006. ISO 4831:2006. Microbiology of food and animal feeding stuffs – horizontal methods for the detection and enumeration of Coliforms – most probable number techniques.
ISO. 2007. ISO 7218:2007(E) Microbiology of food and animal feeding stuffs – general requirements and guidance for microbiological examinations.
Gronewold, AD dan RL Wolpert. 2008. Modeling the relationship between most probable number (MPN) and colonyforming unit (CFU) estimates of fecal coliform concentration. Water Res 42(13): 33273334.
Kajikawa, H, Y Nagasaki dan A Abe. 1990. Comparison between colony counting method and most probable number method in enumeration of rumen bacteria fermenting specific substrates. Jpn. Journal Zootech. Sci 61(9): 810814.
Kodaka, H, H Teramura, T Nirazuka, S Mizuochi. 2006. Comparison of the compact dry CF with the most probable number method (AOAC Official Method 966.24) for enumeration of Coliform bacteria in raw meats. J AOAC Intl 89(1): 115126.
Oblinger JL dan JA Koburger. 1975. Understanding and teaching the most probable number technique. J Milk Food Technol 38(9): 540545. Paulsen, P, C Borgetti, E Schopf, dan FJM Smulders. 2008. Enumeration of Enterobacteriaceae in various foods with a new automated most probablenumber method compared with petrifilm and international organization for standardization procedures. J Food Prot 71(2): 376.
Sutton, Scott. 2006. Counting Colonies. Pharmaceutical Microbiology Forum Newsletter. 12(9).
http://www.microbiol.org/white.papers/WP.count.colony.htm. [2 Oktober 2009].
UNEP (United Nations Environment Programme) / WHO (World Health Organization).1996 Water quality monitoring – a practical guide to the design and implementation of freshwater quality studies and monitoring programmes, Chapter 10 – Microbiological analyses.
USDA (United States Departement of Agriculture) / FSIS (Food Safety and Inspection Service). 2008. Most probable number procedure and tables. Wohlsen, T, J Bates, G Vesey, WA Robinson dan M Katouli. 2006. Evaluation of the methods for enumerating coliform bacteria from water samples using precise reference standards. J compilation 2006 The Society for App Microbiol, Letters in App Microbiol 42: 350–356.
3M. 2004. 3M petrifilm E. coli count plate results from most probable number (MPN) results conversion table™. http://www.microlabscr.com/resources/MPN+to+PEC+Conversion+Table+Dec03.pdf. [3 Januari 2013].
About indra pradhika
beginner microbiologist View all posts by indra pradhika Tags: No tags Categories: Most Probable NumberYou can leave a response, or trackback from your own site.
Leave a Reply
Your email address will not be published. Name Email Website Uji Turing Publik Terotomatisasi Penuh untuk membedakan Komputer dan Manusia *two × = 2 Comment You may use these HTML tags and attributes: <a href="" title=""> <abbr title=""> <acronym title=""> <b> <blockquote cite=""> <cite> <code> <del datetime=""> <em> <i> <q cite=""> <strike> <strong> Post Comment
Mesin Pencari
Untuk Pembaca
Situs ini didedikasikan untuk mempermudah pendidikan di Indonesia dalam bidang ilmu mikrobiologi dan ditujukan untuk mahasiswa, analis dan profesi terkait lainnya. Situs ini dibangun secara profesional dan berisi materi yang lengkap dan valid sehingga dapat meningkatkan kepercayaan pembaca terhadap konten yang disuguhkan. Jika terdapat pertanyaan, dapat diajukan di kolom komentar. Diharapkan untuk para ahli dapat memberi saran jika menemukan kesalahan pada web ini. Semoga bermanfaat. email:[email protected]Daftar Isi Situs
Kata Pengantar Tentang Penulis Sterilisasi Media Pertumbuhan Mikroorganisme Most Probable Number (MPN) Tabel MPNKomentar Terbaru
indra pradhika on Tabel MPN ade on Tabel MPN puspa on Sterilisasi indra pradhika on Tabel MPN geo on Tabel MPNsurvey
Apakah latar belakang Anda ? Biologi umum Bakteriologi Bioteknologi / Genetika Farmasi Pertanian Peternakan Teknologi pangan Kedokteran / Kesehatan kimia lainnya Vote View Results Apakah profesi Anda ? pelajar mahasiswa sarjana mahasiswa pascasarjana guru / dosen peneliti / asisten peneliti analis / laboran QA / QC operatorlainnya Vote View Results
tautan Metode Standard Mikrobiologi
FDA BAM microbiology methods ISO/TC 147/SC 4 – Microbiological methods ISO/TC 34/SC 9 – Microbiology Official Methods of Analysis of AOAC INTERNATIONAL Standard Methods APHA AWWA WEFtautan situs bidang ilmu lain
chemistry.org sicencebiotech.nethistat
kami mengucapkan :
atas kunjungan anda
Mikrobiologi Praktik
Theme by W3blog