SINTESIS ANTIGEN AFB
1-BSA DAN KONJUGASI
ANTIBODI ANTI AFB
1-BSA DENGAN NANOPARTIKEL
EMAS SEBAGAI PEREAKSI IMUNOSTRIP UNTUK
MENDETEKSI AFLATOKSIN B
1ITA KRISSANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Sintesis Antigen AFB1-BSA dan Konjugasi Antibodi Anti AFB1-BSA dengan Nanopartikel Emas sebagai
Pereaksi Imunostrip untuk Mendeteksi Aflatoksin B1 adalah benar karya saya
dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Ita Krissanti
RINGKASAN
ITA KRISSANTI. Sintesis Antigen AFB1-BSA dan Konjugasi Antibodi Anti
AFB1-BSA dengan Nanopartikel Emas sebagai Pereaksi Imunostrip untuk
Mendeteksi Aflatoksin B1. Dibimbing oleh AGUSTIN INDRAWATI dan
ROMSYAH MARYAM.
Aflatoksin B1 (AFB1) adalah mikotoksin yang berasal dari kapang Aspergillus spp. dan merupakan senyawa toksin paling potensial sebagai karsinogen, teratogen
dan agen imunosupresif sehingga berbahaya bagi kesehatan manusia maupun hewan. Toksin AFB1sering mengkontaminasi berbagai komoditas pertanian yang menjadi
bahan pakan dan pangan yang dikonsumsi oleh hewan atau manusia. Hewan ternak yang mengkonsumsi pakan terkontaminasi AFB1 dapat terganggu kesehatan
dan produktivitasnya serta meninggalkan residu aflatoksin pada produk dari hewan tersebut seperti susu dan daging. Residu aflatoksin pada hasil ternak dapat membahayakan kesehatan manusia bila hasil ternak tersebut dikonsumsi. Teknik deteksi yang handal untuk menentukan kualitas dan keamanan bahan pangan dan pakan sangat diperlukan sebagai upaya pengawasan kontaminasi AFB1 pada bahan
pangan dan pakan. Metode deteksi terhadap AFB1 saat ini umumnya hanya dapat
dilakukan di laboratorium seperti TLC, ELISA, dan HPLC. Metode uji yang sederhana, ekonomis, cepat, mudah, dan dapat digunakan terutama di lapangan seperti imunostrip sangat diperlukan untuk deteksi dini cemaran AFB1 pada bahan
pangan dan pakan. Penelitian ini bertujuan untuk mensintesis antigen aflatoksin B1- Bovine Serum Albumin (AFB1-BSA) dan konjugasi antibodi anti AFB1-BSA
terhadap nanopartikel emas sebagai pereaki untuk imunostrip.
Penelitian ini meliputi sintesis dan karakterisasi antigen AFB1-BSA,
purifikasi antibodi anti AFB1-BSA dan konjugasi antibodi anti AFB1-BSA dengan
nanopartikel emas. Antigen AFB1-BSA disintesis dengan mereaksikan AFB1
murni dan bovine serum albumin (BSA) melalui reaksi carboxymethyloxime (CMO) sebagai reaksi penghubung. Keberadaan AFB1-CMO dideteksi dengan
Thin Layer Chromatography (TLC). Kemudian Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS PAGE) digunakan untuk mengidentifikasi antigen AFB1-BSA dan antibodi anti AFB1-BSA. Antibodi anti
AFB1-BSA diuji respon antibodinya melalui reaksi dengan antigen AFB1-BSA
secara dot blot immunoassay (DBIA). Antibodi kemudian dipurifikasi menggunakan kolom HiTrap protein A HP. Kadar antibodi dihitung dengan menggunakan spektrofotometer pada panjang gelombang 280 nm dan dikarakterisasi menggunakan SDS-PAGE. Selanjutnya antibodi anti AFB1-BSA dikonjugasikan dengan nanopartikel emas. Seluruh pereaksi yang terdiri dari antigen AFB1-BSA, konjugat antibodi anti AFB1-BSA dengan nanopartikel emas,
dan IgG anti rabbit digunakan untuk imunostrip serta ditentukan kondisi optimumnya.
Hasil penelitian menunjukan AFB1-CMO tampak sebagai noktah biru
dengan Rf= 0,45 pada uji TLC dan dibandingkan dengan AFB1 baku. Sementara
antigen AFB1-BSA menunjukan pita protein tunggal berukuran 72 kDa pada
analisis SDS PAGE. Antibodi anti AFB1 bereaksi spesifik terhadap antigen AFB1
-BSA yang ditunjukkan dengan noktah cokelat dengan DBIA. Antibodi tersebut menunjukan pita protein tunggal berukuran 53,52 kDa. Konjugasi antibodi anti
AFB1-BSA dengan nanopartikel emas menghasilkan warna merah keunguan yang
dapat digunakan sebagai penanda untuk mendeteksi AFB1 pada imunostrip.
Komposisi optimum imunostrip tercapai pada konsentrasi antigen AFB1-BSA
1-1,5 mg/ml, IgG anti rabbit 0,1 mg/ml, dan konjugat antibodi anti AFB1-BSA
dengan nanopartikel emas pada luasan 0,5x0,4 cm² yang ditandai dengan terbentuknya 2 garis berwarna merah keunguan pada daerah uji dan kontrol. Berdasarkan hal tersebut dapat disimpulkan bahwa pereaksi-pereaksi yang telah dihasilkan dari penelitian ini dapat digunakan untuk pengembangan imunostrip untuk mendeteksi AFB1.
SUMMARY
ITA KRISSANTI. Synthesis of AFB1-BSA Antigen and Conjugation of Antibody
against AFB1-BSA to Gold Nanoparticle as the Immunostrip Test Reagents for
Aflatoxin B1 Detection. Supervised by AGUSTIN INDRAWATI and ROMSYAH
MARYAM.
Aflatoxin B1 (AFB1) is mycotoxin produced by Aspergillus spp. This toxic
compound is the most potential substance as carcinogenic, teratogenic and immunosuppressive agent so it could be dangerous to humans and animals health. This toxin often contaminates a great variety of agriculture product include foods and animal feeds that will be dangerous if consumed by humans or animals. Animals that has been feeding by contaminated AFB1 not only can get adversely
affect for its health and productivity but also leaving residue in their product such as milk and meat. Aflatoxin residue in animal product cause harmful effects to humans if transmitted into foods. A reliable detection techniques that use to determine the quality and safety of food and animal feeds is really needed for monitoring AFB1 contamination. Generally, detection method for AFB1 can only
be achieved in the laboratory like TLC, ELISA and HPLC. The detection method which is more cheap, fast, and easy to be used in the field as immunostrip is really needed for screening AFB1 contamination on food and animal feeds. The
aims of this study were to perform synthesis of AFB1-BSA antigen and
conjugation of antibody against AFB1-BSA to gold nanoparticle as immunostrip
test reagents.
The study were conducted to synthesized and characterization antigens of AFB1-BSA, purify the antibody against AFB1-BSA and conjugated the antibody
against AFB1-BSA with nanogold particles. The antigen was synthesized by
carboxymethyloxime (CMO) linker reaction. The AFB1-CMO was identified on
Thin Layer Chromatography (TLC) and AFB1-BSA was characterized using Sodium
Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS PAGE), as well as the antibody against AFB1. The specific reaction between the antibody and the antigen
was identified by Dot Blot Immunoassay (DBIA). Then the antibodies purified by HiTrap protein A HP column. Antibody concentration was measured by spektrophotometer at 280 nm and was characterized by SDS-PAGE method. The antibody was conjugated to nanogold particles. All reagent consist of AFB1-BSA
antigen, antibody against AFB1-BSA with nanogold particles conjugate, and IgG
anti rabbit were used to immunostrip and the optimal concentration was determined.
The results of the study showed the AFB1-CMO formation indicated as a
blue spot at 0.45 retention factor (Rf) on TLC and compared with AFB1 standard.
The AFB1-BSA antigen revealed as a single band protein at about 72 kDa
molecular weight on the SDS PAGE. The antibody reacted specifically to antigen which showed as a brown spot on DBIA. The antibody also showed a single band protein at about 53.52 kDa molecular weight. Conjugation of antibody against AFB1-BSA to nanogold particles resulted in the formation of reddish purple
compound which can be used for the detection of AFB1 on immunostrip. The
optimum composition achieved in concentration of AFB1-BSA 1-1.5 mg/ml, IgG
conjugate in 0.5x0.4 cm² area characterized by the establishment of two reddish purple lines in the test and control zone. In conclusion, the reagents of immunostrip can be used for the development of immunostrip to detect AFB1.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
SINTESIS ANTIGEN AFB
1-BSA DAN KONJUGASI
ANTIBODI ANTI AFB
1-BSA DENGAN NANOPARTIKEL
EMAS SEBAGAI PEREAKSI IMUNOSTRIP UNTUK
MENDETEKSI AFLATOKSIN B
1SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Dengan rasa syukur Alhamdulillah penulis dapat menyelesaikan penulisan tesis yang berjudul Sintesis Antigen AFB1-BSA dan Konjugasi Antibodi Anti
AFB1-BSA dengan Nanopartikel Emas sebagai Pereaksi Imunostrip untuk
Mendeteksi Aflatoksin B1. Penulisan tesis ini adalah hasil penelitian yang
dilakukan di Balai Besar Penelitian Veteriner Bogor.
Ucapan terima kasih penulis sampaikan kepada komisi pembimbing Dr. Drh. Agustin Indrawati, M.Biomed serta Dr. Dra. Romsyah Maryam, M.Med.Sc. yang senantiasa ikhlas membimbing dan mendampingi penulis dalam penelitian dan penulisan karya ilmiah ini. Terima kasih disampaikan kepada Kepala BB Litvet dan Ketua Kelti Lab. Toksikologi yang telah memberi izin penulis untuk terlibat dalam penelitian dan menggunakan sarana serta fasilitas di Laboratorium Toksikologi BB Litvet. Penulis sampaikan terima kasih kepada semua staf peneliti dan teknisi Laboratorium Toksikologi BB Litvet Bogor atas semua bantuan dan kerja samanya selama penelitian. Terima kasih tak terhingga juga penulis sampaikan kepada Prof. Dr. Drh. Retno Damayanti Soejoedono, MS. atas segala pelajaran, dorongan dan bantuan yang diberikan kepada penulis dan keluarga. Penulis juga menyampaikan rasa terima kasih atas segala bantuan dan dukungan dari semua pihak yang tak dapat disebutkan satu persatu. Karya ilmiah ini penulis persembahkan untuk suami dan anak-anak tercinta, Drh. Sugiarto dan Fathir Aswinbinar; serta kedua orang tua Drs. H. E. Sunarman dan Hj. Yanti Yulianti yang senantiasa mendukung dan mendoakan untuk keberhasilan cita-cita penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi 1 PENDAHULUAN 1 Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 2Ruang Lingkup Penelitian 2
Hipotesis Penelitian 3
2 TINJAUAN PUSTAKA 3
Mikroorganisme Penghasil Aflatoksin 3
Aflatoksin B1 (AFB1) 5
Nanopartikel Emas 7
Bovine Serum Albumin (BSA) 9
Imunostrip 10
3 METODE 12
Waktu dan Tempat Penelitian 12
Bahan 12
Alat 12
Metode Penelitian 12
Analisis Data 15
4 HASIL DAN PEMBAHASAN 15
Sintesis dan Karakterisasi Antigen AFB1-BSA 15
Purifikasi Antibodi Anti AFB1-BSA 18
Konjugasi Antibodi Anti AFB1-BSA dengan Nanopartikel Emas 20
5 KESIMPULAN DAN SARAN 22
Kesimpulan 22
Saran 22
6 DAFTAR PUSTAKA 22
LAMPIRAN 26
DAFTAR TABEL
1 Batas maksimum AFB1 pada pakan dan pangan 7
2 Perhitungan Retention factor (Rf) AFB1 baku dan AFB1-CMO 16
3 Hasil pengukuran absorbansi BSA baku dan antigen AFB1-BSA 17
4 Penghitungan berat molekul pita protein antigen AFB1-BSA pada
analisis SDS PAGE 17
5 Angka absorbansi dan kadar IgG pada setiap fraksi serum kelinci yang
diimunisasi dengan AFB1-BSA 19
6 Penghitungan berat molekul pita protein antibodi anti AFB1-BSA pada
analisis SDS PAGE 20
DAFTAR GAMBAR
1 Morfologi Aspergilus sp. 4
2 Konidiofora dari Aspergilus flavus (A); A. parasiticus (B); A. nomius
(C) dengan mikroskop elektron 4
3 Struktur AFB1 5
4 Metabolisme AFB1 dalam organ hati 6
5 Nanopartikel emas 8
6 Struktur molekul BSA 9
7 Susunan imunostrip menggunakan nanopartikel emas 11
8 Skema imunostrip dengan format kompetitif 11
9 Deteksi AFB1-CMO dengan TLC. 1 = AFB1-CMO; 2= AFB1 baku
2 ppm 16
10 Proses konjugasi AFB1 terhadap BSA 16
11 Kurva persamaan linear larutan BSA baku dalam antigen AFB1-BSA 17
12 Hasil SDS PAGE terhadap antigen AFB1-BSA. 1=Penanda; 2 Antigen
AFB1-BSA; 3 = BSA 17
13 Respon antibodi anti AFB1-BSA terhadap antigen AFB1-BSA pada
uji DBIA. 18
14 Pola fraksinasi kadar IgG anti AFB1-BSA hasil purifikasi 18
15 Hasil S D S P A G E terhadap antibodi anti AFB1-BSA. 1=Penanda;
2=Antibodi anti AFB1-BSA; 3 = antibodi anti AFB1 komersial 19
16 Titrasi antibodi anti AFB1-BSA terhadap nanopartikel emas 21
17 Komposisi optimum antigen AFB1-BSA, konjugat antibodi anti AFB1
-BSA dengan nanpartikel emas dan IgG anti rabbit pada pengujian
sistem imunostrip 21
DAFTAR LAMPIRAN
1 Komponen dan perakitan imunostrip 26
2 Reagen SDS PAGE 27
3 Komposisi gel SDS PAGE 27
4 Proses elektroforesis SDS PAGE 28
5 Purifikasi antibodi anti AFB1-BSA dengan kolom protein A HP 29
1 PENDAHULUAN
Latar BelakangAflatoksin B1 (AFB1) adalah salah satu jenis mikotoksin yang dihasilkan oleh
kapang Aspergillus spp. terutama A. flavus dan A. parasiticus. Toksin ini sering mengkontaminasi berbagai produk pertanian yang menjadi bahan pangan dan pakan seperti jagung, kacang-kacangan, biji-bijian, rempah-rempah, daging dan buah kering (Magnussen & Parsi, 2013). Kontaminasi AFB1 di daerah tropis seperti Indonesia
telah banyak dilaporkan termasuk pada pakan dan bahan pakan (Ahmad, 2009; Rachmawati, 2005; Bahri et al., 2005).
Toksin AFB1 merupakan toksin yang paling potensial sebagai karsinogen,
teratogen dan agen imunosupresif yang berbahaya bagi kesehatan manusia maupun hewan. Toksin ini sangat berbahaya dan merupakan faktor penyebab kanker sehingga International Agency of Research on Cancer menggolongkannya sebagai karsinogen grup IA (IARC, 2002). Paparan dosis rendah dari metabolit cendawan
Aspergillus tersebut secara kronis dapat beresiko menyebabkan kanker hati,
mempengaruhi metabolisme protein dan menurunkan kekebalan hingga menyebabkan malnutrisi. Sementara paparan dosis tinggi menyebabkan aflatoksikosis akut yang bersifat fatal (Williams et al., 2004; Magnussen & Parsi, 2013). Paparan aflatoksin khususnya pada hewan ternak selain berdampak buruk dan toksik juga dapat menjadi
foodborne hazard bagi manusia. Menurut Maciorowskia et al., (2007), pakan ternak
dapat berfungsi sebagai pembawa aflatoksin. Ketika hewan ternak diberi pakan yang terkontaminasi aflatoksin, tidak hanya efek toksik langsung pada hewan tetapi toksin tersebut juga dapat terbawa ke dalam susu dan daging sehingga manusia dapat terpapar melalui konsumsi kedua produk tersebut (Reddy dan Raghavender, 2007; Hussain et al., 2010).
Aflatoksikosis akut pada manusia akibat paparan makanan yang tercemar oleh aflatoksin dosis tinggi dilaporkan terjadi di Kenya, India, Thailand dan Malaysia (CAST, 2003; Reddy & Raghavender, 2007). Salah satu wabah aflatoksikosis terbesar dilaporkan terjadi di pedesaan Kenya pada April 2004 yang mengakibatkan 317 kasus dengan 125 kematian (CDC, 2004). Pada hewan, paparan aflatoksin umumnya menyebabkan kerusakan hati, penurunan produksi, gangguan pertumbuhan dan kematian pada kondisi yang fatal (He et al., 2013; Marin et al., 2013).
Dalam upaya pengawasan kontaminasi aflatoksin khususnya AFB1 pada bahan
pangan dan pakan, teknik deteksi yang handal untuk menentukan kualitas dan keamanan bahan pangan dan pakan sangat diperlukan. Saat ini, metode uji yang umum digunakan untuk mendeteksi AFB1 antara lain Thin-Layer Chromatography
(TLC), High-Performance Liquid Chromatography (HPLC), dan Enzyme-linked
Immunosorbent Assay (ELISA). Metode deteksi tersebut umumnya hanya dapat
dilakukan di laboratorium dengan proses pengujian yang membutuhkan waktu lama dan tenaga dengan keterampilan khusus (Zheng et al., 2006; Saini & Kaur, 2012). Metode uji yang sederhana, ekonomis, cepat mudah, dan dapat digunakan di lapangan sangat diperlukan untuk deteksi dini kontaminasi AFB1 pada bahan pangan dan
pakan. Pengembangan teknik deteksi cepat seperti imunostrip dengan menggunakan nanopartikel emas sebagai penanda sangat menjanjikan untuk dapat mendeteksi AFB1
secara sensitif, mudah dan efesien tanpa memerlukan peralatan dan keterampilan khusus (Liu et al., 2013). Tujuan penelitian ini adalah mensintesis antigen AFB1
-BSA dan memproduksi konjugat antibodi anti AFB1-BSA dengan nanopartikel emas
sebagai bahan pereaksi imunostrip untuk mendeteksi AFB1.
Perumusan Masalah
Kontaminasi AFB1 pada bahan pakan dan pangan sangat berbahaya bagi
kesehatan dan dapat menimbulkan kematian pada manusia dan hewan yang mengkonsumsi bahan pakan dan pangan yang terpapar oleh AFB1. Pengawasan
serta deteksi terhadap AFB1 dalam bahan pangan dan pakan sangat diperlukan
dalam mengatasi dan mencegah dampak buruk dari AFB1. Pengujian AFB1 pada
bahan pakan sering dilakukan di laboratorium dengan menggunakan metode yang umumnya memakan waktu dan biaya yang tidak sedikit serta memerlukan tenaga dengan keterampilan teknik laboratorium. Untuk itu diperlukan pengembangan metode uji yang lebih sederhana, ekonomis, mudah dan cepat serta dapat digunakan di mana pun sebagai perangkat deteksi dini terhadap kontaminasi AFB1
pada pakan .
Tujuan Penelitian
Tujuan penelitian ini melakukan sintesis antigen AFB1-BSA dan konjugasi
antibodi anti AFB1-BSA dengan nanopartikel emas sebagai pereaksi imunostrip
untuk mendeteksi AFB1 pada pakan ternak.
Manfaat Penelitian
Antigen AFB1-BSA dan konjugat antibodi anti AFB1 dengan nanopartikel
emas yang dihasilkan dari penelitian ini diharapkan dapat digunakan sebagai pereaksi imunostrip untuk mendeteksi AFB1 pada pakan ternak. Dengan adanya
imunostrip diharapkan dapat mendeteksi AFB1 secara mudah, cepat dan dapat
digunakan untuk kegiatan pengawasan kontaminasi AFB1.
Ruang Lingkup Penelitian
Pada penelitian ini dilakukan serangkaian kegiatan yaitu sintesis dan karakterisasi antigen AFB1-BSA, purifikasi dan karakterisasi antibodi anti AFB1
-BSA dan konjugasi antibodi anti AFB1-BSA dengan nanopartikel emas. Antigen
AFB1-BSA disintesis dengan mereaksikan AFB1 murni dan bovine serum albumin
(BSA) melalui reaksi carboxymethyloxime (CMO) sebagai reaksi penghubung. Keberadaan AFB1-CMO diidentifikasi dengan TLC dan antigen AFB1-BSA
dikarakterisasi dengan sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE). Antibodi anti AFB1-BSA diuji respon antibodinya melalui reaksi
dengan antigen AFB1-BSA secara dot blot immunoassay (DBIA). Antibodi
kemudian dipurifikasi melalui fraksinasi menggunakan kolom HiTrap protein A HP. Kadar antibodi dihitung dengan menggunakan spektrofotometer pada panjang gelombang 280 nm dan dikarakterisasi menggunakan SDS-PAGE. Selanjutnya,
antibodi anti AFB1-BSA dikonjugasikan dengan nanopartikel emas. Seluruh
pereaksi yang terdiri dari antigen AFB1-BSA, konjugat antibodi anti AFB1-BSA
dengan nanopartikel emas dan IgG anti rabbit digunakan pada imunostrip serta ditentukan kondisi optimumnya.
Hipotesis Penelitian Hipotesis yang diajukan dalam penelitian ini adalah
H0 : konjugat antibodi anti AFB1-BSA dengan nanopartikel emas dapat
digunakan sebagai pereaksi penanda pada imunostrip untuk mendeteksi AFB1 pada pakan
H1 : konjugat antibodi anti AFB1-BSA dengan nanopartikel emas tidak dapat
digunakan sebagai pereaksi penanda pada imunostrip untuk mendeteksi AFB1 pada pakan.
2 TINJAUAN PUSTAKA
Mikroorganisme Penghasil AflatoksinAspergillus adalah salah satu jenis kapang yang tersebar luas di dunia.
Genus Aspergillus secara mikroskopis dicirikan sebagai hifa bersepta dan bercabang, konidiofora muncul dari foot cell (miselium yang bengkak dan berdinding tebal) membawa stigmata dan akan tumbuh konidia yang membentuk rantai berwarna hijau, coklat atau hitam. Aspergillus secara makroskopis mempunyai hifa fertil yang muncul dipermukaan dan hifa vegetatif terdapat dibawah permukaan. Kapang tumbuh membentuk koloni berserabut, smooth, cembung serta koloni yang kompak dengan warna koloni yang dipengaruhi oleh warna spora misalnya hijau kelabu, hijau coklat, hitam, atau putih. Tingkat penyebaran Aspergillus yang tinggi disebabkan oleh produksi konidia yang dapat tersebar dengan mudah melalui udara (airborne) maupun melalui serangga. Selain itu
Aspergillus juga memiliki kemampuan untuk bertahan dalam kondisi yang keras
sehingga kapang tersebut dapat dengan mudah mengalahkan organisme lain dalam mengambil substrat dalam tanah maupun tanaman (Gandjar et al., 1999; Zain, 2011).
Beberapa spesies dari kapang Aspergillus dapat menghasilkan mikotoksin yang disebut aflatoksin. Kapang penghasil aflatoksin atau disebut kapang afaltoksigenik diantaranya yaitu Aspergillus flavus, Aspergillus parasiticus dan
Aspergillus nomius. Kapang aflatoksigenik sering tumbuh pada banyak tanaman
pangan seperti kacang dan jagung pada kondisi yang sesuai. Sehingga aflatoksin sering muncul pada tanaman pangan bagi manusia, yang juga menjadi pakan ternak. Kapang aflatoksigenik tersebut tidak terus-menerus menghasilkan toksin tetapi dipicu oleh beberapa faktor-faktor seperti stres, faktor lingkungan (substrat, kelembaban, suhu, pH), lamanya kontak antara jamur dengan substrat dan faktor yang mengurangi imunitas tanaman induk (kerusakan oleh serangga, pemupukan yang buruk dan kekeringan). Terbentuknya kontaminan aflatoksin pada produk pertanian yang menjadi bahan pangan dan pakan dapat terjadi saat sebelum panen, masa antara panen dan pengeringan, dan saat penyimpanan (Zheng et al, 2006).
Praktek panen yang buruk, penyimpanan dan kondisi yang kurang optimal selama transportasi dan pemasaran juga dapat berkontribusi untuk pertumbuhan jamur dan produksi aflatoksin (Reddy dan Raghavender, 2007).
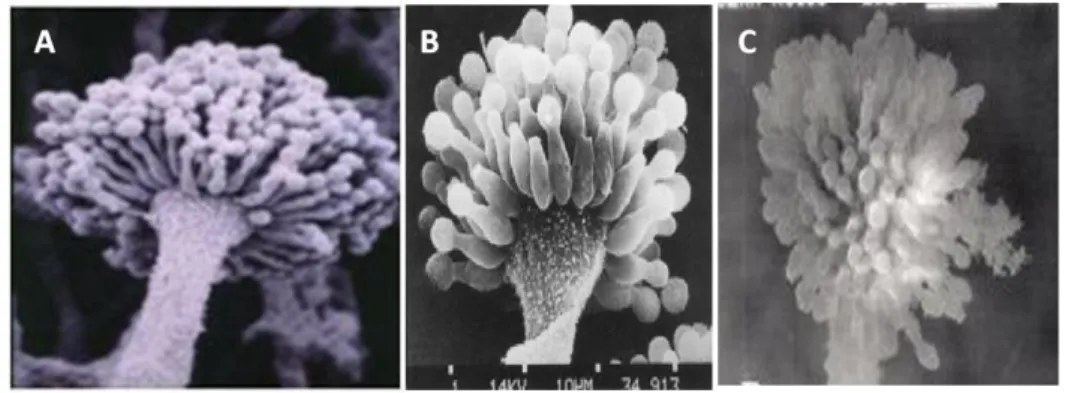
Gambar 1. Morfologi Aspergilus sp. (Vivian, 2013)
Gambar 2. Konidiofora dari Aspergilus flavus (A); A. parasiticus (B); A. nomius (C) dengan mikroskop elektron; (Deepak, 2013; Rodrigues et al. , 2007; Munoz et al., 2010).
Aflatoksin B1 (AFB1)
Aflatoksin merupakan toksin yang tersebar luas yang diproduksi oleh strain
Aspergillus flavus, Aspergillus parasiticus dan Aspergillus nomius. Istilah
―Aflatoksin‖ berasal dari ―A‖ untuk Aspergillus dan ―fla‖ untuk spesies ―flavus‖ digabungkan dengan kata toksin. Terdapat berbagai jenis aflatoksin dan metabolitnya di antaranya yang dikenal luas adalah B1, B2, G1, G2, M1, dan M2.
Aflatoksin B1 dan B2 diproduksi oleh A. flavus dan A. parasiticus. Sedangkan
aflatoksin G1 dan G2 hanya diproduksi oleh A. parasiticus. Aflatoksin M1 dan M2
berturut-turut merupakan hasil metabolisme AFB1 dan AFB2 dalam tubuh
manusia dan hewan yang muncul dalam susu dan urine. Aflatoksin yang sering ditemukan dan dikenal paling toksik adalah AFB1 (Zain, 2011; Binder et al.,
2007; Reddy & Raghavender, 2007).
Senyawa AFB1 adalah aflatoksin yang paling potensial sebagai agen
karsinogenik, mutagenik, teratogenik dan memiliki efek imunosupresif yang merugikan kesehatan manusia dan hewan. Senyawa ini memiliki ukuran 312,3 Dalton dan mempunyai rumus molekul C17H12O6 (Gambar 3). Toksin AFB1
memiliki titik lebur sekitar 268°C sehingga tidak rusak oleh pemanasan. Sifat khas AFB1 yakni menunjukkan fluoresensi berwarna biru jika terkena sinar
ultraviolet dan sifat ini dipakai dalam penentuan kadar kuantitatif maupun kualitatif. Toksin AFB1 berbentuk bubuk putih dan dapat larut dalam
diklorometana (DCM), dimetil sulfoksida (DMSO) serta metanol (Deepak, 2013; Wild dan Turner, 2002; Zain, 2011).
Paparan AFB1 pada manusia maupun hewan dapat menyebabkan penyakit
aflatoksikosis. Aflatoksikosis akut karena paparan AFB1 dosis tinggi ditandai
dengan perdarahan, kerusakan hati yang hebat, edema, dan kematian. Paparan umumnya dapat terjadi melalui konsumsi atau rute ingesti serta dapat juga terjadi melalui rute dermal dan inhalasi (Reddy & Raghavender, 2007). Setelah masuk melalui ingesti, AFB1 diserap dan dibawa ke hati melalui sistem peredaran darah
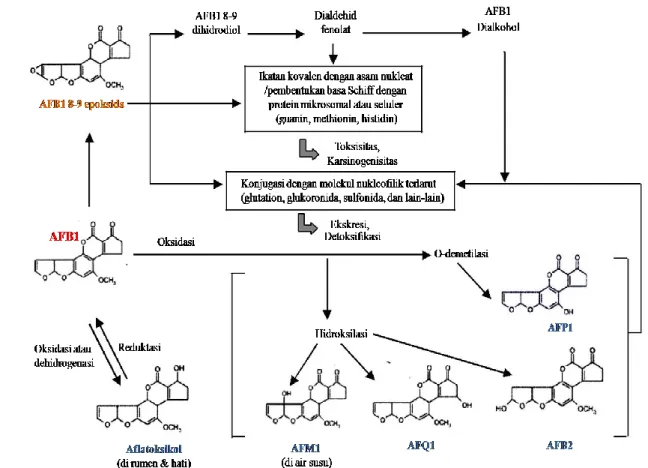
dan terjadi proses metabolisme (Gambar 4). Toksin AFB1 kemudian diubah oleh
hati menjadi epoksida reaktif yang toksik yaitu 8,9 epoksida yang berikatan kovalen dengan makromolekul intraselular seperti DNA, RNA dan enzim protein. Ikatan tersebut dapat mengakibatkan kerusakan sel hati (hepatotoksik). Selain itu pengikatan DNA menyebabkan genotoksisitas dan mutasi di dalam sel
(hepatokarsinogenik). Dosis kronis dari aflatoksin yang dapat menyebabkan karsinogenik jauh lebih rendah daripada dosis akut. Toksin AFB1 diklasifikasikan
oleh International Agency of Research on Cancer sebagai karsinogen grup 1 (Wild dan Turner, 2002; IARC, 2002).
Kontaminasi AFB1 pada bahan pakan dan pangan dapat berakibat buruk
terhadap kesehatan manusia dan hewan. Kejadian wabah aflatoksikosis pada manusia akibat konsumsi makanan yang terkontaminasi oleh aflatoksin dilaporkan telah terjadi berulang-ulang di Kenya, India, Thailand dan Malaysia (CAST, 2003; Reddy dan Raghavender, 2007). Wabah aflatoksikosis yang terbesar terjadi pada April 2004 di pedesaan Kenya, mengakibatkan 317 kasus dan 125 kematian (CDC, 2004). Daniel et al. (2011) memaparkan bahwa tingkat kejadian kematian oleh aflatoksin di daerah Kenya timur mencapai 40% yang disebabkan adanya kontaminasi aflatoksin yang ekstrim (>20 ppb) dalam wilayah ini terutama pada jagung. Sementara Lewis et al. (2006) mengungkapkan bahwa 55% dari jagung yang dperdagangkan di wilayah Kenya terkontaminasi oleh AFB1.
Dampak buruk aflatoksin pada hewan umumnya berupa efek kumulatif dari paparan kronis baik secara langsung berupa kematian hewan atau tidak langsung berupa penurunan produksi dan performa pertumbuhan hewan tersebut (He et al., 2013; Marin et al., 2013). Efek paparan AFB1 pada hewan percobaan seperti tikus
menunjukkan adanya apoptosis sel hepatosit (Ribeiro et al., 2010), gangguan spermatogenik (Agnes dan Akbarsha, 2003) dan tumor (Rastogi et al., 2006).
Paparan aflatoksin khususnya pada hewan ternak selain berdampak buruk dan bersifat toksik juga dapat menjadi foodborne hazard bagi manusia. Menurut Maciorowskia et al., (2007), hewan ternak yang diberi pakan terkontaminasi aflatoksin, selain terkena efek toksik secara langsung juga dapat menjadi pembawa aflatoksin bagi manusia yang mengkonsumsi produk dari hewan ternak tersebut. Toksin AFB1 yang tercampur dalam pakan ternak dapat menyebabkan
residu terutama pada hati, ginjal, daging, susu dan telur sehingga menjadi jalan pemaparan aflatoksin pada manusia. Residu yang dihasilkan dapat berupa AFB1,
AFB2, AFM1 atau aflatoksikol yang bersifat stabil terhadap berbagai proses
pengolahan dan penyimpanan (Reddy dan Raghavender, 2007; Hussain et al., 2010; Widiastuti, 2014).
Toksin AFB1 merupakan mikotoksin yang banyak ditemukan dalam
berbagai bahan pangan, dan pakan seperti jagung, gandum, barley, beras, oat, kacang-kacangan, susu, keju, biji kapas dan sebagainya. Kontaminasi aflatoksin dalam bahan pangan lebih sering terjadi di negara-negara tropis seperti di Indonesia yang memiliki iklim tropis dengan kelembaban tinggi. Iklim tropis sangat kondusif bagi tumbuhnya kapang aflatoksigenik yang dapat menyebabkan bahan pangan/pakan tercemar oleh aflatoksin sehingga residu aflatoksin pada berbagai produk pangan asal ternak (susu, daging dan telur) dan olahannya merupakan hal yang tidak dapat dihindari dan dapat menjadi ancaman bagi kesehatan bagi manusia (William et al., 2004). Regulasi batas maksimum cemaran aflatoksin pada pakan dan pangan perlu diterapkan guna mencegah bahaya kesehatan dan kerugian yang ditimbulkan. Di Indonesia, terdapat peraturan mengenai tingkat kontaminasi AFB1 dan total aflatoksin yang
diperbolehkan pada pangan dan pakan (Tabel 1).
Tabel 1. Batas maksimum AFB1 pada pakan dan pangan
Produk Regulasi Batas Maksimum AFB1/Total Aflatoksin
Indonesia Uni Eropa
Pakan 50ppb AFB1/50 ppb aflatoksin total (Mentan, 2009) 5-50 µg/kg AFB1 (EC, 2010) Pangan (jagung, kacang-kacangan & produk olahannya) 15 ppb AFB1/ 20 ppb aflatoksin total (BPOM, 2009 & BSN, 2009) 2-8 µg/kg AFB1/4-15 aflatoksin total (EC, 2010)
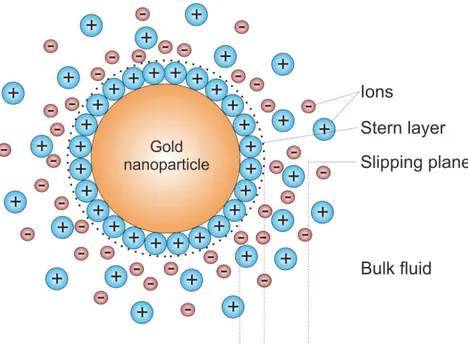
Nanopartikel Emas
Nanopartikel merupakan partikel koloid dengan ukuran lebih kecil dari 1 µm yaitu antara 1-100 nm (skala nanometer/10-9m) . Logam emas (Au) merupakan salah satu logam transisi yang saat ini menjadi topik yang berkembang dalam berbagai bidang, seperti diagnostik maupun kesehatan. Unsur emas memiliki sifat fisika dan kimiawi yang istimewa. Emas adalah elemen kimia dengan simbol Au (latin: Aurum), nomor atom 79, konfigurasi elektron [Xe] 2f14 5d10 6s1, massa atom 196,967 gmol-1 dan jari-jari atom 0,1442 nm. Secara kimia, emas merupakan logam transisi dan dalam larutan dapat berbentuk kation univalen dan trivalen. Emas adalah logam berat berwarna kuning dan lunak (titik leleh 10630C). Dalam bentuk bubuk mempunyai warna coklat kemerahan. Emas tidak reaktif dan tidak bereaksi dengan oksigen atau sulfur namun mudah bereaksi dengan halogen atau dengan larutan yang mengandung atau melepaskan klor. Emas tidak beracun, inert, stabil, dan memiliki kapasitas mengikat tinggi. Nanopartikel emas dianggap potensial diagnostik untuk sejumlah alasan diantaranya yaitu nanopartikel emas mudah disintesis dengan cara sederhana, murah, aman dengan berbagai metode seperti metode fisika, kimia, ataupun biologi. Nanopartikel emas dapat disintesis dalam berbagai bentuk dan ukuran ( 2-500 nm) serta karakteristik permukaan nanopartikel dapat dimanipulasi dengan mudah. Adanya muatan negatif pada permukaan menyebabkan nanopartikel emas memiliki reaktifitas yang tinggi sehingga membantu dalam memodifikasi permukaan tersebut dengan beberapa biomolekul. Teknologi nanopartikel emas dapat digunakan di dalam diagnostik molekuler dan klinik salah satunya yaitu imunokromatografi lateral flow test atau test strip (Moon et al., 2012; Wang et
al., 2011; Park et al., 2011; Baptista et al., 2008).
Bovine Serum Albumin (BSA)
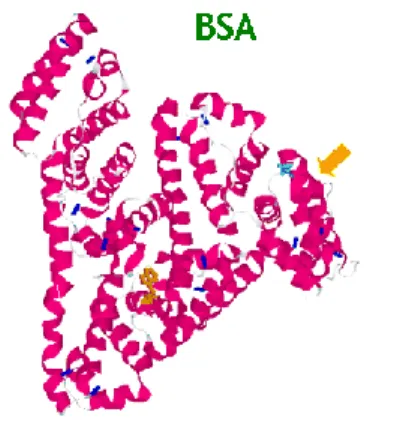
Protein albumin yang diisolasi dari darah sapi disebut dengan Bovine Serum
Albumin (BSA). Protein albumin merupakan protein utama yang paling banyak
ditemukan dalam plasma darah hewan vertebrata, yaitu sekitar 55-60 % dari protein serum yang terukur. Albumin terdiri dari rantai polipeptida tunggal dan terdiri dari 585 asam amino. Pada molekul albumin terdapat 17 ikatan disulfida yang menghubungkan asam-asam amino yang mengandung sulfur. Molekul albumin berbentuk elips sehingga bentuk molekul seperti itu mengakibatkan protein ini terlarut sempurna dan tidak akan meningkatkan viskositas plasma. Albumin mampu mengangkut molekul-molekul kecil melewati plasma dan cairan sel. Protein ini disebut protein pembawa karena memiki muatan negatif yang dapat mengikat molekul lain seperti air, kation (seperti Ca 2+, Na +, dan K +), asam lemak, hormon, vitamin, bilirubin dan obat. Di dalam tubuh, protein albumin juga berfungsi untuk menjaga volume darah dan memberi tekanan osmotik di dalam kapiler. Protein ini disintesis oleh hati dan mempunyai sifat larut dalam air tetapi mudah menggumpal oleh panas. Selain di darah (albumin serum), protein albumin juga ditemukan pada putih telur yaitu albumin telur dan pada susu yaitu laktalbumin (Putnam, 1975; Navara et al., 2009).
Protein BSA merupakan salah satu protein yang paling luas diteliti dan merupakan protein globular yang berukuran besar dengan bobot molekul sekitar 66 kDa. Protein BSA sering dan banyak digunakan dalam berbagai aplikasi bidang biokimia seperti pada prosedur imunodiagnostik (ELISA, imunoblot dan imunohistokimia), sebagai reagen kimia klinik serta pada bidang biologi molekuler. Protein ini digunakan sebagai media/nutrient pada kultur sel dan kultur mikroba. Larutan BSA juga digunakan sebagai standar untuk menentukan jumlah protein lain. Selain itu protein BSA sering digunakan di dalam konjugat bersama dengan antigen yang memiliki ukuran molekul yang kecil (hapten) untuk menginduksi respon kekebalan yang dapat menghasilkan antibodi. Banyaknya penggunaan BSA tersebut karena BSA mempunyai sifat stabil dan tidak mengganggu/mempengaruhi reaksi biologis. Selain itu BSA relatif murah dan mudah didapatkan di pasaran karena merupakan hasil purifikasi darah sapi yang dapat ditemukan secara berlimpah dan merupakan produk sampingan dari industri peternakan. Secara komersil BSA banyak diproduksi negara maju dan dapat diperoleh dalam bentuk tepung dengan warna putih kekuningan (Friedli, 2006; Putnam 1975).
Imunostrip
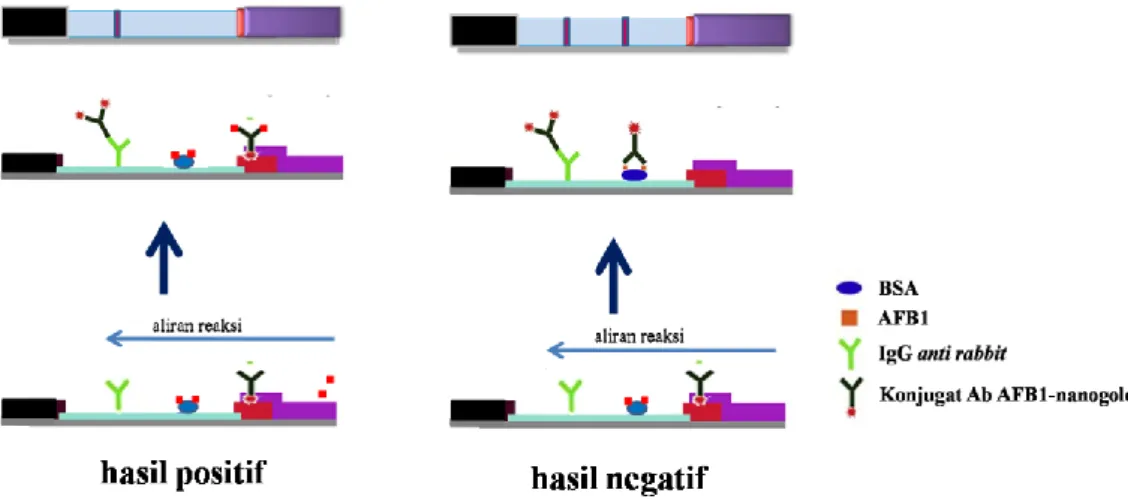
Pengujian aflatoksin penting dilakukan untuk mengetahui adanya kontaminasi aflatoksin dalam suatu komoditas atau produk. Adanya persaingan dalam industri makanan dan pakan memaksa produsen untuk menggunakan metode yang lebih cepat, murah, sederhana dan mudah digunakan untuk analisis mikotoksin terutama untuk digunakan di lapangan. Metode cepat adalah metode yang dapat dilakukan secara singkat yaitu hasil dapat diperoleh dalam hitungan menit dibandingkan dengan metode yang konvensional. Metode cepat juga hendaknya dapat digunakan untuk menentukan efektifitas keamanan pangan, penerapan peraturan, menjaga kelancaran pemasaran produk, penghematan waktu dan biaya serta tidak memerlukan tenaga kerja yang terlatih. Metode cepat ini direkomendasi untuk digunakan dalam pemeriksaan sampel secara screening (Goryachev et al., 2007).
Salah satu metode cepat yang sederhana adalah imunokromatografi tes strip atau imunostrip yang merupakan strip tipis yang terdiri dari 4 komponen yaitu lapisan untuk sampel, konjugat dan absorban serta membran nitroselulosa untuk daerah kontrol dan daerah uji seperti pada Gambar 7 (Kolosova et al., 2007; Wang et al., 2007; Shim et al., 2009). Imunostrip sebagai sebuah alat untuk mendeteksi aflatoksin memiliki tempat yang penting dalam industri pakan dan pangan karena penggunaannya lebih cepat dan mudah serta dapat digunakan di lapangan. Namun imunostrip umumnya mempunyai batasan kepekaan dibandingkan dengan uji konvensional yang dilakukan di laboratorium (Goryachev et al., 2007). Fusvita (2015) melaporkan hasil uji mutu immunostrip yang dikembangkan untuk mendeteksi aflatoksin M1 (AFM1) pada susu memiliki batas terendah sebesar 0,25 ng/ml. Sedangkan kepekaan uji dengan HPLC untuk mendeteksi aflatoksin dapat mencapai 0,1 ng/ml atau bahkan lebih rendah lagi (Li et al., 2009)
Prinsip imunostrip berdasarkan imunokromatografi dapat dibuat dengan berbagai metode. Salah satu metode imunostrip yaitu dengan reaksi kompetitif menggunakan nanopartikel emas. Pada reaksi kompetitif, saat ujung tes untuk sampel terendam dalam larutan sampel maka cairan akan melewati lapisan konjugat yang mengandung antibodi berlabel emas pada imunostrip menuju dua daerah yaitu daerah uji dan daerah kontrol. Jika terdapat kandungan AFB1 dalam
sampel maka antigen AFB1 tersebut akan berikatan dengan konjugat antibodi yang
berlabel nanopartikel emas, dan kompleks antibodi-antigen yang terbentuk akan terus bergerak naik sesuai aliran fluida melewati daerah uji. Pada daerah uji, terjadi kompetisi antara antigen AFB1 dalam sampel dengan antigen AFB1-BSA
yang terdapat di daerah uji untuk berikatan dengan antibodi berlabel nanopartikel emas. Namun antigen AFB1-BSA tidak dapat berikatan dengan antibodi berlabel
nanopartikel emas karena antibodi tersebut telah berikatan terlebih dahulu dengan antigen AFB1 yang terdapat pada sampel. Selanjutnya komplek antibodi-antigen
AFB1 tersebut bersama kelebihan antibodi berlabel nanopartikel emas yang tidak
terikat akan terus mengalir ke daerah kontrol sehingga akan bereaksi dengan IgG
anti rabbit pada daerah kontrol menghasilkan garis merah keunguan pada daerah
kontrol. Dari proses tersebut maka hasil uji yang positif ditunjukan dengan terbentuknya 1 garis merah keunguan yang terbentuk pada daerah kontrol (Gambar 8). Sementara jika tidak ada AFB1 pada sampel maka larutan sampel
akan membawa antibodi berlabel nanopartikel emas ke daerah uji dan berikatan dengan antigen AFB1-BSA yang terdapat di daerah uji. Adanya ikatan antara
antibodi berlabel nanopartikel emas dengan antigen AFB1-BSA pada daerah uji
menghasilkan garis merah keunguan pada daerah tersebut. Sisa antibodi berlabel nanopartikel emas yang tidak terikat pada daerah uji akan mengalir dan terbawa ke daerah kontrol untuk kemudian berikatan dengan IgG anti rabbit membentuk garis merah keunguan pada daerah kontrol (Gambar 8). Dengan demikian hasil negatif ditunjukkan dengan 2 garis merah keunguan yang terbentuk pada daerah uji dan daerah kontrol. Imunostrip dikatakan tidak berjalan apabila tidak terbentuk garis merah keunguan pada daerah kontrol yang merupakan kontrol internal untuk memastikan bahwa antibodi berlabel nanopartikel emas telah melewati semua daerah pada imunostrip (Moon et al., 2012; Park et al., 2011).
Gambar 7. Susunan imunostrip menggunakan nanopartikel emas (Liu et al., 2012).
3 METODE
Waktu dan Tempat Penelitian
Penelitian ini berlangsung dari bulan Mei 2013 sampai Maret 2015 di Laboratorium Toksikologi, Balai Besar Penelitian Veteriner (BB Litvet), Jl. R. E. Martadinata No. 30, Bogor.
Bahan
Bahan yang digunakan adalah akuades, phosphate buffer saline (PBS),
bovine serum albumin (BSA), IgG anti-rabbit, IgG goat HRP, 3,3
dimetilaminobenzidin (DAB), disodium tetraborate (boraks), sukrosa, sodium azide (N2N3), AFB1 baku dalam asetonitril, tween 20, tris-HCL, nanopartikel
emas (Fitzgerald®), acrylamide/bis, N,N,N’,N’-tetrametilenadiamina (TEMED), hidrogen peroksida (H202), amonium persulfat ((NH4)2S2O8), asam sitrat (C6H8O7),
sodium fosfat (Na3PO4), ammonium sulfat ((NH4)2SO4), membran nitroselulosa
(NC) ukuran pori 5 µm (Germany), silika gel 60 F254 Merck KgaA (Germany), penanda (Pharmacia Biotech), carboxymethoxylamine (CMO), carbodiimide (EDC), tween-tris-casein (TTC), N hydroxysuccinimide (NHS), N’N Dimethylformamide (DMF), metanol (MeOH), kloroform (CHCL3), Coomassie
blue, NaCl, piridin.
Alat
Alat yang digunakan adalah pipet mikro, spektrofotometri UV Vis DMS 80, lemari pendingin (SHARP®), kolom HiTrap Protein A HP (Amersham pharmacia biotech), Hitachi Micro Ultracentrifuge CS150NX, vortex mixer, hot plate, kantong dialisis MEMBRA-CEL® MD10 14 x 100 CLR, erlenmeyer, alat kocok (shaker), labu ukur, tabung mikro, mini vertical slab gel (Biorad Laboratories), tabung reaksi, gelas ukur, pengaduk magnetik, dan inkubator.
Metode Penelitian Sintesis dan Karakterisasi Antigen AFB1-BSA
Sintesis antigen AFB1-BSA dilakukan dengan merubah AFB1 menjadi
AFB1-CMO untuk kemudian dikonjugasikan dengan BSA sesuai metode Liu, et
al. (2013). Sebanyak 10 mg AFB1 dan 15 mg CMO dilarutkan dalam larutan
reflux yang terdiri dari 1 ml piridin, 4 ml metanol dan 1 ml akuades. Campuran
diaduk menggunakan pengaduk magnet selama 2,5 jam lalu diinkubasi pada suhu ruang selama satu malam. Selanjutnya campuran dipekatkan dengan aliran gas nitrogen hingga tersisa 1 ml untuk kemudian diuji dengan TLC. Uji TLC dilakukan dengan menotolkan AFB1-CMO dan AFB1 sebanyak 20 µl pada bagian
bawah pelat gel silika yang telah ditandai dengan jarak 1,5 cm. Setelah kedua bahan tersebut mengering, pelat dimasukan ke dalam bejana TLC yang berisi kloroform dan metanol dengan perbandingan 9:1 yang mengandung 1.5% asam
asetat glasial. Pelat silika gel diangkat setelah pelarut bejarak sekitar 1 cm dari bagian atas pelat. Setelah pelat dikeringkan hasil kromatografi kemudian diamati di bawah sinar UV pada panjang gelombang 365 nm dan Rf AFB1 serta AFB1
-CMO dihitung menggunakan rumus:
f jarak yang ditempuh oleh senyawa jarak yang ditempuh oleh pelarut
Bercak AFB1-CMO pada pelat gel silika kemudian dikerok, dilarutkan
dalam kloroform dan disentrifus selama 5 menit. Supernatan dimasukan ke dalam botol gelap yang telah ditimbang lalu dikeringkan dengan aliran gas nitrogen. Selanjutnya AFB1-CMO yang telah kering kemudian ditimbang sebanyak 0,5 mg
dan dilarutkan dalam 0,13 ml N,N-dimetillformamida (DMF). Sebanyak 1 mg N,dicyclohexylcarbodiimide (DCC) dalam 0,01 ml DMF dan 0,8 mg
N-hydroxysuccinimide (NHS) dalam 0,01 ml DMF dimasukkan ke dalam campuran,
diaduk dengan pengaduk magnet dan diinkubasi selama 2 jam pada suhu ruang. Sebanyak 75 µl campuran ditambahkan 1,5 mg BSA dalam 1 ml NaHCO3 sedikit
demi sedikit sambil diaduk. Campuran diinkubasi pada suhu ruang selama 2 jam lalu didialisis selama 3 hari dalam PBS 0,01 M pH 7,4 dengan dua kali penggantian PBS.
Setelah didialisis, antigen AFB1-BSA dianalisis menggunakan SDS PAGE
berdasarkan Laemmli (1970). Komposisi gel penahan (stacking gel) sebesar 4% dan gel pemisah (separating gel) sebesar 12,6%. Dua pelat kaca diletakan pada plate
holder lalu dipasang pada casting stand. Larutan separating gel dimasukan diantara
pelat kaca dan dibiarkan selama 60 menit hingga mengeras. Selanjutnya stacking gel dituang ke atas separating gel dan sisir sumuran dipasang hingga gel membeku. Sisir kemudian diangkat, lalu sebanyak 5 µl penanda bobot molekul (marker) serta masing-masing 30 µl antigen AFB1-BSA yang telah dipanaskan dimasukan ke dalam
sumuran. Proses elektroforesis vertikal dilakukan pada 100 volt selama 180 menit. Selanjutnya gel diangkat dan diwarnai dengan Comassie blue selama satu jam lalu dibilas dengan larutan pemucat (destaining buffer). Jumlah pita protein dan berat molekulnya dihitung dengan membandingkan terhadap penanda yang digunakan. Purifikasi Antibodi Anti AFB1-BSA
Antibodi anti AFB1-BSA telah diproduksi di Laboratorium Toksikologi BB
Litvet melalui imunisasi kelinci dengan antigen AFB1-BSA. Selanjutnya antibodi
anti AFB1-BSA diuji respon antibodinya melalui reaksi dengan antigen AFB1
-BSA secara DBIA.
Antigen AFB1-BSA diteteskan sebanyak 2 µl ke atas membran nitroselulosa
dan dibiarkan kering pada suhu ruang. Membran nitroselulosa kemudian dimasukkan ke dalam larutan tween-tris-casein 0,2 % (TTC) selama satu jam lalu dicuci dengan larutan PBS 0,01 M pH 7,4 yang mengandung 1% Tween 20 (PBST) dan dikeringkan pada suhu ruang. Pada titik yang sama membran nitroselulosa diteteskan antibodi anti AFB1-BSA sebanyak 2 µl dan diinkubasi
hingga kering pada suhu ruang. Membran nitroselulosa dicuci kembali dengan PBST sebanyak 3 kali dan dikeringkan pada suhu ruang. Kemudian sebanyak 2 µl enzim konjugat goat anti rabbit IgG-HRP diteteskan pada titik yang sama di
membran nitroselulosa hingga kering. Setelah dicuci kembali dengan PBST sebanyak 3 kali, membran nitroselulosa direndam dalam larutan substrat
dimetilaminobenzidine (DAB) hingga muncul warna cokelat pada daerah kontrol
positif.
Purifikasi antibodi dilakukan dengan fraksinasi melalui kolom HiTrap
Protein A HP. Sebanyak 10 tabung penampung fraksi diisi dengan 0,2 ml buffer
tris-HCl pH 9,0. Kolom diisi dengan 25 ml buffer phosphate (binding buffer) dan dibilas kembali dengan 50 ml binding buffer. Sebanyak 2 ml larutan antibodi yang telah didialisis ditambahkan 8 ml binding buffer dan dimasukan ke dalam kolom, lalu dicuci dengan 35 ml binding buffer. Imunoglobulin dielusi dengan 20 ml buffer sitrat dan 2 ml fraksi ditampung ke dalam botol penampung yang berisi buffer tris-HCl. Selanjutnya, nilai absorbansi imunoglobulin diukur menggunakan spektrofotometer pada panjang gelombang 280 nm. Konsentrasi imunoglobulin G (IgG dalam mg/ml) diperoleh dari perhitungan nilai absorbansi IgG dikalikan dengan faktor pengenceran dan dibagi dengan distinction coefficient IgG sebesar 1.36 (Harlow dan Lane, 1988). Hasil purifikasi antibodi anti AFB1 selanjutnya
dikonfirmasi menggunakan SDS PAGE dengan metode yang sama seperti pada antigen AFB1-BSA.
Konjugasi Antibodi Anti AFB1-BSA dengan Nanopartikel Emas
Konjugasi dilakukan sesuai dengan metode Liu et al., (2013). Sebelum proses konjugasi terlebih dahulu dilakukan titrasi antibodi anti AFB1-BSA ke
dalam nanopartikel emas (Shim et al., 2007). Titrasi dilakukan untuk memperoleh komposisi optimum antibodi anti AFB1-BSA yang akan
dikonjugasikan dengan nanopartikel emas pada pH 8,5. Sebanyak 75 µl nanopartikel emas pH 8,5 disiapkan dalam 8 sumuran secara berderet. Satu sumuran dibuat sebagai kontrol sedangkan sisa sumuran lainnya ditambahkan antibodi anti AFB1-BSA (2mg/ml) sebanyak 0-6 µl secara berurutan. Setelah
dikocok selama 1 menit, campuran kemudian diinkubasi selama 5 menit pada suhu ruang. Selanjutnya larutan NaCl 10% 7,5 µl ditambahkan ke dalam setiap sumuran kecuali untuk sumuran untuk kontrol dan dicampur selama 1 menit. Kemudian perubahan warna dari merah ke biru diamati pada deret sumuran. Jumlah minimal antibodi dinilai pada sumuran yang tidak mengalami perubahan warna dari merah ke biru seperti sumuran kontrol. Proses konjugasi kemudian dilakukan dengan mencampur antibodi anti AFB1-BSA (2mg/ml) ke dalam
nanopartikel emas pH 8,5 setetes demi setetes. Selanjutnya sebanyak 720 µl BSA 10% ditambahkan ke dalam campuran lalu dikocok perlahan selama 1 jam. Campuran kemudian disentrifus selama 45 menit dengan kecepatan 10.000 rpm. Pelet diambil dan ditambahkan dengan 600µl larutan buffer borat pH 7.2 yang berisi 1% BSA, 1% sukrosa dan 0.05% sodium azida. Konjugat antibodi anti AFB1-BSA dengan nanopartikel emas yang telah terbentuk akan tampak berwarna keunguan.
Preparasi imunostrip selanjutnya dilakukan pada 4 komponen imunostrip yaitu lapisan untuk sampel, konjugat dan absorban serta membran nitroselulosa untuk zona kontrol dan zona uji. Sebanyak 600 µL konjugat antibodi anti AFB1
membran fiber glass ukuran 30 x 0,4 cm dan dikeringkan selama 30 menit. Setelah kering dilakukan pemotongan lapisan konjugat menjadi 0,5 x 0,4 cm untuk kemudian dirakit pada imunostrip. Reagen antigen AFB1-BSA konsentrasi
0,1; 0,25; 0,5; 1 dan 1,5 mg/ml masing-masing diaplikasikan pada imunostrip yang berbeda yaitu pada membran nitroselulosa di daerah uji (T). Kemudian IgG
anti rabbit 0,5 mg/ml sebanyak 3µl diaplikasikan di daerah kontrol (C) dari
membran nitroselulosa pada setiap imunostrip. Perakitan imunostrip dilakukan dengan menyusun keempat komponen yang ditempelkan pada lembar polyethylene secara tumpang tindih (Gambar 7). Sistem imunostrip yang dibuat dengan format kompetitif dapat berjalan apabila terbentuk 2 garis berwarna ungu untuk hasil uji negatif yaitu pada daerah uji dan daerah kontrol (Gambar 8).
Analisis Data
Data yang diperoleh dari penelitian ini dianalisa secara deskriptif.
4 HASIL DAN PEMBAHASAN
Sintesis dan Karakterisasi Antigen AFB1-BSAToksin AFB1 memiliki ciri penampakan fluorosensi berwarna biru dibawah
sinar ultraviolet (UV) pada panjang gelombang 365 nm (Gambar 9). Bercak AFB1-CMO memiliki Rf =0,45 terdapat pada baris 1 yang ditandai dengan A.
Sedangkan baris 2 adalah AFB1 baku yang memiliki Rf = 0,9 (Tabel 2). Analisis
TLC tersebut dilakukan dengan menggunakan pelat gel silika 60 F254 di dalam sistem pelarut kloroform-metanol (9:1,v/v) mengandung 1,5 % asam asetat. Nilai Rf AFB1 bervariasi tergantung pada jenis pelat dan sistem pelarut yang
digunakan. Pada sistem pelarut kloroform dan aseton (9:1) nilai Rf dari AFB1
-CMO berkisar 0,4-0,7 (AOAC, 1995).
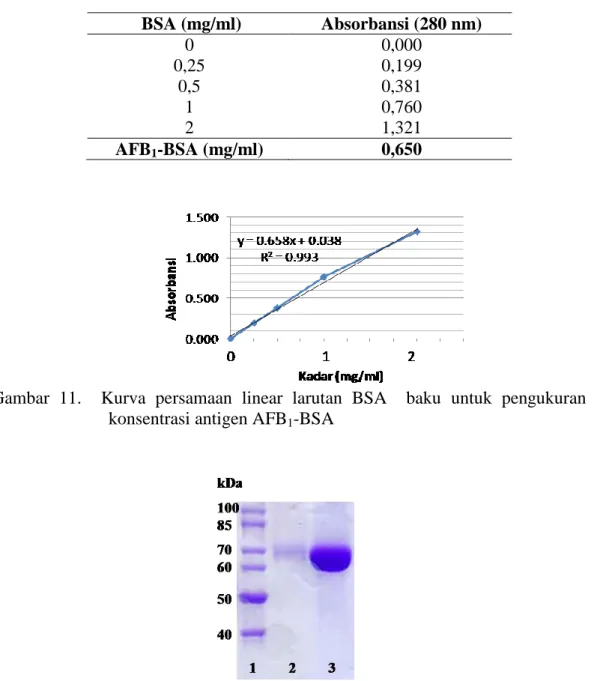
Konsentrasi antigen AFB1-BSA dihitung dengan menggunakan larutan baku
BSA dengan konsentrasi 0; 0,25; 0,5; 1 dan 2 mg/ml (Tabel 3). Berdasarkan persamaan garis y= - 0,658x + 0,038 diketahui kadar antigen AFB1-BSA sebanyak
0,93 mg/ml (Gambar 11). Toksin AFB1 dikonjugasikan dengan protein pembawa yaitu BSA karena toksin ini mempunyai bobot molekul yang terlalu kecil untuk digunakan sebagai imunogen yaitu sebesar 312,3 g/mol. Toksin AFB1 tidak
mempunyai gugus reaktif untuk berikatan dengan BSA, sehingga tahapan sintesis antigen AFB1-BSA harus diawali dengan sintesis hapten AFB1-CMO terlebih dahulu
seperti Gambar 10 (Chu et al.,1977; Liu et al., 2013).
Berdasarkan perhitungan, hasil SDS PAGE antigen AFB1-BSA yang disintesis
menunjukan pita protein tunggal dengan bobot molekul sekitar 72 kDa sedangkan BSA menunjukan pita protein tunggal berukuran sekitar 66,9 kDa (Gambar 12). Pada analisis antigen AFB1-BSA diperoleh migrasi protein penanda dari awal resolving gel
sampai tracking dye berjarak 6,6 cm (Rf). Menurut Hames (1998), ukuran molekul pita protein dihitung berdasarkan rumus regresi dari nilai logaritma berat molekul pita protein penanda (sumbu y) terhadap mobilitas relatif atau Rf (sumbu x). Penghitungan nilai Rf dan logaritma berat molekul pita protein ditunjukan pada Tabel 4. Dari data tersebut diperoleh kurva regresi linear dengan persamaan y = -1,023 x +
2,276; R2 = 0,949. Hasil SDS PAGE menunjukkan antigen AFB1-BSA yang
disintesis lebih besar bobot molekulnya dibandingkan dengan BSA sebagai protein pembawa. Hal ini terjadi karena adanya penambahan molekul AFB1-CMO yang
berikatan dengan BSA.
Gambar 9. Deteksi AFB1- CMO dengan TLC. 1 = AFB1-CMO; 2= AFB1 baku 2
ppm.
Tabel 2. Perhitungan Retention factor (Rf) AFB1 baku dan AFB1-CMO
Retention factor (Rf) Perhitungan
Rf AFB1 baku 6,3/7,0 = 0,9
Rf AFB1-CMO 3,2/7,0 = 0,45
Tabel 3. Hasil pengukuran absorbansi BSA baku dan antigen AFB1-BSA BSA (mg/ml) Absorbansi (280 nm) 0 0,000 0,25 0,199 0,5 0,381 1 0,760 2 1,321 AFB1-BSA (mg/ml) 0,650
Gambar 11. Kurva persamaan linear larutan BSA baku untuk pengukuran konsentrasi antigen AFB1-BSA
Tabel
Tabel 4. Penghitungan berat molekul pita protein antigen AFB1-BSA
Pita Protein Rf (cm) BM (kDa) Log BM
Penanda 0,250 100 2,000 0,295 85 1,929 0,378 70 1,845 0,424 60 1,778 0,515 50 1,699 0,621 40 1,602 y = -1,023x + 2,276 AFB1-BSA 0,409 72,04 1,857 BSA 0,439 66,98 1,826
0 0.5 1 1.5 2 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Purifikasi Antibodi Anti AFB1-BSA
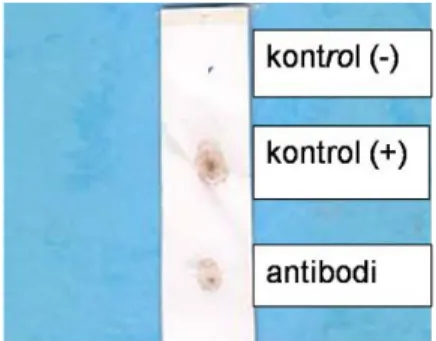
Antibodi yang digunakan diperiksa responnya terhadap antigen melalui uji DBIA. Dari hasil pengujian dapat dilihat adanya antibodi yang spesifik terhadap AFB1 dengan munculnya noktah (dot) berwarna cokelat seperti pada kontrol positif uji (Gambar 13). Hasil pemurnian terhadap antibodi anti AFB1 diukur
menggunakan spektrofotometer pada panjang gelombang 280 nm. Jumlah kadar IgG anti AFB1 yang telah dimurnikan adalah 2,846 mg/ml (Tabel 5). Pola
fraksinasi hasil purifikasi menunjukan adanya puncak tertinggi kadar IgG anti AFB1 yaitu pada fraksi 2, 3 dan 4 (Gambar 14). Hasil integrasi (alikuot) ketiga fraksi tersebut menunjukan jumlah IgG anti AFB1 sebesar 2 mg/ml.
Antibodi anti AFB1-BSA yang dianalisis dengan SDS PAGE menunjukan
satu pita protein dengan ukuran 53,52 kDa. Pita protein kontrol antibodi komersial juga menunjukan satu pita dengan kedudukan dan ukuran yang sama (Gambar 15). Penghitungan nilai mobilitas relatif (Rf) dan logaritma berat molekul pita protein ditunjukan pada Tabel 6. Dari data tersebut diperoleh kurva regresi linear dengan persamaan y= - 0,902 x + 2,390 ; R2 = 0,969. Berdasarkan persamaan regresi tersebut diperoleh ukuran berat molekul pita protein yaitu 53,52 kDa yang merupakan immunoglobulin G rantai berat. Menurut Harlow dan Lane (1988) komponen rantai berat immunoglobulin memiliki ukuran sekitar 55 kDa dan komponen immunoglobulin lain yaitu rantai ringan immunoglobulin memiliki ukuran sekitar 25 kDa.
Gambar 13. Respon antibodi anti AFB1-BSA terhadap antigen AFB1-BSA pada
uji DBIA.
Gambar 14. Pola fraksinasi kadar IgG anti AFB1-BSA hasil purifikasi
Kad ar IgG ( m g/ml) Fraksi
Tabel 5. Angka absorbansi dan kadar IgG pada setiap fraksi serum kelinci yang diimunisasi dengan AFB1-BSA.
Gambar 15. Hasil S D S P A G E terhadap antibodi anti AFB1-BSA. 1=Penanda;
2=Antibodi anti AFB1-BSA; 3 = antibodi anti AFB1 komersial.
Fraksi Absorbansi (280nm) Kadar IgG (mg/ml) 1 0,095 0,070 2 0,148 0,109 3 2,258 1,672 4 0,854 0,632 5 0,045 0,033 6 0,097 0,072 7 0,260 0,192 8 0,020 0,015 9 0,013 0,009 10 0,026 0,019 11 0,011 0,008 12 0,006 0,004 13 0,013 0,009 14 0,004 0,002 15 0,001 0,000 Total 2,846
Tabel 6. Penghitungan berat molekul pita protein antibodi anti AFB1-BSA pada
analisis SDS PAGE.
Konjugasi Antibodi Anti AFB1-BSA dengan Nanopartikel Emas
Pada titrasi antibodi anti AFB1-BSA ke dalam nanopartikel emas diperoleh
komposisi optimum pada penambahan 4 µl antibodi ke dalam 75 µl nanopartikel emas (Gambar 15). Komposisi optimum dapat tercapai sampai jumlah penambahan antibodi yang menghasilkan warna yang sama atau mendekati dengan larutan nanopartikel emas tanpa penambahan antibodi dan NaCl. Menurut Shim et al. (2007), titrasi sebelum konjugasi dilakukan untuk menentukan jumlah minimal antibodi yang diperlukan agar diperoleh larutan konjugat yang stabil. Setelah diperoleh komposisi tersebut maka dilakukan konjugasi antibodi anti AFB1 2 mg/ml sebanyak 400 µl ke dalam nanopartikel emas sebanyak 7,5 ml.
Tampak perbedaan nanopartikel emas sebelum dikonjugasi berwarna merah sedangkan sesudah dikonjugasi dengan antibodi anti AFB1-BSA menjadi warna
merah keunguan. Sistem imunostrip menggunakan format kompetitif dapat berjalan apabila terbentuk garis berwarna merah keunguan pada daerah uji dan daerah kontrol untuk hasil uji negatif. Pada pengujian sistem imunostrip diperoleh konsentrasi optimum dari antigen AFB1-BSA yaitu 1 dan 1,5 mg/ml sebanyak 1
µL dan IgG anti rabbit dengan konsentrasi 0,1 mg/ml sebanyak 1 µL dari terbentuknya garis merah keunguan pada daerah uji dan daerah kontrol (Gambar 16). Jumlah antigen AFB1-BSA pada membran nitroselulosa serta
jumlah konjugat antibodi anti AFB1-BSA dengan nanopartikel emas pada
lapisan konjugat akan menentukan limit deteksi visual dari imunostrip (Li et al., 2009). Imunostrip merupakan alat diagnostik terdiri dari dua macam yaitu menggunakan antibodi yang dilabel oleh enzim atau antibodi dilabel oleh nanopartikel emas. Saat ini penggunaan nanopartikel emas untuk imunostrip lebih menjanjikan karena ukurannya yang kecil. Menurut Chiao et al. (2004), penggunaan nanopartikel emas sebagai pereaksi penanda pada uji imunokromatografi memiliki kelebihan yaitu mempunyai mobilitas yang baik pada membran berpori, dan kecenderungan rendah untuk beragregasi selama
Pita Protein Rf (cm) BM (kDa) Log BM
Penanda 0,183 200 2,301 0,250 150 2,176 0,317 120 2,079 0,400 100 2,000 0,467 85 1,929 0,583 70 1,845 0,650 60 1,778 0,767 50 1,698 0,933 40 1,602 y = -0,902x + 2,390
antibodi anti AFB1-BSA 0,733 53,52 1,728
preparasi imunostrip, sehingga akan mempunyai sensitivitas yang tinggi untuk digunakan sebagai penanda.
Gambar 17. Komposisi optimum antigen AFB1-BSA, konjugat antibodi anti AFB1
-BSA dengan nanopartikel emas dan IgG anti rabbit pada pengujian sistem imunostrip
5 KESIMPULAN DAN SARAN
KesimpulanBerdasarkan hasil penelitian dapat disimpulkan bahwa antigen AFB1-BSA
hasil sintesis memiliki bobot molekul sekitar 72 kDa dan bereaksi spesifik dengan antibodi anti AFB1-BSA. Antibodi anti AFB1-BSA yang dimurnikan merupakan
IgG dengan bobot molekul 53,52 kDa. Antibodi (IgG) yang dikonjugasikan dengan nanopartikel emas dapat memiliki warna merah keunguan sehingga dapat digunakan sebagai penanda. Komposisi optimum imunostrip tercapai pada konsentrasi antigen AFB1-BSA 1 dan 1,5 mg/ml, IgG anti rabbit 0,1 mg/ml, dan
konjugat antibodi anti AFB1-BSA dengan nanopartikel emas pada luasan 0,5 x 0,4
cm yang ditandai dengan terbentuknya 2 garis berwarna merah keunguan pada daerah uji dan daerah kontrol. Dengan demikian dapat disimpulkan bahwa sistem imunostrip tersebut dapat digunakan untuk mendeteksi AFB1 pada sampel.
Saran
Penelitian ini masih memiliki keterbatasan sehingga perlu dikembangkan lebih lanjut. Perlu dilakukan optimasi konsentrasi konjugat antibodi anti AFB1-BSA
dengan nanopartikel emas yang akan digunakan dalam imunostrip sehingga lebih sensitif serta perlu dilakukan uji batas deteksi dari imunostrip yang dikembangkan. Untuk pemotongan bahan imunostrip serta penetesan antigen AFB1-BSA dan IgG
anti rabbit diperlukan alat pemotong yang sesuai sehingga pembuatan dan pengujian
sistem imunostrip akan lebih tepat dan akurat.
DAFTAR PUSTAKA
Agnes VF, Akbarsha MA. 2003. Spermatotoxic effect of aflatoxin B1 in the
albino mouse. Food and Chemical Toxicology. 41: 119–130.
Ahmad RZ. 2009. Cemaran kapang pada pakan dan pengendaliannya.
Jur.Litbang.Pertanian. 28(1):15-22.
AOAC. 1995. Official Methods of Analysis of AOAC International. Maryland: AOAC International.
Bahri S, Maryam R, Widiastuti R. 2005. Cemaran Aflatoksin pada Bahan Pakan dan Pakan di Beberapa Daerah Provinsi Lampung dan Jawa Timur.JITV. 10(3):236-241.
Baptista P, Pereira e, Eaton P, Doria G, Miranda A, Gomez I, Quaresma P, Franco R. 2008. Gold nanoparticles for the development of clinical diagnosis methods. Anal Bioanal Chem. 391:943-950.
Binder EM. Tan LM, Chin LJ, Handl J, Richard J. 2007. Worldwide occurrence of mycotoxins in commodities, feed, and feed ingredients. Anim. Feed
[BPOM] Badan Pengawas Obat dan Makanan 2009. HK.00.06.1.52.4011. Jenis dan Batas Maksimum Kandungan Mikotoksin dalam Makanan Jakarta (ID):BPOM [Internet]. [Diunduh 2 Oktober 2014] Tersedia pada: http://codexindonesia.bsn.go.id/uploads/download/Regulasi%20Pangan%20BP OM%20No%20HK.00.06.1.52.4011.pdf
[BSN] Badan Standardisasi Nasional (2009). Batas maksimum kandungan mikotoksin dalam pangan . SNI 7385:2009 .
[CAST] Council for Agriculture Science and Technology. 2003. Mycotoxins: Risks in Plant, Animal, and Human Systems. Task Force Report No. 139. Ames, IA:Council for Agriculture Science and Technology.
[CDC] Centers for Disease Control and Prevention. 2004. Outbreak of aflatoxin poisoning—eastern and central provinces, Kenya, January–July, 2004. MMWR 53:790–792.
Chiao DJ, Shyu RH, Hu Cs, Chiang HY, Tang SS. 2004. Colloidal gold based immunochromatographic assay for detection of botulinum neurotoxin type B. J.
Chromator.B. 809:37-41.
Chu FS, Hsia SMT, Sun PS. 1977. Preparation and characterization of aflatoxin B1
-oxime. J. Assoc. Off. Anal. Chem. 60:791-794.
Daniel JH, Lewis LW, Redwood YA, Kieszak S, Breiman RF, Flanders WD, Bell C, Mwihia J, Ogana G, Likimani S, Straetemans M, McGeehin MA. 2011. Comprehensive Assessment of Maize Aflatoxin Levels in Eastern Kenya, 2005–2007. Environtmental Health Prespectives. 119(12):1794-1799.
Deepak S. 2013. Naturally occurring mycotoxins-aflatoxin. PharmaTutor. 1(1):39-52.
[EC] Commission of the European Communities. 2010. Regulation No 165/2010 of 26 February 2010 amending regulation (EC) no 1881/2006 setting maximum levels for certain contaminants in foodstuffs as regards aflatoxins. Official
Journal of the European Union. L50:8 – 1
Friedli, GL. 2006. Interaction Of SWP With Bovine Serum Albumin (BSA)[Internet]. [diunduh pada 21 januari 2014]. Tersedia pada: http://www.friedli.com/research/PhD/chapter5.html.
Fusvita A. 2015. Pengembangan Imuostrip dengan Menggunakan Partikel Nano Emas untuk Melacak Aflatoksin M1 dalam Contoh Susu. [Tesis]. Bogor (ID):
Institut Pertanian Bogor.
Gandjar I, Samson RA, Van Den Tweel-Vermeulen K, Oetari A, Santoso I. 1999.
Pengenalan Kapang Tropik Umum. Jakarta: Yayasan Obor Indonesia.
Hames BD. 1998. Ed. Gel Electrophoresis of Protein. 3rd Ed. Newyork:Oxford Univ.
Press.
Harlow E, Lane D. 1988. Antibodies: A Laboratory Manual. New York:Cold Spring Harbor Laboratory.
He J, Zhang KY, Chen DW, Ding XM, Feng GD, Ao X. 2013. Effects of maize naturally contaminated with aflatoxin B1 on growth performance, blood
profiles and hepatic histopathology in ducks. Livestock Science. 152:192–199. Hussain Z, Khan MZ, Khan A, Javed I, Saleemi MK, Mahmood S, Asi MR. 2010.
Residues of aflatoxin B1 in broiler meat:Effect of age and dietary aflatoxin B1
[IARC] International Agency of Research on Cancer. 2002. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene. IARC Monogr.
Eval. Carcinog. Risk.Hum. 82:1-556.
Kim SH, Cha SH, Karyn B, Park SW, Son SW, Kang HG. 2011. Production of group specific monoclonal antibody to aflatoxins and its applications to enzyme-linked immunosorbent assay. Toxicol Res. 27 (2):125-131.
Kolosova AY, de Saeger S, Sibanda L, Verheijen R, van Peteghem C. 2007. Development o a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of zearalenone and deoxynivalenol. Anal. Bioanal.
Chem. 389 (26): 2103-2107.
Laemmli UK. 1970. Cleavage of Structural Protein during the assembly of the head of bacteriophage T4. Nature. 227:680-685.
Larryisgood. 2011. Colloidal gold. Wikipedia [Internet].[diunduh 25 Mei 2013]. Tersedia pada: https://en.wikipedia.org/wiki/Colloidal_gold.
Li P, Zhang Q, Zhang W. 2009. Immunoassays for aflatoxins. Trends in Analitical
Chem. 28(9): 1115-1126.
Liu BH, Yu-Tien Hsu, Chuan-Chen Lu, Feng-Yih Yu. 2013. Detecting aflatoxin B1 in foods and feeds by using sensitive rapid enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip. Food Control. 30:184-189.
Maciorowskia KG, Herreraa P, Jonesb FT, Pillaia SD, Rickea SC. 2007. Effects on poultry and livestock of feed contamination with bacteria and fungi. Animal
Feed Science and Technology. 133: 109–136.
Magnussen A, Parsi MA. 2013. Aflatoxins, hepatocellular carcinoma and public health. World J. Gastroenterol. 19(10):1508-1512.
Marin DE, Taranu I, Bunaciu RP, Pascale F, Tudor DS, Avram N, Sarca M, Cureu I, Criste R D, Suta V, Oswald IP. 2013. Changes in performance, blood parameters, humoral and cellular immune responses in weanling piglets exposed to low doses of aflatoxin. J Anim Sci. 80:1250-1257.
Mentan. 2009. Peraturan Menteri Pertanian Nomor 19/Permentan/OT.140/4 /2009 t entang Syarat dan Tatacara Pendaftaran Pakan. Jakarta (ID): Kementerian Pertanian.
Moon J, Kim G Lee S. 2012. A gold nanoparticle and AFB1-BSA conjugates
based lateral flow assay method for the analysis of AFB1. Materials. 5:
634-643.
Muñoz R, Arena ME, Silva J, González, SN. 2010. Inhibition of mycotoxyn-producing Asp. Nomius vcs 23 by lactid acid bacteria and Saccharomyces
cerevisiae. Brazilian J. Microbiol. 41:1019-1026.
Navarra G, Tinti A, Leone M, Militello V, Torreggiani A. 2009. Influence of metal ions on thermal aggregation of bovine serum albumin: aggregation kinetics and structural changes. J. Inorg. Biochem. 103: 1729-1738.
Park Y, I AR, Joo EJ, Lee J, Park H, Kang YH, Linhard RJ, Kim YS. 2011. Conjugation of genoside Rg3 with gold nanoparticle. Bull. Korean Chem. 32 (1).
Putnam FW. 1975. The Plasma Proteins: Structure, Function and Genetic
Control . New York: Academic Press.
Rachmawati S. 2005. Aflatoksin dalam Pakan Ternak di Indonesia: Persyaratan Kadar dan Pengembangan Teknik Deteksinya. Wartazoa. 15(1):26-37.