MODUL IKATAN KIMIA
Peta Konsep
Definisi Ikatan Kimia
Adalah ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut:
a. Atom yang 1 melepaskan elektron, sedangkan atom yang lain menerima elektron (serah terima elektron)
b. Penggunaan bersama pasangan elektron yang berasal dari masing-masing atom yang berikatan.
c. Penggunaan bersama pasangan elektron yang berasal dari salah 1 atom yang berikatan
Periode Unsur Nomor Atom (K L M N O P):
1. 2He (2 ) 2. 10Ne (2, 8 ) 3. 18Ar,(2, 8, 8 ) 4. 36 Kr ( 2, 8, 18, 8 ) 5. 54Xe (2, 8, 18, 18, 8) 6. 86Rn (2, 8, 18, 32, 18, 8)
Kecenderungan unsur-unsur untuk menjadikan konfigurasi elektronnya sama seperti gas mulia terdekat dikenal dengan istilah Aturan Oktet
Lambang Lewis
Adalah lambang atom yang dilengkapi dengan elektron valensinya. • Lambang Lewis gas mulia menunjukkan 8 elektron valensi (4 pasang).
• Lambang Lewis unsur dari golongan lain menunjukkan adanya elektron tunggal (belum berpasangan).
Berdasarkan perubahan konfigurasi elektron yang terjadi pada pembentukan ikatan, maka ikatan kimia dibedakan menjadi 3 yaitu : ikatan ion, ikatan logam. dan ikatan kovalen
A. IKATAN ION
Ikatan ion terbentuk akibat adanya melepas atau menerima elektron oleh atom-atom yang berikatan. Atom-atom yang melepas elektron menjadi ion positif (kation) sedang atom-atom yang menerima elektron menjadi ion negatif (anion). Ikatan ion biasanya disebut ikatan elektrovalen. Senyawa yang memiliki ikatan ion disebut senyawa ionik. Senyawa ionik biasanya terbentuk antara atom-atom unsur logam dan nonlogam. Atom unsur logam cenderung melepas elektron membentuk ion positif, dan atom unsur nonlogam cenderung menangkap elektron membentuk ion negatif. Contoh: NaCl, MgO, CaF2, Li2O, AlF3, dan lain-lain.
1.
2, 8, 1 2, 8
2, 8, 7 2, 8, 8
Na+ + e– Na
2.
Lambang titik elektron Lewis terdiri atas lambang unsur dan titik-titik yang setiap titiknya menggambarkan satu elektron valensi dari atom-atom unsur. Titik-titik elektron adalah elektron terluarnya.
Contoh-contoh lambang titik elektron Lewis
Unsur Lambang titik
Untuk membedakan asal elektron valensi penggunaan tanda (O) boleh diganti dengan tanda (x), tetapi pada dasarnya elektron mempunyai lambang titik Lewis yang mirip. Contoh penggunaan lambang titik Lewis dalam ikatan ion sebagai berikut.
1. Pada suhu kamar berwujud padat. 2. Struktur kristalnya keras tapi rapuh.
3. Mempunyai titik didih dan titik leleh tinggi.
4. Larut dalam pelarut air tetapi tidak larut dalam pelarut organik.
5. Tidak menghantarkan listrik pada fase padat, tetapi pada fase cair (lelehan) dan larutannya menghantarkan listrik.
B. IKATAN LOGAM
Ikatan logam adalah ikatan kimia yang terbentuk akibat penggunaan bersama elektron-elektron valensi antar atom-atom logam. Contoh: logam besi, seng, dan perak. Ikatan logam bukanlah ikatan ion atau ikatan kovalen. Salah satu teori yang dikemukakan untuk menjelaskan ikatan logam adalah teori lautan elektron. Contoh terjadinya ikatan logam yaitu tempat kedudukan elektron valensi dari suatu atom besi (Fe) dapat saling tumpang tindih dengan tempat kedudukan elektron valensi dari atom-atom Fe yang lain. Tumpang tindih antar elektron valensi ini memungkinkan elektron valensi dari setiap atom Fe bergerak bebas dalam ruang di antara ion-ion Fe+ membentuk lautan elektron. Karena muatannya berlawanan (Fe2+ dan 2e–), maka terjadi gaya tarik-menarik antara ion-ion Fe+ dan elektron-elektron bebas ini. Akibatnya terbentuk ikatan yang disebut ikatan logam.
Adanya ikatan logam menyebabkan logam bersifat: 1. Pada suhu kamar berwujud padat, kecuali Hg. 2. Keras tapi lentur/dapat ditempa.
3. Mempunyai titik didih dan titik leleh yang tinggi. 4. Penghantar listrik dan panas yang baik.
5. Mengilap.
C. IKATAN KOVALEN
Berdasarkan lambang titik Lewis dapat dibuat struktur Lewis atau rumus Lewis. Struktur Lewis adalah penggambaran ikatan kovalen yang menggunakan lambang titik Lewis di mana PEI dinyatakan dengan satu garis atau sepasang titik yang diletakkan di antara kedua atom dan PEB dinyatakan dengan titik-titik pada masing-masing atom.
Contoh:
1. H2
2. H2O
Sifat-sifat fisis senyawa kovalen:
1. Pada suhu kamar berwujud gas, cair (Br2), dan ada yang padat (I2); 2. Padatannya lunak dan tidak rapuh;
3. Mempunyai titik didih dan titik leleh rendah;
4. Larut dalam pelarut organik tapi tidak larut dalam air; 5. Umumnya tidak menghantarkan listrik.
Macam-macam ikatan kovalen:
1) Berdasarkan jumlah PEI-nya ikatan kovalen dibagi 3: a. Ikatan kovalen tunggal
yaitu ikatan kovalen yang memiliki 1 pasang PEI.
Contoh: H2, H2O (konfigurasi elektron H = 1; O = 2, 6)
atau
atau
b. Ikatan kovalen rangkap dua
yaitu ikatan kovalen yang memiliki 2 pasang PEI.
Contoh: O2, CO2 (konfigurasi elektron O = 2, 6; C = 2, 4)
atau
atau
c. Ikatan kovalen rangkap tiga
yaitu ikatan kovalen yang memiliki 3 pasang PEI.
Contoh: N2 (Konfigurasi elektron N = 2, 5)
atau
2) Berdasarkan kepolaran ikatan, ikatan kovalen dibagi 2: a. Ikatan kovalen polar
Ikatan kovalen polar adalah ikatan kovalen yang PEInya cenderung tertarik ke salah satu atom yang berikatan. Kepolaran suatu ikatan kovalen ditentukan oleh keelektronegatifan suatu unsur. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar, mempunyai bentuk molekul asimetris, mempunyai momen dipol ( µ = hasil kali jumlah muatan dengan jaraknya) ≠ 0.
Contoh:
1) HF
Keelektronegatifan 2,1; 4,0
Beda keelektronegatifan = 4,0 – 2,1 = 1,9
µ = q × r = 1,91 Debye
2) H2O
Keelektronegatifan 2,1; 3,5
Beda keelektronegatifan = 3,5 – 2,1 = 1,4
µ = q × r = 1,85 Debye
3) NH3
Keelektronegatifan 2,1; 3,0
Beda keelektronegatifan = 3,0 – 2,1 = 0,9
µ = q × r = 1,47 Debye
b. Ikatan kovalen nonpolar
Ikatan kovalen nonpolar adalah ikatan kovalen yang PEInya tertarik sama kuat ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom-atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri.
Contoh:
1) H2
Keelektronegatifan H = 2,1 maka Beda keelektronegatifan H2 = 0 µ = 0
Bentuk molekul simetri
2) CH4
Keelektronegatifan 2,1; 2,5
Beda keelektronegatifan = 2,5 – 2,1 = 0,4 µ = q × r = 0
Bentuk molekul simetri
3) Ikatan kovalen koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen yang PEInya berasal dari salah satu atom yang berikatan.
Contoh: NH4+
Ikatan kovalen koordinasi
Interaksi Antarmolekul
Molekul-molekul umumnya berinteraksi satu sama lainnya. Gaya tarik-menarik antarmolekul ini terjadi dan merupakan jenis interaksi antarmolekul (gaya antar molekul-molekul yang berbeda). Interaksi ini bertanggung jawab terhadap sifat fisik suatu zat, seperti titik didih, titik
leleh, serta fasa (wujud) zat. Berbeda dengan interaksi antarmolekul, interaksi intramolekul (ikatan kimia) merupakan ikatan yang terbentuk saat atom-atom bergabung membentuk molekul. Ikatan kimia berperan dalam menjaga kestabilan molekul sekaligus dapat digunakan dalam meramalkan bentuk suatu molekul. Interaksi antarmolekul lebih lemah dibandingkan ikatan kimia.
Terdapat lima jenis interaksi antarmolekul, yang disusun berdasarkan kekuatan, dari yang terlemah hingga yang terkuat, yaitu:
1. Gaya London atau Gaya Dispersi
Jenis gaya tarik yang sangat lemah ini umumnya terjadi di antara molekul-molekul kovalen nonpolar, seperti N2, H2, atau CH4. Ini dihasilkan oleh menyurut dan mengalirnya orbital-orbital elektron, sehingga memberikan pemisahan muatan yang sangat lemah dan sangat singkat di sekitar ikatan. Gaya London meningkat seiiring bertambahnya jumlah elektron. Gaya London juga meningkat seiiring bertambahnya massa molar zat, sebab molekul yang memiliki massa molar besar cenderung memiliki lebih banyak elektron. Adanya percabangan pada molekul akan menurunkan kekuatan Gaya London, sebab adanya percabangan akan memperkecil area kontak antarmolekul. Titik didih senyawa sebanding sekaligus mencerminkan kekuatan Gaya London.
2. Interaksi Dipol Terimbas (Dipol Terinduksi)
Gaya antarmolekul ini terjadi saat molekul polar mengimbas (menginduksi) molekul nonpolar. Sebagai contoh, molekul air (H2O) yang bersifat polar dapat menginduksi molekul oksigen (O2) yang bersifat nonpolar. Dipol terimbas inilah yang menyebabkan gas oksigen larut dalam air.
3. Interaksi Dipol-Dipol
Gaya antarmolekul ini terjadi bila ujung positif dari salah satu molekul dipol ditarik ke ujung negatif dari dipol molekul lainnya. Gaya ini lebih kuat dari Gaya London, namun tetap saja sangat lemah. Interaksi ini terjadi pada senyawa kovelen polar, seperti HCl dan HBr.
4. Interaksi Ion-Dipol
Gaya antarmolekul ini terjadi saat ion (kation maupun anion) berinteraksi dengan molekul polar. Kekuatan interaksi ini bergantung pada muatan dan ukuran ion serta kepolaran dan ukuran molekul polar. Kation memiliki interaksi yang lebih kuat dengan molekul polar dibandingkan anion. Salah satu contoh interaksi ini adalah hidrasi senyawa NaCl dalam air (proses ion-ion dikelilingi oleh molekul air).
5. Ikatan Hidrogen
yang terlibat pada ikatan mendapatkan muatan parsial yang sangat besar. Ikatan ini sangat polar, sehingga interaksi antarmolekul menjadi sangat kuat. Akibatnya, titik didih senyawa yang memiliki ikatan hidrogen relatif tinggi (walapun massa molarnya paling rendah) bila dibandingkan senyawa lain pada golongan yang sama.
Teori VSEPR dan Geometri Molekul
Geometri molekul atau sering disebut struktur molekul atau bentuk molekul yaitu
gambaran tiga dimensi dari suatu molekul yang ditentukan oleh jumlah ikatan dan besarnya sudut-sudut yang ada disekitar atom pusat.
Di dalam sebuah molekul atau ion poliatom terdapat atom pusat dan substituent-substituen. Substituent yang ada terikat pada atom pusat. Substituent-substituen ini dapat berupa atom
(misalnya Br atau H) dan dapat pula berupa gugus (misalnya NO2).
Terkadang sulit untuk menentukan atom pusat dari suatu molekul atau ion poliatomik. Berikut beberapa cara yang dapat digunakan untuk menentukan atom pusat yaitu sebagai berikut.
1. Atom pusat biasanya ditulis di awal rumus formulanya.
2. Atom pusat biasanya atom yang lebih elektropositif atau kurang elektronegatif.
3. Atom pusat biasanya atom yang memiliki ukuran lebih besar dari atom atau susbstituen-substituen yang ada. H ukuran paling kecil sehingga tidak pernah berlaku sebagaia atom pusat.
Contoh
BeCl2 atom pusatnya adalah Be
NH3 atom pusatnya adalah N
Elektron valensi atom pusat yang digunakan pada pembentukan senyawa kovalen terkadang digunakan untuk membentuk ikatan kadang tidak digunakan. Elektron yang tidak digunakan ditulis sebagai pasangan elektron bebas (PEB), sedangkan elektron yang digunakan dalam pembentukan ikatan ditulis sebagai pasangan elektron ikatan (PEI). Selain PEB dan PEI pada atom pusat dapat pula terdapat elektron tidak berpasangan seperti pada
molekul NO2.
Berdasarkan teori domain elektron, dalam suatu molekul elektron-elektron tersebut saling tolak-menolak karena memiliki muatan yang sama. Untuk mengurangi gaya tolak tersebut atom–atom yang berikatan membentuk struktur ruang tertentu hingga tercapai gaya tolak yang minimum. Akibat yang ditimbulkan dari tolakan yang yang terjadi yaitu mengecilnya sudut ikatan dalam molekul. Urutan gaya tolak dimulai dari gaya tolak yang
terbesar yaitu sebagai berikut.
1. Gaya tolak antar sesama elektron bebas (PEB vs PEB)
3. Gaya tolak antar pasangan elektron ikatan (PEI vs PEI).
Teori VSEPR (Valence Shell Electron-Pair Repulsion) atau Tolakan Pasangan Elektron Kulit Valensi
Para ahli kimia untuk meramalkan geometri molekul dari molekul-molekul. Teori ini mengasumsikan bahwa pasangan elektron di sekitar atom, baik itu bonding pair maupun lone pair (nonbonding pair), akan berada dalam jarak sejauh mungkin untuk meminimalkan gaya tolakan di antara elektron tersebut. Geometri pasangan elektron (domain elektron) adalah susunan pasangan elektron, baik bonding pair maupun lone pair di sekitar atom pusat. Berdasarkan jumlah domain elektron, kita dapat meramalkan bentuk molekul.
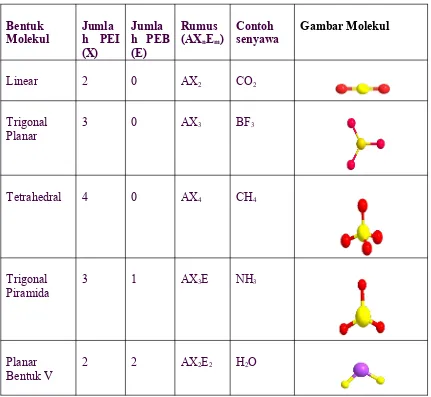
Beberapa Bentuk Molekul Berdasarkan Teori VSEPR
Pada penentuan struktur ruang molekul-molekul berdasarkan teori VSEPR umumnya
atom pusat atom pusat dilambangkan dengan A, jumlah atom yang diikat atau jumlah
pasangan elektron ikatan (PEI) dilambangkan dengan X dan pasangan elektron bebas atom
pusat dilambangkan dengan E.
Bentuk
Molekul Jumlah PEI (X)
Jumla h PEB (E)
Rumus (AXnEm)
Contoh
senyawa Gambar Molekul
Linear 2 0 AX2 CO2
Trigonal
Planar 3 0 AX3 BF3
Tetrahedral 4 0 AX4 CH4
Trigonal Piramida
3 1 AX3E NH3
Planar Bentuk V
Trigonal
Bipiramida 5 0 AX5 PCl5
Planar
Bentuk T 3 2 AX3E2 BrF3
Keterangan: PEI = pasangan elektron ikatan, PEB = pasangan elektron bebas, A= atom pusat,
Xn = jumlah atom yang diikat atom pusat, Em = jumlah pasangan elektron bebas
Selain menggunakan teori VSEPR, bentuk molekul juga dapat diramalkan melalui pembentukan orbital hibrida, yaitu orbital-orbital suatu atom yang diperoleh saat dua atau lebih orbital atom bersangkutan yang memiliki tingkat energi yang berbeda, bergabung membentuk orbital-orbital baru dengan tingkat energi sama (terjadi pada proses pembentukan ikatan kovalen). Hibridisasi adalah proses penggabungan orbital-orbital atom (biasanya pada atom pusat) untuk mendapatkan orbital hibrida.
Hubungan antara jumlah dan jenis orbital atom pusat yang digunakan pada proses hibridisasi terhadap geometri molekul senyawa bersangkutan dapat dilihat pada tabel berikut ini:
Jenis ikatan Orbital Bentuk geometrik Contoh
sp 2 Linier
BeCl2
sp2 3 Segitiga datar
BF3
sp3 4 Tetrahedral
CH4 sp3d 5 Trigonal bipiramida
PCl5
sp3d2 6 Oktahedral
SF6
Langkah-Langkah Meramal Bentuk Molekul
Langkah-langkah yang digunakan untuk meramal struktur molekul tidak berbeda jauh dengan langkah-langkah yang digunakan untuk menggambar struktur Lewis suatu molekul atau ion poliatomik. Langkah-langkah yang digunakan untuk meramal bentuk molekul sebagai berikut.
1. Menentukan atom pusat.
2. Tuliskan jumlah elektron valensi dari atom pusat.
3. Menentukan jumlah elektron valensi dari masing-masing substituen jika berupa atom.
4. Satu elektron dari substituen dipasangkan dengan satu elektron dari atom pusat sehingga
membentuk pasangan elektron (pasangan elektron ikatan, PEI). Perlu diperhatikan bahwa,
bahwa jumlah elektron atom pusat tidak selalu memenuhi kaidah oktet. Jika masih terdapat substituen dan masih terdapat elektron pada atom pusat, maka semuanya harus dipasangkan.
5. Jika semua susbtituen telah dipasangkan dengan elektron atom pusat dan masih terdapat elektron yang tidak berpasangan, maka elektron tersebut tetap ditulis pada atom pusat sebagai elektron bebas atau pasangan elektron bebas (PEB). Atau PEB dapat dicari dengan rumus:
PEB = ev . atom pusat2 −e .ikatan
6. Jika berupa ion poliatomik, maka setelah semua substituen dipasangkan kurangi elektron jika ion bermuatan positif dan tambahkan elektron jika ion bermuatan positif.
Contoh Berilium Klorida (BeCl2)
Be sebagai atom pusat memiliki 2 elektron valensi dan Cl sebagai substituen memiliki 7 elektron valensi. Setelah satu elektron valensi dipasangkan dengan satu elektron dari satu atom Be, masih terdapat satu elektron bebas pada atom Be. Oleh sebab itu, satu elektron tersebut dipasangkan dengan satu elektron dari atom Cl. Setelah semua dipasangkan tidak ada lagi elektron bebas pada atom Be. Agar tolakan minimum maka kedua atom Cl letaknya berlawanan membentuk sudut 180°.
ContohBoronTrifluoridaBF3
Boron sebagai atom pusat memiliki 3 elektron valensi sehingga setelah berikatan dengan
3 atom F maka tidak ada lagi elektron bebas disekitarnya. Agar tolakan pasangan elektron
ikatan minimal maka setiap ikatan menata diri mengarah pada pojok-pojok segitiga sama sisi.
Bentuk molekul seperti ini disebut trigonalplanar dengan sudut ikatan sebesar 120°.