GEN VIRULEN DARI DUA TIPE Vibrio harveyi
PADA DAERAH BUDIDAYA UDANG WINDU YANG BERBEDA
Endang Susianingsih dan Ince Ayu Khairana KadriahBalai Penelitian dan Pengembangan Budidaya Air Payau Jl. Makmur Dg. Sitakka No. 129, Maros 90512, Sulawesi Selatan
E-mail: e_sisy@yahoo.com
ABSTRAK
Selama satu dekade, strain dari bakteri Vibrio harveyi dilaporkan menjadi agen patogen utama yang menyebabkan tingginya tingkat kematian pada industri budidaya udang di seluruh dunia. Penelitian ini bertujuan untuk melihat keberadaan gen virulen pada bakteri V. harveyi tipe wild type (WT) dan resisten rifampicin (RRif) yang diisolasi dari beberapa lokasi budidaya udang windu. Penelitian ini dilaksanakan di Balai Penelitian dan Pengembangan Budidaya Air Payau, Maros. Sebanyak tiga isolat digunakan pada penelitian ini masing-masing kode isolate-1 yang diisolasi dari Banyuwangi, kode isolate-170 dari Takalar, dan kode isolate-275 dari Pinrang. Deteksi gen virulen dilakukan dengan metode PCR (Polymerase Chain Reaction) menggunakan primer spesifik komersil. Hasil visualisasi dengan elektroforesis menunjukkan bahwa keberadaan gen-gen virulen pada suatu isolat ada yang dapat terdeteksi pada bakteri wild type namun setelah diresistenkan dengan rifampicin tidak dapat dideteksi kembali demikian pula sebaliknya. Keberadaan gen gyrase dari bakteri kode-1 WT dapat terdeteksi dengan PCR namun pada bakteri tipe RRif tidak terdeteksi. Sebaliknya untuk gen haemolysin dapat terdeteksi pada bakteri kode-275 RRif dan 170 RRif namun tidak terdeteksi pada bakteri kode yang sama tipe WT. Hasil elektroforesis bakteri kode-1 untuk gen haemolysin dapat terdeteksi baik pada bakteri tipe WT maupun RRif. Keberadaan beberapa gen virulen akan meningkatkan patogenisitas bakteri.
KATA KUNCI: gen virulen, Vibrio harveyi, udang windu, wild type, resisten rifampicin
PENDAHULUAN
Penyakit vibriosis merupakan salah satu penyakit pada budidaya udang yang dapat menyebabkan penurunan produksi yang cukup besar. Di antara beberapa bakteri patogen penyebab penyakit, spesies
Vibrio sudah dikenal sebagai penyebab penyakit vibriosis pada udang penaeid. Bakteri Vibrio berpendar
adalah salah satu penyebab penyakit yang cukup banyak menyerang hewan budidaya seperti udang (Baticados et al., 1990; Karunasagar et al., 1994; Moriarty, 1998; Zhang & Austin, 2000), beberapa spesies ikan dan kekerangan (Austin, 2006) bahkan juga karang (Ben-Haim et al., 2003) di seluruh dunia.
Beberapa spesies Vibrio berpendar seperti Vibrio cholerae (biotype albensis), V. fischeri, V. harveyi, V.
logei, V. splendidus, V. mediterranei (Farmer & Hickman-Brenner, 1992), V. orientalis (Yang et al., 1983), Photobacterium leiognathi dan P. phosphoreum diketahui berhubungan erat dengan beberapa kejadian
penyakit pada lingkungan pembenihan dan pembesaran hewan budidaya.
Selama satu dekade, strain dari bakteri V. harveyi dilaporkan menjadi agen patogen utama yang menyebabkan tingginya tingkat kematian pada industri budidaya udang di seluruh dunia (Karunasagar
et al., 1994; Saeed, 1995; Liu et al., 1996). Penyakit kunang-kunang atau udang berpendar merupakan
masalah yang cukup serius dalam budidaya udang (P. monodon) (Austin & Zhang, 2006).
Tingkat kematian pada larva udang Penaeus monodon dan Penaeus merguensis yang disebabkan oleh penyakit kunang-kunang dilaporkan terjadi di beberapa panti perbenihan di Indonesia (Sunaryanto & Marium, 1986); Filipina (Lavilla-Pitogo et al., 1990), Taiwan (Song & Lee, 1993), Amerika Selatan (Alvarez et al., 1998), Australia (Pizutto & Hirst, 1995), dan Asia (Jiravanichpaisal et al., 1994) dengan kematian larva P. monodon dan P. japonicus mencapai 100% (Liu et al., 1996a, b). Serangan V. harveyi pada udang penaeid sering pula dinamai dengan penaeid vibriosis, penaeid bacterial septicaemia, vibrio berpendar, dan penyakit kaki merah (Cano-Gomez et al., 2009).
Umumnya penyakit pada udang windu disebabkan oleh bakteri Vibrio sp. yang diekspresikan oleh gen-gen virulen, yang mempunyai gen spesifik yaitu toxR, Lux-N GyrB, dan gen hemolysin. Gen hemolysin, GyrB, Lux-N ditemukan dalam bakteri V. harveyi sedangkan gen tox-R pertama kali ditemukan pada bakteri V. cholerae tetapi kemudian ditemukan juga pada V. parahaemolyticus dan bakteri V. harveyi. Gen Tox-R akan mengaktifkan gen-gen lainnya untuk menghasilkan produksi toksin yang berupa hemolysin seperti Thermostable Direct Hemolysin (TDH), Thermostable Related Hemolysin (TRH). Mekanisme patogen V. parahaemolyticus ada hubungannya dengan produksi gen TDH dan gen TRH ini yang memberikan respons terhadap ²-hemolisis. Untuk mengidentifikasi V. parahaemoliticus dalam waktu singkat dari sampel lingkungan dapat digunakan metode Polimerase Chain Reaction (PCR).
Tujuan dan Sasaran
Penelitian ini bertujuan untuk melihat keberadaan gen virulen pada bakteri V. harveyi tipe wild
type (WT) dan resisten rifampicin (RRif) yang diisolasi dari beberapa lokasi budidaya udang windu.
Sasaran yang ingin dicapai adalah terdeteksinya gen-gen virulen yang ada pada masing-masing isolat dengan menggunakan metode PCR.
BAHAN DAN METODE Persiapan Isolat
Isolat yang digunakan adalah isolat yang berasal dari daerah pertambakan di Banyuwangi (Jawa Timur) dengan kode isolate-1, dari daerah pertambakan di Takalar dengan kode isolate-170, serta dari daerah pertambakan di Pinrang Sulawesi Selatan dengan kode isolate-275. Penumbuhan bakteri tersebut masing-masing dilakukan pada media tumbuh TCBSA untuk bakteri dengan tipe wild type dan penumbuhan pada media TCBSA yang telah diberi antibiotik rifampicin untuk bakteri dengan tipe resisten rifampicin. Penambahan rifampicin dilakukan pada konsentrasi 50 dan 100 mg/L.
Isolat-isolat yang sudah tumbuh pada masing-masing media tersebut kemudian di inokulasi ke dalam Nutrien Broth (NB) sebanyak 1 ose. Penumbuhan dan homogenisasi dilakukan selama 4 jam (berdasarkan uji tumbuh yang telah dilakukan sebelumnya dengan menggunakan shaker (penggojok) pada kecepatan 150 rpm. Untuk memastikan sekaligus sebagai penanda bahwa bakteri yang akan kita lihat keberadaaan gen-gen virulennya adalah benar dari isolat bakteri yang telah kita isolasi sebelumnya maka penumbuhan kembali dilakukan pada media tumbuh TCBSA dengan dan tanpa penambahan antibotik rifampicin pada dosis yang sama dengan sebelumnya. Penumbuhan dilakukan selama 24 jam.
Setelah inkubasi selama 24 jam inokulasi sebanyak 1 ose untuk masing-masing isolat bakteri yang tumbuh kembali dilakukan ke dalam media NB dan ditumbuhkan selama 4 jam. Setelah itu, masing-masing biakan disentrifuse dengan kecepatan 6.000 rpm selama 10 menit yang diulang sebanyak tiga kali. Hasil akhir sentrifuse (endapan dengan membuang supernatannya untuk masing-masing biakan kemudian dimasukkan sebanyak 50 µL ke dalam eppendorf. Biakan siap untuk diekstraksi DNA-nya.
Ekstraksi DNA
Ekstraksi DNA dilakukan menggunakan metode standar ekstraksi DNA tetapi yang sudah dimodifikasi di BPPBAP.
Polimerase Chain Reaction (PCR)
Setelah pelet DNA diperoleh dengan metode ekstraksi yang dilakukan maka tahap berikutnya adalah mendeteksi keberadaan gen-gen virulen tersebut dengan menggunakan PCR. Tahapan yang dilakukan adalah:
Siapkan dan beri kode tabung PCR (200 µL). Distribusikan aqua miliq ke dalam tabung tersebut dengan volume masing-masing 20 µL/tabung. Jumlah tabung PCR yang disiapkan sebanyak jumlah sampel yang akan diuji + RTG (1 butir RTG untuk 3 tabung eppendorf).
Masukkan gen produk (Tabel 1) yang akan diideteksi yaitu Gyr-B, Hemo, Lux-N, dan Tox-R.
Tahap terakhir masukkan template yaitu ekstrak DNA ke dalam masing-masing tabung PCR sebanyak 1 µL.
Masukkan tabung eppendorf ke dalam mesin PCR dan atur program sesuai suhu reaksi untuk primer yang digunakan.
Masukkan ke dalam mikroplate well yang berisi agarose yang telah disiapkan
Suhu yang diberikan selama proses PCR berlangsung dapat dilihat pada Table 2.
Tahap berikutnya adalah melakukan elektroforesis dengan tujuan untuk mengetahui ada tidaknya gen-gen virulen pada masing-masing sampel. Elektroforesis dilakukan dengan tahapan sebagai berikut:
Sampel DNA yang akan diperiksa dicampur dengan 1 µL loading dye ( 1 µL loading dye untuk 3 µL sampel), sedangkan untuk 1 µL marker ditambahkan 2 µL loading dye
Tabel 1. Produk yang digunakan pada saat amplifikasi DNA
Gen Gen produk Produk
primer Primer urutan (5’-3)
Produk panjang
(bp)
Referensi
A2 TCTAACTATCCACCGCGG Thaithongnum et al . (2006)
B3 AGCAATGCCATCTTCACGTTC Fukui & Sawabe (2007)
Transmembran
transcriptor regulator Vh-tox R-F TTCTGAAGCAGCACTCAC 390
Conejero & Hedreyda (2003)
Vh_tox R-R TCGACTGGTGAA GACTCA
toxRF1 GAAGCAGCACTCACCGAT 382 Pang et al . (2005)
toxRR1 GGTGAAGACTCATCAGCA VHF1 ATCATGAATAAAACT 1.257 Zhang et al . (2001) ATTACGTTACT VHR1 GAAAGGATGGTTTGACAAT Vhhemo Ra GCTTGATAACACTTTGCGGT Flux N CTGTGTACTCACTGTTTATC rluxN GTCTAATTCGCGTTCTCCA Lubang dari LuxM/Kuorum 2.048 Bassler et al . (1993) Lux-N
Gyr-B Sub unit B A2 girase 363
Tox-R
Vvh Haemolisin
Tabel 2. Suhu yang digunakan selama proses PCR
Tox-R Hemolysin Gyr-B Lux-N
Predenat 94°C1’30’ 94°C1’30’ 94°C1’30’ 94°C1’30’ Denaturasi 94°C1’ 94°C1’ 94°C1’30’ 94°C1’30’ Annealing 55-57°C1’ 53°C1’ 60°C1’ 60°C1’ Elongase 72°C1’ 72°C1’ 72°C2’ 72°C2’ Ekstra elongase 72°C10’ 72°C10’ 72°C7’ 72°C7’ Nama primer
Suhu yang digunakan selama proses PCR untuk masing-masing gen
Campuran kemudian dimasukkan ke dalam masing-masing sumur elektroforesis. Siapkan 1 well pada mikroplate well untuk running marker DNA
Bak elektroforesis ditutup
Setelah DNA mencapai ¾ bagian dari panjang gel (dapat diamati dengan menggunakan migrasi pewarna loading dye) maka proses elektroforesis dapat dihentikan.
Selanjutnya pengamatan cetakan gel dilakukan dengan menggunakan ultraviolet transluminator dengan panjang gelombang 280 nm.
HASIL DAN BAHASAN
Hasil pengamatan terhadap keberadaan gen-gen virulen yang diuji pada masing-masing isolat dapat dilihat pada hasil elektroforesisi berikut ini:
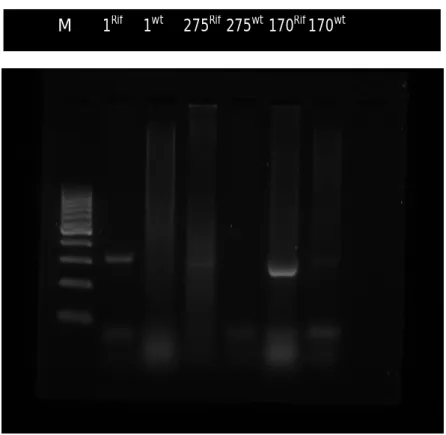
Hasil PCR dengan Program PCR seragam untuk primer hemolysin genom 1 Banyuwangi, 275 Pinrang, 170 Takalar untuk wild type dan resisten Rifamficin
Gambar 1 memperlihatkan bahwa gen-gen virulen hemolisin ini ada yang dapat tereksperesi pada kondisi wild type dan ada yang nanti terekspresi setelah dipicu dengan penambahan rifampicin yang terdeteksi pada panjang gelombang 308 base pare (bp). Hal ini sesuai dengan yang dikemukakan oleh Conejero & Hadreyda (2004), bahwa panjang pita DNA untuk gen hemolisin adalah 308 bp. Gen-gen virulen ini terdeteksi dan terekspresi pada kode isolat 1Rif dan 1wt; 275Rif ; 170Rif sedangkan untuk isolat-275wt dan 170wt tidak terekspresi.
Hal ini menunjukkan bahwa gen virulen hemolisin merupakan gen yang memiliki sifat tidak stabil dan dapat mengalami perubahan, terlihat dari terdeteksinya gen ini setelah mengalami penambahan rifampicin dari kondisi awal yang wild type di mana gen ini tidak terekspresi. Hal ini sesuai pendapat Cano Gomes et al. (2009) yang menyatakan bahwa gen virulen hemolysin merupakan gen yang menyandikan sifat patogen/gen yang bertanggung jawab pada suatu sifat virulensi, di
Gambar 1. Hasil PCR genom Banyuwangi, Takalar, dan Pinrang untuk gen hemolysin
mana gen-gen seperti ini sifatnya tidak stabil dan dapat mengalami transfer antar bakteri secara horizontal.
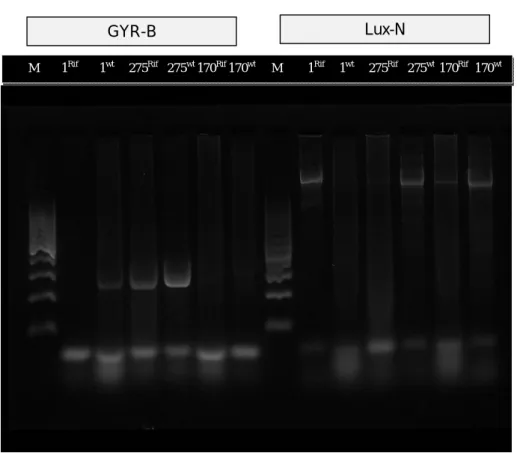
Hasil PCR dengan program PCR seragam untuk primer Gyr dan Lux-N genom 1 Banyuwangi, 275 Pinrang, 170 Takalar untuk wild type dan resisten Rifamficin
Gambar 2. Hasil PCR genom Banyuwangi, Takalar, dan Pinrang untuk gen Gyr dan Lux-N
M 1Rif 1wt 275Rif 275wt 170Rif 170wt M 1Rif 1wt 275Rif 275wt 170Rif 170wt
GYR-B Lux-N
Gambar 2 memperlihatkan bahwa untuk gen Gyr-B terdokumentasikan pada panjang pita DNA 363 bp, sesuai dengan rujukan Thaithongnum et al. (2006) bahwa panjang produk PCR untuk gen Gyr-B adalah 363 bp, sehingga isolat-isolat yang mengekspresikan gen Gyr-B tersebut berdasarkan hasil elektroforesis di atas adalah isolat 1wt, 275wt, dan 275Rif sedangkan isolat 170wt dan 170Rif tidak mengekspresikan gen tersebut.
Gen Gyr-B adalah gen yang sifatnya membantu dalam proses amplifikasi DNA. Gen ini terekspresi pada isolat-275 baik pada sifat alaminya (wild type) maupun setelah dipicu dengan penambahan rifampicin. Hal ini tidak terlihat pada isola-170 yang walaupun telah diberi penambahan rifampicin namun tetap tidak dapat mengeskpresikan gen Gyr-B tersebut. Hal ini menandakan bahwa secara alami gen Gyr-B tersebut memang tidak dimiliki oleh isolat-170.
Untuk gen Lux-N terdokumentasi pada panjang pita DNA 2.048 bp. Hal ini sesuai dengan rujukan literatur berdasarkan Bassleret et al. (1993). Dari hasil yang tervisualisasikan terlihat bahwa semua isolat yang diamati memiliki dan dapat mengekspresikan gen Lux-N tersebut.
Keberadaan gen Lux-N yang terdeteksi pada semua isolat dikarenakan semua isolat yang digunakan adalah spesies Vibrio yang memiliki kemampuan untuk mengeluarkan cahaya atau berpendar. Sifat berpendar ini dikendalikan oleh gen Lux-N yang merupakan gen yang bertanggung jawab untuk sifat tersebut (Defoirdt et al., 2007ª).
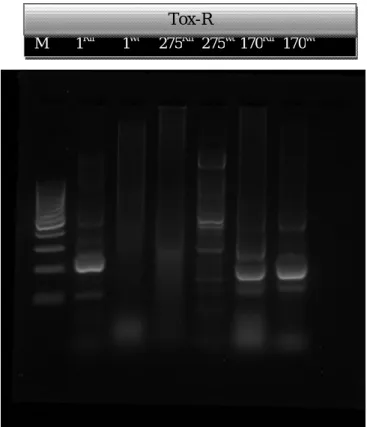
Hasil PCR dengan program PCR seragam untuk primer Tox-R genom 1 Banyuwangi, 275 Pinrang, 170 Takalar untuk wild type dan resisten Rifamficin
Gambar 3. Hasil PCR Genom Banyuwangi, Takalar, dan Pinrang untuk Tox-R
M 1Rif 1wt 275Rif 275wt 170Rif 170wt Tox-R
Hasil PCR dengan panjang pita DNA 263 bp untuk menunjukan keberadaan gen tox-R, yang terdeteksi dan terekspresi pada isolat 1Rif, 1wt, 275Rif, 170Rif, dan 170wt sedangkan pada kode isolate-275wt gen tersebut tidak terekspresikan.
Hasil deteksi untuk gen Tox-R menunjukkan bahwa gen tersebut dapat terekspresi pada isolat baik pada kondisi wild type maupun setelah dipicu dengan penambahan rifampicin. Gen Tox-R ini berfungsi sebagai gen pengaturan untuk ekspresi gen protein membran luar dan untuk mengeluarkan racun dari tubuh udang (okuda et al., 2001).
KESIMPULAN
Keberadaan gen-gen virulen pada suatu isolat ada yang dapat terekspresi pada kondisi wild type dan ada yang nanti terekspresi setelah dipicu dengan penambahan rifampicin. Keberadaan dan jumlah gen virulen yang dimiliki oleh suatu spesies kemungkinan berperan pada perbedaan dan tingkat patogenisitas yang dimiliki oleh spesies tersebut. Hal ini berimplikasi pada semakin banyaknya gen virulen yang dimiliki oleh suatu spesies maka tingkat patogenisitas dari spesies tersebut akan semakin besar pula, demikian juga sebaliknya.
DAFTAR ACUAN
Alvarez, J.D., Austin, B., Alvarez., A.M., & Reyes, H. 1998. Vibrio harveyi: A pathogen of shrimps and fish in Venezuela. J. Fish Dish., 21: 313-316.
Austin, B. & Zhang, X.H. 2006. Vibrio harveyi: A significant pathogen of marine vertebrates and invertebrates. Lett. Appl. Microbiol., 43: 119-124.
Cano-Gomez, A., Bourne, D.G., Hall, M.R., Owens, L., & Hoj, L. 2009. Moleculer identification, typing and tracking of Vibrio harveyi in aquaculture sistem : Current Methods and Future Prospects.
Aquaculture, 287: 1-10.
Ben Haim, Y., Thompson, F.L., Thompson, C.C., Cnockaert, M.C., Hoste, B., Swings, J., & Rosenberg, E. 2003. Vibrio coralliilyticus sp. nov., a temperature-dependent pathogen of the coral Pocillopora
Canejero, M.J.U. & Hedreyda, C.T. 2004. PCR detection of Hemolisyn (vhh) gene in Vibrio harveyi. J.
Gen. Appl. Microbiol., 50: 137-142.
Defoirdt, T., Verstraete, W., & Bossier, P. 2007a. Luminescence, virulence, and quorumsensing signal production by pathogenic Vibrio campbelii and Vibrio harveyi isolates. J. Appl. Microbiol., 104: 1,480-1,487.
Karunasagar, I., Pai, R., Malathi, G.R., & Karunasagar, I. 1994. Mass mortality of Penaeus monodon larvae due to antibiotic-resistant Vibrio harveyi infection. Aquaculture, 128: 203–209.
Lavilla-Pitogo, C.R., Baticados, M.C.L., Cruz-Lacierda, E.R., & Pena, L.D. 1990. Occurrence of luminous bacterial disease of Penaeus monodon larvae in the Philippines. Aquaculture, 91: 1–13.
Liu, P.C., Lee, K.K., & Chen, S.N. 1996a. Pathogenicity of different isolates of Vibrio harveyi in tiger prawn, Penaeus monodon. Lett. Appl. Microbiol., 22: 413-416.
Okuda, J., Nakai, T., Chang, P.S., Oh, T., Nishino, T., Koitabashi, T., & Nishibuchi, M. 2001. The Tox-R gene of Vibrio (Listonella) anguillarum controls expression of the major outermembrane protein but not virulence in a natural host models. Infect. Immun., 69: 6,091-6,101.
Pizzuto, M. & Hirst, R.G. 1995. Classification of isolates of Vibrio harveyi virulent to Penaeus monodon larvae by protein profile analysis and M13 DNA fingerprinting. Dis. Aquat. Org., 21: 61–68. Sunaryanto, A. & Mariam, A. 1986. Occurrence of a pathogenic bacteria causing luminescence in
penaeid larvae in Indonesian hatcheries. Bull. Brackishwater Aquac. Dev. Cent., 8: 64–70.
Song, Y.L. & Lee, S.P. 1993. Characterization of ecological implication of luminous Vibrio harveyi isolated from tiger shrimp (Penaeus monodon). Bull. Inst. Zool. Acad. Sin., 32: 217–220.
DISKUSI
Nama Penanya: Rohama Daud Pertanyaan:
Apakah bakteri V. harveyi dapat dideteksi sebelum kematian untuk mencegah kematian massal
Tanggapan
Sudah ditemukan primer dengan sensitivitas cukup tinggi semogamampu menjadi alat deteksi dini sehingga terhindar dari kematian massal
Nama Penanya: Imron Pertanyaan:
DO hasil tersebut apakah wild type aman/tidak virulen? Sebaran geografis? Tanggapan
Kemungkinan karena lingkungan dari wild type belum memicu virulen dari bakteri tidak ada bedanya.