KEANEKARAGAMAN JAMUR ASOSIASI SPONS DI
EKOSISTEM MANGROVE PULAU KEMUJAN KARIMUNJAWA
DENGAN MENGGUNAKAN METODE REPETITIVE PCR DAN
DNA BARCODING
Oleh :
STEFANIE JESSICA HENNY L
26020116130164
Pembimbing :
Prof. Dr. Ir. Agus Sabdono, M.Si Mada Tiandala Sibero, S.Pi, M.Si
DEPARTEMEN ILMU KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
UNIVERSITAS DIPONEGORO
SEMARANG
2019
BAB I. PENDAHULUAN
1.1.Latar Belakang
Indonesia merupakan Negara yang memiliki tingkat keanekaragaman hayati yang tinggi. Keanekaragam hayati laut (marine biological diversity atau biodiversity) adalah istilah untuk menerangkan keanekaragaman ekosistem laut dan organisme yang menetap atau berasosiasi diekosistem tersebut. Ekosistem laut memiliki 3 komponen penting, yaitu ekosistem terumbu karang, lamun, dan mangrove. Tentu saja dari ketiga ekosistem ini memiliki biodiversitas yang berbeda.
Hutan mangrove merupakan salah satu ekosistem pesisir yang memiliki karakteristik khas dan memiliki fungsi yang cukup penting di wilayah pesisir. Keberadaan hutan mangrove di kawasan pesisir secara ekologi dapat berfungsi sebagai penahan lumpur dan sediment trap, termasuk limbah-limbah beracun yang dibawa oleh aliran air permukaan. Bagi biota perairan, hutan mangrove digunakan sebagai spawning ground, feeding ground, dan juga nursery ground (Pariyono, 2006). Ekosistem hutan mangrove merupakan salah satu ekosistem yang memiliki produktivitas tinggi dibandingkan ekosistem lain dengan dekomposisi bahan organik yang tinggi, dan menjadikannya sebagai mata rantai ekologis yang sangat penting bagi kehidupan mahluk hidup yang berada di perairan sekitarnya. Materi organik menjadikan hutan mangrove sebagai tempat sumber makanan dan habitat berbagai biota seperti ikan, udang dan kepiting (Kapludin, 2012).
Mangrove merupakan tumbuhan yang kaya akan senyawa bioaktif. Senyawa bioaktif yang terdapat dalam bagian-bagian mangrove tidak selalu berasal dari tanaman mangrove itu sendiri, tetapi dapat berasal dari organisme lain yang mengsintesis bioaktif tersebut di dalam bagian mangrove. Ekosistem mangrove termasuk ekosistem pantai yang memiliki fungsi ekologis dan biologis. Pada ekosistem mangrove terdapat beranekaragam komunitas flora dan fauna serta kelompok mikroorganisme. Kelompok mikroorganisme yang terdapat pada ekosistem mangrove salah satunya ialah komunitas jamur. Komunitas jamur adalah komponen
penting pada ekosistem mangrove dan berkontribusi untuk penguraian bahan organik yang terjadi pada jaringan tumbuhan mangrove termasuk daun, (Suciatmih 2015).
Spons merupakan salah satu invertebrate laut yang memiliki kandungan metabolit sekunder, sehingga menadi target eksplorasi sumber senyawa bioaktif alami ( Sukarni dan Radjasa, 2007). Untuk memperoleh senyawa bioaktif dari suatu organisme dapat dilakukan dengan mengekstrak organisme tersebut. Akan tetapi hal ini akan menimbulkan suatu masalah, karena dalam proses ekstraksi membutuhkan massa organisme spons yang sangat besar. Hal tersebut dapat dihindari dengan memanfaatkan mikroorganisme yang berasosiasi seperti jamur. Oleh karena itu perlu diketahui keanekaragaman jamur yang berasosiasi dengan spons .
Taman Nasional Karimunjawa merupakan kawasan konservasi yang terletak di utara Laut Jawa dengan luas kawasan mencapai 111.625 Ha dengan koordinat 5 40’-5 57’ LS dan 110 04’ – 110- 40’ BT. Kondisi perairan yang masih asli dengan rata-rata penutupan terumbu karang pada kondisi baik yaitu 49,89%. Taman Nasional Karimunjawa ditetapkan sebagai Cagar Alam Laut pada tanggal 9 April 1996 melalui Surat Keputusan Menteri Kehutanan No. 123/Kpts-II/1986. Selanjutnya kawasan ini diubah penetapannya menjadi Taman Nasional Karimunjawa melalui Surat Keputusan Menteri Kehutanan No.78/Kpts-II/1999. Pada penelitian sebelumnya telah diketahui bahwa biodiversitas organisme di Karimunjawa sangat beragam. Hal inilah yang mendasari penelitian ini, karena sampai saat ini informasi mengenai keanekaragaman fungsi asosiasi spons pada ekosistem mangrove di Indonesia masih sangat terbatas. Penelitian ini bertujuan untuk mengetahui keanekaragaman jamur yang berasosiasi dengan spons pada ekosistem mangrove.
1.2.Tujuan
1. Mengetahui keanekaragaman jaamur asosiasi spons di Mangrove
2. Mengetahui spesies jamur asosiasi spons pada Mangrove di Pulau Kemujan, Karimunjawa, Jepara
1.3. Kegunaan
1.3.1. Bagi Mahasiswa
a. Mengetahui diversitas jamur asosiasi spons pada ekosistem Mangrove di Karimunjawa
b. Mengetahui spesies Jamur yang berasosiasi dengan spons pada ekosistem mangrove di Karimun Jawa
1.3.2. Bagi UNDIP Departemen Ilmu Kelautan
a. Mencetak calon tenaga kerja yang terampil dan jujur dalam menjalankan tugas.
b. Memberi masukan untuk mengevaluasi kesesuaian kurikulum yang sudah diterapkan dengan kebutuhan tenaga kerja yang terampil di bidangnya. c. Menjadi sarana pengenalan instansi pendidikan Universitas Diponegoro
khususnya Departemen Ilmu Kelautan kepada instansi ataupun instansi yang membutuhkan lulusan atau tenaga kerja yang dihasilkan oleh Universitas Diponegoro.
1.3.3 Bagi Instansi yang bersangkutan
a) Memanfaatkan sumber daya yang potensial.
b) Menambah Informasi mengenai keanekaragaman jamur asosiasi spons di ekosistem Mangrove.
c) Menjadi sarana untuk menjembatani hubungan kerja sama antara instansi dengan Universitas dimasa yang akan datang, khususnya mengenai rekruitmen tenaga kerja.
d) Menjadi sarana untuk mengetahui kualitas pendidikan yang ada di Universitas.
II. TINJAUAN PUSTAKA
2.1 Balai Taman Nasional Karimunjawa
Taman Nasional Karimunjawa merupakan kawasan konservasi yang terletak di utara Laut Jawa dengan luas kawasan mencapai 111.625 Ha. Taman Nasional Karimunjawa ditetapkan sebagai Cagar Alam Laut pada tanggal 9 April 1996 melalui Surat Keputusan Menteri Kehutanan No. 123/Kpts-II/1986. Selanjutnya kawasan ini diubah penetapannya menjadi Taman Nasional Karimunjawa melalui Surat Keputusan Menteri Kehutanan No.78/Kpts-II/1999. Kawasan Taman Karimunjawa memiliki ekosistem hutan tropis dataran rendah dan pantai, hutan mangrove dan terumbu karang. Ekosistem tersebut merupakan potensi yang harus dijaga kelestariannya dengan tujuan agar dapat menjadi tempat hidupan liar di perairan utara laut jawa.
Taman Nasional Karimunjawa melakukan identifikasi dan inventarisasi untuk mengetahui dengan detail flora dan fauna yang terdapat di Kawasan tersebut. Saat ini terdata 102 jenis vegetasi di hutan hujan tropis dataran rendah, 42 jenis mangrove yang terdiri dari 25 mangrove sejati dan 17 mangrove ikutan. Vegetasi pantai terdiri dari 36 jenis, padang lamun 9 jenis dan makroalga 99 jenis. Untuk jenis fauna terutama Pisces tercatat 412 jenis, Anthozoa terdiri dari 18 famili atau 76 genus (Statistik, 2017). Sampai dengan 2017 hiu paus belum tercatat sebagai jenis yang ada di Taman Nasional Karimunjawa (Anonimous, 2017).
Upaya konservasi jenis dilakukan untuk terus menjamin kelestarian tumbuhan dan satwa yang ada di kawasan Taman Nasional Karimunjawa. Upaya pengelolaan tersebut dituangkan dalam berbagai kegiatan pembinaan populasi dan pembinaan habitat. Pembinaan populasi diprioritaskan pada jenis-jenis yang diindikasikan telah mengalami penurunan populasi terlebih jenis yang mempunyai nilai ekonomis tinggi. Pembinaan habitat dilakukan dengan tujuan utama untuk memulihkan habitat
tumbuhan dan satwa sehingga habitat tesebut akan mampu mendukung keberlangsungan hidup tumbuhan dan satwa.
2.1.1. Letak Administratif dan Geografis
Taman Nasional Karimunjawa terletak di utara pulau Jawa yang secara geografis Taman Nasional Karimunjawa terletak pada koordinat 5°40’39” - 5°55’00” LS dan 110°05’ 57” - 110°31’ 15” BT. Secara administratif kawasan ini termasuk Kecamatan Karimunjawa, Kabupaten Jepara, Propinsi Jawa Tengah. Taman Nasional ini memiliki luas 111.625 ha yang meliputi 110.117,30 ha kawasan perairan dan 1.507,70 ha kawasan darat. Taman Nasional Karimunjawa merupakan satu-satunya kawasan pelestarian alam perairan yang berada di Propinsi Jawa Tengah yang merepresentasikan dari keutuhan dan keunikan pantai utara Jawa Tengah.
Saat ini Taman Nasional Karimunjawa dikelola oleh Balai Taman Nasional Karimunjawa dengan tugas utama melaksanakan pengelolaan ekosistem kawasan Taman Nasional Karimunjawa dalam rangka konservasi Sumber Daya Alam Hayati dan Ekosistemnya berdasarkan peraturan perundangan yang berlaku. Dalam pengelolaan terdapat banyak tantangan untuk memadukan konservasi dan pembangunan ekonomi yang memerlukan dukungan seluruh pihak. Gambaran peta zonasi dari Kecamatan Karimunjawa dapat dilihat pada Gambar di bawah ini:
Gambar 1. Peta Taman Nasional Karimunjawa
(Sumber : tnkarimunjawa.id)
Kepulauan Karimunjawa juga memiliki kekayaan sumberdaya alam yang beragam, seperti hutan mangrove, terumbu karang, dan padang lamun. Faktanya sebagian besar penduduknya yang berjumlah lebih dari 40 persen penduduknya (BPS, 2014) adalah nelayan yang menggantungkan hidupnya pada sumber daya perikanan. Sumber daya perikanan menjadi andalan dalam pengembangan perekonomian di kawasan ini.
2.2. Mangrove
Mangrove didefinisikan sebagai tumbuhan atau komunitas yang terdapat di daerah pasang surut, juga didefinisikan sebagai formasi tumbuhan daerah litoral yang khas di pantai daerah tropis dan subtropis yang terlindung. Tumbuhan mangrove yang terdapat di Indonesia berjumlah 43 jenis mangrove sejati. Di seluruh dunia tercatat 60 jenis tumbuhan mangrove sejati dan dengan demikian Indonesia memiliki keanekaragaman jenis tumbuhan mangrove yang cukup tinggi. Slah satu suku tumbuhan mangrove adalah kelompok Rhizophoraceae yang memiliki karakteristik berupa akar tunjang akar papan ataupun akar lutut. Selain itu memiliki hipokotil yang sudah berkecambah ketika masih berada di pohon, sehingga suku ini relatif lebih mudah dikembangbiakkan untuk revegetasi wilayah pesisir.
Setyawan, dkk, (2002) menyatakan secara taksonomi tumbuhan mangrove diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Magnoliophyta Class : Magnoliopsida
Ordo : Scrophulariales, Myrtales
Family : Acanthaceae, Sonneratiaceae, Rhizophoraceae, Arecaceae Genus : Avicennia, Sonneratia, Rhizophora, Bruguiera, Nypa
Fungsi dan manfaat hutan magrove dalam kehidupan masyarakat yang hidup di daerah pesisir sangat banyak sekali. Baik itu langsung dirasakan oleh penduduk
sekitar maupun manfaat dan fungsi yang tidak langsung dari hutan mangrove itu sendiri. Fungsi hutan mangrove dapat dikategorikan menjadi tiga, yaitu biologis/ekologis, fisik, dan ekonomi atau produksi.
a. Fungsi dan Manfaat Biologis/Ekologis.
Hutan mangrove sebagai sebuah ekosistem terdiri dari komponen biotik dan abiotik. Komponen biotik terdiri dari vegetasi mangrove yang meliputi pepohonan, semak, dan fauna. Sedangkan komponen abiotik yang mempengaruhi pertumbuhan dan perkembangan hutan mangrove adalah pasang surut air laut, lumpur berpasir, ombak laut, pantai yang landai, salinitas laut, dan lain sebagainya. Secara biologi hutan mangrove mempunyai fungsi sebagai daerah berkembang biak (nursery ground), tempat memijah (spawning ground), dan mencari makanan (feeding ground) untuk berbagai organisme yang bernilai ekonomis khususnya ikan dan udang. Habitat berbagai satwa liar antara lain, reptilia, mamalia, dan lain-lain. Selain itu, hutan mangrove juga merupakan sumber plasma nutfah. Ekosistem hutan mangrove memiliki produktivitas yang tinggi. Produktivitas primer ekosistem mangrove ini sekitar 400-500 gram karbon/m2 /tahun adalah tujuh kali lebih produktif dari ekosistem perairan pantai lainnya. Oleh karenanya, ekosistem mangrove mampu menopang keanekaragaman jenis yang tinggi. Daun mangrove yang berguguran diuraikan oleh jamur, bakteri dan protozoa menjadi komponen-komponen bahan organik yang lebih sederhana (detritus) yang menjadi sumber makanan bagi banyak biota perairan (udang, kepiting dan lain-lain) (Kustanti, 2011).
2.3. Spons
Spons adalah hewan multi sel dari filum Porifera yang fungsi organ dan jaringannya masih sederhana. Filum Porifera terdiri dari empat kelas, yaitu: Calcarea, Demospongiae, Hexactinellida, dan Sclerospongia Warren (1982), Kozloff (1990), Harrison dan De Vos (1991), Pechenik (1991), Ruppert dan Barnes (1991). Sedangkan menurut Haywood dan Wells (1989), Sara (1992), Rachmaniar (1996), Romimohtarto dan Juwana (1999), Filum Porifera dibagi menjadi tiga kelas, yaitu:
Calcarea, Demospongiae, dan Hexactinelida. Spons hidup menetap pada suatu habitat, misalkan pada karang-karang mati di dalam laut. Spons termasuk dalam hewan filter feeder karena hewan ini sangat aktif menyaring dan menghisap air yang melalui permukaan tubuhnya.
Kelas Demospongia adalah kelompok spons yang tersebar luas di alamyang memiliki jumlah spesies yang sangat banyak. Kelas ini merupakan kelas yang paling dominan hingga saat ini. Spikula beberapa spesies kelas ini terdiri dari silikat dan beberapa terdiri hanya dari serat kolagen, serat spongin atau bahkan ada yang tidak memiliki spikula. Kelas ini biasanya berbentuk massive. Kelas Calcarea merupakan spons yang spikulanya terdiri dari kalsium karbonat dalam bentuk calcite. Spons Kelas Calcarea memiliki struktur yang paling sederhana. Kelas Hexactinellida merupakan spons gelas. Mereka kebanyakan hidup di laut dalam dan tersebar luas. Spikulanya terdiri dari silikat dan tidak mengandung spongin (Warren 1982; Kozloff 1990; Brusca & Brusca 1990; Ruppert & Barnes 1991; Romimohtarto & Juwana 1999).
Spons hidup dengan cara melekat pada habitat berpasi atau bebatuan yang sangat dipengaruhi oleh faktor fisik, kimiawi, dan biologis lingkungannya. Spons dapat berbentuk massive atau berbentuk sederhana seperti tabung. Specimen yang berada di lingkungan yang terbuka dan bergelombang besar cenderung memiliki pertumbuhan yang relative pendek. Sebaliknya, specimen dari lingkungan yang berarus tenang cenderung memiliki pertumbuhan cepat dan tinggi.
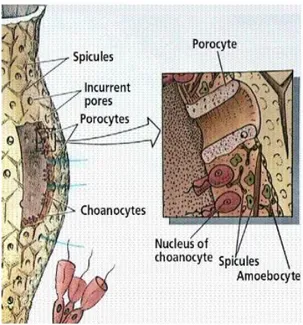
Secara umum, struktur organ spons tersusun dari dinding luar berpori (astia) yang berguna untuk menghisap air dan material kecil disekitarnya yang kemudian disaring oleh sek berbulu cambuk atau sel kolar (choanocytes), kemudian air tersebut dipompakan keluar melalui lubang tengah (oskulum) (Amir dan Budiyanto, 1996). Pada umumnya, spons mampu memompakan air rata-rata sebanyak 10 kali volume tubuhnya dalam waktu 1 menit, sehingga hewan ini dikenal sebagai hewan filter feeder yang paling efisien dibandingkan hewan laut lainnya (Bergquist, 1978).
Dinding tubuh spons terorganisasi secara sederhana. Lapisan luar dinding tubuh disusun oleh sel-sel pipih yang menyerupai sel epitel pada hewan lain, yang disebut
pinacocytes, membentuk lapisan pinacoderm. Perbedaan sel ini dengan sel epitel hewan lainnya adalah tidak adanya basal lamina dan saluran interseluler, serta dapat berkontraksi atau menyusut, sehingga dapat mengubah ukuran spons. Selain itu, sel pinacocyte menghasilkan material seksresi yang dapat melekatkan spons ke substratnya.Pada dinding tubuh spons juga terdapat pori-pori yang dibentuk oleh porocyte, yaitu sel berbentuk cincin yang berkembang dari permukaan luar ke bagian spongocoel. Sel-sel ini dapat membuka dan menutup dengan adanya kontraksi.
Gambar 2. Struktur organisasi tubuh spons (Sumber: www.maricopa.edu)
Pada bagian dalam pinacoderm terdapat mesohyl, yang terdiri dari matriks protein bergelatin yang mengandung skeleton dan sel-sel amoeboid. Lapisan ini berfungsi seperti jaringan ikat pada metazoa lainnya. Skeleton spons demospongia terbentuk dari spikula bersilika dan serat protein spongin. Materi inilah yang membentuk dan menyokong bangun tubuh spons. Spikula spons memiliki jenis yang beragam, sehingga dijadikan dasar untuk identifikasi spons. Secara umum, spikula terbagi menjadi megascleres (spikula berukuran besar dan merupakan elemen penyokong utama dalam skeleton) dan microscleres (spikula berukuran kecil). Spikula berada di dalam mesohyl, namun sering juga ditemukan pada lapisan pinacoderm. Sementara itu, serat spongin merupakan serat protein yang menyerupai kolagen.
Spons dengan serat spongin yang berlimpah, biasanya memiliki morfologi yang keras dan padat (kasar). Selain itu, pada banyak spesies, seringkali sebagian atau keseluruhan spikula bersilika ditutupi oleh serat spongin ini, sehingga menjadi lebih kaku. Sel-sel amoeboid dapat ditemukan pada mesohyl, dan tersusun dari beberapa jenis sel. Archaeocyt adalah sel berukuran besar dengan nukleus yang besar pula. Sel ini merupakan sel fagositosis dan berperan dalam digesti makanan. Sel ini juga bersifat totipotent (dapat berubah fungsi), sehingga dapat berubah fungsi menjadi sel lain yang dibutuhkan oleh spons. Sel-sel tetap yang disebut dengan collencytes, berfungsi mensekresikan jaringan kolagen yang menyebar pada dinding tubuh spons. Spikula pembentuk skeleton dihasilkan oleh sel-sel sclerocyte yang bersifat amoeboid. Sementara jaringan spongin merupakan hasil sekresi sel-sel spongocytes. Choanocytes, adalah lapisan sel yang terdapat pada bagian dalam mesohyl, sejajar dengan spongocoel. Sel ini memiliki struktur yang menyerupai protozoa choanoflagelata. Choanocyte berbentuk bulat, dengan satu ujungnya terhubung ke mesohyl. Sisi berlawanan dengan bagian tersebut memiliki flagella yang dikelilingi oleh mikrovilli. Sel choanocyte berperan dalam pergerakan air dalam tubuh spons dan untuk menyediakan makanan (Rupert & Barnes 1994).
2.4. Jamur
Secara umum, jamur dapat didefinisikan sebagai organisme eukariotik yang mempunyai inti dan organel. Jamur tersusun dari hifa yang merupakan benangbenang sel tunggal panjang, sedangkan kumpulan hifa disebut dengan miselium. Miselium merupakan massa benang yang cukup besar dibentuk dari hifa yang saling membelit pada saat jamur tumbuh. Jamur mudah dikenal dengan melihat warna miseliumnya (Volk and Wheeler, 1993). Organisme yang disebut jamur bersifat heterotrof, dinding sel spora mengandung kitin, tidak berplastid, tidak berfotosintesis, tidak bersifat fagotrof, umumnya memiliki hifa yang berdinding yang dapat berinti banyak (multinukleat), atau berinti tunggal (mononukleat), dan memperoleh nutrien dengan cara absorpsi (Gandjar dkk, 2006).
Bagian penting tubuh jamur adalah suatu struktur berbentuk tabung menyerupai seuntai benang panjang, ada yang tidak bersekat dan ada yang bersekat. Hifa dapat
tumbuh bercabang-cabang sehingga membentuk jaring-jaring, bentuk ini dinamakan miselium. Pada satu koloni jamur ada hifa yang menjalar dan ada hifa yang menegak. Biasanya hifa yang menegak ini menghasilkan alat-alat pembiak yang disebut spora, sedangkan hifa yang menjalar berfungsi untuk menyerap nutrien dari substrat dan menyangga alat-alat reproduksi. Hifa yang menjalar disebut hifa vegetatif dan hifa yang tegak disebut hifa fertil. Pertumbuhan hifa berlangsung terus-menerus di bagian apikal, sehingga panjangnya tidak dapat ditentukan secara pasti. Diameter hifa umumnya berkisar 3-30 µm. Jenis jamur yang berbeda memiliki diameter hifa yang berbeda pula dan ukuran diameter itu dapat dipengaruhi oleh keadaan lingkungan (Carlile and Watkinson, 1994).
Hifa adalah benang halus yang merupakan bagian dari dinding tubuler yang mengelilingi membran plasma dan sitoplasma. Jamur sederhana berupa sel tunggal atau benang-banang hifa saja. Jamur tingkat tinggi terdiri dari anyaman hifa yang disebut prosenkim atau pseudoparenkim. Prosenkim adalah jalinan hifa yang kendor dan pseudoparenkim adalah anyaman hifa yang lebih padat dan seragam. Sering terdapat anyaman hifa yang padat dan berguna untuk mengatasi kondisi buruk yaitu rhizomorf atau sklerotium. Ada pula yang disebut stroma yaitu jalinan hifa yang padat dan berfungsi sabagai bantalan tempat tumbuhnya bermacam-macam bagian lainnya (Sasmitamihardja, 1990). Sebagian besar jamur membentuk dinding selnya dari kitin, yaitu suatu polisakarida yang mengandung pigmen-pigmen yang kuat namun fleksibel (Kimball, 1999).
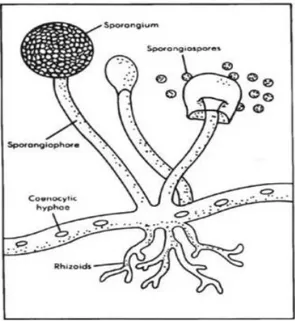
Gambar 3. Struktur tubuh jamur Rhizopus sp. (Sumber: Darliah, 2009) 2.4.1. Klasifikasi Jamur
Setiap jamur tercakup di dalam salah satu dari kategori taksonomi, dibedakan atas dasar tipe spora, morfologi hifa dan siklus seksualnya. Kelompokkelompok ini adalah : Oomycetes, Zygomycetes, Ascomycetes, Basidiomycetes dan Deuteromycetes. Terkecuali untuk deuteromycetes, semua jamur menghasilkan spora seksual yang spesifik (Mc-Kane, 1996). Klasifikasi jamur dapat dijelaskan sebagai berikut :
1. Oomycetes
Dikatakan sebagai jamur air karena sebagian besar anggotanya hidup di air atau di dekat badan air. Hanya sedikit yang hidup di darat. Miseliumnya terdiri atas hifa yang tidak bersekat, bercabang, dan mengandung banyak inti. Hidup sebagai saprofit dan ada juga yang parasit. Pembiakan aseksualnya dengan zoospora, dan dengan sporangium untuk yang hidup di darat. Pembiakan seksualnya dengan oospora. Beberapa contoh dari kelompok ini antara lain : Saprolegnia sp., Achya sp., Phytophtora sp (Alexopoulus dan Mims, 1979).
Kelompok Zygomycetes terkadang disebut sebagai “jamur rendah” yang dicirikan dengan hifa yang tidak bersekat (coneocytic), dan berkembang biak secara aseksual dengan zigospora. Kebanyakan anggota kelompok ini adalah saprofit. Pilobolus, Mucor, Absidia, Phycomyces termasuk kelompok ini. Rhizopus nigricans adalah contoh dari anggota kelompok ini, berkembang biak juga melalui hifa yang koneositik dan juga berkonjugasi dengan hifa lain. Rhizopus nigricans juga mempunyai sporangiospora. Ketika sporangium pecah, sporangiospora tersebar, dan jika mereka jatuh pada medium yang cocok akan berkecambah dan tumbuh menjadi individu baru. Spora seksual pada kelompok jamur ini disebut zygospora (Tortora et. al, 2001).
3. Ascomycetes
Golongan jamur ini dicirikan dengan sporanya yang terletak di dalam kantung yang disebut askus. Askus adalah sel yang membesar, yang di dalamnya terbentuk spora yang disebut askuspora. Setiap askus biasanya menghasilkan 2 - 8 askospora (Dwidjoseputro, 1978). Kelas ini umumnya memiliki 2 stadium perkembangbiakan yaitu stadium askus atau stadium aseksual. Perkembangbiakan aseksual ascomycetes berlangsung dengan cara pembelahan, pertunasan, klamidiospora, dan konidium tergantung kepada spesies dan keadaan sekitarnya. Selain itu kebanyakan Ascomycetes mikroskopis, hanya sebagian kecil yang memiliki tubuh buah. Pada umumnya hifa terdiri atas sel-sel yang berinti banyak (Dwidjoseputro, 1978).
4. Basidiomycetes
Basidiomycetes dicirikan memproduksi spora seksual yang disebut basidiospora. Kebanyakan anggota basiodiomycetes adalah cendawan, jamur payung dan cendawan berbentuk bola yang disebut jamur berdaging, yang spora seksualnya menyebar di udara dengan cara yang berbeda dari jamur berdaging lainnya. Struktur tersebut berkembang setelah fusi (penyatuan) dari dua hifa haploid hasil dari formasi sel dikaryotik. Sebuah sel yang memiliki kedua inti yang disumbangkan oleh sel yang kompatibel secara seksual. Sel-sel yang diploid membelah secara meiosis menghasilkan basidiospora yang
haploid. Basidiospora dilepaskan dari cendawan, menyebar dan berkecambah menjadi hifa vegetatif yang haploid, proses tersebut berlanjut terus (Mc-Kane, 1996).
Karakteristik dari Basiodiomycetes antara lain kebanyakan makroskopik, sedikit yang mikroskopik. Basidium berisi 2 - 4 basiodiospora, masing-masing pada umumnya mempunyai inti satu. Diantara Basiodiomycetes ada yang berguna karena dapat dimakan, tetapi banyak juga yang merugikan karena merusak tumbuhan, kayu-kayu dan perabot rumah tangga. Selain itu tubuh Basidiomycetes terdiri dari hifa yang bersekat dan berkelompok padat menjadi semacam jaringan, dan tubuh buah menonjol dari pada Ascomycetes. Misellium terdiri dari hifa dan sel-sel yang berinti satu hanya pada tahap tertentu saja terdapat hifa yang berinti dua. Pembiakan vegetatif dengan konidia. Pada umumnya tidak terdapat alat pembiakan generatif, sehingga lazimnya berlangsung somatogami (Dwidjoseputro, 1978).
BAB III. MATERI DAN METODE 3.1. Waktu dan Tempat
Penelitian ini akan dilaksanakan pada bulan April 2019 di Pulau Kemujan, Karimun Jawa, Jepara dan Laboratorium Tropical Marine Biotechnology, Departemen Ilmu Kelautan, Fakultas Perikanan dan Ilmu Kelautan Universitas Diponegoro, Semarang.
3.2. Materi Penelitian
Materi penelitian yang digunakan terdiri atas bahan dan alat penelitian. Bahan penelitian yang digunakan adalah Potato Dextrose Agar, Malt Extract Agar,
Chloramphenicol, gelatin, akuades, alkohol 70%, kapas, kain kasa, alumunium foil,
etanol 70%, tissue, kertas label, plastic wrap, LPCB.
Peralatan yang digunakan dalam penelitian adalah Underwater Camera, Cool Box, Water quality checker, Pisau/Cutter, Tang, Kantong Plastik, Alat Tulis, GPS, timbangan digital, nampan, pinset, gunting, cawan Petri, Gelas ukur, Erlenmeyer, tabung reaksi, Autoklaf, rak besi, bunsen, Erlenmeyer, spatula, laminar airflow, oven, corong, ose lurus, ose bulat, Refraktometer, Termometer, Seccidish, Water Quality
Checker.
3.3. Metode Penelitian
Metode yang dilakukan dalam penelitian adalah metode eksperimental laboratoris dengan tujuan untuk memperoleh atau memperluas fakta yang sudah ada sebelumnya, selanjutnya data penelitian dianalisis secara deskriptif (Arikunto, 2002). Pengambilan sampel spons dilakukan dengan menggunakan purposif sampling yaitu mengambil spons dilokasi tracking mangrove.
3.4. Prosedur Penelitian A. Penentuan Lokasi
B. Pengambilan Sampel Spons
Pengambilan sampel dilakukan dengan mengambil sampel spons yang menempel pada akar mangrove menggunakan pisau sebanyak ± 25 gram. Kemudian sampel dimasukkan pada plastik ziplock yang telah diisi air laut. Spons yang telah dimasukkan kedalam plastic ziplock kemudian dipindahkan ke coolbox hingga sampai ke laboratorium. Hal ini dilakukan untuk menghindari terjadinya kontaminasi mikroba dan proliferasi samppel yang berlebihan. Sebelum melakukan isolasi jamur asosiasi, dilakukan sterilisasi spons dengan tujuan menghilangkan mikroba epifit yang masih menempel. Beberapa parameter lingkungan diambil untuk menjadi data tambahan; Kedalaman, Salinitas, Disolved Oxygen, Suhu, Kecerahan, Total Dissolved
C. Isolasi dan Purifikasi Jamur
Segmen jaringan spons dibilas tiga kali dengan air laut buatan steril untuk menghilangkan puing-puing permukaan yang melekat dan kontaminan (Thirunavukkarasu et al. 2012). Jaringan bagian dalam (midinternalmesohylarea) dieksisi dengan pisau bedah steril dan dipotong kecil-kecil. Spons yang telah dipotong kecil-kecil dan sudah disterilkan kemudian diletakkan pada keempat media yang telah disiapkan (Potato Dextrose Agar, Malt Extract Agar, Potato Dextrose
Agar ditambah gelatin, dan Malt Extract Agar ditambah gelatin). Selama proses
isolasi, beberapa petri disiapkan sebagai kontrol lingkungan agar bias membedakan jamur yang tumbuh adalah kontaminan atau jamur asosiasi. Petri yang telah diinokulasi kemudian ditutup dengan plastic wrap dan diinkubasi pada suhu kamar (27˚C). Ketika jamur sudah tumbuh, kemudian dilakukan purifikasi agar tumbuh dan menjadi single colony. Jumlah unit pembentuk koloni (CFU) per gram berat kering (CFU/g) diperkirakan untuk setiap spesies jamur yang dihasilkan.
D. Identifikasi Makrosopis dan Mikroskopis
Jamur berfilamen diidentifikasi berdasarkan karakteristik makroskopis (kolonial) dan mikroskopisnya. Deskripsi kolonial termasuk karakteristik koloni seperti warna , tekstur, margin, ketinggian dan karakteristik hifa udara. Teknik slide culture dari Riddell (1950) digunakan untuk pemeriksaan mikroskopis isolat jamur yang mencakup morfologi spora, warna, bentuk, ornamen atau tekstur dinding, ukuran, pembentukan konidia dan karakteristik terkait lainnya seperti pola phialide dan konidiasi. Deskripsi jamur di MycoBank (www.mycobank.com) digunakan sebagai panduan untuk identifikasi lebih lanjut dari isolat jamur.
E. Identifikasi Molekuler
a. Ekstraksi DNA dan amplifikasi PCR
Ekstraksi DNA pada bakteri dilakukan dengan menggunakan metode chelex 100. Primer yang digunakan untuk PCR 16S rDNA adalah primer universal primer 27F
dan 1492R. Visualisasi produk PCR dilakukan melalui elektroforesis setelah amplifikasi PCR.
b. Elektroforesis
Elektroforesis dilakukan dengan gel agarose dengan konsentrasi 1%. Alat dijalankan dengan voltase 100 V selama 30 menit. Hasil elektroforesis tersebut diamati dengan UV illuminator. c. Sequensing DNA
Sequensing dilakukan untuk melihat susunan basa yang membentuk sequens DNA. Proses sequensing dilakukan dengan menggunakan pewarna Big Dye Terminator V3.1 dan automated DNA sequencer ABI 3130 XL Genetic Analze Applied Biosystem.
d. BLAST homologi
Hasil sequens isolat selanjutnya dibandingkan dengan sequens DNA pada DNA data base bank. Penelusuran dilakukan dengan system internet melalui program pelacakan Data Base Local Allignment Search Tool (BLAST) pada National CentreFor Biotechnology Information, National Institute for health, USA (www.ncbi.nlm.nih.gov)
e. Filogenetik
Analisis filogenetik bakteri dilakukan dengan membandingkan sekuen bakteri terdata dengan sekuen 16S rRNA menggunakan primer (27F 5'AGAGTTTGATCCTGGCTCAG-3';1492R5'-GGTTACCTTGTTACGACTT3') pada database gen bank ketika melakukan analisis BLAST.
F. Analisis Data
(A) Total frekuensi kemunculan (FOC,%)
jamur dalam sampel spons dihitung menggunakan rumus: Total FOC (%):jumlah kehadiran
jumlah kehadiran / total spons * 100 Frekuensi kemunculan (FOC) spesies A (%) per spesies spons:Tidak: koleksi spesies A Jumlah sampel yang diperiksax 100Berdasarkan frekuensi kejadian, pengelompokan berikut dibuat (Hyde 1989; Hyde dan Sarma 2000; Sarma dan Raghukumar 2013): sangat sering (≥10%), sering (5-10%), jarang (1-5%), jarang (1-5%) , jarang (≤1%).
(B) Keragaman jamur yang terkait dengan spons bakau dihitung setelah Ludwig dan Reynolds (1988).
(a) Indeks Shannon 𝐻𝑖′= − ∑( 𝑝𝑖 ln 𝑝𝑖)
pi = proporsi dari masing-masing spesies, i berkontribusi terhadap jumlah total individu yang ditampilkan di bawah ini
𝑝𝑖 =𝑛𝑖 𝑁 di mana: N = jumlah total individu (catatan) ni = jumlah individu i1, i2, i3, i4, ... ix
IV. HASIL HASIL
. 1 KMS 1 S: 05o 49’ 25,51” E: 110o 27’ 49,04” Lumpur Berpasir 4,25 32,3O c 20 ppm 4,70 3,5 cm 2 KMS 2 S: 05o 49’ 27,58” E: 110o 27’ 35,79” Lumpur Berpasir 6,53 34,5O c 25 ppm 6,53 12,5 cm 3 KMS 7 S: 05o 49’ 26,49” E: 110o 27’ 43,89” Lumpur Berpasir 5,78 32,4O c 21 ppm 5,66 5 cm 4 KMS 13 S: 05o 49’ 27,98” E: 110o 27’ 39,93” Lumpur Berpasir 5,82 34,8O c 23 ppm 7,07 7,1 cm 5 KMS 14 S: 05o 49’ 26,91” E: 110o 27’ 41,56” Lumpur Berpasir 5,68 34,8O c 23 ppm 6,70 7 cm 6 KMS 15 S: 05o 49’ 27,58” E: 110o 27’ 35,79” Lumpur Berpasir 6,53 34,5O c 25 ppm 6,53 12,5 cm
Nama Isolat Atas Bawah PKMS 15.2 P KMS 1.5 MG KMS 1.1 7 KMS 17 S: 05o 49’ 27,43” E: 110o 27’ 37,97” Lumpur Berpasir 5,64 34,5O c 23,5 ppm 6,74 15 cm
M KMS 2.5
M KMS 2.1.2
M KMS 2.2
P KMS 2.1
P KMS 2.2
MG KMS 2.1.1
M KMS 2.1
M KMS 5.1
M KMS 15.1
PKMS 14.4
PKMS 7.1
MKMS 2.5.2
MG KMS 1.2
MKMS 5.1
PKMS 13.1
MGKMS 13.4.1
MKMS 2.5.1
MKMS 1.1
MG KMS 1.1.1
Kode isolat Gambar
PKMS 1.1
MGKMS 1.1
DAFTAR PUSTAKA
[FAO] Food and Agriculture Organization of the United Nation. 2017. Sponge and their role in the marine environment.
Becking, L. E., Cleary, D. F. R., de Voogd, N. J. 2013. Sponge species composition, abundance, and cover in marine lakes and coastal mangroves in Berau , Indonesia. Marine Ecology Progress Series 481: 105-120. DOI: 10.3354/meps10155Simajuntak 2015
Bell, J. J. 2008. The functional roles of marine sponges. Estuarine, Coastal, and
Shelf Science 79: 341-353. DOI: 10.1016/j.ecss.2008.05.002.
Bellemain, E., Carlsen, T., Brochmann, C., Coissac, E., Taberlet, P., Kauserud, H. 2010. IRTesSea rcahs a rtaicnle environmental DNA barcode for fungi: an
in silico approach reveals potential PCR biases. BMC Microbiology
10(189). DOI: 10.1186/1471-2180-10-189.
Bolaños, J., Leon, L. F. D., Ochoa, E., Darias, J., Raja, H. A., Shearer, C. A., Miller, A. N., Vanderheyden, P., Alfaro, A. P., George, C. C. 2015. Phylogenetic diversity of sponge-associated fungi from the Caribbean and the Pacific of Panama and their in vitro effect on angiotensin and endothelin receptors. Marine Biotechnology 17: 533-564. DOI: 10.1007/s10126-015-9634-z
Bramandito, A., Subhan, B., Prartono, T., Anggraini, N. P., Januar, H. I., Madduppa, H. H. 2018. Genetic diversity and population structure of Siganus fuscescens across urban reefs of Seribu Islands, Northern of Jakarta, Indonesia. Biodiversitas 19(6): 1993-2002. DOI: 10.13057/biodiv/d190603
Calabon, M. S., Sadaba, R. B., Campos, W. L. 2018. Fungal diversity of mangrove-associated sponges from New Washington, Aklan, Philippines.
Mycology. DOI:10.1080/21501203.2018.1518934
Calcinai, B., Bastari, A., Bavestrello, G., Bertolino, M., Horcajadas, S. B., Pansini, M., Makedupa, D. M., Cerrano, C. 2017. Demosponge diversity from North Sulawesi, with the description of six new species. Zoo Keys 680: 105-150. DOI: doi: 10.3897/zookeys.680.12135
Chrisyariati, I., Hendrarto, B., Suryanti. 2014. Kandungan nitrogen total dan fosfat sedimen mangrove pada umur yang berbeda di lingkungan pertambakan Mangunharjo, Semarang. Diponegoro Journal of Maquares 3(3): 65-72.
Cita, Y. P., Muzaki, F. K., Radjasa, O. K., Sudarmono, P. 2017. Screening of antimicrobial activity of sponges extract from Pasir Putih, East Java (Indonesia). Journal of Marine Science: Research & Development 7(5). DOI: :10.4172/2155-9910.1000237
Dias, J. P., Gilg, M. R., Lukehurst, S. S., Kennington, W. J., Huhn, M., Maddupa, H. H., McKirdy, S. J., de Lestang, P., Teo, S. L. M., Lee, S. S. C., McDonald, J. I. 2018. Genetic diversity of a hitchhiker and prized food source in the Anthropocene: the Asian green mussel Perna viridis (Mollusca, Mytilidae). Biological Invasions. DOI: https://doi.org/10.1007/s10530-018-1659-6Schoch 2012
Fajarningsih, N. D., Nursid, M., Januar, H. I., Wikanta, T. 2013. Bioprospeksi spons, karang lunak, dan ascidian asal Taman Nasional Kepulauan Wakatobi: antitumor dan antioksidan. JBP Perikanan 8(1): 161-170.
Hartoko, A., Soedarsono, P., Indrawati, A. 2013. Analisa klorofil-α, nitrat dan fosfat pada vegetasi mangrove berdasarkan data lapangan dan data satelit
Geoeye di Pulau Parang, Kepulauan Karimunjawa. Journal of Management of Aquatic Resources 2(2): 28-37.
Hinrichs, S., Nordhaus, I., Geist, S. J. 2009. Status, diversity and distribution patterns of mangrove vegetation in the Segara Anakan lagoon, Java, Indonesia. Regional Environmental Change 9: 275-289. DOI: 10.1007/s10113-008-0074-4
Imam, S., Santoso, A., Pribadi, R. 2014. Struktur komunitas gastropoda di
tracking mangrove Kemujan, Taman Nasional Karimunjawa. Journal of Marine Research 3(4): 595-604.
Indraningrat, A. A. G., Smidt, H., Sipkema, D. 2016. Bioprospecting sponge-associated microbes for antimicrobial compounds. Marine Drugs 14(87). DOI: 10.3390/md14050087
Ismet, M. S., Soedharma, D., Effendi, H. 2011. Morfologi dan biomassa sel spons
Aaptos aaptos dan Petrosia sp. Journal Ilmu dan Teknologi Kelautan Tropis
3(2): 153-161.
Kres, W. J., Erickson, D. L. 2008. DNA barcodes: genes, genomics, and bioinformatics. PNAS 105(8): 2761-2762. DOI: www.pnas.org/cgi/doi/10.1073/pnas.0800476105
Kumar, M. S., Pal, A. K. 2016. A review of bioactive compounds from marine organisms with special mention on the potential of marine sponges in pharmacological applications. Journal of Marine Biology Association of
India 58(1): 83-91. DOI: 10.6024/jmbai.2016.58.1.1862-0x.
Kusumadewi, I., Pribadi, R., Widianingsih. 2013. Biologi krustasea di tracking mangrove kawasan terusan Pulau Kemujan Kepulauan Karimunjawa.
Journal of Marine Research 2(4): 94-103.
Nguyen, M. T. H. D., Thomas, T. 2018. Diversity , host-specificity and stability of sponge-associated fungal communities of co-occurring sponges. PeerJ. DOI: 10.7717/peerj.4965
Richards, T. A., Jones, M. D. M., Leonard, G., Bass, D. 2012. Marine fungi: their ecology and molecular diversity. Annual Reviews of Marine Science 4: 495-522. DOI: https://doi.org/10.1146/annurev-marine-120710-100802.
Savolainen, V., Cowan, R. S., Vogler, A. P., Roderick, G. K., Lane, R. 2005. Towards writing the encyclopaedia of life: an introduction to DNA barcoding. Philosophical Transaction of The Royal Society B 360: 1805-1811. DOI: 10.1098/rstb.2005.1730
Setiawan, E., Muzaki, F. K., Ashuri, N. M. 2018. Shallow water sponges that associated to mangrove ecosystem at Labuhan conservation area in Sepulu, Bangkalan, Madura, East Java Province. NICHE Journal of Tropical
Biology 1(2): 19-29.
Setiawan, E., Nurhayati, A. P. D., de Voogd, N. J., Dewi, A. T., Alivy, A., Kartikasari, L., Subagio, I. 2002. Toxicity test of mangrove epibiont sponges in Tampora Situbondo using brine shrimp lethality test (BSLT).
AIP Conference Proceedings 020017. DOI: https://doi.org/10.1063/1.5050113
Setyowati, E. P., Pratiwi, S. U. T., Purwantiningsih, Samirana, P. O. 2018. Antimicrobial activity and identification of fungus associated Stylissa
flabelliformis sponge collected from Menjangan Island West Bali National
Park, Indonesia. Indonesian Journal of Pharmacy 29(2): 66-73. DOI: http://dx.doi.org/10.14499/indonesianjpharm29iss2pp66
Sibero, M. T., Radjasa, O. K., Sabdono, A., Trianto, A., Triningsih, D. W., Debora, I. 2018. Antibacterial activity of Indonesian sponge associated fungi against clinical pathogenic multidrug resistant bacteria. Journal of
Applied Pharmaceutical Science 8(2): 99-94. DOI: 10.7324/JAPS.2018.8214Inthe 2014
Sibero, M. T., Sabdaningsih, A., Cristianawati, O., Nuryadi, H., Radjasa, O. K., Sabdono, A., Trianto, A. 2017. Isolation, identification and screening antibacterial activity from marine sponge-associated fungi against multidrug-resistant (MDR) Escherichia coli. IOP Conf. Series: Earth and
Environmental Science 55(2017) 012028. DOI: 10.1088/1755-1315/55/1/012028.
Sinaga, R. R., Hendrarto, B., Supriharyono, S. 2017. Deskripsi kawasan hutan mangrove berdasarkan sifat biofisik dan faktor sosial di Maroon Mangrove Edupark Desa Tugurejo Semarang, Jawa Tengah. Management of Aquatic
Resources Journal 6(4).
Trianto, A., Sabdono, A., Rochaddi, B., Triningsih, D. W., Zilda, D. W. 2018. Identification sponges-associated fungi from Karimunjawa National Park.
IOP Conference Series Earth and Environmental Science 116(1):012098.
DOI: 10.1088/1755-1315/116/1/012098
Winata, A., Yuliana, E., Rusdiyanto, E. 2017. Diversity and natural regeneration of mangrove vegetation in the tracking area on Kemujan Island Karimunjawa National Park, Indonesia. 9(2): 109-119.
Xu, J. 2016. Fungal DNA barcoding1. Genome 59(11): 913-932. DOI: