1
HIDROKARBON
Standar Kompetensi
Memahami sifat – sifat senyawa organik atas dasar gugus fungsi dan senyawa makro molekul.
Kompetensi Dasar
Mendeskripsikan kekhasan atom karbon dalam membentuk senyawa hidrokarbon
Menggolongkan senyawa hidrokarbon berdasarkan strukturnya dan hubungannya dengan sifat senyawa
.
SENYAWA HIDROKARBON
A. Senyawa Karbon
Pada tahun 1780, seorang bernama Karl Wilhelm Scheele (1742 – 1786) membedakan senyawa-senyawa menjadi dua kelompok, yaitu:
1. Senyawa organik, adalah senyawa yang dihasilkan oleh makhluk hidup. 2. Senyawa anorganik, adalah senyawa yang dihasilkan oleh benda mati.
Sementara itu pada tahun 1807, Jons Jacob Berzelius (1779 – 1848) menyatakan teori vis vitalis, yaitu bahwa senyawa-senyawa organik hanya dapat dibuat di dalam tubuh makhluk hidup dengan bantuan daya hidup (vis vitalis), sehingga menurutnya tidak mungkin senyawa organik dibuat di laboratorium dengan menggunakan bahan senyawa anorganik.
Hingga abad ke-19, kedua teori tersebut masih terus dipegang karena belum pernah ada senyawa organik yang dibuat di laboratorium. Sampai kemudian Friederich Wohler (1800 – 1882) berhasil menumbangkan teori sebelumnya, setelah dia berhasil menyintesis senyawa organik.
Senyawa tersebut adalah urea (yang biasa dihasilkan dari urine makhluk hidup) dengan menggunakan zat anorganik, yaitu dengan mereaksikan perak sianat dengan amonium klorida membentuk amonium sianat.
AgOCN + NH4Cl → NH4OCN + AgCl
Ternyata ketika amonium sianat diuapkan untuk memperoleh kristalnya, pada pemanasan yang terlalu lama, amonium sianat berubah menjadi urea.
NH4OCN → (NH2)2CO ∆ Urea
Dengan keberhasilan Wohler menyintesis urea dari amonium sianat, para ahli
kemudian membedakan senyawa karbon menjadi senyawa karbon organik dan senyawa karbon anorganik.
B. Senyawa Karbon Organik dan Anorganik
Begitu keberhasilan Wohler diketahui, banyak ilmuan lain yang mencoba membuat senyawa karbon dari senyawa anorganik. Lambat laun teori tentang daya hidup hilang dan orang hanya menggunakan kimia organik sebagai nama saja tanpa disesuaikan dengan arti yang sesungguhnya. Selain perbedaan jumlah yang sangat mencolok yang menyebabkan
kimia karbon dibicarakan secara tersendiri, juga karena terdapat perbedaan yang sangat besar antara senyawa karbon dan
senyawa anorganik seperti yang dituliskan berikut ini.
Tabel 1. Perbedaan senyawa karbon dengan senyawa anorganik
Senyawa Karbon/Organik Senyawa Anorganik
o Membentuk ikatan kovalen
o Dapat membentuk rantai karbon
o Non elektrolit
o Reaksi berlangsung lambat
o Titik didih dan titik lebur rendah
o Larut dalam pelarut nonpolar
o Membentuk ikatan ion
o Tidak dapat membentuk rantai karbon o Elektrolit
o Reaksi berlangsung cepat o Titik didih dan titik lebur tinggi o Larut dalam pelarut polar
C. Menguji Keberadaan C, H, O, dalam senyawa hidrokarbon
Di dalam tubuh makhluk hidup terdapat unsur karbon. Hal ini dapat dibuktikan secara sederhana dengan
membakar bahan-bahan yang berasal dari makhluk hidup, misalnya kayu, beras, dan daging. Ketika dibakar,
bahan-bahan
tersebut akan menjadi arang (karbon).
Keberadaan karbon dan hidrogen dalam senyawa organik juga dapat dilakukan dengan percobaan
sederhana, seperti ditunjukkan dengan gambar di bawah:
air kapur
Gambar 1. Percobaan untuk menunjukkan C, H, dan O dalam senyawa karbon
Bahan yang diuji + CuO (oksidator) → CO2 + H2O
1. Atom karbon memiliki 4 elektron valensi
Atom karbon memiliki nomor atom 6 sehingga terletak pada golongan IVA. Untuk mencapai oktet, karbon membutuhkan 4 elektron lagi dengan cara berikatan kovalen. Hal ini menyebabkan karbon dapat berikatan kovalen tunggal sebanyak empat, berikatan kovalen rangkap 2 dan kovalen rangkap 3.
2. Atom karbon relatif kecil
Melalui konfigurasi elektron karbon, atom karbon terletak pada periode ke- 2yang berarti atom ini mempunyai 2 kulit atom, sehingga jari-jari atomnya relatif kecil. Hal ini menyebabkan ikatan kovalen yang dibentuk relatif kuat dan dapat membentuk ikatan kovalen rangkap.
3. Atom karbon dapat membentuk rantai karbon
Atom karbon yang satu dapat berikatan lagi dengan atom karbon yang lain sehingga dapat membentuk rantai karbon yang panjang dan maupun membentuk rantai karbon siklik.
Contoh:
3 E. Atom Karbon Primer, Sekunder, Tersier, dan Kuartener
Senyawa karbon yang paling sederhana adalah hidrokarbon karena hanya terdiri dari dua unsur, yaitu karbon (C) dan hidrogen (H).
Keistimewaan atom karbon yang dapat membentuk ikatan kovalen sebanyak 4 buah dan kemampuannya dalam membentuk rantai karbon, menyebabkan atom karbon mempunyai kedudukan yang berbeda-beda. Berdasarkan jumlah atom karbon yang diikat, atom karbon dapat dibedakan menjadi:
1. Atom karbon primer, yaitu atom karbon yang terikat langsung pada 1 atom karbon yang lain. 2. Atom karbon sekunder, yaitu atom karbon yang terikat langsung pada 2 atom karbon yang lain.
3. Atom karbon tersier, yaitu atom karbon yang terikat langsung pada 3 atom karbon yang lain. 4. Atom karbon kuarterner, yaitu atom karbon yang terikat langsung pada 4 atom karbon yang lain.
Contoh:
Dari contoh di atas:
Atom karbon primer: ada 5 buah (diberi tanda 1o) Atom karbon sekunder: ada 3 buah (diberi tanda 2o) Atom karbon tersier: ada 1 buah (diberi tanda 3o) Atom karbon kuartener: ada 1 buah (diberi tanda 4o)
LATIHAN1
F. Hidrokarbon
1. Penggolongan Hidrokarbon
Penggolongan hidrokarbon didasarkan pada bentuk rantai karbon dan jenis ikatan. a. Berdasarkan bentuk rantai karbon
Alifatis: adalah hidrokarbon dengan rantai terbuka. Rantai karbon alifatis ini bisa lurus dan bisa juga bercabang. Contoh:
CH3−CH2−CH2−CH2−CH3
Alisiklis:yaitu rantai karbon tertutup. Contoh:
Hitunglah jumlah atom C primer, C sekunder, C tersier, dan C kuarterner pada masing – masing senyawa hidrokarbon berikut!
1.
Aromatis: yaitu rantai karbon tertutup yang memiliki ikatan konjugasi Contoh:
b. Berdasarkan jenis ikatan
Ikatan jenuh: yaitu rantai karbon yang hanya mengandung ikatan tunggal
Ikatan tidak jenuh: yaitu rantai karbon yang mengandung ikatan rangkap 2 atau rangkap 3. Alkana
Alkana merupakan senyawa hidrokarbon alifatik jenuh, yaitu hidrokarbon dengan rantai terbuka dan semua ikatan karbonnya merupakan ikatan tunggal.
Rumus umum senyawa alkana adalah:
Berikut merupakan deret homolog senyawa alkana:
Tabel 1. Deret homolog alkana
Jumlah
atom C
Rumus Molekul
Nama
1 CH4 Metana
2 C2H6 Etana
3 C3H8 Propana
4 C4H10 Butana
5 C5H12 Pentana
6 C6H14 Heksana
7 C7H16 Heptana
8 C8H18 Oktana
9 C9H20 Nonana
10 C10H22 Dekana
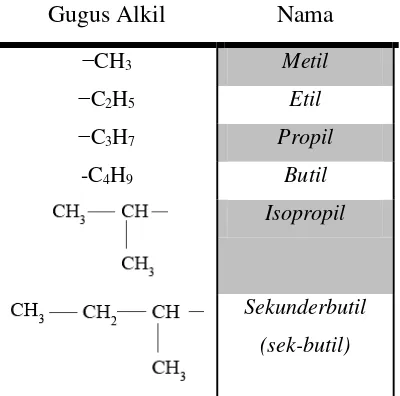
Gugus Alkil
Gugus alkil adalah alkana yang telah kehilangan satu atom H. Gugus alkil dapat dituliskan dengan menggunakan rumus:
Berikut merupakan beberapa gugus alkil yang biasa digunakan dalam rantai karbon:
Gugus Alkil
Nama
−CH3 Metil −C2H5 Etil −C3H7 Propil
-C4H9 Butil
Isopropil
Sekunderbutil (sek-butil)
C
nH
2n + 25
Tersier butil
Tata Nama Alkana
Perhimpunan kimiawan internasional pada pertemuan di Jenewa pada tahun 1892 telah merumuskan aturan penamaan senyawa kimia. Tata nama yang mereka rumuskan tersebut dikenal dengan tata nama IUPAC (International Unionof Pure and Applied Chemistry). Nama yang diturunkan dengan aturan ini disebut nama sistematik atau nama IUPAC, sedangkan nama yang sudah biasa digunakan sebelum tata nama IUPAC dan tetap digunakan disebut dengan nama biasa atau nama trivial.
Aturan IUPAC untuk penamaan alkana bercabang sebagai berikut: 1. Nama alkana bercabang terdiri dari dua bagian, yaitu:
a) Bagian pertama, di bagian depan, yaitu nama cabang (alkil). b) Bagian kedua, di bagian belakang, yaitu nama rantai induk.
2. Rantai induk adalah rantai terpanjang dalam molekul. Bila terdapat dua atau lebih rantai terpanjang, maka harus dipilih yang mempunyai cabang terbanyak.
3. Cabang diberi nama alkil, yaitu nama alkana yang sesuai dengan mengganti akhiran ana menjadi il.
4. Posisi cabang dinyatakan dengan awalan angka. Untuk itu rantai induk perlu dinomori. Penomoran dimulai dari salah satu ujung rantai induk sedemikian hingga posisi cabang mendapat nomor terkecil.
5. Jika terdapat dua atau lebih cabang yang sama, hal ini dinyatakan dengan awalan di, tri, tetra, penta, dan seterusnya pada nama cabang.
6. Cabang-cabang yang berbeda disusun sesuai urutan abjad dari nama cabang tersebut. Misalnya:
• Etil ditulis terlebih dahulu daripada metil. • Isopropil ditulis terlebih dahulu daripada metil.
Contoh:
Latihan 2
1. Tentukan nama IUPAC senyawa alkana berikut: a.
b.
c.
d.
Kegunaan Alkana
Secara umum, alkana berguna sebagai bahan bakar dan bahan baku dalam industry petrokimia.
1) Metana: berguna sebagai bahan bakar untuk memasak, dan bahan baku pembuatan zat kimia seperti H2 dan NH3.
2) Etana: berguna sebagai bahan bakar untuk memasak dan sebagai refrigerant dalam sistem pendinginan dua tahap untuk suhu rendah.
3) Propana: merupakan komponen utama gas elpiji untuk memasak dan bahan baku senyawa organik. 4) Butana: berguna sebagai bahan bakar kendaraan dan bahan baku karet sintesis.
5) Oktana: merupakan komponen utama bahan bakar kendaraan bermotor, yaitu bensin.
2. Alkena
Alkena adalah hidrokarbon alifatik tak jenuh yang memiliki satu ikatan rangkap dua (C = C). Senyawa yang mempunyai dua ikatan rangkap disebut alkadiena, yang mempunyai tiga ikatan rangkap disebut alkatriena, dan seterusnya.
Rumus umum senyawa alkana adalah:
Tata Nama Alkena
1) Alkena rantai lurus
Nama alkena rantai lurus sesuai dengan nama–nama alkana, tetapi dengan mengganti akhiran –ana menjadi –ena.
a) Memilih rantai induk, yaitu rantai karbon terpanjang yang mengandung ikatan rangkap.
b) Memberi nomor, dengan aturan penomoran dimulai dari salah satu ujung rantai induk, sehingga ikatan rangkap mendapat nomor terkecil (bukan berdasarkan posisi cabang).
c) Penamaan, dengan urutan:
- nomor atom C yang mengikat cabang - nama cabang
- nomor atom C ikatan rangkap - nama rantai induk (alkena)
Contoh:
2-metil-1-propena 3,3-dimetil-1-butena
1,3-pentadiena 2-metil-1,3-pentadiena 2. Gambarkan rumus bangun senyawa alkana berikut:
7
Latihan 3
3. Alkuna
Alkuna adalah senyawa hidrokarbon alifatik tak jenuh yang mengandung ikatan rangkap tiga (-C≡C-). Rumus umum alkuna adalah:
Tata Nama Alkuna
1. Alkuna rantai lurus namanya sama dengan alkana, hanya akhiran “ana” diganti dengan “una”.
Contoh: C3H4: propuna C5H8: pentuna
2. Penamaan untuk alkuna rantai bercabang sama dengan urutan penamaan alkena. 1. Tentukan nama IUPAC senyawa alkena berikut:
a.
b.
c.
d.
e.
2. Gambarkan rumus bangun senyawa alkena berikut: a. 3-etil-2-pentena
b. 2,3-dimetil-1-pentena c. 3-etil-2,3-dimetil-1-heksena d. 3-metil-1-butena
e. 5-metil-2-heksena
3. Periksa senyawa alkena berikut apakah penamaannya sudah sesuai atau tidak sesuai dengan tata nama IUPAC, kemudian beri nama yang sesuai! a. 4-metil-2-butena
b. 2-metil-3-butena c. 3-pentena d. 2-etil-2-pentena e. 2-metil-4-pentena
Contoh:
3-metil-1-butuna 4-metil-2-heksuna
Latihan 4
G. Keisomeran
Isomer berasal dari bahasa Yunani yaitu iso = sama, meros = bagian. Jadi, isomer merupakan senyawa – senyawa yang rumus bangunnya berbeda tetapi mempunyai rumus molekul yang yang sama.
1. Keisomeran pada Alkana
Jenis keisomeran pada alkana adalah keisomeran struktur atau isomer kerangka yaitu perbedaan kerangka atom karbonnya. Isomer pada alkana dimulai dari butana (C4H10).
Isomer C4H10:
n – butana 2-metilpropana (isobutana) jadi, untuk alkana dengan rumus C4H10 ada 2 isomer.
2. Keisomeran pada Alkena
Keisomeran pada alkena dapat berupa keisomeran struktur, posisi dan geometri.
Isomer rangka atau isomer strukrur yaitu peristiwa isomeri yang disebabkan adanya perbedaan kerangka atau rantai karbonnya.
1. Tentukan nama IUPAC senyawa alkuna berikut! a.
b.
c.
d.
e.
9
Isomer posisi terjadi karena adanya perbedaan posisi atau letak ikatan rangkapnya.
Isomer geometri merupakan isomer yang terjadi karena perbedaan letak suatu gugus fungsi dalam ruangan. Apabila gugus-gugus tersebut berada dalam satu ruang disebut kedudukan cis dan bila gugus-gugus tersebut berbeda ruang disebut kedudukan
trans.
Contoh:
Isomer C4H8, yaitu:
1-butena
2-butena
2-metil-1-propena Isomer rangka/struktur
Cis 2-butena Trans 2-butena
Syarat suatu senyawa memiliki isomr geometris adalah:
1. Senyawa yang mempunyai atom C yang berikatan rangkap dua (alkena).
2. Atom C yang berikatan rangkap masing-masing mengikat atom atau dua gugus atom yang berbeda.
3. Keisomeran pada Alkuna
Keisomeran pada alkuna berupa isomer rangaka/struktur dan isomer posisi. Pada alkuna tidak terdapat isomer geometri. Contoh:
Isomer C4H6:
1-butuna 2-butuna
H. Sifat – sifat Hidrokarbon 1. Sifat – sifat Fisis
Semua hidrokarbon merupakan senyawa nonpolar sehingga tidak larut dalam air. Jika suatu hidrokarbon bercampur dengan air, maka lapisan hidrokarbon selalu di atas sebab massa jenisnya lebih kecil daripada 1. Pelarut yang baik untuk hidrokarbon adalah pelarut nonpolar, seperti CCl4 atau eter.
Makin banyak atom C, titik didih makin tinggi. Untuk hidrokarbon yang berisomer (jumlah atom C sama banyak), titik didih makin tinggi apabila rantai C makin panjang (bercabang sedikit).
Pada suhu dan tekanan standar, empat alkana yang pertama (CH4 sampai C4H10) berwujud gas. Pentana (C5H12) sampai heptadekana (C17H36) berwujud cair, sedangkan oktadekana (C18H38) dan seterusnya berwujud padat.
2. Reaksi – reaksi Senyawa Hidrokarbon a. Reaksi Oksidasi
Reaksi oksidasi/pembakaran sempurna senyawa hidrokarbon menghasilkan CO2 dan H2O. sedangkan pembakaran tak sempurna menghasilkan CO dan H2O atau jelaga (partikel karbon).
Reaksi oksidasi dapat terjadi pada senyawa alkana, alkena dan alkuna.
Contoh reaksi oksidasi/pembakaran: - C3H8 + 5O2 → 3CO2 + 4H2O - C2H4 + 3O2 → 2CO2 + 2H2O - 2C2H2 + 5O2 → 4CO2 + 2H2O
Isomer posisi
Tentukan isomer C5H10. Dan tentukan isomer yang memiliki keisomeran geometris!
b. Reaksi Substitusi
Reaksi substitusi merupakan reaksi penggantian gugus fungsi (atom atau molekul) yang terikat pada atom C suatu senyawa hidrokarbon. Reaksi substitusi hanya dapat terjadi pada senyawa alkana. Contoh dari reaksi substitusi adalah
reaksi halogenasi alkana, yaitu penggantian atom hidrogen alkana dengan atom halogen. Contoh:
CH4 + Cl2 → CH3Cl + HCl metana metil klorida
c. Reaksi Adisi
Reaksi adisi/ penjenuhan/ penambahan terjadi pada senyawa karbon yang mempunyai ikatan rangkap, yaitu alkena dan alkuna yang menerima atom atau gugus atom sehingga ikatan rangkapnya berubah menjadi ikatan tunggal (jenuh).
1) Hidrogenasi pada alkena dan alkuna
CH3– CH2–CH ═ CH2 + H2 → CH3– CH2– CH2– CH3 1-butena n-butana
CH3– CH2–C≡CH + 2H2 → CH3– CH2– CH2– CH3 1-butuna n-butana
2) Halogenasi alkena
CH3– CH2–CH ═ CH2 + Cl2 → CH3– CH2– CHBr – CHBr 1-butena 1,2-diklorobutana 3) Reaksi asam halida (HX) pada alkena/ hidrohalogenasi
CH3–CH ═ CH – CH3 + HBr → CH3– CH2– CHBr – CH3 2-butena 2-bromobutana
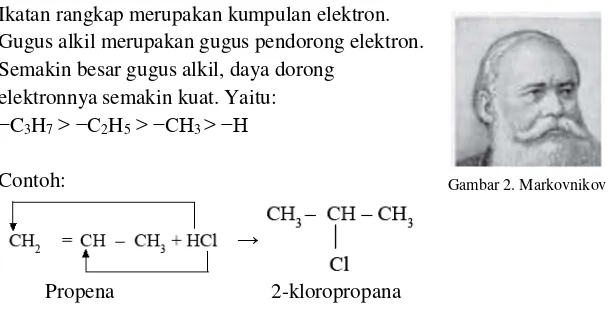
Contoh reaksi adisi HX di atas merupakan senyawa alkena dengan struktur yang simetris. Namun, jika senyawa alkena yang diadisi tidak simetris, maka berlaku aturan Markovnikiov berikut:
Ikatan rangkap merupakan kumpulan elektron. Gugus alkil merupakan gugus pendorong elektron.
Semakin besar gugus alkil, daya dorong elektronnya semakin kuat. Yaitu:
−C3H7> −C2H5> −CH3 > −H
Contoh:
Propena 2-kloropropana
4) Reaksi hidrasi pada alkena
Hidrasi merupakan reaksi adisi oleh air membentuk alkohol. Reaksi ini juga mengikuti aturan Markovnikiov. Contoh:
CH2═CH2 + H2O → CH3−CH2−OH Etena etanol
d. Reaksi Eliminasi
Reaksi eliminasi terjadi pada senyawa hidrokarbon jenuh (alkana) sehingga senyawa tersebut berubah menjadi senyawa tidak jenuh (memiliki ikatan rangkap.)
1) Dehidrogenasi (penarikan hidrogen)
Etana etena
2) Dehidrasi (penarikan air)
Etanol etena
Gambar 2. Markovnikov
11
3) Dehidrohalogenasi (penarikan HX)
→ + HBr 2-bromopropana propena
Latihan 5
1.Sifat-sifat dari suatu deret homolog sebagai berikut, kecuali . . . . a.dapat dinyatakan dengan suatu rumus umum
b.titik didihnya meningkat dengan panjangnya rantai c.mempunyai sifat kimia yang serupa
d.mempunyai rumus empiris yang sama
e.memiliki perbedaan gugus –CH2– di antara anggotanya
2. Pernyataan berikut dapat dijadikan pembenaran adanya unsur hidrogen dalam hidrokarbon setelah dibakar adalah . . . . a. terbentuk asap putih dari hasil pembakaran
b. adanya tetesan-tetesan embun di dalam pipa pengalir akibat pendinginan c. larutan Ca(OH)2 menjadi keruh setelah dilewati gas hasil pembakaran d. terbentuk gas yang dapat dilihat dari gelembung dalam larutan Ca(OH)2 e. tidak dapat dilihat dengan kasat mata karena air yang terbentuk berupa gas 3. Alkana tergolong senyawa hidrokarbon . . . .
a. alifatik jenuh b. alifatik tidak jenuh c. alisiklik tidak jenuh d. aromatik
e. parafin siklik tidak jenuh
4.Rumus molekul yang menyatakan hidrokarbon jenuh adalah . . . .
a.C3H6 b.C5H12 c.C4H6 d.C5H10 e.C4H8
5.Dari rumus-rumus hidrokarbon berikut: I. C2H4 III. C3H4
II. C2H6 IV. C3H6
Hidrokarbon yang termasuk dalam satu deret homolog adalah . . . . a.I dan III c. III dan IV
b.II dan IV d.I dan IV c.I dan II
1. Dari reaksi berikut, tentukan yang mana reaksi substitusi, adisi, dan oksidasi! a. CH≡CH + 2H2→ CH3 – CH3
b. CH3– CH3 + Cl2→ CH3– CH2– Cl + HCl
c. 2C2H6 + 7O2→ 4CO2 + 6H2O
d. CH2 = CH2 + Br2→ CH2Br – CH2Br
e. CH3– CH2OH → CH2 = CH2 + H2O
2. Tuliskan reaksi setara oksidasi propana, propena dan propuna!
3. Tuliskanlah reaksi klorinasi butana!
4. Tuliskan reaksi hidrogenasi pada 1-pentena!
5. Tuliskan reaksi klorinasi pada 2-pentena!
6. Tuliskan reaksi adisi HCl pada 1-pentena dan 2-pentena!
7. Tuliskan reaksi hidrasi pada 1-butena!
8. Tuliskan reaksi dehidrogenasi pada propana!
9. Tuliskan reaksi dehidrasi pada 2-pentanol!
10.Tuliskan reaksi eliminasi HCl pada 2-klorobutana!
6.Nama yang tepat untuk senyawa di bawah ini adalah . . . .
a. 2,5–dietil–3–metilheksana. d. 6–etil–3,4–dimetilheptana b. 2–etil–4,5–dimetilheptana e. 3,4,6–trimetiloktana c. 3,5,6–trimetiloktana
7.Suatu alkena berwujud gas sebanyak 5,6 liter (STP) mempunyai massa 17,5 gram. Gas tersebut adalah . . . . a. etena
b. pentena
c. propena d. heksena
e. butena
8. Reaksi antara etena dengan asam klorida yang menghasilkan etilklorida tergolong reaksi . . . . a. adisi
10. Yang mempunyai isomer cis-trans adalah . . . .
11. Dalam setiap molekul alkuna . . . .
a. semua ikatan antaratom karbon merupakan ikatan rangkap tiga b. terdapat setidaknya satu ikatan rangkap
c. terdapat setidaknya satu ikatan rangkap tiga d. semua atom karbon mengikat 4 atom H e. jumlah atom H lebih sedikit daripada atom C
12. Nama yang tepat untuk senyawa berikut adalah . . . .
13. Berikut ini yang bukan isomer dari heptuna adalah . . . .
14. Suatu hidrokarbon mempunyai rumus empiris CH. Jika Mr senyawa tersebut adalah 26, maka rumus molekulnya adalah ... a. CH2
17. Senyawa yang mempunyai isomer cis-trans adalah .... a. CH2=CH2
b. (CH3)2C=CH2
c. CH3CH=CH2
d. (CH3)2C=C(CH3)2
e. CH3CH=CHCH3
13
19. Hasil adisi HBr terhadap 2-metil-2-butena adalah . . . . a. 1-bromo-3-metilbutana
b. 3-bromo-2-metilbutana c. 2-bromo-2-metilbutana
d. 2-bromo-3-metilbutana e. 3-bromo-2-metilbutana
20. Senyawa berikut ini mengandung atom karbon primer, sekunder, dan tersier secara berturut-turut sebanyak . . . .
a. 5, 5, 1 b. 4, 5, 2 c. 5, 4, 2 d. 4, 4, 1 e. 5, 5, 2
21. Alkana berikut yang memiliki titik didih paling tinggi adalah . . . .
a. C5H12 b. C8H18 c. C10H22 d. C12H26 e. C18H38
22. Pernyataan berikut tentang isomer yang paling tepat adalah . . . . a.isomer memiliki rumus struktur sama
b.isomer mengandung kumpulan gugus sama c.isomer adalah hidrokarbon
d.isomer menghasilkan zat yang sama jika terbakar sempurna dalam oksigen e.isomer memiliki titik didih yang sama
23. Senyawa yang bukan isomer dari oktana adalah . . . .
25. Plastik untuk alat rumah tangga banyak dibuat dari polimerisasi senyawa hidrokarbon. Senyawa tersebut adalah . . . .
a. etana b. metana c. etena d. propena e. etuna
26. Gas asetilena digunakan untuk pengelasan termasuk deret homolog . . . . a.alkana
b.alkadiena
c.alkena d.sikloalkana
e.alkuna
27. Reaksi pembentukan 1-butena dari butana termasuk reaksi . . . . a. oksidasi
30. Di antara reaksi-reaksi berikut yang termasuk reaksi substitusi adalah . . . . a. C2H4 + 3O2→ 2CO2 + 2H2O
b. C2H6 + Br2→ C2H5Br + Br
c. C2H5OH → C2H4 + H2O
d. C2H4 + Br2→ C2H4Br2
e. C2H5Cl → C2H4 + HCl
31. Berdasarkan data telah didapat bahwa metana dan etana memiliki titik didih yang berbeda. Metana memiliki t.d –162 °C dan etana –88,5 °C. Kesimpulan yang dapat diambil adalah . . . .
a. semakin panjang rantai struktur maka titik didih semakin meningkat b. semakin panjang rantai struktur maka titik didih semakin menurun c. alkana mudah larut dalam pelarut nonpolar
33. Suatu hidrokarbon (Mr = 86) terdiri atas 83,72% massa unsur karbon dan 16,28% massa unsur hidrogen (ArH = 1, C = 12). Jumlah isomer hidrokarbon tersebut adalah . . . .
a. 3 b. 6 c. 4 d. 7 e. 5
34. Senyawa yang mempunyai dua buah ikatan rangkap adalah . . . .
a. CH4 b. C3H6 c. C2H4 d. C3H8 e. C3H4
35. Gas yang terbentuk pada reaksi antara batu karbid dengan air adalah . . . . a. etana
b. etena
c. etuna d. metana
e. butana
36. Senyawa alkuna di bawah ini yang memiliki 3 buah isomer yang mengandung ikatan rangkap tiga adalah . . . .
a. C3H4 b. C6H10 c. C4H6 d. C7H12 e. C5H8
37. Senyawa berikut ini, yang merupakan pasangan isomer adalah . . . . a. 2,3-dimetilpentena dan 2-metilpentena
b. propana dan propena c. butana dan butuna
d. pentana dan 2-metilbutana e. n-heksena dan sikloheksana
38. Reaksi etena dengan bromin yang menghasilkan 1,2-dibromoetana ialah jenis reaksi . . . . a. subsitusi