–
A. Hakikat dan Peran Kimia dalam Kehidupan
K⌠t⌠ kimi⌠ ⌡er⌠s⌠l d⌠ri ⌡⌠h⌠s⌠ Ar⌠⌡ “Al-kimiy⌠” ⌠rtiny⌠ peru⌡⌠h⌠n m⌠teri. H⌠l ini ⌡er⌠rti ilmu kimi⌠ ⌠d⌠l⌠h ilmu yang mempelajari tentang materi yang meliputi struktur, susunan, sifat, dan perubahan materi serta energi yang menyertainya.
Peran kimia dalam kehidupan dan perkembangan iptek, misalnya sebagai berikut: Di bidang pertanian, misalnya proses pematangan buah dapat dihambat menggunakan KMnO4. Bidang kedokteran, misalnya penggunaan 131I untuk mendeteksi kerusakan pada kelenjar tiroid.
Bidang farmasi, bahan baku obat diisolasi, disintesis, dan diformulasi dengan menggunakan ilmu kimia. Ilmu biologi, misalnya proses fotosintesis tumbuhan merupakan reaksi-reaksi yang melibatkan zat-zat kimia. Dalam industri petroleum menghasilkan bahan mentah untuk industri kimia organik modern, seperti palstik,
pupuk, bahan pewarna, dan obat-obatan.
Ilmu forensik, misalnya menggunakan sianokrilat, iodin, perak klorida, dan ninhidrin untuk mengidentifikasi sidik jari seseorang.
Industri pangan, misalnya penggunaan propionat sebagai pengawet untuk roti dan keju.
Industri tekstil, misalnya zat warna kurkumin pada temulawak digunakan sebagai pewarna kain rayon viskosa.
Bidang elektronika, misalnya unsur silikon digunakan sebagai bahan dasar pembuatan microchip. B. Metode Ilmiah
Langkah-langkah metode ilmiah adalah sebagai berikut.
Kebenaran hipotesis harus diuji
Memengaruhi keakuratan hasil eksperimen
Data dapat disajikan dalam bentuk tabel, grafik, diagram
alur, atau peta konsep
Merumuskan masalah
Merumuskan hipotesis dan tujuan
Menyusun kerangka teori
Memilih instrumen yang sesuai
Mengumpulkan data
Menganalisis data dan membuat kesimpulan
Menyusun laporan ilmiah
Data dapat disajikan dalam bentuk tabel, grafik, diagram
alur, atau peta konsep
Untuk menjawab hipotesis sebelum eksperimen.
Valid, reliabel, dan objektif.
C. Keselamatan Kerja
Beberapa hal yang peru diperhatikan dalam penyimpanan dan penggunaan bahan kimia berbahaya, antara lain sebagai berikut.
Pisahkan penempatan bahan kimia berbahaya dan tidak berbahaya. Beri label pada kemasan/botol bahan kimia.
Simpan bahan kimia beracun pada tempat khusus yang aman. Jauhkan bahan kimia yang mudah terbakat dari sumber api. Pahami sifat-sifat bahan sebelum digunakan.
Lengkapi laboratorium dengan petunjuk keamanan kerja.
Simpan bahan kimia yang mudah menguap dan terbakar di tempat gelap, bersuhu dingin, dan jauh dari api atau cahaya matahari.
Kenakan jas laboratorium dan pelindung mata. Kenakan sepatu tertutup.
Gunakan semua peralatan dan bahan kimia dengan hati-hati. Dilarang makan, minum atau mencicipin zat kimia.
Cucilah tanganmu setelah eksperimen selesai.
Gambar: Beberapa simbol keselamatan dalam laboratorium
A. Pilihan Ganda
Pilihlah jawaban yang paling tepat! HAKIKAT DAN PERAN ILMU KIMIA 1. Berikut ini manfaat mempelajari ilmu kimia,
kecuali . . . .
A. Penggunaan radioisotop untuk mendeteksi penyakit
B. Peningkatan mutu pangan
C. Penggunaan zat kimia untuk identifikasi sidik jari
D. Penemuan pewarna pakakian E. Penggunaan senjata nuklir
2. Contoh peranan ilmu kimia dalam bidang pertanian adalah . . . .
A. Penemuan mikroprosesor yang digunakan dalam peralatan elektronik
B. Penemuan jenis obat tertentu untuk melawan penyakit
C. Penemuan pupuk sintetis yang dapat meningkatkan hasil pertanian
D. Penemuan sel surya untuk menghasilkan energi
E. Penemuan vaksin untuk penyakit menular METODE ILMIAH
3. Berikut ini adalah langkah-langkah pengerjaan dalam metode ilmiah:
– (5) Hukum ilmiah
Urutan kerja metode ilmiah yang benar adalah .... A. 1 – 2 – 3 – 4 – 5
B. 1 – 2 – 4 – 5 – 3 C. 2 – 3 – 1 – 4 – 5 D. 2 – 4 – 1 – 3 – 5 E. 2 – 5 – 1 – 3 – 4
4. Penyajian hasil percobaan dalam bentuk tabel dan grafik bertujuan untuk . . . .
A. Mengumpulkan hasil percobaan
B. Memudahkan memahami hasil percobaan C. Memastikan kebenaran suatu percobaan D. Menemukan jawaban suatu percobaan E. Menguatkan hipotesis awal
5. Hasil suatu kegiatan ilmiah harus disajikan dalam sebuah dokumen yang disebut . . . .
A. Laporan ilmiah B. Makalah C. Data D. Hipotesis E. Kesimpulan
6. Berikut ini yang tidak termasuk hal yang pahami sebelum melakukan percobaan adalah . . . . A. Masalah yang akan dipecahkan B. Tujuan penelitian
C. Variabel
D. Tingkat kedulitan masalah E. Hipotesis
7. Ketika seorang pengrajin mengukur massa emas menggunakan neraca lengan digolongkan ke dalam pengamatan . . . .
A. Kualitatif B. Pengukuran C. Kuantitatif D. Penimbangan E. Semua salah
8. Berikut ini merupakan hasil pengamatan kualitatif adalah . . . .
A. Massa benda 250 gram B. Warna larutannya hijau tua C. Suhu benda 60 °C
D. Massa jenis benda 10,5 g/cm3 E. Volume larutan50 mL
9. Langkah pertama dalam metode ilmiah adalah merumuskan masalah yang merupakan pertanyaan ilmiah yang harus dicari jawabannya, salah satu syarat dari rumusan masalah tersebut adalah . . . .
A. Masalah harus memiliki sejumlah jawaban B. Masalah harus bias diselesaikan secara
eksperimental
C. Masalah harus memiliki jawaban ya atau tidak
D. Masalah tidak harus memiliki jawaban E. Masalah harus memiliki jawaban yang pasti 10.Dari pernyataan berikut ini, termasuk langkah
mengambil kesimpulan adalah . . . .
A. Membuat perkiraan apa yang akan terjadi di masa depan
B. Membangun imajinasi untuk memecahkan masalah
C. Menjelaskan atau menafsirkan hal-hal yang kita amati
D. Menggambarkan kesimpulan tentang hipotesis yang dibuat
E. Mempelajari yang telah terjadi di masa lampau
PERILAKU ILMIAH
11.Uraian berikut ini merupakan sikap ilmiah seorang ilmuwan, kecuali . . . .
A. Berpendapat secara ilmiah dan kritis B. Berani dan santun dalam mengajukan
pertanyaan dan berargumentasi C. Jujur terhadap fakta
D. Membedakan fakta dan opini E. Subjektif
12.Mau bekerja sama dengan orang lain serta menerima kritik dan saran merupakan cerminan sikap . . . .
A. Terbuka B. Santun C. Jujur D. Tekun E. Objektif
KESELAMATAN KERJA DI LABORATORIUM
13.Ruang laboratorium kimia tidak boleh digunakan untuk . . . .
A. Melakukan percobaan kimia B. Diskusi hasil percobaan C. Tempat belajar teori D. Tempat makan dan minum
E. Membuat kesimpulan dari hasil percobaan 14.Berikut ini adalah uraian cara memperlakukan
bahan berbahaya di laboratorium kimia, kecuali . . . .
A. Pisahkan penempatan bahan kimia berbahaya dengan yang tidak berbahaya
B. Beri label pada kemasan atau botol bahan kimia
D. Simpan bahan kimia yang beracun dan keras di lemari asam
E. Jauhkan bahan kimia yang mudah terbakar dari sumber api
15.Perlengkapan yang harus digunakan saat melakukan percobaan di laboratorium, kecuali . . . .
A. Jas lab
B. Pelindung mata C. Sepatu tertutup D. Tas
E. Sarung tangan
16.Alat gelas yang digunakan untuk wadah sampel atau bahan kimia sebagai berikut, kecuali . . . . A. Gelas kimia
B. Erlenmeyer C. Tabung reaksi D. Gelas ukur E. Buret
17.Alat pada gambar di samping digunakan untuk . . . .
A. Memisahkan campuran
B. Mereaksikan zat kimia
C. Mengukur volume suatu larutan D. Mengumpulkan bahan kimia E. Mengukur massa suatu bahan
18.Alat yang digunakan untuk menggiling bahan kimia padat adalah . . . .
A.
B.
C.
D.
E.
19.Alat pada gambar di samping digunakan untuk . . . .
A. Mengukur volume dari suatu larutan B. Mengambil atau memindahkan sejumlah
kecil cairan
C. Memisahkan campuran D. Mengaduk larutan E. Memanaskan larutan
20.Volume larutan pada gambar di samping adalah . . . .
A. 44 mL B. 46 mL C. 48 mL D. 50 mL E. 43 mL
21.Alat yang dapat digunakan untuk mengukur suhu larutan adalah . . . .
A. D.
B. E.
C.
22.Pereaksi yang telah diambil tidak boleh dimasukkan kembali ke dalam botol karena . . . . A. Membuat lebih larut
B. Menghindari kontaminasi C. Dapat mengubah konsentrasi D. Dapat meningkatkan konsentrasi E. Dapat menurunkan konsentrasi 23.Berikut ini merupakan prosedur untuk
menghindari kecelakaan saat melakukan eksperimen, kecuali . . . .
A. Menggunakan kacamata pelindung B. Menjauhkan beberapa bahan kimia yang
mudah terbakar dari sumber api
C. Menggunakan masker ketika mereaksikan bahan kimia
D. Menggunakan sandal ketika sedang melakukan eksperimen
–
24.Berikut ini perlengkapan yang digunakan ketika melakukan eksperimen di laboratorium, kecuali . . . .
A. D.
B. E.
C.
25.Berikut ini yang merupakan bahan kimia tidak beracun adalah . . . .
A. Alkohol B. Aseton C. Metanol D. Asam klorida E. Asam sulfat
26.Arti dari simbol pada gamabr di samping adalah . . . .
A. Zat kimia radioaktif B. Zat kimia beracun C. Zat kimia mudah
meledak
D. Zat kimia korosif E. Zat kimia mudah
terbakar
27.Berikut ini merupakan simbol yang digunakan sebagai tanda zat kimia korosif adalah . . . .
A. B. C. D. E.
28.Berikut ini merupakan bahan kimia korosif adalah . . . .
A. Eter B. Benzena C. Asam sulfat D. Alkohol E. Aseton
29.Simbol pada gambar di samping digunakan untuk menunjukkan bahan kimia . . . .
A. Radioaktif
B. Iritasi C. Beracun D. Karsinogen E. Mudah meledak
30.Bahan kimia yang dapat menyebabkan iritasi pada jaringan tubuh manusia disebut . . . .
A. Eksplosif B. Iritasi C. Beracun D. Karsinogen E. Pengoksidasi
31.Berikut ini bukan merupakan bahan kimia yang mudah menguap dan mudah terbakar adalah . . . . A. Benzena
B. Alkohol C. Eter D. Aseton E. Metanol
32.Bahan kimia karsinogen merupakan bahan kimia yang . . . .
A. Mudah terbakar
B. Menstimulasi perkembangan sel-sel kanker C. Mudah menguap dan mudah terbakar D. Mengiritasi jaringan tubuh manusia E. Mudah meledak
33.Berikut ini yang merupakan bahan kimia karsinogen adalah . . . .
A. Formalin B. Isopropil alkohol C. Asam nitrat D. Etil eter E. Metanol
34.Arti simbol yang digunakan untuk menunjukkan bahan kimia radioaktif adalah . . . .
A.
B.
C.
D.
E.
35.Simbol yang ditunjukkan pada gambar di samping digunakan untuk bahan kimia . . . . Midah menguap
B. Keras dan berbau menyengat C. Mudah meledak
D. Mudah terbakar
36.Berikut ini merupakan peralatan keselamatan dalam laboratorium, kecuali . . . .
A. Sarung tangan, alat pemadam api, dan masker
B. Kacamata pelindung, topi, dan jas lab C. Masker, jas lab, dan sarung tangan
D. Alat pemadam api, kacamata pelindung, dan masker
E. Sarung tangan, jas lab, dan kacamata pelindung
37.Peralatan gelas harus digunakan dengan baik untuk . . . .
A. Menghindari kecelakaan B. Menghemat biaya
C. Menjaga peralatan dalam jangka panjang D. Lebih mudah dalam penggunaan E. Mengembangkan penemuan baru
38.Alat listrik harus dijauhkan dari air untuk menghindari . . . .
A. Korsleting B. Efek kalibrasi C. Korosi D. Kontaminasi E. Perubahan kalibrasi
39.Timbangan analitik harus dijauhkan dari goncangan dan benturan untuk menghindari . . . . A. Korsleting
B. Perubahan kalibrasi C. Korosi
D. Kontaminasi E. Kerusakan bahan
40.Bahan kimia keras seperti H2SO4 dan HCl harus disimpan di . . . .
A. Lemari pendingin B. Dekat keran air C. Ruang gelap D. Lemari asam
Oscas Course –Unconventional Advanced B. Isian
Lengkapilah pernyataan berikut ini dengan benar!
1. Dalam melakukan penelitian, langkah pertama yang haru dilakukan adalah . . . 2. Sikap ilmiah yang harus dimiliki oleh seorang peneliti adalah . . .
3. Dalam metode ilmiah, . . . dibuat berdasarkan hasil eksperimen.
4. . . merupakan alat yang digunakan ketika mencampurkan atau pemanasan bahan kimia dalam larutan. 5. Bahan kimia yang mudah meledak sering disebut . . .
6. . . merupakan alat pelindung mata saat melakukan eksperimen.
Untuk menjaga keselamata di (7) . . . ., kita harus mengenali berbagai macam karakteristik dari alat dan bahan kimia yang tersedia. Kita dianjurkan untuk menggunakan perlengkapan keselamatan, seperti (8) . . . . . . . ., (9) . . . ., (10) . . . ., dan (11) . . . Alat dan bahan kimia dalam laboratorium harus dignakan dengan baik. Peralatan yang terbuat dari (12) . . . merupakan barang pecah belah dan mudah retak oleh benturan dengan benda lain. (13) . . . harus disimpan di ruangan kerung dan dijauhkan dari air untuk menghindari korsleting. Bahan kimia beracun harus disimpan pada tempat khusus dan aman, seperti di dalam (14) . . . ., sedangkan bahan kimia yang mudah menguap dan mudah terbakar harus disimpan di ruang gelap dan (15) . . . .. penggunaan perlengkapan keselamatan, alat, dan bahan kimia perlu dipahami dengan baik untuk menghindari kecelakaan yang dapat terjadi selama bekerja di laboratorium.
C. Esai
Jawablah pertanyaan berikut ini dengan jelas dan benar! 1. Apa yang dimaksud dengan ilmu kimia?
______________________________________________________________________________________ ______________________________________________________________________________________ 2. Sebutkan lima contoh peranan ilmu kimia dalam kehidupan manusia!
______________________________________________________________________________________ ______________________________________________________________________________________ 3. Jelaskan pengertian dan bagaimana langkah-lagkah metode ilmiah!
______________________________________________________________________________________ ______________________________________________________________________________________ 4. Gambarkan dan tuliskan kegunaan dari alat berikut pada kolom yang tersedia.
a. Tabung reaksi
________________________________________ ________________________________________
b. Gelas Ukur
________________________________________ ________________________________________
c. Gelas Piala
________________________________________ ________________________________________
d. Erlenmeyer
5. Sebutkan alat laboratorium yang dapat digunakan untuk:
___________________________________________________________________________________ ___________________________________________________________________________________ 6. Pengukuran yang dilakukan di laboratorium meliputi mengukur massa, volume, waktu, dan suhu.
Sebutkan alat apa saja yang dapat digunakan untuk melakukan pengukuran tersebut.
___________________________________________________________________________________ ___________________________________________________________________________________ 7. Jelaskan cara menggunakan peralatan gelas!
___________________________________________________________________________________ ___________________________________________________________________________________ 8. Jelaskan cara menggunakan alat listrik dalam laboratorium!
___________________________________________________________________________________ ___________________________________________________________________________________ 9. Sebutkan aturan keselamatan di Laboratorium!
___________________________________________________________________________________ ___________________________________________________________________________________ 10.Jelaskan manfaat belajar kimia yang dikaitkan dengan karir masa depan!
– A. Atom
Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani “⌠tomos” y⌠ng ⌡er⌠rti tid⌠k d⌠p⌠t di⌡⌠gi l⌠gi). N⌠mun, ⌡er⌠khir pend⌠p⌠t terse⌡ut d⌠p⌠t dip⌠t⌠hk⌠n deng⌠n berbagai penelitian ilmiah. Berdasarkan penelitian ilmiah diketahui bahwa partikel dasar atom terdiri atas proton (bermuatan +), (elektron -), dan neutron (tidak bermuatan).
B. Nomor Atom dan Nomor Massa Suatu atom dinotasikan dengan:
X
A Z X = lambang atom unsur
A = nomor massa (jumlah proton + neutron) Z = nomor atom (jumlah proton)
Perhatikan skema hubungan atom-atom berikut ini berdasarkan nomor atom dan nomor massanya.
C. Perkembangan Model Atom
Susunan partikel dasar atom tersebut mengalami perubahan, mulai dari model Dalton, model Thomson, model Rutherford, model Bohr, hingga diperoleh model atom modern seperti sekarang. Konsep dari model atom tersebut sebagai berikut :
1. Model Atom Dalton
Atom berbentuk seperti bola pejal. Gambar:
Model atom Dalton Hubungan Atom-Atom
Isotop Isobar Isoton Isoelektron
Nomor atom sama, tetapi mempunyai nomor massa berbeda
Nomor atomnya berbeda, tetapi nomor
massanya sama
Unsurnya berbeda, tetapi jumlah neutronnya sama
Unsurnya berbeda, tetapi jumlah elektronnya sama
C
12
6 dan
C
146
N
14
7 dan
C
146
P
31
15 dan
S
3216
2 16
2. Model Atom Thomson
Atom berbentuk bola yang bermuatan positif dan di dalamnya tersebar elektron-elektron yang bermuatan
negatif mengelilingi inti atom. Gambar:
Model atom Thomson
3. Model Atom Rutherford
Atom terdiri atas inti atom yang bermuatan positif, sedangkan elektron yang bermuatan negatif mengelilingi inti atom.
Gambar:
Model Atom Rutherford
4. Model Atom Bohr
Atom terdiri atas inti atom yang mengandung proton, sedangkan elektron bergerak mengelilingi inti atom pada lintasan dengan tingkat energi tertentu.
Gambar:
Model Atom Bohr
5. Model Atom Modern
Atom terdiri atas inti atom yang mengandung proton dan neutron, sedangkan elektron-elektron yang mengelilingi inti atom berada pada orbital tertentu membentuk kulit atom.
Gambar:
Model Atom Modern
D. Bilangan Kuantum
Bilangan kuantum adalah bilangan yang menyatakan posisi elektron dalam suatu atom. Perhatikan skema berikut :
Terdiri dari
Menyatakan Magnetik (m)
Bilangan Kuantum
Utama (n) Azimuth (l) Spin (s)
Tingkat energi utama atau kulit utama dimana elektron
berada dan
menggambarkan perkiraan jarak elektron dari inti. Nilai n mulai dari 1, 2, 3, ... dan seterusnya
Subkulit pada setiap kulit n yang juga menentukan bentuk orbital. Nilai l mulai dari l = 0 sampai l = n – 1, dilambangkan dengan huruf s, p, d, f, g, h, ... sebagai contoh, jika orbital s maka l = 0, jika orbital p maka l = 1, jika orbital d maka l = 2, dan seterusnya
Orbital-orbital yang ditempati elektron pada setiap subkulit. Nilai m adalah mulai dari –l
– E. Konfigurasi Elektron
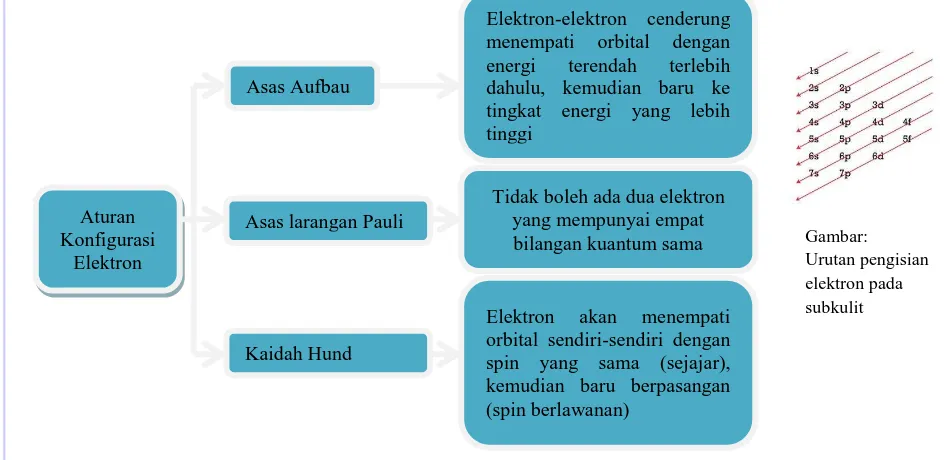
Gambaran penyebaran elektron yang paling mungkin ke dalam orbital-orbital kulit elektron dinamakan konfigurasi elektron suatu atom. Terdapat 3 aturan yang harus diperhatikan dalam menentukan konfigurasi elektron, seperti yang ditunjukkan oleh skema berikut.
Gambar: Urutan pengisian elektron pada subkulit
Urutan pengisian elektron pada subkulit: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d ... dan seterusnya. Tabel berikut menunjukkan jumlah maksimal elektron yang dapat ditampung oleh tiap subkulit.
Tabel Subkulit dan Jumlah Maksimal Elektron
Subkulit Jumlah Orbital Jumlah Maksimal Elektron s
p d f ...
1 3 5 7 ...
2 6 10 14 ...
Beberapa hal penting mengenai konfigurasi elektron, di antaranya sebagai berikut:
1. Konfigurasi panjang, yaitu urutan pengisian elektron pada subkulit yang ditulis secara lengkap. Contoh: 17Cl : 1s
2
2s2 2p6 3s2 3p5
2. Konfigurasi singkat, yaitu konfigurasi yang ditulis dengan menggunakan gas mulia. Contoh: 17Cl : (Ne) 3s2 3p5
3. Konfigurasi elektron ion, yaitu konfigurasi elektron dari atom yang telah melepaskan atau menerima elektron dari atom lain. Contoh: 17Cl-: (Ne) 3s2 3p6
4. Berdasarkan percobaan, subkulit d cenderung penuh (d10) atau setengah penuh (d5) lebih stabil. Hal ini menyebabkan konfigurasi elektron beberapa atom tidak sesuai dengan asas Aufbau.
Contoh: menurut asas Aufbau 29Cu : (Ar) 4s2 3d9
Menurut percobaan 29Cu : (Ar) 4s1 3d10 (lebih stabil) Aturan
Konfigurasi Elektron
Asas Aufbau
Asas larangan Pauli
Kaidah Hund
Elektron-elektron cenderung menempati orbital dengan energi terendah terlebih dahulu, kemudian baru ke tingkat energi yang lebih tinggi
Tidak boleh ada dua elektron yang mempunyai empat bilangan kuantum sama
F. Tabel Periodik Unsur-unsur
Table periodik unsur modern disusun berdasarkan nomor atom dan kemiripan sifat. Lajur horizontal disebut periode, sedangkan lajur vertikal disebut golongan. Unsur segolongan mempunyai sifat kimia yang hampir sama sedangkan unsur seperiode mempunyai jumlah kulit yang terisi elektron sama.
Berdasarkan konfigurasi elektronnya, unsur-unsur dalam tabel periodik dibagi menjadi 4 blok, yaitu blok s, p, d, dan f.
G. Menentukan Golongan dan Periode
Golongan menyatakan jumlah elektron valensi, sedangkan periode menyatakan jumlah kulit. Berikut ini penentuan golongan unsur.
Menentukan golongan unsur utama (IA – VIIIA) : ns1-2 np1-6 Menentukan golongan unsur transisi (blok d) : (n-1)d1-10 4s1-2
Menentukan golongan unsur tr⌠nsisi d⌠l⌠m (⌡lok f) : l⌠nt⌠nid⌠ →4f ; ⌠ktinid⌠ → 5f
H. Sifat Unsur dan Keperiodikan Unsur 1. Sifat keperiodikan unsur
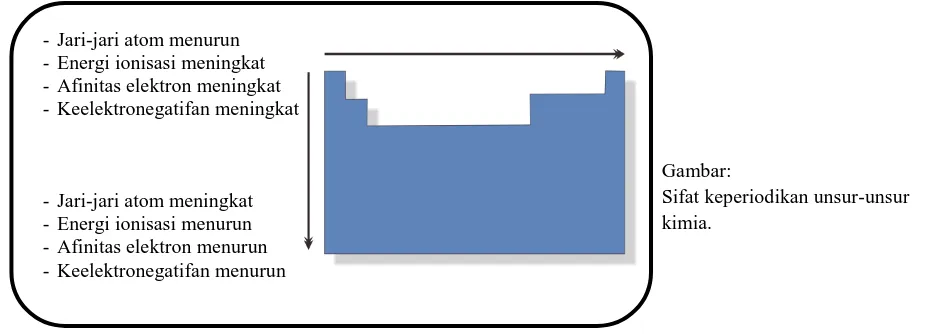
Susunan unsur-unsur dalam tabel periodik membentuk keteraturan atau sifat keperiodikan, seperti yang ditunjukkan gambar di bawah ini.
Gambar:
Sifat keperiodikan unsur-unsur kimia.
Jari-jari atom adalah jarak dari inti atom sampai ke elektron di kulit terluar.
Energi ionisasi adalah energi minimum yang dibutuhkan atom untuk melepaskan satu elektron yang terikat paling lemah.
Afinitas elektron adalah besarnya energi yang dilepas oleh atom netral dalam bentuk gas pada penangkapan satu eletron untuk membentuk ion negatif.
Jenis blok dalam tabel periodik
Blok s Blok p Blok d Blok f
Golongan IA dan IIA termasuk logam aktif, kecuali H
Golongan IIIA sampai VIIIA disebut unsur perwakilan, karena blok p memiliki logam, metaloid (semilogam), dan nonlogam
Golongan IB sampai VIIIB semuanya logam
Lantanida dan aktinida disebut transisi dalam, semuanya logam
-Jari-jari atom menurun -Energi ionisasi meningkat -Afinitas elektron meningkat -Keelektronegatifan meningkat
–
Keelektronegatifaan adalah ukuran kecenderungan suatu atom untuk menarik elektron ke pihaknya dalam suatu ikatan.
2. Sifat unsur
a. Sifat Logam-Nonlogam
Sifat logam-nonlogam suatu unsur dapat diprediksikan dari letaknya dalam tabel periodik. Perhatikan gambar berikut.
b. Kereaktifan
Kereaktifan unsur adalah kemampuan suatu unsur bereaksi dengan unsur yang lain.
A. Pilihan Ganda
Pilihlah jawaban yang paling tepat! NOMOR ATOM DAN NOMOR MASSA 1. Atom terdiri dari partikel proton da neutron yang
berada di dalam inti atom dan elektron yang bergerak mengelilingi inti atom dalam kecepatan tertentu. Muatan listrik dari proton, neutron, dan elektron adalah ....
Proton Neutron Elektron A.
B. C. D. E.
+1 -1
0 +1 -1
-1 +1 -1 0 0
0 0 +1
-1 +1
2. Atom unsur kalsium mempunyai massa atom 40 dan nomor atom 20. Lambang atom unsur kalsium yang benar adalah ....
A. 2040
K
B. 4020
K
C. 2040
Ca
D. 4020
Ca
E. 4040
Ca
3. Spesi yang mempunyai jumlah elektron sama
dengan 1531
P
adalah ....A. 1732
Cl
B. 1632
S
C. 1531
P
3Unsur logam bersifat reduktor, yaitu mengalami oksidasi atau melepaskan elektron. Sementara itu, unsur nonlogam bersifat oksidator, yaitu mengalami reduksi atau menerima elektron.
Kereaktifan Unsur-unsur Berdasarkan Letaknya
Dalam satu periode dari kiri ke kanan.
Unsur-unsur yang paling udah melepas (gol.IA) ataupun menerima elektron (gol. VIIA) merupakan unsur yang paling reaktif.
Dalam satu golongan dari atas ke bawah.
D. 1632
S
2E. 1327
Al
34. Unsur klor dengan lambang 1735
Cl
mengandung ....Proton Neutron
A. B. C. D. E. 18 35 17 16 17 17 7 18 18 35
5. Berdasarkan lambang atom 2656
Fe
3, jumlahproton, elektron, dan neutron dalam ion
Fe
3 adalah ....Proton Neutron Elektron
A. B. C. D. E. 26 26 26 26 23 56 26 23 30 23 30 30 30 20 30
6. Pasangan di bawah ini yang memiliki jumlah neutron yang sama adalah ....
A. 199
F
dan 1022Ne
B. 146
C
danN
14 7
C. 1123
Na
dan 1223Mg
2D. 1632
S
danAl
29 13 E. 31
T
dan 12D
7. Atom Na yang mempunyai massa atom 23 dan nomor atom 11 merupakan isoton dengan atom unsur ....
A. 1224
Mg
B. 1224
Na
C. 1939
K
D. 2040
Ca
E. 147
N
8. Pada isotop 3065
Zn
dan 20983Bi
, jumlah proton dan neutron kedua unsur tersebut berturut-turut adalah ....A. (30,30) ; (83,126) B. (35,30) ; (83,209) C. (35,35) ; (83,126)
D. (30,35) ; (83,126) E. (30,35) ; (83,209)
9. Hubungan yang benar dari pasangan atom dan ion berikut adalah ....
Atom 1 Hubungan Atom 2
A. B. C. D. E.
l
C
35 17 l
C
35 17 l
C
32 17N
13 7r
A
40 18 isotop isotop isotop isotop isotopl
C
36 17r
A
40 18 S
32 16C
13 6K
39 19 MODEL ATOM10.Model atom berikut yang merupakan model atom Rutherford adalah ....
A.
B.
C.
D.
E.
11.Elektron-elektron dalam atom beredar mengelilingi inti dan berada dalam lintasan (tingkat energi_ tertentu. Elektron dapat berpindah dari satu tingkat energi ke tingkat energi lainnya di serial penyerapan atau pelepasan energi. Pernyataan ini dikemukakan oleh ....
– STRUKTUR ATOM
12.Jumlah elektron di kulit terluar dai ion 35
X
adalah .... A. 1 B. 3 C. 6 D. 7 E. 8
13.Suatu elektron berpindah dari kulit (orbital) K ke kulit M. Pernyataan yang benar untuk peristiwa tersebut adalah ....
A. Elektron menyerap energi sebesar selisih energi orbital M dikurangi orbital K B. Elektron menyerap energi sebesar selisih
energi orbital K dikurangi energi orbital M C. Elektron melepaskan energi sebesar selisih energi orbital M dikurangi energi orbital K D. Elektron melepaskan energi sebesar selisih energi orbital K dikurangi energi orbital M E. Elektron tidak menyerap atau melepaskan
energi
14.Jumlah elektron pada kulit atom dari dalam ke luar berturut-turut sebanyak ....
A. 2, 8, 8, 1 B. 2, 18, 8, 7 C. 2, 8, 18, 7 D. 2, 8, 18, 7 E. 2, 8, 10 ,15 F. 2, 8, 20, 5
15.Suatu atom logam L memiliki massa atom 39 dan neutron sebanyak 20. Jumlah elektron di tiap kulit atomnya adalah ....
K L M N
A. B. C. D.
2 2 2 2
8 18
8 8
8 1 9 7
1 - - 2
E. 2 7 9 1
16.Pasangan unsur-unsur di bawah ini yang memiliki elektron valensi yang sama adalah ....
A. 3Li dan 13Al B. 7N dan 15P C. 12Mg dan 30Zn D. 5B dan 21Sc E. 7N dan 17Cl
17.Atom terdiri dari inti atom bermuatan positif dan dikelilingi elektron yang bermuatan negatif pada lintasannya. Teori tersebut diungkapkan oleh .... A. Niels Bohr
B. Ernest Rutherford C. Louise de Broglie D. Werner Heisenberg E. Erwin Schrodinger
18.Suatu ruang di sekitar inti atom tempat elektron berpeluang ditemukan disebut ....
A. Lintasa B. Orbital C. Kuatum D. Kulit E. Mekanika
19.Elektron beredar secara stasioner. Istilah stasioner yang dimaksud adalah ....
A. Diam di tempat B. Berotasi
C. Perubahan kecepatan elektron dari lambat menjadi cepat
D. Perubahan kecepatan elektron dari cepat menjadi lambat
E. Tidak menyerap ataupun memancarkan energi
BILANGAN KUANTUM
20.Bilangan kuantum yang menyatakan orbital yang ditempati elektron disebut ....
A. Utama B. Azimuth C. Magnetik D. Orbital E. Spin
B. Bentuk orbital C. Tingkat energi D. Kulit atom
E. Arah rotasi elektron
22.Jumlah orbital dan elektron maksimum ada subkulit f adalah ....
A. 7 dan 14 B. 3 dan 6 C. 2 dan 4 D. 1 dan 2 E. 5 dan 10
23.Suatu atom dengan tiga kulit elektron memiliki orbital sebanyak ....
A. 8 B. 12 C. 14 D. 20 E. 30
24.Elektron terakhir dari atom A mempunyai bilangan kuantum n = 3; l = 2; m = -2; s = + ½ dan memiliki neutron di dalam intinya sebanyak 24, maka massa atom relatif unsur A adalah .... A. 36
B. 21 C. 48 D. 45 E. 24
25.Bilangan kuantum yang diijinkan adalah .... n l m s
A. B. C. D. E. 1 2 3 4 5 1 0 1 2 3 0 -1 2 -3 +2 -½ +½ -½ +½ -½
26.Elektron dengan bilangan kuantum yang tidak diijinkan adalah ....
A. n = 3, l = 0, m = 0, s = -½ B. n = 3, l = 1, m = 1, s = +½ C. n = 3, l = 2, m = -1, s = +½ D. n = 3, l = 1, m = 2, s = -½ E. n = 3, l = 2, m = 2, s = +½
27.Susunan bilangan kuantum yang tidak mungkin adalah ....
n l m s
A. B. C. D. E. 2 2 3 3 5 1 1 2 3 3 1 -1 2 -3 +3 +½ +½ +½ +½ -½
28.Jika unsur A mempunyai bilangan kuantum n = 4, l = 0, m = 0, s = + ½ bersenyawa dengan unsur B membentuk senyawa A2B, maka unsur B mempunyai bilangan kuantum ....
n l m S
A. B. C. D. E. 2 3 2 3 4 1 1 1 1 0 0 0 -1 -1 0 +½ -½ -½ +½ -½
GOLONGAN DAN PERIODE
29.Unsur X dengan nomor atom 29 dalam tabel periodik terletak pada ....
Golongan Periode
A. B. C. D. E. IA IA IB IB VIIIB 4 3 3 4 3
30.Berikut adalah nomor atom dari beberapa unsur. Unsur P Q R S
Nomor Atom 3 8 12 19 Pasangan unsur yang terletak dalam satu golongan dalam sistem periodik unsur adalah .... A. P dan Q
B. Q dan R C. R dan S D. P dan S E. Q dan S
31.Lambang unsur adalah 2040
X
. Unsur X terletak pada ....Golongan Periode
A. B. C. D. E. VIIIB IIA IIB IA IIA 4 3 4 3 4
32.Dalam tabel periodik, unsut yang mempunyai struktur atom seperti di samping terletak pada ....
–
33.Atom unsur X terletak pada periode ke-3 dan golongan IIIA. Nomor atom unsur X adalah .... A. 13
B. 14 C. 16 D. 21 E. 23
34.Di antara unsur-unsur 3A, 12B, 19C, 33D, dan 53E, yang terletak dalam golongan yang sama pada tabel periodik unsur adalah ....
A. A dan B B. B dan D C. A dan C D. D dan E E. C dan E
35.Ion suatu atom ditulis 35X-1, maka unsur X ini terletak pada ....
Golongan Periode
A. B. C. D. E. VIIB VIIB VIIA VIIA VIIA 3 4 5 4 5
36.Ion X3- mempunyai konfigurasi elektron pada kulit K, L, dan M berturut-turut 2, 8, dan 8. Dalam tabel periodik unsur, atom X terletak pada ....
Golongan Periode A. B. C. D. E. IIIB VB VB VIIIA VA 4 3 4 3 3
37.Atom unsur X terletak pada periode ke-3 dan golongan VIIA. Jika massa atom X adalah 35, maka jumlah proton, neutron, dan elektron yang dimiliki oleh atom unsur X adalah ....
Proton Neutron Elektron
A. B. C. D. E. 17 17 18 17 18 18 17 17 18 18 17 18 17 18 17
KONFIGURASI ELEKTRON DAN SISTEM PERIODIK
38.Unsur yang mempunyai diagram elektron valensi pada keadaan dasar seperti berikut adalah ....
A. 6C B. 8O C. 15P D. 13Al E. 16S
39.Diketahui nomor atom Fe = 26. Konfigurasi elektron ion Fe3+ adalah ....
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d6 B. 1s2 2s2 2p6 3s2 3p6 3d5 C. 1s2 2s2 2p6 3s2 3p6 4s2 3d6 D. 1s2 2s2 2p6 3s2 3p6 4s2 3d4 E. 1s2 2s2 2p6 3s2 3p6 4d6
40.Konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 3d10 dimiliki ion ....
A. 30Zn2+ B. 26Fe
2-C. 27Co 3-D. 33As3+ E. 28Ni2+
41.Konfigurasi unsur M-: [Xe] 6s2 4f14 5d10 6p6. Nomor atom unsur tersebut adalah .... A. 86
B. 85 C. 87 D. 84 E. 88
42.Ge memiliki elektron [Ar] 3d10 4s2 4p2. Ketika membentuk Ge4+, elektron akan dikeluarkan menurut urutan ....
I II III IV
A. B. C. D. E. 4p 4p 4s 4s 3d 4p 4p 4p 4p 4p 4s 3d 4p 3d 4p 4s 3d 4p 3d 3d 43.Konfigurasi elektron S2- (nomor atom = 16)
dalam keadaan netral adalah .... A. [He] 2s2 2p4
B. [Ne] 3s2 3p4 C. [He] 2s2 2p6 D. [Ar] 4s2 4p4 E. [Ar] 4s2 3p4
44.Unsur X mempunyai bilangan kuantum n = 3, l = 1, m = -1, s = + ½.
Konfigurasi unsur X3+ adalah .... A. [Ne] 3p1
D. [He] 2s2 2p6 E. [He] 2s5
45.Unsur X dengan nomor atom 23, dalam sistem periodik terletak pada ....
A. golongan VA periode 4 B. golongan VB periode 4 C. golongan IIIA periode 5 D. golongan IIIA periode 3 E. golongan IB periode 4
46.Unsur yang berada pada golongan VIB periode 5 mempunyai nomor atom ....
A. 38 B. 56 C. 24 D. 65 E. 42
47.Konfigurasi elektron M3+ = 1s2 2s2 2p6. Unsur M dalam sistem periodik terletak pada ....
A. golongan VIIIA periode 2 B. golongan VB periode 2 C. golongan IIIA periode 2 D. golongan IIIA periode 3 E. golongan IIIB periode 3
SIFAT UNSUR DAN KEPERIODIKANNYA 48.pernyataan yang benar tentang sifat-sifat periodik
unsur dalam satu periode dari kiri ke kanan adalah ....
A. emergi ionisasi berkurang B. keelektronegatifan berkurang C. sifat logam bertambah D. sifat asam berkurang E. jari-jari atom berkurang
49.di antara sifat periodik berikut, yang benar dalam satu golongan dari atas ke bawah, kecuali .... A. jari-jari atom makin besar
B. elektronegativitas makin kecil C. energi ionisasi makin kecil D. afinitas elektron makin besar E. sifat logam makin berkurang
50.jika sifat unsur natrium dibandingkan dengan sifat unsur magnesium maka unsur natrium .... A. energi ionisasinya lebih besar
B. jari-jari atomnya lebih kecil C. lebih bersifat oksidator D. sifat reduktornya lebih lemah E. lebih bersifat basa
51.kelompok atom unsur golongan VIIA, yaitu F, Cl, Br, I, At. Atom yang paling kuat menarik
elektron adalah .... A. satatin B. brom C. klor
D. iod E. fluor
52.unsur yang paling mudah melepas elektron adalah ....
A. 11Na B. 13Al C. 14Si D. 17Cl E. 12Mg
53.jika jari-jari atom unsur-unsur Li, Na, K, Be, dan B secara acak dalam angstrom adalah:
2,01;1,57;1,23;0,80;0,89, maka jari-jari atom K sama dengan ....
A. 2,01 B. 1,57 C. 1,23 D. 0,89 E. 0,80
54.berikut adalah nomor atom dari beberapa unsur. Unsur Li Na Mg Cl
Nomor Atom 3 8 12 19 Urutan jari-jari atom dan ion yang benar dari yang terkecil adalah ....
A. K+, Ar, Cl -B. Na, Na+, Mg2+ C. Cl, Cl-, Ar D. Na, K, K+ E. K, Na, Li
55.Nomor atom dari beberapa unsur adalah sebagai berikut.
Unsur A B C D E
Nomor Atom 3 8 11 12 19 Atom yang memiliki energi ionisasi pertama paling besar adalah ....
A. A B. B C. C D. D E. E
56.Energi ionisasi adalah energi yang diperlukan oleh suatu atom pada keadaan gas untuk melepaskan satu elektron valensinya. Urutan energi ionisasi pertama yang benar dari yang terkecil adalah ....
–
57.Pada atom-atom unsur halogen, atom yang memiliki keelektronegatifan paling besar adalah atom ....
A. iod B. brom C. fluor D. klor E. astatin
58.Berikut adalah data keelktronegatifan beberapa unsur.
Unsur K L M N O
Elektronegatifan 2,20 2,55 3,04 4,00 0,93
Unsur yang paling mudah melepas elektron adalah ....
A. K B. L C. M D. N E. O
59.Data keelektronegatifan beberapa unsur adalah sebagai berikut.
Unsur P Q R S T Elektronegatifan 1,2 2,5 3,0 3,5 4,0
Unsur yang paling lemah menarik elektron adalah ....
A. P B. Q C. R D. S E. T
60.Berikut adalah data keelektronegatifan unsur-unsur dalam satu periode.
Unsur O P Q R S Elektronegatifan 2,46 1,45 1,74 2,83 1,00
Urutan letak unsur-unsur tersebut dari kiri ke kanan dalam tabel periodik adalah .... A. O, P, Q, R, S
B. R, O, Q, P, S C. S, R, O, Q, P D. S, P, Q, O, R E. S, R, Q, P, O
B. Isian
Lengkapilah pernyataan berikut ini dengan benar!
1. Perhatikan lambang unsur berikut!
a. ________ menyatakan jumlah _____________.
b. Menyatakan ______________.
c. ________ menyatakan jumlah _____________.
2. Atom 1123
Na
memiliki __________ proton, __________neutron, dan __________elektron, sedangkan ion 2 24
12
Mg
memiliki __________proton, __________neutron, dan __________elektron.3. Atom-atom yang mempunyai jumlah neutron sama disebut __________, sedangkan atom-atom yang mempunyai jumlah elektron sama disebut __________.
4. Dua atom yang mempunyai nomor massa sama disebut __________. 5. Lintasan elektron mengelilingi inti atom dinamakan __________. 6. Susunan elektron dalam kulit atom dikenal dengan istilah __________. 7. Bilangan kuantum utama menyatakan __________ yang ditempati elektron.
8. Jika bilangan kuantum azimut bernilai 2, maka elektron terdapat pada subkulit __________ 9. Bilangan kuantum azimut dari elektron kulit terluar unsur 47Ag bernilai __________ 10.Bilangan kuantum magnetik menyatakan __________ yang ditempati elektron. 11.Bilangan kuantum spin menyatakan ____________________ yang ditempati elektron.
12.Pengisian orbital dimulai dari tingkat energi rendah ke tingkat energi tinggi. Pernyataan tersebut dikenal sebagai ______________________________.
13.Jika terdapat orbital-orbital dengan energi sama, maka elektron akan menempati orbital itu sendiri dengan spin sejajar, kemudian baru berpasangan. Konsep ini dikenal sebagai ____________________.
14.Atom Sc mempunyai nomor atom 21. Konfigurasi elektronnya, yaitu ____________________. Dan diagram orbitalnya, yaitu
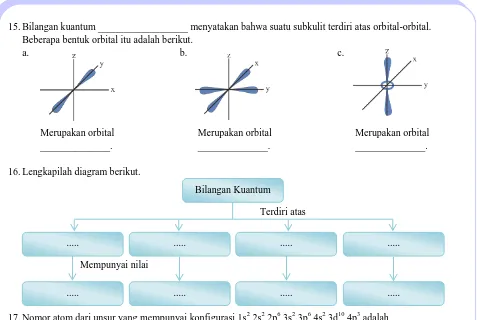
15.Bilangan kuantum __________________ menyatakan bahwa suatu subkulit terdiri atas orbital-orbital. Beberapa bentuk orbital itu adalah berikut.
a.
Merupakan orbital ______________.
b.
Merupakan orbital ______________.
c.
Merupakan orbital ______________.
16.Lengkapilah diagram berikut.
Terdiri atas
Mempunyai nilai
17.Nomor atom dari unsur yang mempunyai konfigurasi 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 adalah _______________.
18.Perpindahan elektron dari tingkat energi rendah ke tingkat energi tinggi dikenal dengan istilah _______________.
19.Tabel periodik unsur disusun berdasarkan kenaikan _______________, yang menunjukkan adanya kemiripan _______________.
20.Golongan unsur utama dalam tabel periodik unsur dapat ditentukan dari jumlah _______________.
21.Besarnya energi yang dilepas atau diserap oleh atom netral dalam bentuk gas pada penangkapan satu elektron untuk membentuk ion negatif disebut _______________.
22.Energi ionisasi 5B lebih _______________ daripada energi ionisasi 4Be.
23.Di antara Na dan Mg, yang lebih reaktif adalah _______________, sedangkan di antara F dan Cl, yang lebih reaktif adalah _______________.
24.Energi ionisasi unsur-unsur alkali tanah dalam tabel periodik unsur dari bawah ke atas makin _______________ karena _______________ makin berkurang.
Bilangan Kuantum
...
...
...
...
...
...
...
–
25.Ukuran kecenderungan suatu atom menarik elektron ke pihanya dalam suatu ikatan disebut _______________.
C. Esai
Jawablah pertanyaan berikut ini dengan jelas dan benar!
1. Jelaskan perbedaan antara model atom yang dikemukakan oleh Dalton, Thomson, Rutherford, dan Niels Bohr!
______________________________________________________________________________________ ______________________________________________________________________________________ 2. Atom unsur Br mempunyai nomor massa 80 dan nomor atom 35.
a. Hitunglah jumlah proton, neutron, dan elektronnya!
__________________________________________________________________________________ __________________________________________________________________________________ b. Tuliskan konfigurasi elektron atom Br!
__________________________________________________________________________________ __________________________________________________________________________________ c. Terletak pada periode dan golongan berapakah atom Br?
__________________________________________________________________________________ __________________________________________________________________________________ d. Bagaimana keelektronegatifan atom Br dibandingkan dengan atom Kr? (Nomor atom Kr = 36)
__________________________________________________________________________________ __________________________________________________________________________________
3. Diketahui suatu atom X bermuatan +3, mempunyai neutron sebanyak 30, dan nomor massanya 56. Tentukan konfigurasi elektron dari ion tersebut!
______________________________________________________________________________________ ______________________________________________________________________________________ 4. Sebuah unsur mempunyai nomor massa 112 dan terdapat 64 neutron di dalam intinya. Tentukan nomor
atom, golongan, periode, dan bilangan kuantum elektron terakhir unsur tersebut!
______________________________________________________________________________________ ______________________________________________________________________________________ 5. Di antara unsur-unsur 3P, 12Q, 19R, 33S, dan 53T, unsur manakah yang terletak dalam golongan sama pada
tabel periodik?
______________________________________________________________________________________ ______________________________________________________________________________________ 6. Apa yang kamu ketahui tentang unsur metaloid? Berikan contohnya!
______________________________________________________________________________________ ______________________________________________________________________________________ 7. Jelaskan secara singkat hubungan antara jari-jari atom dengan jumlah kulit, dan energi ionisasi dengan
keelektronegatifan!
______________________________________________________________________________________ ______________________________________________________________________________________ 8. Afinitas elektron atom klor dan berilium berturut-turut adalah -349 kJ.mol-1. Bila kedua atom tersebut
menerima satu elektron, anion manakah yang lebih stabil? Jelaskan!
9. Dari data energi ionisasi berikut, jelaskan jumlah elektron valensi atom Be! Energi ionisasi Ke-1 Ke-2 Ke-3 Nilai (kJ.mol-1) 899 1,757 14,848
______________________________________________________________________________________ ______________________________________________________________________________________
10.Diketahui atom unusr 3Li, 11Na, 12Mg, 13Al, 19K, 20Ca.
Tuliskan konfigurasi elektron atom-atom tersebut, kemudian urutkanlah energi ionisasi dari yang terkecil, keelektronegatifan dari yang terkecil, dan kereaktifan dari yang paling kurang reaktif!
– A. Konfigurasi Oktet
Kemampuan unsur-unsur membentuk ikatan kimia berkaitan dengan konfigurasi elektron. Setiap unsur cenderung membentuk konfigurasi elektron yang stabil seperti konfigurasi gas mulia (konfigurasi oktet kecuali helium dengan konfigurasi duplet). Konfigurasi oktet artinya elektron-elektron yang mengelilingi suatu atom sebanyak 8 buah, berikut contoh cara unsur-unsur mencapai konfigurasi oktet, yaitu melalui ikatan kimia.
B. Jenis-jenis Ikatan Kimia
Ikatan kimia ada beberapa jenis, yaitu ikatan ion, ikatan kovalen, ikatan kovalen koordinasi, dan ikatan logam. Skema berikut menjelaskan jenis dan konsep pembentukan ikatan kimia.
Contoh ilustrasi
menjelaskan
contoh
Struktur lewis: lambang atom dikelilingi oleh sejumlah elektron valensi yang digambarkan dengan titik atau tanda silang.
Ikatan kimia: ikatan antara atom-atom yang melibatkan elektron valensi, sehingga terbentuk suatu molekul.
Unsur-unsur satu golongan mempunyai elektron valensi yang sama, sehingga memiliki cara yang sama untuk mencapai kestabilan.
Ikatan kimia
Ikatan ion Ikatan kovalen Ikatan kovalen koordinasi
Ikatan logam
Tunggal Rangkap 2 Rangkap 3
Terbentuk melalui serah terima elektron
Terbentuk melalui pemakaian bersama elektron yang berasal dari salah satu atom.
Ion logam yang bermuatan + berada dalam lautan elektron yang bermuatan.
Sifat logam: - Mengkilap
- Menghantarkan listrik dan panas,
- Dapat ditempa, dibengkokkan, dan ditarik
Berdasarkan kepolarannya, ikatan kovalen dapat dibedakan menjadi 2, yaitu ikatan kovalen polar dan ikatan kovalen nonpolar. Perhatikan skema berikut.
C. Penyimpangan Kaidah Oktet
Beberapa senyawa mempunyai struktur Lewis yang menyimpang dari kaidah oktet. Hal ini berarti elektron pada struktur Lewis senyawa tersebut tidak berjumlah delapan.
Selama berikut menunjukkan beberapa senyawa yang struktur Lewisnya menyimpang dari kaidah oktet.
Terbentuk akibat
contoh
NO2 BeCl2 PCl5
Jumlah elektron valensi Jumlah elektron valensi Jumlah elektron valensi
N=7 Be = 4 P = 10
Ikatan kovalen
Kovalen polar
Kovalen nonpolar
Terbentuk dari dua atom nonlogam yang berbeda keelektronegatifannya sehingga elektron tertarik ke arah atom yang lebih elektonegatif.
Terbentuk dari dua atom nonlogam yang sama keelektronegatifanya ataupun senyawa yang berbentuk molekul simetris.
Penyimpangan Kaidah Oktet
Spesies ganjil
Oktet tak lengkap
–
D. Sifat Fisika Senyawa Ion dan Senyawa Kovalen Perhatikan tabel berikut.
Tabel Perbandingan Sifat Fisika Senyawa Ion dengan Senyawa Kovalen
No. Sifat Fisika Senyawa Ion Senyawa Kovalen 1.
2.
3.
Titik lelah dan titik didih Daya hantar lelehan dan larutan terhadap arus listrik Fase pada suhu 25°C 1 atm
Tinggi
Menghantarkan
Padat
Rendah
Tidak menghantarkan
Ada yang padat, cair, dan gas
E. Gaya Antarmolekul
Atom-atom dapat bergabung membentuk ikatan kimia melalui elektron valensinya. Jika dua atom nonlogam yang berbeda keelektronegatifan bergabung, maka pasangan elektron akan tertarik ke arah atom yang elektronegatif. Interaksi antarmolekul yang berikatan kovalen akan menghasilkan gaya antarmolekul. Perhatikan skema berikut.
Semakin kuat gaya antarmolekul, semakin sulit ikatan dalam molekul putus. Akibatnya, titik didih molekul semakin tinggi dan lebih mudah mencair. Untuk senyawa yang mempunyai gaya antarmolekul sama, kekuatan gaya antarmolekul dapat dibandingkan dengan ukuran molekul dan polarisabilitas (penyebaran elektron). Molekul yang mempunyai ukuran molekul lebih besar mempunyai titik didih yang lebih tinggi. Demikian pula molekul yang mempunyai polarisabilitas tinggi juga mempunyai titik didih tinggi.
F. Teori Domain Elektron
Teori domain elektron disebut juga teori VSEPR (Valence Shell Electron Pair Repulsion Theory) terjadi karena adanya gaya tolak-menolak elektron baik elektron yang berkaitan maupun elektron bebas di dalam molekul. Pasangan elektron yang semuanya bermuatan negatif ini akan berusaha saling menjauhi sehingga gaya
Gaya Antarmolekul
Gaya tarik
dipol-dipol
Gaya tarik dipol-dipol terimbas
Gaya tarik dipol-dipol
sesaat
Ikatan hidrogen
Gaya tarik antar 2
molekul polar Disebut juga gaya van der Waals, yaitu gaya tarik yang terbentuk akibat induksi molekul polar (dipol permanen) terhadap molekul nonpolar
Disebut juga gaya London, yaitu gaya tarik yang terbentuk akibat pergerakan elektron dalam molekul nonpolar sehingga mampu menginduksi molekul tetangganya
Terbentuk jika satu molekul yang mempunyai atom H yang terikat pada atom yang sangat
elektronegatif (F, O,N) berikan dengan molekul lain yang mempunyai atom yang sangat elektronegati (F, O, N) dan mempunyai pasangan elektron bebas
C6H12O6 dengan
H2O
O2 dengan H2O
Gaya tarik antar
tolak menolak antarpasangan menjadi minimum. Hubungan antara pasangan (domain) elektron dengan bentuk molekul ditunjukkan oleh tabel berikut.
Tabel hubungan pasangan elektron dengan bentuk molekul.
Jumlah Pasangan Elektron PEI PEB Notasi VSEPR Bentuk Molekul 2 3 4 5 6 2 3 4 3 2 5 4 3 2 6 5 4 0 0 0 1 2 0 1 2 3 0 1 2 AX2 AX3 AX4
AX3E
AX2E2
AX5
AX4E
AX3E2
AX2E3
AX6
AX5
AX4E2
Linier
Segitiga sama sisi Tetrahedral Piramida trigonal Pl⌠n⌠r ‘V”
Bipiramida trigonal Bidang empat Planar ‘T’ Linier Oktahedral
Piramida segi empat Segi empat planar
A. Pilihan Ganda
Pilihlah jawaban yang paling tepat! KAIDAH OKTET
1.
Senyawa berikut yang mengikuti aturan oktet adalah ....
A. BeCl2 B. BF3 C. PCl5 D. NH3 E. BH3 2.
+ →
Atom-atom tersebut bergabung untuk membentuk konfigurasi oktet. Banyaknya pasangan elektron bebas pada atom pusat dalam senyawa PCl3 adalah .... A. 0 B. 1 C. 2 D. 3 E. 4 3.
Senyawa berikut megikuti aturan oktet, kecuali ....
A. CHCl3 B. NH
C. H2O D. CH4 E. PCl5
4. Dari kelompok senyawa berikut yang tidak mematuhi aturan oktet adalah ....
A. NH3, PH3, dan SO3 B. H2O, CH2Cl2, dan CO2 C. BF3, SF4, dan ICI3 D. HOCl, Cl2CO, dan N2H4 E. NO2
-, SO3
2-, dan SCN -IKATAN ION
5. Perhatikan tabel berikut!
Atom A B C D Nomor Atom 6 8 17 19 Pasangan unsur-unsur yang dapat membentuk ikatan ion adalah ....
A. A dan C B. A dan B C. C dan D D. B dan C E. B dan D 6.
Ikatan ion dapat terjadi antara atom-atom usnur ....
A. P dan Q B. Q dan R C. R dan S D. P dan T E. S dan T
9F 15P 7B
15P 15P
–
7. Ikatan ion terdapat pada pasangan atom unsur .... A. 3A dan 9C
B. 9C dan 19E C. 4B dan 16D D. 16D dan 9C E. 3A dan 4B
8. Diketahui unsur-unsur: 10A, 11B, 17C, 18D. Ikatan ion yang mungkin dihasilkan adalah pasangan dari unsur-unsur ....
A. A dan B B. A dan C C. C dan D D. B dan D E. B dan C
9. Data konfigurasi elektron atom-atom suatu unsur adalah sebagai berikut.
Unsur Konfigurasi Elektron P
Q R S X
2 7 2 8 2 2 8 6 2 8 8 2 2 8 7
Unsur-unsur yang dapat membentuk ikatan ion dengan unsur X adalah ....
A. P dan Q B. Q dan R C. R dan S D. S dan P E. Q dan S
10.Senyawa berikut yang dapat membentuk ikatan ion dalam molekulnya adalah ....
A. H2O B. CH3OH C. HF D. KBr E. H2SO4
11.Senyawa yang mempunyai ikatan ion adalah .... A. H2O
B. NH3 C. HF D. Na2S E. PCl3
12.Kelompok senyawa berikut yang ketiganya berikatan ion adalah ....
A. HCl, NaCl, MgCl2 B. NaCl, MgCl2, FeCl3 C. HCl, H2O, CH4 D. CH4, H2S, HCl E. HBr, KBr, CH4
13.Senyawa yang mengandung ikatan ion dalam molekulnya adalah ....
Nama Senyawa Rumus Kimia
A. B. C. D. E. Metanol Dietil eter Asam asetat Natrium asetat Butana
CH3OH
CH3CH2OCH2CH3
CH3COOH
CH3COONa
CH3CH2CH2CH2
IKATAN KOVALEN
14.Ikatan kovalen merupakan ikatan .... I. Antaratom elektronegatif II. Antaratom elektropositif
III. Dengan penggunaan bersama pasangan elektron
IV. Antaratom elektronegatif dengan atom elektropositif
pernyataan tersebut yang benar adalah .... A. I dan II
B. I dan III C. II dan III D. II dan IV E. III dan IV
15.Pasangan unsur yang dapat membentuk ikatan kovalen adalah ....
A. 17Q 11Y B. 12P 17Q C. 6R 17Q D. 20M 16T E. 19A 25B
16.Pasangan senyawa berikut yang mempunyai ikatan kovalen adalah ....
A. KCL dan HCl B. H2S dan Na2S C. PCl3 dan FeCl3 D. CH4 dan NH3 E. H2O dan Na2O
17.Deretan senyawa berikut ini tergolong senyawa kovalen, kecuali ....
A. HF, HCl, HI B. BH3, BF3, CO2 C. H2O, NH3, CO2 D. Na2O, CaS, H2O E. IF5, CCl4, CF3
18.I. II. III. IV.
Di antara senyawa-senyawa di atas, yang mempunyai ikatan kovalen adalah .... A. I dan II
19.Perhatikan pasangan kelompok senyawa berikut! 1. Na2O dengan HCl
2. PH3 dengan HBr 3. NH2 denan H2S 4. KF dengan H2O 5. NH3 dengan NaF
Kelompok senyawa yang mempunyai ikatan kovalen adalah ....
A. 1 dan 2 B. 2 dan 3 C. 3 dan 4 D. 4 dan 5 E. 5 dan 1
IKATAN KOVALEN KOORDINASI
20.Struktur Lewis senyawa klorida adalah sebagai berikut.
Ikatan kovalen koordinasi ditunjukkan oleh nomor ....
A. 1 B. 2 C. 3 D. 4 E. 5 21.
No. Pasangan Senyawa 1.
2. 3. 4. 5.
NH4 dengan NH3BF3
H2O denan HCl
HF dengan H2O
NH3 dengan HBr
NH3 denan H2S
Kelompok senyawa yang mempunyai ikatan kovalen koordinasi adalah ....
A. 1 B. 2 C. 3 D. 1 dan 3 E. 3 dan 4
KEPOLARAN IKATAN KOVALEN 22.Di antara senyawa berikut, yang mempunyai
ikatan kovalen-kovalen paling polar adalah .... A. CO2
B. NH3 C. CCl4 D. H2O E. BF3
23.Di antara senyawa-senyawa berikut yang bukan molekul kovalen polar adalah ....
A. HCl B. NaCl C. NH3 D. H2O E. PCl3
24.Pasangan unsur yang dapat membentuk ikatan kovalen nonpolar adalah ....
A. 6M dan 19R B. 11N dan 19R C. 11N dan 17Q D. 6M dan 17Q E. 17Q dan 19R
25.Diketahui senyawa berikut. (1) H2O (l)
(2) NH4Cl (aq) (3) CH4 (g) (4) CO2 (l) (5) BF3 (g)
(Nomor atom H = 1, B = 5, C = 6, N = 7, Cl = 17) Kelompok senyawa yang bersifat nonpolar adalah ....
A. 1, 2, 3 B. 1, 3, 4 C. 1, 4, 5 D. 2, 3, 5 E. 3, 4, 5 IKATAN LOGAM
26.Kekuatan ikatan logam bergantung pada .... A. Energi ionisasi
B. Jari-jari atom
C. Banyaknya elektron valensi D. Tingkat elektronegativitas E. Besarnya afinitas elektron
27.Ikatan logam sangat berhubungan dengan salah satu sifat logam, kecuali ....
A. Permukaan mengilap B. Penghantar panas yang baik C. Titik didih tinggi
D. Semikonduktor E. Titik leleh tinggi
MEMPREDIKSI RUMUS MOLEKUL DAN JENIS IKATAN
28.Pada molekul CO2 terdapat ikatan .... (nomor atom C = 6, O = 8)
A. Ionik B. Kovalen
C. Kovalen rangkap 2 D. Kovalen rangkap 3 E. Kovalen koordinasi
–
K L M
A. B. C. D. E. 2 2 2 2 2 8 8 8 8 4 2 4 6 8 30.
Unsur Konfigurasi
K L M N
X 2 8 8 2
Y 2 7
Bila unsur X dan Y membentuk senyawa, maka rumus molekul yang mungkin adalah .... A. X2Y
B. XY2 C. X2Y2 D. X3Y2 E. XY 31.
Unsur Konfigurasi
K L M N
X 2 8 8 2
Y 2 7
Jika unsur X dan Y membentuk molekul, maka molekul yang terbentuk mempunyai ikatan .... A. Kovalen polar
B. Kovalen nonpolar C. Kovalen koordinasi D. Elektrovalen E. Logam 32.
Unsur Konfigurasi
K L M N
X 2 8 8 2
Pernyataan yang benar mengenai unsur X, kecuali ....
A. X dapat membentuk ikatan ion dengan atom F
B. X dapat membentuk senyawa XCl2 C. X dapat membentuk ion X2+
D. Oksidasinya dapat membentuk rumus XO E. Unsur tersebut termasuk golongan alkali 33.
Unsur Konfigurasi
K L M
X 2 8 8
Senyawa klorida dari unsur X mempunyai rumus ....
A. XCl B. XCl2 C. XCl3 D. XCl4
E. XCl5 34.
Unsur Konfigurasi
K L M
X 2 8 8
Unsur X dapat bereaksi dengan unsur Y yang terletak di golongan oksigen membentuk senyawa ....
A. XY B. X2Y C. X2Y2 D. X3Y E. XY2
35.Ion M2+ mempunyai konfigurasi elektron: 2 8 8. Oleh karena itu, unsur M ....
A. Dalam inti atomnya terdapat 18 proton B. Dalam sistem periodik terletak pada periode
ke-4
C. Dapat membentuk oksida dengan rumus MO2
D. Berikatan kovalen dengan atom Cl
36.Unsur X yang termasuk golongan oksigen tidak dapat membentuk senyawa atau ion ....
A. X 2-B. H2X C. XO4 2-D. XH3 E. ZnX
37.Pernyataan yang salah untuk suatu unsur dengan
struktur atom di samping adalah ....
A. Bilangan oksidasi tertinggi +2 B. Nomor atomnya 30
C. Oksidasinya mempunyai rumus XO D. Dengan atom klor membentuk ikatan
kovalen
E. Unsur tersebut bersifat logam
38.Suatu logam dengan lambang M terletak pada gologan IIIA. Rumus molekul yang dapat dibentuk oleh atom unsur M adalah .... A. MO
B. MO2 C. M2O3 D. MSO4 E. M2CO3
A. XY B. X2Y C. XY2 D. XY3 E. XY4
40.Ikatan antara atom karbon dengan atom hidrogen dalam molekul normal pentana, C5H12, adalah .... A. Ikatan kovalen
B. Ikatan polar C. Ikatan elektrovalen D. Ikatan kovalen E. Ikatan hidrogen
41.Unsur A yang bernomor atom 13 bersenyawa dengan unsur B yang bernomor atom 17. Rumus molekul dan ikatan yang terbentuk adalah ....
Rumus Molekul Ikatan Kimia A. B. C. D. E. AB AB3 AB A3B3
A3B
Kovalen Ionik Ionik Kovalen ionik
42.Sebuah atom X mempunyai konfigurasi elektron sebagai berikut: 2 8 7. Jika unsur tersebut membentuk hibrida, maka senyawa yang akan terbentuk adalah ....
Jenis Seenyawa Rumus A. B. C. D. E. Ionik Ionik Kovalen Kovalen Kovalen XH2 XH XH2 XH XH3 GAYA ANTARMOLEKUL
43.Gaya van der Waals terbentuk dari .... A. Interaksi ion + dan ion –
B. Interaksi 2 molekul polar
C. Interaksi antara molekul polar dan nonpolar D. Interaksi 2 molekul nonpolar
E. Interaksi 2 molekul yang berbeda ukuran molekulnya
44.Distribusi elektron dalam suatu molekul dinyatakan sebagai ....
A. Keelektronegatifan B. Polarisabilitas C. Gaya antarmolekul D. Derajat ionisasi E. Antaraksi molekul
45.Senyawa yang tidak dapat mengadakan ikatan hidrogen antarsesama molekulnya adalah .... I. Etanol
II. Dimetil eter III. Asam metanoat
IV. Butil aldehid A. I dan II B. I dan III C. I dan IV D. II dan III E. II dan IV
46.Molekul nonpolar yang mempunyai Mr lebih besar akan mempunyai . . . lebih besar. Kata yang tepat untuk melengkapi kalimat tersebut adalah ....
A. Ikatan ionik B. Ikatan hidrogen C. Gaya van der Walls D. Gaya London E. Gaya dipol-dipol
47.Peristiwa gas nitrogen dapat dicairkan merupakan pengaruh dari ....
A. Ikatan ionik B. Ikatan hidrogen C. Gaya van der Walls D. Gaya dipol-dipol E. Gaya London
48.Unsur 7X dapat membentuk senyawa X2 dan memiliki gaya antarmolekul ....
A. Dipol-dipol B. Van der Waals C. London D. Ikatan ionik E. Ikatan hidrogen
49.Bila suatu garam laut dalam air dan mengalami ionisasi maka interaksi antara pelarut dan zat terlarut adalah ....
A. Ikatan hidrogen B. Gaya/interaksi ion-ion C. Interaksi dipol-dipol D. Gaya dispersi London E. Interaksi ion-dipol
PENGARUH IKATAN KIMIA DAN GAYA ANTARMOLEKUL
50.Urutan titik didih n-pentana, isopentana, dan neopetana adalah ....
–
51.Di antara unsur gas mulia, unsur xenon memliki titik didih tertinggi karena ....
A. Dapat membentuk ikatan dipol-dipol B. Dapat membentuk ikatan hidrogen
C. Mempunyai gaya antarmolekul paling besar D. Mempunyai kemampuan terpolarisasi paling
besar
E. Mempunyai ukuran molekul paling besar 52.Pernyataan berikut yang tidak benar adalah ....
A. Jika gaya antarmolekul A > B, maka titik didih A > B
B. Jika gaya antarmolekul A = B, maka titik beku A = B
C. Jika gaya antarmolekul A > B, maka titik beku A > B
D. Jika gaya antarmolekul A = B dan ukuran molekul A > B, maka titik didih A < B E. Jika molekul A membentuk ikatan hidrogen
sedangkan molekul B membentuk ikatan dipol-dipol, maka titik didih A > B 53.Titik didih H2S lebih besar daripada O2. Hal ini
disebabkan ....
A. Ukuran molekul H2S lebih besar daripada O2 B. H2S mempunyai gaya dipol-dipol sesaat,
sedangkan O2 mempunyai gaya dipol-dipol terimbas
C. H2S mempunyai gaya van der Waals, sedangkan O2 mempunyai gaya London D. H2S dapat membentuk ikatan hidrogen,
sedangkan O2 tidak
E. H2S termasuk molekul diatomik, sedangkan O2 termasuk molekul monoatomik
54.54Xe, 8O. Banyaknya pasangan elektron bebas (PEB) dalam molekul XeO4 adalah .... A. 1
B. 0 C. 3 D. 2 E. 4
55.Bentuk linier dimiliki oleh molekul ....
A. CCl4 B. NH3 C. SCl4
D. H2O E. XeF2
56.Diketahui nomor atom S = 16 dan O = 8, maka senyawa SO3 mempunyai notasi VSEPR .... A. AX2
B. AX4 C. AX2E D. AX3 E. AXE2
57.Notasi VSEPR untuk molekul PCl3 adalah .... (nomor atom P = 15, Cl = 17)
A. AX3 B. AX2E C. AXE2 D. AXE3 E. AX3E
58.Sebuah molekul mempunyai 3 pasangan elektron (PEI) dan 1 pasangan elektron bebas (PEB), maka bentuk geometri molekul adalah ....
A. Tetrahedral B. Planar V C. Linier
D. Piramida trigonal E. Bidang empat
59.Jika nomor atom B = 5 dan F = 9, maka senyawa BF3 mempunyai bentuk geometri molekul .... A. Linier
B. Tetrahedral C. Bidang empat D. Segitiga sama sisi E. Piramida trigonal
60.Perhatikan struktur molekul berikut.
H H O H
| | | | |
H – C1 – C2 – C3 – C4 – C5 = N
| | |
H H H
Hibridas atom C2, O, dan N berturut-turut adalah ....
A. sp2, sp2, sp3 B. sp3, sp3, sp3 C. sp3, sp2, sp D. sp, sp2, sp3 E. sp2, sp2, sp2
B. Isian
Lengkapilah pernyataan berikut ini dengan benar!
3. Ikatan __________________ terbentuk melalui pemakaian bersama elektron yang berasal dari salah satu atom.
4. Ikatan __________________ terbentuk dari unsur logam dengan nonlogam, sedangkan ikatan __________________ terbentuk dari unsur nonlogam dengan nonlogam.
5. Ikatan antaratom C merupakan ikatan __________________.
6. Jika terdapat pemakaian bersama 2 pasang elektron, maka ikatan yang terbentuk adalah __________________.
7. Proses pembentukan ikatan ion menggunakan simbol Lewis adalah sebagai berikut.
8. Jika A + : B → A : B, maka senyawa yang terbentuk mempunyai ikatan __________________. 9. Ikatan kovalen polar terbentuk karena adanya perbedaan __________________.
10. Tentukan senyawa pada skema berikut termasuk polar/nonpolar!
= ....
= ....
= ....
= ....
11. Daya hantar listrik lelhan senyawa kovalen lebih __________________ daripada lelehan senyawa ion. 12. Ion logam yang bermuatan positif berada dalam lautan elektron yang bermuatan negatif merupakan ilustrasi
dari ikatan __________________. 13. Lengkapilah tabel berikut!
a. Tuliskan rumus molekul senyawa yang terbentuk bila atom 20X berikatan dengan ion-ion yang terdapat pada tabel berikut!
Atom 20X Rumus Molekul
Ion Cl- Ion NO3- Ion SO42- Ion PO4
3-.... .... .... ....
b. Tuliskan tumus molekul senyawa yang terbentuk dari reaksi kimia berikut dan prediksikan jenis ikatan yang terbentuk!
Reaksi antara Golongan IIA (X) dengan Ion Rumus Molekul X + S- → ... X + SO42- → ... X + NO3- → ...
Jenis Ikatan yang Terbentuk .... .... .... Senyawa
Metana
Metil halida
CH4
CH3Cl
CH2Cl2
–
14. Bentuk molekul berdasarkan jumlah pasangan elektronnya adalah sebagai berikut. No. Jumlah Pasangan
Elektron
Jumlah Pasangan Ikatan (PEI)
Jumlah Pasangan Bebas (PEB)
Rumus Domain Elektron
Bentuk Molekul a.
b. c. d. e. f. g. h. i. j.
2 3 ... ... ... ... ... ... 6 ...
2 3 2 ... 2 ... ... 2 ... 6
0 ... 1 ... 2 ... ... 3 1 0
... ... ... AX4
... AX5
AX3E2
... ... ...
... ... Segitiga siku
... ... ... Planar T
... ... ...
15. Dipol terimbas merupakan dipol yang bersifat ____________________________________ akibat pengaruh molekul yang bersifat __________________.
C. Esai
Jawablah pertanyaan berikut ini dengan jelas dan benar!
1. Tunjukkan dan jelaskan ikatan kimia yang terbentuk dalam molekul senyawa amonium klorida NH4Cl! ______________________________________________________________________________________ ______________________________________________________________________________________ 2. Dapatkan senyawa BCl3 berpasangan dengan molekul NH3? Ikatan kimia apa saja yang mungkin terbentuk
dalam molekul baru?
______________________________________________________________________________________ ______________________________________________________________________________________ 3. Diketahui 17Y, 9Z. Bila atom dapat berikatan, baik dengan atom Y maupun atom Z, jelaskan ikatan dan
rumus molekul dari senyawa yang terbentuk!
_____________________________________________________________________ Konfigurasi atom X
_____________________________________________________________________
4. Mengapa dalam molekul BeCl2, ikatan antara atom Be dengan atom Cl adalah ikatan kovalen, padahal Be adalah golongan IIA?
______________________________________________________________________________________ ______________________________________________________________________________________ 5. Dari fakta di bawah ini, bagaimana kekuatan ikatan kovalen molekul HCl dibandingkan dengan molekul
H2O?
6. Jelaskan alasan NaCl larut dalam air, tetapi tidak larut dalam pelarut CCl4!
______________________________________________________________________________________ ______________________________________________________________________________________ 7. Bagaimana urutan sifat ionik pada ikatan antara atom H dengan atom-atom halogen pada molekul asam
halida dari yang terlemah?
______________________________________________________________________________________ ______________________________________________________________________________________ 8.
Atom P Q R S T
Nomor Atom 11 15 17 19 20
Tentukan pasangan atom yang akan membentuk senyawa dengan: a. Ikatan ion,
__________________________________________________________________________________ b. Ikatan kovalen,
__________________________________________________________________________________ 9. Suatu senyawa ionik mempunyai rumus molekul X2O. Bila atom X berada dala bentuk senyawa fosfat,
coba tuliskan rumus molekulnya!
______________________________________________________________________________________ ______________________________________________________________________________________
10. Di antara molekul berikut, manakah yang ikatan kovalennya lebih polar? Berikan pula alasannya!
a. dan
NH3 H2O
__________________________________________________________________________________ b. CH3Cl dan CHCl3 ____________________________________________________________
____________________________________________________________ c. H2O dan H2S ____________________________________________________________ ____________________________________________________________ 11. Urutkan kenaikan titik didih dari senyawa di bawah ini!
O2, NH3, C3H8, HCl
______________________________________________________________________________________ ______________________________________________________________________________________ 12. Jelaskan yang dimaksud:
a. Pasangan elektron ikatan (PEI)
__________________________________________________________________________________ b. Pasangan elektron bebas (PEB)
__________________________________________________________________________________ c. Ikatan hidrogen
__________________________________________________________________________________ d. Gaya dispersi/gaya London
__________________________________________________________________________________ 13. Jelaskan tentang teori domain elektron dan hubungannya dengan geometri molekul!
–
14. Nomor atom Xe = 54 dan F = 9. Tentukan pasangan elektron ikatan (PEI), pasangan elektron bebas (PEB), no