LAPORAN PRAKTIKUM KIMIA FISIKA I
Judul :Penentuan Tetapan Pengionan Secara Spektrofotometri. Disusun oleh:
Nama :Alpius Suriadi
NIM :H13112020
Dosen : Berlian Sitorus S.Si., M.Si / Intan SyahbanuS.Si., M.si Nama asisten : Sefunny dan Eka Supriatin
Hari/Tanggal :Jumat, 24 Oktober 2013 Kelompok : 6 (Enam)
Anggota : 1. Ayu fitri
2. Erika juniar sianipar 3. Hesti asparingga 4. Indri puspa ningrum 5. Muhardi
6. Nurhayatun nafsiah 7. Rudi gunawan
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS TANJUNGPURA
ABSTRAK
PENENTUAN TETAPAN PENGIONAN SECARA SPEKTROFOMETRI
Penentuan Tetapan Pengionan Secara Spektrofotometri adalah suatu metode analisis kimia dengan mengukur panjang gelombang dan mengukur besar nilai absorbansi (serapan) berdasarkan tingkatan konsentrasi larutan yang uji dengan cara spektrofotometri. Tujuan dilakukan percobaan ini yaitu untuk menentukan tetapan pengionan pada metil merah dengan cara melakukan variasi konsentrasi pada larutan asam (HCl) dan basa (NaOH) yang telah di tambah dengan metil merah. Larutan dimasukan dalam kuvet selanjutnya di analisis dengan cara spektrofotometri menggunakan alat spektrofotometer dan dicari hubungan antara panjang gelombakang dengan besar adsorbansinya dan juga konsentrasi dari larutan tersebut. Variasi konsentrasi akan mempengaruhi tingkat absorbansinya. Setelah dianalisis dari data yang diperoleh dibuat grafik hubungan antara konsetrasi dan absorbansi dan kemudian akan diperoleh tetapan pengionan sebesar (Ka = 4,66x10-3)
Kata kunci : spektrofotometri, absorbansi, metil merah dan pengionan.
ABSTRACT
DETERMINATION IONIZATION CONSTANTS SPECTROPHOTOMETRICALLY
In Spectrophotometric determination of ionization constants is a chemical analysis method to measure the wavelength and measuring the value of the absorbance (absorption) by level of concentration of the test solution by spectrophotometry. The purpose of this experiment is to determine the ionization constant of methyl red by way of variation of the concentration of the acid solution (HCl) and base (NaOH) which has been added with methyl red. Included in the solution in the cuvette subsequent analysis by spectrophotometry using a spectrophotometer and the relationship between long-sought gelombakang with big adsorbansinya and also the concentration of the solution. Variations in the concentration will affect the absorbance. After analysis of the data obtained graphed the relationship between concentration and absorbance, and then will be obtained by ionization constant(Ka=4.66x10-3)
BAB I PENDAHULUAN
1.1 Latar Belakang
Perkembangan ilmu pengetahuan dan teknologi dewasa ini berdampak pada makin meningkatnya pengetahuan serta kemampuan manusia. Betapatidak setiap manusia lebih dituntut dam diarahkan kearah lmu pengetahuan disegala bidang. Tidak ketinggalan pula ilmu kimia yang identik dengan ilmu mikropun tidak luput dari sorotan perkembangan iptek. Salah satu dari bentuk kemajuan ini adalah alat yang disebut denganSpektrometri Serapan Atom (SSA).
Analisis Spektroskopi didasarkan pada interaksi radiasi dengan spesies kimia. Berprinsip pada penggunaan cahaya/tenaga magnet atau listrik untuk mempengaruhi senyawa kimia sehingga menimbulkan tanggapan. Spektroskopi adalah ilmu yang mempelajari materi dan atributnya berdasarkan cahaya, suara atau partikel yang dipancarkan, diserap atau dipantulkan oleh materi tersebut. Spektroskopi umumnya digunakan dalam kimia fisik dan kimia analisis untuk mengidentifikasi suatu substansi melalui spektrum yang dipancarkan atau yang diserap. Alat untuk merekam spektrum disebut spektrometer.
1.2 Tujuan Percobaan
Menentukan tetapan pengionan indikator metil merah secara spektrofotometri 1.3 Prinsip Percobaan
Penentuan tetapan pengionan indikator metil merah secara spektrofotometri dilakukan dengan mengubah suasana larutan HCl dan NaOH, dengan menambahkan larutan standar dan di ukur absorbansinya. Pada larutan HCl metil merah berupa I, disingkat HMR yang berwarna merah dan mempunyai dua bentuk resonansi. Ketika ditambahkan laruta NaOH , sebuah proton akan hilang dan terjadi II, anion MR yang berwarna kuning. Keadaan kesetimbangan antara kedua metil merah yang berlainan warna :
I ↔ II
Bentuk asam – HMR(merah) Bentuk basa MR- (kuning) Reaksi pengionan metil merah : HMR ↔ H+ + MR-
TINJAUAN PUSTAKA 2.1 Spektrofotometri
Spektrofotometri adalah suatu metode analisa kimia yang pada dasarnya merupakan perbandingan intensitas warna suatu larutan dengan larutan standar. Metode ini juga merupakan bagian dari analisa fotometri. Disamping itu, dikenal juga tetapan metode analisa kalorimetri yang lain, diantaranya adalah analisa turbidimetri, nefolometri dan fluoresensi (sudjadi,1985)
Analisa kalorimetri adalah variasi nama suatu sistem dengan berubahnya konsentrasi suatu komponen warna itu biasanya disebabkan oleh pembentukan suatu senyawa berwarna dengan ditambahkannya reagensia yang tepat atau warna kemudian dapat dikembangkan dengan yang diperoleh, dengan menangani kuantitor yang diketahui dari zat itu dengan cara yang sama (Basset, dkk, 1994).
2.2 Hukum Lambert-Beer
Hukum labert-beer menyatakan bahwa fraksi penyerapan sinar tidak tergantung dari intensitas sumber cahaya. Hukum beer menyatakan bahwa penyerapan sebanding dengan jumlah molekul yang menyerap. Hukum Lambert-Beer, dapat diketahui hubungannya antara trasmitasi, tebal cuplikan/media, dan konsentrasi.
Hubugan ini dapat dinyatakan dengan persamaan berikut ( Triyati, 1985). Log LoI = k . c. B = A .
keteranga; Io = intensitas sianar awal; I = intensitas sinar yang diteruskan K = terapan karateristik dan terlarut; C= konsetrasi; b = tebal sel; A= serapan. 2.3 Spektrum pancar
Absorpsi energi direkam sebagai absorban. Adsorpsi pada suatu panjang gelombang tertentu didefinisikan sebagai (keenan, 1990).
A = log Io/I. Dimana A adalah absorpsi, Io merupakan intensitas cahaya rujukan dan I adalah intensitas berkas cahaya.
2.4 Tetapan pengionan metil merah
Metil merah ditemukan sebagai zwitter ion dalam air. Senyawa ini berupa I dalam suasana asam disingkat HMR. HMR pada kondisi ini berwarna merah dan mempunyai dua bentuk resonansi (Basset, 1994).
Apabila keduanya ditambahkan basa, sebuah ion akan hilang, anion MR -yang berwarna kuning -yang ditunjukan dengan reaksi sebagai berikut (keenan, 1990). HMR ↔ H+ + MR
(Merah) (Kuning) 2.5 Zwitter Ion
Zwitter ion adalah senyawa yang memiliki sekaligus gugus bersifat asam dan basa contonya metil merah. Pada PH netral zwitter ion akan bermutan positif (kation) maupun bermuatan negatif (anion). Biasanya ion mudah larut dalam air karena bermuatan (air adalah pelarut polar dan sukar larut dalam pelarut non polar) (sastrohamidjojo, 2001).
Zwitter ion merupakan molekul yang memiliki dua muatan (positif dan negatif) sekaligus pada protein gugus hidroksilnya cendrung membentuk ion negatif, sedangkan pada gugus aminanya akan membentuk ion positif (Sudjadi, 1985).
3.3 Analisa bahan 3.3.1 Akuades (H2O)
Akuades merupakan larutan tidak berwarna, titik didih 1000c, titik leleh 00. Akuades merupakan pelarut yang sangat baik, konstanta dielektriknya paling tinggi, netral, komposisi kalornya lebih tinggi dibandingkan cairan lain. Temperatur stabil pada titik beku, serta melarutakan banyak elektrolit dan daerah kestabilan redoksnya sangat luas (kusuma, 1983).
3.3.2 Asam asetat ( CH3COOH)
besar gas CH3COOH gampang larut dalam air. Asam asetat memiliki titik beku 16,60C dan titik didih -118,10C (Arsyad, 2001).
3.3.3 Asam klorida (HCl)
Asam klorida memiliki titik leleh -114,8 0C, titik didih -850C, berat jenis 7,05 gr/cm3, dan berat gas uap 1,268, HCl adalah gas tidak berwarna, berbau merangsang, berbahaya bila kontak mata dan kulit atau terhirup. Larutan asam banyak di gunakan dalam laboratorium, industri logam sebagai pelarut dan penetralisasi (Rivai, 1994).
3.3.4 Etanol (C2H5OH)
Etanol adalah senyawa dengan formula (C2H5OH). Etanol berwujud cair, tidak berwarna, larut dicampir dalam air, eter, kloroform dan aseton. Etanol digunakan sebagai bahan bakar dan pelarut organik, produk yang komersial mengandung sekitar 95,96% etanol (Basri, 2003).
3.3.5 Metil merah (C15H15N3O2)
Metil merah merupakan senyawa organik berupa serbuk merah gelap digunakan sebagai indikator asam – basa. Metil merah akan mengalami perubahan warna pada rentang PH 4 – 6,0. Metil merah menpunyai kisaran PH < 4,4 berwarna merah dan pada PH > 6 berwarna kuning (Arsyad, 2001).
3.3.6 Natrium asetat (CH3COONa)
Natrium asetat merupakan senyawa dengan rumus formula (CH3COONa). Natrium asetat adalah senyawa kristalin tanpa warna, terdapat dalam bentuk hidrat atau terhidrat . Larut dalam air dan etuksi etuna. Asam asetat digunakan dalam buffer untuk mengendalikan PH (Daintith, 1994).
3.3.7 Natrium hidroksida (NaOH)
Natrium hidroksida berbentuk padat, berwarna putih, bersifat lembab dan secara spontan menyerap CO2 dari udara bebas. NaOH larut dalam air dan etanol, tetapi tidak larut dalam eter. Larutan natrium hidroksida sangat korosif terhadap tubuh dan membahayakan mata (Daintith, 1994).
3.1 Alat
Alat-alat yang di gunakan dalam percobaan ini adalah ball pipet, botol sampel 250 ml,corong kaca, erlenmeyer 50 ml, kertas saring, labu ukur 100 ml, pipet ukur 5 ml, 10 ml, pipet volume 10 ml, 25 ml dan spektrofotometri (spectronic-20).
3.2 Bahan
Bahan-bahan yang di gunakan dalam percobaan ini antara lain; akuades (H2O), asam asetat (CH3COOH), asam klorida (HCl), etanol (C2H5OH), metil merah (C15H15N3O2), natrium asetat (CH3COONa) dan natrium hidroksida (NaOH).
3.3 Prosedur kerja
3.3.1 Pembuatan larutan baku metil merah
Diambil sebanyak 0,5 gram Etanol 95% sebanyak 300 mL Diencerkan
Akuades
Ditepatkan hingga 500 mL
3.3.2 Pembuatan larutan standar metil merah
Dimasukan kedalam labu ukur 100 mL Larutan persediaan sebanyak 10 mL
Akuades
Ditepatkan kedalam labu ukur 100 Ml
3.3.3 Pembuatan spektrum absorbansi HMR- dan MR+ METIL MERAH KRISTAL
LARUTAN BAKU METIL MERAH
ETANOL 50 mL
Dipipet sebanyak 5 mL
Diambil 10 ml dan dimasukkan kedalam labu ukur 100 ml
Ditambah 5 ml indikator metil merah konsentrasi 0,04 M; 0,02 M; 0,01 M; 0,005 M
Diambil 25 ml dan dimasukkan kedalam labu ukur 100 ml
Ditambah 10 ml indikator metil merah
Prosedur kerja CH3COOH + HMR + CH3COONa
Ditentukan absorbansinya pada panjang gelombang 400–5500 nM
Digunakan akuades sebagai pembanding
Dibuat kurva A terhadap λ
Dipilih λ1 dan λ2 yang sesuai untuk menganalisi campuran bentuk asam dan basa
3.3.4 Pengujian Hukum Lambert - Beer LARUTAN ASAM - BASA
MR
CH3COOH dengan berbagai konsentrasi 0,1 M; 0,05
Diambil 50 ml dan dimasukkan kedalam
Ditambah 25 ml CH3COONa 0,04 M
Ditambah 5 ml indikator metil merah
Ditepatkan dengan akuades
Diencerkan dengan 0,1 N HCl dan 0,1 N HCl dan 0,1 N NaOH
(Pengenceran 2x, 4x, 8x)
Ditentukan harga indeks absorbansinya pada λ1 dan λ2 Diamati nilai λ1 dan λ2
3.3.5 Penentuan Tetapan Kesetimbangan ionisasi
Dipipet sebanyak 5 mL
Ditambahkan larutan CH3COOH 0,04 M sebanyak 25 mL H2O Ditepatkan hingga tanda batas
Dibagi menjadi 3 larutan
CH3COOH 0,01 M CH3COOH 0,05 M CH3COOH 0,1 M
3.4 Rangkaian Alat
METIL MERAH ASAM DAN BASA
HASIL
LARUTAN STANDAR METIL MERAH
LARUTAN 1 LARUTAN 2 LARUTAN 3
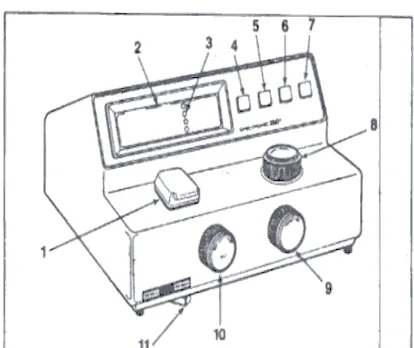
Gambar 3.4.1 spektrofotometri
Keterangan gambar:
1. Tempat kuvet
2. Display digital
3. mode indikator
4. Mode pilihan
5. Tombol pengurangan
Gambar 3.4.2 Bagian dalam spektrofotometer
BAB IV
6. Tombol untuk scaning
7. Tombol untuk mencetak
8. pengatur panjang gelombang
9. pengatur transmitan/absorbansi
10. Tombol power/ pengator nol
11. pengatur filter
Keterangan gambar:
Gambar bagian dalam
spektrofotometer, tempat meletakan kuvet yang akan di tembak dengan sinar kromatis untuk mengukur
HASIL DAN PEMBAHASAN 4.1 Hasil pengamatan
4.1.1 Besar absorbansi HCl dan NaOH dengan rentang panjang gelombang 400- 600
panjang gelombang A HCl A NaOH
580 0,897 0,012
manusia peka, gelombang dengan panjang berlainan akan menimbulkan cahaya yang berlainan sedangkan campuran cahaya dengan panjang ini akan menyusun cahaya putih. Cahaya putih meliputi seluruh spektrum nampak 400-760 mm Spektrofotometri ini hanya terjadi bila terjadi perpindahan elektron dari tingkat energi yang rendah ke tingkat energi yang lebih tinggi. Perpindahan elektron tidak diikuti oleh perubahan arah spin, hal ini dikenal dengan sebutan tereksitasi singlet. Keuntungan utama pemilihan metode spektrofotometri bahwa metode ini memberikan metode sangat sederhana untuk menetapkan kuantitas zat yang sangat kecil. Spektrofotometri menyiratkan pengukuran jauhnya penyerapan energi cahaya oleh suatu sistem kimia itu sebagai suatu fungsi dari panjang gelombang radiasi, demikian pula pengukuran penyerapan yang menyendiri pada suatu panjang gelombang tertentu Dalam analisis spektrofotometri digunakan suatu sumber radiasi yang menjorok ke dalam daerah ultraviolet spektrum itu. Dari spektrum ini, dipilih panjang-panjang gelombang tertentu dengan lebar pita kurang dari 1 nm.
spektrofotometer adalah suatu alat yang digunakan untuk menentukan suatu senyawa baik secara kuantitatif maupun kualitatif dengan mengukur transmitan ataupun absorbansi dari suatu cuplikan sebagai fungsi dari konsentrasi dan panjang gelombang. Spektrofotometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau di absorbsi. Kelebihan spektrometer dibanding fotometer adalah panjang gelombang dari sinar putih terseleksi dan ini diperoleh dengan alat pengurai seperti prisma, grating, atau celah optis. Absorbsi (serapan) atom adalah suatu proses penyerapan bagian sinar oleh atom-atom bebas pada panjang gelombang (λ) tertentu dari atom itu sendiri sehingga konsentrasi suatu logam dapat ditentukan. Karena absorbansi sebanding dengan konsentrasi suatu analit, maka metode ini dapat digunakan untuk sistem pengukuran atau analisis kuantitatif.
Transmitans adalah perbandingan intensitas cahaya yang di transmisikan ketika melewati sampel (It) dengan intensitas cahaya mula-mula sebelum melewati sampel (Io). Persyaratan hukum Lambert-Beer antara lain : Radiasi yang digunakan harus monokromatik, energi radiasi yang di absorpsi oleh sampel tidak menimbulkan reaksi kimia, sampel (larutan) yang mengabsorpsi harus homogeny, tidak terjadi flouresensi atau phosphoresensi, dan indeks refraksi tidak berpengaruh terhadap konsentrasi, jadi larutan harus pekat (tidak encer).
Syarat suatu zat atau senyawa yang dapat dianalisis menggunakan spektrofotometri sinar tampak adalah zat dalam bentuk larutan dan zat tersebut harus tampak berwarna, sehingga analisis yang didasarkan pada pembentukan larutan berwarna disebut juga metode kolorimetri. Jika tidak berwarna maka larutan tersebut harus dijadikan berwarna dengan cara memberi reagen tertentu yang spesifik. Dikatakan spesifik karena hanya bereaksi dengan spesi yang akan dianalisis. Reagen ini disebut reagen pembentuk warna (chromogenik reagent).
Pembuatan larutan baku metil merah, 0,5 gram metil jingga kristal dilarutkan dalam 300 ml etanol 95% kemudian diencerkan hingga tepat 500 ml dengan aqua d.m. Digunakan etanol karena metil merah lebih larut dalam etanol dibandingkan ketika dilarutkan di dalam air sebab Senyawa etanol mengandong ikatan hidrogen pada gugus hidroksilnya (-OH). Semua senyawa yang memiliki ikatan hidrogen ( yaitu ikatan anrata H dengan F, O dan N) bersifat polar. Kepolaran berhubungan dengan perbedaan muatan pada ujung molekulnya. Molekul yang geometrinya asimetris ( tidak simetris) akan mempunyai perbedaan kepolaran pada ujung2nya , shg bersifat polar. Barulah setelah itu diencerkan dengan akuades untuk ditepatkan dengan menggunakan labu ukur. Pembuatan larutan standar metil merah. Sebanyak 10 ml larutan persediaan ditambahkan kedalam 50 ml etanol 95% dalam labu takar 100 ml , diencerkan hingga 100 ml. Metil merah adalah salah satu indikator yang banyak digunakan dalam titrasi asam-basa.
asam kuat yang terdisosiasi sempurna dalam air sehingga absorbansi [HMR] pada suasana asam dapat diketahui.
Dilakukan variasi konsentrasi untuk mengetahui hubungan antara konsentrasi larutan dengan absorbansi larutan serta keakuratan dalam mengambil data. Variasi konsentrasi yang dilakukan adalah dengan pengenceran bertingkat, yaitu dengan cara menambahkan akuades sebanyak setengah dari volume air awal (V2) sehingga didapatkan konsentrasi sebesar setengah dari konsentrasi semula.
Pengukuran absorbansi pada spektrofotometri menggunakan panjang gelombang maksimum karena pada panjang gelombang maksimum absorbansi yang dihasilkan juga maksimum sehingga intesitas cahaya yang diserap besar. Semakin bertambah kepolaran suatu pelarut maka puncak absorbansi yang dihasilkan akan berada pada panjang gelombang yang lebih pendek. Menyerap energi pada saat cahaya dilewatkan yang digunakan untuk mengeksitasi elektron dari atom.energi yang diserap dalam bentuk gelombang, semakin besar energi yang diserap maka panjang gelombang semakin kecil. Kemudian menguji dipenuhnya hukum lambert beer dan menentukan harga-harga indeks absorbansi molar HMR dan MR- pada λ
1 dan λ2, mengamati absorbansi nya untuk berbagai kosentrasinya.
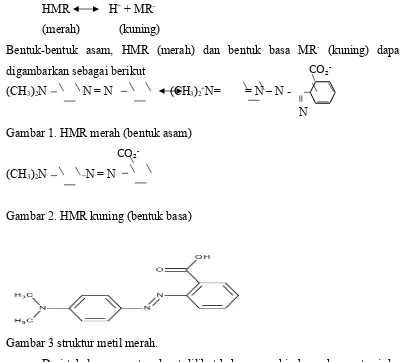
HMR H+ + MR -(merah) (kuning)
Bentuk-bentuk asam, HMR (merah) dan bentuk basa MR- (kuning) dapat digambarkan sebagai berikut
(CH3)2N N = N (CH3)2+N= = N – N - N Gambar 1. HMR merah (bentuk asam)
(CH3)2N N = N
Gambar 2. HMR kuning (bentuk basa)
Gambar 3 struktur metil merah.
Dari tabel pengamatan dapat dilihat bahwa semakin besar konsentrasi dan panjang gelombangnya maka nilai absorbansinya semakin besar. Hal ini berlaku pada semua jenis larutan baik basa maupun asam. Hal ini dapat dipahami bahwa semakin besar konsentrasinya maka akan semakin banyak partikel-partikel yang terdapat dalam larutan tersebut, sehingga sinar yang diserap juga akan semakin banyak.
Dari tabel pengamatan juga dapat dicari hubungan antara absorbansi dan panjang gelombang. Dari data didapat bahwa semakin besar panjang gelombang yang digunakan maka akan semakin besar pula absorbansinya. Hal ini terjadi pada semua jenis larutan yang digunakan yaitu HCl, NaOH dan CH3COOH.
CO2
-BAB V PENUTUP 5.1 Kesimpulan
naik, ( pada panjang gelombang 425 dan saat M HCl 0,0125 absorbansinya 0,227 dan meningkat menjadi 0,251 pada konsetrasi 0,1M hal ini juga terjadi pada NaOH). Jika panjang gelombang naik dan pH yang semakin besar. Dari data yang di peroleh dibuat grafik dan dari grafik dihitung maka didapat nilai tetapan pengionan untuk metil merah sebesar (Ka = 4,66x10-3).
5.2 Saran
Setelah melakukan percobaan ini maka di sarankan untuk percobaan selanjutnya dapat menggunakan indikator lain lagi selain indikator metil merah, misalnya menggunakan metil orange dan metil biru. Selain itu untuk pelarutnya disarankan menggunakan akua d.m.
DAFTAR PUSTAKA
Arsyad, 2001, “kamus kimia Inti dan Penjelasan ilmiah,” Erlangga, Jakarta.
Basri, s, 2003, “Kamus Lengkap Kimia ,” Erlangga, Jakarta.
Daintith, 1994, “oxford; Kamus Lengkap Kimia,” Erlangga, Jakarta.
Keenan, C.W, D.C, Kleinfelter dan J.H, Nood, 1984, “Ilmu Kimia Untuk
Universitas,” Erlangga, Jakarta.
Kusuma, S, 1983, “Pengetahuan Bahan-Bahan,” Erlangga, jakarta.
Rivai, H, 1994, “Asas Pemeriksaan Kimia,” UI Press, Jakarta .
Satrohamidjojo, 2001, “Kimia Dasar”, UGM, press, Yogyakarta.
Triyati, Eti, 1985, “Spektrofotometer Ultra-Violet dan Sinar Tampak Serta
Aplikasinya Dalam Oseonologi,” Oseana, Volume X, Nomor 1 : 39 - 47, 1985.
POST TEST
c. Absorbansi d. Transmisi
2. Sebutkan bunyi hukum Lamber –Beer dan rumusnya ! 3. Gambar dan jelaskan komponen spektrofotometer ! 4. Apa yang dimaksud dengan zwiter ion dan contohnya!
5. Berapa berat NaoH yang diperlukan untuk membuat NaOH 1M dalam 100 ml, Ar Na =23, O=16, H= 1
Jawab
1. - Spektrofotometri yaitu metode atau cara pengukuran jauhnya sebuah pengabsorpsian energi oleh suatu sistem kimia sebagai fungsi dari panjang gelombang.
- Spektrofotometer adalah alat untuk mengukur intensitas cahaya yang diserap oleh molekul
- Absorbansi adalah peneyerapan cahaya oleh suatu panjang gelombang tertentu
- Transmisi adalah cahaya yang tidak dapat diserap
2. Bunyi hukum Lamber-Beer jika seberkas cahaya dilewatkan ke larutan maka akan ada sebagian cahaya yang akan diserap ada yang dilewatkan
serta sebagian kecil yang dipantulkan. Dengan rumus -LogII
0=A
3. Zwiter ion adalah senyawa yang dapat bersifat asam atau basa dalam suatu larutan contohnya metil merah
Keterangan gambar:
1. tempat kuvet 7. tombol untuk mencetak
2. display digital 8. pengatur panjang gelombang
3. mode indikator 9. pengatur transmitan/absorbans (100%T/0 A)
4. mode pilihan 10. tombol power/pengatur nol
5. tombol pengurangan 11. pengatur filter
6. tombol menaikkan
5 .n=grammr X 1oooV
1=gram40 X1000500
1=gram40 X2
gram=402
gram=20gram
JAWABAN PERTANYAAN
Spektrofotometer UV menggunakan sinar UV sebagai sumber energi atau cahayanya dengan panjang gelombang 190-380 nm
Spektrofotometer IR menggunakan inframerah sebagai sumber energi atau cahaya dengan panjang gelombang 25-1000 µm.
2. Kromatogarfi, elektrokimia,