FISIOLOGI HEWAN AKUAKULTUR
NAMA :
NIM :
KELOMPOK :
PROGRAM STUDI BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
UNIVERSITAS BRAWIJAYA MALANG
KATA PENGANTAR
Puji syukur penyusun panjatkan kehadirat Tuhan Yang Maha Esa yang telah memberi petunjuk dan bimbingan-Nya, sehingga penyusun dapat mengerjakan dan menyelesaikan penyusunan Buku Panduan Praktikum Fisiologi Hewan Akuakultur. Buku panduan praktikum ini disusun dengan tujuan untuk membantu mahasiswa dalam melaksanakan praktikum Fisiologi Hewan Akuakultur.
Penyusun menyadari bahwa masih banyak kekurangan yang mendasar pada buku panduan praktikum ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan dalam penulisan selanjutnya. Semoga buku panduan praktikum ini dapat bermanfaat bagi kita semua. Demikian penyusun sampaikan terimakasih.
Malang, 18 Agustus 2017
DAFTAR ISI
Halaman
KATA PENGANTAR ... ii
DAFTAR ISI... iii
TATA TERTIB PRAKTIKUM ... v
1. OSMOREGULASI ... 1
1.1 Dasar Teori ... 1
1.2 Maksud dan Tujuan ... 2
1.3 Alat dan Bahan ... 2
1.4 Skema Kerja ... 3
1.4.1 Pengamatan Empedu ... 3
1.4.2 Toleransi Salinitas ... 3
2. RESPIRASI ... 4
2.1 Dasar Teori ... 4
2.2 Maksud dan Tujuan ... 5
2.3 Alat dan Bahan ... 6
2.4 Skema Kerja ... 7
3. SISTEM PENCERNAAN... 8
3.1 Dasar teori ... 8
3.2 Maksud dan Tujuan ... 9
3.3 Alat dan Bahan ... 9
3.4 Skema Kerja ... 10
3.4.1 Daya Cerna (Digestibility) ... 10
3.4.2 Waktu Pengosongan Lambung (Gastric Evacuation Time) ... 11
4. PEWARNAAN TUBUH DAN FOTOTAKSIS ... 12
4.1 Dasar teori ... 12
4.2 Maksud dan Tujuan ... 13
4.3 Alat dan Bahan ... 13
4.4 Skema Kerja ... 14
4.4.1 Pewarnaan Tubuh ... 14
4.4.2 Fototaksis ... 15
5. HEMATOLOGI ... 16
5.1 Dasar Teori ... 16
5.2 Maksud dan Tujuan ... 17
5.3 Alat dan Bahan ... 17
5.4 Skema Kerja ... 18
5.4.1 Pengambilan Sampel Darah ... 18
5.4.2 Pembuatan Film Darah Tipis ... 18
5.4.3 Perhitungan Eritrosit ... 19
5.4.4 Perhitungan Leukosit ... 19
6. SARAF ... 21
6.1 Dasar Teori ... 21
6.2 Maksud dan Tujuan ... 22
6.3 Alat dan Bahan ... 22
6.4 Skema Kerja ... 23
6.4.1 Keseimbangan Tubuh Ikan ... 23
6.4.2 Reaksi Saraf pada Udang ... 24
7. ENDOKRINOLOGI ... 25
7.1 Dasar Teori ... 25
7.2 Maksud dan Tujuan ... 26
7.3 Alat dan Bahan ... 26
7.4 Skema Kerja ... 27
8. PENGAMATAN GONAD DAN TELUR ... 28
8.1 Dasar Teori... 28
8.2 Maksud dan Tujuan ... 29
8.3 Alat dan Bahan ... 29
8.4 Skema kerja ... 30
DAFTAR PUSTAKA ... 31
DAFTAR NAMA DAN ALAMAT ASISTEN FHA 2017... 33
TATA TERTIB PRAKTIKUM
1. Datang 15 menit sebelum praktikum dimulai dan tidak ada toleransi keterlambatan
2. Mengerjakan tiket masuk
3. Memakai pakaian berkerah, sepatu tertutup dan berkaos kaki 4. Memakai jas lab sesuai dengan identitasnya
5. Menonaktifkan hp selama praktikum berlangsung 6. Menjaga ketertiban dan kelancaran jalannya praktikum 7. Dilarang makan dan minum selama praktikum berlangsung
8. Dilarang menggunakan alat-alat yang ada di labolatorium selain yang dipergunakan untuk praktikum
9. Membawa alat tulis dan obat pribadi
10. Dilarang meninggalkan pratikum tanpa seijin koordinator asisten 11. Menjalankan praktikum dengan baik
1. OSMOREGULASI
1.1 Dasar Teori
Suatu hal yang harus dihadapi oleh ikan sebagai organisme yang hidup dalam media air adalah adanya tekanan osmotik tubuhnya. Peranan proses osmoregulasi sangat vital dalam menjaga tekanan osmotik tubuh ikan. Dalam upaya beradaptasi dengan lingkungan tempat ia hidup, ia harus mengatur keseimbangan air dan garam dalam jaringan tubuhnya agar tidak kelebihan atau kekurangan air (Syakirin, 2007).
Osmoregulasi merupakan sebuah proses yang kompleks dan adalah respon tubuh terhadap lingkungan. Menurut Pamungkas (2012), proses osmoregulasi dapat diartikan sebagai pengaturan konsentrasi cairan dengan menyeimbangkan pemasukkan serta pengeluaran cairan tubuh oleh sel atau organisme hidup. Osmoregulasi dapat didefinisikan juga sebagai pengaturan tekanan osmotik cairan tubuh yang layak bagi kehidupan sehingga proses-proses fisiologis dalam tubuh berjalan normal.
Proses osmoregulasi terjadi juga pada hewan perairan. Menurut Nicol (1967)
dalam Lantu (2010), osmoregulasi disebabkan adanya perbedaan tekanan
osmosis (osmosis berasal dari bahasa Yunani yang berarti mendorong) antara larutan (biasanya kandungan garam-garam) di dalam tubuh dan di luar tubuh. Osmoregulasi dapat dikatakan merupakan upaya hewan air untuk mengontrol keseimbangan air dan ion yang terdapat di dalam tubuhnya dengan lingkungan melalui sel permeable.
Hubungan erat terjadi antara kadar garam yang terlarut atau salinitas dan faktor lain dalam perairan tempat hidup ikan dengan respirasi atau pernapasan ikan. Jumlah pernafasan ikan dapat berubah apabila kondisi lingkungannya juga
berubah, dalam hal ini dengan terjadinya perubahan salinitas air. Organisme yang tidak mampu menoleransi perubahan ini tidak dapat bertahan hidup, sehingga peran osmoregulasi penting dalam proses fisiologis ikan.
1.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah untuk mengerti dan memahami peranan salinitas terhadap kehidupan ikan dan proses-proses fisiologis yang berkaitan dengannya.
Tujuan dari praktikum ini adalah agar praktikan (Mahasiswa) dapat melakukan percobaan untuk mengetahui pengaruh salinitas air (lingkungan) yang berbeda terhadap kelangsungan hidup ikan.
1.3 Alat dan Bahan
Alat
Lap basah Baskom
Nampan Timbangan Oz
Seser Kamera digital
Freezer Bak besar Penggaris
Aerator set Kabel roll Toples kapasitas 3 liter
Akuarium Timbangan digital Stopwatch
Gunting
Bahan
Empedu sapi Air tawar
Air bersalinitas Benang kasur
Ikan nila (Oreochromis niloticus) Air laut
Trash bag Kertas label
Ikan lele dumbo (Clarias gariepinus) Es batu
Plastik bening Garam grasak (NaCl)
1.4 Skema Kerja
1.4.1 Pengamatan Empedu Toples
-Diisi air 2,25 liter NaCl
-Ditimbang sesuai dengan toleransi yang diinginkan -Dilarutkan ke dalam air
Empedu
-Ditimbang berat awal (W0)
-Dimasukkan ke dalam toples dengan perlakuan: Meja 1 : 0 ppt
Meja 2 : 10 ppt Meja 3 : 20 ppt Meja 4 : 30 ppt Meja 5 : 40 ppt
-Diamati perubahannya setiap 20 menit selama 2 jam -Ditimbang berat akhir (Wt)
Hasil
1.4.2. Toleransi Salinitas
Toples
- Diisi air 2,25 liter NaCl
- Ditimbang sesuai toleransi yang diinginkan - Dilarutkan ke dalam air
Ikan Nila (Oreochromis niloticus) Ikan Damsel (Chrysiptera cyanea) Ikan Lele dumbo (Clarias gariepinus)
- Ditimbang ikan sebagai berat awal (W0)
- Dimasukkan ikan ke dalam toples dan diberi perlakuan: Meja 1 = 0 ppt
Meja 2 = 10 ppt Meja 3 = 20 ppt Meja 4 = 30 ppt Meja 5 = 40 ppt
-Diamati tingkah laku setiap 20 menit selama 2 jam -Ditimbang berat akhir (Wt)
2. RESPIRASI
2.1 Dasar Teori
Sistem pernapasan adalah proses pengikatan oksigen (O2) dan
pengeluaran karbondioksida (CO2) oleh darah melalui permukaan alat pernapasan. Oksigen sebagai bahan pernapasan dibutuhkan oleh sel untuk berbagai reaksi metabolism. Kelangsungan hidup ikan sangat ditentukan oleh kemampuannnya memperoleh oksigen yang cukup dari lingkungannya melalui proses ini (Mahyuddin, 2008).
Alat pernapasan ikan dapat digolongkan ke dalam organ pernapasan akuatik dan pernapasan udara. Organ pernapasan akuatik atas insang dalam yakni insang yang berada di dalam rongga insang dan insang luar yakni insang yang berada di luar rongga insang yang biasanya ditemukan pada stadia embrio atau larva pada beberapa jenis ikan. Organ pernapasan udara adalah organ yang dapat mengambil oksigen langsung dari udara (Rahardjo et al., 2011).
Proses respirasi pada ikan adalah dengan membukanya mulut, sehingga terdapat sedikit tekanan negatif dalam rongga mulut maupun rongga insang. Begitu mulut ditutup (menjadi positif), air didorong masuk rongga insang dan selanjutnya mendorong operculum sehingga air keluar rongga insang. Tekanan dalam rongga mulut dari rongga insang menjadi lebih kecil daripada tekanan air diluar tubuh sehingga tutup insang menutup kembali. Pada saat air masuk ke dalam rongga, maka oksigen yang terlarut dalam air masuk dan berdifusi dalam pembuluh kapiler darah yang terdapat dalam insang dan karbondioksida akan dikeluarkan ke lingkungan (Rahmawati, 2012 dalam Putra et al., 2014).
Konsumsi O2 pada ikan bervariasi yang tergantung pada spesies, ukuran,
banyak O2 selama periode aktivitasnya. Hewan berukuran besar membutuhkan
O2 lebih sedikit per unit berat badannya dibandingkan ikan yang berukuran
kecil. Konsumsi O2 meningkat sejalan dengan meningkatnya suhu sampai
pada suatu titik kritis dan akhirnya menurun, tetapi banyak hewan mengganti O2 pada waktu perubahan musim guna metabolisme dan dapat mengkonsumsi lebih banyak O2 pada musim dingin dibandingkan musim-musim lainnya.
Dalam respirasi, terdapat faktor yang mempengaruhinya. Menurut Coche et
al. (1997), faktor internal dalam proses respirasi adalah usia, spesies, sexual maturity, ukuran, psikologi ikan. Faktor internal menurut Hoar and Randall
(1970), adalah suhu, lingkungan, kadar O2, CO2, pH, aktivitas, dan kepadatan. Ikan yang membutuhkan jumlah O2 yang banyak adalah spesies yang aktif
dimana terbiasa hidup pada perairan dengan kandungan O2 yang stabil. Sebagai contoh ialah ikan jenis makarel. Spesies ikan air tawar yang kebutuhan O2
nya cukup besar misalnya ikan trout, dimana ikan ini biasanya hidup pada perairan jenuh O2 serta beraliran dingin. Mereka tidak dapat bertahan hidup pada
perairan dengan kandungan O2 kurang dari 5 mg/liter. Sebaliknya secara ekstrim
(meliputi ikan yang dapat bernafas di udara) adalah spesies ikan dasar air tawar yang kurang aktif karper dan catfish. Ikan-ikan ini dapat bertahan hidup dengan kandungan O2 terlarut hanya 0,5 mg/liter.
2.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah untuk mengamati dan memahami pengaruh suhu (lingkungan) terhadap proses respirasi yang dilakukan insang.
Tujuan dari praktikum ini adalah agar praktikan (mahasiswa) dapat mengetahui pengaruh perlakuan suhu yang berbeda terhadap proses respirasi pada ikan.
2.3 Alat dan Bahan
Alat
Heater akuarium Nampan
Heater masak Akuarium
Seser Thermometer Kabel roll Toples kapasitas 3 liter
Stopwatch Penggaris
Aerator set Beaker glass
Hand tally counter Kamera digital
Timbangan digital DO meter
Bahan
Ikan nila (Oreochromis niloticus) Plastik Karet gelang Akuades Tisu Es batu Kertas label Air panas
2.4 Skema Kerja Toples 2,25 liter
-Diisi air
-Disesuaikan suhu air dengan perlakuan -Dimasukkan termometer dalam toples -Ditunggu media air sampai pada suhu Perlakuan: Meja 1 = 28 0 C
Meja 2 = 29 0 C
Meja 3 = 30 0 C
Meja 4 = 31 0 C
Meja 5 = 32 0 C
-Diukur DO awal (DO0) dengan DO meter
-Dimasukkan ke dalam toples -Ditutup toples dengan plastik
-Ditunggu selama 5 menit agar ikan beradaptasi
-Dihirung bukaan operculum ikan selama 10 menit dengan
handtally counter
-Diukur DO dengan DO meter -Diulangi sebanyak 3 kali
DO = DO0-DOt Keterangan: DO = Perubahan DO DO0 = DO awal DOt = DO akhir Hasil
3. SISTEM PENCERNAAN
3.1 Dasar Teori
Pencernaan adalah proses yang terjadi di dalam saluran pencernaan dengan memecah belah pakan menjadi bagian-bagian yang lebih sederhana. Pemecahan senyawa kompleks menjadi senyawa sederhana agar dapat diabsorpsi melalui dinding saluran pencernaan. Pecahan senyawa ini kemudian masuk ke dalam darah dan diedarkan keseluruh tubuh (Kamal, 1994 dalam Hartono et al. 2015).
Proses pencernaan pada seluruh taksa Animalia, kecuali protozoa dan
sponges, merupakan jenis pencernaan ekstraseluler baik sebagian maupun
seluruhnya. Fungsi dari tiap-tiap bagian saluran pencernaan ekstraseluler berbeda-beda, sehingga penyaluran sekresi enzim, penyimpanan dan transpor makanan serta nutrien, pencernaan kimia, absorbsi dan pembentukan feses yang dapat berlangsung di daerah khusus.
Pakan yang masuk akan disederhanakan melalui mekanisme fisik dan kimiawi agar mudah diserap. Menurut Mahyuddin (2008), p roses pencernaan makanan dipercepat oleh sekresi kelenjar pencernaan yang berasal dari hati, kantong empedu, lambung, dan usus. Burhanuddin (2014), menyatakan bahwa alat-alat pencernaan pada ikan secara umum dari awal hingga akhir adalah: mulut, rongga mulut, pharynx, esophagus, lambung, pylorus, usus dan anus.
Gerak peristaltik dari dinding gastrointestinal musculature digunakan oleh organisme untuk menghancurkan atau mencampur bahan makanan di dalam tubuhnya. Metode-metode tersebut digunakan sebelum perlakuan pada makanan, yaitu menyiapkan makanan untuk dihancurkan oleh kerja enzim. Hal ini merupakan dasar dari semua proses pencernaan, baik pencernaan pencernaan intraselular maupun ekstraselular.
3.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah untuk mengenali dan menjelaskan organ- organ sistem pencernaan dan mengetahui sistem pencernaan, mengetahui daya cerna ikan dan menghitung waktu pengosongan lambung.
Tujuan dari praktikum ini adalah agar praktikan (mahasiswa) mengetahui dan dapat menjelaskan mekanisme pencernaan, mengerti cara penentuan daya cerna ikan tehadap makanan dan waktu pengosongan lambung dan faktor-faktor yang mempengaruhinya.
3.3 Alat dan Bahan
Alat Toples kapasitas 3 L Timbangan OZ Timbangan digital Freezer Stopwatch Lap basah Seser Aerator set Akuarium Kamera digital Nampan Sectio set Oven Selang Saringan Ember Kabel roll Desikator Kalkulator Bahan Ikan nila (Oreochromis niloticus)
Lumut jaring (Chaertomorfa sp.) Mata lele (Azolla pinnata) Cacing sutra (Tubifex sp.) Cacing darah (Chironomous sp.) Trash bag Pelet Kertas label Tisu Kain ukuran 15x15 cm2 Kertas buram Air tawar
3.4 Skema Kerja
3.4.1 Daya Cerna (Digestibility)
Ikan Nila (Oreochromis niloticus)
-Diadaptasikan selama 24 jam (dipuasakan) Toples
-Diisi air 2,25 liter -Diberi aerasi -Ditimbang ikan nila -Dimasukkan ke toples Pakan
-Ditimbang 5% dari berat tubuh ikan
Perlakuan jenis pakan: 1 = lumut jaring (Chaertomorfa sp.) 2 = cacing darah (Chironomous sp.) 3 = pellet
4 = mata lele (Azolla pinnata) 5 = cacing sutra (Tubifex sp.) -Diberi pada ikan secara terus menerus hingga kenyang (adlibitum) -Ditunggu dengan lama waktu 3 jam
Kain 15 x 15 cm
-Dioven dengan suhu 100oC selama 15 menit -Didesikator selama 15 menit
-Kain ditimbang
-Kain diletakkan dalam saringan
-Diambil sisa pakan dan sisa feses dengan saring berbeda -Dioven sisa pakan dan feses kemudian ditimbang
-Dihitung Digestibility dengan rumus:
Digestibility:
BTM = Berat Total Makanan (gram) BTM = Total pakan diberikan–(sisa pakan
kering+sisa pakan di perairan) BTF = Berat total feses (gram)
Hasil
BTM-BTF x 100% BTM
3.4.2 Waktu Pengosongan Lambung (Gastric Evacuation Time)
Ikan Nila (Oreochromis niloticus)
-Diadaptasikan selama 24 jam (dipuasakan) Toples
-Diisi air 2,25 liter -Diberi aerasi
-Diambil 4 ekor ikan nila, ditimbang ikan nila -Dimasukkan ke toples
-Ditetapkan ikan:
-Ikan 1: ditetapkan sebagai ikan kontrol Pakan
-Diberi pakan 5 % dari berat tubuh ikan Perlakuan:
➢1 = lumut jaring (Chaetomorfa sp.) ➢2 = cacing sutra (Tubifex)
➢3 = cacing darah (Chironomous sp.) ➢4 = Pellet
➢5 = Mata lele (Azolla pinnata) -Ikan 2 diamati sebagai 1 jam (GET 1) -Ikan 3 diamati sebagai 2 jam (GET 2) -Ikan 4 diamati sebagai 3 jam (GET 3) Ikan Nila (Oreochromis niloticus)
-Dibedah masing-masing sesuai perlakuan -Diambil lambung dan ditimbang
-Dibandingkan dengan lambung ikan kontrol
4. PEWARNAAN TUBUH DAN FOTOTAKSIS
4.1 Dasar Teori
Ikan dalam hidupnya di dalam air dipengaruhi oleh beberapa faktor lingkungan seperti cahaya, suhu, salinitas dan sebagainya. Dalam mengidentifikasi ikan, perlu juga kita ketahui mengenai warna tubuh ikan itu sendiri serta proses terjadinya warna tubuh ikan tersebut. Selain itu juga untuk mengetahui bagaimana pengaruh faktor-faktor luar (lingkungan) terhadap warna serta perubahan warna pada ikan seperti cahaya atau sinar, predator dan lain sebagainya.
Warna pada ikan disebabkan oleh adanya sel kromatofora yang terdapat pada kulit bagian dermis. Menurut Solichin et al. (2012), sel ini diklasifikasikan menjadi lima kategori warna dasar, yaitu eritrofora yang menghasilkan warna merah dan oranye, xanthofora yang menghasilkan warna kuning, melanofora yang menghasilkan warna hitam, leukofora yang meghasilkan warna putih dan
iridofora yang memantulkan refleksi cahaya.
Warna tubuh ikan disesuaikan dengan kondisi lingkungan tempat ikan tersebut hidup. Warna ikan yang biasa hidup di permukaan akan berbeda dengan warna tubuh ikan yang biasa hidup di perairan dasar. Warna tubuh ikan dapat digunakan sebagai salah satu alternatif identifikasi kehidupan ikan baik kebiasaan ataupun tingkah laku hidup ikan. Selain itu, warna tubuh ikan dapat digunakan sebagai ciri tersendiri bagi kondisi ikan tersebut, misalnya saat memijah warna tubuh ikan akan berbeda sekali dengan saat ikan setelah memijah, sebagai contoh ikan nila.
Selain warna tubuh ikan, identifikasi juga dapat dilakukan dengan mengamati pola tingkah laku ikan yang berhubungan dengan kepekaan ikan terhadap sinar atau cahaya lingkungannya. kepekaan tersebut disebut dengan fototaksis. Pada siang hari umumnya dijumpai ikan yang bersifat diurnal (aktif mencari
makan pada siang hari). Ikan-ikan tersebut memiliki sifat fototaksis positif. Ikan yang tidak menyukai adanya cahaya matahari umumnya merupakan ikan nokturnal yang aktif pada malam hari dan ikan tersebut bersifat fototaksis negatif.
4.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah mahasiswa (praktikan) dapat mengerti dan memahami peranan warna tubuh (pigmen) dan fototaksis dalam kehidupan ikan.
Tujuan dari praktikum ini adalah untuk mengetahui perubahan warna pada ikan dan sifat fototaksis ikan serta faktor-faktor yang mempengaruhinya.
4.3 Alat dan Bahan
Alat Toples ukuran 3 L Gunting Kabel roll Selang aerasi Batu aerasi Seser Kamera digital Stopwatch T aerator Akuarium Lampu Ember Nampan Bahan Ikan sepat siam (Trichogaster tricopterus) Ikan mas koi (Carrasius auratus)
Ikan black ghost (Apteronotus albifrons) Lobster air tawar (Cherax quadricarinatus) Ikan gurame (Osphronemous gouramy) Ikan guppy (Poecillia reticulata)
Selotip bening Kertas label Tisu
Plastik warna hijau Plastik warna biru Plastik warna merah Plastik warna kuning Plastik warna ungu Plastik besar hitam Sterofoam
4.4 Skema Kerja
4.4.1 Pewarnaan Tubuh
Toples 3 liter -Disiapkan
-Diisi air ¾ bagian -Diberi aerasi
Ikan Sepat Siam (Trichogaster tricopterus) 1, sebagai ikan kontrol -Dimasukkan kedalam toples 1
-Diberi aerasi
-Diadaptasikan selama 15 menit
Ikan Sepat Siam (Trichogaster tricopterus) 2, sebagai ikan uji -Dimasukkan kedalam toples 2
-Diberi aerasi
-Diadaptasikan selama 15 menit -Dicatat warna awal tubuh
-Ditutup dengan perlakuan warna: Meja 1. Hijau Meja 2. Merah Meja 3. Biru Meja 4. Kuning Meja 5. Ungu -Diberikan pencahayaan -Dibiarkan selama 24 jam
-Dicatat perubahan waktu (didokumentasikan) -Dicatat waktu saat kembali normal
-Diamat warna akhir
4.4.2 Fototaksis
Akuarium
-Disiapkan
-Diisi air ¾ bagian dan diberi aerasi
-Dilapisi seluruh sisi akuarium dengan plastik gelap Ikan Mas Koki (Carrasius auratus)
Ikan Guppy (Poecillia reticullata)
Lobster Air Tawar (Cherax quadricarinatus) Ikan Black Ghost (Apteronotus albifrons) Ikan Gurame (Osphronemous gouramy)
-Dimasukkan ke dalam akuarium -Ditunggu sampai keadaan gelap -Diberi biasan cahaya senter -Diamati tingkah laku
5. HEMATOLOGI
5.1 Dasar Teori
Hematologi adalah cabang ilmu pengetahuan yang mempelajari darah, organ pembentuk darah dan penyakitnya. Khususnya jumlah dan morfologi sel-sel darah, serta sumsum tulang. Darah adalah jaringan khusus yang berbeda dengan organ lain dikarenakan berbentuk cairan. Jumlah darah dalam tubuh adalah 6-8% berat tubuh total. Empat puluh lima sampai 60% darah terdiri dari sel-sel, terutama eritrosit, leukosit dan trombosit. Fungsi utama darah adalah sebagai media transportasi, serta memelihara suhu tubuh dan keseimbangan cairan (Atul dan Victor, 2008 dalam Arifin et al., 2012).
Peran utama darah secara umum adalah mengintergrasikan fungsi tubuh dan memenuhi kebutuhan jaringan khusus. Peran ini dilakukan melalui transportasi, regulasi dan mekanisme perlindungan. Darah mengirimkan oksigen, nutrient, produk sisa, dari satu tempat ke tempat lain. Regulasi dilakukan melalui buffer dalam darah, protein plasma dan transpor panas. Fungsi perlindungan darah mencangkup antibody dan fagosit untuk melindungi terhadap penyakit serta faktor-faktor dalam homeostasis (Tambayong, 2000).
Pada sistem pertahanan alami, makrofag dapat dikatakan sebagai kunci terpenting dalam merespon patogen yang masuk tanpa menunggu waktu adaptasi. Sel fagosit melakuan kerjanya tanpa memerlukan spesifikasi antigen dan tidak memakan waktu. Sel fagosit pada udang diperankan oleh hemosit terutama sel hyalin. Sel hyalin berperan dalam proses fagositosis mikroba yang masuk ke dalam tubuh saat terjadinya infeksi penyakit. Salah satu komponen yang terlibat dalam proses fagositosis adalah terbentuknya reactive oxygen
spesies (ROS) seperti anion superoksida, hidrogen peroksida, oksigen singlet
5.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah untuk mengetahui teknik pewarnaan struktur darah secara umum pada ikan serta mengetahui mekanisme dan alat- alat yang berkenaan dengan peredaran darah.
Tujuan dari praktikum ini adalah agar praktikan (mahasiswa) dapat melakukan pengamatan sel darah, menghitung sel darah dan mengetahui struktur sel darah.
5.3 Alat dan Bahan
Alat Nampan Haemocytometer Mikroskop binokuler Pipet toma 0,5 ml Pipet tetes Cover glass Objek glass Spuit 3 ml Seser Ember Handtally counter Tube 1,5 ml Washing bottle Tabung sahli Sahlimeter Pipet sahli
Kotak standar warna sahli Sedotan pipet
Kamera digital Lap basah
Bahan
Ikan lele dumbo (Clarias gariepinus) Alkohol 70% Na Sitrat Tisu Kertas label Giemsa Methanol Akuades Larutan Hayem Larutan Turk HCl Kapas
5.4 Skema Kerja
5.4.1 Pengambilan Sampel Darah
Spuit 3 ml
-Diaseptiskan dengan alkohol 70 %
-Dibilas dengan antikoagulan (Na Sitrat) 0,1 ml Ikan Lele Dumbo (Clarias gariepinus)
-Diaseptiskan bagian yang akan disuntik dengan alkohol 70 % -Diambil darahnya dari linea lateralis, caudal peduncle, dorsal aorta, anal atau jantung
-Darah dimasukkan ke dalam tube
Hasil
5.4.2 Pembuatan Film Darah Tipis
Darah Ikan Lele dumbo (Clarias gariepinus) -Diteteskan pada objek glass (1 tetes) -Diratakan dengan metode smear
-Difiksasi dengan methanol (1 tetes) selama 5 menit
-Diwarnai dengan pewarna giemsa (1-2 tetes) selama 1-2 menit -Dibilas dengan aquades
-Dikeringkan selama 2 menit -Diamati dibawah mikroskop -Didokumentasikan
5.4.3 Perhitungan Eritrosit
Darah Ikan Lele (Clarias gariepinus)
-Diambil dengan pipet toma sampai skala 0,5 -Dicampur dengan larutan hayem sampai skala 101 -Dihomogenkan
-Dibuang 3 tetes pertama
-Diteteskan ke haemochytometer -Ditutup dengan cover glass
-Diamati di bawah mikroskop dengan perbesaran 400x -Dihitung eritrosit dengan rumus
= n x 104 (sel/mm3)
Keterangan:
n: jumlah eritrosit di kotak yang diambil 104: Faktor koefisien
Hasil
5.4.4 Perhitungan Leukosit
Darah Ikan Lele (Clarias gariepinus)
-Diambil dengan pipet toma sampai skala 0,5 -Dicampur dengan larutan turk sampai skala 11 -Dihomogenkan
-Dibuang 3 tetes pertama
-Diteteskan ke haemochytometer -Ditutup dengan cover glass
-Diamati di bawah mikroskop dengan perbesarab 40x -Dihitung leukosit dengan rumus
= n x 50 (sel/mm3)
Keterangan:
n: jumlah eritrosit di kotak yang diambil
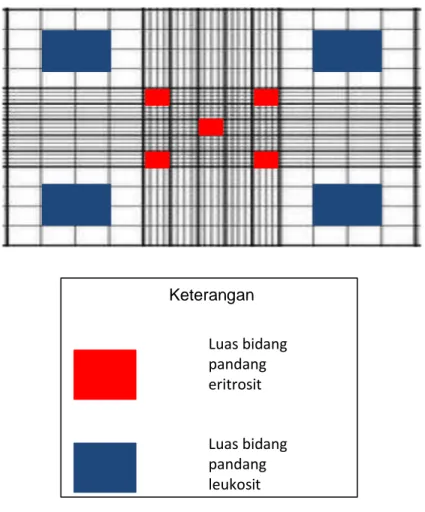
Keterangan Luas bidang pandang eritrosit Luas bidang pandang leukosit
Gambar 1. Luas Bidang Pandang pada Mikroskop
5.4.5 Perhitungan Hemoglobin Tabung Sahli
-Ditambahkan HCl 0,1 N sampai skala 2 Darah Ikan Lele (Clarias gariepinus)
-Diambil menggunakan pipet sahli sampai skala 0,02 ml -Dimasukkan ke dalam tabung sahli
-Dihomogenkan sampai berwarna coklat kehitaman
-Ditambahkan akuades hingga warnaya sama dengan indikator warna pada sahlihaemometer
Satuan hasil G% Hasil
6. SISTEM SARAF
6.1 Dasar Teori
Sel saraf adalah sel yang berfungsi untuk menjalarkan rangsang. Pada keadaan istirahat, sel saraf berada pada keadaan polar, yaitu keadaan sedang tidak menjalarkan rangsang. Keadaan polar ini ditandai dengan adanya muatan yang lebih negatif di sisi dalam membran dan lebih positif di sisi luar membran. Dalam keadaan semacam itu membran saraf bersifat impermeable terhadap ion natrium dan permeable terhadap ion kalium, serta memperlihatkan adanya perbedaan potensial antara bagian luar dan dalam membran (Isnaeni, 2008).
Perbedaan potensial tersebut disebabkan oleh adanya distribusi ion natrium dan kalium yang tidak seimbang diantara kedua sisi membran saraf. Ion natrium yang terdapat di luar sel lebih banyak jumlahnya daripada yang terdapat di dalam sel. Dalam keadaan istirahat membran akson bersifat impermeable terhadap ion natrium sehingga sejumlah besar ion natrium akan tetap berada di luar sel. Hal ini ternyata menjadi faktor penentu adanya keadaan yang lebih positif di luar sel dibanding di dalam sel. Perbedaan potensial ini akan mempengaruhi transmisi sinaps (Isnaeni, 2008).
Dalam transmisi sinaptik, kompleks reseptor- neurotransmitter memengaruhi membran pasca sinaps hanya dalam waktu yang sangat singkat (1-5 ms). Kemudian neurotransmitter akan segera dihidrolisis oleh enzim yang sesuai yang terdapat di celah sinaps. Jika neurotransmitter berupa asetikolin, enzim yang menghidrolisisnya adalah asetikolin esterase. Asetikolin dihidrolisi menjadi asetil, koenzim-A, dan kolin (Isnaeni, 2008).
Kadang-kadang proses transmisi sinaps mengalami gangguan sehingga penjalaran impuls menjadi tidak normal. Beberapa jenis bahan yang diketahui dapat mengganggu transmisi sinaps ialah pestisida, racun ular dan obat bius.
Pestisida sangat banyak jenisnya, salah satu diantaranya adalah golongan organofosfat, misalnya diazinon, yang merupakan antikolin esterase. Keracunan dizinon ditandai dengan gejala kejang otot. Sedangkan obat bius membuat hewan mengalami ganguan fungsi saraf sehingga tidak dapat merasakan sakit meskipun bagian tubuhnya diiris (Isnaeni, 2008).
6.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah untuk mengetahui pengaruh rangsangan terhadap saraf yang dikendalikan oleh otak.
Tujuannya untuk mengetahui kerja otak dalam mengadakan koordinasi terhadap organ tubuh ikan dan untuk mengetahui fungsi dari masing-masing bagian otak.
6.3 Alat dan Bahan
Alat Toples kapasitas 3 L Seser Nampan Stopwatch Penggaris 30 cm Gunting Lap basah Ember Pipet tetes Kamera digital Bahan Ikan nila (Oreochromis niloticus)
Udang galah (Macrobrachium rosenbergii) Minyak cengkeh
Kertas label Tisu
6.4 Skema Kerja
6.4.1 Keseimbangan Tubuh Ikan Toples 3L
-Disiapkan 4 buah -Diisi air ¾ bagian
4 ekor ikan nila (Oreochromis niloticus)
-Dimasukkan ke dalam masing-masing toples -Diadaptasikan selama 15 menit
Ikan Nila (Oreochromis niloticus) pertama -Diberi kejutan arus, bunyi dan sentuhan -Diamati tingkah laku sebagai ikan kontrol Ikan Nila (Oreochromis niloticus) ke dua
-Ditetesi minyak cengkeh dengan perlakuan Meja 1: 1 tetes
Meja 2: 2 tetes Meja 3: 3 tetes Meja 4: 4 tetes Meja 5: 5 tetes
-Diberi kejutan arus, bunyi dan sentuhan -Diamati tingkah laku
-Diberi perlakuan universal -Dipotong seluruh sirip
-Diberi kejutan arus, bunyi dan sentuhan -Diamati tingkah laku
- Meja 1: ditusuk mata
2: ditusuk linea lateralis 3: dipotong sirip anal 4: dipotong sirip caudal 5: dipotong sirip pectoral -Diberi kejutan arus, bunyi dan sentuhan -Diamati tingkah laku
Hasil
Ikan Nila (Oreochromis niloticus) ke tiga
6.4.2 Reaksi Saraf pada Udang
Toples 3L
-Disiapkan 4 buah -Diisi ¾ bagian
4 ekor Udang Galah (Macrobranchium rosenbergii) -Dimasukkan ke dalam masing-masing toples -Diadaptasikan selama 15 menit
Udang Galah (Macrobranchium rosenbergii) pertama -Diberi kejuran arus, bunyi dan sentuhan -Diamati tingkah laku sebagai udang kontrol Udang Galah (Macrobranchium rosenbergii) ke dua -Ditetesi minyak cengkeh dengan perlakuan:
Meja 1: 1 tetes Meja 2: 2 tetes Meja 3: 3 tetes Meja 4: 4 tetes Meja 5: 5 tetes
-Diberi kejutan arus, bunyi dan sentuhan -Diamati tingkah laku
-Diberi perlakuan universal
-Dipotong capit, telson, kaki renang, mata, kaki jalan, antena dan antenula
-Diberi kejutan arus, bunyi dan sentuhan -Diamati tingkah laku
Udang Galah (Macrobranchium rosenbergii) keempat -Meja 1: dipotong capit
2: dipotong telson dan kaki renang 3: dipotong mata
4: dipotong kaki jalan
5: dipotong antena dan antenula -Diberi kejutan arus, bunyi dan sentuhan -Diamati tingkah laku
Hasil
7. ENDOKRINOLOGI
7.1 Dasar Teori
Endokrinologi adalah ilmu yang mempelajari fungsi kelenjar endokrin. Endokrin adalah kelenjar yang tidak mempunyai saluran khusus untuk mengeluarkan skretnya. Skretnya dari kelenjar endokrin dinamakan hormon yang penting untuk mengatur berbagai aktivitas dalam tubuh hewan (Isnaeni, 2006).
Sistem endokrin, dalam kaitannya dengan sistem saraf, mengontrol dan memadukan fungsi tubuh. Kedua sistem ini bersama-sama bekerja untuk mempertahankan homeostasis tubuh. Fungsi mereka satu sama lain saling berhubungan, namun dapat dibedakan dengan karakteristik tertentu. Misalnya, medulla adrenan dan kelenjar hipofisa posterior yang mempunyai asal dari saraf (neural). Jika keduanya dihancurkan atau diangkat, maka fungsi dari kedua kelenjar ini sebagian diambil alih oleh sistem saraf (Rumaharbo, 1997).
Kelenjar endokrin dalam bekerja akan mengeluarkan hormon. Menurut Walker (2003), hormon adalah suatu zat pembawa pesan kimia hasil dari kelenjar endokrin yang dilepas di pembuluh darah. Hampir keseluruhan dari sistem homeostastis dikontrol oleh aktivitas hormon dan saraf, terutama vertebrata tingkat tinggi. Regulasi kimia oleh hormon digunakan untuk aktivitas sebagai berikut: 1. Aktivitas reproduksi kontrol gametogenesis, perkembangan dan pemeliharaan
saluran sex dan akseksori atau karakteristik seksual yang kedua, melepaskan pola tingkah laku seksual memulai masa bertelur.
2. Pertumbuhan, maturasi dan regenerasi dan regenerasi: molting dan metamorfosa pada crustacea dan amphibi, menyembuhkan luka.
3. Metabolisme dan homeostasi: regulasi metabolisme lanjutan, pemeliharaan variabel-variabel internal, seperti temperatur, kandungan air, keseimbangan ion, level gula darah dan lain-lain.
7.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah untuk mengatur dan mempelajari bagaimana teknik mengambil hipofisa di dalam tubuh ikan dan bagaimana teknik hipofisasi dilakukan.
Tujuan dari praktikum ini adalah untuk mengetahui pengaruh hipofisa pada penyuntikan terhadap ikan yang sudah matang gonad pada teknik hipofisasi.
7.3 Alat dan Bahan
Alat Spuit 3 ml Sentrifuge Tabung reaksi Sectio set Akuarium Aerator set Heater akuarium Thermometer Lap basah Telenan
Rak tabung reaksi
Kabel roll Timbangan OZ Bak Pisau Meteran jahit Senter Nampan Tissue grinder Kamera digital Seser Bahan Ikan mas (Cyprinus carpio) jantan dan betina Na fisiologis Alkohol 70% Aluminium foil Kertas saring Kapas Hipofisa Tisu Air tawar Kertas label Trash bag
7.4 Skema Kerja Ikan Donor
-Disiapkan -Ditimbang
-Diamati seks sekunder -Dipotong kepala -Diambil hipofisa
-Diletakkan pada kertas saring Hipofisa
-Dihancurkan + 1 ml NaFis
-Dimasukkan dalam tabung reaksi -Disentrifuge 3200 rpm selama 21 menit Supernatan
-Diambil dengan spuit sepenuhnya
Hasil
Ikan Resipien
-Diamati seks sekunder -Ditimbang berat awal (W0)
-Diukur panjang tubuh (TL) -Disuntik supernatan
-Diamati selama tiap 2 jam sekali
8. PENGAMATAN GONAD DAN TELUR
8.1 Dasar Teori
Dalam usaha budidaya ikan, jenis kelamin merupakan salah satu faktor yang perlu diperhatikan. Jenis kelamin ikan erat kaitannya dengan faktor-faktor internal maupun eksternal yang mempengaruhi keberhasilan usaha budidaya ikan. Dengan mengetahui jenis kelamin pada ikan, kita dapat mengetahui pula kapan ikan tersebut akan memijah berdasarkan Tingkat Kematangan Gonadnya (TKG).
Tingkat kematangan gonad dapat dipergunakan sebagai penduga status reproduksi ikan, ukuran dan umur pada saat pertama kali matang gonad, proporsi jumlah stok yang secara produktif matang dengan pemahaman tentang siklus reproduksi bagi suatu populasi atau spesies (Sulistiono et al., 2001 dalam Mariskha dan Abdulghani, 2012). Oleh sebab itu perlu dilakukan pengamatan gonad pada ikan jantan maupun betina untuk mengetahui kapan ikan tersebut siap memijah serta mengetahui status reproduksi ikan tersebut.
Pengamatan gonad ikan dapat dilakukan berdasarkan morfologi gonadnya maupun anatomi gonadnya. Menurut Elrifadah dan Rimalia (2013), pengamatan secara morfologi terhadap gonad ikan meliputi pengamatan bentuk, warna, besar kecilnya ukuran gonad, serta jelas tidaknya warna dan bentuk telur yang dikandung. Pengamatan mikroskopik yaitu pengamatan histologi (struktur gonad, telur atau spermatozoa) dengan bantuan mikroskop menggunakan teknik pewarnaan gonad.
Pengamatan atau seleksi terhadap jenis kelamin ikan dapat dilakukan dengan beberapa cara antara lain melihat morfologi alat kelain ikan (ciri primer) dan melihat ciri-ciri sekunder ikan seperti morfologi tubuh ikan (dimorfisme) dan warna ikan (dikromatisme). Namun baik cara pertama maupun kedua
memiliki kelemahan, yaitu pengamatan berdasarkan ciri seks primer akan mengalami kesulitan apabila ukuran ikan masih kecil karena pada saat itu alat kelamin ikan belum tampak jelas. Sedangkan kelemahan pengamatan ciri seks sekunder yaitu sering kali terkecoh dengan ciri-ciri sekunder pada ikan. Ikan yang tampak berkelamin jantan bisa jadi ikan tersebut mempunyai jenis kelamin betina ataupun hermaprodite (berjenis kelamin ganda) dan sebaliknya. Dari beberapa kelemahan kedua cara tersebut diatas, maka ada satu cara lain yang dipandang sebagai cara terbaik dan tepat untuk mengidentifikasi jenis kelamin ikan secara benar, yaitu dengan metode pewarnaan dan pengamatan gonad ikan secara langsung.
8.2 Maksud dan Tujuan
Maksud dari praktikum ini adalah untuk mengetahui jenis kelamin ikan dengan membuat pewarnaan pada preparat telur ikan.
Tujuan dari pada praktikum ini adalah untuk memperkenalkan kepada mahasiswa tentang teknik pewarnaan telur dan ciri-ciri gonad ikan jantan atau ikan betina.
8.3 Alat dan Bahan
Alat Sectio set Objek glass Kalkulator Bak Timbangan OZ Mikroskop binokuler Pipet tetes Nampan Telenan Pisau Lap basah Kamera digital Meteran jahit Seser Bahan Ikan mas (Cyprinus carpio) betina
Gonad Akuades Asetokarmin Kertas saring Kertas label Air tawar Trash bag Tisu
8.4 Skema kerja Ikan resipien
-Disiapkan
-Diamati seksual sekunder -Diukur TL
-Ditimbang berat tubuh -Dipotong kepala
-Dibedah dengan sectio set
-Dibersihkan organ-organnya (kecuali gonad) -Diamati gonadnya (letak, TKG, warna) Kertas saring
-Ditimbang Gonad
-Diletakkan diatas kertas saring -Ditimbang, dihitung GI dan GSI
GSI =
GI =
-Diambil sebagian
-Diletakkan diatas obyek glass -Dicacah
-Ditetesi asetokarmin
-Didiamkan selama 2-3 menit
-Ditutupi dengan cover glass dengan sedikit ditekan -Diamati di bawah mikroskop
-Didokumetasi Hasil
Keterangan
GSI = Gonad Somatic Indeks GI = Gonad Indeks
Wg = Berat gonad Wt = Berat tubuh ikan L3 = Panjang tubuh ikan
DAFTAR PUSTAKA
Arifin, H., W. Nofiza dan Elisma. 2012. Pengaruh pemberian jus buah naga (Hylocerus undatus) terhadap jumlah hemoglobin, eritrosit dan hematoksit pada gonad betina. Jurnal Sains dan Teknologi Farmasi. 17(2): 118-125.
Burhanuddin, A. I. 2014. Ikhtiologi Ikan dan Segala Aspek Kehidupannya. Deepublish. Yogyakarta. 421 hlm.
Coche, A. G., J. F. Munir and T. Laughlin. 1997. Management for Freshwater Fish Culture: Ponds and Water Practices. Food and Agriculture Organization of the United Nation. Rome. 233 hlm.
Elrifadah dan A. Rimalia. 2013. Aspek reproduksi ikan Seluang (Rasbora Spp.) yang tertangkap di perairan sungai Batang kabupaten Banyar Kalimantan Selatan. Media Sains. 5(1): 1-6.
Hartono, R., Y. Fenita dan E. Sulistyowati. 2015. Uji in vitro kecernaan bahan kering, bahan organik dan produksi N-NH3 pada kulit buah durian (Durio zibethinus) yang difermentasi jamur tiram putih (Pleurotus
ostreatus) dengan perbedaan waktu inkubasi. Jurnal Sain Peternakan Indonesia. 10(2): 87-94.
Hoar, W. S, and D. J. Randall. 1970. Fish Physiology: Volume 4 The Nervous System, Circulation, and Respiration. Academic Press INC. London. 467 hlm.
Isnaeni, W. 2006. Fisiologi Hewan. Kanisius. Yogyakarta: 113 hlm.
Lantu, S. 2010. Osmoregulasi pada hewan akuatik. Jurnal Perikanan Dan
Kelautan. 5(1): 46-51.
Mahyuddin, K. 2008. Panduan Lengkap Agribisnis Lele. Penebar Swadaya. Jakarta. hlm 12.
Mariskha, P. R. dan N. Abdulgani. 2012. Aspek reproduksi ikan kerapu macan (Epinephelus sexfasciatus) di perairan Glondonggede Tuban.
Jurnal Sains dan Seni ITS. 1(1): 27-32.
Pamungkas, W. 2012. Aktivitas osmoregulasi, respons pertumbuhan, dan energetic cost pada ikan yang dipelihara dalam lingkungan bersalinitas. Media Akuakultur. 7(1): 44-51.
Putra, D. A., Lisdiana dan T. A. Pribadi. 2014. Ramjet ventilation, perubahan struktur morfoloanatomi indang ikan Lele akibat paparan limbah cair pewarna batik. Unnes Journal of Life Science. 3(1): 53-59.
Rahardjo. M. F., D. S. Sjafel., R. Affandi dan Sulistiono. 2011. Iktiology. CV Lubuk Agung. Bandung. 395 hlm.
Rozik, M. 2014. Pengaruh Imunostimulan OMP terhadap sel hyaline dan hispatologi hepatopankreas udang windu (Penaeus monodon Fabricius) pasca uji tantang dengan Vibrio harveyi. Journal of Tropical Fisheries. 10(1): 750- 755.
Rumaharbo, H. 1999. Asuhan Keperawatan Klien dengan Gangguan Sistem Endokrin. Jakarta. Penerbit Buku Kedokteran EGC. 118 hlm. Sholichin, I., K. Haetami dan H. Suherman. 2012. Pengaruh penambahan tepung
rebon pada pakan buatan terhadap nilai chroma ikan mas koki (Carassius auratus). Jurnal Perikanan dan Kelautan. 3(4):185-190. Syakirin, M. B. 2007. Mekanisme pompa Natrium Kalium (Na+ - K+) pada
osmoregulasi ikan bertulang sejati (Teleost). Jurnal Ilmiah Perikanan
dan Kelautan. 1(1): 24-33.
Tambayong, J. 2000. Patofosiologi: Untuk Keperawatan. Penerbit Buku Kedokteran EGC. Jakarta 211 hlm.
DAFTAR NAMA DAN ALAMAT ASISTEN FHA 2017
No Nama NIM Alamat No. HP/ID Line
1. Diani Kusumaningrum 145080500111048 Jl. Sumbersari Gg. 4 No. 225 D 085955042092 @dianikusuma 2. Rangga Idris Affandi 145080500111018 Puri Nirwana Gajayana Kav. 18 089680306968 ranggaaidris 3. Siska Dwi Satya
Mariani 145080500111031 Jl. Sunan Ampel Gg. 3 No. 3 082338389378 siskasatya 4. Dea Shofura Wijayanti 145080500111045 Jl. Pisang Kipas Dalam No. 2E 082311721955 shofurawijayanti 5. Attaibatus Sholiha 145080501111002 Jl. Semanggi
Barat No.29
089622161926 Atta112495 6. Anissa Zalsabilla 145080500111028 Jl. Sumbersari
Gg. 2 No. 141
085735952563 Anissabilla 7. Billy Juliadi 145080501111073 Jl. Kumis
Kucing No. 2B 089669603246 Billyjul 8. Aninditya Nur Safitri 145080500111019 Jl. Watugong No.26 081357047376 9. Bella Intan Wahyuni 145080501111052 Tirtasani Estate Blok D-D2 085649344782 bellaintanwahyuni123 10. Desta Inas Fauziyah 145080507111008 Jl. Watugong No.16 082331440254 Destainass 11. Muhammad Nurfaiq Hibatullah 155080507111035 Jl. Kertorejo No. 31 087859730036 autistic.addiction 12. Bobi Novaliando 155080500111020 Villa Puncak
Tidar Blok M No.20
082132933261 bobinovaliando97 13. Diyan Nur Jayanti 155080501111037 Jl. Raya
Sumbersari 254 A
082234362626 diyannur_jay 14. Roichatul Jannah 155080500111005 Jl. Kedawung
Gg. XI No. 18 087701650675 hannajahcior 15. Elok Wasifah Jannati 155080507111023 Jl. Kerto Pamuji No. 18 082335511190 el_wasifah 16. Hendra Lesmana 155080500111074 Jl. Terusan
Piranha Atas No. 11 082244695314 hendralsm 17. Nafa Aulia Ramadani 155080501111039 Jl. Simpang Gajayana No. 49 082338062506 nafaxie 18. Bagus Ihsaan Indramaulana 155080500111065 Jl. Metro Perumahan Metro D 4 Batu 082257687365 bagusihsaan 19. Taufik Anshar Prayoga 155080500111040 Perumahan Poharin Blok H No. 171 085736712537 Ansharpt
TIM ASISTEN FISIOLOGI HEWAN AKUAKULTUR
KARTU KENDALI PRAKTIKUM
NAMA : NIM : NO TANGGAL MATERI PRAKTIKUM TANDA TANGAN KETERANGAN 1. 2. 3. 4. 5. 6. 7. 8. . Malang,
FOTO Koordinator Asisten
3X4
Diani Kusumaningrum 145080500111048