Bab II Tinjauan Pustaka
II.1 Pengertian Korosi
Korosi berasal dari bahasa latin ”corrous” yang berarti menggerogoti. Korosi didefinisikan sebagai berkurangnya kualitas suatu material (biasanya berupa logam atau campuran logam) sebagai akibat adanya interaksi dengan lingkungannya yang berlangsung secara berangsur-angsur yang dapat terjadi akibat interaksi secara fisika, kimia atau adanya pengaruh mahluk hidup (mikroorganisme) (Riggs, 1994 dalam Bundjali, 2005).
Pada umumnya korosi pada logam disebabkan oleh proses elektrokimia yang terjadi pada permukaan logam dan atau pada antarmuka logam/larutan. Dalam sel korosi, logam yang terkorosi mengalami reaksi oksidasi (berlaku sebagai anoda, logam melarut menjadi ion-ion atau menjadi lapisan oksida/senyawa lain yang tidak larut) dan zat lain dari lingkungannya mengalami reduksi (sebagai katoda yang menerima elektron yang dilepaskan logam). Reaksi redoks yang berlangsung secara spontan dalam sistem tersebut dimungkinkan karena terbentuknya sirkuit tertutup hubungan pendek dengan adanya penghubung listrik antara anoda dan katoda. Penghubung listrik tersebut berupa penghantar elektrolitik dan penghantar elektronik.
II.2 Karakteristik Jenis Korosi
Berdasarkan bentuk pemicunya, serangan korosi dapat dibedakan menjadi beberapa jenis, yaitu :
a. Korosi umum/korosi seragam. Suatu bentuk korosi yang menghasilkan serangan seragam pada seluruh permukaan logam. Seringkali dikaitkan dengan korosi di lingkungan atmosfir dan oksidasi pada suhu tinggi atau serangan sulfidasi.
b. Korosi bentuk lubang/sumuran. Suatu serangan korosi terlokalisasi yang berbentuk lubang sumuran dengan kedalaman, ukuran dan jumlah lubang persatuan luas permukaan logam yang bervariasi. Sebagai pemicu terjadinya serangan korosi ini adalah faktor-faktor metalurgi yang telah disebutkan di atas.
c. Korosi celah. Termasuk jenis korosi lokal yang berkaitan dengan adanya sevolume kecil larutan diam/terperangkap pada bagian sambungan, endapan di permukaan dan celah-celah di bawah baut dan kepala paku. Baja nirkarat dan sejumlah aliasi logam nikel adalah rentan terhadap jenis korosi ini.
d. Serangan korosi antar butiran (intergranular attack). Korosi yang dimulai dari batas butiran di dalam logam disebabkan karena perlakuan panas awal dan berkaitan dengan kimia aliasi spesifik.
e. Korosi galvanik sel korosi terbentuk dari penggandengan dua logam berbeda jenis. Sejalan dengan deret galvanik logam yang lebih aktif (potensial reduksi bernilai negatif) akan menjadi anoda, sedangkan logam yang lebih mulia akan menjadi katoda. Laju korosi logam yang lebih aktif akan mengalami percepatan, sedangkan logam yang lebih mulia akan mengalami hambatan. f. Korosi erosi. Adanya aliran zat padat, cairan atau gas dapat membantu dan
mempercepat terjadinya korosi yang meliputi bentuk-bentuk kerusakan seperti tumbuk gerusan dan erosi.
g. Korosi tegang retak (stress corrosion cracking, SCC). Inisiasi dan perambatan retakan intergranular atau transgranular yang diakibatkan oleh lingkungan korosif secara serentak dengan adanya tegangan tarik statik pada logam atau paduan logam. Pada umumnya kerentanan logam terhadap peretakan meningkat dengan naiknya suhu.
II.3 Material Uji
Material uji yang digunakan dalam penelitian ini adalah sampel paduan logam bahan konstruksi runner turbin (bekas pakai di PLTA). Komposisi paduan logam ini adalah : Cu 62,79% dan Zn 37,17% sedangkan unsur lainnya sangat kecil (<0,04%) (Lampiran B). Paduan campuran logam dengan komposisi tersebut
sering disebut sebagai material ”kuningan” (brass) yang selanjutnya disebut sebagai Cu-37Zn.
Pengaruh lingkungan terhadap gejala korosi pada kuningan (Cu-37Zn) sangat menarik untuk dipelajari, karena informasi tentang korosi yang terjadi pada
runner turbin yang terbuat dari material kuningan masih sangat sedikit. Dari
beberapa literatur diketahui bahwa material dengan kandungan Cu cukup besar termasuk campuran logam dengan ketahanan korosi sangat tinggi.
Masalah yang sering muncul pada kuningan yang mengandung campuran lebih dari 15% seng adalah adanya peluruhan seng (dezincification) sebagai akibat adanya pengaruh lingkungan yang mengandung sulfida yang tinggi. Proses hilangnya seng biasanya dipercepat oleh tingginya temperatur dan naiknya kandungan klorida. Sedangkan dalam sistem–sistem air masalah utama yang dihadapi oleh paduan–paduan tembaga adalah korosi aerasi–diferensial, korosi erosi, korosi retak tegang. Korosi aerasi-diferensial pada dasarnya merupakan masalah perancangan meskipun korosi sumuran mungkin saja terjadi jika ada tempat yang laju alirannya sangat rendah sehingga permukaan logam kekurangan oksigen. Korosi erosi merupakan efek sinergis kerusakan akibat korosi dan erosi. Efek kerusakan ini dipengaruhi oleh laju aliran zat cair ketika melewati katup dan pompa yang dapat menimbulkan kerusakan berupa peronggaan, sementara gelembung–gelembung udara yang terjebak atau partikel–partikel abrasif akan merusak selaput pelindung permukaan dan menimbulkan ceruk–ceruk dangkal berbentuk tapal kuda. Sedangkan korosi tegang retak dapat disebabkan oleh keberadaan ion–ion amonium dan ion–ion sianida.
II.4 Spektroskopi Impedansi Elektrokimia (EIS)
Spektroskopi Impedansi Elektrokimia juga sering dikenal dengan sebutan
Electrochemical Impedance Spectroscopy, (EIS) merupakan suatu teknik
eksperimental elektrokimia yang memiliki peranan khusus dalam kajian korosi karena perilaku korosi merupakan proses elektrokimia. Kajian kinetika sistem
elektrokimia termasuk sistem korosi dapat dilakukan dengan menggunakan teknik pengukuran dan pemrosesan data digital yang sering disebut analisis sinyal digital atau analisis sistem dinamik. Analisis sistem dinamik dalam elektrokimia dengan teknik impedansi arus bolak balik pertama kali diungkapkan oleh Epelboin dkk., pada tahun 1960, meskipun daerah pengukurannya masih dalam daerah frekuensi yang sempit. Saat ini jangkauan frekuensi yang dapat diukur sudah lebih lebar sekitar 10 orde besarnya, terutama diperluas ke daerah frekuensi rendah. Hal ini sangat bermanfaat terutama untuk mengikuti kinetika proses yang berlangsung sangat lambat yaitu pada sistem korosi yang terinhibisi dengan sangat baik atau pada korosi logam–logam yang memiliki ketahanan korosi cukup tinggi. Peralatan modern ini terdiri atas penganalisis frekuensi, penganalisis spektrum yang dikombinasikan dengan divais pengatur digital untuk antarmuka sel elektrokimia dan sistem komputer yang berfungsi mengumpulkan dan menganalisis data eksperimen.
Spektroskopi impedansi elektrokimia (EIS) merupakan suatu teknik analisis in
situ yang digunakan untuk penyelidikan proses elektrokimia dan sistem korosi.
Pada prinsipnya EIS dapat menentukan sejumlah parameter yang berkaitan dengan kinetika elektrokimia, termasuk di dalamnya tahanan polarisasi (Rp), tahanan larutan (Rs), kapasitansi lapisan rangkap (double layer), (CDL).
Karena besarnya arus korosi (icorr) berbanding lurus dengan laju korosi, maka
berdasarkan Persamaan Stern-Geary yang memberikan kaitan langsung antara arus korosi keadaan mantap dan tahanan searah yang melewati antarmuka :
βa dan βc adalah tetapan-tetapan Tafel berturut-turut untuk bagian reaksi anodik
dan bagian reaksi katodik, dan Rp adalah tahanan polarisasi (Ω.cm2). Ungkapan
Persamaan II.1 menunjukkan bahwa besarnya laju korosi akan berbanding terbalik dengan besarnya tahanan polarisasi (Rp) permukaan material uji.
Rp 1 ) c β a β ( 303 , 2 c β . a β icorr + = (II.1)
Penggunaan metode perata–rataan sinyal dapat memperbesar tingkat ketepatan dan ketelitian yang diinginkan, dengan lebar jangkauan frekuensi (106 – 10-4 Hz) memungkinkan dilakukan penelitian yang terjadi pada proses–proses antarmuka pada daerah yang lebar. Keistimewaan inilah yang menjadi keunggulan karakteristik kinerja teknik eksperimen ranah waktu, oleh karena itu EIS menjadi suatu metode pengukuran yang berkembang pesat untuk penyelidikan mekanisme reaksi antarmuka dan untuk penentuan laju korosi secara in situ. Selain itu keunggulan EIS adalah dapat digunakan untuk mengidentifikasi terjadinya pasifasi dan lapisan selaput berpori pada permukaan logam serta mampu menganalisis secara non–destruktif pada berbagai jenis baterai.
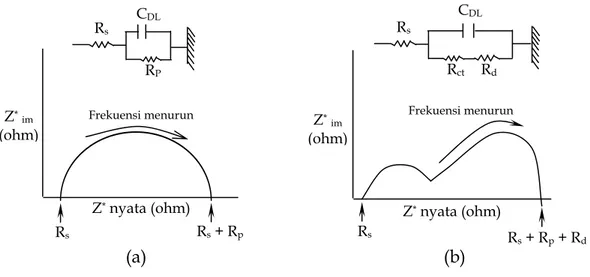
Inti dari pendekatan dengan teknik pengukuran spektroskopi impedansi elektrokimia berdasarkan pengertian bahwa : arus listrik yang mengalir melintasi suatu antarmuka logam dan larutan dipandang sebagai bagian dari reaksi elektrokimia yaitu proses transfer muatan dan bagian dari proses yang membentuk antarmuka bermuatan. Oleh karena itu suatu sistem antarmuka elektroda / larutan dapat dipandang sebagai susunan komponen listrik yang terdiri atas sejumlah resistor dan kapasitor listrik. Gambar II.3 menggambarkan model sirkuit sistem elektrokimia logam yang tercelup dalam larutan elektrolit. Gambar II.3 (a) menunjukkan pada antarmuka logam dengan larutan terdapat tahanan polarisasi, Rp, sedangkan pada Gambar II.3 (b) menunjukkan adanya hambatan transfer
muatan, Rct, dan hambatan difusi, Rd, paralel dengan lapisan rangkap listrik yang
dinyatakan oleh adanya kapasitansi lapis rangkap, CDL dan secara seri dengan
hambatan listrik larutan yang dinyatakan sebagai Rs. Spektrum EIS berupa aluran
Nyquist terlukiskan di bawah masing – masing sirkuit ekivalen.
Aluran Nyquist merupakan diagram datar impedansi kompleks yang mengalurkan komponen impedansi imaginer (Zim) terhadap komponen impedansi nyata (Zreal).
Untuk suatu antarmuka situasi elektrokimia paling sederhana dengan tahanan polarisasi, terdiri atas proses pemindahan muatan dan kapasitansi lapisan rangkap listrik.
Besarnya impedansi total diungkapkan dengan Persamaan (II.2) sebagai berikut :
dengan j = (– 1)1/2, ω*, adalah frekuensi pada maksimum setengah lingkaran pada Gambar II.3 (a), dan C, adalah kapasitansi yang diturunkan dari nilai maksimum impedansi imaginer dengan ungkapan :
dengan f adalah frekuensi dalam hertz.
Gambar II.3 (a). Spektrum EIS aluran Nyquist untuk reaksi antarmuka yang dikendalikan oleh hambatan perpindahan muatan listrik, dan (b). Aluran Nyquist untuk reaksi antarmuka yang dikendalikan proses difusi. (Bundjali, 2005).
II.5 Inhibitor Korosi
Suatu inhibitor korosi adalah senyawa kimia yang pada konsentrasi rendahpun sudah berfungsi secara efektif menurunkan, atau mencegah reaksi pelarutan logam oleh lingkungannya yang bersifat korosif. Inhibitor ini dapat digolongkan menjadi inhibitor anorganik dan organik, namun inhibitor yang dipakai dalam penelitian
Rs + Rp Rs Z* nyata (ohm) Z*im (ohm) Frekuensi menurun Rs RP CDL (a) Z*im (ohm) Rs Rct CDL Rd Rs + Rp + Rd Rs Z* nyata (ohm) Frekuensi menurun (b) (II.3) maks im Z f π 4 1 = C (II.2) 2 2 * 2 * 2 2 * 1 + 2ω C .R R . C jω -R . C 2ω + 1 R = Z
ini adalah inhibitor organik. Alasan pemilihan inhibitor ini karena luasnya penggunaan inhibitor ini dalam pencegahan korosi logam–logam dan inhibitor ini lebih mudah terdegradasi, sehingga tidak mencemari lingkungan, sedangkan inhibitor anorganik bergantung kationnya dapat mencemari lingkungan bila terakumulasi.
Suatu inhibitor senyawa organik dapat digolongkan sebagai inhibitor anodik, inhibitor katodik, atau campuran keduanya, tergantung pada pengaruhnya terhadap reaksi–reaksi elektrodik di permukaan logam yang diamati dari pergeseran potensial korosi.
Bila dengan teradsorpsinya molekul–molekul inhibitor pada permukaan logam menyebabkan potensial korosi bergeser ke arah positif, hal ini menunjukkan bahwa inhibitor tersebut terutama menghambat proses anodik, sebaliknya pergeseran potensial korosi ke arah negatif menunjukkan bahwa inhibitor tersebut terutama menghambat proses katodik. Bila inhibitor korosi mampu menurunkan laju korosi dan hanya terjadi sedikit perubahan dalam potensial korosi logam, hal ini menunjukkan inhibitor tersebut menghambat reaksi anodik maupun reaksi katodik (Riggs, 1994 dalam Bundjali, 2005).
II.5.1 Inhibitor Benzotriazol (BTAH)
Salah satu cara untuk menurunkan laju korosi secara signifikan dapat digunakan inhibitor tipe adsorpsi, yang dapat larut dalam air tetapi tidak menstabilkan emulsinya, tidak beracun dan tidak membahayakan bagi lingkungan.
Benzotriazol adalah salah satu jenis inhibitor korosi yang efektif dan paling banyak digunakan sebagai inhibitor untuk korosi tembaga (Mator dkk. 2001 dan Yu dkk. 2003) (dalam Yatiman, 2006) pada berbagai variasi larutan, suhu dan daerah pH (Ismail, 2007) dan paduannya (Ammeloot dkk. 1999 dan Walker, 2000) (dalam Yatiman, 2006).
Berdasarkan hasil penelitian, benzotriazol diketahui termasuk inhibitor tipe adsorpsi (Eldakar dan Nobe, 1981), dapat larut dalam air (Jintukar dkk., 1998) dan dalam minyak (yang merupakan campuran zat–zat non polar) akan tetapi memiliki toksisitas yang tinggi (Ismail, 2007) sehingga limbahnya akan sangat berbahaya bagi lingkungan.
Benzotriazol mempunyai rumus molekul C6H5N3, dengan struktur sebagai
berikut:
Benzotriazol merupakan zat padat berwarna kuning hingga warna antara abu-abu dan coklat, mempunyai titik lebur 95°C – 99°C, titik didih 350°C, densitas 1,36 g.cm-3 dan kelarutan dalam air 25 g.L-1 pada 20°C (MSDS Benzotriazol, 2005). Benzotriazol adalah senyawa organik yang mengandung atom nitrogen (N) dan ikatan rangkap sebagai pusat adsorpsi, yang memudahkan adsorpsi pada permukaan logam.
Benzotriazol secara keseluruhan molekulnya adalah netral tapi masing-masing atom nitrogen pada cincin triazol memiliki dua elektron yang tidak berpasangan menyebabkan cincin cenderung bermuatan negatif sejalan dengan yang dikemukakan oleh Ling dkk. (Ling dkk., 1995). Oleh karena itu dalam penelitian ini benzotriazol adalah cincin triazol yang cenderung bermuatan negatif dalam larutan yang diduga akan tertarik ke permukaan logam yang terkorosi, menempel dengan kuat pada permukaan dan permukaan membentuk lapisan/selaput protektif dari hasil adsorpsi molekul benzotriazol untuk melindungi logam terhadap korosi lebih lanjut. Selain itu adanya elektron-elektron yang tidak berpasangan pada atom-atom nitrogen dalam cincin triazol dapat membentuk ikatan dengan orbital d
Benzotriazol
N N N H
atom Cu pada permukaan. Dengan demikian benzotriazol diduga dapat menghambat laju korosi logam tembaga.
Besarnya laju korosi dan efisiensi inhibisinya akan sangat bergantung pada konsentrasi benzotriazol (Eldakar dan Nobe, 1977 dan 1981, Ling dkk., 1995, Babic dkk., 1999, Bastidas dkk., 2002 dan Yu dkk., 2003), temperatur (Bastidas dkk., 2002 dan Yu dkk., 2003) dan waktu pemaparan (waktu kontak antara logam dengan larutan yang mengandung benzotriazol) (Eldakar dan Nobe, 1997 dan 1981, Ling dkk., 1995, Babic dkk., 1999 dan Yu dkk., 2003) (dalam Yatiman, 2006).
II.5.2 Inhibitor Sistein (Cys)
Asam amino merupakan senyawa organik yang tidak beracun, senyawanya dapat larut dalam media yang mengandung air, dapat diproduksi dengan tingkat kemurnian tinggi dan biaya yang relatif murah (Matos dkk., 2004). Hal ini yang menjadi dasar pertimbangan penulis menggunakan sistein sebagai inhibitor korosi pada penelitian ini.
Sistein merupakan α-asam amino yang memiliki rumus kimia C3H7NO2S dengan
massa molekulnya 121,16 g/mol (nama IUPAC :
(2R)-2-amino-3-sulfanyl-propanoic acid) memiliki rumus struktur :
Sistein merupakan salah satu inhibitor korosi yang efektif pada korosi tembaga dalam medium netral dan asam klorida (dalam medium NaCl mencapai 77% dan dalam medium HCl mencapai 84%) dan sistein termasuk senyawa organik yang ramah lingkungan (Ismail, 2007).
Sistein S H OH O N H2
Sistein dalam bentuk zwitter ion S H O -O N H3 +
Sistein (C3H7NO2S) dapat memiliki tiga tetapan dissosiasi proton (pKCOOH = 1,9,
pKNH3+ = 8,16 and pKSH = 10,25) jika terionisasi dalam larutan mengandung air,
ionisasi asam amino akan sangat tergantung pada pH. Pada pH isoelektrik molekul sistein berada dalam keadaan tidak bermuatan. Struktur zwiter ion dari sistein paling dominan pada daerah pH antara 1,9 dan 8,16, di bawah atau di atas
pH tersebut, molekul sistein akan dominan sebagai kation atau anion.
Matos dkk. (2004), telah mempelajari efek sistein pada proses penghambatan reaksi anodik logam tembaga dalam medium asam sulfat pada suhu kamar menggunakan metode elektrokimia. Matos dkk. (2004), mengusulkan mekanisme penghambatan reaksi anodik logam tembaga dalam medium asam sulfat tanpa kehadiran sistein ketika potensial lebihnya rendah terjadi dengan cara pembentukan ”senyawa antara” Cu(I)Ads pada permukaan tembaga. Keberadaan
sistein sebagai inhibitor mulai efektif dari fase ”senyawa antara” sampai membentuk film tipis pada permukaan logam ketika konsentrasi sistein lebih tinggi (0,001 dan 0,01mol/L) dengan membentuk ikatan Cu(I)-Cys kompleks. Pada konsentrasi rendah, sistein dapat terikat pada permukaan logam Cu tetapi tidak dapat membentuk kompleks.