5 BAB II
TINJAUAN PUSTAKA 2.1 Ekosistem Mangrove
Mangrove merupakan hutan lahan basah pesisir yang terdapat pada zona intertidal pada estuari, delta, anak sungai, laguna, rawa-rawa, lumpur khususnya di daerah tropis dan subtropis. Daerah spesifik tempat tanaman mangrove tumbuh dinamakan sebagai ekosistem mangrove (Sahoo et al. 2008). Sebagai salah satu ekosistem pesisir, hutan mangrove merupakan ekosistem yang unik dan rawan. Ekosistem ini mempunyai fungsi ekologis dan ekonomis. Fungsi ekologis hutan mangrove antara lain sebagai pelindung garis pantai, mencegah intrusi air laut, habitat, tempat mencari makan (feeding ground), tempat asuhan dan pembesaran (nursery ground), tempat pemijahan (spawning ground) bagi aneka biota perairan, serta sebagai pengatur iklim mikro. Fungsi ekonomisnya antara lain: penghasil keperluan rumah tangga, penghasil keperluan industri dan penghasil bibit.
Hutan mangrove adalah sebutan umum yang digunakan untuk menggambarkan suatu varietas komunitas pantai tropik yang didominasi oleh beberapa spesies pohon-pohon yang khas atau semak-semak yang mempunyai kemampuan untuk tumbuh pada perairan asin. Hutan mangrove meliputi pohon-pohon dan semak yang tergolong ke dalam 8 famili, dan terdiri atas 12 genera tumbuhan berbunga: Avicennia, Sonneratia, Rhizopora, Bruguiera, Ceripos, Xilocarpus, Lummitzera, Laguncularia, Aegiceras, Aegiatilis, Snaeda dan Conocarpus (Bengen, 2000 dalam Rochana, 2012).
6
Ekosistem mangrove adalah suatu sistem di alam tempat berlangsungnya kehidupan yang mencerminkan hubungan timbal balik antara makhluk hidup dengan lingkungannya dan di antara makhluk hidup itu sendiri, terdapat pada wilayah pesisir, dipengaruhi pasang surut air laut, dan didominasi oleh spesies pohon atau semak yang khas dan mampu tumbuh pada perairan asin/payau (Santosa, 2000 dalam Rochana, 2012).
Struktur dan fungsi ekosistem mangrove, komposisi dan distribusi spesies, serta pola pertumbuhan organisme mangrove sangat tergantung pada faktor-faktor lingkungan. Faktor lingkungan yang mempengaruhi mangrove dalam jangka panjang adalah fluktuasi pasang surut dan ketinggian rata-rata permukaan laut. Secara umum faktor yang mempengaruhi ekosistem mangrove mencakup: topografi dan fisiografi pantai, tanah, oksigen, nutrien, iklim, cahaya, suhu , curah hujan, angin dan gelombang laut, pasang-surut laut, serta salinitas.
Ekosistem mangrove yang terdapat di Desa Bulalo, Kecamatan Kwandang, Kabupaten Gorontalo Utara, Provinsi Gorontalo, terdiri dari 10 spesies yakni Rhizophoraapiculata Blume, Rhizophora mucronata Lamk., Ceriops tagal (Perr) C.B.Rob, Bruguiera parviflora (Roxb) W & A, Bruguiera gymnorrhiza (L) Lamk, Sonneratia alba J.E. Smith, Sonneratia caseolaris (L) Eng, Xylocarpus granatum Koen (niri), Avicennia alba Blume dan Avicennia marina (Forsk) Vierh (Katili, 2009). Selain itu kawasan ini didominasi oleh spesies Rhizophora apiculata Blume dan Rhizophora mucronata Lamk dengan pola zonasi yakni jenis Rhizophora (Rhizophora mucronata Lamk dan Rhizophora apiculata Blume) pada lapisan terluar. Selanjutnya zona Soneratia yang didampingi oleh jenis
7
Bruguiera dan Ceriops tagal, dan lapisan terakhir adalah zona Avicennia dan zonasi Xylocarpus granatum Koen (Katili, 2009).
2.1.2 Zonasi Mangrove
Ekosistem mangrove dapat tumbuh dengan baik pada zona pasang-surut di sepanjang garis pantai daerah tropis seperti laguna, rawa, delta, dan muara sungai. Ekosistem mangrove bersifat kompleks dan dinamis tetapi labil. Kompleks, karena di dalam ekosistem mangrove dan perairan maupun tanah di bawahnya merupakan habitat berbagai jenis satwa daratan dan biota perairan. Dinamis, karena ekosistem mangrove dapat terus tumbuh dan berkembang serta mengalami suksesi serta perubahan zonasi sesuai dengan tempat tumbuh. Labil, karena mudah sekali rusak dan sulit untuk pulih kembali (Kusmana, 1995) dalam Talib (2008). Pertumbuhan mangrove akan menurun jika suplai air tawar dan sedimen rendah. Keragaman jenis hutan mangrove secara umum relatif rendah jika dibandingkan dengan hutan alam tipe lainnya, hal ini disebabkan oleh kondisi lahan hutan mangrove yang senantiasa atau secara periodik digenangi oleh air laut, sehingga mempunyai salinitas yang tinggi dan berpengaruh terhadap keberadaan jenisnya. Jenis yang dapat tumbuh pada ekosistem mangrove adalah jenis halofit, yaitu jenis-jenis tegakan yang mampu bertahan pada tanah yang mengandung garam dari genangan air laut. Kondisi-kondisi lingkungan luar yang terdapat di kawasan mangrove cenderung bervariasi di sepanjang gradien dari laut ke darat. Banyak spesies mangrove telah beradaptasi terhadap gradien ini dengan berbagai cara, sehingga di dalam suatu kawasan suatu spesies mungkin tumbuh secara lebih efisien daripada spesies lain, tergantung pada kombinasi dari kondisi
8
kimia dan fisik setempat. Oleh karena itu jalur atau zona dari spesies tunggal atau asosiasi sederhana sering kali berkembang di sepanjang garis pantai. Faktor lainnya seperti toleransi keteduhan, metoda penyebaran tumbuhan mangrove muda serta predasi juga akan berpengaruh terhadap pen-zonaan.
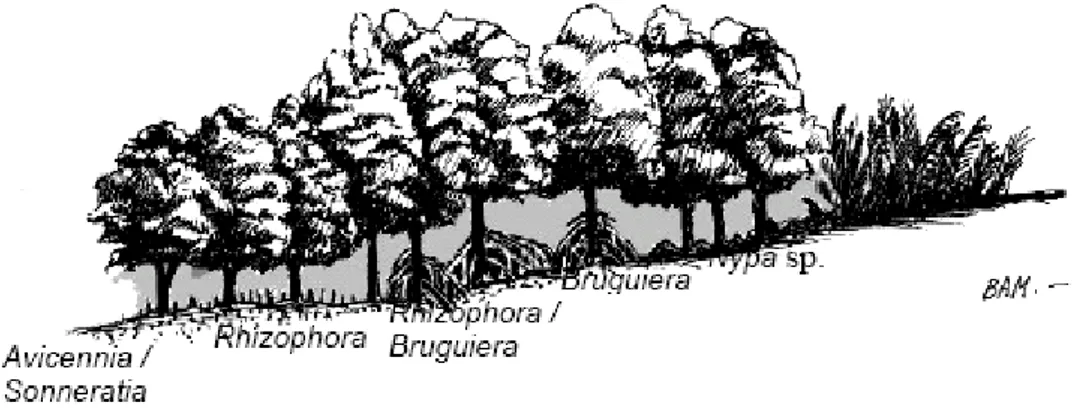
Gambar 1. Pola Zonasi Mangrove (Bengen, 2004, dalam Talib, 2008) Watson (1928) dalam Talib (2008) berpendapat bahwa hutan mangrove dapat dibagi menjadi lima bagian (gambar.1) berdasarkan frekuensi air pasang, yaitu; zonasi yang terdekat dengan laut, akan didominasi oleh Avicennia spp dan Sonneratia sp, tumbuh pada lumpur lunak dengan kandungan organik yang tinggi. Avicennia sp tumbuh pada substrat yang agak keras, sedangkan Avicennia alba tumbuh pada substrat yang agak lunak; zonasi yang tumbuh pada tanah kuat dan cukup keras serta dicapai oleh beberapa air pasang. Zonasi ini sedikit lebih tinggi dan biasanya didominasi oleh Bruguiera cylindrica; ke arah daratan lagi, zonasi yang didominasi oleh Rhizophora mucronata dan Rhizophora apiculata. Jenis Rhyzophora mucronata lebih banyak dijumpai pada kondisi yang agak basah dan lumpur yang agak dalam. Pohon ini dapat tumbuh dengan ketinggian 35-40 m. Pohon lain yang juga terdapat pada hutan ini mencakup Bruguiera parviflora dan
9
Xylocarpus granatum; hutan yang didominasi oleh Bruguiera parviflora kadang-kadang dijumpai tanpa jenis pohon lainnya; hutan mangrove di belakang didominasi oleh Bruguiera gymnorrhiza. Menurut Bengen dan Dutton (2004) dalam Talib (2008) zonasi mangrove dipengaruhi oleh salinitas, toleransi terhadap ombak dan angin, toleransi terhadap lumpur (keadaan tanah), serta frekuensi tergenang oleh air laut. Zonasi ini menggambarkan tahapan suksesi yang sejalan dengan perubahan tempat tumbuh. Perubahan tempat tumbuh sangat bersifat dinamis yang disebabkan oleh laju pengendapan atau pengikisan. Daya adaptasi tiap jenis akan menentukan komposisi jenis tiap zonasi, termasuk tanaman Rhizophora sp.
2.1.3 Rhizophora sp. sebagai Salah Satu Jenis Tumbuhan Mangrove
Rhizophora sp. merupakan salah satu jenis hutan bakau yang berkembang di bawah berbagai kondisi pasang surut, termasuk berbagai tingkat salinitas. Rhizophora sp. mentolerir berbagai kondisi seperti banjir, jenis tanah, dan faktor fisik lainnya. Rhizophora sp. umumnya memiliki ukuran yang jauh lebih pendek dari yang lainnya, yakni sekitar 5-8 m (16-26 kaki), diameter batang berkisar 15-35 cm, akar tunjang besar dan berkayu dan akar udara yang tumbuh dari percabangan bagian bawah.
Rhizophora sp. memiliki batang yang berdiameter hingga 70 cm dengan kulit kayu
berwarna gelap hingga hitam dan celah horizontal. Daun berkulit, gagang daun berwarna hijau dengan panjang 2,5-5,5 cm. Pinak daun terletak pada pangkal gagang daun berukuran 5.5-8,5 cm. Unik dan letak; sederhana dan berlawanan, bentuk; elips melebar hingga bulat memanjang. Ujung; meruncing, ukuran: 11-23x 5-13 cm.
Gagang kepala bunga seperti cagak bersifat biseksual, masing-masing menempel pada gagang individu yang panjangnya 2,5-5 cm. letak: di ketiak daun.
10
Formasi: kelompok (4-8 bunga per kelompok). Daun mahkota: 4; putih ada rambut. 9 mm kelopak bunga: 4; kuning, pucat panjangnya 13-19 mm. benang sari; 8 tak bertangkai. Buah lonjong panjang hingga berbentuk telur berbentuk telur 5-7 cm, berwarna hijau kecoklatan, seringkali kasar dibagian pangkal, berbiji tunggal. Hipokotil silindris, kasar dan berbintil. Leher kotiledon kuning ketika matang. Ukuran hipokotil: panjang 36-70 cm dan diameter 2-3 cm.
Rhizophora sp. memiliki tipe biji vivipar (biji atau benihnya telah berkecambah sebelum buahnya gugur dari pohon), berbiji tunggal. Hipokotil silindris, kasar dan berbintil (Setyabudi, 2007). Dalam sistem klasifikasi Rhizophora sp. termasuk dalam:
Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Rhizophorales Family : Rhizophoraceae Genus : Rhizophora Species : Rhizophora sp. (Setyabudi, 2007)
2.2 Kajian Tentang Actinomycetes
Actinomycetes merupakan mikroorganisme tanah yang umum dijumpai pada berbagai jenis tanah (Alexander, 1961; Elberson et al.,2000 dalam Kanti, 2005).
2.2.1 Pengertian Actinomycetes
Actinomycetes adalah bakteri gram positif anaerob atau fakultatif yang membentuk filamen bercabang atau hifa dan spora aseksual (Rollin dan Josep, 2000 dalam Ambarwati, 2007). Actinomycetes pada awalnya merupakan kelompok intermediet antara bakteri dan fungi tetapi sekarang dimasukkan
11
kedalam organisme prokaryotik karena memiliki nukleid yang sama dengan bakteri. Selain itu, chitin dan selulosa sebagai penyusun dinding sel fungi tidak terdapat pada Actinomycetes. Penyusun dinding sel Actinomycetes adalah polimer gula, gula amino, dan beberapa asam amino seperti halnya bakteri gram positif (Locci et al, 1983 dalam Sunaryanto 2011). Berdasarkan klasifikasinya, Actinomycetes termasuk kelas Schizomycetes, ordo Actinomycetales yang dikelompokkan menjadi empat familia, yaitu: Mycobacteriaceae, Actinomycetaeceae, Streptomyceae, dan Actinoplanaceae. Genus yang paling banyak dijumpai adalah Streptomyces (hampir 70%), Nocardia, dan Micronospora. Pengamatan di bawah mikroskop menunjukkan adanya miselium ramping bersel satu yang bercabang membentuk spora aseksual untuk perkembang biakannya (Lechevalier, 1967 dalam Kanti, 2005)
2.2.2. Karakteristik Actinomycetes
Actinomycetes hidup sebagai safrofit dan aktif mendekomposisi bahan organik, sehingga dapat meningkatkan kesuburan tanah (Nonomura dan Ohara, 1969a,b dalam Kanti, 2005). Jenis Actinomycetes tergantung pada tipe tanah, karakteristrik fisik, kadar bahan organik, dan pH lingkungan. Jumlah Actinomycetes meningkat dengan adanya bahan organik yang mengalami dekomposisi (Nonomura dan Ohara, 1971a,b,c,d dalam Kanti, 2005). Temperatur yang cocok untuk pertumbuhan Actinomycetes adalah 25-30oC, tetapi pada suhu 55-65oC Actinomycetes masih dapat tumbuh dalam jumlah cukup besar, khususnya genus Thermoactinomyces dan Streptomyces (Rao, 1994 dalam Kanti, 2005). Rentang pH yang paling cocok untuk perkembangbiakan Actinomycetes
12
adalah antara 6,5-8,0. Tanah yang tergenang air tidak cocok untuk pertumbuhan Actinomycetes, sedangkan tanah gurun yang kering atau setengah kering dapat mempertahankan populasi dalam jumlah cukup besar, karena adanya spora (Nonomura dan Ohara, 1971a,b,c,d; Alexander, 1961 dalam Kanti, 2005)
Actinomycetes tersebar di alam baik secara alami maupun lingkungan buatan manusia dan memegang peran penting dalam biodegradasi bahan organik. Actinomycetes juga dikenal sebagai penghasil antibiotik dan molekul bioaktif yang sangat penting dalam dunia industry, pertanian, kehutanan, dan industri obat-obatan. Densitas populasi Actinomycetes pada lingkungan laut pada umumnya lebih sedikit dibandingkan lingkungan terestrial. Beberapa Actinomycetes yang berhasil diisolasi dari ekosistem mangrove diketahui mempunyai aktivitas sebagai antimikroba yang dapat menghambat pertumbuhan bakteri gram positif maupun gram negatif (Sahoo et al. 2008). Ravikumar et al. (2011) berhasil mengisolasi 17 Actinomycetes endofitik dari tanaman Avicennia marina, Bruguiera cylindrica, Rhizophora mucronata, Salicornia brachiata dan Suaeda monoica, dari ekosistem mangrove Karangkadu dan 10 isolat di antaranya menunjukan aktivitas antibakteri. Ravikumar et al.(2011) juga berhasil menunjukkan bahwa diversitas Actinomycetes pada daerah rhizosfer khususnya tanaman Achrosstichum aereum lebih besar daripada daerah di luar rhizosfer khususnya pada ekosistem mangrove di Manakkudi India. Kurniati Ari (2011) berhasil mengisolasi 16 jenis Actinomycetes halotoleran dari kawasan mangrove Segara Anakan Cilacap.
13
2.2.3 Jenis-jenis Actinomycetes dan Antibiotik yang Dihasilkan
Ketika mulai diterapkan teknik isolasi konvensional, kebanyakan isolat yang berhasil diisolasi melalui agar plate dan diidentifikasi sebagai genus streptomyces, merupakan genus yang dominan di tanah. Beberapa faktor yang harus diperhatikan untuk tujuan skrening molekul bioaktif baru adalah pemilihan sumber skrining, perlakukan awal, medium selektif, dan kondisi kultur (Sateesh et al. 2011)
Actinomycetes penting sebagai penghasil antibiotik, hampir tiga perempat dari antibiotik yang ada merupakan produksi dari Actinomycetes, khususnya adalah Streptomyces merupakan genus yang paling produktif dan dapat menghasilkan metabolit sekunder aktif yang lainnya. Hampir sekitar 80% dari total antibiotik adalah produksi dari kelompok Streptomyces. Kelompok Micromonospora juga merupakan penghasil antibiotik tetapi tidak sebanyak streptomyces (Sateesh et al, 2011). Di samping antibiotik, Actinomycetes juga mampu menghasilkan metabolit sekunder lain yaitu agen anti tumor, agen immunosupresif dan enzim. Metabolit tersebut juga potensial sebagai antibakteri, antifungi, neuritogenik, anti kanker, anti alga, anti malaria dan memiliki aktivitas antiinflamasi (Ravikumar et al. 2011). Oleh karena kepentingannya yang sangat besar, maka mulai difokuskan untuk melakukan isolasi jenis Actinomycetes yang baru dari lingkungan terestrial. Di samping itu mulai dikembangkan juga isolasi Actinomycetes dari lingkungan lain, khususnya lingkungan yang ekstrim, misalnya perairan laut.
14
Bukti awal yang mendukung keberadaan Actinomycetes laut berasal dari adanya dekskripsi Rhodococcus marinonascene yang merupakan spesies Actinomycetes pertama yang berhasil dikarakterisasi. Data terbaru menunjukkan adanya beberapa genera Actinomycetes yang asli dari laut yaitu: Dietzia, Rhodococcus, Streptomyces, Salinispora, Arinophilus, Solwaraspora, Salinibacterium, Aeromicrobium marinum, Williamsia maris dan Verrucosispora (Kin S Lam, 2006).
Grossart et al. (2004) menggambarkan bahwa kurang lebih 10% dari jumlah Actinomycetes mampu membentuk koloni dengan bakteri laut membentuk agregat organik dan aktivitas antagonistik berpengaruh dalam degradasi dan mineralisasi bahan organik. Actinomycetes merupakan komponen aktif pada komunitas mikroba laut. Actinomycetes membentuk populasi yang stabil, persisten dalam berbagai ekosistem laut. Hasil observasi lain menunjukkan bahwa senyawa baru dengan aktivitas biologi berhasil diisolasi dari Actinomycetes laut, hal tersebut mengindikasikan bahwa Actinomycetes laut merupakan sumber penting untuk penemuan metabolit sekunder baru.
Akhir-akhir ini berhasil diisolasi metabolit sekunder baru termasuk abyssomicin C dan A. Salinosporamide Abyssomicin C diproduksi oleh strain Verrucosispora terisolasi dari Laut Jepang pada kedalaman 289 M. Antibiotik poliketida polisiklik ini bertindak dengan menghambat biosintesis asam para-aminobenzoic dalam jalur asam folat. Salinosporamide adalah inhibitor untuk β-lactone-λ-lactam proteosome yang diproduksi oleh obligat baru laut Actinomycetes Salinispora tropica. Senyawa ini dalam uji coba fase-I klinis
15
untuk mengobati tumor padat dan limfoma yang sedang disponsori oleh nereus farmasi dari Diego, California (Baltz, 2007).
Eksploitasi terhadap Actinomycetes laut telah berhasil menemukan metabolit sekunder. Beberapa metabolit sekunder yang berhasil diisolasi dari actinomycetses laut adalah:
a. Abyssomicin C yang merupakan antibiotik poliketida polisiklik baru yang dihasilkan oleh strain Verrucosispora. Antibiotik tersebut potensial menghambat biosinstesis asam para-aminobenzoic dan menghambat biosintesis asam folat pada tahap awal. Abyssomicin C berpotensi untuk menghambat bakteri gram positif Staphylococcus aureus, sehingga antibiotik ini potensial untuk dikembangkan sebagai agen antibakteri untuk melawan patogen resisten obat-obatan.
b. Diazepinomicin yang dihasilkan oleh micromonospora yang potensial sebagai antibakteri, antiinflamasi dan aktivitas antitumor.
c. Salinosporamide A yang merupakan β-lactone-λ-lactam yang diisolasi dari Salinispora tropica (Kin S Lam, 2006).
Tumor research berhasil mengidentifikasi 5 metabolit sekunder yang dihasilkan oleh 2 Actinomycetes endofitik tanaman mangrove, yaitu Streptomyces cinerochromogenes dan Streptomyces parvus var. marinus. Kelima metabollit sekunder tersebut menunjukkan adanya aktivitas sebagai antitumor. Hal tersebut menunjukkan bahwa ekosistem mangrove merupakan sumber untuk penemuan Actinomycetes baru yang mampu menghasilkan metabolit sekunder yang potensial untuk anti tumor.
16
Kui Hong et al. (2009) berkesimpulan bahwa habitat mangrove merupakan lingkungan yang sangat potensial untuk mengeksploitasi Actinomycetes yang mampu menghasilkan senyawa metabolit sekunder dengan aktivitas anti infeksi, anti tumor dan agen untuk perlakukan penyakit neurodegeneratif dan diabetes. Senyawa untuk perlakuan diabetes tersebut dihasilkan khususnya oleh 2 genus Actinomycetes yakni, Micromonospora dan Streptomyces.
2.3 Antibiotika
Antibiotik adalah agen antimikroba, yang diproduksi oleh beberapa mikroorganisme untuk menghambat atau membunuh banyak mikroorganisme lainnya termasuk bakteri yang berbeda, virus dan sel eukariotik. Antibiotik merupakan metabolit sekunder (Abass et al. 2010). Metabolit sekunder adalah senyawa kimia yang dihasilkan mikroba, tumbuhan, atau hewan yang tidak secara langsung terlibat dalam pertumbuhan, perkembangan, dan reproduksi. Metabolit sekunder merupakan produk spesifik dari setiap spesies (atau hanya ditemukan dalam bagian kecil dari spesies dalam 15 grup filogenik). Tanpa senyawa ini maka organisme akan berakibat menderita karena kurang dapat mempertahankan diri. Akan tetapi tidak menyebabkan kematian secara langsung, contohnya antifungi, antibakteri, antikolesterol, enziminhibitor, dan lain-lain. Fungsi utama dari metabolit sekunder dalam organisme adalah sebagai fungsi ekologi yaitu sebagai alat pertahanan melawan predator, parasit, dan kompetisi antar spesies (Prescot et al. 2002; Bennett et al.1989; Luckner 1990 dalam Sunaryanto, 2011).
Antibiotik yang digunakan saat ini selain dihasilkan oleh mikroorganisme juga telah ditemukan antibiotik sintetik. Istilah antibiotik disebut juga sebagai
17
antimikroba, yaitu senyawa yang dihasilkan oleh mikroorganisme dan secara sintetik. Mekanisme kerja antimikroba dengan cara menekan atau menghentikan suatu proses biokimia di dalam organisme, misalnya terikat pada protein atau organel sel dan merusak fungsi penting yang berhubungan dengan pertumbuhan ataupun bentuk adaptasi mikroorganisme. Antimikroba dapat bersifat membunuh atau menghambat pertumbuhan mikroorganisme (Atlas et al. 1997). Penggunaan antibiotika khususnya berkaitan dengan pengobatan penyakit infeksi, meskipun dalam bioteknologi dan rekayasa genetika juga digunakan sebagai alat seleksi terhadap mutan atau transforman. Antibiotika bekerja seperti pestisida dengan menekan atau memutus satu mata rantai metabolisme, hanya saja targetnya adalah bakteri. Antibiotika berbeda dengan desinfektan karena cara kerjanya. Desifektan membunuh bakteri dengan menciptakan lingkungan yang tidak wajar bagi bakteri untuk hidup.
2.3.1 Jenis-Jenis Antibiotik
Secara garis besar, jenis-jenis antibiotika dan kemoterapetika adalah sebagai berikut:
1. Golongan Penisilin.
Golongan penisilin bersifat bakterisid dan bekerja dengan mengganggu sintesis dinding sel. Antibiotika pinisilin mempunyai ciri khas secara kimiawi adanya nukleus asam amino-penisilinat, yang terdiri dari cincin tiazolidin dan cincin betalaktam. Spektrum bakteri terutama untuk bakteri kokus gram positif. Beberapa golongan penisilin ini juga aktif terhadap bakteri gram negatif. Golongan penisilin masih dapat terbagi menjadi beberapa kelompok, yakni:
18
Penisilin yang rusak oleh enzim penisilinase, tetapi spektrum anti bakteri terhadap gram positif paling kuat. Termasuk penisilin G (benzil penisilin) dan derivatnya yakni penisilin prokain dan penisilin benzatin, dan penisilin V (fenoksimetil penisilin). Penisilin G dan penisilin prokain rusak oleh asam lambung sehingga tidak bisa diberikan secara oral, sedangkan penisilin V dapat diberikan secara oral. Spektrum antimikroba golongan ini masih merupakan pilihan utama meliputi infeksi-infeksi streptokokus beta hemolitikus grup A, pneumokokus, meningokokus, gonokokus, Streptococcus viridans, staphyloccocus, pyoneges (yang tidak memproduksi penisilinase), Bacillus anthracis, Clostridia, Corynebacterium diphteriae, Treponema pallidum, Leptospirae dan Actinomycetes sp. Penisilin yang tidak rusak oleh enzime penisilinase, termasuk kloksasilin, flukloksasilin, dikloksasilin, oksasilin, nafsilin dan metisilin, sehingga hanya digunakan untuk bakteri yang memproduksi enzim penisilinase.
Penisilin dengan spektrum luas terhadap bakteri gram positif dan gram negatif, tetapi rusak oleh enzim penisilinase. Termasuk ampisilin dan amoksisilin. Kombinasi obat ini dengan bahan-bahan penghambat enzim penisiline, seperti asam klavulanat atau sulbaktam, dapat memperluas spektrum terhadap bakteri penghasil enzim penisilinase. Penisilin antipseudomonas meliputi karbenisilin, tikarsilin, meklosilin dan piperasilin diindikasikan khusus untuk bakteri Pseudomonas aeruginosa.
2. Golongan Sefalosporin.
Golongan sefalosporin hampir sama dengan penisilin karena mempunyai cincin beta laktam. Secara umum aktif terhadap bakteri gram positif dan gram
19
negatif, tetapi spektrum anti bakteri dari masing-masing antibiotika sangat beragam, terbagi menjadi 3 kelompok, yakni:
- Generasi pertama yang paling aktif terhadap bakteri gram positif secara in vitro, contohnya sefalotin, sefaleksin, sefazolin, sefradin. Generasi pertama kurang aktif terhadap bakteri gram negatif.
- Generasi kedua agak kurang aktif terhadap bakteri gram positif tetapi lebih aktif terhadap bakteri gram negatif, contohnya sefamandol dan sefaklor.
- Generasi ketiga lebih aktif lagi terhadap bakteri gram negatif, termasuk Enterobacteriaceae dan kadang-kadang Peudomonas. Termasuk sefoksitin (termasuk suatu antibiotika sefamisin), sefotaksim dan moksalatam.
3. Golongan Amfenikol
Golongan amfenikol mencakup senyawa induk kloramfenikol maupun derivat-derivatnya yakni, kloramfenikol palmitat, natrium suksinat dan tiamfenikol. Antibiotika ini aktif terhadap bakteri gram positif dan gram negatif maupun ricketsia, klamidia, spirokaeta dan mikoplasma. Karena toksisitasnya terhadap sumsum tulang, terutama anemia aplastika, maka kloramfenikol hanya dipakai untuk infeksi S. typhi dan H. influenzae.
4. Golongan Tetrasiklin
Tetrasiklin Merupakan antibiotika spektrum luas bersifat bakteriostatik untuk bakteri gram positif dan gram negatif, tetapi indikasi pemakaiannya sudah sangat terbatas oleh karena masalah resistensi. Akan tetapi antibiotika ini masih merupakan pilihan utama untuk infeksi-infeksi yang disebabkan oleh klamidia, riketsia, mikoplasma dan juga efektif terhadap N. meningitidis, N. gonorhoeae dan
20
H. influenzae, termasuk tetrasiklin, klortetrasiklin, oksitetrasiklin, doksisiklin, minosiklin, metasiklin dan demeklosiklin.
5. Golongan Aminoglikosida
Aminoglikosida merupakan golongan antibiotika yang bersifat bakterisid dan terutama aktif untuk bakteri gram negatif. Aktif terhadap gram positif. Streptomisin dan kanamisin juga aktif terhadap bakteri TBC. Selain itu yang termasuk golongan ini adalah amikasin, gentamisin, kanamisin, streptomisin, neomisin, metilmisin dan tobramisin, antibiotika ini punya sifat khas toksisitas berupa nefrotoksik, ototoksik dan neurotoksik.
6. Golongan Makrolida
Golongan makrolida hampir sama dengan penisilin dalam hal spektrum antibakteri, sehingga merupakan alternatif untuk pasien-pasien yang alergi penisilin. Bekerja dengan menghambat sintesis protein bakteri. Aktif secara in vitro terhadap bakteri gram positif, gram negatif, mikoplasma, klamidia, riketsia dan actinomysetes. Selain sebagai alternatif penisilin, eritromisin juga merupakan pilihan utama untuk infeksi pneumonia atipik (disebabkan oleh Mycoplasma pneumoniae) dan penyakit Legionnaires (disebabkan Legionella pneumophilla) termasuk dalam golongan makrolida selain eritromisin juga termasuk roksitromisin, spiramisin, josamisin, rosaramisin, oleandomisin dan trioleandomisin.
7. Golongan Linkosamid.
Golongan Linkosami meliputi linkomisin dan klindamisin, aktif terhadap bakteri gram positif termasuk stafilokokus yang resisten terhadap penisilin. Juga
21
aktif terhadap bakteri anaerob, misalnya bakteroides. Golongan ini sering dipakai sebagai alternatif penisilin antistafilokokus pada infeksi tulang dan sendi serta infeksi-infeksi abdominal. Akan tetapi pemakaiannya sering diikuti dengan superinfeksi C. difficile, dalam bentuk kolitis pseudomembranosa yang fatal. 8. Golongan Polipeptida.
Golongan polipeptida meliputi polimiksin A, B, C, D dan E, merupakan kelompok antibiotika yang terdiri dari rangkaian polipeptida dan secara selektif aktif terhadap bakteri gram negatif, misalnya psedudomonas maupun bakteri koliform yang lain. Toksisitas polimiksin membatasi pemakaiannya, terutama dalam bentuk neurotoksisitas dan nefrotoksisitas.
9. Golongan Antimikobakterium
Golongan antimikobakterium aktif terhadap bakteri mikobakterium, termasuk anti TBC dan lepra.
10. Golongan Sulfonamida dan Trimetropim
Kepentingan sulfonamida dalam kemoterapi infeksi banyak menurun karena masalah resistensi. Tetapi beberapa mungkin masih aktif terhadap bentuk-bentuk infeksi tertentu misalnya sulfisoksazol untuk infeksi dan infeksi saluran kencing. Kombinasi sulfamektoksazol dan trimetoprim untuk infeksi saluran kencing, salmonelosis, bakteri bronkitis, prostatitis. Spektrum bakteri mencakup bakteri gram positif dan gram negatif.
11. Golongan Kuinolon
Golongan Kuinolon merupakan kemoterapetika sintetis yang akhir-akhir ini mulai populer dengan spektrum antibakteri yang luas terutama untuk bakteri
22
gram negatif dan gram positif, enterobakteriaceae dan pseudomonas. Terutama dipakai untuk infeksi-infeksi nosokomial. Termasuk asam nalidiksat, norfloksasin, ofloksasin, pefloksasin dan lain-lain.
12. Golongan lain-lain
Masih banyak jenis-jenis antibiotika dan kemoterapetika lain yang tidak tercakup dalam kelompok yang disebutkan di atas. Misalnya vankomisin, spektinomisin, basitrasin, metronidazol, dan lain-lain (Farmakologi, 2004).
2.3.2 Mekanisme Kerja Senyawa Antibakterial
Pemusnahan mikroba dengan antimikroba yang bersifat bakteriostatik masih tergantung dari kesanggupan reaksi daya tahan tubuh hospes. Peranan lamanya kontak antara mikroba dan antimikroba dalam kadar efektif juga sangat menentukan untuk mendapatkan efek, khususnya pada tuberkulostatik. Berdasarkan mekanisme kerjanya, antimikroba dibagi dalam lima kelompok: 1. Antimikroba yang menghambat metabolisme sel mikroba.
Antimikroba yang termasuk dalam kelompok ini adalah sulfonamid, trimetoprim, asam p-aminosalisilat (PAS) dan sulfon. Berdasarkan mekanisme kerja ini diperoleh bakteriostatik. Mikroba membutuhkan asam folat untuk kelangsungan hidupnya. Berbeda dengan mamalia yang mendapatkan asam folat dari luar. Bakteri patogen harus mensintesis sendiri asam folat dari asam amino benzoat (PABA). Apabila sulfonamid dan sulfon menang bersaing dengan PABA untuk diikutsertakan dalam pembentukan asam folat, maka terbentuk analog asam folat yang nonfungsional. Akibatnya, kehidupan mikroba akan terganggu. Berdasarkan sifat kompetisi, efek sulfonamid dapat diatasi dengan meningkatkan
23
kadar PABA. Untuk dapat bekerja, dihidrofolat harus diubah menjadi bentuk aktifnya yaitu asam tetrahidrofolat. Enzim dihidrofolat reduktase yang berperan dihambat oleh trimetoprim, sehingga asam dihidrofolat tidak dapat direduksi menjadi asam tetrahidrofolat yang fungsional.
2. Antimikroba yang menghambat sintesis dinding sel mikroba.
Antimikroba yang termasuk dalam kelompok ini adalah penisilin, sefalosporin, basitrasin, vankomisin, dan sikloserin. Dinding sel bakteri, terdiri dari polipeptidoglikan yaitu suatu kompleks polimer mukopeptida (glikopeptida). Sikloserin menghambat reaksi yang paling dini dalam proses sintesis dinding sel; diikuti berturut-turut oleh basitrasin, vankomisin, dan diakhiri oleh penisilin dan sefalosporin, yang menghambat reaksi terakhir (transpeptidase) dalam rangkaian reaksi tersebut. Oleh karena tekanan osmotik dalam sel bakteri lebih tinggi daripada di luar sel maka kerusakan dinding sel bakteri akan menyebabkan terjadinya lisis, yang merupakan dasar efek bakterisidal pada bakteri yang peka. 3. Antimikroba yang mengganggu keutuhan membran sel mikroba.
Antimikroba yang termasuk dalam kelompok ini adalah polimiksin, golongan polien serta berbagai antimikroba kemoterapeutik, contohnya antiseptik surface active agents. Pollimiksin sebagai senyawa amonium-kuatener dapat merusak membran sel setelah bereaksi dengan fosfat pada fosfolipid membran sel mikroba. Polimiksin tidak efektif terhadap bakteri gram positif karena jumlah fosfor bakteri ini rendah. Bakteri gram negatif yang menjadi resisten terhadap polimiksin, ternyata jumlah fosfornya menurun. Antibiotik polien bereaksi dengan struktur sterol yang terdapat pada membran sel sehingga mempengaruhi
24
permeabilitas selektif membran tersebut. Bakteri tidak sensitif terhadap antibiotik polien, karena tidak memiliki struktur sterol pada membran selnya. Antiseptik yang mengubah tegangan permukaan (surface active agents), dapat merusak permeabelitas selektif dari membran sel menyebabkan keluarnya berbagai komponen penting dari dalam sel mikroba yaitu protein, asam nukleat, nukleotida, dan lain-lain.
4. Antimikroba yang menghambat sintesis protein sel mikroba.
Antimikroba yang termasuk kelompok ini adalah golongan aminoglikosid, makrolid, linkomisin, tetrasiklin, dan kloramfenikol. Untuk kehidupannya, sel mikroba perlu mensintesis berbagai protein. Sintesis protein berlangsung di ribosom, dengan bantuan mRNA dan tRNA. Pada bakteri, ribosom terdiri atas dua sub unit, yang berdasarkan konstanta sedimentasi dinyatakan sebagai ribosom 30S dan 50S. Untuk berfungsi pada sintesis protein, kedua komponen ini akan bersatu pada pangkal rantai mRNA menjadi ribosom 70S. Penghambatan sintesis protein terjadi dengan berbagai cara. Streptomisin berikatan dengan komponen ribosom 30S dan menyebabkan kode pada mRNA salah dibaca oleh tRNA pada waktu sintesis protein. Akibatnya akan terbentuk protein yang abnormal dan nonfungsional bagi sel mikroba. Antibiotik aminoglikosid lainnya yaitu gentamisin, kanamisin, dan neomisin memiliki mekanisme kerja yang sama, namun potensinya berbeda. Eritromisin berikatan dengan ribosom 50S dan menghambat translokasi kompleks tRNA-peptida dari likasi asam amino ke lokasi peptida. Akibatnya, rantai polipeptida tidak dapat diperpanjang karena lokasi asam amino tidak dapat menerima kompleks
tRNA-25
asam amino yang baru. Linkomisin juga berikatan dengan ribosom 50S dan menghambat sintesis protein. Tetrasiklin berikatan dengan ribosom 30S dan menghalangi masuknya kompleks tRNA asam amino pada lokasi asam amino. Kloramfenikol berikatan dengan ribosom 50S dan menghambat pengikatan asam amino baru pada rantai polipeptida oleh enzim peptidil transferase.
5. Antimikroba yang menghambat sintesis asam nukleat sel mikroba.
Antimikroba yang termasuk dalam kelompok ini adalah rifampisin, dan golongan kuinolon. Walaupun bersifat antimikroba, karena sifat sitotoksisitasnya, pada umumnya hanya digunakan sebagai obat antikanker; tetapi beberapa obat dalam kelompok terakhir ini dapat pula digunakan sebagai antivirus. Rifampisin, salah satu derivat rifamisin, berikatan dengan enzim polimerase-RNA (pada sub unit) sehingga menghambat sintesis RNA dan DNA oleh enzim tersebut. Golongan kuinolon menghambat enzim DNA girase pada bakteri yang fungsinya menata kromosom yang sangat panjang menjadi bentuk spiral sehingga bisa masuk dalam sel bakteri yang kecil (Akhyar, 2010).
2.3.3 Bakteri Uji
Bakteri yang digunakan untuk pengujian aktivitas antibakteri yaitu S. aureus, B. subtilis, dan E. coli. Alasan penggunaan kedua bakteri tersebut adalah untuk melihat aktivitas antibakteri terhadap bakteri gram postif dan bakteri gram negatif. S. aureus dan B. subtilis adalah bakteri gram positif, sedangkan E. coli adalah bakteri gram negatif. Perbedaan antara dinding sel bakteri gram positif degan gram negatif dapat dilihat pada gambar 2.
26
Gambar 2. Perbedaan antara Struktur Dinding Sel Bakteri Gram Positif dan Gram Negatif (sumber: biobacteri.com).
1. Staphylococus aureus
S. aureus adalah bakteri yang bersifat anaerobik fakultatif, termasuk dalam kelompok bakteri gram positif dan menghasilkan asam laktat. Sel S. aureus berbentuk bulat memiliki diameter sekitar 1 μm, berwarna kuning terang dan cenderung muncul bergerombol menyerupai seikat anggur atau tersusun dalam kelompok-kelompok yang tidak teratur, tidak berspora, dan dapat menghemolisis sel darah. S. aureus dapat menyebabkan beberapa infeksi yang serius seperti radang paru-paru (pneumonia), radang otot, dan pembengkakan otak bagian luar (Todar, 2002 dalam Agung, 2012). Bakteri ini juga bersifat patogen terhadap manusia dan dapat menyebabkan terjadinya infeksi pada kulit seperti bisul dan luka gores.
2. Escherichia coli
E. coli adalah salah satu jenis bakteri yang secara normal hidup dalam saluran pencernaan baik manusia maupun hewan yang sehat. E. coli merupakan bakteri dengan struktur dinding sel yang relatif tipis dan berlapis tiga, dinding
27
selnya memiliki kandungan lipida tinggi dengan kandungan peptidoglikan relatif rendah dan tidak memiliki asam terikoat. Membran luar bakteri gram negatif mempunyai peranan sebagai barier masuknya senyawa-senyawa yang tidak dibutuhkan oleh sel, diantaranya bakteriosin, enzim dan senyawa-senyawa yang bersifat hidrofobik (Alokomi et al., 2000 dalam Agung, 2012). Bakteri ini memiliki bentuk batang (basil) dengan ukuran lebar 0,5 nm dan panjang 1,0-3,0 nm serta tidak berkapsul (Agung, 2012)
3. Basilus subtilis
Basilus subtilis merupakan bakteri gram positif berbentuk batang lurus berukuran 1,5-4,5 µm, sendiri-sendiri atau tersusun dalam bentuk rantai, bergerak dan tidak bersimpai.
2.4 Kromatografi Lapis Tipis (KLT)
Kromatografi digunakan untuk memisahkan substansi campuran menjadi komponen-komponennya. Kromatografi merupakan pemisahan campuran senyawa menjadi senyawa murninya dan mengetahui kuantitasnya. Oleh karena itu, kemurnian bahan atau komposisi campuran dengan kandungan yang berbeda dapat dianalisis dengan benar. Tidak hanya kontrol kualitas, analisis bahan makanan dan lingkungan, tetapi juga kontrol dan optimasi reaksi kimia dan proses berdasarkan penentuan analitik dari kuantitas material. Teknologi yang penting untuk analisis dan pemisahan preparatif pada campuran bahan adalah prinsip dasar kromatografi. Pemisahan senyawa biasanya menggunakan beberapa tekhnik kromatografi. Pemilihan teknik kromatografi sebagian besar bergantung pada sifat kelarutan senyawa yang akan dipisahkan. Semua kromatografi memiliki fase diam (dapat berupa padatan, atau kombinasi cairan-padatan) dan fase gerak (berupa cairan atau gas). Fase gerak
28
mengalir melalui fase diam dan membawa komponen-komponen yang terdapat dalam campuran. Komponen-komponen yang berbeda bergerak pada laju yang berbeda. Kromatografi juga merupakan analisis cepat yang memerlukan bahan sangat sedikit, baik penyerap maupun cuplikannya. KLT dapat digunakan untuk memisahkan senyawa–senyawa yang sifatnya hidrofobik seperti lipida dan hidrokarbon yang sukar dikerjakan dengan kromatografi kertas. Identifikasi senyawa secara kromatografi dan isolasi senyawa murni skala kecil. Pelarut yang dipilih untuk pengembang disesuaikan dengan sifat kelarutan senyawa yang dianalisis. Bahan lapisan tipis seperti silika gel adalah senyawa yang tidak bereaksi dengan pereaksi-pereaksi yang lebih reaktif seperti asam sulfat (Arista, 2010).