LAPORAN PRAKTIKUM KOMPUTASI KIMIA
KESETIMBANGAN KETO-ENOL
DISUSUN OLEH :
LIZA SRI MARNINGSIH
F1C114024
KRISTIANTY NURVITASARY SITORUS
F1C114026
UTI KHAIRINI
F1C114030
DOSEN PENGANMPU :
DIAH MASTUTIK, S.Pd., M.Si.
PROGRAM STUDI KIMIA
UNIVERSITAS JAMBI
2016
PERCOBAAN II
KESETIMBANGAN KETO-ENOL I. Tujuan
Mengetahui tetapan kesetimbangan keto-enol dari dua senyawa karbonil menggunakan perhitungan semi empiris AM1 dan untuk menyelidiki pengaruh ikatan hidrogen intramolekular pada kesetimbangan ini.
II. Latar Belakang
Keton dan aldehida selalu dalam kesetimbangan dengan bentuk enolnya. Jumlah enol yang ada dalam keseimbangan bergantung pada struktur dari keton dan aldehida, pelarut, suhu dan faktor lain seperti konjugasi dan ikatan hidrogen. Pada percobaan ini akan dievaluasi tetapan keseimbangan dari tiga senyawa karbonil. Enol merupakan suatu struktur dengan gugus – OH yang terikat pada karbon yang berikatan rangkap. Akhiran –ena menunjukkan suatu ikatan karbon dengan karbon rangkap dua, sedangkan –ol menunjukkan gugus alkohol dan keto menunjukkan senyawa tersebut mengandung gugus karbonil.
Perlu diketahui bahwa bentuk keto dan bentuk enol dari suatu senyawa adalah molekul-molekul yang berbeda (jangan dikacaukan dengan bentuk resonansi yang kadang keberadaannya tidak nyata). Bentuk keto dan enol disebut tautometer satu sama lainnya, dan perubahannya dari satu bentuk ke bentuk yang lainnya disebut tautometri. Tautometer-tautometer dengan mudah dan cepat berubah dari satu bentuk ke bentuk yang lain pada kondisi biasa. III. Landasan Teori
Aldehid dan keton merupakan dua dari sekian banyak kelompok senyawa organik yang mengandung gugus karbonil. Suatu
keton menghasilkan dua gugus alkil yang terikat pada karbon karbonilnya. Gugus lain dalam suatu aldehid dapat berupa alkil, aril atau H. Aldehid dan keton lazim terdapat dalam system mahluk hidup. Banyak aldehid dan keton mempunyai bau khas, yang membedakannya umumnya aldehid berbau merangsang dan keton berbau harum. Suatu senyawa karbonil dengan hidrogen alfa yang bersifat asam, dapat berada dalam dua bentuk yang disebut tautomer, yaitu suatu tautomer keto dan sebuah tautomer enol. Tautomer adalah isomer-isomer yang berbeda satu dengan yang lainnya hanya pada posisi ikatan rangkap dan sebuah atom hidrogen yang berhubungan. Tautomer keto suatu senyawa karbonil mempunyai struktur karbonil seperti diharapkan. Tautomer enol (dari –ena + -ol), yang merupakan suatu alkohol vinilik, terbentuk dengan serah terima sebuah hidrogen asam dari karbon α ke oksigen karbonil. Karena atom hidrogen berada dalam posisi yang berlainan, kedua bentuk tautomerik ini bukanlah struktur-resonansi, melainkan dua struktur berlainan yang berada dalam kesetimbangan.
Bentuk enol tidak hanya memilki ikatan rangkap berkonjugasi, yang sedikit menambah kestabilan, tetapi juga memiliki susunan struktur yang sedemikian rupa sehingga memungkinkan terbetuknya ikatan hidrogen internal, yang membantu menstabilkan tautomer (Fessenden, 1986).
Tautomerisme, kasus khusus dari isomerisme, memainkan peran penting dalam kimia modern organik, biokimia, kimia obat, farmakologi, biologi molekuler, dan kehidupan itu sendiri. Istilah "Tautomerisme" (Yunani, Tauto - sama, dan meros -bagian) mengacu pada senyawa yang ada dalam kesetimbangan di antara dua atau lebih bentuk isomer yang disebut tautomer. Tautomer mengalami interkonversi dalam proses reversibel, baik penataan ulang intra molekuler maupun intermolekuler Senyawa organik dalam senyawa - senyawa karbonil yang mempunyai atom hidrogen pada karbon-α (karbon yang terletak bersebelahan karbon karbonil) dengan cepat
akan berubah-ubah antara bentuk keto dan bentuk enol . Enol merupakan suatu struktur dengan gugus – OH yang terikat pada karbon yang berikatan rangkap. Akhiran – ena menunjukkan suatu ikatan karbon dengan karbon rangkap dua, sedangkan – ol menunjukkan gugus alkohol dan keto menunjukkan senyawa tersebut mengandung gugus karbonil.Sebagaimana tautomeri yang terjadi pada senyawa organik dalam keto – enol, hampir seluruh tautomeri pada senyawa keto – enol, melibatkan struktur – struktur yang berbeda dalam hal letak terikatnya hidrogen secara khas, keseimbangan perubahan ini sangat menyukai struktur yang hidrogennya terikat pada karbon (bentuk keto) (Ewa dan wanda, 2005).
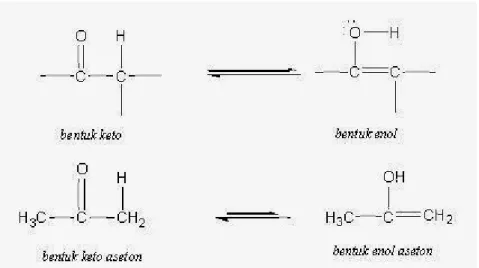
Aseton memiliki gugus karbonil yang mempunyai ikatan rangkap dua karbon oksigen terdiri atas satu ikatan σ dan satu ikatan π. Umumnya atom hidrogen yang terikat pada atom karbon sangat stabil dan sangat sukar diputuskan. Namun lain halnya dengan atom hidrogen yang berada pada karbon (C) disamping gugus karbonil yang disebut atom hidrogen alfa (α). Sebagai akibat penarikan elektron oleh gugus karbonil, kerapatan elektron pada atom karbon α semakin berkurang, maka ikatan karbon dan hidrogen α semakin melemah,sehingga hidrogen α menjadi bersifat asam dan dapat mengakibatkan terjadinya substitusi α. Substitusi α melibatkan penggantian atom H pada atom karbon α dengan elektrofilik (Wade, L.G. 2006). Atom hidrogen α pada aseton dapat dilihat pada Gambar 1
Aseton mempunyai atom hidrogen α bersifat asam, oleh karena itu dapat terionisasi menghasilkan ion enolat. Ion enolat dapat berada dalam dua bentuk yaitu bentuk keto dan bentuk enol atau disebut dapat terjadi tautomerisasi.Tautomer adalah isomer-isomer pada senyawa karbonil yang hanya dibedakan oleh kedudukan ikatan rangkap dan yang disebabkan perpindahan letak atom hidrogen α ke atom oksigen. Bentuk keto dan bentuk enol pada aseton dapat dilihat pada Gambar 2.
Gambar 2. Bentuk keto dan bentuk enol pada aseton.
Acetylacetone (2,4-pentadion) adalah senyawa organik yang ada di dua tautomerik bentuk yang interconvert cepat dan diperlakukan sebagai senyawa tunggal dalam sebagian besar aplikasi. Meskipun senyawa tersebut secara resmi disebut sebagai bentuk diketon, 2,4-pentanadion, bentuk enol membentuk komponen substansial dari bahan dan sebenarnya bentuk disukai di banyak pelarut. Ini adalah cairan tak berwarna yang merupakan prekursor untuk acetylacetonate (acac), umum bidentat ligan (Caminati dan Grabow,2006). Ini juga merupakan blok bangunan untuk sintesis senyawa heterosiklik.
Pada bentuk keto dan enol asetilaseton hidup berdampingan dalam larutan; bentuk Tautomer ini . Bentuk enol memiliki C 2v
simetri , berarti atom hidrogen dibagi sama rata antara kedua atom oksigen. Pada fase gas, konstanta kesetimbangan , K keto → enol, adalah
11,7, mendukung bentuk enol. Dua bentuk tautomer dapat dengan mudah dibedakan dengan spektroskopi NMR , spektroskopi IR , dan metode lainnya (Manbeck,dkk,2011).
IV. Prosedur Kerja
Gambarkan senyawa karbonil aseton dan bentuk enolnya. Hitung panas pembentukannya menggunakan metode semiempiris AM1 dan catat hasilnya pada lembar laporan. Gambarkan bentuk keto dan minimisasi strukturnya. Hilangkan atom hidrogen pada karbon alfa (gunakan menu Select) dan dengan menggunakan menu Draw. Gambarkan bentuk enol dengan mengubah ikatan C=O menjadi ikatan tunggal dan C-C menjadi ikatan ganda. Pilih menu Build dan Add H & Model Build. Anda akan mendapatkan bentuk enol. Lakukan minimasi dan catat panas pembentukannya.
Gambarkan diketon 2,4-pentadion, minimisasi strukturnya dan catat panas pembentukannya.
Pada bentuk sebelah kiri, OH digambarkan menjauh dari C=O sehingga tidak dapat mengadakan ikatan hidrogen dengan gugus karbonil. Jika senyawa tidak nampak seperti itu, pilih mode Select dan klik dan geser dari atom H dari OH ke atom sp2 yang mengikat H (4 atom terpilih). Pilih
Build dan atur Constrain Bond Torsion pada Trans. Lakukan Model Build. Lakukan optimasi struktur dan catat panas pembentukannya.
Gambarkan bentuk enol yang lain dengan mengatur Constrain Bond Torsion pada Cis. Optimasi struktur dan catat panas pembentukannya.
V. Hasil dan Pembahasan 5.1 Hasil
Molekul Hf bentuk Keto (kkal/mol) Hf bentuk Enol (kkal/mol) Tetapan Kesetimbangan Keq Aseton -934,1538 -922,3659 0,98738 2,4-pentadion non ikatan hidrogen -1472,1079 -1466,803 0,99639 2,4-pentadion dengan ikatan hidrogen -1472,1079 -1475,4676 1,00228
5.2 Pembahasan
Enol (juga disebut sebagai alkenol) adalah alkena yang mempunyai
gugus hidroksil yang melekat pada karbon berikatan rangkap dua. Enol dan
senyawa karbonil (seperti keton dan aldehida) sebenarnya adalah isomer; ini
dikenal sebagai tautomerisme keto-enol:
Bentuk enol ditunjukkan pada gambar sebelah kanan. Biasanya ia tidak stabil dan berubah dengan cepat menjadi bentuk keto (keton) pada gambar sebelah kiri. Hal ini dikarenakan oksigen lebih elektronegatif daripada karbon, sehingga oksigen membentuk energi ikatan rangkap yang lebih kuat. Ikatan ganda karbon-oksigen (karbonil) lebih kuat dua kali lipat daripada ikatan tunggal karbon-oksigen, namun ikatan ganda karbon-karbon lebih lemah daripada dua ikatan tunggal karbon-karbon.
Hanya dalam senyawa 1,3-dkarbonil dan 1,3,5-trikarbonil yang memiliki bentuk enol yang stabil. Hal ini disebabkan oleh resonansi dan ikatan hidrogen
antarmolekul yang terjadi pada bentuk enol dan tidak mungkin terjadi pada bentuk keto. Oleh karenanya, pada kesetimbangan, lebih dari 99% molekul propanadial (OHCCH2CHO) berbentuk monoenol. Persentase tersebut lebih
rendah untuk keton 1,3-aldehida dan diketon. Enol (dan enolat) merupakan zat antara yang penting pada banyak reaksi organik. Perkataan enol dan alkenol adalah akronim dari alkena (-ena) dan alkohol (-ol).
Untuk percobaan ini yang akan dibahas mengenai molekul aseton bentuk keto. Dalam sebuah molekul keton ataupun aldehidanya terdapat dua jenis kesetimbangan dengan bentuk molekulnya. Dua bentuk molekul kesetimbangan itu adalah keto dan enol. Menurut literatur, bentuk yang pa;ing disukai dari antara kedua bentuk ini adalah bentuk enol, karena pada saat dalam bentuk keto, maka sifat dari kearomatisan dari bentuk enolnya akan hilang ketika molekul tersebut dalam bentuk keto.
Dapat dilihat dari percobaan yang telah dilakukan dengan menggunakan metode semiempiris AM1 maka didapat nilai pengaruh ikatan hidrogen intramolekular pada kesetimbangan ini ialah sebesar -934,1538 kkal/mol yang menunjukkan bahwa reaksi berlangsung eksotermis.
Pada aseton bentuk enol ini dilakukan melalui bentuk keto yang sebelumnya dibuat kemudian dilakukan pengubahan ke bentuk enol dengan cara mengubah ikatan C=O menjadi ikatan tunggal dan C-C menjadi ikatan ganda.
Untuk bentuk molekul aseton bentuk enol sendiri seperti telah dijelaskan sebelumnya bahwa bentuk enol lebih disukai daripada bentuk keto karena sifat aromatisnya yang akan hiang jika molekulnya dalam bentuk keto. Hal ini dapat terlihat juga dari nilai pengaruh ikatan hidrogen intramolekular pada kesetimbangan ini adalah sebesar -922,3659 kkal/mol yang menunjukkan bahwa reaksi berlangsung eksotermis.
Berdasrkan literatur bahwa molekul yang memiliki nilai panas pembentukan yang lebih kecil adalah molekul yang lebih stabil. Maka dapat dilihat pada percobaan ini untuk panas pembentukan antara kedua molekul dimana antara molekul bentuk keto dan enol, molekul yang memiliki bentuk enol adalah molekul yang memiliki energi panas pembentukan yang lebih kecil dibandingkan keto maka ini berarti bahwa dibandingkan dengan molekul bentuk keto, bentuk enol merupakan yang lebih stabil karena memiliki panas pembentukan yang lebih kecil .
Tetapan kesetimbangan dapat dicari nilainya dari :
Dengan :
A = Senyawa keto B = Senyawa enol Sehingga,
Dari kedua perbandingan juga didapat untuk tetapan kesetimbangan Keq
pada kesetimbangan ini adalah sebesar 0,98738. Nilai ini didapat dari dari nilai pengaruh ikatan hidrogen intramolekular enol dibagi dengan dari nilai pengaruh ikatan hidrogen intramolekular keto maka didapat nilai kesetimbangan seperti disebut diatas.
5.2.3. Diketon 2,4 Pentadion Non Ikatan Hidrogen Bentuk Keto
Dengan menggambarkan struktur 2,4 pentadion yang kemudian dioptimasi maka didapat energi atau panas pembentukannya adalah sebesar -1472,1079 kkal/mol yang menunjukkan bahwa reaksi berlangsung eksotermis.Bentuk 2,4 pentadion ini sendiri yang merupakan bentuk pertama adalah 2,4 pentadion non ikatan hidrogen bentuk keto.
5.2.4. 2,4 Pentadion Non Ikatan Hidrogen Bentuk Enol
Setelah menggambarkan bentuk keto dilakukan pengubahan ke bentuk enol dengan cara mengubah ikatan C=O menjadi ikatan tunggal dan C-C menjadi ikatan ganda. Pada bentuk molekul diketon 2,4 pentadion non ikatan hidrogen bentuk enol didapat nilai pengaruh ikatan hidrogen intramolekular
pada kesetimbangan ini adalah sebesar -1466,803 kkal/mol yang menunjukkan bahwa reaksi berlangsung eksotermis.
Jika dibandingkan dengan energi panas pembentukan dari bentuk keto maka bentuk enol memiliki energi panas pembentukan yang lebih kecil daripada keto, maka dapat disimpulkan disini bahwa bentuk enol pada 2,4 pentadion non ikatan hidrogen ini lebih stabil karen amemiliki nilai energi panas pemebntukan yang lebih kecil.
Pada kesetimbangan ini setelah didapat nilai dari bentuk keto dan enol didapatlah perbandingan antara enol berbanding keto.
Dimana,
A = Senyawa keto B = Senyawa enol Sehingga,
Dari persamaan diatas maka didapat bahwa nilai tetapan kesetimbangan pada 2,4 pentadion non ikatan hidrogen ini sebesar 0,99639.
5.2.5. 2,4 Pentadion Dengan Ikatan Hidrogen Bentuk Keto
Pada 2,4 pentadion dengan ikatan hidrogen bentuk keto memiliki nilai energi pembentukan panas yang sama dengan 2,4 pentadion non ikatan
hidrogen bentuk keto yaitu -1472,1079 kkal/mol yang menunjukkan bahwa reaksi berlangsung eksotermis.
5.2.6. 2,4 Pentadion Dengan Ikatan Hidrogen Bentuk Enol
Pada 2,4 pentadion dengan ikatan hidrogen bentuk enol adanya pengubahan struktur ini dapat ditentukan senyawa mana yang terdapat ikatan hidrogen dan tidak. Kemudian setelah dilakukan optimasi didapat hasil besar panas pembentukannya pada kondisi enol adalah sebesar -1475,4676 kkal/mol yang menunjukkan bahwa reaksi berlangsung eksotermis.
Untuk menentukan tetapan kesetimbangan dari kedua molekul ini yaitu :
Dimana,
A = Senyawa keto B = Senyawa enol Sehingga,
Maka dari perbandingan antara kedua energi panas pembentukan adalah 1,00228.
VI. Kesimpulan dan Saran 6.1 Kesimpulan
Dari percobaan yang telah dilakukan maka dapat disimpulkan bahwa :
Untuk molekul aseton tetapan kesetimbangan Keq adalah 0,98738.
Pengaruh ikatan hidrogen intramolekularnya pada bentuk keto -934,1538 kkal/mol dan pada bentuk enolnya 922,3659 kkal/mol
Untuk molekul 2,4 pentadion non ikatan hidrogen tetapan kesetimbangan Keq adalah 0,99639. Pengaruh ikatan hidrogen
intramolekularnya pada bentuk keto -1472,1079 kkal/mol dan pada bentuk enolnya -1466,803 kkal/mol
Untuk molekul 2,4 pentadion dengan ikatan hidrogen tetapan kesetimbangan Keq adalah 1,00228. Pengaruh ikatan hidrogen
intramolekularnya pada bentuk keto -1472,1079 kkal/mol dan pada bentuk enolnya -1475,4676 kkal/mol
6.2 Saran
Dalam melakukan praktikum ini sebaiknya seluruh mahasiswa sudah memiliki software yang akan digunakan terlebih dahulu dan memahami terlebih dahulu mengenai topik yang akan dibahas agar praktikum dapat berjalan lebih baik.
DAFTAR PUSTAKA
Caminati, W .; Grabow, J.-U. (2006). " Struktur C 2v dari Enolic Acetylacetone".
Journal of American Chemical Society .128 (3): 854-857. Doi : 10.1021 /
ja055333g . PMID16417375 .
Ewa,Daniela Raczyn´ska dan Wanda,Kosin´ska. (2005). Tautomeric Equilibria in Relation to Pi-Electron Delocalization. Chem. Rev. 105, 3561-3612 The American Chemical Society.
Fessenden, Ralp J dan Fessenden, Joan S.1986.Kimia Organik Jilid I.Jakarta:Erlangga.
Manbeck, Kimberly A .; Boaz, Nicholas C .; Bair, Nathaniel C .; Sanders, Allix MS; Marsh, Anderson L. (2011). "Substituen Efek pada Keto-Enol Kesetimbangan Menggunakan Spektroskopi NMR". J. Chem. Educ. 88 (10):. 1444-1445 doi : 10.1021 / ed1010932 .
Wade, L.G.2006. Organic Chemistry. Sixth edition. New Jersey : Pearson Education International.
Analisis
1. Bentuk yan mana, keto atau enol yang lebih disukai dari molekul dikarbonil non-ikatan hydrogen? Bagaimana besarnya tetapan keseimbangan dibandinon. Bandingkan dengan aseton. Berikan alasan untuk perbedaan yang didapat dalam Keq dari dua molekul tersebut.
Jawab :
2. Bentuk yang mana, keto atau enol yang lebih disukai dari molekul dikarbonil berikatan hydrogen? Bagaimana hal ini jika dibandingkan dengan non-ikatan Hydrogen? Berdasarkan hasil perhitungan, faktor apakah yang bertanggungjawab terhadap stabilitas bentuk enol pada 2,4-pentadion? Jelaskan secara rinci.
Jawab :
1. Yang lebih disukai diantara keto atau eno dari molekul dikarbonil non-ikatan hidrogen yaitu bentuk enol, karena panas pembentukannya lebih rendah dari pada bentuk keto. Tetapan kesetimbangannya jika dibandingkan dengan aseton lebih besar, artinya kesetimbangan dari molekul dikarbonil non ikatan hidrogen lebih memungkinkan dari pada aseton.perbedaan Keq antara kedua molekul tersebut dikarenakan
adanya pengaruh bentuk tautomernya,dimana pada 2,4-pentadion non ikatan hydrogen (keto) adanya gugus karbonil pada rantai 2,4 sementara pada aseton (keto) hanya memiliki satu gugus karbonil sehingga dalam resonansinya memungkinkan untuk 2,4-pentadion lebih stabil dibanding aseton,karena Hfnya lebih kecil,begitu pula dalam bentuk enolnya,maka
dalam perhitungan didapatkan Keq 2,4-pentadion non ikatan hydrogen
lebih besar dibanding aseton,maka itu kesetimbangannya lebih memungkinkan 2,4-pentadion non ikatan hydrogen daripada aseton. 2. Yang lebih stabil dari keto atau enol dari molekul dikarbonil berikatan
hidrogen yaitu bentuk keto, karena panas pembentukannya lebih rendah dibandingkan dengan bentuk enol. Jika dibandingkan dengan non ikatan hidrogen, panas pembantukan yang lebih besar yaitu bentuk enol dari dikarbonil dengan ikatan hydrogen, hal ini karena pengaruh ikatan
hydrogen pada molekul sehingga kurang kestabilannya.berdasarkan perhitungan dapat dilihat bahwa Faktor yang menentukan kestabilan dari 2,4-pentadion yaitu ada atau tidaknya ikatan hidrogen dan juga pengaruh dari jumlah elektron atom dari gugus karbonil.