Riska Padmi Dwi Utami, 2015
A. Lokasi dan Subjek Penelitian
Penelitian ini dilakukan di salah satu SMA Negeri di Kota Bandung. Subjek penelitian ini adalah enam orang siswa SMA kelas XI IPA yang sudah mendapatkan materi asam basa, larutan penyangga, hidrolisis dan titrasi asam basa.
B. Metode Penelitian
Metode yang digunakan pada penelitian ini adalah metode deskriptif. Metode deskriptif merupakan metode yang menjelaskan fenomena dengan mendeskripsikan karakteristik individu, kelompok, situasi, atau peristiwa. Penelitian deskriptif bertujuan untuk membuat deskripsi, gambaran, atau lukisan secara sistematis, faktual, dan akurat mengenai fakta-fakta, sifat-sifat serta hubungan antar fenomena yang diselidiki (Nazir, 2003, hlm. 54). Dalam penelitian deskriptif, peneliti tidak melakukan manipulasi atau memberikan perlakuan-perlakuan tertentu terhadap variabel atau merancang sesuatu yang diharapkan terjadi pada variabel, tetapi semua kegiatan, keadaan, kejadian, aspek, komponen, atau variabel berjalan sebagaimana adanya (Sukmadinata, 2005, hlm. 73-74). Penelitian deskriptif dilakukan dengan menempuh langkah-langkah pengumpulan, klasifikasi, pengolahan data, analisis data, dan membuat kesimpulan dengan tujuan utama untuk membuat gambaran terperinci tentang suatu subjek penelitian. Dalam penelitian ini, gambaran terperinci tersebut adalah profil model mental siswa.
C. Desain Penelitian
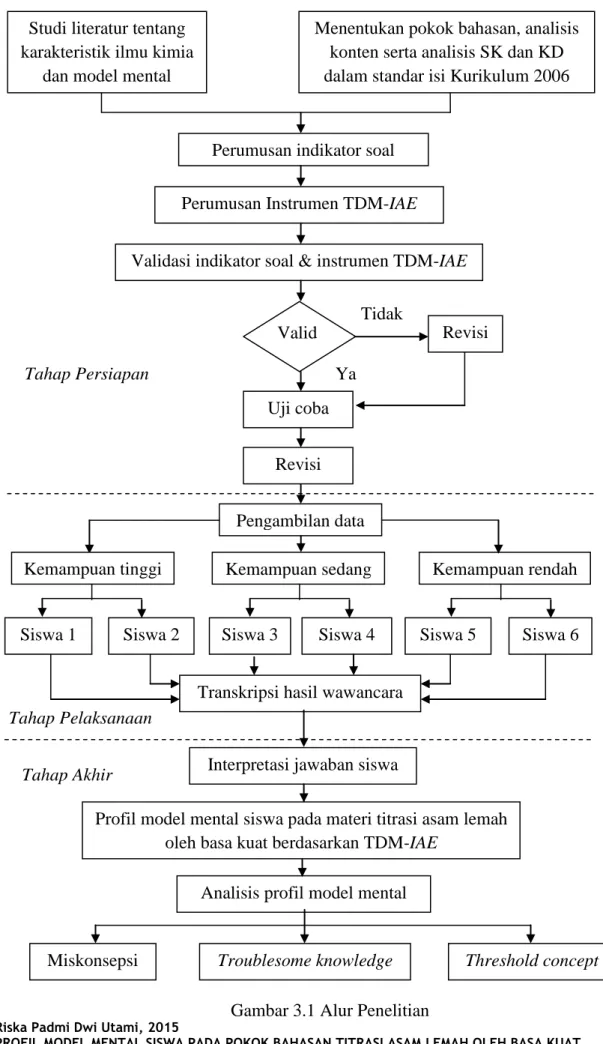
Desain penelitian ini adalah penelitian kualitatif. Prosedur penelitian ini secara umum terbagi menjadi tiga tahap, yaitu tahap persiapan, tahap pelaksanaan dan tahap akhir.
Riska Padmi Dwi Utami, 2015
1. Tahap Persiapan
Pada tahap persiapan, langkah pertama yang dilakukan adalah melakukan studi kepustakaan tentang karakteristik ilmu kimia dan model mental. Dari hasil kepustakaan mengenai karakteristik ilmu kimia kemudian menentukan topik kimia yang akan diteliti. Selanjutnya dilakukan analisis SK-KD pada standar isi kurikulum 2006. Hal ini dilakukan untuk menentukan kedalaman dan keluasan materi yang akan digunakan dalam penelitian. Analisis konsep-konsep inti juga dilakukan berdasarkan beberapa pustaka textbook kimia untuk menentukan ketepatan konsep. Berdasarkan hasil analisis standar isi dan konsep inti kemudian disusun indikator untuk instrumen penelitian. Berbekal pengetahuan mengenai karakteristik imu kimia, model mental, serta indikator butir soal yang telah disusun, selanjutnya dikembangkan instrumen penelitian berupa pedoman wawancara dengan TDM-IAE dan video mengenai percobaan titrasi asam basa. Instrumen tersebut kemudian divalidasi oleh lima orang dosen kimia. Jika instrumen tidak valid, maka instrumen tersebut dilakukan revisi. Jika instrumen tersebut sudah valid, maka dapat dilakukan uji coba instrumen kepada beberapa orang siswa. Hal tersebut dilakukan untuk mengetahui respon siswa terhadap pertanyaan-pertanyaan yang ada dalam pedoman wawancara sehingga saat penelitian dilakukan peneliti memiliki gambaran dari kemungkinan-kemungkinan jawaban siswa.
2. Tahap Pelaksanaan
Pada tahap pelaksanaan dilakukan pengambilan data mengenai model mental siswa pada konsep titrasi asam basa dengan TDM-IAE. Pengambilan data dilakukan di salah satu SMA Negeri di kota Bandung. Jumlah siswa yang diteliti sebanyak enam orang yang terdiri dari tiga kelompok kemampuan berbeda, yaitu dua orang siswa kemampuan tinggi, dua orang siswa kemampuan sedang, dan dua orang siswa kemampuan rendah. Penentuan siswa kemampuan tinggi, rendah, dan sedang berdasarkan penilaian guru kelas XI selama satu semester di sekolah tersebut. Tahap wawancara dilakukan secara perorangan Siswa lain tidak
diperbolehkan berada dalam satu ruangan dengan siswa yang diwawancarai dan mendengarkan percakapan saat wawancara. Pada saat pengambilan data, sebelum wawancara dimulai, kondisi siswa dibuat senyaman mungkin sehingga diharapkan mampu menjawab pertanyaan dengan optimal. Proses wawancara dimulai dengan mengamati terlebih dahulu video mengenai titrasi asam basa. Selanjutnya siswa diberikan pertanyaan umum yang ada pada pedoman wawancara. Jika jawaban siswa belum optimal maka diajukan beberapa pertanyaan probing untuk menggali jawaban siswa. Setelah dilakukan pengambilan data, peneliti mentranskripsi jawaban siswa ke dalam bentuk tulisan untuk mempermudah analisis.
3. Tahap Akhir
Pada tahap akhir, jawaban siswa yang diperoleh dari hasil wawancara yang telah ditranskripsikan ke dalam bentuk tulisan dan dilakukan interpretasi tanpa merubah makna jawaban siswa. Hasil interpretasi tersebut kemudian dibuat suatu pola jawaban siswa yang menunjukkan profil model mentalnya. Selanjutnya, profil model mental siswa dianalisis untuk menemukan miskonsepsi, troublesome knowledge, dan threshold concept yang dialami siswa pada materi titrasi asam lemah oleh basa kuat. Prosedur penelitian yang dilakukan tergambar pada alur penelitian yang disajikan pada Gambar 3.1.
Riska Padmi Dwi Utami, 2015
Studi literatur tentang karakteristik ilmu kimia
dan model mental
Menentukan pokok bahasan, analisis konten serta analisis SK dan KD dalam standar isi Kurikulum 2006
Perumusan indikator soal
Perumusan Instrumen TDM-IAE
Validasi indikator soal & instrumen TDM-IAE
Valid Revisi
Uji coba
Tidak
Ya
Pengambilan data
Transkripsi hasil wawancara
Interpretasi jawaban siswa Revisi
Tahap Persiapan
Tahap Pelaksanaan
Tahap Akhir
Siswa 1 Siswa 2 Siswa 3 Siswa 4 Siswa 5 Siswa 6
Kemampuan tinggi Kemampuan sedang Kemampuan rendah
Analisis profil model mental
Miskonsepsi Troublesome knowledge Threshold concept
Profil model mental siswa pada materi titrasi asam lemah oleh basa kuat berdasarkan TDM-IAE
D. Definisi Operasional
1. Profil model mental adalah ikhtisar yang memberikan fakta-fakta tentang representasi intrinsik mengenai kemampuan siswa dalam menggunakan dan mempertautkan ketiga level representasi kimia untuk menggambarkan dan menjelaskan suatu fenomena kimia.
2. TDM-IAE adalah salah satu jenis tes diagnostik model mental yang digunakan untuk menggali kemampuan siswa dalam menggunakan dan mempertautkan ketiga level representasi kimia untuk menggambarkan dan menjelaskan suatu fenomena kimia melalui wawancara dengan menyajikan masalah atau fenomena.
E. Instrumen Penelitian
Instrumen penelitian yang digunakan adalah serangkaian pedoman wawancara berdasarkan TDM-IAE yang berisi 8 pertanyaan umum. Setiap pertanyaan umum memiliki beberapa pertanyaan probing. Pertanyaan probing digunakan untuk menggali jawaban siswa jika siswa menjawab pertanyaan umum kurang optimal. Selain pertanyaan umum dan pertanyaan probing, jawaban yang mungkin dari setiap butir pertanyaan juga tersedia dalam pedoman wawancara. Pedoman wawancara untuk mengetahui profil model mental siswa pada materi titrasi asam lemah oleh basa kuat berdasarkan TDM-IAE secara lengkap dapat dilihat pada lampiran C.
F. Proses Pengembangan Instrumen
Pengembangan instrumen yang dilakukan pada penelitian ini terdiri dari empat tahap, yaitu analisis standar isi berdasarkan kurikulum 2006, analisis konsep titrasi asam lemah oleh basa kuat dari beberapa buku teks general chemistry, perumusan indikator butir soal, dan pengembangan instrumen wawancara berdasarkan TDM-IAE. TDM-IAE yang dikembangkan berfokus pada fenomena yang diamati dari video proses titrasi asam lemah oleh basa kuat.
Instrumen pedoman wawancara berdasarkan TDM-IAE dan video proses titrasi asam lemah oleh basa kuat divalidasi oleh validator ahli, yaitu lima
Riska Padmi Dwi Utami, 2015
orang dosen kimia. Instrumen yang telah divalidasi kemudian diuji cobakan terhadap beberapa orang siswa. Validasi instrumen terdiri dari beberapa tahap, yaitu validasi kesesuaian indikator butir soal terhadap Kompetensi Dasar (KD) berdasarkan kurikulum 2006 materi titrasi asam basa, validasi kesesuaian butir soal terhadap indikator butir soal, dan validasi kesesuaian butir soal dengan jawaban. Adapun secara lebih rinci, hasil validasi instrumen adalah sebagai berikut.
1. Hasil Validasi Kesesuaian Indikator Butir Soal terhadap Kompetensi Dasar (KD) berdasarkan Kurikulum 2006
Indikator butir soal ditentukan dari penurunan Kompetensi Dasar (KD) berdasarkan kurikulum 2006 yang terkait dengan materi titrasi asam basa. Berdasarkan hasil analisis Kompetensi Dasar (KD) tersebut, dikembangkan 8 indikator butir soal. Dari hasil validasi, indikator butir soal 3, kalimat “Menghitung pH larutan awal sebelum titrasi asam basa” diganti menjadi “Menjelaskan larutan titrat sebelum ditambahkan titran berdasarkan pH larutan”. Pada indikator butir soal 4, kalimat “Menghitung pH larutan sebelum titik ekivalen saat larutan penyangga” diganti menjadi “Menjelaskan terbentuknya larutan penyangga pada saat titrasi asam basa berdasarkan pH larutan”. Pada indikator butir soal 5, kalimat “Menghitung pH larutan pada titik ekivalen saat terjadi hidrolisis” diganti menjadi “Menjelaskan terjadinya proses hidrolisis pada saat titrasi asam basa berdasarkan pH larutan”. Pada indikator butir soal 6, kalimat “Menghitung pH larutan setelah titik ekivalen” diganti menjadi “Menjelaskan larutan titrat setelah tercapai titik ekivalen berdasarkan pH larutan”. Pada indikator butir soal 7, kata “menggambarkan dan menganalisis” pada kalimat “Menggambarkan dan menganalisis kurva titrasi asam lemah dan basa kuat untuk menjelaskan larutan penyangga dan hidrolisis.” dibagi menjadi 2 indikator butir soal yang berbeda, yaitu “Menggambarkan kurva titrasi asam basa” dan “Menganalisis kurva titrasi asam lemah dan basa kuat untuk menjelaskan larutan penyangga dan hidrolisis.”
2. Hasil Validasi Kesesuaian Butir Soal terhadap Indikator Butir Soal
Butir soal terdiri dari pertanyaan umum dan pertanyaan probing. Berdasarkan analisis hasil validasi butir soal, diputuskan bahwa pertanyaan probing dibagi menjadi dua tahap, yaitu pertanyaan probing umum dan pertanyaan probing khusus agar wawancara yang dilakukan lebih mendalam dan terarah. Dari hasil validasi butir soal, terdapat beberapa perbaikan. Pada pertanyaan probing untuk pertanyaan umum 2 tentang penentuan konsentrasi larutan CH3COOH dalam cuka yang dititrasi oleh larutan NaOH harus
ditambah pertanyaan probing khusus, seperti jumlah mol NaOH dan CH3COOH dalam larutan berdasarkan persamaan reaksi. Pada pertanyaan
probing untuk pertanyaan umum 3, 4, 5, dan 6 tentang perhitungan pH larutan harus ditambah pertanyaan probing khusus untuk menuntun siswa menurunkan rumus perhitungan pH larutan asam lemah, larutan penyangga, hidrolisis garam, dan basa kuat. Pada pertanyaan umum 7 harus ditambah pertanyaan probing umum tentang tabel, sumbu tegak dan sumbu datar pada kurva titrasi asam basa.
3. Hasil Validasi Kesesuaian Jawaban terhadap Pertanyaan dalam Pedoman Wawancara
Secara umum, jawaban pertanyaan sudah sesuai dengan pertanyaan yang dikembangkan dalam pedoman wawancara. Namun, ada beberapa jawaban yang harus diperbaiki agar sesuai dengan tujuan dari pertanyaan yang dikembangkan dalam TDM-IAE pada materi titrasi asam lemah oleh basa kuat. Jawaban pertanyaan yang direvisi antara lain, jawaban pada pertanyaan menghitung pH larutan asam lemah, pH saat terbentuk larutan penyangga, dan pH saat terjadi proses hidrolisis harus diuraikan penurunan rumusnya, sehingga jawaban pertanyaan tidak menuntut siswa menghafal konsep kimia yang berkaitan dengan level simbolik, khususnya rumus perhitungan pH tanpa mengetahui makna setiap rumusan yang ada dan mengkaitkannya dengan level submikroskopik.
Riska Padmi Dwi Utami, 2015
4. Hasil Uji Coba Instrumen Pedoman Wawancara
Instrumen hasil validasi yang telah direvisi kemudian diuji cobakan terhadap beberapa orang siswa. Uji coba dilakukan untuk mengetahui apakah butir-butir soal pada pedoman wawancara mudah dipahami oleh siswa atau tidak.
Berdasarkan hasil uji coba, ada beberapa perbaikan terhadap instrumen pedoman wawancara yang digunakan. Pada pedoman wawancara, dilakukan perbaikan pada pertanyaan umum 4 yang berbunyi “Jelaskan apakah yang terjadi ketika larutan CH3COOH dititrasi oleh larutan NaOH sebelum titik
ekivalen tercapai berdasarkan pH larutan?” menjadi “Jelaskan apakah yang terjadi ketika larutan CH3COOH dititrasi oleh 10 mL larutan NaOH
berdasarkan pH larutannya?”. Selain itu, pada pertanyaan umum 5 yang berbunyi “Jelaskan apakah yang terjadi ketika larutan CH3COOH dititrasi oleh
larutan NaOH mencapai titik ekivalen berdasarkan pH larutan?” dilakukan perbaikan menjadi “Jelaskan apakah yang terjadi ketika larutan CH3COOH
dititrasi oleh 20 mL larutan NaOH berdasarkan pH larutannya?”. Pada petanyaan umum 6 yang berbunyi “Jelaskan apakah yang terjadi ketika larutan CH3COOH dititrasi oleh larutan NaOH melewati titik ekivalen berdasarkan pH
larutan?” dilakukan perbaikan menjadi “Jelaskan apakah yang terjadi ketika larutan CH3COOH dititrasi oleh 30 mL larutan NaOH berdasarkan pH
larutannya?”. Perbaikan ini dilakukan karena pertanyaan tersebut tidak dipahami oleh siswa.
G. Teknik Pengumpulan Data
Pengumpulan data dari hasil wawancara dilakukan terhadap enam orang siswa yang terdiri dari dua orang siswa dengan kemampuan tinggi, dua orang siswa dengan kemampuan sedang, dan dua orang siswa dengan kemampuan rendah. Pemilihan keenam siswa dengan kemampuan berbeda, yaitu tinggi, sedang, dan rendah agar dapat mewakili kemampuan siswa lainnya. Siswa-siswa tersebut dipilih berdasarkan hasil diskusi dengan guru mata pelajaran kimia kelas XII IPA pada sekolah tersebut. Pengelompokkan kemampuan
siswa dilakukan berdasarkan prestasi yang diraih siswa pada mata pelajaran kimia.
Sebelum dilakukan wawancara, peneliti melakukan pendekatan kepada siswa dengan memberikan beberapa pertanyaan, seperti menanyakan kabar, pengalaman belajar kimia, dan pertanyaan lain agar siswa merasa nyaman dan tidak tegang. Jika dirasa siswa sudah merasa nyaman dan tidak tegang, siswa disajikan tayangan video proses titrasi asam lemah oleh basa kuat dan kemudian diberikan soal pada kertas yang telah dipersiapkan sebelumnya tentang penentuan konsentrasi CH3COOH dan kurva titrasi asam basa. Setelah
itu, wawancara dimulai dengan memberikan pertanyaan umum yang terdapat dalam pedoman wawancara. Jika jawaban siswa kurang optimal maka diajukan pertanyaan probing umum dan probing khusus berdasarkan jawaban yang dikemukakan siswa. Setiap proses wawancara direkam dengan rekaman suara untuk memudahkan proses analisis data. Selain itu, untuk setiap siswa disediakan alat tulis berupa pensil, ballpoint dan kertas serta alat hitung untuk memudahkan siswa menjelaskan, menghitung, dan menuliskan jawabannya.
H. Analisis Data
Analisis data yang dilakukan pada penelitian ini terdiri dari empat tahap. Pada tahap pertama, jawaban siswa mengenai penjelasan dari pertanyaan yang diajukan selama proses wawancara dalam bentuk rekaman suara dan tulisan-tulisan siswa ditranskripsikan ke dalam bentuk tulisan-tulisan. Pada tahap kedua, transkripsi jawaban siswa kemudian diinterpretasikan dengan melakukan penghalusan kata dan menyederhanakannya tanpa mengurangi makna dari jawaban siswa. Pada tahap ketiga, hasil transkripsi jawaban siswa dituangkan ke dalam pola jawaban yang menggambarkan model mentalnya. Pada tahap terakhir, analisis profil model mental siswa dilakukan untuk menemukan miskonsepsi, troublesome knowledge, dan threshold concept yang dialami oleh siswa pada materi titrasi asam lemah oleh basa kuat.
Pada pola jawaban siswa terdapat konsep dari setiap pertanyaan umum dan pertanyaan probing yang diajukan. Adapun konsep pada pola jawaban siswa adalah sebagai berikut.
Riska Padmi Dwi Utami, 2015
1. Konsep “prinsip titrasi asam basa berdasarkan reaksi netralisasi”. Konsep ini menunjukkan penjelasan siswa pada level makroskopik dan submikroskopik melalui pengamatan dari video proses titrasi asam lemah oleh basa kuat dan submikroskopik. Konsep ini merupakan konsep dari pertanyaan umum 1. Jawaban benar untuk konsep ini adalah “Prinsip titrasi asam basa adalah reaksi netralisasi. Reaksi netralisasi adalah reaksi antara asam dan basa dimana ion H+ dari asam akan bereaksi dengan ion OH- dari basa membentuk molekul H2O
Persamaan reaksi netralisasi asam basa adalah sebagai berikut. H+(aq) + OH-(aq) → H2O(l)
Reaksi netralisasi ini dapat digunakan untuk menentukan kadar suatu asam dengan menggunakan larutan basa yang telah diketahui kadarnya (larutan standar) atau sebaliknya. Berdasarkan video yang telah ditayangkan, larutan yang akan ditentukan konsentrasinya adalah larutan CH3COOH,
sedangkan larutan yang telah diketahui konsentrasinya adalah larutan NaOH. Larutan yang telah diketahui kadarnya ditambahkan setetes demi setetes ke dalam larutan yang akan ditentukan kadarnya sampai titik ekivalen tercapai yang biasanya ditandai dengan berubahnya warna indikator. Indikator digunakan untuk menunjukkan sifat asam/basa dari suatu larutan melalui perubahan warna yang khas. Titik ekivalen adalah titik ketika semua mol ion H+ tepat bereaksi dengan jumlah ekivalen mol ion OH- yang ditambahkan. Titik akhir titrasi adalah titik ketika terjadinya perubahan warna indikator, untuk indikator fenolftalein perubahan dari larutan tidak berwarna menjadi larutan berwarna merah muda.
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep reaksi netralisasi asam basa, larutan titrat dan titran, indikator, titik ekivalen, dan titik akhir titrasi.
2. Konsep “penentuan konsentrasi asam asetat dalam cuka berdasarkan proses titrasi asam basa”
Konsep ini menunjukkan penjelasan siswa pada level simbolik. Konsep ini merupakan konsep dari pertanyaan umum 2. Jawaban benar untuk konsep ini adalah sebagai berikut.
Persamaan reaksi
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Data yang diketahui : M NaOH = 0,1 M
V NaOH saat titik akhir titrasi = 20 mL V CH3COOH = 20 mL
n NaOH = M NaOH × V NaOH = 0,1 M × 20 mL = 2 mmol n CH3COOH = 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝐶𝐻3𝐶𝑂𝑂𝐻 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑁𝑎𝑂𝐻 × mol NaOH = 11 × 2 mmol = 2 mmol M CH3COOH = 𝑛 𝐶𝐻3𝐶𝑂𝑂𝐻 𝑉 𝐶𝐻3𝐶𝑂𝑂𝐻 = 2 𝑚𝑚𝑜𝑙20 𝑚𝐿 = 0,1 M
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep data-data yang diketahui, persamaan reaksi, perhitungan kimia, dan konsentrasi asam asetat.
3. Konsep “menjelaskan larutan titrat sebelum ditambah titran berdasarkan pH larutan”
Konsep ini menunjukkan penjelasan siswa pada level submikroskopik dan simbolik. Konsep ini merupakan konsep dari pertanyaan umum 3. Jawaban benar untuk konsep ini adalah sebagai berikut.
Sebelum larutan NaOH ditambahkan, komponen dalam larutan hanya terdapat CH3COOH.
Persamaan reaksi ionisasi CH3COOH :
CH3COOH(aq) ⇌ H+(aq) + CH3COO-(aq)
Pada tahap awal titrasi sebelum NaOH ditambahkan, spesi utama dalam larutan adalah CH3COOH, CH3COO-, H+ dan H2O. Asam lemah
CH3COOH hanya terionisasi sebagian menjadi ion-ionnya di dalam
larutan. Reaksi ionisasinya merupakan reaksi kesetimbangan, sehingga untuk asam lemah CH3COOH, konsentrasi H+ dalam larutan bergantung
Riska Padmi Dwi Utami, 2015
Perhitungan pH larutan CH3COOH 0,1 M
Ka =
[𝐶𝐻3𝐶𝑂𝑂−][𝐻+]
[𝐶𝐻3𝐶𝑂𝑂𝐻]
Karena [H+] = [CH3COO-], maka
Ka = [𝐻+]2 [𝐶𝐻3𝐶𝑂𝑂𝐻] [H+]2 = Ka × [CH3COOH] [H+] = √𝐾𝑎 × [CH3COOH] = √1,8 × 10−5× 10−1𝑀 = √1,8 × 10−6 = 1,34 × 10-3 pH = - log [H+] = - log (1,34 x 10-3) = 3 – log 1,34 = 2,87
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep reaksi ionisasi asam lemah, spesi-spesi dalam larutan, konsentrasi H+/nilai pH.
4. Konsep “menjelaskan terbentuknya larutan penyangga pada saat titrasi asam basa berdasarkan pH larutan”
Konsep ini menunjukkan penjelasan siswa pada level submikroskopik dan simbolik. Konsep ini merupakan konsep pada pertanyaan umum 4. Jawaban benar untuk konsep ini adalah sebagai berikut.
“Ketika larutan CH3COOH dititrasi oleh 10 mL larutan NaOH, belum
terjadi perubahan warna larutan. Spesi dalam larutan CH3COOH adalah
CH3COOH, CH3COO-, dan H+. Spesi dalam larutan NaOH adalah Na+ dan
OH-. Ketika larutan CH3COOH dan NaOH dicampurkan, akan terjadi
interaksi antara ion H+ dengan ion OH- menghasilkan molekul H2O.
Sedangkan ion Na+ dan ion CH3COO- tetap berada dalam ion-ionnya.
Jumlah mol pereaksi dan produk pada saat awal, bereaksi, dan akhir setelah penambahan 10 mL larutan NaOH.
M CH3COOH = 0,1 M
V CH3COOH = 20 mL
n CH3COOH = M CH3COOH × V CH3COOH
M NaOH = 0,1 M V NaOH = 10 mL
n NaOH = M NaOH × V NaOH
= 0,1 M × 10 mL = 1 mmol
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Awal 2 mmol 1 mmol
Bereaksi 1 mmol 1 mmol 1 mmol 1 mmol
Akhir 1 mmol - 1 mmol 1 mmol
Spesi utama yang terdapat dalam larutan setelah bereaksi adalah molekul CH3COOH, ion CH3COO-, ion Na+, dan molekul H2O. Adanya molekul
CH3COOH dan ion CH3COO- dalam larutan akan menyebabkan larutan
bersifat penyangga. M CH3COONa = 𝑛 𝐶𝐻3𝐶𝑂𝑂𝑁𝑎 𝑉 𝑐𝑎𝑚𝑝𝑢𝑟𝑎𝑛 dan M CH3COOH = 𝑛 𝐶𝐻3𝐶𝑂𝑂𝐻 𝑉 𝑐𝑎𝑚𝑝𝑢𝑟𝑎𝑛 = 1 𝑚𝑚𝑜𝑙30 𝑚𝐿 = 1 𝑚𝑚𝑜𝑙30 𝑚𝐿 = 0,03 M = 0,03 M
Persamaan reaksi ionisasi CH3COONa dan CH3COOH
CH3COONa(aq) → Na+(aq) + CH3COO-(aq)
0,03 M 0,03 M 0,03 M
CH3COOH(aq) ⇌ H+(aq) + CH3COO-(aq)
0,03 M x M x M
[CH3COO-] berasal dari garam dan asam, tetapi karena yang berasal dari
asam sangat kecil maka [CH3COO-] dianggap seluruhnya berasal dari
garam [CH3COONa]. Ka = [𝐶𝐻3𝐶𝑂𝑂−][𝐻+] [𝐶𝐻3𝐶𝑂𝑂𝐻] [H+] = Ka × [𝐶𝐻3𝐶𝑂𝑂𝐻] [𝐶𝐻3𝐶𝑂𝑂−] = 1,8 𝑥 10-5 × (0,03 𝑀)(0,03 𝑀) = 1,8 𝑥 10-5 pH = - log [H+] = - log (1,8 𝑥 10-5 ) = 5 – log 1,8 = 4,74
Riska Padmi Dwi Utami, 2015
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep spesi dalam larutan, interaksi antar spesi dan konsentrasi [H+]/nilai pH.
5. Konsep “menjelaskan terjadinya proses hidrolisis pada saat titrasi asam basa berdasarkan pH larutan”
Konsep ini menunjukkan penjelasan siswa pada level submikroskopik dan simbolik. Konsep ini merupakan konsep pada pertanyaan umum 5. Jawaban benar untuk konsep ini adalah sebagai berikut.
Ketika larutan CH3COOH dititrasi oleh 20 mL larutan NaOH terjadi
perubahan dari larutan tidak berwarna menjadi larutan berwarna merah muda, artinya telah tercapai titik ekivalen. Pada titik ekivalen, semua H+ dari CH3COOH sudah bereaksi dengan OH- dari NaOH membentuk
molekul air.
Jumlah mol pereaksi dan produk pada saat awal, bereaksi, dan akhir setelah penambahan 20 mL larutan NaOH.
M CH3COOH = 0,1 M
V CH3COOH = 20 mL
n CH3COOH = M CH3COOH × V CH3COOH
= 0,1 M × 20 mL = 2 mmol
M NaOH = 0,1 M V NaOH = 20 mL
n NaOH = M NaOH × V NaOH
= 0,1 M × 20 mL = 2 mmol
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Awal 2 mmol 2 mmol
Bereaksi 2 mmol 2 mmol 2 mmol 2 mmol
Akhir - - 2 mmol 2 mmol
Spesi utama yang terdapat dalam larutan setelah bereaksi adalah ion Na+, ion CH3COO-, dan molekul H2O. Ion CH3COO- merupakan suatu basa
konjugat dari CH3COOH dan memiliki afinitas kuat terhadap proton,
konjugat akan bereaksi dengan air (terhidrolisis) menghasilkan CH3COOH
dan OH- sehingga nilai pH pada titik ekivalen lebih besar dari 7. Persamaan reaksi ionisasi CH3COONa dan hidrolisis CH3COO-
CH3COONa(aq) → Na+(aq) + CH3COO-(aq)
CH3COO-(aq)+H2O(l) ⇌ CH3COOH(aq)+OH-(aq)
Kh = [𝐶𝐻3𝐶𝑂𝑂𝐻][𝑂𝐻−] [𝐶𝐻3𝐶𝑂𝑂−] Kh = [𝑂𝐻−]2 [𝐶𝐻3𝐶𝑂𝑂−] [OH-]2 = Kh 𝑥[𝐶𝐻3𝐶𝑂𝑂−] [OH-] = √𝐾ℎ 𝑥 [𝐶𝐻3𝐶𝑂𝑂−] Penentuan nilai tetapan hidrolisis (Kh)
Kh = [𝐶𝐻3𝐶𝑂𝑂𝐻][𝑂𝐻−] [𝐶𝐻3𝐶𝑂𝑂−] × [𝐻+] [𝐻+] = [𝐶𝐻3𝐶𝑂𝑂𝐻] [𝐶𝐻3𝐶𝑂𝑂−][𝐻+] × [OH -][H+] = 1 𝐾𝑎 × Kw = 𝐾𝑤 𝐾𝑎 = 1 ×10−14 1,8 ×10−5 Kh = 5,6 × 10-10
Perhitungan pH larutan saat terjadi proses hidrolisis [CH3COO-] = 𝑛 𝐶𝐻3𝐶𝑂𝑂𝑁𝑎 𝑉 𝑐𝑎𝑚𝑝𝑢𝑟𝑎𝑛 = 2 𝑚𝑚𝑜𝑙 40 𝑚𝐿 = 5 × 10 -2 M [OH-] = √𝐾ℎ 𝑥 [𝐶𝐻3𝐶𝑂𝑂−] = √5,6 × 10−10× 5 × 10−2 𝑀 =√27,5 𝑥 10−11 = 5,24 x 10-6 pOH = -log [OH-]
= -log (5,24 x 10-6) = 6-log 5,24 = 5,28 pH = 14 – pOH
= 14 – 5,28 = 8,72
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep spesi dalam larutan, interaksi antar spesi dan konsentrasi [H+]/nilai pH.
Riska Padmi Dwi Utami, 2015
6. Konsep “menjelaskan larutan titrat setelah tercapai titik ekivalen berdasarkan pH larutan”
Konsep ini menunjukkan penjelasan siswa pada level submikroskopik dan simbolik. Konsep ini merupakan konsep pada pertanyaan umum 6. Jawaban benar untuk konsep ini adalah sebagai berikut.
Ketika larutan CH3COOH dititrasi oleh 30 mL larutan NaOH, terjadi
perubahan dari larutan berwarna merah muda (pada saat titik akhir titrasi) menjadi larutan berwarna merah muda lebih pekat. Jumlah mol pereaksi dan produk pada saat awal, bereaksi, dan akhir setelah penambahan 30 mL larutan NaOH.
M CH3COOH = 0,1 M
V CH3COOH = 20 mL
n CH3COOH = M CH3COOH × V CH3COOH
= 0,1 M × 20 mL = 2 mmol
M NaOH = 0,1 M V NaOH = 30 mL
n NaOH = M NaOH × V NaOH
= 0,1 M × 30 mL = 3 mmol
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Awal 2 mmol 3 mmol
Bereaksi 2 mmol 2 mmol 2 mmol 2 mmol
Akhir - 1 mmol 2 mmol 2 mmol
Spesi utama yang terdapat dalam larutan setelah bereaksi adalah ion CH3COO-, ion Na+, ion OH- dan molekul H2O. Perhitungan nilai pH
ditentukan oleh konsentrasi OH- yang berasal dari kelebihan NaOH dalam larutan setelah bereaksi.
[NaOH] = 𝑛 𝑁𝑎𝑂𝐻 𝑠𝑒𝑡𝑒𝑙𝑎ℎ 𝑏𝑒𝑟𝑒𝑎𝑘𝑠𝑖𝑉 𝑐𝑎𝑚𝑝𝑢𝑟𝑎𝑛 = 1 𝑚𝑚𝑜𝑙50 𝑚𝐿 = 0,02 M Persamaan reaksi ionisasi NaOH NaOH(aq) → Na+
(aq) + OH-(aq)
[OH-] = 0,02 M = 2 × 10-2 pOH = - log [OH-]
= - log (2 × 10-2) = 2 – log 2 = 1,7 pH = 14 – pOH
= 14 – 1,7 = 12,3
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep spesi dalam larutan, interaksi antar spesi dan konsentrasi [H+]/nilai pH.
7. Konsep “menggambarkan kurva titrasi asam basa”
Konsep ini menunjukkan penjelasan siswa pada level simbolik. Konsep ini merupakan konsep pada pertanyaan umum 7. Jawaban benar untuk konsep ini adalah sebagai berikut.
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep tabel, sumbu datar dan sumbu tegak pada kurva titrasi asam basa.
8. Konsep “menganalisis kurva titrasi asam lemah oleh basa kuat untuk menjelaskan larutan penyangga dan hidrolisis”
Konsep ini menunjukkan penjelasan siswa pada level simbolik. Konsep ini merupakan konsep pada pertanyaan umum 8. Jawaban benar untuk konsep ini adalah sebagai berikut.
0 2 4 6 8 10 12 14 0 20 40 60 pH
Volume NaOH yang ditambahkan (mL) Kurva Titrasi Asam Lemah
Riska Padmi Dwi Utami, 2015
“Pada tahap awal titrasi sebelum NaOH ditambahkan, spesi utama dalam larutan adalah CH3COOH, CH3COO-, H+ dan H2O. Asam lemah
CH3COOH hanya terionisasi sebagian menjadi ion-ionnya di dalam
larutan. Reaksi ionisasinya merupakan reaksi kesetimbangan, sehingga untuk asam lemah CH3COO , konsentrasi H+ dalam larutan bergantung
pada nilai tetapan kesetimbangan ionisasi asamnya (Ka).
Sebelum titik ekivalen, ketika NaOH ditambahkan ke dalam larutan CH3COOH, reaksi yang terjadi akan menghasilkan CH3COO-.
Spesi yang ada pada tahap ini adalah CH3COO-, CH3COOH, Na+ dan
H2O. Adanya CH3COO- dan CH3COOH dalam larutan akan menyebabkan
larutan bersifat penyangga sehingga pada tahap ini perubahan nilai pH terjadi relatif sangat kecil.
Pada titik ekivalen, semua CH3COOH telah habis bereaksi dengan
NaOH. Spesi utama dalam larutan adalah Na+, CH3COO-, dan H2O. Spesi
CH3COO- merupakan suatu basa konjugat dari CH3COOH dan memiliki
afinitas kuat terhadap proton, sedangkan sumber utama proton dalam larutan adalah air, maka basa konjugat akan bereaksi dengan air (terhidrolisis) menghasilkan CH3COOH dan OH- sehingga nilai pH pada
titik ekivalen lebih besar dari 7.
Setelah titik ekivalen, penambahan NaOH lebih lanjut akan menyebabkan larutan menjadi semakin basa dan spesi utama dalam larutan adalah Na+, CH3COO-, OH- dan H2O. Perhitungan nilai pH ditentukan
2.87 4,74 8.72 12,3 0 2 4 6 8 10 12 14 0 20 40 60 pH
Volume NaOH yang ditambahkan (mL) Kurva Titrasi Asam Lemah
oleh Basa Kuat
pH awal larutan
Daerah larutan penyangga Titik ekivalen
oleh konsentrasi OH- yang berasal dari kelebihan NaOH dalam larutan setelah bereaksi.”
Jika siswa belum menjawab secara optimal maka diberikan pertanyaan probing dengan konsep pH larutan awal, daerah larutan penyangga, titik ekivalen saat terjadinya hidrolisis, pH larutan setelah titik ekivalen.
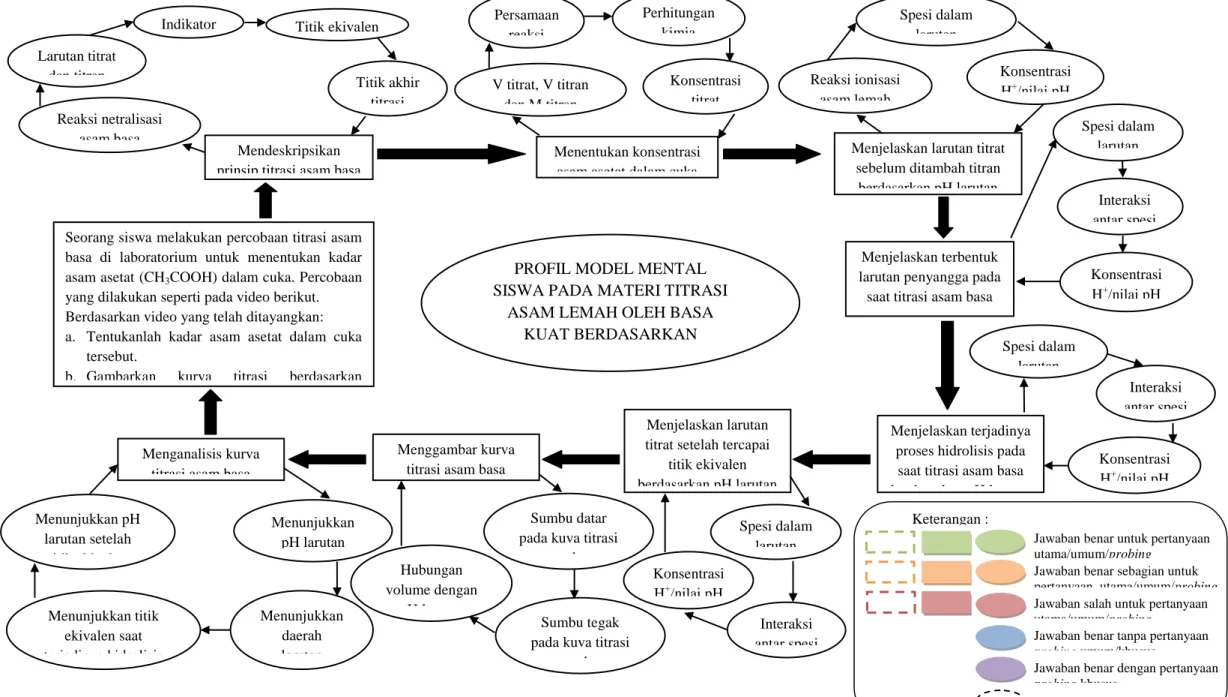
Berdasarkan gambar 3.2 dapat terlihat bahwa setiap pertanyaan umum dan pertanyaan probing dibuat suatu pola jawaban siswa. Konsep untuk pertanyaan umum dibuat dalam suatu persegi. Sedangkan konsep untuk pertanyaan probing dibuat dalam bulatan elips. Setiap konsep dari pertanyaan umum dihubungkan oleh tanda panah hitam dengan cetakan tebal yang menunjukkan alur jawaban siswa. Setiap konsep untuk pertanyaan probing dihubungkan oleh tanda panah dengan cetakan tipis. Jawaban siswa yang diperoleh dari hasil wawancara kemudian disesuaikan dengan pola profil model mental yang telah dibuat.
Pada tahap pengolahan data, pertanyaan utama yang dijawab benar digambarkan dengan persegi tidak berwarna dengan garis putus-putus berwarna hijau, pertanyaan utama yang dijawab benar sebagian digambarkan dengan persegi tidak berwarna dengan garis putus-putus berwarna jingga, pertanyaan utama yang dijawab salah digambarkan dengan persegi tidak berwarna dengan garis putus-putus berwarna merah. Untuk pertanyaan umum yang dijawab benar digambarkan dengan persegi berwarna hijau, pertanyaan umum yang dijawab benar sebagian digambarkan dengan persegi berwarna jingga, pertanyaan umum yang dijawab salah digambarkan dengan persegi berwarna merah. Untuk pertanyaan probing umum yang dijawab benar tanpa pertanyaan probing khusus digambarkan dengan bulatan elips berwarna hijau, pertanyaan probing umum yang dijawab benar dengan pertanyaan probing khusus digambarkan dengan bulatan elips berwarna ungu, pertanyaan probing yang dijawab benar sebagian digambarkan dengan bulatan elips berwarna jingga, pertanyaan probing yang dijawab salah digambarkan dengan bulatan elips berwarna merah, pertanyaan probing yang tidak dilalui digambarkan dengan bulatan elips berwarna biru, dan pertanyaan probing yang tidak dijawab digambarkan dengan bulatan elips tidak berwarna.
Riska Padmi Dwi Utami, 2015 Mendeskripsikan prinsip titrasi asam basa Reaksi netralisasi
asam basa
dan titran Titik akhir
titrasi
Menjelaskan terbentuk larutan penyangga pada
saat titrasi asam basa berdasarkan pH larutan Reaksi ionisasi asam lemah Konsentrasi H+/nilai pH Menjelaskan terjadinya proses hidrolisis pada
saat titrasi asam basa berdasarkan pH larutan Interaksi antar spesi Spesi dalam larutan Konsentrasi H+/nilai pH Menjelaskan larutan
titrat setelah tercapai titik ekivalen berdasarkan pH larutan Seorang siswa melakukan percobaan titrasi asam
basa di laboratorium untuk menentukan kadar asam asetat (CH3COOH) dalam cuka. Percobaan yang dilakukan seperti pada video berikut. Berdasarkan video yang telah ditayangkan: a. Tentukanlah kadar asam asetat dalam cuka
tersebut.
b. Gambarkan kurva titrasi berdasarkan perubahan pH dan berikan penjelasannya
Menganalisis kurva titrasi asam basa
Konsentrasi H+/nilai pH Menunjukkan pH larutan awal Menunjukkan daerah larutan penyangga
PROFIL MODEL MENTAL SISWA PADA MATERI TITRASI
ASAM LEMAH OLEH BASA KUAT BERDASARKAN STRATEGI EVALUASI MODEL
IAE
Menjelaskan larutan titrat sebelum ditambah titran
berdasarkan pH larutan Menentukan konsentrasi
asam asetat dalam cuka V titrat, V titran dan M titran Konsentrasi titrat Spesi dalam larutan Spesi dalam larutan Konsentrasi H+/nilai pH Menunjukkan titik ekivalen saat terjadinya hidrolisis Interaksi antar spesi Interaksi antar spesi Menunjukkan pH larutan setelah titik ekivalen Menggambar kurva titrasi asam basa
Sumbu datar pada kuva titrasi
asam basa
Sumbu tegak pada kuva titrasi
asam basa Hubungan
volume dengan pH larutan
Gambar 3.2. Profil Model Mental Siswa pada Materi Titrasi Asam Lemah oleh Basa Kuat
Keterangan :
Jawaban benar untuk pertanyaan utama/umum/probing
Jawaban benar dengan pertanyaan
probing khusus
Jawaban benar tanpa pertanyaan
probing umum/khusus Jawaban benar sebagian untuk pertanyaan utama/umum/probing
Jawaban salah untuk pertanyaan utama/umum/probing