BAB II
DASAR TEORI
2.1 Adsorpsi
Adsorpsi merupakan suatu proses penyerapan oleh padatan tertentu terhadap zat tertentu yang terjadi pada permukaan padat karena adanya gaya tarik atom atau molekul pada permukaan zat padat tanpa meresap kedalam (Atskin, 1999). Adsorbsi merupakan peristiwa penjerapan dipermukaan oleh suatu adsorben atau daya jerap dari zat penjerap yang terjadi pada permukaan. Peristiwa adsorpsi dapat terjadi karena adsorben yang umum-nya zat padat, terdiri dari atom-atom atau molekul-molekul yang saling tarik-menarik dengan gaya Van der Waals. Bila ditinjau dari molekul-molekul dalam zat padat oleh karena banyaknya
molekul-molekul atau atom-atom yang mengelilingi tiap-tiap arah sama, maka gaya tarik antara molekul yang satu dengan yang lain disekelilingnya adalah seimbang, sebab gaya tarik yang satu akan dinetralkan oleh yang lain yang letaknya simetris atau dengan kata lain resultan gayanya sama dengan nol. Lain halnya dengan yang ada pada permukaan, gaya-gaya tersebut tidak seimbang oleh karena pada satu arah di sekeliling molekul tersebut akan mempunyai sifat menarik molekul-molekul gas atau solute pada permukannya. Fenomena ini disebut adsorpsi (Reynolds, 1992).
5
Adsorpsi adalah peristiwa penyerapan suatu zat, ion atau molekul yang melekat pada permukaan, dimana molekul dari suatu materi terkumpul pada bahan pengadsorpsi atau adsorben. Sifat adsorpsi partikel koloid banyak dimanfaatkan dalam proses penjernihan air atau pemurnian suatu bahan yang masih mengandung pengotor, partikel koloid mempunyai permukaan luas sehingga mempunyai daya serap adsorpsi yang besar. Terjadinya adsorpsi pada permukaan larutan disebabkan karena adanya kekuatan atau gaya tarik menarik antara atom atau molekul pada permukaan larutan. Peristiwa penyerapan suatu zat pada permukaan zat lain disebut adsorpsi, zat yang diserap disebut fase terserap sedangkan zat yang menyerap disebut adsorben. Peristiwa adsorpsi disebabkan oleh gaya tarik molekul dipermukaan adsorben (Estein, 2005).
Berdasarkan daya tarik molekul adsorben dengan adsorbat, adsorpsi dibedakan menjadi dua, yaitu:
a. Adsorpsi fisika
Adsorpsi yang disebabkan oleh gaya Van Der Wall yang ada pada permukaan adsorben, panas adsorpsinya rendah dan lapisan yang terjadi pada permukaan adsorben biasanya lebih kecil dari satu molekul. Adsorpsi secara fisik terjadi karena adanya perbedaan energi atau gaya tarik menarik elektrik (gaya Van der Waals) sehingga molekul-molekul adsorbat secara fisik terikat pada molekul adsorben. Jenis adsorpsi ini umumnya adalah lapisan ganda (multi layer) dalam hal ini tiap lapisan molekul terbentuk di atas lapisan-lapisan yang proporsional dengan konsentrasi kontaminan. Adsorpsi fisik ini bersifat dapat balik (reversible)
yang berarti atom-atom atau ion-ion yang terikat dapat dilepaskan kembali dengan bantuan pelarut tertentu yang sesuai dengan sifat ion yang diikat (Rumidatul, 2006).
b. Adsorpsi kimia
Adsorpsi yang terjadi karena adanya reaksi antara zat yang diserap dengan adsorben panas adsorpsinya tinggi lapisan molekul pada adsorben hanya satu lapis, terbentuk ikatan kimia. Peristiwa adsorpsi disebabkan oleh daya tarik molekul di permukaan adsorben. Adsorpsi menurunkan ketidakseimbangan daya tarik yang terjadi di permukaan (Alberty, 1992). Cheremisinoff dan Ellerbusch mengemukakan bahwa adsorpsi secara kimia dimana ikatan yang terjadi adalah ikatan kimia yang kuat dan bersifat tidak dapat balik (irreversible) karena pada pembentukannya diperlukan energi pengaktifan sehingga untuk melepaskannya diperlukan pula energi yang besarnya relative sama dengan energi pembentukan (Rumidatul, 2006).
Beberapa gaya yang dapat menyebabkan terjadinya adsorpsi diantaranya adalah : (1) interaksi non polar Van der Wall, (2) pembentukan ikatan hidrogen, (3) pertukaran ion dan (4) pembentukan ikatan kovalen. Adsorpsi fisika sering sekali menunjukkan adsorpsi dari adanya gaya Van der Wall, terjadi karena adanya gaya adhesi antara zat terlarut dengan adsorben. Gaya-gaya paling kuat yang ada dalam adsorpsi molekul-molekul kecil dari larutan cair yaitu pertukaran ion dan ikatan hidrogen. Adsorpsi zat terlarut oleh adsorben padat cenderung membentuk ikatan hidrogen jika salah satu mempunyai kelompok ikatan hidrogen
sebagai donor dan yang lainnya sebagai akseptor (Yun dkk., 2001 dan Alberty dkk, 1992).
Gaya Van der Waals merupakan gaya terlemah dengan energy sekitar 0,4 sampai 40 kJ/mol. Gaya ini biasanya tertutupi oleh gaya kovalen yang lebih kuat di dalam molekul. Gaya tersebut digunakan untuk menjelaskan orbital yang tidak memungkinkan terjadinya ikatan kovalen. Gaya Van der Waals dapat bekerja pada jarak yang tidak dapat menyebabkan pertumpangtindihan sehingga dikaitkan dengan energi yang lebih kecil (Companon, 1991). Gaya Van der Waals telah dikenali ada di atom atau senyawa molecular netral. Jarak terdekat namun non- ikatan antar atom diperkirakan dengan menjumlahkan jari-jari Van der Waals yang diberikan untuk masing-masing atom. Gaya Van der Waals dengan mudah akan terlepas bila dikenai gaya (Saito, 1996).
Secara umum, faktor-faktor yang mempengaruhi dari proses adsorpsi adalah sebagai berikut:
a. Luas permukaan
Semakin luas permukaan adsorben, maka makin banyak zat yang teradsorpsi. Luas permukaan adsorben ditentukan oleh ukuran partikel dan jumlah dari adsorben.
b. Jenis adsorbat
Peningkatan polarisabilitas adsorbat akan meningkatkan kemampuan adsorpsi molekul yang mempunyai polarisabilitas yang tinggi (polar) memiliki
kemampuan tarik-menarik terhadap molekul lain dibandingkan molekul yang tidak dapat membentuk dipol (nonpolar). Peningkatan berat molekul adsorbat dapat meningkatkan kemampuan adsorpsi. Adsorbat dengan rantai yang bercabang biasanya lebih mudah diadsorp dibandingkan rantai yang lurus.
c. Struktur molekul adsorbat
Hidroksil dan amino mengakibatkan mengurangi kemampuan penyisihan sedangkan nitrogen meningkatkan kemampuan penyisihan.
d. Konsentrasi adsorbat
Semakin besar konsentrasi adsorbat dalam larutan maka semakin banyak jumlah substansi yang terkumpul pada permukaan adsorben.
e. Temperatur
Pemanasan atau pengaktifan adsorben akan meningkatkan daya serap adsorben terhadap adsorbat menyebabkan pori-pori adsorben lebih terbuka.
Pemanasan yang terlalu tinggi menyebabkan rusaknya adsorben sehingga kemampuan penyerapannya menurun.
1. pH larutan mempengaruhi kelarutan ion logam, aktivitas gugus fungsi pada biosorben dan kompetisi ion logam dalam proses adsorpsi.
2. Kecepatan pengadukan, menentukan kecepatan waktu kontak adsorben dan adsorbat. Bila pengadukan terlalu lambat maka proses adsorpsi berlangsung
2- - -
lambat pula, tetapi bila pengadukan terlalu cepat kemungkinan struktur adsorben cepat rusak, sehingga proses adsorpsi kurang optimal.
3. Waktu kontak, penentuan waktu kontak yang menghasilkan kapasitas adsorpsi maksimum terjadi pada waktu kesetimbangan. Waktu kesetimbangan dipengaruhi oleh tipe biomassa (aktif atau tidak aktif), ion yang terlibat dalam system biosorpsi, konsentrasi ion logam.
Hubungan antara jumlah adsorbat yang terserap dengan konsentrasi adsorbat dalam larutan pada keadaan kesetimbangan dan suhu tetap dapat dinyatakan dengan isoterm adsorpsi (Sembodo, 2006). Dalam adsorpsi terjadi proses pengikatan oleh permukaan adsorben padatan atau cairan terhadap adsorbat atom-atom, ion-ion atau molekul-molekul gas atau cairan lainnya.Proses adsorpsi melibatkan ikatan intramolekuler diantara keduanya. Sehingga, proses pengikatan tersebut dapat menghilangkan logam (Keteran, 1986). Logam yang akan diikat merupakan atom pusat pada ikatan koordinasi, dimana urutan kekuatan ligan yaitu CO~CN- > NO2- > EDTA > pir > NH3 > H2O > NCS- > C2O4 > CH3COO > OH
> Urea > F- > Cl- > Br - > I- (Companion, 1991).
2.2 Sekam Padi
Sekam dikategorikan sebagai biomassa yang dapat digunakan untuk berbagai kebutuhan seperti bahan baku industri, pakan ternak dan energi atau bahan bakar ataupun sebagai adsorpsi pada logam-logam berat. Sekam tersusun dari jaringan serat-serat selulosa yang mengandung banyak silika dalam bentuk serabut-serabut yang sangat keras. Pada keadaan normal, sekam berperan penting
melindungi biji beras dari kerusakan yang disebabkan oleh serangan jamur, dapat mencegah reaksi ketengikan karena dapat melindungi lapisan tipis yang kaya minyak terhadap kerusakan mekanis selama pemanenan, penggilingan dan pengangkutan (Haryadi, 2006).
Sifat sekam padi yang rendah nilai gizinya, tahan terhadap pelapukan, memiliki kandungan abu yang tinggi, bersifat abrasif, menyerupai kandungan kayu, serta memiliki kandungan karbon yang cukup tinggi (Danarto, 2007).
Ditinjau dari komposisi kimiawinya, sekam mengandung beberapa unsur penting sebagai yang tercantum pada Tabel 2.
Tabel 2. Komposisi kimia sekam padi (% berat)
Komponen % (berart)
H2O 2,4 - 11,35
Crude Protein 1,7 - 7,26
Crude Fat 0,38 - 2,98
Ekstrak nitrogen bebas 24,7 - 38,79
Crude Fiber 31,37 - 49,92
Abu 13,16 - 29,04
Pentosa 16,94 - 21,95
Sellulosa 34,34 - 43,80
Lignin 21,40 - 46,97
Sumber: Saptowati, 2000
Sedangkan kandungan kimia dari abu hasil pembakaran sekam padi adalah seperti yang tercantum pada Tabel 3.
Tabel 3. Komposisi kimia abu sekam padi (% berat)
Komponen % Berat
SiO2 86,9 - 97,8
K2O 0,58 - 2,50
Na2O 0,0 - 1,75
CaO 0,20 - 1,50
MgO 0,12 - 1,96
Fe2O3 0,0 - 0,54
P2O5 0,20 - 2,84
SO3 0,10 - 1,13
Cl 0,0 - 0,41
Sumber: Soenardjo, 1991
Adapun pemanfaatan sekam padi di bidang industri ialah sebagai berikut:
a. Sumber Silika
Sekitar 20% silika dalam sekam padi merupakan suatu sumber silika yang cukup tinggi, silika dari sekam merupakan saingan dari sumber silika lain seperti pasir, bentonit dan tanah diatomae tetapi biasanya silika dari sekam padi mempunyai keuntungan karena jumlah elemen lain (pengotor) yang tidak diinginkan adalah sangat sedikit dibandingkan jumlah silikanya. Silika diperoleh dari pembakaran sekam untuk menghasilkan abu atau secara ekstraksi sebagai natrium silikat dengan larutan alkali.
b. Pemurnian Air
Pemanfaatan sekam antara lain sebagai sumber energi, abu gosok yaitu untuk keperluan rumah tangga, bahan pencampur untuk pembuatan semen portland dalam bidang industri, selain itu untuk menjernihkan air. Pemanfaatan sekam padi untuk menjernihkan air yaitu melalui proses filtrasi/penyaringan partikel, koagulasi dan adsorpsi. Akan tetapi karbon yang terkandung didalam sekam padi berfungsi sebagai koagulan pembantu dengan menyerap atau menurunkan kadar logam pada air yang tercemar.
c. Bahan Bakar
Pembakaran merupakan satu metode yang umum dan sering digunakan dalam proses akhir pengolahan sekam padi. Sekam padi yang dibakar secara langsung untuk meneruskan aliran uapnya atau digunakan di dalam generator untuk menghasilkan tenaga penguat dengan minyak yang memiliki nilai bahan bakar.
d. Bahan Bangunan
Manfaat sekam padi adalah sebagai bahan bangunan yang berhubungan dengan pengerasan balok, batu bata, ubin, batu tulis dan sifat lunak. Yang dapat dimanfaatkan sesuai dengan fungsinya.
Silika Gel
Salah satu bahan yang telah berhasil dibuat dengan bahan dasar abu sekam padi adalah silika gel. Kegunaan silika gel didasarkan pada keberadaan situs aktif berupa gugus silanol (Si – OH) dan siloksan (Si – O – Si) di permukaan dan sifat fisiknya seperti kestabilan mekanik, dan luas permukaan. Gugus silanol (Si – OH)
inilah yang memberikan sifat polar pada silika gel dan merupakan sisi aktif dari silika gel. Permukaan yang kompleks dari silika gel yakni terdiri atas lebih dari satu macam tipe gugus hidroksil –OH yang terikat pada permukaan silika gel (Narsito, 2005). Luas permukaan silika gel yang besar 300-800 m2/g, akibat dari banyaknya pori yang dimilikinya. Sifat yang paling penting dari silika gel adalah sebagai adsorben yang dapat diregenerasi. Silika gel memiliki kemampuan menyerap yang sangat besar terhadap molekul-molekul air. Dengan bertambahnya luas permukaan silika gel, porositas silika gel juga akan bertambah. Gel silika adalah butiran seperti kaca dengan bentuk yang sangat berpori, silika dibuat secara sintetis dari natrium silikat. Walaupun namanya gel silika padat, gel silika adalah mineral alami yang dimurnikan dan diolah menjadi salah satu bentuk butiran atau manik-manik.
Sebagai pengering, ia memiliki ukuran pori rata-rata 2,2-2,6 nanometer dan memiliki afinitas yang kuat untuk molekul air. Silika gel merupakan suatu bentuk dari silika yang dihasilkan melalui penggumpalan sol natrium silikat (NaSiO2). Sol yang mirip agar dapat didehidrasi sehingga berubah menjadi padatan atau butiran mirip kaca yang bersifat tidak elastis. Sifat ini menjadikan silika gel dimanfaatkan sebagai zat penyerap, pengering dan penopang katalis.
Garam–garam kobalt dapat diabsorpsi oleh gel ini. Adanya gugus -OH yang mampu membentuk ikatan hidrogen dengan gugus yang sama dari molekul lain yang mengakibatkan silika dapat digunakan sebagai pengering dan fasa diam pada kolom kromatografi (Narsito, 2005).
2.3 Logam Berat
Logam berat masih termasuk golongan logam dengan kriteria-kriteria yang sama dengan logam-logam yang lain. Perbedaan terletak pada dari pengaruh yang dihasilkan bila logam berat ini masuk atau diberikan ke dalam tubuh mahkluk hidup. Istilah logam berat sebetulnya sudah dipergunakan secara luas, terutama dalam perpustakaan ilmiah, sebagai unsur yang menggambarkan bentuk dari logam tertentu. Karakteristik dari kelompok logam berat adalah sebagai berikut:
1. Memiliki spesifikasi grafitasi yang sangat besar (lebih dari 4).
2. Mempunyai nomor atom 22 - 23 dan 40 - 50 serta unsur laktanida dan aktinida.
3. Mempunyai respon biokimia yang khas (spesifik) pada organisme hidup.
Logam berat pada umumnya tersebar diseluruh permukaan bumi: tanah, air maupun udara. Logam tersebut dapat dalam bentuk terikat maupun terlarut dalam suatu partikel. Menurut Laws (1981) ditinjau dari kegunaanya logam berat dibedakan kedalam dua golongan yaitu, golongan mikronutrien (konsentrasi rendah) yang bermanfaat bagi organisme perairan (Zn, Fe dan Cu) sedangkan golongan kedua adalah golongan yang sama sekali belum diketahui manfaatnya bagi organisme perairan (Hg, Cd, dan Pb).
Semua logam berat dapat dikatakan sebagai bahan beracun yang akan meracuni makhluk hidup. Sebagai contoh logam berat tembaga (Cu), timbal (Pb), dan krom (Cr). Namun demikian, meskipun semua logam berat dapat mengakibatkan keracunan atas makhluk hidup, sebagian dari logam berat tersebut
dibutuhkan oleh makhluk hidup. Kebutuhan tersebut dalam jumlah yang sedikit.
Tetapi apabila kebutuhan tersebut tidak terpenuhi dapat berakibat fatal terhadap kelangsungan makhluk hidup. Karena tingkat kebutuhan yang sangat diperlukan sehingga logam tersebut juga dinamakan sebagai logam esensial tubuh. Bila logam esensial yang masuk ke dalam tubuh dalam jumlah yang berlebihan, maka berubah fungsi menjadi racun (Sudarwin, 2008). Logam yang digunakan pada penelitian ini adalah logam tiruan Tembaga (Cu), Kromium (Cr) dan Timbal (Pb).
a. Cu (Tembaga)
Tembaga termasuk kedalam kelompok logam esensial, di mana dalam kadar yang rendah dibutuhkan oleh organisme sebagai koenzim dalam proses metabolisme tubuh, sifat racunnya baru muncul dalam kadar yang tinggi apabila terakumulasi secara terus menerus dan dalam jangka waktu lama dapat mengakibatkan gangguan sistem syaraf, kelumpuhan, dan kematian dini serta penurunan tingkat kecerdasan anak-anak (Widaningrum, 2007).
Unsur tembaga dengan nomor atom 29, bobot atom 63,546 g/mol dan densitas 8,96 g/cm3 merupakan salah satu jenis logam berat yang berbahaya karena unsur ini dapat mengganggu saluran pernafasan yaitu menimbulkan kerusakan pada selaput lendir yang berhubungan dengan hidung. Secara kimia senyawa-senyawa yang dibentuk oleh logam tembaga mempunyai bilangan valensi +1 dan +2. Tembaga merupakan penghantar listrik yang baik setelah perak (Ag), karena itu logam tembaga banyak digunakan dalam bidang elektronik dan perlistrikan . Meskipun tembaga mengakibatkan keracunan atas makhluk hidup,
dalam jumlah yang sangat kecil merupakan logam atau mineral penting tubuh.
Namun bila jumlahnya berlebih, maka akan berubah fungsi menjadi zat racun bagi tubuh (Palar 2004).
Air tidak bereaksi dengan tembaga, tetapi dalam atmosfer lembab, tembaga lambat laun membentuk lapisan hijau pada permukaannya. Senyawaan tembaga mengandung unsur dengan bilangan oksidasi +1 dan +2. Tingkat oksidasi +2 adalah bentuk yang paling stabil dari tembaga. Ion tembaga Cu2+
mempunyai konfigurasi elektronik d9 dan mempunyai elektron yang tidak berpasangan. Senyawaan tembaga (I) kebanyakan berwarna putih (oksidasinya berwarna merah). Garam tembaga (II) dalam larutan berwarna biru. Logam ini juga banyak membentuk banyak senyawa koordinasi. Dalam senyawa atau ion kompleks, tembaga umumnya dalam bentuk Cu (I) dan Cu(II) (Lee, 1994).
b. Cr (Kromium)
Unsur Cr dengan nomor atom 24, bobot atom 51, 996 g/mol merupakan salah satu jenis logam berat yang mempunyai daya racun tinggi. Daya racun yang dimiliki oleh logam Cr ditentukan oleh valensi ionnya. Ion Cr6+ merupakan bentuk logam Cr yang paling banyak dipelajari sifat racunnya, bila dibandingkan dengan ion-ion Cr2+ dan Cr3+. Sifat racun yang dibawa logam ini menyebabkan terjadinya keracunan akut dan kronis. Cr telah dimanfaatkan secara luas dalam kehidupan manusia. Logam ini banyak digunakan sebagai bahan pelapis (plating) pada berbagai peralatan mulai dari peralatan rumah tangga sampai bahan pembuat mobil. Cr juga banyak dibentuk menjadi alloy (Palar 2004).
c. Pb (Timbal)
Timbal atau dikenal sebagai Pb merupakan logam lunak berwarna kebiru- biruan atau abu-abu keperakan, dengan titik leleh 327,5 oC dan titik didih 1,740
oC pada tekanan atmosfer. Timbal mempunyai nomor atom terbesar dari semua unsur yang stabil yaitu 82 dengan berat atom (BA) 207,2. Pb termasuk ke dalam kelompok logam golongan IV-A pada tabel periodik unsur. Namun logam ini sangat beracun, yang dapat merusak system saraf jika terakumulasi dalam jaringan halus dan tulang dalam jangka waktu lama. Timbal terdapat dalam isotop 204 Pb (1,4%), 206 Pb (24,1%), 207 Pb (22,1%), dan 208 Pb (52,4%) (Panda, 2012).
Timbal merupakan logam yang bersifat racun dan dapat terakumulasi dalam jaringan sehingga dapat menimbulkan gangguan kesehatan yang serius seperti gangguan saraf otak dan dan menyebabkan kematian (Boecky, 1986).
Kisaran logam berat timbal (Pb) sebagai pencemar dalam tanah adalah 2-200 ppm dan kisaran logam berat timbal (ppb) dalam tanaman adalah 0,1-10 ppm.
2.4 Spektroskopi Serapan Atom (SSA)
Spektroskopi Serapan Atom (SSA) merupakan bentuk spektroskopi serapan yang umum digunakan untuk menganalisis konsentrasi berbagai macam unsur logam dalam matiks kompleks. Spektroskopi ini didasarkan pada jumlah radiasi elektromagnetik dilewatkan melalui sistem yang mengandung atom-atom bebas tersebut. Analisis kuantitatif logam dengan metode SSA didasarkan pada fakta yang mana bahwa atom suatu unsur pada keadaan dasar (ground state) dapat menyerap energi radiasi dengan panjang gelombang tertentu tergantung pada sifat
unsurnya, dimana jumlah energi yang diserap sebanding dengan jumlah atom yang menyerap energi tersebut (Haswel, 1991).
AAS merupakan metode analisis unsur secara kuantitatif yang pengukurannya berdasarkan penyerapan cahaya dengan panjang gelombang tertentu oleh atom logam dalam keadaan bebas (Skoog et al., 2000). Apabila cahaya dengan panjang gelombang tertentu dilewatkan pada suatu sel yang mengandung atom-atom bebas yang bersangkutan maka sebagian cahaya tersebut akan diserap dan intensitas penyerapan akan berbanding lurus dengan banyaknya atom bebas logam yang berada di dalam sel (Day dan Underwood, 1989).
Konsentrasi analit dikolerasikan terhadap jumlah energi radiasi yang diserap melalui penggunaan kurva kalibrasi yang dibuat dari suatu seri larutan standart. Batas deteksi metode SSA sangat bervariasi dan dapat mencapai puluhan ppb, tergantung sifat analit dan matriks serta kesensitifan instrument SSA yang digunakan (Mulia, 1995). SSA juga merupakan teknik analisa yang banyak digunakan untuk menentukan kadar unsur-unsur logam dalam sampel penelitian.
Teknik ini sangat tepat untuk menganalisis unsur-unsur pada logam dalam sampel penelitian pada konsentrasi yang rendah dan tidak banyak memerlukan perlakuan pendahuluan. Prinsip penentuan metode ini didasarkan pada penyerapan energi radiasi oleh atom-atom netral pada keadaan dasar, dengan panjang gelombang tertentu yang menyebabkan tereksitasinya dalam berbagai tingkat energi.
Keuntungan penggunaan SSA adalah analisanya peka, teliti, cepat dan pengerjaannya relatif sederhana, dengan tidak diperlakukannya proses-proses
pemisahan dan logam yang dianalisa terhadap logam lain yang ada dalam larutan.
Pemilihan panjang gelombang maksimum (λ maksimum) yang tepat, pengaturan nyala yang optimum, serta penggunaannya sumber radiasi dari unsur tertentu akan diperoleh hasil dengan selektivitas yang tinggi. Dengan membandingkan absorban larutan sampel dengan absorban larutan standart pada kurva kalibrasi dari larutan standart yang berada garis lurus (Suharta, 2004). Persamaan dari regresi linier yaitu:
y = bx + a
dimana:
y = absorban
x = konsentrasi
Dasar suatu pengukuran SSA dalam menentukan konsentrasi suatu larutan sampel adalah dengan mengukur intensitas radiasi yang diteruskan (transmitan) atau mengukur intensitas radiasi yang diserap (absorban) pada panjang gelombang tertentu. Hubungan antara absorban dan konsentrasi dikemukakan oleh Lambert Beer dengan rumus sebagai berikut:
A = log Io/It = log I/T = a.b.
dimana:
A = absorban
Io = intensitas cahaya yang masuk
It = intensitas cahaya yang keluar
a = absortivitas
b = tebal medium pengadsorpsi
2.5 N-[3-(trimethoxysilyl)propyl]-ethylenediamine (EDAPTMS)
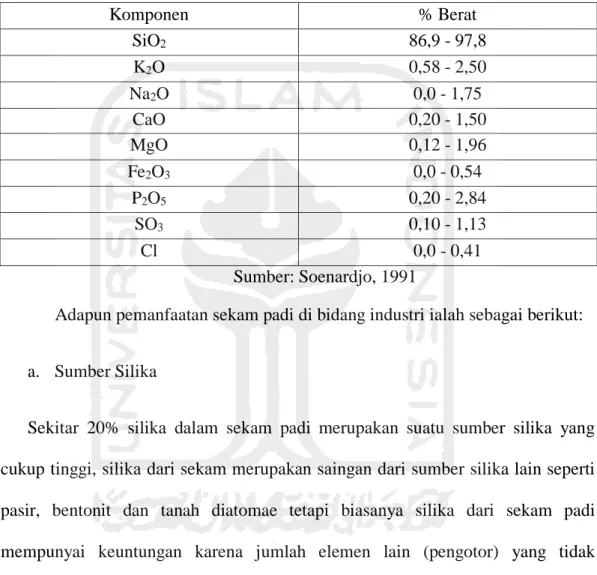
EDAPTMS merupakan senyawa organik aktif yang memiliki sisi hidrofilik (gugus Amina) dan hidrofobik (gugus metoksi). Struktur EDAPTMS ditunjukan pada Gambar 1.
Gambar 1. Struktur N-[3-(trimethoxysilyl)propyl]-ethylenediamine (EDAPTMS)
Hidrofobik Hidrofilik
(A)
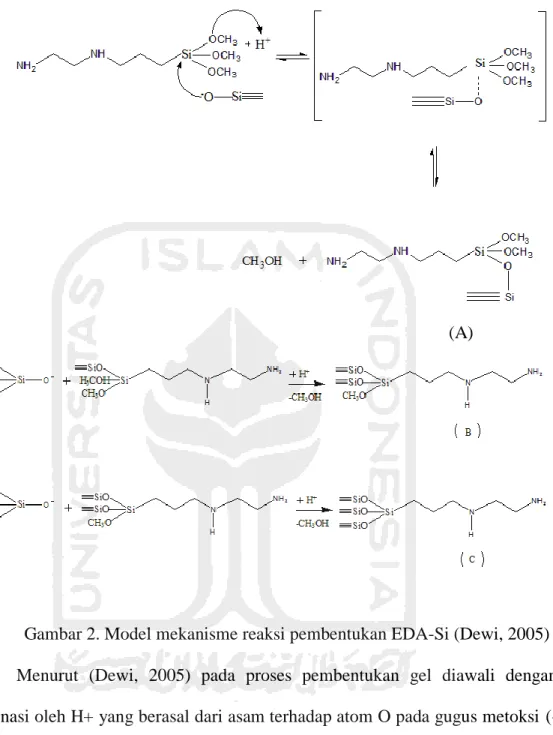
Gambar 2. Model mekanisme reaksi pembentukan EDA-Si (Dewi, 2005) Menurut (Dewi, 2005) pada proses pembentukan gel diawali dengan protonasi oleh H+ yang berasal dari asam terhadap atom O pada gugus metoksi (- OCH3) dalam senyawa EDAPTMS dan dilanjutkan dengan serangan anion silika terhadap senyawa EDAPTMS melalui mekanisme SN2 sehingga membentuk ikatan siloksan ( Si O Si ) dengan melepas metanol. Reaksi masih dapat berlanjut apabila terdapat gugus metoksi yang memungkinkan untuk berkondensasi dengan anion silikat yang lain. Reaksi kondensasi yang disertai
pelepasan metanol tidak selalu berlanjut pada reaksi selanjutnya menghasilkan C, tetapi terhenti pada pembentukan A atau B.
Kemungkinan pembentukan EDA-Si dapat diawali dengan protonasi atom O gugus metoksi (- OCH3) pada senyawa EDAPTMS (3 -Etilendiaminopropil)- Trimetoksisilan). Selanjutnya spesies anion silikat yang berperan sebagai nukleofil akan menyerang atom Si pada EDAPTMS, di mana atom O pada gugus metoksi telah terprotonasi. Spesies anion silikat yang masuk akan menggantikan gugus metoksi -OCH3 dengan atom O yang telah terprotonasi sehingga terbentuk ikatan siloksan. Gugus metoksi dengan atom O yang telah terprotonasi akan dilepaskan dalam bentuk metanol. Penambahan asam yang terus berlanjut mengakibatkan reaksi dapat terus berlanjut sampai semua gugus metoksi dalam senyawa EDAPTMS mengalami reaksi kondensasi denagn spesies anion silikat dengan melepas metanol.
2.6 Fourier Transform Spectroscopy infrared (FTIR)
Spektroskopi inframerah berfungsi untuk mengidentifikasi gugus fungsional yang ada. Spektra inframerah mengandung banyak serapan yang dihubungkan dengan sistemm vibrasi yang berinteraksi dalam molekul dan mempunyai karakteristik yang unik untuk setiap molekul. Pada spektra inframerah terdapat pita-pita serapan yang karakteristik untuk gugus-gugus fungsional (Sastrohamidjojo,1991). Spektroskopi infra merah disebut dengan IR atau FTIR membantu dalam mengidentifikasi ikatan kovalen yang dapat perkirakan gugus fungsionalnya (Fessenden, 1997). Hampir setiap senyawa yang memiliki ikatan
kovalen, baik organic maupun anorganik akan menyerap berbagai frekuensi radiasi elektromagnetik dalam daerah spectrum inframerah.
Atom-atom yang berikatan dalam molekul mengalami vibrasi secara terus menerus. Akibat terjadinya vibrasi ini menghasilkan perubahan jarak antara atom yang satu dengan yang lain secara simultan. Frekuensi yang dihasilkan dari vibrasi ini sesuai dengan frekuensi radiasi inframerah berkisar 1013-1012 per detik, jika molekul yang mempunyai vibrasi dengan disertai perubahan moment dipol, bila dikenai radiasi dengan sinar inframerah, maka frekuensi radiasi yang sesuai dengan frekuensi transisi vibrasi intramolekul akan diserap seluruhnya atau sebagian. Persentase radiasi yang diserap oleh setiap material adalah spesifik untuk setiap panjang gelombang atau frekuensi. Vibrasi interatomik secara umum diklasifikasikan menjadi dua yaitu; vibrasi ulur (stretching) dan vibrasi tekuk (bending). Frekuensi vibrasi dari ikatan dapat dihitung berdasarkan hukum Hooke. Dalam hal ini dua atom yang saling berikatan diasumsikan sebagai dua bola massa yang diikat oleh sistem pegas. Hukum Hooke dinyatakan dengan persamaan,
ῡ =
√
Dimana :
µ= m1 x m2
m1 + m2
= frekuensi (Hz)
c = kecepatan cahaya (3 x 1010 cm/detik )
2-
k = tetapan yang dihubungkan dengan kekuatan pegas (tetapan gaya untuk ikatan).
m1, m2 = massa dari dua bola (dua atom) (kg) µ = massa tereduksi (kg)
Tabel 4. Daerah serapan inframerah (Stevens, 2001) Pola Vibrasi Bilangan gelombang (cm-1 )
υ (OH) 3500 ( melebar, kuat )
υ (H2O) 1640 ( melebar, sedang )
υ (CO3 ) 1368 (tajam kuat), 860 (lemah) 680 (lemah)
υ (Al-O) -CH3
-CH2
C - H
C – H (= C – H) C – H (= C – H) C – X
C – O atau C – N C = O
RCOR RCOH
RCOOH
RCOOR
C = O
O – H atau N – H N – H
O – H
559,3 dan 750,3 1375 Metil 1450 Metilen
2800 - 3000 Alkana (sp3) 3000 – 3300 Alkena (sp2)
~3300 Alkuna (sp) 500 – 1430 Haloalkana 900 – 1300 Eter
1640 – 1820 Karbonil 1705 – 1750 Keton 1720 – 1740 Aldehida
2700 – 2900 Terdapat dua pita karakteristik
1700 – 1725 Asam Karboksilat 3330 Terdapat serapan yang miring ke dalam pita adsorpsi CH alifatik 1735 – 1750 Ester
1110 – 1300 Ikatan C – O pada sidik jari kuat
2350 CO2
3000 – 3700 Resapan O – H akan menghasilkan pita lebar
3310 – 3350 Amin 850 Nitrit
3509 – 3704 Fenol
Instrumentasi spektrofotometer IR susunanya hamper sama dengan UV- Vis, perbedaannya terletak pada sumber radiasi (Mulja, 1995).
(1) (2) (3) (4) (5)
(6)
Gambar 3. Instrumentasi Spektrofotometer IR (Harti, 2014) Keterangan :
(1) Sumber radiasi (2) Sampel kompartemen (3) Monokromator (4) Detektor
(5) Amplifier atau penguat (6) Rekorder
Komponen dalam spektrofotometer inframerah antara lain:
a. Sumber radiasi inframerah, yang memancarkan sinar yang mengenai cuplikan yang akan dianalisis (Sastrohamidjojo, 1992).
b. Sampel kompartemen, tempat sampel yang akan dianalisis. Disesuaikan dengan jenis sampel, baik berupa padatan, cairan ataupun gas (Mulja, 1995).
c. Monokromator, yang mendispersikan energy sinar awal menjadi banyak frekuensi dan kemudian setelah melalui serangkaian celah yang
menyeleksi frekuensi tertentu yang akan dideteksi oleh detektor (Sastrohamidjojo, 1992).
d. Detektor, mengubah energi dari frekuensi serapan menjadi sinyal listrik yang kemudian diperkuat hingga cukup untuk dicatat (Sastrohamidjojo, 1992).
e. Amplifier atau penguat, penguat sinyal radiasi IR (Mulja, 1995).
f. Rekorder, mencatat spectrum IR secara keseluruhan pada setiap frekuensi dengan sinambung (Mulja, 1995).
Daerah spectrum elektromagnetik inframerah terletak pada panjang gelombang sekitar 400 nm hingga 800 nm (1 nm = 10-9 m). Penyerapan energi dengan cara molekul akan tereksitasi ke tingkatan energy yang lebih tinggi bila mereka menyerap radiasi inframerah (Sastrohamidjojo, 1992). Radiasi inframerah tersebut terbagi atas dua daerah yaitu:
Daerah gugus fungsi pada rentang panjang gelombang 4000- 1600 cm-1
Daerah sidik jari pada rentang panjang gelombang 1600- 670 cm-1
2.7 Surface Area Analyzer (SAA)
Surface Area Analyzer merupakan salah satu alat utama dalam
karakterisasi material yang memerlukan sampel dalam jumlah yang kecil, biasanya berkisar 0,01–0,1 gram. SAA berfungsi untuk menentukan luas permukaan material, distribusi pori dari material dan isotherm adsorpsi suatu gas.
Gas yang umumnya digunakan yaitu nitrogen, argon, dan helium. Secara sederhana jika volume gas spesifik yang dapat dijerap oleh suatu permukaan
padatan pada suhu dan tekanan tertentu (disebut juga isoterm) dan secara teoritis luas permukaan dari suatu gas yang dijerap telah diketahui, maka luas permukaan total padatan tersebut dapat dihitung.
Preparasi sampel untuk dianalisis cukup sederhana yaitu degassing.
Degassing dilakukan untuk menghilangkan gas–gas yang terjerap pada
permukaan padatan dengan cara memanaskan dalam kondisi vakum. Biasanya dilakukan selama lebih dari 6 jam pada suhu berkisar antara 200–300 oC. Sampel yang sudah siap analisa kemudian ditimbang terlebih dahulu. Kondisi yang diperlukan diperhatikan adalah kontainer pendingin telah diisi dengan gas cair.
Waktu analisa dapat berkisar antara 1 jam hingga 3 hari untuk 1 sampel. Jika ingin mengetahui luas permukaan maka hanya membutuhkan 3–5 titik isotherm sehingga proses analisa menjadi lebih singkat. Namun, jika ingin mengetahui distribusi pori khususnya material yang mengandung pori ukuran mikro maka memerlukan waktu 2–3 hari dengan gas nitrogen sebagai adsorbennya.
Isoterm adsorpsi merupakan fungsi konsentrasi zat terlarut yang terjerap pada padatan terhadap konsentrasi larutan. Jenis adsorpsi dapat digunakan untuk mempelajari mekanisme adsorpsi. Adsorpsi fase cair–padat pada umumnya mengikuti jenis isotherm, Freundlich dan Langmuir (Atkins, 1997). Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan pada permukaan adsorben pada suhu tetap. Kesetimbangan terjadi saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya. Dalam istilah termodinamika, ini berarti potensial kimia antara adsorbat di fase fluida dan yang terikat di adsorben telah sama besar.
Kesetimbangan mungkin, tetapi tidak harus, terjadi saat adsorben mencapai kapasitas adsorpsi.
Isoterm adsorpsi terbagi menjadi tiga sesuai untuk adsorpsi gas atau cairan pada permukaan padatan yaitu:
a. Isoterm Langmuir b. Isoterm Freundlich
c. Isoterm Brunauer, Paul Hugh Emmett dan Edward Teller (BET)
Isoterm Langmuir dan Freundlich digunakan untuk tekanan gas atau konsentrasi larutan yang rendah. Sedangkan BET ialah modifikasi isotherm Langmuir pada tekanan tinggi (Sari, 2014).
Langmuir
Model Isoterm Langmuir menggunakan pendekatan kinetika, yaitu kesetimbangan terjadi apabila kecepatan adsorpsi sama dengan kecepatan desorpsi.
Teori Langmuir diusulkan berdasarkan asumsi berikut:
a. Jumlah situs kosong untuk adsorpsi tersedia pada permukaan padat.
b. Semua situs kosong permukaan adsorben memiliki ukuran dan bentuk yang sama.
c. Setiap situs dapat menyimpan maksimum satu molekul gas dengan panas adsorpsi yang konstan.
d. Terjadi kesetimbangan dinamis antara molekul gas teradsorpsi dan molekul gas bebas.
Molekul + permukaan molekul teradsorpsi
e. Adsorpsi terjadi pada lapisan monolayer.
Persamaan isotherm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul zat yang tidak teradsorpsi.
BET (Brunauer-Emmet-Teller)
Untuk mengkarakteristik luas permukaan, ukuran pori digunakan metode Brunauer-Emmet-Teller (BET). Prinsip kerja BET didasarkan pada proses adsorpsi gas N2 pada padatan permukaan berpori (Yahya, 2012). Luas permukaan spesifik katalis ditentukan berdasarkan jumlah gas nitrogen yang diperlukan untuk membentuk “monolayer” pada permukaan dan pori katalis pada tekanan relatif (P/Po) 0,05-0,35. Jumlah gas yang teradsorpsi pada tekanan tertentu didefinisikan sebagai isotherm adsorpsi. Diantara isotherm adsorpsi yang dikenal, salah satunya adalah Brunauer-Emmet-Teller (BET). Merupakan metode yang sering digunakan terutama untuk analisa luas permukaan (Adamson, 1976).
Prinsip kerja SAA didasarkan atas kemampuan sensor tekanan mengukur bervariasi tekanan proses yang dihasilkan pada adsorpsi dan desorpsi isotherm gas Nitrogen (N2) pada kondisi temperatur nitrogen cair sebagai lapisan tunggal (monolayer) yang kemudian datanya diolah menggunakan persamaan BET (Mujinem, et al dalam Sahroni 2014). Metode adsorpsi gas yang dikemukakan oleh BET telah dikenal luas untuk mengidentifikasi porositas material. Hal penting yang dapat diketahui dari analisis material padatan menggunakan metode serapan gas N2 adalah pola adsorpsi-desorpsi dan evaluasi distribusi ukuran pori serta luas permukaan spesifik material (Fatimah, 2014).
Pada dasarnya permukaan nyata padatan tidaklah memiliki bentuk yang sempurna dan teratur, selalu ada retakan dan celah yang akan memberikan sumbangan pada luas permukaan padatan. Jika adsorben yang berupa padatan berpori mengadsorpsi adsorbat, maka akan terjadi proses adsorpsi di luar dan di dalam pori. Teknik karakterisasi dengan metode adsorpsi gas dapat memberikan informasi mengenai luas permukaan spesifik, volume total pori, distribusi ukuran pori dan isotherm adsorpsi (Lowell dan Shields, 1984 dalam Wardani 2015).
Isoterm adsorpsi fisika dikelompokkan menjadi lima berdasarkan klasifikasi Brunauer, Deming, Deming dan Teller (BDDT). Gambar 4 menunjukkan adsorpsi isoterm gas nitrogen menurut klasifikasi Brunair-Deming-Deming- Teller (BDDT) dibagi ke dalam 6 (enam) kategori.
Gambar 4. Klasifikasi isoterm adsorpsi- desorpsi BDDT (Sing dkk., 1985 dalam Wardani 2015).
Grafik adsorpsi isoterm tipe I biasa disebut tipe Langmuir. Isoterm ini jarang ditemukan untuk material nonpori, umumnya pada karbon teraktivasi, silica gel dan zeolit yang mempunyai pori sangat halus. Nilai asimtot ini
menunjukkan mikropori yang terisi seluruhnya. Tipe isoterm ini diperkirakan untuk kemisorpsi reversible. Peningkatan yang tajam dari adsorpsi P/Po menunjukkan adanya mikropori dan mesopori di dalamnya. Isoterm tipe I menggambarkan adsorpsi yang dominan terjadi pada tekanan relatif yang rendah. Isoterm tipe I berasosiasi dengan dominannya mikropori dalam material atau material dengan kandungan mesopori yang ukurannya mendekati mikropori.
Grafik isoterm tipe II kadang disebut isoterm berbentuk S atau sigmoid.
Umumnya ditemui pada material nonpori atau pada material yang diameter porinya lebih besar dari mikropori. Perubahan titik atau lengkungan dari isoterm selalu terjadi dekat dengan titik akhir dari lapisan tunggal adsorbat yang pertama, dengan kenaikan tekanan relatif (P/Po), kemudian lapisan kedua sampai lapisan tertinggi dan berakhir sampai tingkat kejenuhan ketika jumlah lapisan adsorbat menjadi tidak terbatas. Titik B menunjukkan bahwa monolayer sudah sempurna terbentuk.
Grafik isoterm tipe III berbentuk konveks. Sistem ini relatif jarang dan merupakan tipe dimana gaya adsorpsinya relatif rendah. Pada dasarnya dikarakteristik oleh panas adsorpsi yang lebih kecil dari panas pencairan adsorbat.
Oleh karena itu, selama adsorpsi berlangsung, adsorpsi tambahan lebih mudah terjadi karena interaksi adsorbat dengan lapisan yang menyerap lebih besar daripada interaksi dengan permukaan adsorben.
Isoterm tipe IV terjadi pada adsorben yang memiliki jari-jari pori sebesar 15 – 1000 Å. Saat nilai P/Po kecil, tipe isotermnya mirip tipe II namun
peningkatan adsorpsi menyolok sekali pada nilai P/Po yang lebih besar yakni saat kondensasi pori (kapilaritas) terjadi. Kondensasi dan evaporasi kapiler terjadi pada tekanan relatif yang berbeda sehingga akan menunjukkan adanya hysterisis loop. Adsorpsi tipe IV ini umumnya terjadi pada clay terpilar yang
dipreparasi melalui jalur pembentukan sol-gel dimana mesopori dalam material akan dominan.
Isoterm tipe V sama dengan tipe III namun kondensasi pori terjadi pada nilai P/Po yang lebih tinggi. Tipe ini relatif jarang ditemui. Ukuran pori untuk isoterm ini sama range pori tipe IV.
Metode yang paling umum digunakan untuk menentukan luas permukaan dikembangkan oleh Brunauer, Emmet, dan Teller yang lebih dikenal dengan metode BET. Metode ini menyatakan bahwa molekul padatan yang terdapat paling atas berada dalam kesetimbangan dinamis. Artinya jika permukaan hanya dilapisi oleh satu molekul, maka molekul-molekul gas ini berada dalam kesetimbangan fase uap padatan. Jika terdapat dua atau lebih lapisan, maka lapisan paling atas berada pada kesetimbangan dalam fase uap padatan. Bentuk isoterm tergantung pada jenis gas adsorbat, sifat adsorben dan struktur pori.
Pengamatan dilakukan terhadap gejala adsorpsi isoterm berupa adsorpsi lapisan molekul tunggal, adsorpsi lapisan molekul ganda, dan kondensasi dalam kapiler.
Persamaan BET dapat ditulis sebagai berikut :
*( ) +
………… (1)
Dimana :
W = Berat total gas yang teradsorpsi tekanan relatif P/Po (g) Wm = Berat gas nitrogen yang teradsorpsi pada lapis tunggal (g) C = Konstanta BET
Po = Tekanan uap jenuh adsorpsi (mmHg) P = Tekanan gas (mmHg)
P/Po = Tekanan relatif
Untuk mencari C pada persamaan BET yang tetap yaitu : C s 1 i
Persamaan BET (1) berupa garis lurus apabila dibuat grafik 1/W{(P/Po)- 1} versus P/P dan berat gas nitrogen yang membentuk lapisan satu lapis (monolayer), Wm dapat ditentukan dari nilai slope (s) dan intersep (i) ini:
Slope
Intersep
C 1
... (2) WmC
1
... (3) WmC
Jadi berat nitrogen yang membentuk monolayer didapatkan dari menggabungkan persamaan (2) dan (3) sehingga didapatkan persamaan:
Wm 1
(s i) ... (4) Aplikasi metode BET ini dapat digunakan untuk menghitung luas permukaan.
Untuk itu perlu diketahui luas rata-rata molekul gas teradsorp.
Luas permukaan, S, dari cuplikan diperoleh dari persamaan:
S Wm N
x1020 m2
s M
... (5) dengan :
N = Bilangan Avogadro (6,02 x 1023 partikel/mol)
M = Berat molekul dari gas teradsorp (g/mol) Wm = Berat gas teradsorpsi monolayer
= Luas rata-rata molekul teradsorp
Total volume pori dihitung pengukuran adsorpsi pada P/Po cukup tinggi sehingga diasumsikan semua pori terisi dengan adsorbat sebagai fasa terkondensasi.
Vp = Wa / l
Lowell, S dan Shields, J.E (1984) juga menjelaskan mengenai penentuan rata-rata ukuran pori dapat diperkirakan dari volume pori dengan mengasumsikan geometri pori adalah silindris sehingga jari-jari pori rata-rata dapat dihitung dari rasio total volume pori dan luas permukaan BET, sesuai dengan persamaan berikut:
rp = 2 Vp / Ss
dengan :
rp = Jari-jari pori rata-rata Vp = Volume pori total
Ss = Luas permukaan spesifik
Asumsi menurut teori BET bahwa permukaan padatan tidak akan tertutupi secara sempurna selama tekanan uap jenuh (Po) belum tercapai. Jika adsorpsi mengikuti teori BET maka kurva antara 1/W [(Po/P)-1] lawan (P/Po) akan menghasilkan garis lurus, untuk keperluan ini digunakan adsorbat gas N2 dan adsorpsi berlangsung pada temperatur 77 K. Pada adsorpsi isoterm ini, tekanan relatif (P/Po) yang berlaku menurut teori BET dibatasi pada rentang 0,05-0,35.
Dalam aplikasinya menggunakan N2 (sebagai adsorbat) dengan densitas fasa cair
pada tekanan 1 atm dan temperature 77 K dan harga σ = 16,2 Å2/molekul (Baksh
dkk., 1992; Huston dkk., 1998; Ocelli dkk., 2000 dalam Wardani 2015).
Menurut definisi IUPAC, porositas material diklasifikasikan sebagai mikropori jika memiliki diameter pori di bawah 20-25 Ǻ, mesopori jika memiliki diameter pori antara 20-25 dan 500 Ǻ, serta makropori jika memiliki diameter pori lebih dari 500 Ǻ. Definisi mutakhir membagi pori ke dalam nanopori (antara 0,1 dan 100 nm) dan mikropori (antara 0,1 dan 100 mm).
![Gambar 1. Struktur N-[3-(trimethoxysilyl)propyl]-ethylenediamine (EDAPTMS)](https://thumb-ap.123doks.com/thumbv2/123dok/1915437.4005607/17.893.172.768.387.867/gambar-struktur-n-trimethoxysilyl-propyl-ethylenediamine-edaptms.webp)