PENETAPAN KADAR TOTAL FENOL DAN TOTAL FLAVONOID DARI EKSTRAK ETANOL DAUN SIBO (Leea
indica F.) SKRIPSI
OLEH:
SOMATHY KRISHNAN NIM 161501195
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2020
PENETAPAN KADAR TOTAL FENOL DAN TOTAL FLAVONOID DARI EKSTRAK ETANOL DAUN SIBO (Leea
indica F.) SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
SOMATHY KRISHNAN NIM 161501195
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2020
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan karunia, sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Penetapan Kadar Total Fenol dan Total Flavonoid dari Ekstrak Etanol Daun Sibo (Leea indica F.)”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan rasa terima kasih kepada kepada Bapak Drs.
Nahitma Ginting, M.Si., Apt., dan Ibu Dr. Marline Nainggolan, M.S., Apt., sebagai dosen pembimbing skripsi yang telah membimbing dan mengajarkan dengan baik, tulus, ikhlas serta penuh kesabaran dalam proses penelitian dan penulisan skripsi.
Ucapan terima kasih juga penulis sampaikan kepada kepada Bapak Prof. Dr. Ginda Haro, M.Sc., Apt., selaku ketua penguji, Ibu Dra. Tuty Roida Pardede., M.Si., Apt., selaku anggota penguji yang telah memberikan saran untuk penyempurnaan skripsi ini, dan kepada Ibu Dr. Sumaiyah, S.Si., M.Si., Apt., selaku dosen penasehat akademik serta Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah banyak membimbung penulis selama masa perkuliahan. Penulis juga mengucapkan terima kasih kepada Ibu Prof. Dr. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi.
Skripsi ini penulis hadiahkan kepada kedua orang tua, Ayahanda Krishnan Alagri dan Ibunda Jaya Munusamy tercinta sebagai rasa terima kasih dan penghargaan yang tulus atas doa, dorongan dan pengorbanan, baik moril dan materil yang tak pernah pudar saat proses penyelesaian skripsi ini maupun dalam kehidupan sehari-hari sejak penulis dilahirkan.
PENETAPAN KADAR TOTAL FENOL DAN TOTAL FLAVONOID DARI EKSTRAK ETANOL DAUN SIBO (Leea indica F.)
ABSTRAK
Latar belakang: Sibo (Leea indica F.) termasuk familia vitaceae yang mengandung senyawa metabolit sekunder. Hasil penelitian menyebutkan bahwa daun sibo digunakan sebagai obat antinflamasi, antibakteri, antidiare, disentri, vertigo, antidiabetes juga penyakit kulit.
Tujuan: Tujuan penelitian ini untuk mengetahui kadar total fenol dan total flavonoid dari ekstrak etanol daun sibo menggunakan pereaksi Folin-Ciocalteu dan aluminium klorida secara spektrofotometer Ultraviolet-Visible (Uv-Vis).
Metode: Simplisia diekstraksi dengan cara maserasi menggunakan etanol 96% dan filtrat yang diperoleh diuapkan dengan bantuan rotary evaporator. Selanjutnya serbuk simplisia dan ekstrak etano daun sibo dilakukan skrining fitokima. Ekstrak etanol daun sibo dianalisis kadar total fenol dan total flavonoid dengan pereaksi Folin-Ciocalteu dan aluminium klorida menggunakan spektrofotometri UV-Vis pada rentangan 200 nm-800 nm.
Hasil: Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol daun sibo diperoleh senyawa triterpenoid/steroid, glikosida, flavonoid, saponin dan tannin.
Hasil penetapan kadar total fenol ekstrak etanol daun sibo diperoleh panjang gelombang 766 nm dengan kadar 14,5352 mg GAE/g ekstrak etanol daun sibo dan kadar total flavonoid pada panjang gelombang 434 nm dengan kadar 20,3621 mg QE/g.
Kesimpulan: Ekstrak etanol daun sibo mengandung senyawa fenol dengan kadar 14,5352 mg GAE/g ekstrak etanol daun sibo dan flavonoid pada kadar 20,3621 mg QE/g.
Kata kunci: Sibo, ekstrak etanol, total fenol, total flavonoid
DETERMINATION OF TOTAL PHENOL AND TOTAL FLAVONOID LEVELS FROM ETHANOL EXTRACT OF SIBO LEAF (Leea indica F.)
ABSTRACT
Background: Sibo (Leea indica F.) is a family of vitaceae that contains secondary metabolite compounds. The results of the study indicates that sibo leaves are used as an anti-inflammatory, antibacterial, antidiarrheal, dysentery, vertigo, antidiabetic as well as skin diseases.
Purpose: The purpose of this study was to determine the total levels of phenol and total flavonoids from ethanol extracts of sibo leaves using Folin-Ciocalteu and aluminum chloride reagents by Ultraviolet-Visible (Uv-Vis) spectrophotometer.
Methods: Simplisia is extracted by maceration using 96% ethanol and the filtrate obtained is evaporated with the help of a rotary evaporator. Furthermore, phytochemical screening was done towards simplicia powder and ethanol extract of sibo leaf. Ethanol extract of sibo leaf was analyzed for total phenol and total flavonoid levels by Folin-Ciocalteu and aluminum chloride reagents using UV-Vis spectrophotometry at a range of 200 nm-800 nm.
Results: Phytochemical screening results of simplicia powder and ethanol extract of sibo leaf obtained triterpenoid/steroid compounds, glycosides, flavonoids, saponins and tannins. The results of determining the total phenol content of ethanol extract of sibo leaf obtained wavelength of 766 nm with levels of 14.5352 mg GAE / g of ethanol extract of sibo leaves and total flavonoid levels at wavelength of 434 nm with levels of 20.3621 mg QE / g.
Conclusion: Ethanol extract of sibo leaf contains phenol compound with a level of 14.5352 mg GAE / g ethanol extract of sibo leaf and flavonoids at a level of 20.3631 mg QE / g.
Keywords: Sibo, ethanol extract, total phenol, total flavonoids
DAFTAR ISI
Judul Halaman
HALAMAN JUDUL ... …………...i
LEMBAR PENGESAHAN ... ...iii
KATA PENGANTAR ... ………….iv
SURAT PERNYATAAN... ………….vi
ABSTRAK ... …………vii
ABSTRACT ... ………...viii
DAFTAR ISI ... ………….ix
DAFTAR TABEL ... …………xii
DAFTAR GAMBAR ... ………...xiii
DAFTAR GAMBAR DALAM LAMPIRAN ... ………...xiv
DAFTAR LAMPIRAN ... …………xv
BAB I PENDAHULUAN ... …………..1
1.1 Latar Belakang ... …………..1
1.2 Perumusan Masalah ... …………..2
1.3 Hipotesis Penelitian ... …………..3
1.4 Tujuan Penelitian ... …………..3
1.5 Manfaat Penelitian ... …………..4
1.6 Kerangka Pikir Penelitian ... …………..4
BAB II TINJAUAN PUSTAKA ... …………..5
2.1 Uraian Tumbuhan... …………..5
2.1.1 Taksonomi Tumbuhan ... …………..5
2.1.2 Morfologi Tumbuhan ... …………..5
2.1.3 Manfaat Tumbuhan……….…………..6
2.1.4 Kandungan Kimia ... …………..6
2.2 Senyawa Fenol ... …………..6
2.3 Senyawa Flavonoid. ... …………..7
2.4 Metode Ekstraksi ... …………..8
2.5. Spektrofotometer UV-Vis ... …………10
2.6 Penetapan Kadar Total Fenol ... …………11
2.7 Penetapan Kadar Total Flavonoid ... …………12
BAB III METODE PENELITIAN... …………13
3.1 Lokasi Penelitian ... …………13
3.2 Alat dan Bahan ... …………13
3.2.1 Alat ... …………13
3.2.2 Bahan ... …………13
3.2.3 Sampel ... …………14
3.3 Pembuatan Pereaksi ... …………14
3.3.1 Pereaksi Bouchardat ... …………14
3.3.2 Pereaksi Mayer ... …………14
3.3.3 Larutan Asam Klorida 2N ... …………14
3.3.4 Larutan Asam Sulfat 2N ... …………14
3.3.5 Pereaksi Dregendroff ... …………14
3.3.6 Larutan Penyemprot Lieberman Bouchardat ... …………15
3.3.7 Larutan Asam Nitrat 0,5 N ... …………15
3.3.8 Larutan Timbal (II) Asetat 0,4 M ... …………15
3.3.9 Larutan Besi (III) Klorida1% ... …………15
3.310 Larutan Pereaksi Kloralhidrat ... …………15
3.3.11 Pereaksi Molish ... …………15
3.3.12 Larutan Aluminium Klorida 10% ... …………15
3.3.13 Larutan Natrium Asetat 1 M ... …………15
3.3.14 Larutan Natrium Karbonat ... …………16
3.3.15 Larutan Folin-Ciocalteu 10% ... …………16
3.4 Pengumpulan dan Pengolahan Tumbuhan ... …………16
3.4.1 Pengumpulan Bahan Tumbuhan ... …………16
3.4.2 Identifikasi Tumbuhan ... …………16
3.4.3 Pembuatan Simplisia ... …………16
3.5 Skrining Fitokimia ... …………16
3.5.1 Pemeriksaan Steroid/Triterpenoid ... …………17
3.5.2 Pemeriksaan Flavonoid ... …………17
3.5.3 Pemeriksaan Saponin ... …………17
3.5.4 Pemeriksaan Alkaloid ... …………17
3.5.5 Pemeriksaan Glikosida ... …………18
3.5.6 Pemeriksaan Tanin. ... …………18
3.6 Pembuatan Ekstrak ... …………19
3.7 Penentuan Kadar Total Fenol dan Total Flavonoid dari Ekstrak Daun Sibo ... …………19
3.7.1 Penentuan Kadar Total Fenol ... …………19
3.7.1.1Penentuan Panjang Gelombang Absorbansi Maksimum Asam Galat………19
3.7.1.2Penentuan Waktu Kerja (operating time) ... …………20
3.7.1.3Penentuan Kurva Kalibrasi Asam Galat ... …………20
3.7.1.4Penetapan Kadar Total Fenol pada Ekstrak Etanol Daun Sibo ... …………20
3.7.2 Penentuan Kadar Total Flavonoid ... …………21
3.7.2.1Penentuan Panjang Gelombang Absorbansi Maksimum Kuersetin...21
3.7.2.2Penentuan Waktu Kerja (operating time) ... …………21
3.7.2.3Penentuan Kurva Kalibrasi Kuersetin ... …………22
3.7.2.4Penetapan Kadar Total Flavonoid pada Ekstrak Etanol Daun Sibo ... …………22
3..8 Perhitungan Kadar Total Fenol dan Total Flavonoid ... …………23
BAB IV HASIL DAN PEMBAHASAN………...24
4.1 Hasil Identifikasi Tumbuhan………...24
4.2 Hasil Ekstraksi Daun Sibo………...24
4.3 Hasil Skrining Daun Sibo………....24
4.4 Hasil Penetapan Kadar Total Fenol... …………25
4.4.1 Hasil Penetapan Panjang Gelombang Absorbansi Maksimum Asam Galat...25
4.4.2 Hasil Penentuan Waktu Kerja (operating time) ... …………26
4.4.3 Hasil Penetapan Kurva Kalibrasi Asam Galat………26
4.4.4 Hasil Penetapan Kadar Total Fenol Dalam Ekstrak Etanol Daun Sibo (Leaa Indica F.)………...………....27
4.5 Hasil Penetapan Kadar Total Flavonoid………..28
4.5.1 Hasil Penetapan Panjang Gelombang Absorbansi Maksimum Kuersetin…...28
4.5.2 Hasil Penentuan Waktu Kerja (operating time) ... …………29
4.5.3 Hasil Penetapan Kurva Kalibrasi Kuersetin………....30 4.5.4 Hasil Penetapan Kadar Total Flavonoid Dalam Ekstrak Etanol Daun Sibo
(Leaa indica F.)………...31
BAB V KESIMPULAN DAN SARAN……….33
5.1 Kesimpulan………..33
5.2 Saran ... ………….33
DAFTAR PUSTAKA……….34
LAMPIRAN ... …………36
DAFTAR TABEL
Tabel ... Halaman
4.1 Hasil skrining fitokimia simplisa dan ekstrak etanol daun sibo………..24
4.2 Hasil absorbansi standar Asam Galat………..26
4.3 Hasil kadar total fenol pada ekstrak daun sibo (Leea indica F.)…………...28
4.4 Hasil absorbansi standar kuersetin ... …………30
4.5 Hasil kadar total flavonoid pada ekstrak daun sibo (Leea indica F.)...…..31
DAFTAR GAMBAR
Gambar ... Halaman
1.1 Kerangka Pikir Penelitian………..4
2.1 Struktur kimia Fenol ... …………..7
2.2 Sktruktur kimia-kimia Flavonoid ... …………..8
2.3 Diagram skematis spektrofotometer UV-Vis ... …………10
4.1 Kurva panjang gelombang maksimum Asam Galat... …………25
4.2 Kurva kalibrasi larutan standar Asam Galat ... …………27
4.3 Kurva panjang gelombang maksimum Kuersetin ... …………29
4.4 Kurva kalibrasi larutan standar Kuersetin ... …………30
DAFTAR GAMBAR DALAM LAMPIRAN
Gambar ... Halaman
1. Tumbuhan Sibo ... …………39
2. Daun Sibo ... …………39
3. Simplisia daun Sibo ... …………40
4. Serbuk daun Sibo ... …………40
5. Alat spektrofotometer UV-Visible ... …………41
DAFTAR LAMPIRAN Lampiran Halaman
1. Hasil identifikasi tumbuhan...………...36
2. Bagan kerja penelitian ……….…...……37
3. Bagan pembuatan ekstrak etanol daun sibo………38
4. Gambar tumbuhan dan daun sibo………39
5. Gambar simplisia dan serbuk simplisia daun sibo...40
6. Gambar Alat Spektrofotometer Uv-Visibel (Shimadzu)……….41
7. Data pengukuran waktu kerja operating time larutan Asam Galat dengan reageni Folin Ciocalteu dan Natrium Karbonat 7,5%...42
8. Perhitungan persamaan regresi dari kurva kalibrasi Asam Galat………45
9. Hasil penetapan kadar total Fenol pada ekstrak etanol daun Sibo (Leea indica F.)………...46
10. Contoh perhitungan penetapan kadar total Fenol pada ekstrak etanol daun Sibo (Leea indica F.)………...47
11. Data pengukuran waktu kerja (operating time) larutan Kuersetin dengan reagen aluminium klorida 10% dan natrium asetat……….48
12. Perhitungan persamaan regresi dari kurva kalibrasi Kuersetin………...50
13. Hasil penetapan kadar total Flavonoid pada ekstrak etanol daun Sibo (Leea indica F.)………...51
14. Contoh perhitungan kadar total Flavonoid pada ekstrak etanol daun Sibo (Leea indica F.)………...52
BAB I
PENDAHULUAN 1.1 Latar Belakang
Herbal telah menempati tempat yang berbeda dalam kehidupan sejak zaman primitif hingga saat ini, dalam beberapa waktu terakhir telah terjadi perubahan yang nyata ke arah penyembuhan penyakit menggunakan herbal. Saat ini, minat terhadap obat-obat yang berasal dari tumbuhan telah bangkit kembali terutama disebabkan oleh kepercayaan bahwa obat herbal lebih aman dan lebih dapat diandalkan daripada obat-obatan sintetis yang mahal, banyak di antaranya memiliki efek samping yang merugikan (Mishra, 2016).
Di Indonesia terutama di Sumatera Utara, Leea indica umumnya dikenal sebagai mali-mali dan di Kabupaten Karo Sumatera Utara tumbuhan ini umumnya dikenal sebagai sibo yang termasuk golongan perdu, yang terdapat di Asia tropis, Australia, Bangladesh, India, China, Bhutan dan Malaysia. Daun sibo tersebar luas di hutan tropis dan seluruh bagian tumbuhan digunakan secara tradisional untuk sakit kepala dan keluhan sakit kulit. Daun dan akarnya digunakan untuk obat diabetes, jantung, demam, diare, disentri dan daunnya untuk mengobati keputihan, kanker usus, dan kanker rahim (Bais, 2013).
Penelitian sebelumnya menyebutkan daun sibo memiliki kadar air 9,33%, kadar sari larut air 11,32%, kadar sari larut etanol 6,92%, kadar abu total 8,1%
dan kadar abu tidak larut dalam asam 0,88% (Roy Indrianti Bangar, 2019). Hasil karakterisasi ini tergantung dari bahan tanaman, hal ini dapat memeberikan hasil yang berbeda terkait dengan tempat tumbuh. Perbedaan ini dapat meluas ke varietas yang berbeda atau sama ditanam di lokasi yang berbeda. Bagian tanaman yang berbeda seperti daun, kulit kayu, biji-bijian, akar dan bunga dan juga dapat
memiliki konstituen aktif yang berbeda (Kiranmayee, 2016).
Fenolik adalah kelompok fitokimia terbesar yang paling banyak dan bertindak sebagai aktivitas antioksidan dalam tanaman. Lebih dari 4000 polifenol ditemukan pada tanaman vaskular. Senyawa fenolik seperti kuersetin, rutin, naringin, katechin, asam kaffeic, asam galat dan asam klorogenik adalah konstituen tanaman yang sangat penting (Rao dkk., 2016).
Flavonoid adalah kelompok terbesar senyawa fenolik yang terdapat secara alami, yang terjadi pada bagian tanaman yang berbeda dan sebagai berupa glikosida. Mereka ditemukan memiliki banyak aktivitas biologis termasuk antimikroba, antiulcer, antiarthritic, antiangiogenik, antikanker, penghambatan protein kinase (Rao dkk., 2016), (Tungmunnithum, 2018). Senyawa flavon dan flavonol adalah yang paling banyak didistribusikan dari semua fenolik (Rao dkk., 2016).
Fenolik dan flavonoid umumnya dikenal sebagai molekul fitokimia terbesar dengan sifat antioksidan dari tanaman (Tungmunnithum, 2018), (Rao dkk., 2016). Menurut Tungmunnithum (2018), ekstrak rimpang Polygonatum verticillatum (L.), juga menunjukkan aktivitas antioksidan yang terkait dengan tingkat komposisi fenolik.
Berdasarkan hal di atas, yang menyebutkan senyawa fenol dan flavonoid sangat bermanfaat dalam pengobatan sehingga pada penelitian ini dilakukan pengujian terhadap kadar total fenol dan total flavonoid dari ekstrak daun sibo secara spektrofotometri UV-Vis.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka permasalan pada penelitian ini
dapat dirumuskan sebagai berikut:
a. Apakah kadar total fenol ekstrak etanol daun sibo dapat ditentukan dengan pereaksi Folin-Ciocalteu menggunakan metode spektrofotometri UV-Vis?
b. Apakah kadar total flavonoid ekstrak etanol daun sibo dapat ditentukan dengan pereaksi aluminium klorida menggunakan metode spektrofotometri UV-Vis?
1.3 Hipotesis Penelitian
Berdasarkan perumusan masalah diatas, maka hipotesis pada penelitian ini adalah:
a) Kadar total fenol ekstrak etanol daun sibo yang ditentukan dengan pereaksi Folin-Ciocalteu menggunakan metode spektrofotometri UV-Vis.
b) Kadar total flavonoid ekstrak etanol daun sibo yang ditentukan dengan pereaksi aluminium klorida menggunakan metode spektrofotometri UV- Vis.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah:
a. Untuk menetapkan kadar total fenol ekstrak etanol daun sibo dengan pereaksi Folin-Ciocalteu menggunakan metode spektrofotometri UV- Vis.
b. Untuk menetapkan kadar total flavonoid ekstrak etanol daun sibo dengan pereaksi aluminium klorida menggunakan metode spektrofotometri UV-Vis.
1.5 Manfaat Penelitian
Manfaat penelitian ini adalah untuk menambah informasi dan pengetahuan tentang total fenol dan total flavonoid dari daun sibo.
1.6 Kerangka Pikir Penelitian
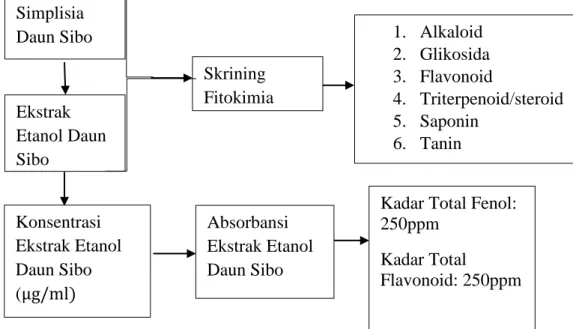
Kerangka pikir penelitian untuk analisis kadar total fenol dan total flavonoid ekstrak etanol daun sibo adalah sebagai berikut:
Gambar 1.1 Kerangka Penelitian Simplisia
Daun Sibo
Ekstrak Etanol Daun Sibo
Skrining Fitokimia
1. Alkaloid 2. Glikosida 3. Flavonoid
4. Triterpenoid/steroid 5. Saponin
6. Tanin
Konsentrasi Ekstrak Etanol Daun Sibo (μg/ml)
Absorbansi Ekstrak Etanol Daun Sibo
Kadar Total Fenol:
250ppm Kadar Total
Flavonoid: 250ppm Variabel Terikat
Variabel Bebas Parameter
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
Daun sibo (Leea indica) adalah tanaman obat yang tersebar luas di tempat- tempat tropis seperti Cina, India, Malaysia, Thailand, dan Indonesia. Semak besar yang selalu hijau, tumbuh setinggi 8 meter. Daun besar, majemuk, selebaran lonjong atau berbentuk bulat panjang.Tumbuhan ini memiliki namalain seperti Bandicoot berry (Inggris); Memali (Melayu); huo tong shu (Cina); katangbai
(Thailand); Hastipalash (India) (Valkenburg dkk, 2002).
2.1.1 Taksonomi Tumbuhan
Menurut Catalogue of Life., (2015)., daun sibo (Leea indica) berada di bawah klasifikasi ilmiah sebagai berikut:
Kingdom : Plantae Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Vitales
Famili : Vitaceae Genus : Leea
Species : Leea Indica (Burm. F.) Merr 2.1.2 Morfologi Tumbuhan
Morfologi tumbuhan ini biasanya berupa semak, pohon kecil, setinggi 2- 16 m dan dapat bertangkai tunggal atau bertangkai banyak dan kasar. Daun dari spesies ini selebaran dengan tangkai sepanjang 7-20 cm. Selebaran tersebut berbentuk ovatelanceolate, panjang 5-23,5 cm dengan lebar 3-9 cm dan dengan tangkai daun hingga 3 cm. Panjang perbungaannya adalah 5–25 cm (Bais, 2013).
2.1.3 Manfaat Tumbuhan
Seluruh tumbuhan digunakan secara tradisional untuk sakit kepala, nyeri tubuh dan keluhan kulit. Daun dan akar sibo digunakan untuk mengobati diabetes, jantung, dan berbagai penyakit seperti demam, sakit kepala, pusing, pegal, eksim, keseleo, kusta, patah tulang, sakit tubuh, kejang otot, diare, dan disentri (Bais, 2013).
Akarnya digunakan sebagai sudorifik, antidiare, antidisenterik, antispasmodik dan penyakit jantung serta kulit. Ekstrak metanol dari sibo dilaporkan memiliki aktivitas antioksidan yang kuat (Bais, 2013).
2.1.4 Kandungan Kimia
Berdasarkan pada Kekuda (2018), daun sibo mengandung asam ftalat, asam palmitat, 1-eicosanol, solanesol, farnesol, tiga ester asam ftalat, asam galat, lupeol,-sitosterol, asam ursolat, glikosida, terpenoid, flavonoid, steroid, tanin, glikosida triterpenoid, asam mollat arabinoside dan asam mollat xyloside sedangkan batang dan akar mengandung saponin, steroid, terpenoid, tanin, dan flavonoid.
2.2 Senyawa Fenol
Istilah senyawa fenolik mencakup berbagai zat tanaman yang memiliki kesamaan cincin aromatik yang mengandung satu atau lebih substituen hidroksil (Harborne, 1973). Zat-zat ini diklasifikasikan sebagai senyawa fenolik. Fenolik tumbuhan bersifat heterogen secara kimia senyawa, beberapa hanya larut dalam pelarut organik dan ada yang larut dalam air, sementara yang lain adalah polimer tidak larut (Anulika dkk., 2016).
Fenol adalah senyawa yang mempunyai gugus OH berikat pada cincin aro-
matik. Fenol bersifat lebih asam bila dibandingkan dengan alkohol, tetapi lebih basa daripada asam karbonat karena fenol dapat melepaskan ion 𝐻+dari gugus hidroksilnya. Lepasnya ion 𝐻+menjadikan anion fenoksida 𝐶6𝐻5𝑂 dapat melarut dalam air (Fessenden dan Fessenden, 1986).
Fenolik tersebar luas di tanaman vaskular dan tampaknya berfungsi dikapasitas yang berbeda (Anulika dkk., 2016). Struktur kimia fenol dapat terlihat pada Gambar 2.2 di bawah (Fessenden dan Fessenden, 1986):
Gambar 2.1 Struktur Kimia Fenol
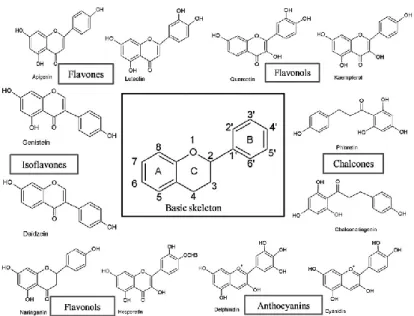
2.3 Senyawa Flavonoid
Flavonoid adalah kelas penting dari produk alami yang termasuk dalam kelas metabolit sekunder. Menurut Robinson. T (1995), flavonoid mencakup banyak pigmen yang paling umum dan terdapat pada seluruh dunia tumbuhan mulai fungus sampai angiospermae. Menurut Markham dan Anderson (2006), tidak ada kelas lain dari produk sekunder yang dikreditkan dengan begitu banyak.
Flavonoid merupakan kelompok polifenol dan diklasifikasikan berdasarkan struktur kimia serta biosintesisnya. Struktur dasar flavonoid terdiri dari dua gugus aromatik yang digabungkan oleh jembatan karbon (C6-C3-C6) (Alfaridz dan Amalia, 2018).
Flavonoid dapat dibagi lagi menjadi beberapa subkelompok yang berbeda
tergantung pada karbon dari cincin C di mana cincin B terpasang dan tingkat ketidakjenuhan dan oksidasi cincin. Flavonoid di cincin B dihubungkan pada posisi 3 cincin C disebut isoflavon. Cincin B yang dihubungkan pada posisi 4 disebut neoflavonoid, sedangkan cincin B yang dihubungkan di posisi 2 dapat dibagi lagi menjadi beberapa subkelompok berdasarkan bentuk struktural cincin C (Panche dkk., 2016). Flavonoid diklasifikasikan sebagai flavon, flavanone, flavonol, katekin, flavanol, kalkon dan antosianin (Alfaridz dan Amalia, 2018).
Struktur kimia-kimia tipe flavonoid dapat terlihat pada Gambar 2.1 di bawah (Panche dkk., 2016):
Gambar 2.2 Struktur Kimia-Kimia Tipe Flavonoid.
2.4 Metode Ekstraksi
Ekstrak adalah material hasil penarikan oleh pelarut air atau pelarut organik dari bahan kering (dikeringkan). Hasil penyarian tersebut kemudian pelarutnya diuapkan dengan cara penguapan dengan alat evaporator sehingga diperoleh ekstrak kental jika pelarutnya pelarut organik. Metanol, etanol 70 %, dan etanol 96% adalah pelarut pilihan utama untuk mengekstraksi metabolit
sekunder yang belum diketahui strukturnya dan untuk tujuan skrining (Saifudin, 2014).
Pemilihan teknik ekstraksi bergantung pada bagian tanaman yang akan diekstraksi dan bahan aktif yang diinginkan. Tujuan dari suatu proses ekstraksi adalah untuk memperoleh metabolit sekunder dari suatu bagian tanaman dengan spesies tertentu dan mengidentifikasi metabolit sekunder yang terdapat dalam tumbuhan sebagai penanda kimia atau kajian metabolisme (Endarini, 2016).
Menurut Endarini (2016), teknik-teknik ekstraksi adalah:
1. Maserasi. Maserasi dilakukan dengan melakukan perendaman bagian tanaman yang sudah digiling kasar dengan pelarut dalam bejana tertutup pada suhu kamar selama sekurang-kurangnya 3 hari dengan pengadukan berkali-kali sampai semua bagian tanaman yang dapat larut melarut dalam cairan pelarut.
2. Infusi. Infusi dibuat dengan maserasi bagian tanaman dengan air dingin atau air mendidih dalam jangka waktu yang pendek. Pemilihan suhu infus tergantung pada ketahanan senyawa bahan aktif yang selanjutnya segera digunakan sebagai obat cair.
4. Dekoksi. Pada proses dekoksi, bagian tanaman yang berupa batang, kulit kayu, cabang, ranting, rimpang atau akar direbus dalam air mendidih dengan volume dan selama waktu tertentu kemudian didinginkan dan disaring untuk memisahkan cairan ekstrak dari ampasnya. Proses ini sesuai untuk mengekstrak bahan bioaktif yang dapat larut dalam air dan tahan terhadap panas.
5. Perkolasi. Perkolasi merupakan teknik yang digunakan untuk mengekstrak bahan aktif dari tanaman dalam penyediaan ekstrak cair.
6. Sokhletasi. Pada teknik ekstraksi ini, bagian tanaman yang sudah digiling halus dimasukkan ke dalam kantong berpori (thimble) yang terbuat dari kertas saring yang kuat dan dimasukkan ke dalam alat sokhlet untuk dilakukan ekstraksi. Pelarut yang ada dalam labu akan dipanaskan dan uapnya akan mengembun pada kondenser.
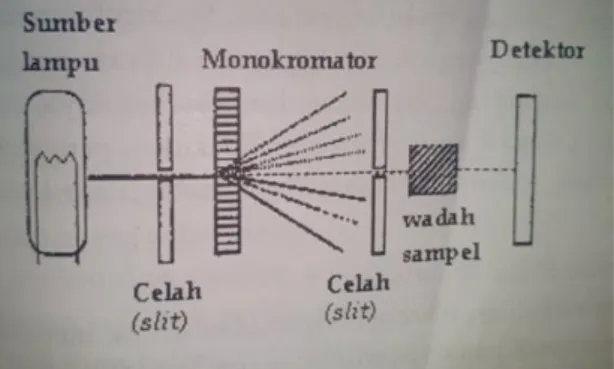
2.5. Spektrofotometer UV-Vis
Spektrofotometri umumnya lebih disukai terutama oleh industri skala kecil karena biaya peralatan lebih sedikit dan masalah perawatannya minimal. Metode analisis didasarkan pada pengukuran penyerapan cahaya monokromatik oleh senyawa tidak berwarna di jalur spektrum ultraviolet (200-380nm) (Shah dkk., 2015).
Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan sinar tampak terdiri atas suatu sistem optik dengan kemampuan menghasilkan sinar monokromatis dalam jangkauan panjang gelombang 200- 800nm. Diagram skematis spektrofotometer UV-Vis dapat dilihat pada Gambar 2.3 di bawah (Rohman, 2007):
Gambar 2.3 Diagram skematis spektrofotometer UV-vis (Rohman, 20017).
Menurut Rohman (2007), komponen- komponen spektrofotometer meliputi:
a) Sumber-sumber lampu: lampu deuterium untuk daerah UV pada panjang gelombang 190-350nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visible pada panjang antara 350-900nm.
b) Monokromator: digunakan untuk mendispersikan sinar ke dalam komponen-komponen panjang gelombang dimana akan dipilih oleh celah (slit). Monokromator berputar sedemikian rupa hingga kisaran panjang gelombang dilewatkan pada sampel sebagai scan instrument melewati spektrum.
c) Optik-optik; dapat didesain untuk memecah sumber sinar sehingga sumber sinar melewati 2 kompartmen dan sebagaimana dalam spektrofotometer berkas ganda (double beam), suatu larutan blanko dapat digunakan dalam satu kompartmen untuk mengkoreksi pembacaan atau spektrum sampel.
Hukum Lambert-Beer adalah prinsip spektroskopi absorbansi. Untuk panjang gelombang tunggal, A adalah absorbansi, a adalah absorptivitas molar senyawa atau molekul dalam larutan, b adalah panjang jalur kuvet atau pemegang sampel dan c adalah konsentrasi larutan (Shah dkk., 2015). Persamaan hukum Lambert- Beer adalah sebagai berikut:
Di mana, A = Absorbansi, a = absorptivitas, b = panjang jalur, c = konsentrasi.
2.6 Penetapan Kadar Total Fenol
Fenol biasanya lebih baik dideteksi dengan menggunakan pereaksi yang lebih spesifik dan terbaik adalah Folin-Ciocalteu (Harborne, 1973). Senyawa
A = a.b.c
fenol bereaksi dengan reagen Folin-Ciocalteu dalam suasana basa agar terjadi disosiasi proton pada senyawa fenol menjadi ion fenolat. Reagen Folin-Ciocalteau digunakan karena senyawa fenolik dapat bereaksi dengan Folin membentuk larutan berwarna yang dapat diukur absorbansinya (Alfian dan Susanti, 2012).
Prinsip dari metode Folin-Ciocalteau adalah terbentuknya senyawa kompleks berwarna biru yang dapat diukur pada panjang gelombang maksimumnya. Gugus hidroksil fenol mereduksi asam heteropoli (fosfomolibdat- fosfotungsat) yang terdapat dalam reagen Folin-Ciocalteu menjadi suatu kompleks molybdenum-tungsten yang berwarna biru (Alfian dan Susanti, 2012).
Berdasarkan Sam dkk (2016), larutan asam galat atau asam 3,4,5- trihidroksibenzoat (C6H2(OH)3CO2H ) digunakan sebagai standar karena asam galat merupakan turunan dari asam hidroksibenzoat yang tergolong asam fenolik sederhana dan sebagai standar yang ketersediaan substansi yang stabil dan murni.
2.7 Penetapan Kadar Total Flavonoid
Penentuan jumlah flavonoid dilakukan dengan kolorimetri komplementer yang mempunyai prinsip pengukuran berdasarkan pembentukan warna. Prinsip penetapan kadar flavonoid dengan metode aluminium klorida adalah terjadinya pembentukan kompleks antara aluminium klorida dengan gugus keto pada atom C-4 dan gugus hidroksi pada atom C-3 atau C-5 yang bertetangga dari golongan flavon dan flavonol (Azizah dkk., 2014).
Senyawa yang digunakan sebagai standar pada penetapan kadar flavonoid adalah kuersetin, karena kuersetin merupakan flavonoid golongan flavonol yang memiliki gugus keto pada atom C-4 dan juga gugus hidroksil pada atom C-3 dan C-5 yang bertetangga (Aminah dkk., 2017).
BAB III
METODE PENELITIAN
Dalam penelitian ini, metode yang digunakan adalah metode eksperimental meliputi pengumpulan dan pengolahan tumbuhan, skrining fitokimia, pembuatan ekstrak, dan kadar total fenol dan flavonoid menggunakan spektrofotometer UV-Visible.
3.1 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Biologi Farmasi dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.2 Alat dan Bahan 3.2.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas laboratorium, blender (Panasonic), seperangkat alat destilasi, oven listrik (Stork), neraca analitik (Vibra AJ), neraca kasar (Saherand), penangas air (Yenaco), lemari pengering, vortex (Boeco Germany), vial dan spektrofotometer UV-Visible (Shimadzu).
3.2.2 Bahan
Semua bahan yang digunakan adalah asam galat, kuersetin, methanol pro analysis, reagen Folin-Ciocalteu, akuades, alfa naftol, aluminium (III) klorida,
amil alkohol, amil asetat anhidrat, asam klorida pekat, asam nitrat pekat, asam sulfat pekat, besi (III) klorida, bismuth nitrat, etanol 96%, etil asetat, ioduim, isopropanol, kalium iodide, kloralhidrat, kloroform, n-heksan, natrium karbonat,
natrium hidroksida, natrium asestat, natrium klorida, serbuk magnesium, timbal (II) asetat dan toluen.
3.2.3 Sampel
Sampel yang telah digunakan pada penelitian ini adalah daun sibo (Leea indica F.).
3.3 Pembuatan Pereaksi 3.3.1 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida P dilarutkan dalam 20 ml air secukupnya, lalu ditambahkan 2 g iodium P kemudian ditambahkan air hingga 100 ml (Marjoni, 2016).
3.3.2 Pereaksi Mayer
Pereaksi Mayer dapat dibuat degan cara menambahkan 5 g kalium iodida dalam 10 ml aquades, kemudian ditambahkan larutan 1,36 g merkuri (II) klorida dalam 60 ml air suling. Larutan kemudian dikocok dan ditambahkan aquadest sampai 100 ml (Marjoni, 2016).
3.3.3 Larutan Asam Klorida 2 N
Larutan asam klorida pekat sebanyak 17 ml diencerkan dengan air suling sampai 100 ml (Marjoni 2016).
3.3.4 Larutan Asam Sulfat 2 N
Larutan asam sulfat pekat sebanyak 5,8 ml ditambah dengan air suling sampai 100 ml (Depkes, 1995).
3.3.5 Pereaksi Dragendorff
Bismut nitrat sebanyak 8 g dilarutkan dalam asam nitrat sebanyak 20 ml.
Kemudian dicampurkan dengan 27,2 g kalium iodida dalam 50 ml air suling, didiamkan sampai memisah sempurna. Kemudian diambil lapisan jernih dan dien-
cerkan dengan air secukupnya hingga 100 ml (Marjoni, 2016).
3.3.6 Larutan Penyemprot Liebermann-Burchard
Asam sulfat pekat sebanyak 5 ml dicampur dalam 50 ml etanol 96%, lalu ditambahkan hati-hati dengan 5 ml asam asetat anhidrida ke dalam campuran tersebut (Depkes, 1995).
3.3.7 Larutan Asam Nitrat 0,5 N
Asam nitrat pekat sebanyak 3,4 ml diencerkan dengan air suling hingga 100 ml (Depkes, 1995).
3.3.8 Larutan Timbal (II) Asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat P dilarutkan dalam air bebas karbon dioksida hingga 100 ml (Depkes, 1995).
3.3.9 Larutan Besi (III) Klorida 1% (b/v)
Sebanyak 1 g besi (III) klorida dilarutkan dalam air secukupnya hingga 100 ml (Depkes, 1995).
3.3.10 Larutan Pereaksi Kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml air (Depkes, 1995).
3.3.11 Pereaksi Molish
Sebanyak 3 g α-naftol, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Marjoni, 2016).
3.3.12 Larutan Aluminium Klorida 10% (b/v)
Sebanyak 1 g aluminium klorida ditimbang kemudian dilarutkan dalam akuades hingga 10 ml.
3.3.13 Larutan Natrium Asetat 1 M
Sebanyak 0,83 g natrium asetat ditimbang kemudian dilarutkan dalam aku-
ades hingga 10 ml.
3.3.14 Larutan Natrim Karbonat
Sebanyak 4 g natrium karbonat ditimbang kemudian dilarutkan dalam akuades hingga 20 ml.
3.3.15 Larutan Folin-Ciocalteu 10% (v/v)
Diambil 5 ml larutan pereaksi Folin-Ciocalteu lalu diencerkan dengan akuades sampai 50 ml.
3.4 Pengumpulan dan Pengolahan Tumbuhan 3.4.1 Pengumpulan Bahan Tumbuhan
Pengumpulan bahan tumbuhan dilakukan secara purposif, yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan yang digunakan adalah daun sibo (Leea Indica F.).
3.4.2 Identifikasi Tumbuhan
Identifikasi tumbuhan sibo dilakukan di Herbarium Medanense (MEDAN) Fakultas Matematika dan Ilmu Pengetahuan Alam USU.
3.4.3 Pembuatan Simplisia
Daun sibo dibersihkan lalu dikeringkan di dalam lemari pengering pada suhu 40℃-50℃. Tumbuhan dianggap kering apabila sudah rapuh, selanjutnya tumbuhan diserbukkan dengan menggunakan blender.
3.5 Skrining Fitokimia
Skrining fitokimia serbuk simplisia dan ekstrak meliputi pemeriksaan senyawa golongan triterpenoid/steroid, flavonoid, saponin, alkaloid, glikosida dan tannin.
3.5.1 Pemeriksaan Steroid/Triterpenoid
Sejumlah 1 g serbuk direndam dengan 20 ml n-heksan selama 2 jam.
Disaring, filtrat diuapkan dicawan penguap, sisanya ditambahkan 2 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi Lieberman-Burchard).
Apabila terbentuk warna biru hijau menunjukkan adanya triterpenoid, manakala warna merah, merah muda atau ungu menunjukkan adanya steroid (Marjoni, 2016).
3.5.2 Pemeriksaan Flavonoid
Sebanyak 10 g serbuk simplisia ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring ketika panas. Kedalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Jika terjadi warna merah, kuning, jingga pada lapisan amil alcohol berarti flavonoida positif (Marjoni, 2016).
3.5.3 Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia, dimasukkan ke dalam tabung reaksi lalu ditambahkan dengan 10 ml air panas, didinginkan kemudian dikocok kuat–kuat selama 10 detik. Jika terbentuk buih yang mantap setinggi 1–10 cm yang tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes HCl 2 N menunjukkan adanya saponin (Marjoni, 2016).
3.5.4 Pemeriksaan Alkaloid
Serbuk simplisia 0,5 g ditambah 1 ml HCl 2 N dan 9 ml air suling, Dipanaskan di atas penangas air selama 2 menit lalu didinginkan dan disaring.
Filtratnya dipakai untuk uji alkaloida sebagai berikut:
a. Filtrat 3 tetes ditambahkan dengan 2 tetes larutan pereaksi Mayer, terbentuk endapan berwarna putih atau kuning.
b. Filtrat 3 tetes ditambahkan dengan 2 tetes larutan pereaksi Bouchardat, terbentuk endapan coklat sampai hitam
c. .Filtrat 3 tetes ditambahkan dengan 2 tetes larutan pereaksi Dragendorff terbentuk warna merah atau jingga.
Alkaloida disebut positif jika endapan atau kekeruhan paling sedikit dua dari tiga tabung reaksi dari percobaan di atas (Marjoni, 2016).
3.5.5 Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95%
dengan air suling (7:3), direfluks selama 10 menit, didinginkan dan disaring. Pada 20 ml filtrat ditambahkan 25 ml air dan 25 ml timbal (II) asetat 0,4N, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari sebanyak 3 kali, tiap kali dengan 20 ml campuran isopropanol P dan kloroform P (2:3).
Kumpulan sari air diuapkan pada suhu tidak lebih dari 50℃ dan sisanya dilarutkan dalam 2 ml methanol P. Larutan sisa dimasukkan dalam tabung reaksi selanjutnya diuapkan di atas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes larutan pereaksi Molish. Tambahkan hati-hati 2 ml asam sulfat P melalui dinding tabung, terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya glikosida (Depkes, 1995).
3.5.6 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling, lalu dipanaskan, disaring. Filtratnya diencerkan dengan akuades sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida, jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Marjoni, 2016).
3.6 Pembuatan Ekstraksi
Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut etanol 96%. Serbuk simplisia daun sibo sebanyak 800 g dimasukkan ke dalam bejana, kemudian dimaserasi dengan etanol 96% sebanyak 75 bagian, dibiarkan selama 5 hari, terlindung dari cahaya sambil diaduk sekali-kali setiap hari.
Setelah 5 hari disaring dan ampas dicuci dengan pelarut secukupnya, diaduk dan disaring sehingga diperoleh 100 bagian. Tampung maserat ke dalam bejana tertutup, dibiarkan sejuk terlindung dari cahaya selama 2 hari. Selanjutnya pelarut diuapkan dengan rotary evaporator pada suhu 40-50°C, kemudian dipekatkan di atas penangas air sampai diperoleh ekstrak kental (Ditjen POM RI, 1979).
3.7 Penentuan Kadar Total Fenol dan Total Flavonoid dari Ekstrak Etanol Daun Sibo
Penetapan kadar fenolik total dilakukan dengan menggunakan reagen Folin-Ciocalteau yang dapat diukur absorbansinya dengan spektrofotometer UV- Vis (Alfian dan Susanti, 2012). Penentuan jumlah flavonoid dilakukan dengan kolorimetri komplementer yang mempunyai prinsip pengukuran berdasarkan pembentukan warna dengan metode kolorimetri AlCl3 (Desmiaty dkk., 2009).
3.7.1 Penentuan Kadar Total Fenol
3.7.1.1 Penentuan Panjang Gelombang Absorbansi Maksimum Asam Galat Ditimbang 10 mg asam galat, kemudian dilarutkan dengan metanol hingga 100 ml (konsentrasi 100 μg/ml). Sebanyak 5 ml larutan dipipet ke dalam labu 10 ml dan ditambahkan dengan metanol sehingga batas tanda (konsentrasi 500 μg/ml). Sebanyak 2 ml larutan dipipet dan dimasukkan ke dalam vial. Larutan ditambahkan dengan 7,9 ml akuades, 1,5 ml reagen Folin-Ciocalteu 10% dan
larutan divortex selama 1 menit, lalu didiamkan selama 5 menit. Ditambahkan 1,5 ml larutan Na2CO3 7.5%. Absorbansi larutan diukur terhadap reagen yang digunakan sebagai blanko secara spektrofototmeteri UV-Vis pada rentang 200 nm – 800 nm. Diperoleh panjang gelombang serapan maksimum asam galat.
3.7.1.2 Penentuan Waktu Kerja (operating time)
Dipipet larutan asam galat konsentrasi 500 μg/ml sebanyak 2 ml dan dimasukkan ke dalam vial. Larutan ditambahkan dengan 7,9 ml akuades, 1,5 ml reagen Folin-Ciocalteu 10% dan larutan divortex selama 1 menit, lalu didiamkan selama 5 menit. Ditambahkan 1,5 ml larutan Na2CO3 7.5%. Diukur absorbansi larutan pada panjang gelombang 766 nm setiap 1 menit dan diamati waktu larutan tersebut mulai menghasilkan absorbansi yang stabil, yang akan digunakan sebagai operating time.
3.7.1.3 Penentuan Kurva Kalibrasi Asam Galat
Dipipet larutan asam galat konsentrasi 500 μg/ml sebanyak 0 ml, 0,6 ml, 1,0 ml, 1,4 ml dan 1,8 ml ke dalam labu 10 ml dan ditambahkan dengan metanol sehingga batas tanda (konsentrasi 0 μg/ml, 6 μg/ml, 10 μg/ml, 14 μg/ml dan 18 μg/ml). Masing-masing konsentrasi dipipet 3,0 ml dan dimasukkan ke dalam vial.
Larutan ditambahkan dengan 7,9 ml akuades, 1,5 ml reagen Folin-Ciocalteu 10%
dan larutan divortex selama 1 menit, lalu didiamkan selama 5 menit. Ditambahkan 1,5 ml larutan Na2CO3 7,5%. Diinkubasi pada suhu kamar pada rentang operating time. Diukur absorbansi larutan standar asam galat pada masing-masing
konsentrasi pada panjang gelombang maksimum 766 nm secara spektrofotometri UV-Vis. Dihasilkan kurva kalibrasi serta persamaan garis linear y = ax + b.
3.7.1.4 Penetapan Kadar Total Fenol pada Ekstrak Etanol Daun Sibo Ditimbang 25 mg ekstrak etanol daun sibo dan dilarutkan dengan metanol
hingga 100 ml (konsentrasi 250 μg/ml). Dipipet 2 ml larutan kedalam labu 10 ml dan ditambahkan metanol hingga batas tanda (konsentrasi 200 μg/ml). Larutan uji dipipet sebanyak 0,1 ml, kemudian ditambahakan 7,9 ml akuades, 1,5 ml reagen Folin-Ciocalteu. Larutan divortex selama ± 1 menit lalu didiamkan 4-8 menit, selanjutnya ditambahkan 1,5 ml larutan natrium karbonat (Na2CO3) 20%. Larutan diinkubasi pada suhu kamar pada rentang operating time. Absorbansi larutan uji diukur terhadap kalibrasi asam galat pada panjang gelombang 766 nm secara spektrofotometri UV-Vis. Konsentrasi fenol dalam larutan uji dihitung dari plot kalibrasi dan kadar total fenol dinyatakan dalam GAE (gallic acid equivalent) yaitu jumlah kesetaraan milligram asam galat dalam 1 gram sampel.
3.7.2 Penentuan Kadar Total Flavonoid
3.7.2.1 Penentuan Panjang Gelombang Absorbansi Maksimum Kuersetin Sebanyak 10 mg kuersetin ditimbang lalu dilarutkan dengan metanol hingga 100 ml (konsentrasi 100 μg/ml ). Sebanyak 1,4 ml larutan dipipet ke dalam labu 10 ml dan ditambahkan dengan metanol sehingga batas tanda (konsentrasi 140 μg/ml). Sebanyak 2 ml larutan dipipet ke dalam vial kemudian ditambahkan dengan 0,1 ml aluminium klorida 10% (AlCl3), 0,1 ml natrium asetat (CH3COONa ) serta 2,8 ml akuades Diinkubasi pada suhu kamar. Absorbansi larutan diukur terhadap reagen yang digunakan sebagai blanko secara spektrofotometeri UV-Vis pada rentang 200 nm – 800 nm. Diperoleh panjang gelombang serapan maksimum kuersetin.
3.7.2.2 Penentuan Waktu Kerja (operating time)
Dipipet larutan kuersetin konsentrasi 140 μg/ml sebanyak 2 ml larutam dipipet ke dalam vial kemudian ditambahkan dengan 0,1 ml aluminium klorida 10% (AlCl3), 0,1 ml natrium asetat (CH3COONa) serta 2,8 ml akuades. Diukur
absorbansi larutan pada panjang gelombang 434 nm setiap 1 menit dan diamati waktu larutan tersebut mulai menghasilkan absorbansi yang stabil, yang akan digunakan sebagai operating time.
3.7.2.3 Penentuan Kurva Kalibrasi Kuersetin
Dipipet larutan kuersetin konsentrasi 140 μg/ml sebanyak 0 ml, 0,6 ml, 1,0 ml, 1,4 ml dan 1,8 ml ke dalam labu 10 ml dan ditambahkan dengan metanol sehingga batas tanda (konsentrasi 0 μg/ml, 6μg/ml, 10 μg/ml, 14 μg/ml dan 18 μg/ml). Masing-masing konsentrasi dipipet 2 ml dan dimasukkan ke dalam vial.
Larutan ditambahkan dengan 0,1 ml aluminium klorida 10% ( AlCl3), 0,1 ml natrium asetat (CH3COONa) serta 2,8 ml akuades. Diinkubasi pada suhu kamar pada rentang operating time. Diukur absorbansi larutan standar kuersetin pada masing-masing konsentrasi pada panjang gelombang maksimum 434 nm terhadap reagen yang digunakan sebagai blanko secara spektrofotometri UV-Vis.
Dihasilkan kurva kalibrasi serta persamaan garis linear y = ax + b terhadap kuersetin.
3.7.2.4 Penetapan Kadar Total Flavonoid pada Ekstrak Etanol Daun Sibo Ditimbang 25 mg ekstrak etanol daun sibo dan dilarutkan dengan metanol hingga 100 ml (konsentrasi 250 μg/ml). Dipipet 2 ml ke dalam labu 10 ml dan ditambahkan metanol sehingga batas tanda (konsentrasi 200 μg/ml). Dipipet 2 ml larutan lalu ditambahkan dengan 0,1 ml aluminium klorida 10% (AlCl3), 0,1 ml natrium asetat (CH3COONa) serta 2,8 ml akuades. Diinkubasi pada suhu kamar pada rentang operating time. Absorbansi larutan uji diukur terhadap standar kalibrasi kuersetin pada panjang gelombang 434 nm secara spektrofotometri UV- Vis. Konsentrasi flavonoid dalam sampel uji yang dihitung dari plot kalibrasi dan dinyatakan dalam QE ( quercetin equivalent ) yaitu jumlah keseteraan milligram
kuersetin dalam 1 gram sampel.
3.8 Perhitungan Kadar Total Fenol dan Total Flavonoid
Konsentrasi total fenol dan total flavonoid dapat dihitung dengan mensubstitusikan nilai absorbansi sampel ke dalam persamaan regresi linear yang didapat pada kurva kalibrasi. Nilai konsentrasi sampel dapat disubstitusikan lagi ke dalam rumus perhitungan sebagai berikut:
Kadar (μg/ml) = C x V x Fp W Keterangan:
C = Konsentrasi senyawa dalam larutan sampel (μg/ml) V = Volume larutan sampel (ml)
Fp = Faktor pengenceran W = Berat sampel (g)
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil Identifikasi tumbuhan yang digunakan dilakukan di Herbarium Medanese, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara Medan, menyebutkan bahwa tumbuhan yang diteliti adalah tumbuhan sibo (Leea Indica F.), familia Leeaceae. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman 39.
4.2 Hasil Ekstraksi Daun Sibo
Hasil ekstraksi simplisia daun sibo dari 800 g dengan cara maserasi menggunakan pelarut etanol 96% diperoleh ektrak etanol daun sibo sebanyak 50,5 g dengan nilai rendemen 6,31%.
4.3 Hasil Skrining Daun Sibo
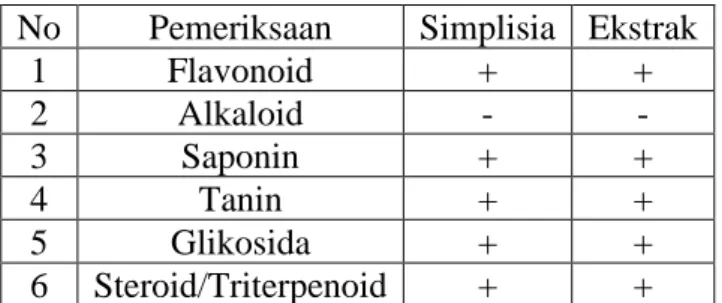
Skrining fitokimia terhadap simplisia dan ekstrak etanol daun sibo dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat didalamnya. Hasil skrining fitokimia serbuk simplisia, ekstrak etanol dari daun sibo dapat dilihat pada Tabel 4.1 dibawah ini.
Tabel 4.1 Hasil skrining fitokimia simplisia dan ekstrak etanol daun sibo
Keterangan: (+) positif: mengandung golongan senyawa (-) negatif: tidak mengandung golongan senyawa
No Pemeriksaan Simplisia Ekstrak
1 Flavonoid + +
2 Alkaloid - -
3 Saponin + +
4 Tanin + +
5 Glikosida + +
6 Steroid/Triterpenoid + +
Hasil yang diperoleh pada Tabel 4.1 menunjukkan bahwa daun sibo mengandung golongan senyawa flavonoid, saponin, tanin, steroid/triterpenoid dan glikosida.
4.4 Hasil Penetapan Kadar Total Fenol
4.4.1 Hasil Penetapan Panjang Gelombang Absorbansi Maksimum Asam Galat
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Panjang gelombang maksimal dipilih dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu (Rohman, 2007).
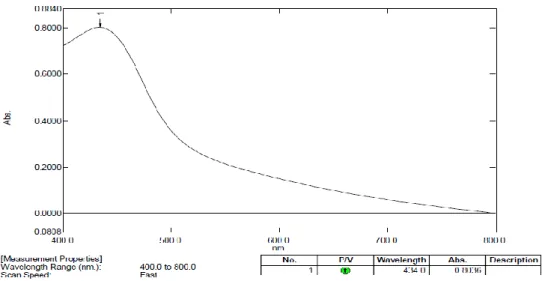
Pengukuran panjang gelombang maksimum larutan baku konsentrasi 500 ppm, dilakukan setelah penambahan reagen Folin-Ciocalteu 10% dan larutan natrium karbonat 7,5%. Hasilnya diperoleh menghasilkan panjang gelombang maksimum 766 nm yang diukur dengan cara spektrofotometeri UV-Vis seperti yang dapat dilihat pada Gambar 4.1.
Gambar 4.1 Kurva panjang gelombang maksimum Asam Galat
4.4.2 Hasil Penentuan Waktu Kerja (operating time)
Operating time bertujuan untuk mengetahui waktu pengukuran yang
stabil. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan (Rohman, 2007). Penentuan kadar total fenol dimulai dengan melakukan operating time larutan baku asam galat segera setelah penambahan reagen Folin- Ciocalteu dan larutan natrium karbonat 7.5%
pada panjang gelombang 766 nm. Berdasarkan Sari (2017), hasil yang diperoleh adalah menit ke-90 karena larutan mulai menghasilkan nilai absorban yang stabil.
4.4.3 Hasil Penetapan Kurva Kalibrasi Asam Galat
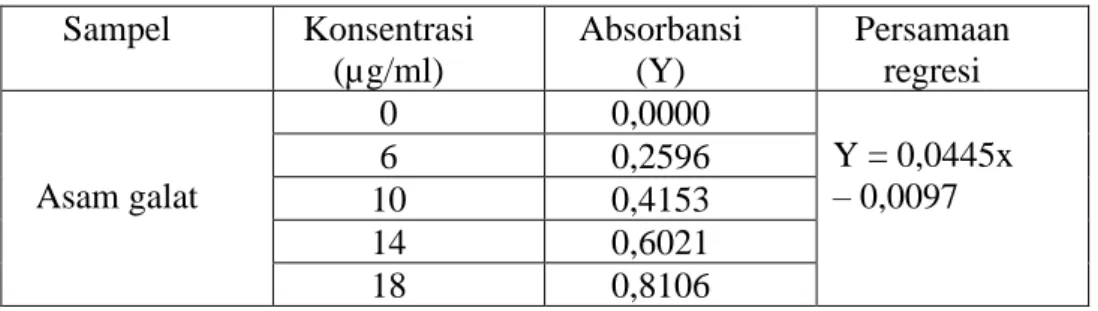
Kurva kalibrasi dibuat dengan mengukur absorbansi larutan dengan konsentrasi 0 µg/ml , 6 µg/ml, 10 µg/ml, 14 µg/ml , 18 µg/ml pada panjang gelombang 766 nm. Penentuan kadar total fenol dilakukan menggunakan reagen Folin-Ciocalteu secara spektrofotometri UV-Vis. Kadar total fenol dapat ditentukan menggunakan asam galat sebagai standar. Kosentrasi total fenol diperoleh berdasarkan perhitungan persamaan regresi yang diperoleh dengan cara memplot konsentrasi dan absorbansi larutan standar. Nilai absorban setiap konsentrasi dan gambar kurva kalibrasi asam galat dapat dilihat pada Tabel 4.2 dan Gambar 4.2.
Tabel 4.2. Hasil absorbansi standar Asam Galat Sampel Konsentrasi
(µg/ml)
Absorbansi (Y)
Persamaan regresi
Asam galat
0 0,0000
Y = 0,0445x – 0,0097
6 0,2596
10 0,4153
14 0,6021
18 0,8106
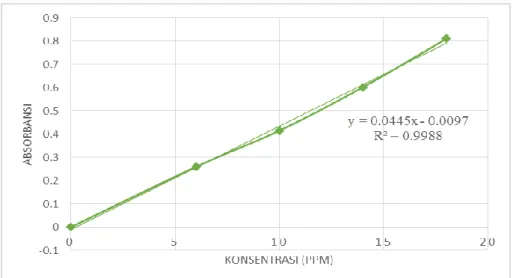
Gambar 4.2 Kurva kalibrasi larutan standar asam galat
Gambar di atas menunjukkan kurva serapan asam galat diperoleh nilai r = 0,9988 dengan persamaan regresi Y = 0,0445x – 0,0097, dimana perhitungan kurva kalibrasi telah dilampirkan pada Lampiran 8, halaman 45. Koefisien korelasi, r, adalah indeks standar yang nilainya tidak tergantung pada skala pengukuran variabel. Nilainya terletak dalam kisaran (−1, 1) dan nilai kuadratnya menggambarkan pengurangan proporsional dalam variabilitas satu variabel ketika yang lain dipertahankan konstan. Oleh karena itu, meskipun koefisien korelasi dengan sendirinya merupakan ukuran penting hubungan antara variable itu adalah R kuadrat yang memungkinkan perbandingan kekuatan hubungannya (Asuero dan Gonz´alez, 2016).
4.4.4 Hasil Penetapan Kadar Total Fenol Dalam Ekstrak Etanol Daun Sibo (Leea indica F.)
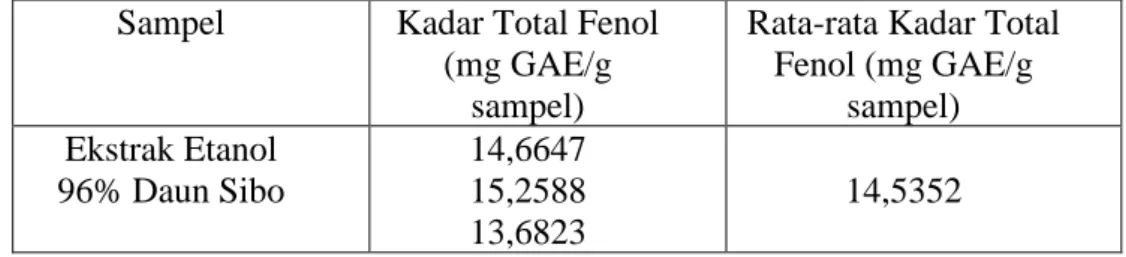
Nilai absorbansi dari ekstrak etanol daun sibo yang diukur dengan spektrofotometer UV-Vis diperoleh pada menit ke-30. Larutan sampel direaksikan dengan reagen Folin-Ciocalteu menghasilkan warna biru. Hasil penentuan kadar total fenol pada ekstak daun sibo dapat dilihat pada Tabel 4.3.
Tabel 4.3 Hasil kadar total fenol pada ekstrak daun sibo (Leea indica
F.)
Sampel Kadar Total Fenol (mg GAE/g
sampel)
Rata-rata Kadar Total Fenol (mg GAE/g
sampel) Ekstrak Etanol
96% Daun Sibo
14,6647 15,2588 13,6823
14,5352
Hasil penentuan kadar total fenol dari ekstrak etanol daun sibo yang diperoleh yaitu 14,5352 mg GAE/g sampel. Perhitungan kadar total fenol telah dilampirkan pada Lampiran 9 dan 10, halaman 46 dan 47.
Asam galat sebagai standar dipilih karena merupakan substansi yang murni dan stabil. Pengukuran total fenol digunakan dengan metode Folin- Ciocalteu yang berdasarkan kekuatan mereduksi dari gugus hidroksi fenol dengan menggunakan standar asam galat. Semua senyawa fenolik termasuk fenol sederhana dapat bereaksi dengan reagen Folin-Ciocalteu walaupun bukan penangkap radikal efektif. Inti aromatis pada senyawa fenolik dapat mereduksi fosfomolibdat-fosfotungstat menjadi molybdenum-tungsten. Senyawa fenolik hanya bereaksi dengan reagen Folin-Ciocalteu dalam suasana basa agar terjadi disosiasi proton pada senyawa fenolik menjadi ion fenolat. Reaksi fenol dan Folin-Ciocalteu akan terlihat dari adanya warna kuning dan dengan menambahkan natrium karbonat akan memberikan warna biru. Semakin biru larutan menunjukkan semakin tingginya absorbansi (Senet dkk., 2018)
.
4.5 Hasil Penetapan Kadar Total Flavonoid
4.5.1 Hasil Penetapan Panjang Gelombang Absorbansi Maksimum Kuersetin Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Panjang gelombang
maksimal dipilih dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu (Rohman, 2007).
Pengukuran panjang gelombang maksimum menggunakan larutan baku konsentrasi 140 ppm, dilakukan setelah penambahan reagen aluminium klorida dan natrium asetat 1 M serta akuades. Hasilnya diperoleh menghasilkan panjang gelombang maksimum 434 nm yang diukur dengan cara spektrofotometer UV- Vis, seperti yang dapat dilihat pada Gambar 4.3.
Gambar 4.3 Kurva panjang gelombang maksimum Kuersetin 4.5.2 Hasil Penentuan Waktu Kerja (operating time)
Operating time bertujuan untuk mengetahui waktu pengukuran yang stabil.
Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan (Rohman, 2007). Penentuan kadar total flavonoid dimulai dengan melakukan operating time larutan baku kuersetin segera setelah penambahan reagen aluminium klorida dan natrium asetat 1 M serta akuades pada panjang gelombang 434 nm. Berdasarkan Sari (2017), hasil yang diperoleh adalah menit ke -30 karena larutan mulai menghasilkan nilai absorban larutan mulai menghasilkan nilai absorban yang stabil.
4.5.3 Hasil Penetapan Kurva Kalibrasi Kuersetin
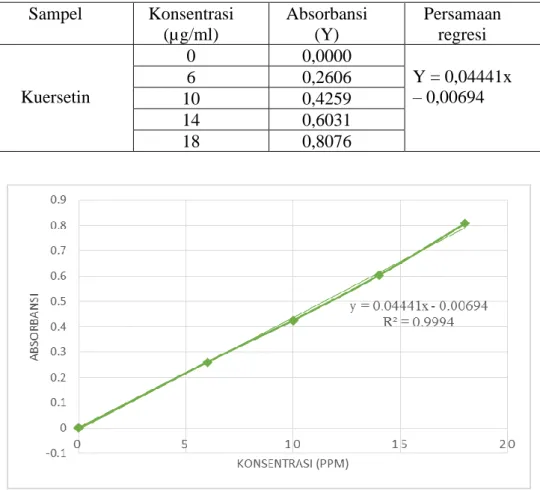
Kurva kalibrasi dibuat dengan mengukur absorbansi larutan dengan konsentrasi 0 µg/ml, 6 µg/ml, 10 µg/ml, 14 µg/ml, 18 µg/ml pada panjang gelombang 434 nm. Penentuan kadar total flavonoid dilakukan menggunakan reagen aluminium klorida 10% secara spektrofotometri UV-Vis. Kadar total flavonoid dapat ditentukan menggunakan kuersetin sebagai standar. Kosentrasi total flavonoid diperoleh berdasarkan perhitungan persamaan regresi yang diperoleh dengan cara memplot konsentrasi dan absorbansi larutan standar. Nilai absorban setiap konsentrasi dangambar kurva kalibrasi larutan standar kuersetin dapat dilihat pada Tabel 4.4 dan Gambar 4.4.
Tabel 4.4 Hasil absorbansi standar kuersetin Sampel Konsentrasi
(µg/ml)
Absorbansi (Y)
Persamaan regresi
Kuersetin
0 0,0000
Y = 0,04441x – 0,00694
6 0,2606
10 0,4259
14 0,6031
18 0,8076
Gambar 4.4 Kurva kalibrasi larutan standar kuersetin
Gambar di atas menunjukkan kurva serapan kuersetin diperoleh nilai r =
0,9994 dengan persamaan regresi y = 0,0441x – 0,00694, dimana perhitungan kurva kalibrasi telah dilampirkan pada Lampiran 12, halaman 50. Koefisien korelasi, r, adalah indeks standar yang nilainya tidak tergantung pada skala pengukuran variabel. Nilainya terletak dalam kisaran (−1, 1), dan nilai kuadratnya menggambarkan pengurangan proporsional dalam variabilitas satu variabel ketika yang lain dipertahankan konstan. Oleh karena itu, meskipun koefisien korelasi dengan sendirinya merupakan ukuran penting hubungan antara variabel, itu adalah R kuadrat yang memungkinkan perbandingan kekuatan hubungannya (Asuero dan Gonz´alez, 2016).
4.5.4 Hasil Penetapan Kadar Total Flavonoid Dalam Ekstrak Etanol daun Sibo (Leea indica F.)
Nilai absorbansi dari ekstrak etanol daun sibo yang diukur dengan spektrofotometer UV-Vis diperoleh pada menit ke-30. Larutan sampel direaksikan dengan reagen AlCl3 menghasilkan warna kekuningan. Hal ini menunjukkan bahwa pada sampel mengandung senyawa flavonoid yang bereaksi dengan AlCl3 tetapi tidak menghasilkan warna kuning intensif seperti pada kuersetin. Hasil penentuan kadar total flavonoid pada ekstak daun sibo dapat dilihat pada Tabel 4.5.
Tabel 4.5 Hasil kadar total flavonoid pada ekstrak daun sibo (Leea indica F.)
Sampel Kadar Total
Flavonoid (mg QE/g sampel)
Rata-rata Kadar Total Flavonoid (mg QE/g
sampel) Ekstrak Etanol
96% Daun Sibo
20,4292 19,4445 21,2126
20,3621
Hasil penentuan kadar total flavonoid dari ekstrak etanol daun sibo diperoleh 20,3621 mg QE/g ekstrak etanol daun sibo. Perhitungan kadar total flavonoid dapat dilihat pada Lampiran 13 dan 14, halaman 51 dan 52.
Total kandungan flavonoid ditentukan menggunakan reagen aluminium klorida. Aluminium klorida akan membentuk kompleks stabil dengan karbonil kelompok pada C4 dan hidroksil pada C3 (flavonol) dan C5 dalam flavonol dan flavon (Sembiring dkk., 2018).
Prinsip dari metode aluminium klorida yaitu pembentukan kompleks yang stabil dengan C-4 gugus keto, serta pada C-3 atau C-5 gugus hidroksil dari flavon dan flavonol. Dalam penambahannya, aluminium klorida membentuk kompleks asam yang stabil dengan gugus ortohiroksil pada cincin A- atau B- dari senyawa- senyawa flavonoid. Kuersetin dipilih sebagai larutan pembanding karena merupakan salah satu senyawa golongan flavonoid yang dapat bereaksi dengan aluminium klorida membentuk kompleks (Haeria, 2016).
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Hasil penelitian yang dilakukan terhadap ekstrak etanol daun sibo (Leea indica F.) diperoleh kesimpulan:
a) Kadar total fenol dari ekstrak daun sibo menggunakan reagen Folin- Ciocalteu dengan metode spektrofotometri UV-Vis adalah sebesar 14,5352 mg GAE/g sampel.
b) Kadar total flavonoid dari ekstrak daun sibo menggunakan reagen aluminium klorida dengan metode spektrofotometri UV-Vis adalah sebesar 20,3621 mg QE/g sampel.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan penentuan kadar total fenol dan total flavonoid dengan ekstrak daun sibo menggunakan pelarut lain seperti butanol atau etil asetat.
DAFTAR PUSTAKA
Alfaridz, F., dan Amalia, R., (2018). Review Jurnal: Klasifikasi dan Aktivitas Farmakologi dan Senyawa Aktif Flavonoid. 16(3); 2-3.
Alfian, R., dan Susanti, H., (2012). Penetapan Kadar Total Fenolik dari Ekstrak Metanol Kelopak Bunga Rosella Merah (Hibiscus Sabdariffa Linn) dengan Variasi Tempat Tumbuh secara Spektrofotometri. Jurnal Ilmiah Kefarmasian. 2(1); 77-79.
Aminah., Tomayahu. N., dan Abidin. Z., (2017). Penetapan Kadar Flavonoid Total Ekstak Etanol Kulit Buah Alpukat (Persea americana Mill.) dengan Metode Spektrofotometri Uv-Vis. Jurnal Fitokimia Indonesia. 4(2); 228.
Anulika, N.P., Ignatius, E. O., Raymond. E. S. dkk., (2016). The Chemistry Of Natural Product: Plant Secondary Metabolites. International Journal of Technology Enhancements and Emerging Engineering Research. 4(8); 2.
Asuero, A.G., Sayago. A., dan Gozalez. A. G., (2006). The Correlation Coefficient: An Overview; 49.
Azizah, D.N., Kumolowati, E., dan Faramayuda, F., (2014). Penetapan Kadar Flavonoid Metode AlCl3 pada Ekstrak Metanol Kulit Buah Kakao (Theobroma Cacao L.). Jurnal Ilmiah Farmasi 2(2); 48.
Bais, S. (2013). A Phytochemical Review on an Important Medicinal Plat: Leea Indica. 2013(1); 1-3.
Catalogue of Life., (2015). Indexing the World's Known Species.[online].
https://www.catalogueoflife.org/col/details/species/id/3f288e5c534335e66 c405b9922884901. [diakses: 09 Desember 2019].
Depkes. (1995). Materi Medika Indonesia Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia; Halaman 300, 302, 303, 306, 321, 325 dan 334.
DitjenPOM RI, 1995. Farmakope Indonesia. Edisi Keempat. Jakarta: Direktorat Jenderal Pengawasan obat dan Makanan Departemen Kesehatan; Halaman 81-82.
Endarini, L.H. (2016). Farmakognisi dan Fitokimia. Jakarta: Pusdik SDM Kesehatan; Halaman 145-147.
Fessenden, R.J dan Fessenden, J.S. (1986). Kimia Organik. Penerjemah: Aloysius Hadyana Pudjaatmaka. Edisi Ketiga. Jilid Pertama. Jakarta: Penerbit Erlangga; Halaman 279-280.
Haeria, Hermawati, Dg.Pine, A.T.U., (2016). Penentuan Kadar Flavonoid Total dan Aktivitas Antioksidan Etanol Daun Bidara (Ziziphus spina-christi L.).Journal of Pharmaceutical and Medicinal Science.1(2);60.
Hapsari. A.M., (2017). Pengujian KAndungan Total Fenol dan Flavonoid serta Antioksidan Ekstrak Etanol Tempuyung (Sonchus arvenis L.); 68.
Harbrone, J.B. (1973). Phytochemical Methods. A Guide to Modern Techniques of Plant Analysis. London: Chapman and Hall;Halaman 1 dan 15.
Kekuda, T.R.P., Raghavendra, H.L., Bharadway, N.A., dan Akhilesha, S., (2018).
Traditional Uses Chemistry and Pharmacological Activites of Leea Indica (Burm. F. ) Merr. (Vitacea): A Comprehensive Review. International Journal of Green Pharmacy. 12(1).; 71 dan 72.
Kiranmayee, P., Anitha, K., dan Usha, R., (2016). Isolation ans Identification of Steroid Triterpenoid from the Polar and Non-polar Fractions of Caralluma
Attenvate (Wight) Roots. International Journal of Pharmacognosy and Phytochemical Research. 8(6).; 1.
Marjoni, M. R. (2016). Dasar-dasar Fitokimia untuk Diploma III Farmasi.
Jakarta: CV Trans Info Medan; Halaman 6-10, 12 dan 13.
Markham, K.R., dan Andersen, O.M., (2006). Flavonoids. Chemistry, Biochemistry and Applications. United States of America. CRC Press Book; Halaman 397-398.
Mishra, G., Khosa, R.L., Singh, P., dan Tahseen, M.A., (2014). Ethnobotany and Phytopharmacology of Lea Indica: An Overview . Journal of Coastal Life Medicine. 4(1); 69-70.
Panche.,A.N., Dwan, A.D., dan Chandra, S.R., (2016). Flavonoids: An Overview . Journal of Nutritional Science. 5(47); 1-3.
Rao, U.S.M., Abdurrazak, M., dan Mohd, K. S., (2016). Phytochemical Screening Total Flavonoid and Phenolic Content Assays of Various Solvent Extracts of Tepal of Musa Paradisiaca. Malaysian Journal of Analytical Science.
20(5); 1182-1183.
Robinson, T., (1995). Kandungan Organik Tumbuhan Tinggi. Bandung. Penerbit ITB; Halaman 191.
Rohman, A., (2007). Kimia Farmasi Analisis . Yogyakarta : Pustaka Pelajar;
Halaman 254, 261 dan 262.
Roy Indrianti Bangar S (2019). Uji Aktivitas Antibakteri Fraksi n-Heksana dan Frkasi Etil Asetat Daun Sibo (Leea indica F.) terhadap Staphylcoccus aureus dan Escherichia coli. Skripsi; 46.
Saifudin. A., (2014). Senyawa Alam Metabolit Sekunder. Teori, Konsep dan Teknik Permuniaan. Edisi Pertama. Yogyakarta : Penerbit Deepublish;
Halaman 46
Sam, S., Malik, A., dan Handayani (2016). Penetapan Kadar Fenolik Total dari Ekstrak Etanol Bunga Rosella Berwarna Merah (Hibiscus Sabdariffa L.) dengan Menggunakan Spektrofotometri UV-Vis . Jurnal Fitofarmako Indonesia. 3(2); 1865.
Sari, N., (2017). Penentuan Kadar Total Fenol dan Total Flavonoid dari Ekstrak Buah Andaliman (Zanthoxylum acanthopodium DC.). Skripsi; 43 dan 48.
Sembiring, E.N., Elya, B., dan Sauriasari, R., (2018). Phytochemical Screening.
Total Flavonoid and Total Phenolic Content and Antioxidant Activity of Different Parts of Caesalpinia Bonduk (L.) Roxb. Pharmacognosy Journal. 10(1); 123.
Senet, M.R.M., Raharja, IG.M.A.P., Darma, IK.T., dkk (2018). Penentuan Kandungan Total Flavonoid dan Total Fenol dari Akar Kersen (Mutingia Calabura) serta Aktivitasnya sebagai Antioksidan. Jurnal Kimia 2(1); 16 dan 17.
Shah, R.S., Pawar, R.B., Shah, R.R., dkk., (2015). Uv-Visible Spectroscopy. A Review. International Journal of Institutional Pharmacy and Life Science.
5(5)., Halaman 490-493.
Tungmunnithum, D., Thongboonyou, A., Pholboon, A., dan Yangsabai, A., (2018). Flavonoids and Other Phenolic Compunds from Medicinal Plants for Pharmaceutical and Medical Aspects: An Overview. 5(93); 2.
Valkenburg, J.L.C.H dan Bunyapraphatsara, N., (2002). Plant Resources of South-East Asia No 12(2). Medicinal and Poisonous Plants 2. Bogor.
Prosea Foundation; Halaman 330.
Lampiran 1. Hasil identifikasi tumbuhan
Lampiran 2. Bagan kerja penelitian
dicuci dari pengotor sampai bersih ditiriskan
ditimbang berat basahnya (1,08 kg) dikeringkan pada lemari pengering dengan suhu 40-50°
ditimbang berat keringnya
diperiksa secara organoleptis dihaluskan dengan blender
disimpan dalam wadah yang tertutup rapat sebelum digunakan
Dimaserasi dengan etanol 96 % Daun Sibo (1,2 kg)
Simplisia (1,00 kg)
Skrining fitokimia Ekstrak
Serbuk simplisia (0,8) kg)
Senyawa golongan:
1. Alkaloid 2. Glikosida 3. Saponin 4. Tanin 5. Flavonoida
6. Steroid/Triterpeoid.
Ekstrak etanol Skrining fitokimia
Ditentukan kadar total fenol dan total flavonoid dengan
spektrofotometer UV-Visible