i
LAPORAN AKHIR
HIBAH UNGGULAN PROGRAM STUDI
ANALISIS KOMPOSISI ASAM AMINO DAN POLA PROTEIN
GELATIN HALAL DARI KULIT AYAM BROILER
Oleh:
Dra. Ni Made Puspawati, M.Phil., PhD. NIDN:0019036502
Ida Ayu Gede Widihati, S.Si., M.Si. NIDN:0031126826
Drs. I Nyoman Widana, MSi. NIDN:0008086403
Dibiayai oleh DIPA BLU Universitas Udayana Sesuai dengan Surat Perjanjian Penugasan Pelaksanaan Penelitian Nomor: 1306/UN.14.1.28.1/PP/2015, tanggal 25 Mei 2015
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA
iii
RINGKASAN
Salah satu kelemahan produk gelatin halal yang berasal dari non-mamalia adalah sifat mekaniknya yang kurang bagus sehingga aplikasinya di bidang kedokteran menjadi terbatas. Penelitian ini bertujuan untuk mempelajari pengaruh proses demineralisasi dan perbedaan jenis asam yang digunakan pada proses perendaman terhadap komposisi asam amino dan panjang rantai protein serta kaitannya dengan sifat mekanik gelatin yaitu kekuatan gel. Proses isolasi gelatin terdiri dari tahap deproteinasi menggunakan natrium hidroksida (NaOH 0,15%), demineralisasi dengan asam sulfat (H2SO4), dan dilanjutkan
dengan tahap perendaman menggunakan tiga jenis asam yang berbeda (asetat, laktat, dan sitrat 1%). Pengukuran kekuatan gel dilakukan dengan CT3 Texture Analyzer, analisis komposisi asam amino dilakukan dengan HPLC, dan analisis pola pita protein dilakukan menggunakan metode elektroforesis. Hasil penelitian menunjukkan perbedaan jenis asam yang digunakan berpengaruh terhadap rendemen, kekuatan gel, panjang rantai protein, dan komposisi asam amino dari produk gelatin yang dihasilkan. Rendemen gelatin tertinggi yaitu 21,11% diperoleh melalui proses perendaman asam sitrat (GASH), sedangkan terendah 10,70% diperoleh dengan perendaman asam asetat (GAAH). Sebaliknya kekuatan gel tertinggi 216,63 g bloom diberikan oleh gelatin dengan proses perendaman asam asetat, dan terendah 32.73 g bloom diperlihatkan oleh gelatin dengan proses perendaman asam laktat (GALH). Komposisi utama asam amino dari ketiga produk gelatin yaitu glisin, prolin, glutamate, dan arginin masing-masing dengan persentase berurutan 17,77%, 8,78%, 7,01%, dan 6,79% untuk GASH, 18,58%, 8,93%, 7,08%, dan 7,01% untuk GAAH, dan 20,54%, 9,87%, 7,53%, dan 7,96% untuk GALH. Asam amino histidin dan asam amino essensial triptofan tidak ditemukan pada ketiga produk gelatin hasil perlakuan. Hasil analisis elektroforegram ketiga produk gelatin tidak menunjukkan adanya pita protein dengan berat molekul yang tinggi pada 200kDA untuk rantai protein β sheet dan 300kDa untuk γ sheet tetapi GAAH dan GASH memperlihatkan pita protein dengan berat molekul yang relatif cukup tinggi yaitu pada 97 kDA dan 85 kDA untuk rantai protein α1 dan α2. Hal ini menunjukkan bahwa protein gelatin yang diperoleh tidak utuh dan terfragmentasi menjadi protein dengan berat molekul yang lebih rendah. Hal ini ditunjukkan dengan terdapatnya beberapa pita protein pada GAAH dan GASH dengan berat molekul yang lebih rendah yaitu pada 66kDA, 45, kDa, 31 kDA dan 25 kDA. Sedangkan GALH hanya memberikan protein dengan berat molekul yang rendah yaitu 21kDA dan dibawahnya. Pada penelitian ini dapat disimpulkan bahwa sifat mekanik produk gelatin khususnya kekuatan gel tidak dipengaruhi oleh komposisi asam aminonya tetapi dipengaruhi oleh berat molekul dan distribusi berat molekulnya atau pola pita proteinnya. Pada penelitian ini perendaman dengan asam asetat memberikan hasil gelatin dengan sifat mekanik terbaik dan memiliki kualitas mutu yang memenuhi kualitas mutu gelatin Standar Nasional Indonesia (SNI).
iv
PRAKATA
Puji dan syukur penulis panjatkan kehadapan Sang Hyang Widhi Wasa atas rahmat dan karunia yang dilimpahkan sehingga penelitian dan penulisan laporan akhir penelitian yang berjudul “ANALISIS KOMPOSISI ASAM AMINO DAN POLA PROTEIN GELATIN HALAL DARI KULIT AYAM BROILER” ini dapat dilaksanakan dengan baik dan beberapa kendala yang dihadapi dapat diatasi dengan baik. Penulis juga mengucapkan terima kasih kepada:
1. Rektor Universitas Udayana dan Ketua LPPM
2. Fakultas Matematika Universitas Udayana yang telah memberikan dana PNBP scheme Hibah Unggulan Program Studi tahun anggaran 2015.
3. Dekan Fakultas MIPA dan Ketua Jurusan Kimia Universitas Udayana yang telah mengesahkan usulan proposal penelitian ini sehingga dapat dilanjutkan dan telah memberikan fasilitas penggunaan Laboratorium Penelitian Jurusan Kimia dan Laboratorium bersama FMIPA Universitas Udayana untuk penggunaan Instrumen.
4. Kepala Laboratorium Bersama FMIPA Universitas Udayana untuk fasilitas penggunaaan Instrumen FTIR.
5. Kepala Lanoratorium Balai Penelitian Ternak Bogor untuk Analisis Komposisi Asam Amino
6. Kepala Laboratorium Center for Development of Advances Sciences and Technology, Jember Untuk Elektroforesis SDS_PAGE
7. Kepala Laboratorium EHP Fakultas Teknologi Pertanian Universitas Jember 8. Kepala Laboratorium Kimia Organik Jurusan Kimia FMIPA Universitas
Udayana atas bantuannya untuk fasilitas dalan proses pre-treatment dan pengeringan sampel.
9. Balai Besar Penelitian dan Pengembangan Budi Daya Laut Bali,Gondol Singaraja atas bantuannya dalam proses pengeringan sampel kulit ayam dengan Freeze Drier.
v
10. Tutut Hardikawati dan Anak Agung Rahma Prabawanti , mahasiswa kimia yang telah membantu dalam pelaksanaan penelitian ini.
Semoga laporan penelitian ini dapat menjadikan acuan untuk penelitian selanjutnya.
Denpasar, 27 Oktober 2015
vi DAFTAR ISI Hal HALAMAN SAMPUL i HALAMAN PENGESAHAN ii RINGKASAN iii PRAKATA iv DAFTAR ISI vi
DAFTAR TABEL vii
DAFTAR GAMBAR ix BAB I PENDAHULUAN 1.1 Latar Belakang 1.2 Rumusan Masalah 1.3 Tujuan Khusus 1.4 Urgensi Penelitian 1 1 3 4 4 BAB II TINJAUAN PUSTAKA
2.1 Ayam Broiler 2.2 Kolagen 2.3 Gelatin
2.4 SDS-PAGE (Elektroforesis Gel Poliakrilamida-Sodium Dodesil Sulfat) 5 5 5 11 BAB III METODE PENELITIAN
3.1 Alat dan Bahan 3.2 Tempat Penelitian
13 14
vii
3.3 Prosedur Kerja 14
BAB IV HASIL DAN PEMBAHASAN 4.1 Penyiapan bahan baku
4.2 Proses Perendaman 4.3 Proses Ekstraksi
4.4 Karakterisasi Produk Gelatin 4.4.1.Rendemen gelatin
4.4.2.Derajat keasaman (pH) gelatin 4.4.3.Viskositas gelatin
4.4.4. Analisis kadar proksimat 4.4.5. Kekuatan gel
4.4.6. Analisis komposisi asam amino
4.4.7. Analisis berat molekul dengan elektroforesis menggunakan SDS_PAGE
4.4.8. Identifikasi gugus fungsi produk gelatin dengan FTIR
18 19 20 21 21 24 25 26 29 31 34 37
BAB V. SIMPULAN DAN SARAN
5.1. Simpulan 40
5.2. Saran 41
DAFTAR PUSTAKA 41
viii
DAFTAR GAMBAR
Gambar 2.1. Struktur Tripel Helix Penyusun Gelatin 6
Gambar 2.2. Struktur Kimia Gelatin 8
Gambar 2.3. Contoh elektroforegram gelatin dari Bigeye snapper 13
Gambar 4.1. Foto Kulit ayam kering 19
Gambar 4.2.Foto Serbuk kulit ayam bebas lemak 19
Gambar 4.3.Foto Kulit ayam setelah perendaman NaOH 20
Gambar 4.4.Foto Kulit ayam setelah perendaman 20
Gambar 4.5.Foto Proses ekstraksi Waterbath 21
Gambar 4.6.Foto Gel sebelum dioven 21
Gambar 4.7. Elektroforegram produk gelatin hasil perlakuan 35 Gambar 4.8. Spektra Inframerah gelatin yang diekstraksi dengan asam sitrat 37
Gambar 4.9. Spektra Inframerah gelatin yang diekstraksi dengan asam laktat 38
Gambar 4.10. Spektra Inframerah gelatin yang diekstraksi dengan asam asetat 38
ix
DAFTAR TABEL
Tabel 2.1. Komposisi Asam Amino Gelatin 7
Tabel 2.2. Sifat Gelatin Berdasarkan Jenisnya 9
Tabel 2.3. Standar Mutu Gelatin Menurut SNI No. 06-3735 Tahun 1995 dan British Standard: 757 Tahun 1975
9 Tabel 4.1. Hasil Analisis Proksimat Serbuk Kulit Ayam Broiler 18 Tabel 4.2. Pengaruh Perlakuan Terhadap Nilai Rendemen Gelatin Kulit Ayam 22 Tabel 4.3. Pengaruh Perlakuan Terhadap Nilai pH Gelatin Kulit Ayam 24 Tabel 4.4. Pengaruh Perlakuan Terhadap Nilai Viskositas Gelatin Kulit Ayam 25 Tabel 4.5. Kandungan Proksimat Produk Gelatin Hasil Perlakuan 27 Tabel 4.6. Pengaruh Perlakuan Terhadap Nilai Kekuatan Gel Gelatin Kulit Ayam 29 Tabel 4.7. Komposisi Asam Amino Produk Gelatin Kulit Ayam Hasil perlakuan
Tabel 4.8. Interpretasi gugus fungsi
31 39
1 BAB 1. PENDAHULUAN
Gelatin adalah suatu biopolimer yang diperoleh dari hidrolisis parsial kolagen, suatu protein fibrius penyusun utama jaringan pada kulit, tulang, dan jaringan ikat hewan. Sifat dari gelatin secara intrinsik dipengaruhi oleh sumber (spesies), umur hewan, dan jenis kolagen (Johnson, 2009).
1.1. Gelatin dimanfaatkan secara luas dalam industri makanan, kosmetik, farmasi, tekstil, kertas dan fotografi karena sifatnya yang dapat membentuk gel, busa emulsifier, dan dapat mempertahankan elastisitas suatu bahan. Manfaat gelatin yang sangat luas menyebabkan kebutuhan dunia akan gelatin terus meningkat. Di Indonesia kebutuhan akan gelatin sampai saat ini lebih banyak dipenuhi dengan cara mengimpor dari negara-negara penghasil gelatin, sehingga harganya menjadi mahal. Selain itu, tingginya harga gelatin juga disebabkan oleh permintaan konsumen yang tinggi karena pemanfaatan gelatin yang sangat luas, seperti sebagai bahan kosmetik dan produk farmasi serta bahan baku makanan (susu dan produknya, es krim, permen karet, pengental, dan mayonnaise), juga sebagai bahan pembuat film, material medis (hard capsule), dan bahan baku kultur jaringan, sebagai pelapis kertas, tinta inkjet, korek api, gabus, pelapis kayu untuk interior, karet plastik, dan lain-lain (Apriyantono, 2003). Sampai sekarang ini gelatin yang beredar di pasaran, 46 % berasal dari kulit babi, 29,4 % dari kulit sapi, 23,1 % dari tulang sapi, dan hanya 1,5 % dari sumber lainnya (GME, 2008). Akhir-akhir ini, adanya pertimbangan dan ketakutan akan BSE dan pengaruh penyakit sapi gila serta adanya prasyarat kehalalan akan produk gelatin bagi umat muslim, maka bahan baku alternatif dari berbagai jenis ikan sebagai sumber gelatin selain dari babi dan sapi terus dikembangkan (Jamilah dan Harvinder, 2002). Beberapa penelitian telah dilakukan, seperti eksplorasi gelatin yang bersumber dari kulit dan tulang berbagai spesies ikan (Irwandi 2009, Phanat 2010). Namun sampai saat ini, hanya 1 % dari produksi gelatin dunia berasal dari ikan. Produk gelatin ikan tidak berhasil menarik perhatian masyarakat karena faktor alergi dan fishy odour (Rammaya,2012). Sehingga pengembangan gelatin dari sumber selain ikan perlu dikaji potensinya.
Daging ayam merupakan daging yang paling populer dan murah untuk dikonsumsi dan tidak ada larangan khusus dari segi agama sehingga peternakan ayam dan produksi
2
daging ayam meningkat setiap tahunnya. Kulit ayam sebagai hasil samping industri rumah potong ayam (RPA) belum banyak dimanfaatkan untuk diproses menjadi produk baru yang bernilai tinggi (Cliche, 2003). Kandungan kolagen yang tinggi pada kulit ayam 38,9% (Cliche, 2003) sangat potensial untuk dikembangkan menjadi bahan baku alternatif gelatin. Beberapa penelitian tentang ekstraksi gelatin dari ayam telah dilakukan. Abustam (2008), telah berhasil mengekstraksi gelatin dari kulit kaki ayam melalui perendaman dengan menggunakan asam asetat 1% selama 24 jam diperoleh hasil optimum rendemen 12,9 % dan kekuatan gel 261,44 g bloom.
Miskah (2010) dalam penelitiannya melaporkan ekstraksi gelatin dari tulang dan kulit kaki ayam melalui variasi konsentrasi asam asetat (CH3COOH) 4%, 5%, 6%, 7%, 8% dan
HCl 4%, 5%, 6%, 7%, 8% serta waktu perendaman 1 hari, 2 hari, 3 hari, 4 hari dan 5 hari, menghasilkan konsentrasi terbaik pada pembuatan gelatin untuk HCl adalah 4 % yang menghasilkan rendemen sebesar 11,2 %, sedangkan untuk CH3COOH adalah 7 %
menghasilkan rendemen sebesar 7,956 % dengan waktu perendaman terbaik adalah 1 hari.
Isolasi dan karakterisasi gelatin dari kulit ceker ayam Broiler dengan metode ekstraksi terkombinasi dengan perendaman basa NaOH dan asam asetat yang dikombinasikan dengan ekstraksi pelarut menggunakan etanol untuk meghilangkan lemak telah dilakukan oleh Puspawati dkk, 2011, namun gelatin yang dihasilkan kandungan lemaknya masih diatas 5% (Puspawati, 2011). Rammaya (2012) dalam penelitiannya melaporkan ekstraksi gelatin dari residu mechanically deboned chicken meat (MDCM) yang dilakukan dengan perendaman basa NaOH selama 72 jam dan dengan variasi suhu ekstraksi pada 60oC,70oC, dan 80oC selama 2 jam yang dilakukan pada pH 4 menghasilkan gelatin dengan kekutan gel rendah (<100 gr bloom), dimana semakin tinggi suhu maka kekuatan gel gelatin yang diperoleh semakin rendah. Peneliti lainnya, Norizah et.al, 2012, melaporkan untuk pertama kali ekstraksi gelatin dari kulit ayam kering yang telah diekstrak lemaknya dengan ekstraksi soxhlet, dengan proses perendaman menggunakan kombinasi basa NaOH dan asam (asam sulfat dan asam sitrat) masing-masing selama 2 jam, dan dilanjutkan dengan ekstraksi waterbath pada suhu 45oC selama 24 jam menghasilkan gelatin berkualitas tinggi dengan kekuatan gel 355 g bloom yang melampaui kekuatan gel
3
gelatin sapi. Namun Puspawati (2014), melaporkan optimasi proses ekstraksi gelatin dari kulit ayam broiler yang dilakukan melalui variasi suhu dan lama ekstraksi dengan proses perendaman campuran basa NaOH 0,15 % dan asam (H2SO40,15% dan asam sitrat0,7%)
menghasilkan gelatin dengan kekuatan gel tertinggi yaitu 145,95 g bloom yang diperoleh pada suhu ekstraksi 40oC selama 12 jam.
Salah satu kelemahan dari gelatin yang berasal dari non mamalia adalah sifat mekaniknya yang kurang bagus (rendahnya kekuatan gel gelatin) sehingga pemanfaatannya terbatas dalam bidang industri non pangan khususnya dalam industri kedokteran. Salah satu faktor yang berpengaruh terhadap sifat mekanik gelatin adalah komposisi asam amino dan berat molekulnya (Gudmundson, 2002, Norland, 1990).
Dari uraian diatas, beberapa penelitian tentang ekstraksi dan karakterisasi sifat fisikokimia gelatin dari kulit ayam telah dilaporkan, namun belum banyak penelitian yang dilakukan untuk mengkaji pengaruh komposisi asam amino dan pola protein gelatin (tingkat kemurnian dan berat molekul relatif) terhadap sifat mekanik gelatin khususnya kekuatan gel. Untuk itu sangatlah penting mempelajari bagaimana pengaruh proses perendaman dengan jenis asam yang berbeda (sitrat, asetat, dan laktat) terhadap komposisi dan pola protein produk gelatin yang dihasilkan dan sifat mekaniknya khususnya kekuatan gel.
1.2. Rumusan Masalah
Dari uraian diatas maka permasalahan yang diangkat adalah:
1. Bagaimana komposisi asam amino dan pola protein dari gelatin halal hasil ekstraksi kulit ayam Broiler melalui proses perendaman dengan variasi jenis asam yang digunakan?
2. Bagaimana pengaruh komposisi asam amino dan pola protein gelatin terhadap sifat mekanik gelatin khususnya kekuatan gel?
4 1.3. Tujuan Khusus
1. Menganalisis komposisi asam amino dan pola protein dari gelatin halal hasil ekstraksi kulit ayam Broiler melalui proses perendaman dengan jenis asam yang berbeda?
2. Mengetahui pengaruh komposisi asam amino dan berat molekul gelatin terhadap sifat mekanik gelatin khususnya kekuatan gel.
1.4. Urgensi Penelitian
Pemanfaatan gelatin yang sangat luas di bidang industri makanan, kosmetik, farmasi, obat-obatan, tekstil, kertas, dan fotografi menyebabkan kebutuhan akan gelatin cenderung meningkat tiap tahunnya. Sampai saat ini, Indonesia masih mengimpor gelatin untuk memenuhi kebutuhan gelatin dalam negeri. Gelatin yang beredar di pasaran, 46 % berasal dari kulit babi, 29,4 % dari kulit sapi, 23,1 % dari tulang sapi, dan hanya 1,5 % dari sumber lainnya (GME, 2008). Akhir-akhir ini, adanya pertimbangan dan ketakutan akan BSE dan pengaruh penyakit sapi gila, serta adanya prasarat kehalalan akan produk gelatin bagi umat muslim, maka bahan baku alternatif sebagai sumber gelatin selain dari babi dan sapi sangat penting untuk dikembangkan.dan diteliti. Penelitian dan pengembangan gelatin dari tulang dan kulit ikan sudah banyak dilakukan namun produk gelatin ikan kurang diminati karena baunya dan faktor alergi bagi beberapa orang. Kulit ayam sebagai hasil samping produksi RPA belum banyak dimanfaatkan untuk diproses menjadi produk baru yang bernilai tinggi (Cliche, 2003). Kandungan kolagen yang tinggi pada kulit ayam 38,9% (Cliche, 2003) sangat potensial untuk dikembangkan menjadi bahan baku penyedia gelatin halal. Beberapa penelitian tentang ekstraksi dan karakterisasi sifat fisikokimia gelatin dari kulit ayam telah dilaporkan, namun belum banyak penelitian yang dilakukan untuk mengkaji pengaruh komposisi asam amino dan pola protein gelatin (tingkat kemurnian dan berat molekul relatif) terhadap sifat mekanik gelatin khususnya kekuatan gel. Untuk itu sangatlah penting mempelajari bagaimana pengaruh proses perendaman dengan jenis asam yang berbeda (sitrat, asetat, dan laktat) terhadap komposisi dan pola protein produk gelatin yang dihasilkan dan sifat mekaniknya khususnya kekuatan gel.
5 BAB II. TINJAUAN PUSTAKA
2.1 Ayam Broiler
Ayam pedaging (Broiler) merupakan ayam ras yang memiliki daya produktivitas tinggi sehingga dapat menghasilkan produksi daging dalam waktu relatif singkat (5-6 minggu).Ayam broiler sering dibudidayakan karena memiliki masa panen yang pendek dan relatif mudah dalam pemeliharaan, sehingga dalam waktu yang singkat sudah dapat dipasarkan (Abbas dan Rusmana, 1995).
Kulit ayam merupakan bagian yang berfungsi melindungi permukaan tubuh.Kulit terdiri dari dua lapis, lapisan luar disebut epidermis dan bagian dalam disebut dermis.Dermis tersusun dari jaringan pengikat yang mengandung banyak lemak dan serat kolagen (Nurwantoro dan Mulyani, 2003).Kolagen merupakan sejenis protein yang mengandung asam amino prolin dan hidroksiprolin. Kandungan kolagen pada kulit ayam diperkirakan sebesar 38,9% (Cliche, 2003) sehingga kulit ayam berpotensi untuk dikembangkan menjadi bahan baku pembuatan gelatin.
2.2 Kolagen
Kolagen merupakan komponen struktural utama dari jaringan ikat putih (whiteconnetive tissue) yang meliputi hampir 30 persen dari total protein pada jaringan dan organ tubuh vertebrata dan invertebrata. Pada mamalia, kolagen terdapat di kulit, tendon, tulangrawan, dan jaringan ikat. Demikian juga pada burung dan ikan, sedangkan pada avertebrata kolagen terdapat pada dinding sel (Bailey dan Light,1989). Molekul kolagen tersusun dari kira-kira dua puluh asam amino yang memiliki bentuk agak berbeda bergantung pada sumber bahan bakunya. Asam amino glisin, prolin, dan hidroksiprolin merupakan asam amino utama kolagen. Asam-asam amino aromatik dan sulfur terdapat dalam jumlah yang sedikit. Hidroksiprolin merupakan salah satu asam amino pembatas dalam berbagai protein (Chaplin, 2005). Molekul dasar pembentuk kolagen disebut tropokolagen yang mempunyai struktur batang dengan BM 300 kDa, dimana di dalamnya terdapat tiga rantai polipeptida yang sama panjang bersama-sama membentuk struktur heliks. Tiap tiga rantai polipeptida dalam unit tropokolagen membentuk struktur heliks
6
tersendiri, menahan bersama-sama dengan ikatan hidrogen antara group NH dari residu glisin pada rantai yang satu dengan grup CO pada rantai lainnya. Cincin pirolidin, prolin, dan hidroksiprolin membantu pembentukan rantai polipeptida dan memperkuat triple heliks (Wong, 1989).
Gambar 2.1. Struktur Triple Helix Penyusun Gelatin
Tropokolagen akan terdenaturasi oleh pemanasan atau perlakuan dengan zat seperti asam, basa, urea, dan potassium permanganat, selain itu serabut kolagen dapat mengalami penyusutan jika dipanaskan di atas suhu penyusutannya (Ts). Suhu penyusutan (Ts) kolagenikan adalah 45oC. Jika kolagen dipanaskan pada T>Ts (misalnya 65 ± 70oC), serabut triple heliks yang dipecah menjadi lebih panjang. Pemecahan struktur tersebut menjadi lilitan acak yang larut dalam air inilah yang disebut gelatin. Menurut Fernandez-Diaz, et. al (2001), kolagen kulit ikan lebih mudah hancur daripada kolagen kulit hewan, dimana kedua jenis kolagen ini akan hancur oleh proses pemanasan dan aktivitas enzim.
2.3. Gelatin
Gelatin merupakan salah satu produk turunan protein yang diperoleh dari hasil hidrolisis kolagen hewan yang terkandung dalam tulang dan kulit, dan merupakan senyawa yang tidak pernah terjadi secara alamiah. Gelatin mempunyai titik leleh 35oC, di bawah suhu tubuh manusia. Titik leleh inilah yang membuat produk gelatin mempunyai karakteristik yang unik bila dibandingkan dengan bahan pembentuk gel lainnya seperti pati, alginat, pektin, agar-agar dan karaginan yang merupakan senyawa karbohidrat (Gomez dan Montero, 2001). Sifat gelatin antara lain hampir tidak berasa, tidak berbau, tidak berwarna sampai kekuningan, larut dalam air, asam asetat, dan pelarut alkohol seperti gliserol,
7
propilen glikol, sorbitol dan manitol tetapi tidak larut dalam aseton, karbon tetraklorida, benzene, petroleum eter, dan pelarut organik lainnya. Pada kondisi tertentu juga larut dalam campuran aseton-air dan alkohol-air (Viro, 1992). Gelatin dapat berubah secara reversible dari bentuk sol ke gel, mengembang dalam air dingin, dapat membentuk film, mempengaruhi viskositas suatu bahan. Sifat-sifat yang dimiliki gelatin tersebut menyebabkan gelatin lebih disukai dibandingkan bahan-bahan pembentuk gel lain seperti karagenan, pektin, dan gum arab (Peranginangin, 2007).
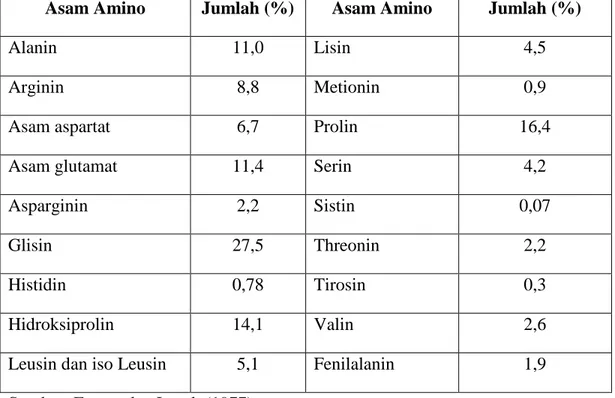
Senyawa gelatin merupakan suatu polimer linier asam-asam amino. Pada umumnya rantai polimer tersebut merupakan perulangan dari asam amino glisin-prolin-prolin atau glisin-prolin-hidroksiprolin. Dalam gelatin tidak terdapat asam amino triptofan, sehingga gelatin tidak dapat digolongkan sebagai protein yang lengkap (Gelatin Food Science, 2007). Gelatin tersusun atas 18 asam amino yang saling terikat dan dihubungkan dengan ikatan peptida membentuk rantai polimer yang panjang (Eastoe dan Leach, 1977). Secara lengkap komposisi asam amino gelatin disajikan pada Tabel 2.1.
Tabel 2.1. Komposisi Asam Amino Gelatin
Asam Amino Jumlah (%) Asam Amino Jumlah (%)
Alanin 11,0 Lisin 4,5
Arginin 8,8 Metionin 0,9
Asam aspartat 6,7 Prolin 16,4
Asam glutamat 11,4 Serin 4,2
Asparginin 2,2 Sistin 0,07
Glisin 27,5 Threonin 2,2
Histidin 0,78 Tirosin 0,3
Hidroksiprolin 14,1 Valin 2,6
Leusin dan iso Leusin 5,1 Fenilalanin 1,9
8
Komposisi asam amino mempengaruhi sifat mekanik dari produk gelatin. Bila kandungan asam iminonya (prolin dan hidroksi prolin) rendah maka kekuatan gel dan titik lelehnyapun akan rendah sehingga sifat mekaniknyapun kurang bagus. Penurunan komposisi asam amino tergantung pada metode pembuatannya. Pembuatan dengan proses alkali umumnya lebih banyak mengandung hidroksiprolin dan lebih sedikit tirosin dibandingkan dengan proses asam (Ward dan Courts, 1977). Struktur kimia gelatin dapat dilihat pada Gambar 2.2.
Gambar 2.2. Struktur Kimia Gelatin (Poppe, 1992)
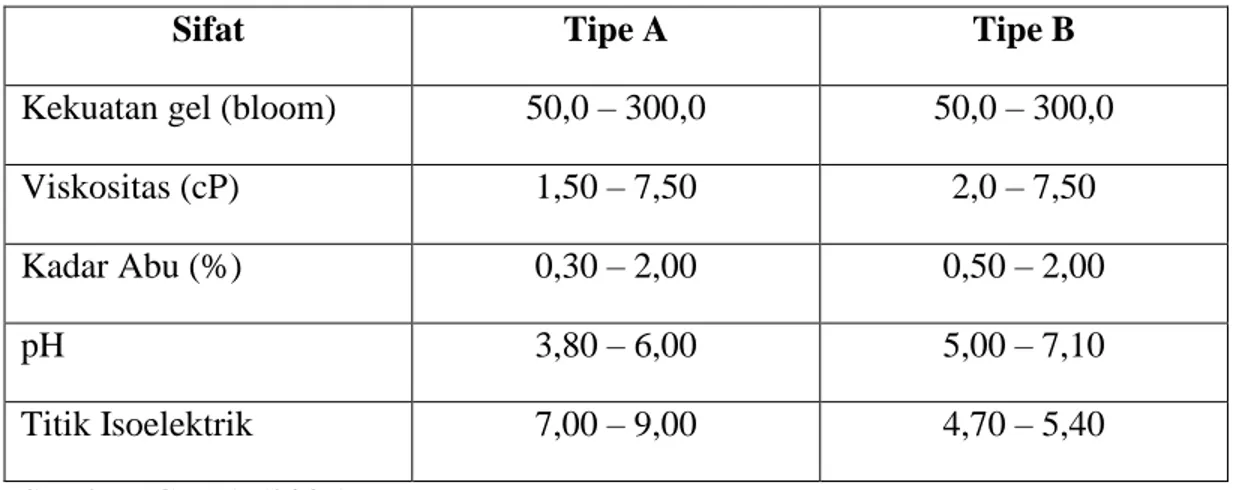
Gelatin terbagi menjadi dua tipe berdasarkan perbedaan proses pengolahannya, yaitu tipe A dan tipe B. Dalam pembuatan gelatin tipe A, bahan baku diberi perlakuan perendaman dalam larutan asam sehingga proses ini dikenal dengan sebutan proses asam. Sedangkan dalam pembuatan gelatin tipe B, perlakuan yang diaplikasikan adalah perlakuan basa. Proses ini disebut proses alkali (Utama, 1997).Bahan baku yang biasanya digunakan pada proses asam adalah tulang dan kulit babi, sedangkan bahan baku yang biasa digunakan pada proses basa adalah tulang dan kulit jangat sapi (Viro, 1992). Menurut Wiyono (2001), gelatin ikan dikatagorikan sebagai gelatin tipe A. Secara ekonomis, proses asam lebih disukai dibandingkan proses basa. Hal ini karena perendaman yang dilakukan dalam proses asam relatif lebih singkat dibandingkan proses basa (Wiyono, 2001). Sifat gelatin berdasarkan tipenya dapat dilihat pada Tabel 2.1.
9
Tabel 2.2. Sifat Gelatin Berdasarkan Jenisnya
Sifat Tipe A Tipe B
Kekuatan gel (bloom) 50,0 – 300,0 50,0 – 300,0
Viskositas (cP) 1,50 – 7,50 2,0 – 7,50
Kadar Abu (%) 0,30 – 2,00 0,50 – 2,00
pH 3,80 – 6,00 5,00 – 7,10
Titik Isoelektrik 7,00 – 9,00 4,70 – 5,40
Sumber: GMIA (2007)
Salah satu sifat fisik gelatin yang menentukan mutu gelatin adalah kemampuannya untuk membentuk gel yang disebut kekuatan gel. Sifat fisik penting lainnya adalah viskositas (Poppe (1992). Viskositas terutama dipengaruhi oleh interaksi hidrodinamik antar molekul gelatin, dipengaruhi suhu, pH dan konsentrasi. Standar mutu gelatin untuk industri dapat dilihat pada Tabel 2.3.
Tabel 2.3. Standar Mutu Gelatin Menurut SNI No. 06-3735 Tahun 1995 dan British Standard: 757 Tahun 1975
Karakteristik SNI No. 063735a British Standar 757b
Warna Tidak berwarna sampai
kekuningan
Kuning pucat
Bau. rasa Normal -
Kadar air Maksimum 16% -
Kadar abu Maksimum 3,25% -
Kekuatan gel - 50 – 300 bloom
Viskositas - 15 – 70 mps atau 1,5 – 7
cP
10
Logam berat Maksimum 50 mg/kg -
Arsen Maksimum 2 mg/kg -
Tembaga Maksimum 30 mg/kg -
Seng Maksimum 100 mg/kg -
Sulfit Maksimum 1000 mg/kg -
Sumber: a) Dewan Standarisasi Nasional (SNI 06.3735-1995) (1995)
b) British Standard: 757 (1975)
Proses produksi utama gelatin dapat dibagi menjadi tiga tahapan, yaitu persiapan bahan baku, konversi kolagen menjadi gelatin, dan yang terakhir perolehan gelatin dalam bentuk kering. Metode pengkonversian kolagen menjadi gelatin adalah dengan denaturasi kolagen. Proses denaturasi terjadi dengan pemanasan kolagen pada suhu 40oC atau lebih dengan penambahan senyawa pemecah ikatan hidrogen pada suhu kamar atau lebih rendah, berupa pemecahan struktur koil kolagen menjadi satu, dua atau tiga rantai polipeptida secara acak (Gomez dan Montero, 2001).
Konversi kolagen menjadi gelatin terjadi dalam tiga tahap, yaitu hidrolisis lateral, hidrolisis ikatan polipeptida terutama glisin, dan penghancuran struktur kolagen (Ward dan Courts, 1977). Menurut Hadiwiyoto (1983) produksi gelatin meliputi tahap-tahap pengecilan ukuran bahan baku, perendaman, pencucian, pemanasan, pemekatan, pendinginan, dan pengeringan. Pengecilan ukuran disini menurutnya diperlukan untuk lebih memperluas permukaan bahan sehingga proses dapat berlangsung lebih cepat dan sempurna.
Ekstraksi adalah proses denaturasi untuk mengubah kolagen menjadi gelatin dengan penambahan senyawa pemecah ikatan hidrogen pada suhu kamar atau suhu ang lebih rendah. Ekstraksi juga dapat dilakukan dengan menggunakan air panas, dimana pada proses ini terjadi denaturasi, peningkatan hidrolisis dan kelarutan gelatin. Setelah diperoleh ekstrak gelatin, dilakukan pengeringan untuk mengurangi kadar air sebanyak 85-90%. Hal ini dapat
11
dilakukan dengan menggunakan evaporator vakum dengan suhu 43-45oC dan dilanjutkan dengan menggunakan freeze dryer atau oven pada suhu antara 30-60oC (Viro, 1992).
2.3. SDS-PAGE (Elektroforesis Gel Poliakrilamida-Sodium Dodesil Sulfat)
Elektroforesis merupakan proses bergeraknya molekul bermuatan pada suatu medan listrik. Kecepatan molekul yang bergerak pada medan listrik tergantung pada muatan, bentuk dan ukuran. Dengan demikian elektroforesis dapat digunakan untuk separasi makromolekul (seperti protein dan asam nukleat). Posisi molekul yang terseparasi pada gel dapat dideteksi dengan pewarnaan atau autoradiografi, ataupun dilakukan kuantifikasi dengan densitometer.
Elektroforesis untuk makromolekul memerlukan matriks penyangga untuk mencegah terjadinya difusi karena timbulnya panas dari arus listrik yang digunakan. Elektroforesis biasanya memerlukan media penyangga sebagai tempat bemigrasinya molekul-mulekul biologi. Media penyangganya bermacam-macam tergantung pada tujuan dan bahan yang akan dianalisa. Media penyangga yang seringdipakai dalam elektroforesis antara lain yaitu kertas, selulose, asetat dan gel. Gel poliakrilamid dan agarosa merupakan matriks penyangga yang banyak dipakai untuk separasi protein dan asam nukleat. Beberapa faktor mempengaruhi kecepatan migrasi dari molekul protein (Soedarmadji, 1996), yakni:
1. Ukuran molekul protein
Migrasi molekul protein berukuran besar lebih lambat daripada migrasi molekul berukuran kecil.
2. Konsentrasi gel
Migrasi molekul protein pada gel berkosentrasi rendah lebih cepat daripada migrasi molekul protein yang sama pada gel berkosentrasi tinggi.
3. Bufer (penyangga)
Dapat berperan sebagai penstabil medium pendukung dan dapat mempengaruhi kecepatan gerak senyawa karena ion sebagai pembawa protein yang bermuatan. Kekuatan ion yang tinggi dalam bufer akan meningkatkan panas sehingga aliran
12
listrik menjadi maksimal. Hal ini dapat mempercepat gerakan molekul protein. Kekuatan ion rendah dalam bufer akan menurunkan panas sehingga aliran listrik akan sangat minimal dan migrasi molekul protein sangat lambat.
4. Medium penyangga
Medium pendukung ideal untuk elektroforesis adalah bahan kimia inert yang bersifat relatif stabil, mudah ditangani dan mempunyai daya serap yang baik, sebagai migrasi elektron atau penyaringan berdasarkan ukuran molekul seperti gel poliakrilamid (Sudarmadji, 1996). Jika ukuran pori dari medium kira-kira sama dengan molekul, maka molekul yang lebih kecil akan berpindah lebih bebas di dalam medan listrik, sedangkan molekul yang lebih besar akan dibatasi dalam migrasinya. Besarnya pori-pori dapat diatur dengan mengubah konsentrasi penyusun gel poliakrilamidnya yaitu akrilamid dan bisakrilamid.
5. Kekuatan voltase
- Voltase yang dipakai rendah (100-500) V, kecepatan migrasi molekul sebanding dengan tingginya voltase yang digunakan.
- Voltase yang dipakai tinggi (500-10000) V, mobolitas molekul meningkat secara lebih tajam dan digunakan untuk memisahkan senyawa dengan BM rendah serta jenis arus yang dipakai selalu harus searah (bukan bolak balik).
6.Temperatur medium disaat proses elektroforesis berlangsung.
Jika temperatur tinggi akan mempercepat proses bermigrasinya protein dan sebaliknya jika temperatur rendah akan mengurangi kekuatan bermigrasinya protein. Pada saat elektroforesis berlangsung, protein akan bergerak dari elektroda negatif menuju elektroda positif sampai pada jarak tertentu pada gel poliakrilamid tergantung pada berat molekulnya. Semakin rendah berat molekulnya maka semakin jauh pula protein bergerak atau mobilitasnya tinggi.
13
Sebaliknya protein dengan berat molekul lebih besar akan bergerak pada jarak yang lebih pendek atau mobilitasnya rendah (Sumitro et al., 1996).
Hasil elektroforesis akan didapatkan pita-pita protein yang terpisahkan berdasarkan berat molekulnya. Tebal tipisnya pita yang terbentuk dari pita protein menunjukkan kandungan atau banyaknya protein yang mempunyai berat molekul yang sama yang berada pada posisi pita yang sama. Hal ini sejalan dengan prinsip pergerakan molekul bermuatan, yakni molekul bermuatan dapat bergerak bebas di bawah pengaruh medan listrik, molekul dengan muatan dan ukuran yang sama akan terakumulasi pada zona atau pita yang sama atau berdekatan (Soedarmadji, 1996).
Gambar 2.3. Contohelektroforegram gelatin dari Bigeye snapper (Priacanthus tayenus) (Sukkwai, 2011)
BAB III. METODE PENELITIAN
3.1 Alat dan Bahan
Bahan dasar penelitian ini adalah kulit ayam Broileryang dibeli dari RPA UD Eka Prasetya Nusa Dua, Badung. Bahan-bahan kimia yang digunakan dalam penelitian ini adalah aquades, aquademineral, asam sulfat (0,15%b/v), asam sitrat (C6H8O7) 1 % (b/v),
asam laktat(C3H6O3) 1% v/v, asam asetat (CH3COOH) 1% (v/v), NaOH (0,15%), pH
indicator,n-heksana, dan gelatin komersial, kertas saring WhatmanNo.4, kertas saring lembaran.
14
Alat kimia yang digunakan adalah berupa alat-alat gelas yang biasa digunakan di Laboratorium kimia dan ditunjang dengan alat lainnya yaitu seperangkat alat soxhlet, hot plate dan magnetic stirrer, ember, tray, loyang, botol sample, toples plastik, cawan petri, blender, pisau, waterbath, pH meter, thermometer, oven, teflon, spatula, saringan, corong, beker gelas, erlenmeyer, timbangan, desikator, cawan petri, oven, TA-XT CT3 Analyser, viskositas ostwald, FTIR Szimadsu Prestige 21, Elektroforesis.
3.2 Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Penelitian dan Laboratorium Kimia Organik Jurusan Kimia, FMIPA, UNUD, Lab. Bersama FMIPA UNUD, Lab. EHP Teknologi Pertanian, Jember, Lab. Center for Development of Advances Sciences and Technology CDAST), Jember, dan Lab. Balai Penelitian Ternak Bogor..
3.3 Prosedur Kerja
Proses iolasi gelatin dari kulit ayam Broiler pada penelitian ini mengikuti prosedur Badii dan Howel (2006), dengan sedikit modifikasi yang terdiri dari tahap persiapan, perendaman, ekstraksi dan pengeringan, karakterisasi (Figure 3.1).
Penyiapan bahan baku:
15 kg kulit ayam yang segar dibeli dari RPA dicuci bersih dengan air untuk menghilangkan kotoran-kotoran yang menempel. Lemak yang menempel dipisahkan dari kulit ayam sebelum dicuci dengan air bersih. Kulit ayam dipotong kecil-kecil ±2-3 cm. Kulit ayam yang telah dipotong-potong dikeringkan dengan freez drier kemudian kulit ayam yang telah kering diblender sehingga diperoleh serbuk kulit ayam. Serbuk kulit ayam selanjutnya diekstrak lemaknya dengan metode soxhletasi menggunakan pelarut n-heksana.
Tahap Perendaman (Pre-Treatment)
Serbuk kulit ayam yang telah bebas lemak kemudian dibagi menjadi 3 bagian yang nantinya akan dibagi lagi menjadi 3 bagian untuk dilakukan pengulangan. Masing-masing sebesar ± 15 g serbuk sampel dicampur dengan 200 mL NaOH (0,15% b/v) diaduk dengan magnetic stirrer selama 40 menit kemudian disaring. Supernatannya dipisahkan dan
15
dibuang, residunya kemudian dicuci dengan aquades dan dicampur dengan asam sulfat (0.15%v/v) diaduk perlahan selama 40 menit dan disentrifugasi. Supernatannya dibuang dan residunya kemudian direndam dengan 200 mL asam sitrat (1% b/v) diaduk sebentar, didiamkan selama 40 menit. Setiap 40 menit larutannya dibuang dan diganti dengan larutan yang baru (dilakukan 3 X). Setelah itu, disaring. Residu yang diperoleh dicuci dengan aquades sampai pH 4-5 kemudian ditambahkan aquademineral (1:1) dan diekstrak pada waterbath dengan suhu 45oC selama 24 jam. Prosedur yang sama dilakukan untuk perendaman dengan jenis asam lainnya yaitu asam asetat dan asam laktat. Masing-masing perlakuan dilakukan pengulangan 3 kali. (Skema Kerja 3.1)
Tahap Pengeringan Gelatin
Ekstrak gelatin yang diperoleh dari masing-masing perlakuan kemudian disaring menggunakan kertas saring Whatman, diukur volumenya, dimasukkan dalam botol kaca kedap udara dan diletakkan dalam lemari pendingin bersuhu 4-10oC selama 24 jam. Ekstrak yang telah berubah menjadi gel kemudian diletakkan dalam cawan petri (teflon) dan dioven selama 24 jam pada suhu 60oC (Cho et. al, 2004), dan didinginkan dalam desikator. Lapisan gelatin yang terbentuk diseluruh permukaan dikerok lalu ditumbuk hingga menjadi gelatin bubuk dan ditimbang dan disimpan dalam desikator.
Tahap Karakterisasi
Serbuk gelatin yang diperoleh dikarakterisasi gugus fungsinya dengan FTIR di Lab Bersama FMIPA UNUD. Sedangkan penentuan kekuatan gel akan dilakukan Laboratorium EHP Fakultas Teknologi Pertanian Universitas Jember, analiis asam amino dilakukan di Balai Penelitian Ternak, Bogor, dan Elektroforesis dilakukan di Lab. CADST, Jember.
16
17 ANALISIS ASAM AMINO (Muchtadi, 1992)
Sebanyak 0,2 gram sampel disiapkan dalam tabung reaksi tertutup dan ditambahkan sebanyak 5 mL HCl 6 N. Sampel dimasukkan dalam oven dengan suhu 100oC selama 18-24 jam. Selanjutnya sampel disaring dengan kertas saring Whatman 40. Hasil hidrolisis dipipet sebanyak 10µl dan dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 30 µl larutan pengering, lalu dikeringkan dengan pompa vacuum. Sampel yang telah dikeringkan ditambahkan larutan derivate sebanyak 30 µl dan dibiarkan kering selama 20 menit. Sampel kemudian diencerkan dengan 200 µl larutan pengencer natrium asetat 1M. Sampel siap dianalisis dengan HPLC.
Analisis Berat Molekul Gelatin Dengan Metode SDS-PAGE
Sebanyak 50miligram sampel dilarutkan dalam 1,0 mLlarutan buffer(250mM Tris-Cl pH7,5; 5 mM EDTA; 2% SDS), kemudian dipanaskan pada suhu 85oC selama 1 jam. Setelah itu larutandicampur dengan buffersampel0,5 M tris-HCl, pH 6,8( yang mengandung 4% (b/v) SDS, 20% (v/v) gliserol, dan 10% (v/v) βME) dengan perbandingan 1: 1 (v/v). Kemudian campuran dipanaskan dengan suhu 100oC selama 3 menit. Sampel dimasukkan ke dalam gel poliakrilamida yang dibuat dengan 7,5% (v/v) running gel dan 4% (v/v) stacking gel sebanyak :
Elektroforesis dilakukan pada arus konstan 15 mA, kemudian gel diwarnai dengan buffer staining0,1% (b/v) Coomassie biru R-250 dalam 15% (v/v) metanol dan 5% (v/v) asam asetat dan destaining dengan 30% (v/v) metanol dan 10% (v/v) asam asetat.
18 BAB IV. HASIL DAN PEMBAHASAN 4.1 Penyiapan Bahan Baku
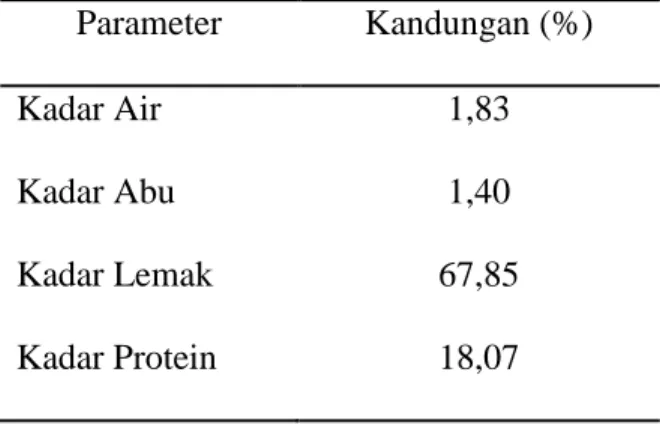
Pembuatan gelatin dari kulit ayam broiler pada penelitian ini dilakukan dengan menggunakan pelarut kombinasi asam-basa. Serbuk kulit ayam sebelum digunakan pada tahap awal ekstraksi gelatin, dianalisis kandungan kimianya yang meliputi kadar air, kadar abu, kadar lemak dan kadar protein. Hasil analisis kandungan kimia dari serbuk kulit ayam disajikan pada Tabel 4.1.
Tabel 4.1. Hasil Analisis Proksimat Serbuk Kulit Ayam Broiler Parameter Kandungan (%)
Kadar Air 1,83
Kadar Abu 1,40
Kadar Lemak 67,85
Kadar Protein 18,07
Berdasarkan data pada Tabel 4.1., kadar air yang terkandung dalam sampel kulit ayam sebesar 1,83% yang menunjukkan bahwa sampel yang digunakan tidak dalam keadaan segar karena telah melalui proses pengeringan menggunakan freeze drier (Gambar 4.1). Proses pengeringan sampel bertujuan agar sampel tidak mudah rusak bila disimpan dalam jangka waktu yang lama. Kadar abu dalam sampel kulit ayam adalah 1,40% yang menandakan kandungan mineral dalam kulit ayam cukup rendah. Pada vertebrata, sepertiga total massa proteinnya disusun oleh kolagen yang terdapat pada jaringan ikat dalam otot, kulit, tulang, tulang rawan, gigi dan tendon (de Man, 1997). Kandungan protein yang terdapat dalam kulit ayam broiler adalah 18,07%, sehingga kulit ayam dapat digunakan
19
sebagai bahan baku pembuatan gelatin. Kandungan lemak pada sampel kulit ayam sebesar 67,85%. Lemak yang terkandung pada kulit ayam sangat tinggi, sehingga perlu dilakukan ekstraksi lemak pada sampel kulit ayam sebelum proses perendaman. Pada penelitian ini, lemak yang terkandung pada sampel kulit ayam diekstraksi dengan metode soxhletasi menggunakan pelarut n-heksana sehingga diperoleh serbuk kulit ayam bebas lemak (Gambar 4.2) .
Gambar 4.1. Kulit ayam kering Gambar 4.2. Serbuk kulit ayam bebas lemak
4.2 Proses Perendaman
Pada proses perendaman digunakan beberapa pelarut yaitu NaOH (0,15% b/v), H2SO4 (0,15% v/v), dan variasi asam yaitu asam sitrat (C3H5O(COOH)3) (1% b/v), asam
laktat 1%, dan asam asetat 1%, yang bertujuan untuk mempercepat proses perendaman (3x40 menit untuk masing-masing pelarut) yang mana dengan pelarut tunggal memerlukan waktu yang relatif lebih lama.
Perendaman dengan basa NaOH bertujuan untuk melarutkan protein non-kolagen dan penghilangan warna (decolorisation). Hal ini dapat dilihat setelah perendaman dengan NaOH sampel yang semula berwarna kuning kecoklatan menjadi lebih bersih dan mengembang (Gambar 4.3). Setelah direndam NaOH kemudian dicuci sampai pH mendekati netral kemudian direndam kembali dengan H2SO4 (0,15% v/v) selama 3 x 40
menit untuk proses demineralisasi. Setelah disaring kulit ayam direndam kembali dengan (C3H5O(COOH)3) (1% b/v) selama 3x40 menit. Proses perendaman menyebabkan
20
karena adanya interaksi antara jaringan kolagen dengan pelarut yang digunakan. Prosedur yang sama juga dilakukan untuk hidrolisis dengan perendamann asam laktat 1% v/v, dan asam asetat 1% v/v. Dari rata-rata 15 g serbuk sampel yang digunakan, setelah perendaman beratnya bertambah rata-rata menjadi 109-258 g (Gambar 4.4).
Gambar 4.3.Kulit ayam setelah perendaman NaOH Gambar 4.4.Kulit ayam setelah perendaman
4.3 Proses Ekstraksi
Kulit ayam yang telah direndam kemudian dicuci dengan aquades mengalir sampai pH 4-5. Proses ekstraksi dilakukan pada suasana asam karena pada umumnya pH tersebut merupakan titik isoelektrik dari komponen protein non-kolagen (Fatimah 1996). Sehingga pada saat proses ekstraksi protein non-kolagen tidak ikut terekstrak. Proses ekstraksi dilakukan pada sistem waterbath dengan perbandingan sampel kulit ayam dan quademineral (1:1). Proses ekstraksi berfungsi sebagai lanjutan untuk merusak ikatan hidrogen antar molekul tropokolagen dan ikatan hidrogen antara rantai-α dalam tropokolagen yang pada tahap perendaman belum semuanya terurai secara sempurna. Ikatan hydrogen antara rantai α dalam tropokolagen kali ini didenaturasi oleh molekul H2O.
Tahap ekstraksi ini menyebabkan rantai triple-helix kehilangan stabilitasnya dan akhirnya terurai menjadi 3 rantai α. Denaturasi kolagen menyebabkan rantai tripel-helix secara sempurna bertransformasi menjadin rantai tunggal gelatin. Ekstraksi dilakukan pada waterbath (Gambar 4.5) pada suhu 45oC selama 24 jam.
21
Gambar 4.5 Proses ekstraksi Waterbath Gambar 4.6 Gel sebelum dioven
Hasil ekstraksi kemudian disaring menggunakan kertas saring Whatman No.4. Kertas saring ini dapat menyaring hasil ekstraksi material organik yang memiliki ukuran partikel 20-25µm. Filtrat ditampung dan ditempatkan pada toples kemudian disimppan di lemari pendingin pada suhu 4-10oC selama 24 jam. Perlakuan pada tahap ini adalah untuk membuktikan bahwa ekstrak tersebut adalah gelatin. Hasil ekstrak menunjukkan perubahan menjadi gel pada suhu 10oC. Pada saat pendinginan, rantai-rantai polipeptida gelatin dapat secara acak kembali membentuk struktur triple-helix. Gel kemudian dioven pada suhu 60oC selama 48 jam untuk proses pengeringan sehingga diperoleh lapisan tipis gelatin (padatan). Suhu dibuat tidak terlalu tinggi untuk menghindari denaturasi rantai polipeptida. Pada perlakuan ini, gelatin yang semula dalam fase gel mencair akibat pemanasan. Setelah kering dan didinginkan dalam desikator, gelatin membentuk lapisan tipis pada teflon. Lapisan ini kemudian dikerok, ditimbang dan dihitung rendemennya.
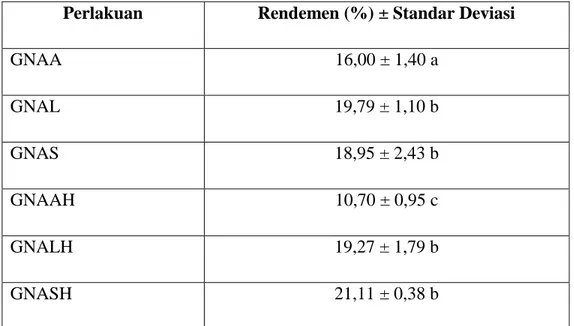
4.4 Karakterisasi Produk Gelatin 4.4.1 Rendemen gelatin
Rendemen merupakan parameter yang penting diketahui untuk menilai efektif tidaknya proses produksi gelatin. Semakin besar nilai rendemen yang dihasilkan maka semakin efesien perlakuan yang diberikan. Nilai rendemen gelatin kulit ayam dari berbagai jenis perlakuan dalam penelitian ini dapat dilihat pada Tabel 4.2.
22
Tabel 4.2. Pengaruh Perlakuan Terhadap Nilai Rendemen Gelatin Kulit Ayam
Perlakuan Rendemen (%) ± Standar Deviasi
GNAA 16,00 ± 1,40 a GNAL 19,79 ± 1,10 b GNAS 18,95 ± 2,43 b GNAAH 10,70 ± 0,95 c GNALH 19,27 ± 1,79 b GNASH 21,11 ± 0,38 b
Keterangan: Data yang diikuti huruf berbeda pada kolom menunjukkan perbedaan nyata menurut uji Duncan pada taraf ketelitian 5%
GNAA : gelatin dengan perlakuan asam asetat tanpa demineralisasi dengan asam sulfat GNAL : gelatin dengan perlakuan asam laktat tanpa demineralisasi dengan asam sulfat GNAS : gelatin dengan perlakuan asam sitrat tanpa demineralisasi dengan asam sulfat GNAAH: gelatin dengan perlakuan asam asetat dengan demineralisasi asam sulfat GNALH: gelatin dengan perlakuan asam laktat dengan demineralisasi asam sulfat GNASH: gelatin dengan perlakuan asam sitrat dengan demineralisasi asam sulfat
Nilai rendemen gelatin hasil penelitian berkisar antara 10,70% - 21,11%. Nilai rendemen tertinggi diperoleh dari perlakuan perendaman sampel kulit ayam dengan NaOH 0,15% dilanjutkan dengan perendaman asam sulfat 0,15%, kemudian perendaman dengan asam sitrat 1%, yaitu sebesar 21,11%. Sedangkan nilai rendemen terendah diperoleh dari perendaman sampel dengan NaOH 0,15% dilanjutkan dengan perendaman menggunakan asam sulfat 0,15%, kemudian perendaman dengan asam asetat 1%, yaitu 10,70%.
Hasil uji Duncan menunjukkan bahwa rendemen gelatin dipengaruhi oleh perendaman dengan asam sulfat dan tanpa asam sulfat menunjukkan hasil yang berbeda nyata (P<0,05) pada perlakuan sampel yang menggunakan larutan asam asetat sebagai
23
salah satu larutan perendam. Penggunaan variasi pelarut asam, yaitu asam asetat, asam laktat dan asam sitrat juga berpengaruh nyata (P<0,05) terhadap hasil rendemen gelatin.
Hasil gelatin dari perlakuan perendaman dengan asam sulfat menghasilkan rendemen yang relatif lebih rendah dibandingkan gelatin tanpa perendaman asam sulfat. Hal ini dapat disebabkan penggunaan asam sulfat 0,15% sebelum perendaman dengan masing-masing asam asetat, asam laktat dan asam sitrat tidak hanya berperan dalam proses demenineralisasi tetapi juga menyebabkan struktur triple helix pada tropokolagen terurai menjadi single helix (gelatin) yang larut dalam larutan perendam sehingga saat proses pencucian ekstrak gelatin ikut terbuang bersama larutan perendam asam sulfat yang menyebabkan menurunnya rendemen ekstrak gelatin.
Dilihat dari jenis asam yang digunakan, rendemen gelatin juga dapat dipengaruhi oleh kemampuan interaksi ion H+ dari masing-masing larutan asam dengan kolagen. Semakin banyak ion H+ maka hidrolisis akan semakin efektif sehingga rendemen yang dihasilkan juga semakin tinggi. Asam asetat dan asam laktat merupakan asam monoprotik, dimana hanya dapat melepaskan sebuah proton (H+) di dalam larutannya sedangkan asam sitrat merupakan asam poliprotik karena memiliki tiga atom hidrogen yang dapat terionisasi sehingga menyebabkan semakin banyaknya pemecahan ikatan hidrogen yang memudahkan konversi kolagen menjadi gelatin. Dari keenam jenis perlakuan sampel untuk memperoleh gelatin, perlakuan perendaman dengan NaOH 0,15% dilanjutkan dengan perendaman asam sulfat 0,15%, kemudian perendaman dengan asam sitrat 1% merupakan proses perendaman yang paling efektif untuk menghasilkan gelatin dengan rendemen tinggi.
24 4.4.2 Derajat keasaman (pH) gelatin
Pengukuran pH larutan gelatin merupakan salah satu parameter yang ditetapkan dalam penentuan mutu standar gelatin. Nilai pH larutan gelatin berpengaruh terhadap aplikasi gelatin dalam produk. Nilai pH gelatin berhubungan dengan proses yang digunakan pada produksi gelatin. Gelatin dengan nilai pH netral lebih disukai karena penggunaannya yang luas, sehingga proses penetralan memiliki peranan penting untuk menetralkan sisa-sisa asam maupun basa setelah dilakukan perendaman (Hinterwaldner, 1977). Hasil pengukuran gelatin dalam penelitian ini terdapat dalam Tabel 4.3.
Tabel 4.3. Pengaruh Perlakuan Terhadap Nilai pH Gelatin Kulit Ayam
Perlakuan pH ± Standar Deviasi
GNAA 5,59 ± 0,00 a GNAL 4,16 ± 0,00 b GNAS 4,83 ± 0,00 c GNAAH 5,12 ± 0,00 d GNALH 5,48 ± 0,00 e GNASH 3,79 ± 0,00 f
Keterangan: Data yang diikuti huruf berbeda pada kolom menunjukkan perbedaan nyata menurut uji Duncan pada taraf ketelitian 5%
Berdasarkan hasil pengukuran pH gelatin didapatkan bahwa kisaran nilai pH gelatin hasil ekstraksi dari kulit ayam pada penelitian ini adalah 3,79 - 5,59. Hasil uji lanjut Duncan menunjukkan bahwa perbedaan perlakuan perendaman sampel terhadap nilai pH larutan gelatin berpengaruh secara signifikan (P<0,05). Nilai pH yang mendekati kondisi
25
netral (pH 7) dimiliki oleh perlakuan serbuk kulit ayam dengan perendaman menggunakan larutan NaOH 0,15% dilanjutkan dengan perendaman dengan larutan asam asetat 1% yaitu sebesar 5,59 dan nilai pH terendah dimiliki oleh perlakuan sampel kulit ayam dengan perendaman NaOH 0,15% dilanjutkan dengan perendaman asam sulfat 0,15% dan asam sitrat 1%, yaitu sebesar 3,79.
Dari nilai pH yang dihasilkan, perlakuan sampel dengan perendaman NaOH dilanjutkan dengan perendaman asam asetat tanpa perendaman asam sulfat merupakan perlakuan terbaik untuk menghasilkan gelatin dari kulit ayam, karena paling mendekati kondisi pH netral, yaitu 5,59. Nilai pH gelatin tersebut juga memenuhi standar gelatin pangan dan farmasi yang dikeluarkan oleh Norland (2003), yaitu 5,5–7,0.
4.4.3 Viskositas gelatin
Pengukuran viskositas larutan gelatin sangat penting artinya untuk menentukan mutu dan pengunaan gelatin tersebut. Pengujian viskositas dilakukan untuk mengetahui tingkat kekentalan gelatin sebagai larutan pada konsentrasi dan suhu tertentu. Hasil pengukuran viskositas gelatin kulit ayam dengan perbedaan perlakuan terdapat pada Tabel 4.4.
Tabel 4.4. Pengaruh Perlakuan Terhadap Nilai Viskositas Gelatin Kulit Ayam Perlakuan Viskositas (cP) ± Standar Deviasi
GNAA 1,07 ± 0,09 a
GNAL 0,51 ± 0,01 b
26
GNAAH 0,82 ± 0,04 c
GNALH 0,10 ± 0,01 d
GNASH 0,30 ± 0,02 e
Keterangan: Data yang diikuti huruf berbeda pada kolom menunjukkan perbedaan nyata menurut uji Duncan pada taraf ketelitian 5%
Berdasarkan uji lanjut Duncan, nilai viskositas gelatin kulit ayam berbeda secara signifikan (P<0,05). Perbedaan nilai viskositas gelatin dipengaruhi oleh perbedaan perlakuan terhadap sampel. Kisaran nilai viskositas gelatin yang dihasilkan dari penelitian ini adalah 0,10 – 1,07 cP. Gelatin hasil ekstraksi dari perlakuan perendaman NaOH 0,15% dilanjutkan dengan asam asetat 1% tanpa perendaman asam sulfat 0,15% memiliki viskositas paling tinggi, yaitu 1,07 cP, sedangkan nilai viskositas yang paling rendah dihasilkan dari gelatin dengan perlakuan perendaman NaOH 0,15% dilanjutkan dengan perendaman asam sulfat 0,15% dan asam laktat 1%, yaitu 0,10 cP.
Nilai viskositas atau kekentalan larutan gelatin sangat erat kaitannya dengan kadar air gelatin kering. Semakin rendah kadar air gelatin kering maka kemampuannya untuk mengikat air (untuk membentuk gel) akan semakin tinggi. Semakin banyak jumlah air yang terikat oleh gelatin maka gel akan menjadi semakin kental, yang secara langsung berpengaruh pada semakin tingginya nilai viskositas yang diukur (Kurniadi, 2009).
4.4.4 Analisis kandungan proksimat
Kandungan proksimat produk gelatin hasil perlakuan dengan variasi asam dapat dilihat pada Tabel 4.5.
27
Tabel 4.5. Kandungan Proksimat Produk Gelatin Hasil Perlakuan Kode Sampel Kadar air Kadar
Abu
Kadar Protein Kadar Lemak
GNAA 12,95 1,45 91,82 1,59 GNAL 15,61 1,91 77,48 1,83 GNAS 13,23 1,63 86,09 1,57 GNAAH 11,53 1,02 80,59 1,85 GNALH 11,84 1,82 78,12 1,63 GNASH 11,50 1,12 78,53 1,33
Kadar air suatu bahan sangat berpengaruh terhadap mutu dan kualitasnya. Kandungan air dalam bahan menentukan kesegaran, penampakan, tekstur, cita rasa, dan masa simpan bahan (Winarno, 2002). Peranan air dalam bahan pangan merupakan salah satu faktor yang mempengaruhi aktivitas metabolisme seperti aktivitas enzim, aktivitas mikroba, dan aktivitas kimiawi, yaitu terjadinya ketengikan dan reaksi-reaksi non enzimatis, sehingga menimbulkan perubahan sifat-sifat organoleptik (warna, aroma, rasa) dan nilai gizinya (de Man, 1997).
Berdasarkan hasil pengukuran kadar air keenam produk gelatin kulit ayam hasil perlakuan berkisar antara 11,50%-15,60%. Kadar air produk gelatin kulit ayam pada penelitian ini masih memenuhi standar SNI (1995) No. 3735, yaitu maksimum 16% sehingga dapat digunakan untuk bahan pangan.
Nilai kadar abu suatu bahan menunjukkan kuantitas mineral yang terkandung dalam bahan tersebut (Apriyantono, 1989). Abu adalah zat anorganik sisa hasil pembakaran suatu
28
zat organik. Zat anorganik tersebut diantaranya adalah kalsium, kalium, natrium, besi, magnesium dan mangan (Desrosier, 1988).
Hasil pengukuran terhadap kadar abu keenam produk gelatin hasil perlakuan berkisar antara 1,02%-1,91%. Berdasarkan Standar Nasional Indonesia (1995), kadar abu gelatin kulit ayam yang diperoleh dalam penelitian ini memenuhi standar mutu yang disyaratkan, yaitu maksimum 3,25% dan Norland Product (2003), yaitu maksimum 2,0%, sehingga gelatin kulit ayam yang diperoleh dapat diaplikasikan kedalam produk pangan.
Gelatin merupakan salah satu jenis protein konversi yang dihasilkan melalui proses hidrolisis kolagen yang pada dasarnya memiliki kadar protein yang tinggi dan termasuk protein sederhana dalam kelompok skleroprotein (deMan, 1989). Hasil uji kadar protein untuk keenam produk gelatin kulit ayam pada penelitian ini berkisar antara 77,48%-91,82%. Berdasarkan hasil pengukuran kadar protein tertinggi diperoleh pada gelatin kulit hasil perlakuan dengan asam asetat baik dengan proses demineralisasi maupun tanpa demineralisasi dan terendah diperoleh dengan perlakuan asam laktat yang mana kadar proteinnya lebih rendah dari protein standar.
Kadar lemak merupakan salah satu parameter yang mempengaruhi perubahan mutu suatu produk. Gelatin dengan kualitas baik diharapkan tidak mengandung lemak. Rendahnya kadar lemak gelatin memungkinkan serbuk gelatin dapat disimpan dalam waktu relatif lama (de Man, 1997).
Hasil penentuan kadar lemak keenam produk gelatin kulit ayam berkisar antara 1,33-1,85%. Nilai kadar lemak pada produk gelatin kulit ayam hasil perlakuan tergolong cukup rendah karena tidak melebihi 5% yang merupakan batasan nilai maksimal yang disyaratkan untuk mutu gelatin sesuai SNI (Taufik, 2011). Rendahnya kadar lemak pada
29
gelatin kulit ayam menandakan ekstraksi lemak pada sampel kulit ayam dengan metode soxhletasi menggunakan pelarut n-heksana sebelum proses perendaman mampu mengekstrak lemak dengan baik.
4.4.5 Kekuatan gel gelatin
Salah satu sifat fisik yang penting pada gelatin adalah kemampuan untuk membentuk gel. Kemampuan inilah yang menyebabkan gelatin sangat luas penggunaannya dalam berbagai bidang industri, sehingga kekuatan gel menjadi pertimbangan dalam menentukan kelayakan penggunaan gelatin. Kekuatan gel gelatin diukur sebagai besarnya kekuatan yang diperlukan oleh probe untuk menekan gel sampai kedalaman 4 mm sampai gel pecah. Satuan untuk menunjukkan kekuatan suatu gel yang dihasilkan dari suatu konsentrasi tertentu disebut gram bloom (Lachman, 1994). Hasil pengukuran kekuatan gel gelatin hasil ekstraksi dari kulit ayam terdapat pada Tabel 4.6.
Tabel 4.6. Pengaruh Perlakuan Terhadap Nilai Kekuatan Gel Gelatin Kulit Ayam Perlakuan Kekuatan Gel (gram bloom) ± Standar Deviasi
GNAA 107,20 ± 1,22 b GNAL 71,53 ± 1,64 a GNAS 66,27 ± 0,69 c GNAAH 216,63 ± 0,11 d GNALH 32,73 ± 0,14 e GNASH 109,01 ± 1,18 f
Keterangan : Data yang diikuti huruf berbeda pada kolom menunjukkan perbedaan nyata menurut uji Duncan pada taraf ketelitian 5%
30
Kekuatan gel yang dihasilkan pada penelitian pembuatan gelatin dari kulit ayam berkisar antara 32,73 – 216,63 g bloom. Uji lanjut Duncan menunjukkan bahwa perbedaan perlakuan berpengaruh nyata (P<0,05) terhadap nilai kekuatan gel gelatin kulit ayam. Kekuatan gel tertinggi dimiliki oleh perlakuan kulit ayam dengan perendaman NaOH 0,15% dilanjutkan dengan perendaman asam sulfat 0,15%, kemudian asam asetat 1%, yaitu sebesar 216,63 g bloom, sedangkan nilai kekuatan gel terendah dimiliki oleh perlakuan kulit ayam dengan perendaman NaOH 0,15% dilanjutkan dengan asam sulfat 0,15%, kemudian asam laktat 1%, yaitu 32,73 g bloom.
Kekutan gel gelatin tergantung dari panjang rantai asam aminonya. Jika proses hidrolisis kolagen berada pada fase yang tepat, yakni pada rantai polipeptida dimana terjadi pemutusan ikatan hidrogen, ikatan kovalen silang serta sebagian ikatan peptida, maka akan dihasilkan struktur gelatin dengan rantai peptida yang panjang sehingga kekuatan gel yang dihasilkan juga tinggi (Ward dan Courts, 1977).
Gelatin dengan perlakuan terbaik dilihat dari nilai kekuatan gel yang tinggi diperoleh dari perlakuan dengan perendaman NaOH 0,15% dilanjutkan dengan perendaman menggunakan asam sulfat 0,15% dan dilanjutkan dengan asam asetat 1%, yaitu 216,63 g bloom. Nilai kekuatan gel tersebut termasuk dalam gelatin pangan grade B (Norland Product, 2003), sehingga dapat diaplikasikan dalam produk pangan seperti beer, juice, meat products dan dairy products (GMIA, 2012). Dalam spesifikasi gelatin farmasi, gelatin dengan kekuatan gel 216,63 g bloom termasuk ke dalam gelatin farmasi kelas 2 (Norland Product, 2003).
31 4.4.6 Analisis komposisi asam amino
Senyawa gelatin merupakan suatu polimer linier asam-asam amino. Pada umumnya rantai polimer tersebut merupakan perulangan dari asam amino glisin-prolin-prolin atau glisin-prolin-hidroksiprolin . Analisis asam amino ini bertujuan untuk mengetahui jenis dan komposisi asam amino gelatin kulit ayam hasil perlakuan dengan perendaman menggunakan asam yang berbeda. Hasil analisis komposisi asam amino gelatin kulit ayam dengan variasi jenis asam yang digunakan pada proses perendaman disarikan pada Tabel 4.7. Secara umum komposisi asam amino gelatin kulit ayam jauh lebih rendah dari komposisi asam amino gelatin sapi (Eastoe and Leach) namun tidak jauh berbeda dari komposisi asam amino tulang ayam (Junianto, 2006). Seperti tertera pada Tabel 4.7, secara deskriptif komposisi asam amino keenam jenis produk gelatin tidak jauh berbeda dengan kandungan asam amino glisin tertinggi dibandingkan dengan asam amino lainnya yaitu berkisar antara 15,40%-20,54%.
Tabel 4.7 Komposisi Asam Amino Produk Gelatin Kulit Ayam Hasil perlakuan
Asam Amino (g/100g)
GNAAH GNALH GNASH GNAL GNAA GNAS
ASP 3,83 3,94 3,40 3,89 3,64 3,60 SER 2,08 2,08 1,77 2,25 2,04 2,02 GLU 7,41 7,44 6,33 7,53 7,08 7,01 GLY 18,31 17,88 15,40 20,54 18,08 17,77 HIS * * * * * * ARG 7,13 6,90 5,70 7,96 6,89 6,86
32 THR 1,65 1,66 1,37 1,86 1,61 1,58 ALA 7,07 6,82 5,84 7,51 7,01 6,79 Prolin 8,85 9,18 7,46 9,87 8,93 8,78 CYS 0,02 0,02 0,02 0,03 0,02 0,02 TYR 0,51 0,54 0,48 0,61 0,51 0,51 VAL 1,67 1,63 1,39 1,84 1,66 1,64 MET 0,77 0,80 0,64 0,92 0,79 0,79 LYS 2,44 2,42 2,07 2,35 2,37 2,29 ILE 1,12 1,11 0,95 1,23 1,12 1,10 LEU 2,36 2,32 1,98 2,61 2,36 2,33 PHE 1,97 1,94 1,67 2,36 1,93 1,92
Hal ini karena gelatin merupakan hasil hidrolisis kolagen yang penyusun utamanya adalah asam amino glisin. Kandungan glisin tertinggi 20,54% diperoleh melalui perendaman asam laktat tanpa proses demineralisasi menggunakan asam sulfat dan kandungan glisin terendah 15,40 % diperoleh dari proses perendaman menggunakan asam sitrat setelah proses demineralisasi menggunakan asam sulfat. Kandungan glisin pada gelatin pada penelitian ini, tidak berbeda jauh dengan kandungan glisin gelatin tulang ayam yang dilaporkan oleh Junianto, 2006 yaitu 15,02%. Kandungan glisin yang tinggi pada gelatin diduga dapat menyebabkan gelatin mudah larut dalam air dan mampu membentuk emulsi. Hal ini disebabkan karena glisisn merupakan asam amino yang bersifat hidrofilik. (Lehninger, 1982). Asam glutamat dan alanin juga terdapat dalam jumlah yang cukup tinggi yaitu dengan persentase 6,33%-7,53% dan 5,84%-7,51% berurutan. Pada keenam produk gelatin
33
tidak terdeteksi adanya asam amino histidin. Hal ini mungkin disebabkan karena kandungan histidin pada kulit ayam sangat kecil sehingga tidak terdeteksi atau gelatin kulit ayam memang tidak mengandung asam amino histidin. Kandungan histidin pada gelatin tulang ayam dilaporkan 0,25% (Junianto, 2006.)
Asam amino prolin juga merupakan komponen yang cukup tinggi persentasenya pada keenam gelatin hasil perlakuan yaitu berkisar antara 7,46%-9,87% tetapi jauh lebih rendah dari pada kandungan prolin gelatin sapi yaitu 16,14%. Kandungan prolin tertinggi 9,87 % diperoleh pada gelatin yang diproses melalui perendaman asam laktat tanpa proses demineralisasi menggunakan asam sulfat, dan kadar prolin terendah 7,46% ditunjukkan gelatin hasil perendaman dengan asam sitrat setelah proses demineralisasi dengan sam sulfat.
Asam amino essensial triptopan juga tidak terdeteksi pada gelatin hasil perlakuan karena pada kolagen maupun gelatin secara umum tidak mengandung asam amino triptopan. Hal inilah yang menyebabkan gelatin dikatakan sebagai protein yang kandungan gizinya tidak lengkap. Triptopan merupakan salah satu asam amino essensial yang dibutuhkan oleh tubuh (Glicksman, 1969). Oleh karena itu penggunaannya sebagai bahan baku industri pangan perlu dikombinasikan dengan bahan pangan yang banyak mengandung triptopan.
Pada penelitian ini, komposisi asam amino kekeenam produk gelatin tidak jauh berbeda tetapi kekuatan gelnya berbeda secara sigifikan (Tabel 4.6) sehingga dapat dikatakan komposisi asam amino gelatin kulit ayam tidak berpengaruh terhadap kekuatan gelnya. Menurut Johnston-Banks (1990) kandungan asam imino prolin dan hidroksi prolin memegang peran penting terhadap sifat fisik gelatin. Namun sifat fisik dan mekanik gelatin
34
tidak hanya bergantung pada komposisi asam aminonya tetapi juga ditentukan oleh kandungan relative dari komponen rantai protein β- atau γ – dan aggregates dengan berat molekul yang tinggi serta adanya kandungan fragmen protein dengan berat molekul yang rendah. Faktor lain yang juga berpengaruh terhadap sifat fisik dan mekanik gelatin adalah sumber atau asal dari bahan awal yang digunakan dan proses pengawetan dari bahan mentah yang digunakan atau kesegaran dari bahan mentah yang digunakan.
4.4.7 Analisis berat molekul dengan elktroforesis menggunakan SDS_PAGE
Pada penelitian ini, fragmen pita protein produk gelatin kulit ayam broiler dianalisa menggunakan teknik elektroforesis SDS gel poliakrilamida (SDS PAGE). Hasil yang didapatkan dari elektroforesis yaitu berupa pita – pita protein yang terpisahkan berdasarkan perbedaan berat molekulnya yang setara dengan panjang rantai protein. Migrasi pita protein dalam SDS PAGE berbanding terbalik dengan berat molekulnya (panjang pita), maka semakin besar berat molekul produk gelatin semakin lambat migrasinya sehingga posisinya pada elektroforegram semakin di atas.
Pita protein produk gelatin kulit ayam broiler dibandingkan dengan pola protein dari gelatin komersial ditunjukkan pada Gambar 4.7.
35
Gambar 4.7 Elektroforegram produk gelatin hasil perlakuan Keterangan:
M: Marker Protein (SDS-PAGE molecular Weight Standars Broad Range (BIORAD) A: GNAS B: GNAA C: GNALH D: GNAAH E: GNASH F: GNAL
Berdasarkan elektroforegram hasil SDS PAGE tersebut diketahui bahwa pada marker protein terdapat tujuh pita protein dengan berat molekul 97 kDa, 85kDa, 66kDa, 45kDa, 31kDa, 25kDa, dan 21kDa. Untuk sampel A(GASH), pita protein tidak tampak jelas terpisah dikarenakan pita – pita yang terbentuk terlalu tipis. Pada sampel B (GNAA) pita protein yang terbentuk pada 5 pita dengan berat molekul 97 kDa, 85 kDa, 66 kDa, 45 kDa, dan 31 kDa, 25kDA. Untuk sampel C(GNALH) tidak menunjukkan adanya pita
36
protein. Hal ini kemungkinan disebabkan fragmen protein yang dihasilkan memiliki berat molekul yang rendah (berat molekul lebih rendah daripada berat molekul protein marker yang terpendek), sehingga tidak terdeteksi dengan metode SDS PAGE. Fragmen protein dengan berat molekul rendah tersebut kemungkinan adanya proses degradasi yang terlalu kuat sehingga ikatan peptida pada kolagen terputus menjadi lebih pendek. Untuk Sampel D (GNAAH) menunjukkan adanya pita protein yang terbentuk dengan berat molekul 97 kDa, 85 kDa, 66 kDa, 45 kDa, dan 35 kDa, 25kDA sama dengan yang ditunjukkan oleh sampel B (GNAA) namun dengan pita yang lebih tebal. Untuk sampel E (GNASH) hampir sama dengan sampel D hanya 5 pita protein yang terbentuk sangat tipis dan tidak terlalu jelas. Demikian juga dengan sampel F (GNAL) pita protein ang terbentuk sangat tipis sehingga tidak terlalu jelas kenampakannya.
Berdasarkan hasil elektroforegam terlihat bahwa produk gelatin kulit ayam broiler yang memiliki berat molekul yang besar yaitu sampel D (GNAAH), hal ini ditunjukkan dengan pita protein yang terbentuk lebih tebal bila dibandingkan dengan pita protein produk gelatin GNASH, dan GNAL. Pada penelitian ini, tidak ditemukan pita protein dengan berat molekul yang tinggi (200-300Kda) yang merupakan komponen protein β-sheet dan γ-β-sheet, hanya pita protein dengan berat molekul 95 kDA dan 90kDa yang menunjukkan keberadaan rantai α1 dan α2 protein dan beberapa agregates protein dengan berat molekul yang rendah pada 66, 45, 35, dan 21 kDA. Dengan demikian dapat dikatakan bahwa perbedaan variasi jenis asam yang digunakan berpengaruh terhadap pita protein dan berat molekul gelatin yang dihasilkan. Pada penelitian ini proses isolasi gelatin dengan demineralisasi asam sullfat dan perendaman asam asetat menghasilkan gelatin
37
dengan berat molekul tertinggi dan kekuatan gel tertinggi meskipun rendemennya relatif rendah.
4.4.8 Identifikasi Gugus FungdiProduk Gelatin dengan FTIR
Pada penelitian ini, identifikasi gugus fungsi hanya ditampilkan dan didiskusikan untuk produk gelatin kulit ayam broiler melalui proses demineralisasi asam sulfat dengan variasi asam dan dilakukan dengan menggunakan Spektroskopi FTIR. Gelatin seperti umumnya protein memilki struktur yang terdiri dari karbon, hidrogen, gugus hiroksil (OH), gugus karbonil (C=O), dan gugus amina (NH). Gelatin memiliki serapan khas, yaitu daerah amida A pada v 3600-2300 cm-1, amida I pada v 1636-1661 cm-1, amida II pada v 1560-1335 cm-1 dan amida III pada v 1300-1200 cm-1 (Muyongga, 2004). Interpretasi spektra IR ditunjukkan pada Tabel 4.7 dan spektra Inframerah ditampilkan pada Gambar 4.8-4.10.
38
Gambar 4.9. Spektra Inframerah gelatin yang diekstraksi dengan asam laktat
39 Tabel 4.8 Interpretasi Gugus Fungsi Gelatin
Daerah Serapan
Puncak serapan (cm-1) Dugaan
gugus fungsi Gelatin Asam Sitrat Gelatin Asam Laktat Gelatin Asetat Amida A 3569 3396 3491 3396 3412 3360 Regangan N-H dari gugus amida yangberasosiasi dengan ikatan hydrogen dan
regangan O-H dari hidroksi prolin 2941 3099 2958 Regangan CH2asimetri 2345 2401 2337 Regangan CH2 Amida I 1712 1699 1712 1570 1699 1579
Regangan C=O dari asam karboksilat Regangan C=O dengan adanya kontribusi dari tekukan NH dan regangan CN (random coil) Amida II 1492 1467 - Deformasi NH, tekukan CH2 - - 1340 Goyangan CH2 dari proline
Amida III 1273 1271 1263 Tekukan N-H
- 1143 1114 Regangan C-O dari
alkohol sekunder
952 966 - Goyangan C-C dari
CH3
763 848 854 Kibasan NH keluar
bidang dari amida primer
696 659 - Tekukan OH keluar
bidang
543 592 - Tekukan dari NCO