LAPORAN AKHIR PRAKTIKUM FARMASI FISIKA II UJI STABILITAS
NAMA : NITA SARI
NPM : 260110140044
HARI/TANGGAL PRAKTIKUM : SELASA , 31 MARET 2015
ASISTEN : 1. IMAM HAFIZ RAHAYUDA
2. KHOIRUNNISA ALFITRIA
LABORATORIUM FARMASI FISIKA II
FAKULTAS FARMASI
UNIVERSITAS PADJADJARAN
JATINANGOR
ABSTRAK
Stabilitas obat adalah derajat degradasi suatu obat dipandang dari segi kimia. Stabilitas obat dapat diketahui dari ada tidaknya penurunan kadar selama penyimpanan. Pada pembuatan obat harus diketahui waktu paro suatu obat. Waktu paro suatu obat dapat memberikan gambaran stabilitas obat, yaitu gambaran kecepatan terurainya obat atau kecepatan degradasi kimiawinya. Dengan mengetahui stabilitas obat dan waktu paronya kita dapat mengetahui lamanya obat dapat disimpan atau waktu simpan. Shelf life atau masa kadaluarsa adalah periode penggunaan dan penyimpanan yaitu waktu dimana suatu produk tetap memenuhi spesifikasinya jika disimpan dalam wadahnya yang sesuai dengan kondisi penjualan di pasar. Stabilitas obat sangat di pengaruhi oleh perubahan suhu, semakin tinggi suhu maka stabilitas suatu obat menurun. Pada percobaan dilakukan uji stabilitas asetosal terhadap perubahan suhu. Semakin tinggi suhu maka semakin menurun stabilitasnya.
ABSTRACT
Drug stability is the degree of degradation of the drug in terms of chemistry . The stability of the drug can be seen from the absence of a decrease in the levels during storage . In the manufacture of the drug should be known half-life time of a drug . The half-half-life of a drug can provide an overview of drug stability , ie the speed of picture degradation speed decomposition of the drug or chemical . By knowing the stability of the drug and the half-life we can determine the length of time the drug can be stored or saved . Shelf life or expiration period is the period of use and storage that is the time when a product still meets the specifications if stored in containers in accordance with the conditions of sale on the market . Drug stability is influenced by changes in temperature , the higher the temperature , the stability of a drug decreases . In experiments to test the stability of aspirin to temperature changes . The higher the temperature , the decreased stability.
UJI STABILITAS
I. Tujuan
1. Membuat larutan yang mengandung 4% asetosal dan 10 % natrium sitrat
2. menentukan kadar asetosal dalam berbagai variasi suhu dan waktu tertentu dengan menggunakan sediaan farmasi yang disebabkan oleh kenaikan suhu
3. Memperlihatkan penguraian sediaan farmasi yang disebabkan oleh kenaikan suhu
4. Meramalkan kecepatan sediaan yang terurai pada suhu penyimpanan yang biasa (suhu kamar) dengan persamaan Arrhenius dan ekstrapolasi grafik.
II. Prinsip
1. Hukum Arrhenius
Persamaan Arrhenius menyatakan hubungan antara energi aktivasi dengan laju reaksi ( ilmukimia, 2014).
2. Azas Le Chatelier
Bila pada sistem kesetimbangan diadakan aksi, maka sistem akan mengadakan reaksi sedemikian rupa sehingga pengaruh aksi itu menjadi sekecil kecilnya (Ratna, 2009).
3. Titrasi Asam Basa
Titasi merupakan salah satu metode untuk menetukan konsentrasi suatu larutan dengan cara mereaksikan sejumlah volume larutan tersebut
terhadap sejumlah volume larutan lain yang konsentrasinya sudah diketahui. Titrasi yang melibatkan reaksi asam dan basa disebut titrasi asam basa (Muchtaridi,2007).
4. Laju reaksi
Laju reaksi dapat diartikan sebagai penambahan atau pengurangan konsentrasi zat per satuan waktu(Ratna, 2009).
5. Reaksi Netralisasi
Reaksi yang terjadi dengan pembentukan garam dan H2O netral (pH = 7) hasil reaksi antara H+ dari suatu asam dan OH- dari suatu basa (Sumardjo, 2006).
6. Pengenceran
Prosedur untuk penyiapan larutan yang kurang pekat dari larutan yang lebih pekat disebut pengenceran. Dalam melakukan proses pengenceran, perlu diingat bahwa penambahan lebih banyak pellarut ke dalam sejumlah tertentu larutan stok akan berubah (mengurangi) konsentrasi larutan tanpa mengubah jumah mol zat terlarut yang terdapat dalam larutan
( Chang, 2005).
7. Stoikiometri
Stoikiometri reaksi adaah penentuan perbandingan massa unsur unsur dalam senyawa dalam pembentukan senyawanya(Alfian, 2009).
III. Reaksi
2NaOH + H2C2O4 Na2C2O4 + 2 H2O ( Svehla ,1990).
IV. Teori Dasar
Stabilitas kimia suatu obat adalah lamanya waktu suatu obat untuk mempertahankan integritas kimia dan potensinya seperti yang tercantum pada etiket , dalam batas batas yang ditentukan oleh united stated pharmacopedia. Untuk menetapkan stabilitas kimia suatu obat .laju reaksi dan orde reaksi harus diteliti. Stabilitas didefinisikan sebagai kemampuan zat obat atau produk obat untuk tetap di dalam spesifikasi yang dibentuk untuk menjaga identitas kekuatan dan kualitas juga kemurnian melalui luar tes tes ulang atau berakhirnya masa datang (Aulton,2003).
Dalam suatu larutan ,terkenal suatu istilah masa kadaluarsa atau shelf life (waktu simpan ). Shelf life adalah periode penggunaan dan penyimpanan yaitu waktu dimana suatu produk tetap memenuhi spesifikasinya jika disimpan dalam wadahnya yang sesuai dengan kondisi penjualan di pasar ( Joshita,2008).
Pada pembuatan obat harus diketahui waktu paro suatu obat. Waktu paro suatu obat dapat memberikan gambaran stabilitas obat, yaitu gambaran kecepatan terurainya obat atau kecepatan degradasi kimiawinya. Panas, asam-asam, alkali-alkali, oksigen, cahaya, kelembaban dan faktor-faktor lain dapat menyebabkan rusaknya obat. Mekanisme degradasi dapat disebabkan oleh pecahnya suatu ikatan, pergantian spesies, atau perpindahan atom-atom dan ion-ion jika dua molekul bertabrakan dalam tabung reaksi (Moechtar, 1989).
Stabilitas obat perlu diuji untuk memberikan bukti tentang mutu suatu bahan dan atau produk obta yang berubah seiring waktu di bawah pengaruh faktor faktor lingkungan seperti suhu , kelembaban, dan cahaya. Selain itu, tujuan uji tersebut adalah untuk menetapkan suatu periode uji ulang untuk bahan obat tersebut atau masa edar untuk produk obat dan kondisi penyimpanan yang direkomendasikan (Watsonm, 2009).
Jenis stabilitas yang umum dikenal adalah : a. Stabilitas fisika
Meliputi penampilan, konsistensi, warna, aroma, rasa, kekerasan, kerapuhan, kelarutan, pengendapan, perubahan berat, adanya uap, bentuk dan ukuran partikel.
b. Stabilitas kimia
Meliputi degradasi formulasi bentuk, kehilangan potensi (bahan aktif), kehilangan bahan bahan tambahan (pengawet, antioksidan, dll).
c. Stabilitas mikrobiologi
Meliputi perkembangbiakan mikroorganisme pada sediaan non steril, sterilisasi dan perubahan efektifitas pengawet.
d. Stabilitas terapi
meliputi efek terapi tidak berubah e. Stabilitas toksikologi (Ukhti, 2013).
Stabilitas berkaitan erat dengan laju reaksi dan orde reaksi. Proses laju merupakan hal dasar yang perlu bagi setiaporang dengan kaitan bidang kefarmasian mulai dari pengusaha obat sampai pasien. Beberapa prinsip dan proses laju yang berkaitan dimasukkan ke dalam rantai peristiwa ini:
1. Kestabilan dan tidak tercampurkan 2. Disolusi
3. Proses adsorpsi pada tingkat molekular ( Connors, 1979).
Efek yang tidak diinginkan dan ktidakstabilan produk farmasi adalah:
1. Hilangnya zat aktif
2. Naiknya konsentrasi zat aktif 3. BA berubah
4. Hilangnya keseragaman kandungan 5. Menurunnya status mikrobiologis
7. Pembentukan hasil urai yang toksik 8. Hilangnya kekedapan kemasan 9. Menurunnya kualitas label
10. Modifikasi faktor hubungan fungsional ( Leon, 1994).
Faktor faktor yang mempengaruhi kestabilan suatu obat :
1. Profil sifat fisika dan kimia pada sediaan yang dibuat (termasuk eksipien dalam sistem kemasan yang digunakan untuk formulasi sediaan )
2. Faktor faktor lingkungan seperti suhu , kelembaban, dan cahaya (Ukhti,2013).
Kestabilan dari suatu zat merupakan faktor yang harus diperhatikan dalam membuat formulasi suatu sediaan farmasi. Hal itu penting mengingat sediaannya biasanya diproduksi dalam jumlah yang besar dan juga memrlukan waktu yang lama untuk sampai ketangan pasien yang membutuhkannya. Oabt yang disimpan dalam jangka waktu yang lama dapat mengalami penguraian dan mengakibatkan hasil urai dari zat tersebut bersifat toksik sehingga dapat membahaykan jiwa pasien. Oleh karena itu, perlu diketahui faktor-faktor apa saja yang mempengaruhi kestabilan suatu zat hingga dapat dipilih suatu kondisi dimana kestabilan obat tersebut optimum (Depkes RI, 1979).
V. Alat dan Bahan
5.1. Alat 5.2 Bahan
a. buret a. air
b.Corong b. Asam oksalat
c. erlenmeyer c. asetosal
d. Kertas Indikator pH d. fenolftalein
e.labu ukur e. Natrium hidroksida
f.neraca analitis f. Natrium sitrat
g. pipet ukur 10 ml
5.3. Gambar Alat
Buret corong Erlenmeyer
Kertas indikator Kertas saring neraca analitik
Pipet volume
VI . Prosedur
250 ml larutan yang mengandung 4 % asetosal dan 10 % natrium sitrat dibagi 4 sampel dan disimpan pada suhu 30oC , 40oC, 50OC, dan 60oC diatas tangas air (water bath).
Kurang lebih 200 ml larutan Na-sitrat 10 % dalam labu ukur dihangatkan pada suhu 50oC kurang lebih 10 menit. Asetosal ditimbang seksama (teliti),masukkan ke dalam labu ukur berisi larutan Na-sitrat 10% melalui corong, bilas dengan larutan Na-sitrat 10% . Dikocok sampai larut, ditambahkan larutan Na-sitrat 10% sampai 250 ml. Diambil sebanyak 4 kali 50 ml, dimasukkan kedalam wadah tertutup. Masing masing ditaruh di atas tangas air yang sesuai suhunya. Dicatat waktunya. Dipipet duplo 10 ml sampel dari sisa larutan yang 250
ml, dan segera ditetapkan kadarnya untuk mengetahui kadar awal asetosal (potensi 100%). Ditentukan kadar sampel dalam ke empat botol pada interval waktu 15 menit hingga satu jam.
VIII. Data Pengamatan
1. Pembakuan NaOH V1. N1 = V2.N2 V1. N1 = V2.N2 12,5 . N1 = 10 . 0,1 8 . N1 =10 . 0,1 N1 = 0,08 N N1 = 0,125 N N rata rata = = 0,1025N 2. Potensi a. Kadar awal Potensi = . 100% = x 100% = 100%
b. Potensi tiap waktu suhu 30oC
Potensi waktu 0 menit
Potensi waktu 0 =
x 100%
Potensi waktu 15 menit
Potensi waktu 15 =
x 100% = 72,195%
Potensi waktu 30 menit
Potensi waktu 30 =
x 100%
= 61,95%
Potensi waktu 45 menit
Potensi waktu 45 =
x 100% = 87,80%
Keterangan : X = V titran awal
Y = V titran pada suhu 30oC
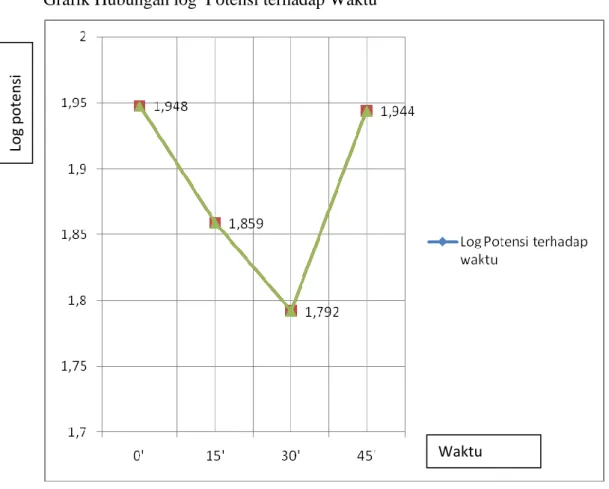
c. Log potensi
Waktu o menit = log 88,78 = 1,948 Waktu 15 menit = log 72,195
= 1,859 Waktu 30 menit = log 61,95
= 1,792 Waktu 45 menit = log 87,80
3. Kadar Asetosal Tiap Waktu suhu 30oC Kadar asetosal = x Vstok Waktu 0 menit = x 250 ml = 5262,924 Waktu 15 menit = x 250 ml = 6047,748 Waktu 30 menit = x 250 ml = 6532,489 Waktu 45 menit = x 250 ml = 5309,09
4. Perhitungan K Tiap Waktu suhu 30 oC
M =
M= M = M = -8,889 . 10-5 M= -8,889 . 10 -5 =
K= 2,047 . 10-4 Log K = -3,689 Keterangan ; Y2 = log potensi (t=45) Y1 = log potensi (t = 0) X2 = t = 45 menit X1= t = 0 menit
Data dari kelompok lain
Kelompok 2 (40oC) Kelompok 3(50oC) Kelompok 4 (60oC)
M -0,00978 -0,0128 -1,3. 10 -3
K 0,00225 0,0294 3,07. 10 -3
Log K -2,648 -1,5316 -2,51
5. Perhitungan Energi Aktivasi (Ea)
M =
M = M = M= -2828,28 M = -2828,28 = Ea =12896,79
Keterangan :
Y2 = log K suhu akhir
Y1= log K suhu awal
R= 1,98 X2 = 1/T ( T =kelvin) X1 = 1/T (T= kelvin) 6. Perhitungan Nilai A In A =
x
=
x
= 18,48 A= 106111395,4 Log A = 8,025 7. Perhitungan K25 Log K25 = log A -
=
8,025- = -1,309 K25 = 0,049 8. perhitungan t90 T90 = = 2,142 jamGrafik Hubungan log Potensi terhadap Waktu
Buat Grafik Hubungan Log K terhadap 1/T
Lo g p o te n si Waktu Lo g K suhu
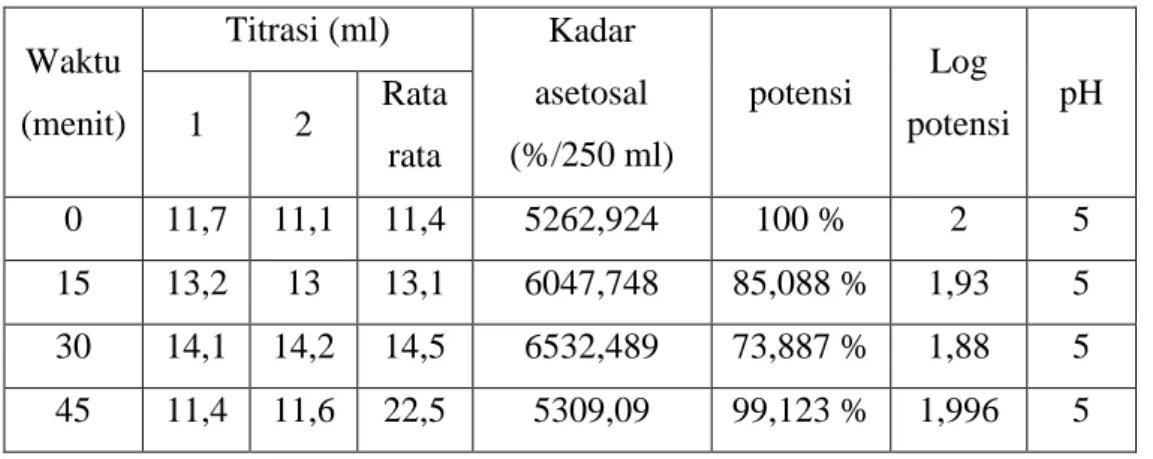
Tabel penetapan kadar Asetosal suhu 30oC Waktu (menit) Titrasi (ml) Kadar asetosal (%/250 ml) potensi Log potensi pH 1 2 Rata rata 0 11,7 11,1 11,4 5262,924 100 % 2 5 15 13,2 13 13,1 6047,748 85,088 % 1,93 5 30 14,1 14,2 14,5 6532,489 73,887 % 1,88 5 45 11,4 11,6 22,5 5309,09 99,123 % 1,996 5 VIII . Pembahasan
Uji stabilitas dimaksudkan untuk menjamin kualitas produk yang telah diluluskan dan beredar dipasaran. Dengan uji stabilitas dapat diketahui pengaruh faktor lingkungan seperti suhu dan kelembaban terhadap parameter parameter stabilitas produk seperti kadar zat aktif , pH, berat jenis dan net volume sehingga dapat ditetapkan tanggal kadaluwarsa yang sebenarnya. Stabilitas obat adalah kemampuan suatu obat untuk mempertahankan sifat dan karakteristiknya agar sama dengan yang dimilikinya pada saat dibuat (identitas, kekuatan, kualitas, kemurnian) dalam batas yang ditetapkan sepanjang periode penyimpanan dan penggunaan sehingga mampu memberikan efek terapi yang baik dan menghindari efek toksik. Salah satu aktivitas yang paling penting dalam kerja preformulasi adalah evaluasi kestabilan fisika dan kimia dari zat obat murni. Kestabilan suatu zat merupakan faktor yang harus diperhatikan yaitu pembuatan sediaan farmasi. Suatu sediaan farmasi yang telah melebihi dari waktu penyimpanannya dapat mengalami reaksi yang tidak diinginkan misalnya penguraian zat zat yang ada didalamnya yang dapat menimbulkan efek toksik. Efek toksik tersebut dapat membahayakan pasien yang mengkonsumsi sediaan tersebut.
Energi aktivasi (Ea) yaitu kemampuan suatu sediaan untuk dapat mengalami penguraian zat. Energi aktivasi (Ea) harus ditentukan dengan cara mengamati perubahan konsentrasi pada suhu tinggi, dengan membandingkan dua harga konstanta penguraian zat pada temperatur atau suhu yang berbeda sehingga dapat ditentukkan energi aktivasinya .t½ atau waktu paruh adalah periode penggunaan dan penyimpanan yaitu waktu dimana suatu produk tetap memenuhi spesifikasinya jika disimpan dalam wadahnya yang sesuai dengan kondisi atau waktu yang diperlukan untuk hilangnya konsentrasi setengahnya. t90 atau masa kadaluarsa adalah waktu yang tertera yang menunjukkan batas waktu diperbolehkannya obat tersebut dikonsumsi karena diharapkan masih memenuhi spesifikasi yang ditetapkan. Kestabilan suatu sediaan farmasi sangat mempengaruhi kualitas nya pula. Sehingga segala hal yang berhubungan dengan kestabilan sediaan farmasi harus diperhatikan. Faktor yang mempengaruhi stabilitas sediaan farmasi tergantung pada profil sifat fisika dan kimia. Faktor utama lingkungan dapat menurunkan stabilitas di antaranya temperatur yang tidak sesuai, cahaya, kelembaban, oksigen dan mikroorganisme. Beberapa faktor lain yang juga mempengaruhi stabilitas suatu obat adalah ukuran partikel, pH, kelarutan, dan bahan tambahan kimia.
Aplikasi stabilitas obat dalam bidang farmasi yaitu kestabilan suatu zat merupakan faktor yang harus diperhatikan dalam membuat formulasi suatu sediaan farmasi. Hal ini penting mengingat suatu sediaan biasanya diproduksi dalam jumlah yang besar dan memerlukan waktu yang lama dapat mengalami penguraian dan mengakibatkan dosis yang diterima pasien berkurang. Adakalanya hasil urai tersebut bersifat toksis sehingga membahayakan jiwa pasien. Oleh karena itu perlu diketahui faktor-faktor mempengaruhi kestabilan suatu zatsehingga dapat dipilih kondisi pembuatan sediaan yang tepat sehingga kestabilan obat terjaga.
Pada percobaan ini sampel yang digunakan yaitu Asetosal. Variasi suhu yang digunakan dalampercobaan yaitu 30oC, 40oC, 50oC dan 60oC, dimana maksuddari dilakukannya variasi suhu tersebut yaitu agar diketahui pada suhu berapa suatu sediaan secara optimum dapat stabil dan untuk mengetahui pengaruh temperatur terhadap kecepatan reaksi suatu obat. Variasi waktu yang digunakan dalam percobaan yaitu 0,15, 30, 45 menit, dimana maksud dilakukannyavariasi waktu tersebut yaitu untuk mengetahui dimana pada setiap waktu, kestabilan suatu sediaan atau obat makin berkurang atau batas kadaluarsa obat semakin cepat.
Metode pengujian stabilitas obat dengan kenaikan temperatur tidak dapat diterapkan untuk semua jenis sediaan terutama untuk produk yang mengandung bahan pensuspensi seperti metilselulosa yang menggumpal pada pemanasan, protein yang mungkin didenaturasi, salep dan suppositoria yang yang meleleh pada kondisi temperatur yang sedikit dinaikkan
Selain temperatur, stabilitas obat dapat dipengaruhi juga oleh efek pengemasan dan penyimpanan. Sediaan berupa larutan masa simpannya relatif lebih singkat dibandingkan dengan bentuk sediaan padat, karena sediaan larutan mudah terurai dan bereaksi dengan keadaan sekitarnya atau lingkungannya (suhu dan cahaya). Misalnya, Jika suatu larutan obat disimpan dalam kondisi terlalu panas, ada kemungkinan botol(yang merupakan wadah umum untuk larutan) berinteraksi atau bereaksi dengan obat-obat yang terdapat di dalam botol tersebut. Selain itu perlu diperhatikan juga, bahwa jika suatu sediaan obat berupa larutan telah dibuka dari kemasannya atau wadahnya, stabilitas obat tersebut tidak sama lagi seperti stabilitas obat semula yang masih tersegel(masih dalam kemasan) sehingga waktu kadaluarsanya pun tidak akan sama persis seperti yang tertera pada kemasan obat tersebut karena obat yang telah dibuka segelnya (wadahnya/botolnya) akan berinteraksi langsung dengan udara luar dan keadaan sekitarnya yang akan menurunkan kestabilan obat tersebut.
Dari percobaan dapat diketahui bahwa semakin tinggi suhu atau temperatur maka semakin menurun stabilitas suatu sediaan farmasi. Hal ini dikarenakan suhu merupakan faktor lingkungan yang dapat mempengaruhi kestabilan suatu sediaan farmasi.
Pada percobaan uji stabilitas ini menggunakan metode titrasi dengan NaOH . NaOH sebagai larutan baku sekunder harus dibakukan dengan larutan baku primer asam oksalat. Tujuan pembakuan adalah untuk memastikan dan menentukan kadar atau konsentrasi pasti NaOH. NaOH merupakan senyawa yang higroskopis sehingga mudah berikatan dengan udara yang menyebabkan konsentrasinya berubah. Oleh karena itu konsentrasi yang tertera dalam etiket belum tentu sama dengan konsentrasi yang sebenarnya. Indikator yag digunakan adalah pp (fenolftalein) yang mudah diamati perubahan pH nya dengan perubahan warna dari tidak berwarna menjadi pink rosa ketika kelebihan sedikit basa karena rentang pHnya antata 8,3 – 10. Sehingga cocok digunakan untuk indikator NaOH.
IX. Simpulan
1. Larutan Na Sitrat 10 % dibuat dengan melarutkan 25 g padatan dalam 250 ml air dan 4% asetosal dengan menambahkan 10 g ke dalamnya dan ditambahkan aquades sampai 250 ml.
2. Dengan titrasi asam basa menggunakan baku sekunder NaOH, kadar
asetosal dapat ditentukan dengan rumus kadar =
3. Kenaikan suhu menyebabkan penguraian larutan asetosal sehingga
potensinya berkurang.
4. Kecepatan sediaan uang terurai pada suhu penyimpanan dapat dihitung dengan persamaan Arrhenius dan eksrapolasi grafik.
DAFTAR PUSTAKA
Aulton, MG . 2003. Pharmaceutics : The Science of Dosage from Design Second
edition . Edin Burg : Churchill Living Stone.
Connors, K.A ,dkk. 1979. Chemical Stability of Phamaceutics . New York : wiley.
Depkes RI. 1979. Farmakope Indonesia. Jakarta : Depkes RI.
Joshita, D. 2008. Kestabilan Obat . Tersedia online di
http://staff.ui.ac.id/internal/130674809/material/kestabilan-obat-kuliah-s2.pdf [ 28 Maret 2015].
Leon . 1994. Teori dan Praktek Farmasi Industri . Jakarta : UI Press.
Moechtar. 1989. Farmasi Fisika : Bagian Larutan dan Sistem Dispersi .Yogyakarta : Gadjah Mada press
Svehla. 1990 . Analisis Kuantitatif Mikro dan Semimikro. Jakarta : Kalman Media Pusaka.
Ukhti . 2013. Stabilitas Obat. Tersedia online di
http://www.prezi.com/stabilitas-obat-adalah-suatu-pengertian-yang-mencakup-masalah/ [ 28 Maret 2015].