BAB II
TINJAUAN PUSTAKA
2.1. Sejarah Aluminium
Orang pertama yang telah berhasil memisahkan aluminium adalah H.Davy yaitu pada tahun 1808. Pada tahun 1825 Oersted dapat menghasilkan aluminium yang lebih murni dengan jalan memanaskan natrium amalgama dan natrium aluminium klorida. Pada tahun 1854, Henari Saint Clavil Deauville memproduksi aluminium dari natrium aluminium klorida dengan pemanasan menggunakan logam natrium sebagai katalisator. Proses ini telah berlangsung kurang lebih 35 tahun.
Pada tahun 1886 Charles Hall dari USA menghasilkan aluminium dari proses elektrolisa alumina yang dipisahkan dari campuran kriolit (Na3AlF6). Pada tahun yang sama Poult Heroult
2.1.1. Aluminium
Aluminium ialah unsur melimpah ketiga terbanyak dalam kerak bumi (sesudah oksigen dan silikon), mencapai 8,2 % dari massa total. Bijih yang paling penting untuk produksi aluminium ialah bauksit, yaitu aluminium oksida terhidrasi yang mengandung 50 sampai 60 % Al2O3, 1 sampai 20 % Fe2O3, 1 sampai 10 % silikat sedikit sekali titanium, zirconium, vanadium,
dan oksida logam transisi yang lain, dan sisanya 20 sampai 30 % adalah air. Bauksit dimurnikan melalui proses Bayer, yang mengambil manfaat dari fakta bahwa oksida alumina amfoter larut dalam basa kuat tetapi besi (III) oksida tidak. Bauksit mentah dilarutkan dalam natrium hidroksida
Al2O3 (s) + 2 OH (aq) + 3 H2O (l) → 2 Al(OH)4 (aq)
Dan dipisahkan dari besi oksida terhidrasi serta zat asing tak larut lainnya dengan penyaringan (Oxtoby, 2003).
industrial adalah proses elektrolisis Hall-Heroult. Proses tersebut merupakan elektrolisis larutan alumina (Al2O3) di dalam lelehan kriolit (Na3AlF6) pada temperature 960oC sehingga dihasilkan
aluminium cair.
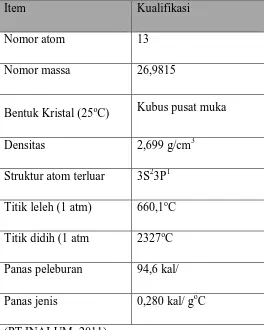
Tabel 2.1 Sifat-sifat Fisik dan Kimia dari aluminium
Item Kualifikasi
Nomor atom 13
Nomor massa 26,9815
Bentuk Kristal (25oC) Kubus pusat muka
Densitas 2,699 g/cm3
Struktur atom terluar 3S23P1
Titik leleh (1 atm) 660,1oC
Titik didih (1 atm 2327oC
Panas peleburan 94,6 kal/
Panas jenis 0,280 kal/ goC
(PT INALUM, 2011).
2.2. Alumina (Al2O3)
Alumina (Al2O3) merupakan material keramik nonsilikat yang paling penting. Material
1700oC. Alumina mempunyai ketahanan listrik yang tinggi dan tahan terhadap kejutan termal dan korosi. Alumina (Al2O3) diperoleh dari pengolahan biji bauksit yang mengandung 50-60%
Al2O3; 1-20% Fe2O3; 1-10% silika; sedikit sekali titanium, zirkonium dan oksida logam transisi
lain; dan sisanya (20-30%) adalah air.
Aluminium sebagai salah satu unsur logam yang terdapat berlimpah di alam dan merupakan unsur terbanyak ketiga setelah oksigen. Unsur ini sangat reaktif sehingga di alam tidak pernah ditemui aluminium dalam keadaan native. Di alam aluminium berupa oksida, diantaranya adalah bauksit (Al2O3.H2O) dan oksida ini sangat stabil sehingga tidak dapat
SiO2 % 0,03 max
Fe2O3 % 0,03 max
TiO2 % 0,005 max
Na2O % 0,600 max
CaO % 0,060 max
Al2O3 (dalam keadaan kering) % 98,40 min
Specific surface area m2/g 40-80
Particle size
+ 100 # % 12,0 max
+ 150 # % 25 min
− 325# % 12,0 max
Angle of refuse Deg 30-34
2.2.1. Kecepatan Melarut Alumina (Al2O3) Pada Cairan Kriolit
Kecepatan alumina (Al2O3) didalam cairan kriolit dipengaruhi oleh temperatur
pemanasan alumina (Al2O3) dan beberapa bahan tambahan yang ditambahkan kedalam lelehan
kriolit. Alumina (Al2O3) yang dikalsinasi antara 800oC - 900oC mempunyai kecepatan melarut
yang besar di dalam cairan kriolit.
Hal ini sudah ditetapkan, bahwa partikel alumina (Al2O3) cepat melarut pada cairan
ini adalah akibat alumina sandy mempunyai permukaan lebih besar bila dibandingkan alumina floury.
Pada pot peleburan (tungku reduksi), alumina (Al2O3) dimasukkan kedalam pot dengan
memecahkan kerak diatas bath/kriolit terlebih dahulu. Jelaslah alumina (Al2O3) tidak larut
seluruhnya di dalam bath/kriolit secara tiba-tiba setelah penambahan, dan beberapa material langsung tenggelam ke dasar pot/tungku membentuk sludge (lumpur) dibawah lapisan mtal. Terjadinya sludge (lumpur) dalam jumlah yang banyak didalam pot/tungku akan merugikan setiap operasi, dimana sludge (lumpur) didasar pot mengandung 40 % alumina (Al2O3)
(Anonymous, 1998).
2.3. Larutan Elektrolit (Bath)
Komposisi utama dari larutan elektrolit (bath) adalah kriolit (Na3AlF6). Lelehan kriolit,
yang berdisosiasi sempurna menjadi ion-ion Na+ dan AlF63-, merupakan pelarut yang baik untuk
aluminium oksida dalam elektrolit. Kriolit meleleh pada suhu 1000oC, tetapi titik lelehnya turun dengan adanya aluminium oksida terlarut, sehingga suhu operasi sel hanya sekitar 950oC. Dibandingkan dengan titik leleh Al2O3 murni (2050oC), suhu tersebut merupakan suhu yang
rendah (Oxtoby, 2003). Sifat-sifat yang diperlukan untuk kriolit (Na3AlF6) adalah :
Tabel 2.3 Sifat-sifat kriolit dan kegunaannya
Sifat-sifat kriolit (Na3AlF6) Berguna untuk Memiliki temperatur kristalisasi primer
rendah
Memiliki konduktivitas listrik baik a. Menurunkan temperatur bath b. Memperbaiki produktivitas
c. Dapat melarutkan alumina (Al2O3) dalam jumlah besar
d. Memiliki berat jenis yang rendah, yang berguna agar metal dan bath terpisah e. Stabil dalam keadaan cair
f. Memiliki tegangan permukaan yang baik dimana dapat mengurangi reoksidasi Memiliki viskositas yang sesuai a. Mengurangi kecepatan sedimentasi
b. Mengurangi emisi gas
c. Mengurangi gerakan partikel aluminium dan karbon
Pengendalian komposisi elektrolit merupakan hal yang sangat penting dalam proses produksi aluminium. Oleh karena titik leleh kriolit murni adalah 1009oC, elektrolit itu mengandung kalsium flourida (CaF2) dan sisa AlF3, yang bersama alumina yang terlarut dapat
menurunkan titik leleh cukup rendah sehingga sel itu dapat beroperasi pada suhu sekitar 940oC – 980oC. Kelebihan AlF3 juga dapat meningkatkan efisiensi. Perbandingan berat NaF/AlF3 didalam
kriolit adalah 1,50 ; kelebihan AlF3 didalam kriolit (Na3AlF6) diatur sedemikian rupa, sehingga
menghasilkan rasio NaF/AlF3 sekitar 1,10 sampai 1,40. Dalam beberapa minggu pertama setelah
sel yang baru diberi pelapis itu beroperasi, elektrolit itu diserap dengan cepat kedalam pelapis dan isolasi.
Komponen utama penyusun elektrolit adalah kriolit (Na3AlF6) yang berfungsi sebagai
pelarut dan alumina yang berfungsi sebagai zat terlarut, serta beberapa zat aditif lainnya. Kriolit (Na3AlF6) digunakan dalam proses elektrolisa aluminium, karena sifat-sifatnya yang unik dan
a. Kemampuan melarutkan alumina dengan baik
b. Tegangan komposisi lebih tinggi
c. Konduktivitas elektrolitnya cukup tinggi.
d. Titik leburnya relatif rendah
e. Tidak dapat bereaksi dengan aluminium dan karbon
f. Cukup encer sebagai pelarut
g. Masa jenisnya cukup rendah, bila dalam keadaan sama-sama cair
h. Tekanan uapnya relatif rendah.
Pada tekanan atmosfer aluminium fluoride (AlF3) tidak dapat dijumpai dalam bentuk cair.
Cairan kriolit-alumina juga mengandung kalsium fluorida (CaF2) atau natrium flourida (NaF)
membentuk komposisi kriolit 3NaF-AlF3. Kriolit sebagai elektrolit dalam reduksi aluminium
juga harus memenuhi syarat-syarat elektrolit yang dibutuhkan sebagai berikut : a. Temperatur kristalisasi primer rendah
b. Konduktivitas listrik yang baik
c. Dapat melarutkan alumina dalam jumlah besar
d. Mempunyai berat jenis kecil
e. Stabil dalam keadaan cair
klorida dari logam alkali, AlF3 dan CaF2 dan juga biasa digunakan MgF2, LiF, dan NaCl
(Grjotheim, 1982).
2.3.1. Keasaman Bath
Keasaman bath dinyatakan dalam banyaknya kadar AlF3 yang terkandung di dalam
bath. Biasanya keasaman bath sekitar 9 – 11%. Keasaman bath sangat berpengaruh terhadap
terhadap temperatur bath, biasanya bila kadar keasaman rendah maka temperatur bath akan tinggi dan sebaliknya bila kadar keasaman tinggi maka temperatur bath akan rendah. Namun tidak selamanya keasaman berbanding terbalik dengan temperatur bath ada kalanya pada saat keasaman rendah temperatur juga rendah, hal ini tergantung pada kondisi pot terutama jumlah metal dan voltase pot.
Pada saat start up, keasaman bath sangat rendah yaitu sekitar 1 - 2%, hal ini terjadi karena adanya penambahan soda abu. Setelah beberapa hari, pemasukan soda abu mulai dikurangi kemudian dimasukkan AlF3 agar keasaman menjadi naik dan akan terbentuk
lapisan-lapisan pada dinding pot.
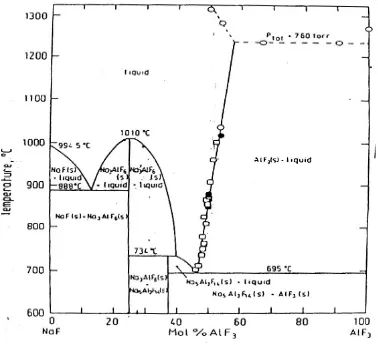
2.3.2. Temperatur Liquidus
Temperatur liquidus merupakan temperatur dimana batas pertemuan yang tepat antara fasa cair, padat, ataupun campuran dari bath. Jika dilihat dari diagram fasa sistem NaF – AlF3,
pengurangan AlF3 maka temperatur liquidus akan bergerak turun ataupun naik. Berikut
adalah gambar diagram fasa sistem NaF – AlF3 dalam gambar 2.1.
Gambar 2.1. Diagram Fasa Sistem NaF – AlF3
Dalam literatur, beberapa hubungan liquidus temperature kriolit untuk sistem multi
= 1011 + 0.50 × −0.13 × . − 3.45 × 1 + 0.0173 ×
+ 0.124 × × −0.00542 × × .
− 7.93 ×
1 + 0.0936 × −0.0017 × −0.0023 × ×
−1 + 0.0047 ×8.90 ×+ 0.0010 × −3.95 ×
TL = liquidus temperature (0C)
CAlF3 = konsentrasi aluminium fluorida (wt%)
CCaF2 = konsentrasi kalsium fluorida (wt%)
CAl2O3 = konsentrasi alumina (wt%)
CLiF = konsentrasi lithium fluorida (wt%)
CMgF2 = konsentrasi magnesium fluorida (wt%)
2.3.3. Superheat
Superheat secara sederhana didefinisikan sebagai selisih antara BT dan LT. Lebih
mudah mengoperasikan pada SH yang lebih tinggi, juga dikarenakan membantu dalam aspek
pelarutan alumina. Pada teorinya, SH selalu bernilai positif. Namun, SH bisa didapat bernilai
negatif.
2.3.4. Komposisi Bath
Elektrolit yang banyak mengandung sodium fluorida (NaF) akan meningkatkan CE karena bath seperti ini biasanya mengandung AlF3, LiF, MgF2 dan CaF2 adalah aditif yang dapat
menaikkan CE. Konsentrasi AlF3 yang kecil pada bath akan menurunkan CE.
2.4. Soda abu (Na2CO3)
Soda abu berfungsi memperkuat struktur katoda dan dinding samping agar sulit tererosi. Lapisan dinding samping dengan Na2CO3 dilakukan pada tahap transisi untuk membantu proses
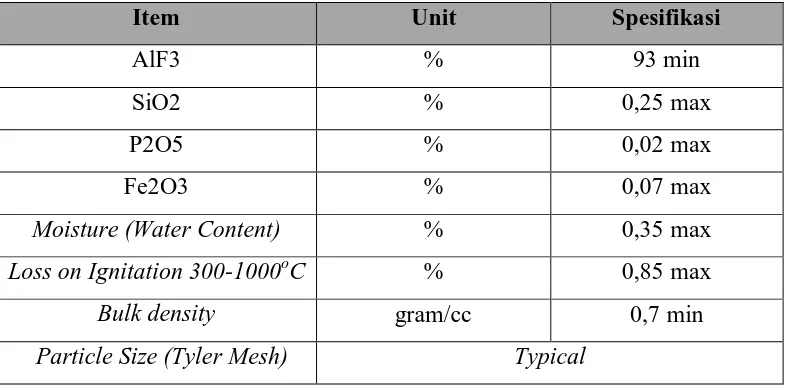
2.5. Aluminium Fluorida (AlF3)
Aluminium fluorida berfungsi menjaga temperatur bath dan merupakan bahan yang
dituangkan secara manual jika AlF3 kurang didalam bath. Spesifikasi AlF3 yang digunakan oleh PT
INALUM dapat dilihat pada tabel 2.3.
AlF3 merupakan aditif yang dimasukkan setiap hari untuk mengimbangi penguapan gas
fluorida dan menjaga kompisi bath tetap stabil. Selain itu, kriolit akan terbentuk akibat terjadinya reaksi antara AlF3 dengan Na2O.
4 AlF + 3Na O→2Na AlF + Al O
Fungsi utama AlF3 adalah menurunkan temperatur liquidus bath, sehingga pot bisa
dioperasikan pada temperatur yang lebih rendah. Bath cair terkadang perlu di keluarkan dari dalam pot bila tidak sesuai dengan standar tinggi bath, 22 ± 2 cm, dan apabila terjadi kekurangan, AlF3 akan ditambahkan ke dalam pot. Pemasukan ataupun pengeluaran dilakukan
+ 150 mesh % 25-60
+ 200 mesh % 50-75
+ 320 mesh % 75 min
(PT.INALUM, 2011).
2.6. Elektrolisis
Elektrolisis adalah peristiwa penguraian elektrolit oleh arus listrik searah dengan menggunakan dua macam elektroda. Elektroda tersebut adalah katoda (elektroda yang dihubungkan dengan kutub negatif) dan anoda (elektroda yang dihubungkan dengan kutub positif).
Pada anoda terjadi reaksi oksidasi, yaitu anion (ion negatif) ditarik oleh anoda dan jumlah elektronnya berkurang sehingga bilangan oksidasinya bertambah.
c. Ion sisa asam yang lain dioksidasi menjadi molekul. Contoh: 2Cl-(aq)→ Cl2 (g) + 2e-
Pada katoda terjadi reaksi reduksi, yaitu kation (ion positif) ditarik oleh katoda dan menerima tambahan elektron, sehingga bilangan oksidasinya berkurang.
2H+ (aq) + 2e- → H2(g)
b. Ion logam alkali (IA) dan alkali tanah (IIA) tidak direduksi, yang direduksi air. 2H2O (aq) + 2e- → H2(g) + 2OH-(aq)
a. Elektrolisis larutan HCl dengan elektroda Pt, reaksinya: 2HCl (aq)→ 2H+(aq) + 2Cl- (aq)
Faraday mengamati peristiwa elektrolisis melalui berbagai percobaan yang dia lakukan. Dalam pengamatannya jika arus listrik searah dialirkan ke dalam suatu larutan elektrolit, mengakibatkan perubahan kimia dalam larutan tersebut. Sehingga Faraday menemukan hubungan antara massa yang dibebaskan atau diendapkan dengan arus listrik. Hubungan ini dikenal dengan Hukum Faraday.
1. Jumlah zat yang dihasilkan di elektroda sebanding dengan jumlah arus listrik yang melalui sel.
2. Bila sejumlah tertentu arus listrik melalui sel, jumlah mol zat yang berubah di elektroda adalah konstan tidak bergantung jenis zat. Misalnya, kuantitas listrik yang diperlukan untuk mengendapkan 1 mol logam monovalen adalah 96.485 C(Coulomb) tidak bergantung pada jenis logamnya.
Hukum Faraday I : Massa zat yang timbul pada elektroda karena elektrolisis berbanding lurus dengan jumlah listrik yang mengalir melalui larutan.
w ~ Q w = massa zat yang diendapkan (g)
Massa ekivalen = massa zat yang sebanding dengan 1 mol elektron = 6,02 x 1023 e- 1 gek ~ 1 mol e
-Jika arus listrik 1F dialirkan ke dalam larutan AgNO3 maka akan diendapkan 1gram ekivalen Ag.
1 mol e- ~ 1 mol Ag ~ 1 gram ekivalen Ag
Untuk mendapatkan 1 gram ekivalen Ag diperlukan 1 mol e- 1 gram ekivalen Ag = 1 mol e- = 1 mol Ag = 108 gram Ag
Jika listrik 1 F dialirkan ke dalam larutan CuSO4 maka akan diendapkan 1 gek Cu.
Cu2+(aq) + 2e- → Cu (s)
2 mol e- ~ 1 mol Cu 1 mol e- ~ ½ mol Cu
1 gek Cu = 1 mol e- = ½ mol Cu = (1/2 x 64) gram Cu = 32 gram Cu
Q = banyaknya arus listrik yang dialirkan (Coulomb) = I . t (Ampere.detik) Muatan 1 e- = 1,6 x 10-19 C
Muatan 1 mol e- = (6,02 x 1023) x (1,6 x 10-19) C ≈ 96 500 C
= 1 F
Hukum Faraday II : Massa dari bermacam-macam zat yang timbul pada elektrolisis dengan jumlah listrik sama, berbanding lurus dengan massa ekivalennya.
m1 : m2 = e1 : e2 m = massa zat (g)
m1 : m2 = : e = massa ekivalen zat
Ar = massa molekul relatif
2.7. Elektrolisis Aluminium
Arus listrik dapat digunakan untuk memaksa berlangsungnya reaksi reduksi-oksidasi (redoks) yang tidak spontan, yaitu penguraian elektrolit menjadi unsur-unsurnya.Peristiwa penguraian suatu elektrolit oleh arus listrik disebut elektrolisa.Berkat metode elektrolisa yang ditemukan oleh Sir Humphry Davy pada awal abad ke-19 dan kemudian dikembangkan oleh Michael Faraday, umat manusia dapat memperoleh logam-logam serta unsur-unsur halogen yang tidak dijumpai di alam dalam bentuk unsur bebasnya.
Elektrolisa khususnya bermanfaat untuk produksi logam dengan kecenderungan ionisasi tinggi, misalnya aluminium. Produksi aluminium di industri dengan proses elektrolisa dicapai tahun 1886 secara independen oleh penemu berkebangsaan Amerika Charles Martin Hall (1863-1914) dan penemu berkebangsaan Perancis Paul Louis Toussaint Héroult (1863-(1863-1914) pada waktu yang bersamaan. Keberhasilan proses elektrolisa ini karena penggunaan lelehan Na3AlF6
sebagai pelarut bijih (aluminium oksida; alumina; Al2O3). Sebagai syarat berlangsungnya proses
elektrolisa, ion harus dapat bermigrasi ke elektroda. Salah satu cara yang paling jelas agar ion mempunyai mobilitas adalah dengan menggunakan larutan dalam air. Namun, dalam kasus elektrolisa Al2O3, larutan dalam air jelas tidak tepat sebab air lebih mudah direduksi daripada ion
aluminium sebagaimana ditunjukkan di bawah ini:
Al + 3e →Al potensial elektroda normal = -1,662 V
Metoda lain adalah dengan menggunakan lelehan garam. Masalahnya Al2O3 meleleh
pada suhu sangat tinggi yaitu 2050 °C dan proses elektrolisa pada suhu setinggi ini jelas tidak realistis. Namun, titik leleh campuran Al2O3 dan Na3AlF6 adalah sekitar 1000 °C dan suhu ini
mudah dicapai.Prosedur detailnya adalah bijih aluminium, bauksit mengandung berbagai oksida logam sebagai pengotor.Bijih ini diolah dengan alkali, dan hanya oksida aluminium yang amfoter yang larut.Bahan yang tak larut disaring dan CO2 dialirkan ke filtratnya untuk
menghasilkan hidrolisis garamnya kemudian Al2O3 akan diendapkan.
Al O ( s) + 2OH ( aq) →2AlO( aq) + H O( l)
2CO + 2AlO ( aq) + ( n + 1) H O( l) →2HCO ( aq) + Al O nH O( s)
Al2O3 yang didapatkan dicampur dengan Na3AlF6 dan kemudian garam lelehnya
dielektrolisa.Reaksi dalam sel elektrolisa rumit.Kemungkinan besar awalnya Al2O3 bereaksi
dengan Na3AlF6 dan kemudian reaksi elektrolisa berlangsung.
Al O + 4AlF →3Al OF + 6F
Reaksi elektrodanya adalah sebagai berikut:
Elektroda negatif :2Al OF + 12F + C→4AlF + CO + 4e
Elektroda positif :AlF + 3e →Al + 6F
Reaksi total :2Al O + 3C→ 4Al + 3CO
aluminium sangat baik dan selain itu, harganya juga tidak terlalu mahal. Namun, harus diingat bahwa produksi aluminium membutuhkan arus listrik dalam jumlah sangat besar
2.7.1. Reaksi Utama Elektrolisis Aluminium
Reaksi keseluruhan pada industri elektrolisis alumina dengan menggunakan anoda karbon adalah sebagai berikut :
2Al2O3 (l) + 3C (s) 4 Al (l) + 3CO2 (g)...(4.12)
Reaksi ini berlangsung pada temperatur sekitar 977oC, beda potensial 1,18 volt. Mekanisme reaksi yang paling sering terjadi adalah reduksi Al2O3 secara langsung dengan reaksi
:
Al2O3 AlO2- + AlO+
AlO2 Al 3++ 2O
2-Reaksi katodik : 2Al3+ + 6 e- 6 Al
2.8. Efisiensi Arus
Efisensi arus atau (Current Efficiency, CE) merupakan persentase perbandingan antara jumlah metal yang dihasilkan dari pot dengan jumlah metal yang dihasilkan secara teoritis.
Current Efficiency (CE) =
Dalam sel elektrolisis modern, rata-rata CE adalah 95 – 96%, hal ini tergantung kepada prosedur teknis yang dilakukan. Besarnya CE dapat dipengaruhi oleh beberapa hal antara lain:
a. Temperatur operasi
Temperatur operasi harus dijaga karena akan sangat mempengaruhi CE. Bila temperatur operasi terlalu tinggi maka akan mempercepat laju reaksi kabut metal atau reaksi balik, namun bila temperatur operasi terlalu rendah maka bath tidak dapat melarutkan Al2O3 sehingga Al2O3
menjadi lumpur.
b. Kadar alumina
Banyaknya metal yang dihasilkan tergantung pada banyaknya kadar Al2O3 di dalam bath,
kadar Al2O3 dalam bath harus tetap berada pada 1 – 3%.
c. Rapat arus
Rapat arus yang tinggi akan menaikkan CE, karena kuantitas metal (aluminium) hilang yang terlarut ke bath tidak meningkat secara proporsional terhadap rapat arus. Persamaan
dimana : = efisiensi arus (%)
m = jarak anoda - katoda (cm)
d = rapat arus (A/cm2)
k = konstanta
k = 0,698 :bath kelebihan AlF3
0,550 :bath netral AlF3
0,388 :bath kelebihan NaF
2.9. Efek Anoda (Anode effect)
Anode effect sering terjadi pada proses elektrolisa dari garam logam. Anode effect terjadi
saat kekurangan alumina (Al2O3) di dalam larutan elektrolit (Na3AlF6). Tanda fisiknya adalah
timbulnya gelembung gas CO2 pada bagian bawah anoda, yang menandakan menurunnya
kemampuan elektrolit (Na3AlF6) untuk membasahi anoda. Akhirnya gelembung-gelembung gas
CO2 tersebut akan bergabung untuk membentuk suatu lapisan tunggal yang akan menutupi
sebagian besar permukaan anoda. Dengan sumber arus listrik yang tetap, beda potensial listrik akan naik lebih dari 30 volt. Hal ini disebabkan oleh gelembung gas CO2 yang besar dan akan
Beda tegangan listrik akan naik perlahan seiring dengan kurangnya alumina (Al2O3)
sampai suatu harga konsentrasi kritis tertentu yang berkisar antara 1 % - 2 % berat, tergantung dari rapat arus, suhu, konveksi larutan elektrolit (Na3AlF6), komposisi larutan elektrolit
(Na3AlF6) , dan bentuk dari anoda. Anoda effect dapat juga terjadi saat konsentrasi alumina