HALAMAN PENGESAHAN
LAPORAN RESMI PRAKTIKUM KIMIA DASAR
Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi
Kelompok :12 (Dua Belas)
Nama :1 Muhammad Dary Dzaky (1404015185)
2. Ina Subiyanti (1404015187)
3. Muhammad Rafii Nur Fauzan (1404015189)
4. Ahmad (1404015191)
5. M. Haris Hamonangan (1404015193) 6. John Peterson Serius
Parmonangan Sihotang (1404015195)
Program Studi :Kehutanan
Mengetahui, Asisten Pendamping
Samarinda,25 November 2014 Tim Penyusun
Anindya Marsabella Rosiarto NIM. 1104015013
BAB I PENDAHULUAN
1.1. Latar belakang
Dalam kehidupan sehari-hari kita sering melihat reaksi-reaksi kimia dengan kecepatan yang berbeda-beda. Ada reaksi yang berlangsung sangat cepat seperti petasanyang meledak, ada juga reaksi yang berlangsung sangat lambat seperti pengkaratan besi.
Reaksi kimia adalah proses perubahan zat reaksi menjadi produk. Seiring dengan bertambahnya waktu reaksi, maka jumlah pereaksinya akan semakin sedikit, sedangkan produk semakin banyak. Laju reaksi dapat dinyatakan sebagai laju perubahan konsentrasi per satuan waktu. Waktu yang digunakan dapat berupa detik, menit, jam, hari, bulan, maupun tahun, tergantung pada lamanya reaksi berlangsung.
Laju reaksi dapat dipengaruhi oleh beberapa faktor. Diantaranya yaitu konsentrasi, suhu, luas permukaan, tekanan dan katalis.
Oleh karena itu percobaan ini dilakukan untuk mengetahui laju reaksi kimia yang ada dalam kehidupan dan bagaimana perlakuan untuk meningkatkan laju reaksi.
1.2. Tujuan percobaan
Untuk mengetahui faktor-faktor yang mempengaruhi laju reaksi
Untuk mengetahui pengaruh konsentrasi dan suhu terhadap laju reaksi
BAB II
TINJAUAN PUSTAKA
Cabang ilmu kimia yang khusus mempelajari tentang laju reaksi disebut kinetikia kimia. Tujuan utama kinetika kimia ialah menjelaskan bagaimana laju bergantung pada konsentrasi reaktan dan mengetahui mekanisme suatu reaksi berdasarkan pengetahuan tentang laju reaksi yang diperoleh dari eksperimen (oxtoby). Laju reaksi dapat didefinisikan sebagai perubahan konsentrasi pereaksi atau produk per satuan waktu. Artinya terjadi pengurangan konsentrasi pereaksi atau pertambahan konsentrasi produk tiap satuan waktu. (Keenan, 2004) .
A + B 3C + D Persamaan laju reaksinya yaitu v = k [A] [B]2. Dimana v adalah laju reaksi, k adalah konstanta laju reaksi dan [A] [B] adalah konsentrasi dari zat yang bereaksi. Nilai pangkat 2 menyatakan koefisien zat ataupun orde dari reaksi tersebut. Orde reaksi berarti menjelaskan tentang tingkat reaksi atau hubungan antara konsentrasi dengan kecepatan. Laju reaksi memiliki satuan mol / liter detik (Petrucci,2008).
Macam-macam orde reaksi yaitu :
1. Orde reaksi 0 yaitu laju reaksi yang tidak bergantung pada konsentrasi. Persamaan laju reaksi yang berorde 0 yaitu v = k [A]0
2. Orde reaksi 1 yaitu laju reaksi yang berbanding lurus dengan konsentrasi pereaksi. Jika konsentrasi dinaikkan dua kali, maka laju reaksinya pun akan naik dua kali lebih cepat dari semula, dst.
Persamaan laju reaksi yaitu v = k [A]
Gambar 2. Orde reaksi 1
3. Orde reaksi 2 yaitu pada reaksi orde dua, kenaikan laju reaksi akan sebanding dengan kenaikan konsentrasi pereaksi pangkat dua. Bila konsentrasi pereaksi dinaikkan dua kali maka laju reaksinya akan naik menjadi empat kali lipat dari semula.
Gambar 3. Orde reaksi 2
Dengan demikian, jika konsentrasi suatu zat dinaikkan a kali, maka laju reaksinya menjadi b kali sehingga orde reaksi terhadap zat tersebut adalah : ax = b. Dimana x = orde reaksi (Petrucci,2008).
Persamaan laju reaksi mempunyai dua penerapan utama, yaitu penerapan praktis dan penerapan teoritis. Dikatakan untuk penerapan praktis adalah dimana telah diketahui persamaaan laju reaksi dan konstanta laju reaksi sehingga dapat diramalkan laju reaksi dari komposisi campuran. Sedangkan penerapan teoritis adalah dimana laju persamaan digunakan untuk menentukan mekanisme reaksi (Atkins,2007).
Laju reaksi sebanding dengan konsentrasi reaktan suatu pangkat. Contohnya laju reaksi sebanding dengan konsentrasi reaktan A dan B, sehingga :
Koefisien k disebut konstanta laju reaksi yang tidak bergantung pada konsentrasi tetapi bergantung pada temperatur. Persamaan sejenis ini yang ditentukan secara eksperimen disebut hukum laju reaksi. Secara formal, hukum laju reaksi adalah persamaan yang menyatakan laju reaksi, dimana v sebagai fungsi dari konsentrasi semua spesies yang ada termasuk produknya (Atkins, 2007).
Laju reaksi adalah laju pengurangan konsentrasi molar pereaksi atau laju pertambahan konsentrasi molar hasil reaksi dalam satuan waktu. Laju reaski menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan setiap detik. Reaksi kimia berlangsung dengan laju yang berbeda-beda.(Purba, 2007)
Hubungan kuantitatif antara konsetrasi pereaksi dengan laju reaksi dinyatakan dalam suatu persamaan, yaitu persamaan laju reaksi. Untuk reaksi :
ma + nb → pc + qd Persamaan laju reaksinya adlah v = k[A]x [B]y
Dimana :
v : kecepatan laju reaksi k : tetapan laju reaksi [A] : konsentrasi A [B] : konsentrasi B
x : orde reaksi terhadap pereaksi A y : orde reaksi terhadap pereaksi B (Purba, 2007)
Orde reaksi menyatakan besarnya pengaruh konsentrasi pereaksi pada laju reaksi. beberapa di antaranya adalah :
1. Orde nol
Reaksi dikatakan berorde nol terhadap salah satu satu pereaksinya apabila perubahan konsentrasi pereaksi tersebut tidak mempengaruhi lau reaksi. Persamaan laju reaksi yang berorde 0 yaitu v = k [A]0.
2. Orde satu
Suatu reaksi dikatan berorde satu terhadapa salah satu pereaksinya jika laju reaksi berbanding lurus dengan konsentrasi pereaksi tersebut. Jika konsentrasi pereaksi tersebut dilipat-tigakan maka laju reaksi akan menjadi 31 atau tiga kalinya. Persamaan laju reaksi yaitu v = k [A] .
3. Orde dua
Suatu reaksi dikatakan berorde dua terhadap salah satu pereaksi jika aju reaksi merupakan pangkat dua dari konsentrasi pereaksi itu. Apabila konsentasi zat itu dilipat-tigakan, maka laju pereaksi akan menjadi 32 atau 9 kali lebih besar.
Laju reaksi terlihat dari perubahan konsentrasi molekul reaktan atau konsentrasi molekul produk terhadap waktu. Laju reaksi tidak tetap melainkan berubah terus-menerus seiring dengan perubahan konsentrasi. Faktor-faktor yang mempengaruhi laju reaksi adalah sebagai berikut :
1. Luas permukaan
Luas permukaan zat yang digunakan untuk bereaksi mempengaruhi kecepatan laju reaksi. Suatu zat yang berbentuk serbuk lebih cepat bereaksi daripada zat yang berbentuk
kepingan. Hal ini karena zat yag berbentuk serbuk mempunyai bidang sentuh yang lebih luas sehingga tumbukan akan lebih sering terjadi. Luas permukaan total zat akan semakin bertambah bila ukurannya diperkecil. Semakin halus suatu zat maka laju reaksi akan semakin besar karena luas permukaan yang bereaksi semakin besar.
2. Konsentrasi
Suatu zat yang bereaksi mempunyai konsentrasi yang berbeda-beda. Konsentrasi menyatakan pengaruh kepekatan atau zat yang berperan dalam proses reaksi. Semakin besar nilai konsentrasi, maka laju reaksi akan semakin cepat. Hal ini dikarenakan zat yang konsentrasinya besar mengandung jumlah partikel yang lebih banyak, sehingga partikel-partikelnya tersususn lebih rapat dibanding zat yang konsentrasinya rendah. Partikel yang susunannya lebih rapat, akan sering bertumbukan dibanding dengan partikel yang susunannya renggang, sehingga kemungkinan terjadinya reaksi makin besar.(Utami, 2009)
3. Temperatur
Setiap partikel selalu bergerak. dengan menaikkan temperatur, energi gerak atau energi kinetik partikel bertambah, sehingga tumbukan lebih sering terjadi. dengan frekuensi tumbukan yang semakin besar, maka kemungkinan terjadiya tumbukan efektif yang mampu enghasilkan reaksi juga semakin besar.
Suhu atau temperatur juga mempengaruhi energi potensial suatu zat. Zat-zat yang energi potensialnya kecil, jika bertumbukan akan sukar menghasilkan tumbukan efektif. Hal ini karena zat-zat tersebut tidak mampu melampui energi aktivasi. Dengan menaikkan suhu, maka hal ini akan memperbesar energi potensial sehingga ketika bertumbukan akan menghasilkan enrgi.(Utami, 2009)
Archenius, seorang ahli kimia Swedia mengemukakan persamaan empiriknya pada tahun 1889 sebagai berikut:
k = A. dengan: k = tetapan laju
A = faktor Archienius, faktor pra eksponensial = energi pengaktifan
R = tetapan gas T = temperatur absolut e = 2,71828
Jika persamaan dikalikan dengan log, maka diperoleh log k = log A
log k = log A
-Grafik log k terhadap 1/T menghasilkan garis lurus dengan slope =- dan intersep. (Supardi, 2008)
4. Katalis
Katalis adalah suatu zat yang berfungsi mempercepat terjadinya reaksi, tetapi pada akhir reaksi dapat diperoleh kembali. Fungsi katalis adalah menurunkan enrgi aktivasi sehingga jika ke dalam suatu reaksi ditambahkan katalis, maka reaksi akan lebih mudah terjadi. Hal ini disebabkan karena zat-zat yang bereaksi akan lebih mudah melampaui energi aktivasi. (Budi Utami, 2009). Katalis adalah zat yang mempengaruhi laju reaksi yang pada umumnya jumlahnya tidak diubah oleh reaksi keseluruhan. Komposisi kimia katalis tidak berubah pada akhir reaksi. Katalis diperlukan dalam jumlah sedikit untuk suatu
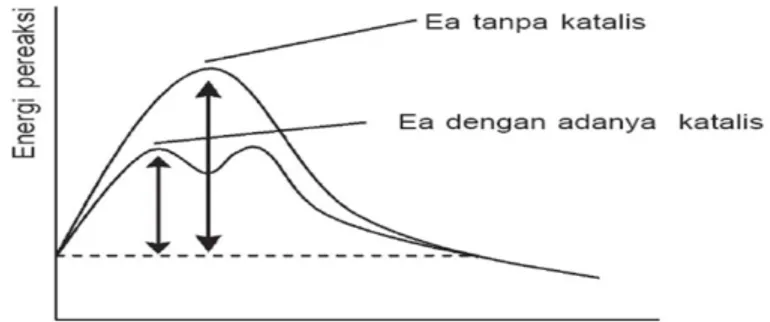
reaksi, tidak mempengaruhi harga tetapan kesetimbangan, tidak memulai suatu reaksi tetapi hanya mempengaruhi laju reaksi, dan bekerjanya spesifik. Katalis yang meningkatkan laju reaksi disebut katalis positif sedang katalis yang menurunkan laju reaksi disebut katalis negatif. Katalis bekerja dengan optimum pada temperatur tertentu dan dapat diracuni oleh zat tertentu dalam jumlah yang sedikit yang disebut racun katalis. Kehadiran katalis dalam suatu reaksi dapat memberkan ekanisme alternatif untuk menghasilkan hasil reaksi dengan energi yang lebih rendah dibandingkan dengan reaksi yang tanpa katalis. Energi pengaktifan yang lebih rendah menunjukkan bahwa jumlah bagian dari molekul-molekul yang memiliki energi kinetik cukup untuk bereaksi jumlahnya lebih banyak. Jadi kehadiran katalis adalah meningkatkan adanya tumbukan yang efektif, yang berarti juga memperbesar laju reaksi. (Supardi, 2008)
Reaksi kimia terjadi karena adanya tumbukan yang efektif antara partikel-partikel zat yang bereaksi. Tumbukan efektif adalah tumbukan yang mempunyai energi cukup untuk memutuskan ikatan-ikatan pada zat yang bereaksi. Sebelum suatu tumbukan terjadi, partikel-partikel memerlukan suatu energi minimum yang disebut energi pengaktifan atau energi aktivasi (Ea). Energi pengaktifan atau energi aktivasi adalah energi minimum yang diperlukan untuk belangsungnya suatu reaksi. Ketika reaksi sedang berlangsung akan terbentuk zat kompleks teraktivasi. zat kompleks teraktivasi berada pada puncak energi. jika reaksi berhasil, maka zat kompleks etraktivasi akan terurai menjadi zat hasil reaksi. (Utami, 2009)
Katalisator adalah suatu zat yang ditambahkan untuk mempercepat laju reaksi. Katalisator tidak mengalami perubahan kekal dalam reaksi namun mungkin terlibat dalam reaksi. Katalis mempercepat suatu reaksi dengan menurunkan energi aktivasi, namun
tidak mengubah entalpi reaksi. Katasis ditambahkan pada zat dalam jumlah yang sedikit dan umumnya bersifat spesifik untuk setiap reaksi (Arsyad, 2009).
Jadi, katalis tidak muncul dalam laju persamaan kimia secara keseluruhan, tetapi kehadirannya sangat mempengaruhi hukum laju, memodifikasi dan mempercepat lintasan yang ada. Katalis menimbulkan efek yang nyata pada laju reaksi, meskipun dengan jumlah yang sangat sedikit. Dalam kimia industri, banyak upaya untuk menemukan katalis yang akan mempercepat reaksi tertentu tanpa meningkatkan timbulnya produk yang tidak diinginkan (Oxtoby, 2010).
Gambar 4. Hubungan energi pereaksi terhadap penggunaan katalis Sebelum terjadi reaksi, molekul pereaksi harus saling bertumbukan membentuk suatu molekul kompleks aktif, yang kemudian berubah menjadi hasil reaksi (Produk). Energi yang di butuhkan untuk membentuk kompleks aktif ialah yang dinamakan energi aktivasi (Sukarjo, 2009).
Berdasarkan hasil pengamatan, ada dua faktor yang mempengaruhi keefektifan suatu molekul untuk bertumbukan, yaitu :
1. Hanya molekul yang lebih energetik dalam campuran reaksi akan menghasilkan reaksi sebagai hasil tumbukan.
2. Probabilitas tumbukan untuk menghasilkan reaksi bergantung pada orientasi molekul yang bertumbukan (Petrucci,2008).
Percobaan pengaruh konsentrasi dan suhu ini bersifat semi kualitatif yang dapat digunakan untuk menentukan pengaruh perubahan konsentrasi dan pengaruh suhu pada laju reaksi. Reaksi yang diamati adalah reaksi pengendapan koloid belerang yang terbentuk apabila tiosulfat direaksikan dengan asam. Yang diukur dalam percobaan ini adalah waktu yang dperlukan agar koloid belerang mencapai suatu intensitas tertentu. Reaksi pengandapan belereng dapat ditulis sebagai berikut :
S2O32-(aq) + 2H+(aq) H2O(l) + SO2(g) + S(s) (Basuki, Atastina Sri, dan Setijo Bismo, 2003
BAB III METODOLOGI
3.1. Waktu dan Tempat Praktikum
Hari/Tanggal : Kamis, 6 November 2104
Pukul : 15.30-16.30 WITA
Tempat Praktikum : Laboratorium Kimia Hasil Hutan
Fakultas : Kehutanan, Universitas Mulawarman
3.2. Alat dan Bahan 3.2.1. Alat-alat 1. Gelas Kimia 100 ml 2. Gelas ukur 3. Pipet Tetes 4. Pipet Mohr 5. Pengaduk Plastik
6. Stopwatch
7. Tallysheet 3.2.2. Bahan-bahan
1. Larutan Na2S2O3 ( Larutan Tiusulfat )
2. Larutan HCl Pekat ( Larutan Asam Klorida )
3. Aquades.
3.3. Prosedur Percobaan
1. Di tempatkan 50 ml Na2S2O3 0,2 ke dalam gelas ukur yang mempunyai alas rata
2. Ditempatkan gelas ukur diatas kertas putih rutan tiosulfat tepat diatas tanda silang
hitam
3. Ditambahkan 2 ml HCL 1 M dan nyalakan stopwatch. kemudian aduk larutan sampai
warna keruh tanda silang hitam tidak terlihat lagi dari atas
4. Dicatat waktu yang dibutuhkan sampai tanda silang hitam tidak dapat terlihat lagi dari
atas
BAB IV
HASIL DAN PEMBAHASAN
4.1.Hasil Pengamatan
(Tabel 6. Hasil percobaan dengan berbagai volume larutan untuk menentukan laju reaksi)
System Na2S2O3Volume Volume H2O Volume HCL Waktu(detik) 1 / waktu(detik)
1 50 0 2 28 0,0357 2 40 10 2 29 0,0344 3 30 20 2 30 0,0333 4 20 30 2 21 0,0476 5 10 40 2 183 0,0054 6 5 45 2 433 0,0023 4.2. Pembahasan
Pada pengamatan yang kami lakukan pada tanggal 6 November 2014 jam 15.30 – 16.30 dapat kami simpulkan bahwa semakin sedikit volume tiosulfat maka waktu yang dibutuhkan untuk sampai kondisi hilangnya tanda (x) akan semakin lama. Warna cairan akan berubah pada saat waktu percobaan pertama menunjukkan 21 detik sampai tanda silang hitam tidak terlihat dan membutuhkan waktu 433 detik pada percobaan keenam.
1. Hasil percobaan pertama sebanyak 50 ml Na2S2O3 ditambahkan 2 ml HCL pekat 1 M
mampu membuat tanda silang hitam tidak terlihat lagi dari atas dalam waktu 21 detik dengan laju reaksi 0,0357
2. Hasil percobaan kedua sebanyak 40 ml Na2S2O3 ditambahkan 10 ml air aquades dan
2 ml HCL pekat mampu membuat tanda silang hitam tidak terlihat lagi dari atas dalam waktu 29 detik dengan laju reaksi 0,0344
3. Hasil percobaan ketiga sebanyak 30 ml Na2S2O3 ditambahkan 20 ml air aquades dan
2 ml HCL pekat mampu membuat tanda silang hitam tidak terlihat lagi dari atas dalam waktu 30 detik dengan laju reaksi 0,0333
4. Hasil percobaan keempat sebanyak 20 ml Na2S2O3 ditambahkan 30 ml air aquades
dan 2 ml HCL pekat mampu membuat tanda silang hitam tidak terlihat lagi dari atas dalam waktu 21 detik dengan laju reaksi 0,0476
5. Hasil percobaan kelima sebanyak 10 ml Na2S2O3 ditambahkan 40 ml air aquades dan
2 ml HCL pekat mampu membuat tanda silang hitam tidak terlihat lagi dari atas dalam waktu 183 detik dengan laju reaksi 0,0054
6. Hasil percobaan keenam sebanyak 5 ml Na2S2O3 ditambahkan 45 ml air aquades dan
2 ml HCL pekat mampu membuat tanda silang hitam tidak terlihat lagi dari atas dalam waktu 433 detik dengan laju reaksi 0,0023
BAB V PENUTUP
5.1. Kesimpulan
1. Faktor-faktor yang mempengaruhi laju reaksi adalah :
Suhu
Luas permukaan
Konsentrasi
Tekanan
Katalis
2. Dari percobaan ini didapat pengaruh konsentrasi dan suhu.
3. Pengaruh konsentrasi yaitu apabila konsentrasi suatu reaktan semakin besar, maka
laju reaksi juga meningkat.
4. Pengaruh suhu yaitu apabila suhu dinaikkan maka laju suatu reaksi juga meningkat.
Sebaiknya dalam setiap percobaan laju reaksi menggunakan persepsi tingkat kekeruhan larutan yang sama, meskipun tanda silang tidak benar-benar tak terlihat. Sehingga dapat mengefisiensikan waktu dan hasil yang lebih akurat.
LAMPIRAN
Berikut ini merupakan dokumentasi dari hasil percobaan “Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi” yang dilaksanakan pada hari Kamis tanggal 06 November 2014 di Laboratorium Kimia Hasil Hutan, Fakultas Kehutanan, Universitas Mulawarman, Samarinda
1. Gambar dibawah ini merupakan proses pengukuran larutan Natrium tiosulfat dengan menggunakan gelas ukur
(Lampiran 19. proses pengukuran larutan Natrium tiosulfat) 2. Proses penuangan larutan Natrium Tiosulfat kedalam Gelas Piala
(Lampiran 20. penuangan larutan Natrium Tiosulfat)
3. Proses pengukuran aquades dengan menggunakan gelas ukur
(Lampiran 21. pengukuran aquades)
5. Proses penambahan HCl pekat kedalam gelas piala
(Lampiran 23. penambahan HCl pekat)
6. Aduk dan hitunglah lama waktu yang diperlukan hingga berubah menjadi keruh menggunakan stopwatch
DAFTAR PUSTAKA
Anonim.2008.http//www.smkn1bandung.com/adaptif-larutan-asam-basa.tangerang (diakses pada tanggal 29 oktober 2014 )
Anonim.2009.http://www.kimialedge.org/kimia-dasar-asam-basa ( diakses pada tanggal 29 oktober 2014 )
Anonim.2010.http://www.chem-is-try.org/materi_kimia/kimia_dasar/asam_dan_basa/sifat-sifat-asam-basa-dan-garam/ (diakses pada tanggal 29 oktober 2014 )
Anonim.20111.http://sitirachmawati.wordpress.com/2011/12/14/pengenalan-ilmu-kimia/ (diakses pada tanggal 20 Oktober 2014)
Anonim.20112 .https://benzenaddict.wordpress.com/2011/05/30/pengenalan-alat-alat-laboraturium/(diakses pada tanggal 20 Oktober 2014)
Anonim.2012.http://fadliqnoze.blogspot.com/2012/03/laporan-pengenalan-alat-alat.html(diakses pada tanggal 20 Oktober 2014)
Anonim.2013d .http://kartiakaputrisanti.wordpress.com/2013/08/21/laporan-tetap-praktikum-kimia/(diakses pada tanggal 29 oktober 2014 )
Anonim.2013e .http://dsikreatif.blogspot.com/2013/11/pengenalan-alat-alat-laboratorium.html(diakses pada tanggal 20 Oktober 2014)
Anonim.2014a .http://adlanfadhillah.blogspot.com/2014/01/laporan-penelitian-asam-basa.html (diakses tanggal 29 oktober 2014)
Anonim.2014b.http://kasandika.blogspot.com/2014/05/alat-kerja-laboratorium.html
Antara, I K. G., I W. Budiarsa Suyasa, dan A. A. Bawa Putra, 2008, Kajian Kapasitas dan Efektivitas Resin Penukar Anion untuk Mengikat Klor dan Aplikasinya pada Air, Jurnal Kimia 2. Vol. 2 No. 87.
Badawi, Rachmat, Ismulawardi, Agoes Noegraha, dan Subroto, 2010, Pemanfaatan Grafit Pensil sebagai Elektrode Selektif Ion Bermembran AgCl/Ag2S untuk Analisa Ion Klorida, Fakultas Farmasi Universitas Airlangga, Surabaya.
Keenan Kleinfelter, Wood. 2005. Kimia untuk Universitas Jilid 1 . Jakarta : Erlangga
Muslim.f. dan Suhendar.c.2008 kimia unsur SMK kelompok teknologi dan Bandung. Grafindo media pratama.
Khopkhar, SM., 2010, Konsep Dasar Kimia Analitik. UI Press, Jakarta.
Rivai. H., 2008, Asas Pemeriksaan Kimia, Universitas Indonesia Press, Jakarta.
Soebiyanto, Nur Hidayati, Dewi Sulistyawati, 2005, Konsentrasi Indikator Terkontrol Pada Argentometri Mohr, Fakultas Ilmu Kesehatan Universitas Setia Budi, Surakarta. Sugiarto Teguh dan Eny.I.2008 ilmu pengetahuan alam , Jakarta . PT Widya Pustaka
Vogel, 2005, Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro Jilid I, PT. Kalman Media Pustaka, Jakarta.
Underwood, A.L, dan Day, R.A., 2007, Analisis Kimia Kuantitatif, Erlangga, Jakarta