i
EFEK HEPATOPROTEKTIF EKSTRAK ETANOL 50% DAUN JARONG (Stachytarpheta indica (L.) Vahl.) TERHADAP AKTIVITAS ALANIN AMINOTRANSFERASE DAN ASPARTATE AMINOTRANSFERASE
PADA TIKUS JANTAN GALUR WISTAR TERINDUKSI KARBON TETRAKLORIDA
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
oleh :
Hosianna Yossi Agustina
NIM: 128114060
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
ũ
Serahkanlah kuatirmu kepada Tuhan,
maka Ia akan memelihara Engkau!
Ū
(Mazmur 55:23a)
ũ
Tetaplah berdoa.
Ū
(1 Tesalonika 5:17)
Kupersembahkan tulisan kecil ini untuk, Tuhan Yesus Kristus atas kasih dan anugerah-Nya dalam hidupku Papah, Mamah, Kakak, dan Adikku yang selalu memberikan cinta dan dukungannya Serta Almamaterku Universitas Sanata Dharma Yogyakarta
vii
PRAKATA
Puji Syukur kepada Tuhan atas kasih, anugerah, dan damai sejahtera
yang selalu tercurah dan melimpah, sehingga penulis dapat menyelesaikan
skripsi yang berjudul “EFEK HEPATOPROTEKTIF EKSTRAK ETANOL 50% DAUN JARONG (Stachytarpheta indica (L.) Vahl.) TERHADAP AKTIVITAS ALANIN AMINOTRANSFERASE DAN
ASPARTATE AMINOTRANSFERASE PADA TIKUS JANTAN
GALUR WISTAR TERINDUKSI KARBON TETRAKLORIDA” dengan baik. Skripsi ini disusun sebagai salah satu syarat memperoleh gelar Sarjana
Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa dalam keseluruhan proses pelaksanaan dan
penyusunan skripsi, terdapat bantuan dari berbagai pihak sehingga meskipun
terdapat beberapa kendala namun seluruhnya dapat diatasi dengan baik. Oleh
karena itu, tanpa mengurangi rasa hormat, penulis hendak menyampaikan
ucapan terima kasih kepada :
1. Ibu Aris Widayati, M.Si., Ph.D., Apt., selaku Dekan dan Ibu Dr. Sri
Hartati Yuliani, Apt. selaku Ketua Program Studi Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Bapak Prof. Dr. C.J. Soegihardjo, Apt., selaku Dosen Pembimbing, atas
segala arahan, dukungan, motivasi, nasihat, pengertian, kesabaran, dan
ketulusannya selama membimbing penulis dalam penelitian dan
viii
3. Ibu drh. Sitarina Widyarini, MP., Ph.D., selaku Dosen Pembimbing, atas
segala arahan, dukungan, motivasi, nasihat, pengertian, kesabaran, dan
ketulusannya selama membimbing penulis dalam penelitian dan
penyusunan naskah skripsi.
4. Ibu Phebe Hendra, M.Si., Ph.D, Apt., selaku Dosen Penguji skripsi atas
bantuan dan masukan kepada penulis demi kemajuan skripsi.
5. Ibu Dr. Yustina Sri Hartini, M.Si, Apt. selaku Dosen Penguji skripsi atas
bantuan dan masukan kepada penulis demi kemajuan skripsi.
6. Ibu Agustina Setiawati, M.Sc., Apt., selaku Kepala Penanggung Jawab
Laboratorium Fakultas Farmasi yang telah memberi izin dalam
penggunaan fasilitas laboratorium Farmakologi-Toksikologi,
Biofarmasetika-Farmakokinetika, Anatomi-Fisiologi,
Farmakognosi-Fitokimia, Imunologi, dan Kimia Organik demi kepentingan penelitian ini.
7. Bapak Yohanes Dwiatmaka, M.Si., atas bantuannya dalam determinasi
tanaman Stachytarpheta indica (L.) Vahl.
8. Komite Etik Universitas Gajah Mada, atas izin penggunaan hewan uji
dalam penelitian.
9. Bapak Heru selaku laboran Laboratorium Farmakologi-Toksikologi dan
Laboratorium Biofarmasetika-Farmakokinetika, Bapak Supardjiman
selaku laboran Laboratorium Imunologi, Bapak Kayatno selaku laboran
Laboratorium Anatomi-Fisiologi, Bapak Wagiran selaku laboran
Laboratorium Farmakognosi-Fitokimia, Bapak Kunto selaku laboran
ix
Laboratorium Kebun Tanaman Obat atas kerja sama dan segala bantuan
selama penulis melakukan penelitian di Laboratorium.
10.Papah, Mamah, Kakakku Ria “rehe”, dan Adikku Ijoy “konjoy” yang senantiasa ada untuk mendukung, mendoakan, memberi nasihat, dan selalu
memberikan cinta kasih sehingga penulis dapat menyelesaikan skripsi ini
dan melewati berbagai rintangan yang ada.
11.Rekan-rekan Tim Stachytarpheta indica : Etheldreda Everest Norutama,
Jonathan Wijaya Setiawan, dan Bartolomeus Widiasta yang telah setia dan
rela hati dalam membantu penulis dalam setiap dinamika penelitan dan
penyusunan skripsi.
12.Keluarga PMK Apostolos tercinta : Imas, Cece, Nenu, Lika, Dovan, Yere,
Priscill, Kiki, dll., atas doa, motivasi, cinta, dan tawa yang tiada habis
menyertai perjuangan penulis.
13.Patner segala tugas praktikum serta diskusi selama dinamika perkuliahan :
Valent, Agnes, Pho, Domo, Feli, Gita, Cik Fel.
14.Teman luar biasa penulis : Oyot, Dora, Dewi, dan Vitha yang selalu
memberikan semangat dan menjadi rekan berbagi suka dan duka.
15.Teman-teman FSM B 2012 dan FST A 2012 atas kebersamaannya,
khususnya angkatan 2012 Fakultas Farmasi Universitas Sanata Dharma.
16.Semua pihak yang telah membantu dalam penyusunan skripsi ini yang
tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa setiap manusia pasti memiliki keurangan.
x
yang membangun untuk kemajuan di masa mendatang. Penulis juga berharap
semoga tulisan ini dapat bermanfaat bagi perkembangan ilmu pengetahuan,
terutama bidang farmasi, maupun masyarakat.
Yogyakarta, Desember 2015
xi
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERSETUJUAN PUBLIKASI KARYA ILMIAH ... vi
PRAKATA ... vii
DAFTAR ISI ... xi
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... ... xviii
DAFTAR LAMPIRAN ... ... xix
INTISARI ... xx ABSTRACT ... xxi BAB I PENGANTAR ... 1 A. Latar Belakang ... 1 1. Perumusan masalahan ... 3 2. Keaslian penelitian ... 3 3. Manfaat penelitian ... 4 B. Tujuan Penelitian ... 4 1. Tujuan umum ... 4 2. Tujuan khusus ... 4
xii
A. Anatomi Hati ... 5
1. Anatomi hati manusia ... 5
2. Anatomi hati tikus ... 6
B. Jenis Kerusakan Hati ... 7
1. Steatosis ... 7
2. Nekrosis ... 7
3. Kolestasis ... 7
4. Sirosis ... 8
C. Jarong (Stachytarpheta indica (L.) Vahl.) ... 8
1. Taksonomi ... 9
2. Nama lain ... 9
3. Morfologi ... 10
4. Kandungan kimia ... 10
D. Alanine Aminotransferase (ALT) dan Aspartate Aminotransferase (AST) .. 11
E. Hepatotoksin ... 11 1. Hepatotoksin intrinsik ... 11 2. Hepatotoksin idiosinkratik ... 12 F. Karbon Tetraklorida ... 12 G. Metode Ekstraksi ... 14 H. Landasan Teori ... 15 I. Hipotesis ... 17
BAB III METODOLOGI PENELITIAN... 18
xiii
B. Variabel dan Definisi Operasional ... 18
1. Variabel utama ... 18 2. Variabel pengacau ... 18 3. Definisi operasional ... 19 C. Bahan Penelitian... 20 1. Bahan utama ... 20 2. Bahan kimia ... 20 D. Alat Penelitian ... 21
1. Alat preparasi dan pembuatan ekstrak etanol daun S. indica (L.) Vahl. ... 21
2. Alat pengujian hepatoprotektif ... 22
E. Tata Cara Penelitian ... 22
1. Determinasi tanaman jarong ... 22
2. Pengumpulan bahan uji ... 22
3. Pembuatan serbuk daun jarong ... 22
4. Penetapan kadar air serbuk daun jarong ... 23
5. Uji tabung kandungan polifenol serbuk daun jarong ... 23
6. Pembuatan etanol 50% ... 23
7. Pembuatan ekstrak kental daun jarong ... 24
8. Pembuatan CMC-Na 1% ... 24
9. Penetapan dosis hepatotoksin karbon tetraklorida ... 25
10.Penetapan dosis ekstrak etanol 50% daun jarong ... 25
11.Penetapan waktu pencuplikan darah ... 26
xiv
13.Pembuatan serum ... 27
14.Pengukuran aktivitas ALT-AST ... 27
F. Tata Cara Analisis Hasil ... 28
BAB IV HASIL DAN PEMBAHASAN ... 30
A. Hasil Determinasi Tanaman Jarong ... 30
B. Penyiapan Bahan Uji ... 31
1. Pembuatan serbuk daun jarong ... 31
2. Penetapan kadar air serbuk daun jarong... 31
3. Uji tabung kandungan polifenol serbuk daun jarong ... 31
C. Pembuatan Ekstrak Etanol 50% Daun Jarong ... 33
D. Uji Pendahuluan ... 35
1. Penetapan dosis hepatotoksin karbon tetraklorida ... 35
2. Penetapan dosis ekstrak etanol 50% daun jarong ... 35
3. Penetapan waktu pencuplikan darah ... 35
E. Efek Hepatoprotektif Pemberian Ekstrak Etanol 50% Daun Jarong Pada Tikus Jantan Galur Wistar Terinduksi Karbon Tetraklorida ... 39
1. Kontrol negatif olive oil 2 mL/kgBB ... 43
2. Kontrol hepatotoksin karbon tetraklorida ... 46
3. Kontrol perlakuan ekstrak etanol 50% daun jarong dosis 400 mg/kgBB .. 47
4. Kelompok perlakuan ekstrak etanol 50% daun jarong dosis 100; 200; dan 400 mg/kgBB ... 47
BAB V KESIMPULAN DAN SARAN ... 53
xv
B. Saran ... 53
DAFTAR PUSTAKA ... 54
LAMPIRAN ... 58
xvi
DAFTAR TABEL
Tabel I. Komposisi dan konsentrasi reagen ALT ... 21
Tabel II. Komposisi dan konsentrasi reagen AST ... 21
Tabel III. Purata kadar ALT tikus setelah induksi karbon tetraklorida dengan
dosis 2 mL/kgBB saat pencuplikan darah pada jam ke-0, 24, dan 48
(n=3) ... 36
Tabel IV. Hasil uji T berpasangan kadar ALT tikus setelah induksi karbon
tetraklorida dengan dosis 2 mL/kgBB saat pencuplikan darah pada jam
ke-0, 24, dan 48 (n=3) ... 37
Tabel V. Purata kadar AST tikus setelah induksi karbon tetraklorida dengan
dosis 2 mL/kgBB saat pencuplikan darah pada jam ke-0, 24, dan 48
(n=3) ... 37
Tabel VI. Hasil uji T berpasangan kadar AST tikus setelah induksi karbon
tetraklorida dengan dosis 2 mL/kgBB saat pencuplikan darah pada jam
ke-0, 24, dan 48 (n=3) ... 39
Tabel VII. Purata ± SE kadar ALT dan AST tikus jantan galur Wistar pada
kelompok perlakuan ... 40
Tabel VIII. Hasil uji post hoc Tuckey kadar ALT praperlakuan ekstrak etanol
50% daun jarong pada tikus terinduksi karbon tetraklorida dosis 2
mL/kgBB ... 42
Tabel IX. Hasil uji post hoc Mann Whitnry kadar AST praperlakuan ekstrak
etanol 50% daun jarong pada tikus terinduksi karbon tetraklorida
xvii
Tabel X. Purata kadar ALT dan AST tikus setelah pemberian olive oil 2
mL/kgBB pada jam ke-0 dan 24 ... 44
Tabel XI. Hasil uji T berpasangan kadar ALT tikus setelah pemberian olive
oil 2 mL/kgBB pada jam ke-0 dan 24 ... 44
Tabel XII. Hasil uji T berpasangan kadar AST tikus setelah pemberian olive oil 2
xviii
DAFTAR GAMBAR
Gambar 1. Struktur dasar lobulus hati... 5
Gambar 2. Tanaman Jarong (Stachytarpheta indica (L.) Vahl.)... 8
Gambar 3. Struktur karbon tetraklorida ... 12
Gambar 4. Biotransformasi karbon tetraklorida... 13
Gambar 5-8. Hasil uji kualitatif kandungan polifenol dalam serbuk daun Jarong 32 Gambar 9. Ekstrak kental etanol 50% daun Jarong ... 34
Gambar 10. Ekstrak etanol 50% daun Jarong ... 34
Gambar 11. Diagram batang purata kadar ALT pada selang waktu 0, 24, dan 48 jam setelah pemberian karbon tetraklorida dosis 2 mL/kgBB ... 36
Gambar 12. Diagram batang purata kadar AST pada selang waktu 0, 24, dan 48 jam setelah pemberian karbon tetraklorida dosis 2 mL/kgBB ... 38
Gambar 13. Diagram batang purata kadar ALT tikus jantan galur Wistar pada kelompok perlakuan ... 41
Gambar 14. Diagram batang purata kadar AST tikus jantan galur Wistar pada kelompok perlakuan ... 41
Gambar 15. Diagram batang purata kadar ALT tikus jantan galur Wistar setelah pemberian olive oil 2 mL/kgBB pada jam ke-0 dan 24 ... 45
Gambar 16. Diagram batang purata kadar AST tikus jantan galur Wistar setelah pemberian olive oil 2 mL/kgBB pada jam ke-0 dan 24 ... 45
xix
DAFTAR LAMPIRAN
Lampiran 1. Hasil determinasi Jarong ... 59
Lampiran 2. Surat pengesahan determinasi Jarong (Stachytarpheta indica
(L.) Vahl.) ... 62
Lampiran 3. Surat pengesahan Medical and Health Research Ethics
Committee (MHREC) ... 63
Lampiran 4. Surat keterangan penggunaan program IBM SPSS Statistics
22 Lisensi UGM ... 64
Lampiran 5. Analisis statistik kadar ALT dan AST pada penetapan waktu
pencuplikan darah ... 65
Lampiran 6. Analisis statistik kadar ALT dan AST pada kelompok kontrol
olive oil 2 mL/kgBB ... 67
Lampiran 7. Analisis statistik kadar ALT pada perlakuan ekstrak etanol
50% daun Jarong (Stachytarpheta indica (L.) Vahl.) setelah
induksi karbon tetraklorida 2 mL/kgBB ... 69
Lampiran 8. Analisis statistik kadar AST pada perlakuan ekstrak etanol
50% daun Jarong (Stachytarpheta indica (L.) Vahl.) setelah
induksi karbon tetraklorida 2 mL/kgBB ... 71
Lampiran 9. Perhitungan efek hepatoprotektif ... 79
Lampiran 10. Perhitungan konversi dosis ekstrak etanol 50% daun Jarong ... 80
Lampiran 11. Perhitungan rendemen ekstrak etanol 50% daun Jarong ... 81
xx
INTISARI
Penelitian ini bertujuan untuk mengetahui efek hepatoprotektif ekstrak etanol 50% daun Jarong (Stachytarpheta indica (L.) Vahl.) terhadap aktivitas Alanin Aminotransferase dan Aspartat Aminotransferase pada tikus jantan galur Wistar yang terinduksi karbon tetraklorida serta untuk mengetahui dosis efektif ekstrak sebagai senyawa hepatoprotektif.
Penelitian ini termasuk jenis penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Penelitian ini menggunakan tikus jantan galur Wistar sebanyak 30 ekor yang berumur 2-3 bulan dengan berat badan 160-250 gram dibagi secara acak kedalam 6 kelompok perlakuan. Kelompok I (kontrol negatif) diberi minyak zaitun dosis 2 mL/kgBB. Kelompok II (kontrol hepatotoksin) diberi larutan karbon tetraklorida dalam minyak zaitun (1:1) dosis 2 mL/kgBB. Kelompok III (kontrol ekstrak etanol) diberi ekstrak etanol 50% daun
S. indica dengan dosis 400 mg/kgBB. Kemudian setelah enam jam, dilakukan pengambilan darah dari daerah sinus orbitalis mata. Kelompok IV, V, dan VI (kelompok perlakuan uji) diberi ekstrak etanol 50% daun S. indica dengan dosis bertingkat yakni 100; 200; dan 400 mg/kgBB. Dilakukan pengambilan darah pada daerah sinus orbitalis mata untuk penetapan aktivitas ALT (Alanin Aminotransferase) dan AST (Aspartat Aminotransferase) pada jam ke-24 setelah pemberian karbon tetraklorida. Data aktivitas serum ALT dan AST dianalisis menggunakan one way ANOVA dengan taraf kepercayaan 95% dan dilanjutkan uji
Post Hoc.
Hasil penelitian menunjukkan bahwa pemberian ekstrak etanol 50% daun Jarong memiliki efek hepatoprotektif dengan menurunkan aktivitas ALT dan AST pada tikus jantan galur Wistar terinduksi karbon tetraklorida pada dosis 100 mg/kgBB dan 200 mg/kgB dan dosis efektif yang diperoleh yaitu pada dosis 100 mg/kgBB.
Kata kunci : Efek hepatoprotektif, Stachytarpheta indica (L.) Vahl., Ekstrak etanol 50%, ALT, AST.
xxi
ABSTRACT
The aim of study research to determine the hepatoprotective effect of 50% ethanol extract of Jarong leaves (Stachytarpheta indica (L.) Vahl. to alanine aminotransferase and aspartate aminotransferase activities in male Wistar rats induced carbon tetrachloride and to know the effective dose in giving extraction.
This research is purely experimental research with randomized complete direct smpling design. This research used 30 male Wistar rats, aged 2-3 months, 160-250 grams weight, and divided randomly into 6 groups. Group I (negatif controlled-group) was given olive oil at a dose of 2 mL/kgBW. Group II (hepatotoxins controlled-group) was given carbon tetrachloride dissolved in olive oil (1:1) at a dose of 2 mL/kgBW. Group III (ethanol extract group) was given 50% ethanol extract S. indica at dose 400 mg/kgBW. Six hours later, blood was collected from the orbital sinus eye. Group IV, V, and VI (treatment group) were given 50% ethanol extract S. indica with doses level 100,; 200; and 400 mg/kgBW. Blood samples from all group were taken through the eyes orbital sinus for measuring the Alanine Aminotransferase (ALT) and Aspartate Aminotransferase (AST) activities at 24th hour after administration of carbon tetrachloride. The data were analyzed by one way ANOVA with 95% significancy level and continued with post hoc test.
The results showed that administration of 50% ethanol extract of Jarong leaves had a hepatoprotective effect by reducing ALT and AST activities in male Wistar rats induced carbon tetrachloride at a dose of 100 mg/kgBW and 200 mg/kgBW and effective dose is 100 mg/kgBW.
Keywords : Hepatoprotective effect, Stachytarpheta indica (L.) Vahl., 50% ethanol extract, ALT, AST.
1
BAB I PENGANTAR A. Latar Belakang
Sejak lama manusia menggunakan tanaman untuk mencegah,
mengurangi dan menyembuhkan dari penyakit tertentu (Sari, 2006). World Health
Organization merekomendasikan penggunaan tanaman obat dalam pemeliharaan
kesehehatan masyarakat, pencegahan dan pengobatan penyakit (WHO, 2003).
Salah satu tanaman yang dapat dimanfaatkan sebagai tanaman obat adalah jarong
(Stachytarpheta indica (L.) Vahl.). Daun jarong diketahui memiliki kandungan
kimia berupa terpenoid, flavonoid, glikosida (Chowdhury, 2003).
Hati merupakan salah satu organ vital pada tubuh manusia. Fungsi utama
dari organ yang sekaligus kelenjar ini adalah metabolisme (Wibowo dan Paryana,
2009). Salah satu bentuk kerusakan hati yang sering dijumpai adalah perlemakan
hati (steatosis). Pada perlemakan hati terjadi penumpukan trigliserida dalam
bentuk droplet di dalam sitoplasma sel hepatosit (Schattner and Knobler, 2008).
Karbon tetraklorida (CCl4) merupakan hepatotoksin yang dapat memberikan kerusakan sel hati berupa perlemakan hati (Geregus, 2008).
Sebuah penelitian dari Joshi et al. (2010), menjelaskan bahwa ekstrak
etanol daun jarong dengan metode ekstraksi sokhletasi memiliki aktivitas
hepatoprotektif yang ditunjukkan dengan tikus yang telah diinduksi hepatotoksik
CCl4 mengalami penurunan nilai Serum Glutamic Oxaloacetic Transaminase
(SGOT), Serum Glutamic Piruvic Transaminase (SGPT), Serum Alkaline
tanaman diketahui menjadi salah satu komponen yang dapat melindung hati.
Flavonoid merupakan golongan fenolik yang memiliki sifat polar. Flavonoid
dapat mudah tersari oleh pelarut yang memiliki sifat kepolaran yang sama, yaitu
etanol. Karena itu dalam penelitian ini digunakan etanol sebagai pelarut dalam
pembuatan ekstrak daun jarong. Pembuatan ekstrak menggunakan metode
maserasi. Metode maserasi dipilih karena merupakan jenis ekstraksi yang
sederhana dan mudah dilakukan.
Salah satu tingkatan konsentrasi yang dapat digunakan dalam ekstraksi
adalah konsentrasi 50%. Menurut Wijesekera (1991) etanol 50% sangat berguna
untuk menghindari klorofil, senyawa resin atau polimer yang biasanya tidak
mempunyai aktivitas berarti tetapi seringkali dapat menimbulkan
masalah-masalah farmasetis seperti misalnya terjadi pengendapan yang sulit untuk
dihilangkan. Selain itu, pada pilot scale di pabrik-pabrik digunakan pelarut etanol
50% untuk ekstraksi bahan alam (Javaplant, 2000).
Berdasarkan pemaparan diatas, perlu dilakukan penelitian mengenai
pengaruh efek hepatoprotektif ekstrak etanol 50% daun jarong (Stachytarpheta
indica (L.) Vahl.) terhadap aktivitas AST-ALT pada tikus jantan galur Wistar
terinduksi karbon tetraklorida.
1. Perumusan masalah
a. Apakah ekstrak etanol 50% daun jarong (Stachytarpheta indica (L.)
Vahl.) mempunyai efek hepatoprotektif dengan menurunkan aktivitas AST-ALT
b. Berapakah dosis efektif pemberian ekstrak etanol 50% daun jarong
(Stachytarpheta indica (L.) Vahl.) untuk memberikan efek hepatoprotektif
terhadap penurunan aktivitas ALT-AST pada tikus jantan galur Wistar terinduksi
karbon tetraklorida ?
2. Keaslian penelitian
a. Penelitian menggunakan tanaman Stacytarphyta indica (L.) Vahl.
pernah dilakukan oleh Sahoo et al. (2014), yang melaporkan mengenai aktivitas
antioksidan dari ekstrak metanol Stacytarpheta indica (L.) Vahl. dengan
menggunakan metode DPPH.
b. Joshi et al. (2010) yang melakukan penelitian tentang skrining ekstrak
etanol daun Stacytarpheta indica (L.) Vahl. menggunakan metode sokhlet dengan
pelarut yang kepolaritasanya meningkat. Uji efek hepatoprotektif dilakukan
dengan menggunakan kontrol positif liv 52 dengan jangka waktu penelitian 10
hari.
c. Gayatri et al. (2011) melakukan penelitian tentang efek
hepatoprotektif ekstrak etanol herba Stachytarpheta indica (L.) Vahl. pada tikus
galur Wistar. Metode ekstraksi yang digunakan adalah metode sokhlet. Uji
aktivitas hepatoprotektif dilakukan dalam jangka waktu 7 hari.
Berdasarkan jurnal penelitian diatas maka penelitian efek hepatoprotektif
ekstrak etanol 50% daun Stachytarpheta indica (L.) Vahl. dengan metode
3. Manfaat penelitian
a. Manfaat teoretis. Hasil penelitian ini diharapkan mampu memberikan
informasi terkait ilmu pengetahuan khususnya bidang kefarmasian mengenai
pengaruh ekstrak etanol 50% daun jarong (Stachytarpheta indica (L.) Vahl.)
sebagai hepatoprotektor.
b. Manfaat praktis. Hasil penelitian ini diharapkan mampu dijadikan
sebagai bahan pertimbangan masyarakat untuk menggunakan daun Jarong dengan
dosis yang diperoleh dalam penelitian sebagai alternatif pengobatan penyakit hati.
B. Tujuan Penelitian 1. Tujuan umum
Mengetahui efek hepatoprotektif pemberian ekstrak etanol 50% daun
jarong (Stachytarpheta indica (L.) Vahl.) terhadap aktivitas ALT dan AST pada
tikus jantan galur Wistar yang terinduksi karbon tetraklorida.
2. Tujuan khusus
Mengetahui dosis pemberian ekstrak etanol 50% daun jarong
(Stachytarpheta indica (L.) Vahl.) yang efektif terhadap aktivitas ALT-AST pada
5
BAB II
PENELAAHAN PUSTAKA A. Anatomi Hati 1. Anatomi hati manusia
Organ hati di dalam tubuh memiliki berat sekitar 2% dari berat badan
dewasa normal atau rata-rata sebesar 1500 g, terletak dalam rongga perut sebelah
kanan pada bawah diafragma (Pearce, 2009). Fungsi utama dari organ yang
sekaligus kelenjar ini adalah metabolisme (Wibowo dan Paryana, 2009).
Jaringan hati terdiri atas kumpulan sel-sel yang tersusun dalam lobus
yang teratur. Setiap lobus hati terbagi dalam struktur yang disebut lobulus, yang
terdiri dari lempeng-lempeng sel hati yang bentuknya menyerupai kubus dan
mengelilingi vena sentralis (Pearce, 2009). Gambar struktur dasar lobulus hati
adalah sebagai berikut :
Terdapat sinusoid (gambar 1) yang letaknya berada diantara
lempengan-lempengan tersebut. Sinusoid merupakan cabang vena porta dan arteri hepatika
(Ganong dan McPhee, 2011). Pada setiap sinusoid terdapat pembatas yang disebut
sel Kupffer, yang berfungsi untuk menghancurkan sel darah merah dan bakteri
yang melewatinya dalam darah (Sherwood, 2007).
2. Anatomi hati tikus
Hati tikus terdiri dari empat lobus utama yang saling berhubungan di
sebelah belakang. Lobus tengah dibagi menjadi kanan dan kiri oleh bifurcatio
yang dalam. Lobus sebelah kiri tidak terbagi sedangkan lobus sebelah kanan
terbagi secara horizontal menjadi bagian anterior dan posterior. Lobus belakang
terdiri dari dua lobus berbentuk daun yang berada di sebelah dorsal dan ventral
dari oesophagus sebuah kurvatura dari lambung. Tikus tidak mempunyai kantung
empede. Struktur dan komponen hati tikus sama dengan mamalia lainnya (Hebel,
1989).
Lobus hati tikus dibagi menjadi tiga zona yang terdiri dari zona 1, zona 2,
dan zona 3 yang sama dengan area periportal, midzona, dan centrilobular.
Hepatosit di zona 1 dekat dengan pembuluh aferen yang mendapat suplai darah
yang kaya akan nutrien, sedangkan zona 3 yang terdapat pada bagian ujung
mikrosirkulasi menerima darah yang sudah mengalami pertukaran gas dan
metabolit dari sel-sel zona 1 dan 2. Zona 3 selnya lebih sensitif daripada zona
lainnya terhadap gangguan sirkulasi seperti iskemik, anoksia atau kongesti dan
mempunyai respon yang berbeda terhadap keadaan hemodinamik di dalam asinus
dengan ditingkatkannya mikrosirkulasi (Hebel, 1989).
B. Jenis Kerusakan Hati
Macam-macam jenis kerusakan hati yang dapat terjadi sebagai akibat
dari efek toksik yang dihasilkan oleh toksikan, antara lain :
1. Steatosis
Steatosis ditandai dengan adanya peningkatan kandungan lemak seperti
trigliserida di hati lebih dari 5% dari berat hati manusia. Terjadinya steatosis
digambarkan dengan terjadinya akumulasi lemak yang tidak normal pada
hepatosit dan terjadi penurunan kadar lipid plasma dan lipoprotein (Hodgson dan
Levi, 2004).
2. Nekrosis
Nekrosis merupakan suatu keadaan hati yang ditandai dengan kematian
dari hepatosit yang termasuk dalam kerusakan akut. Kematian sel ini ditandai
dengan peningkatan eosinofil pada bagian sitoplasma disertai neutrofil pada
daerah yang terjadi kerusakan hepatosit (Hodgson dan Levi, 2004).
3. Kolestasis
Kolestasis adalah salah satu jenis kerusakan hati yang bersifat akut dan
jarang ditemukan (Lu, 1995). Kolestasis ditandai dengan adanya peningkatan
asam empedu di dalam plasma dan mengakibatkan kadar bilirubin menjadi tinggi
4. Sirosis
Sirosis merupakan hepatotoksisitas yang ditandai dengan adanya kolagen
di seluruh hati yang mengakibatkan terbentuknya jaringan parut. Hal ini dapat
terjadi karena adanya paparan senyawa kimia secara kronis yang mengakibabtkan
akumulasi di matriks ekstra seluler yang menghambat aliran darah, metabolisme
normal hepar, dan proses detoksifikasi (Hodgson, 2010).
C. Jarong (Stachytarpheta indica (L.) Vahl.)
Jarong merupakan jenis tumbuhan liar yang berasal dari bagian benua
Amerika yang beriklim panas dan dapat ditemukan di Indo-Cina, Semenanjung
Malaka, dan Indonesia (Dharma, 1996). Berikut ini adalah gambar dari tanaman
jarong :
Gambar 2. Tanaman Jarong (Stachytarpheta indica (L.) Vahl.) (Dokumentasi pribadi, 2015)
Bagian dari jarong pada umumnya yang sering digunakan yaitu daun.
digunakan untuk mengobati penyakit kencing nanah, berak darah, amandel,
disentri, ambeien, haid tidak teratur, nifas, luka memar, bisul (Soedibyo, 1998),
rematik hepatitis A (Dalimartha, 2001), pembersih darah, anti radang, dan diuretik
(Dalimartha, 2000). Namun, pada ibu hamil yang menderita keluhan-keluhan
seperti yang telah disebutkan diatas tidak diperbolehkan mengkonsumsi tanaman
ini karena dapat mengakibatkan keguguran (Soedibyo, 1998).
1. Taksonomi
Kingdom : Plantae
Subkingdom : Tracheobionta
Super divisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Sub kelas : Asteridae
Ordo : Lamiales
Famili : Verbenaceae
Genus : Stachytarpheta
Spesies : Stachytarpheta indica Vahl.
(Plantamor, 2012).
Sinonim nama ilmiah :
Spesies : Stachytarpheta indica (L.) Vahl.
2. Nama lain
Di Indonesia, jarong dikenal dengan nama remek getih (Jawa), jarongan
selasih hutan (Sumatera) (Dharma, 1996; Soedibyo, 1998). Masyarakat China
menyebut tanaman ini yu long bian. Di Malaysia tanaman ini dikenal dengan
nama gajihan. Di Negara Filipina, tanaman ini dikenal dengan nama ratstail
(Plantamor, 2012).
3. Morfologi
Jarong adalah rumput-rumputan yang tegak, tinggi 0,3-0,9 m. Memiliki
daun berhadap-hadapan, bertangkai sangat panjang, berbentuk elips memanjang
atau bulat telur, dengan kaki yang menyempit, di atas bagian kaki yang bertepi
rata berigigi beringgit, berambut jarang atau tidak yang ukurannya 4-9 cm dan
2,5-5 cm. Bulir bertangkai pendek, panjang 15-30 cm. Daun pelindung menempel
kuat pada kelopak, bertepi lebar serupa selaput. Kelopak bergigi empat, panjang
0,5 cm. Tabung dasar bunga berbentuk bantal. Buah berbentuk garis baji, panjang
0,5 cm, pecah dalam 2 kendaga. Terutama di daerah dengan musim kemarau yang
tegas, di tempat yang cerah atau sedikit, 1-1,250 m (van Steenis, 1992).
4. Kandungan kimia
Jarong mengandung senyawa kimia berupa terpenoid, flavonoid,
glikosida (Chowdhury, 2003). Flavonoid sendiri diketahui dapat melindung hati.
Konsentrasi 1-100 μg/mL pada flavonoid mampu meningkatkan kelangsungan hidup sel hepatosit dan menghambat terjadinya pelepasan ALT dan AST serum
D. Alanin Aminotransferase (ALT) dan Aspartat Aminotransferase (AST)
ALT dan AST serum sering digunakan dalam uji fungsi hati. Jika kedua
enzim ditemukan di dalam serum, maka mengindikasikan adanya kerusakan
fungsi hati (Ganong dan McPhee, 2011). Kadar aminotransferase dalam level
tinggi menunjukkan adanya infeksi virus, iskemik, atau keracunan pada hepar
(Dipiro et al, 2005). Konsentrasi enzim ALT terbesar terdapat pada hati yag
merupakan petunjuk spesifik adanya nekrosis hati dibandingkan AST yang
terdapat pada hampir semua jaringan, otot rangka, dan hati (Zimmerman, 1999).
Keberadaan enzim ALT pada hewan primata, anjing, tikus, kucing, dan
kelinci terpusat pada sel hepatosit sehingga terjadinya peningkatan kadar ALT
pada serum merupakan indikator yang sering digunakan untuk mendeteksi adanya
kerusakan hati (Stockham & Scott, 2002). Kadar AST dan ALT pada serum tikus
putih normal berkisar antara 19,3-68,9 U/L dan 29,8-77,0 U/L (Pilichos et al,
2004) sedangakan menurut Girindra (1989) kadar AST dan ALT pada tikus
normal masing-masing sebesar 45,7-80,0 U/L dan 17-30,2 U/L.
E. Hepatotoksin
Hepatotoksin diklasifikasikan menjadi dua, yaitu :
1. Hepatotoksin intrinsik
Senyawa yang mempunyai efek hepatotoksik hampir pada seluruh
populasi yang terpejankan senyawa tersebut. Senyawa ini bergantung pada dosis
2. Hepatotoksin idiosinkratik
Senyawa yang mempunyai efek hepatotoksik pada sebagian kecil
populasi yang terpejankan senyawa tersebut. Beberapa bergantung pada dosis
pemberian. Contohnya : fenitoin, sulfonamida, valproat, dan isoniazid
(Friedman and Keeffe, 2012).
F. Karbon Tetraklorida
Salah satu senyawa yang dapat menyebabkan nekrosis hati adalah karbon
tetraklorida, bila digunakan dengan dosis rendah maka akan menyebabkan
terjadinya steatosis. Karena karbon tetraklorida bergantung pada metabolisme
aktivasi dari sitokrom P-450 (CYP2E1) yang ada di hati, maka hati menjadi target
utama dari ketoksikan yang ditimbulkan oleh senyawa ini (Timbrell, 2008).
Struktur karbon tetraklorida adalah sebagai berikut :
Gambar 3. Struktur karbon tetraklorida (ATSDR, 2005)
Karbon tetraklorida merupakan senyawa yang sebelumnya pernah
digunakan sebagai penghilang noda, pembersih karpet, pelarut, pemadam api,
serta sebagai antihelmintik pada pengobatan hewan. Penggunaan karbon
tetraklorida saat ini terbatas untuk perantara bahan kimia dalam produksi senyawa
organik terklorinasi. Karbon tetraklorida memiliki kelarutan dalam lemak tinggi,
tulang, ginjal, serta otak (Wexler, Anderso, Peyster, Gad, Hakkinen, Kamrin,
dkk., 2005).
Berikut ini adalah gambaran biotransformasi karbon tetraklorida :
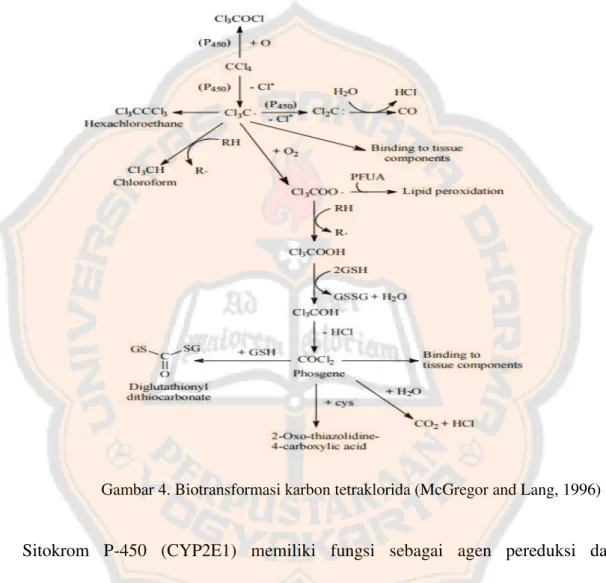
Gambar 4. Biotransformasi karbon tetraklorida (McGregor and Lang, 1996)
Sitokrom P-450 (CYP2E1) memiliki fungsi sebagai agen pereduksi dan
mengkatalisis adisi elektron yang mengakibatkan satu ion klorin yang hilang
sehingga membentuk suatu radikal bebas berupa triklorometil (•CClз) (Geregus,
2008). Radikal bebas triklorometil (gambar 4) dapat berikatan dengan protein dan
lemak mikrosomal, serta akan bereaksi secara langsung dengan kolesterol dan
fosfolipid dan terbentuk radikal lipid yang mengaktifkan oksigen reaktif dan
terbentuknya lipid dalam hati yang mengakibatkan terjadinya penurunan produksi
lipoprotein. Lipoprotein ini bertanggungjawab dalam transport lipid keluar dari
hepatosit dan terjadi steatosis (Timbrell, 2008). Kerusakan hati oleh karbon
tetraklorida dapat dilihat dengan adanya kenaikan aktivitas serum ALT dan AST.
Pada saat steatosis terjadi peningkatan aktivitas serum ALT sebesar 3x normal
dan aktivitas serum AST sebesar 4x normal (Zimmerman, 1999).
G. Metode Ekstraksi
Ekstrak adalah sediaan yang diperoleh dengan cara ekstraksi tanaman
obat dengan ukuran partikel tertentu dengan menggunakan medium pengekstraksi
yang tertentu yang dapat dilakukan dengan berbagai cara (Agoes, 2009). Ekstraksi
senyawa metabolit sekunder dari seluruh bagian tumbuhan pada umumnya
menggunakan sistem maserasi dengan pelarut organik.
Metode maserasi merupakan cara penyarian yang sederhana yang
dilakukan dengan merendam serbuk simplisia dalam cairan penyari selama
beberapa hari pada temperatur kamar dan terlindung cahaya (Sudjadi, 1986).
Dalam penelitian ini, pelarut yang digunakan untuk maserasi adalah
etanol 50%. Menurut Javaplant (2000), pada proses pilot scale dapat digunakan
etanol 50% untuk ekstraksi bahan alam. Pilot scale biasanya dilakukan oleh
pabrik-pabrik yang memproduksi ekstrak, dengan tujuan mengantisipasi
terbuangnya banyak produk karena tidak memenuhi serangkaian pengujian. Hal
yang diujikan dalam proses pilot scale salah satunya yaitu pengujian untuk
tertentu, misalnya efek hepatoprotektif. Selain itu, menurut Wijesekera (1991),
etanol 50% sangat berguna untuk menghindari klorofil, senyawa resin atau
polimer yang biasanya tidak mempunyai aktivitas berarti tetapi seringkali dapat
menimbulkan masalah-masalah farmasetis seperti misalnya terjadi pengendapan
yang sulit untuk dihilangkan
H. Landasan Teori
Sebagai salah satu organ terbesar pada tubuh manusia, hati memiliki
peran penting dalam metabolisme (Baradero, Dayrit, dan Siswadi, 2005). Hati
memiliki kerja terberat karena berhubungan dengan zat berbahaya yang tidak
diperlukan oleh tubuh, sehingga kemungkinan mengalami kerusakan sangat besar.
Beberapa keruskaan hati akibat dari efek toksik yang dihasilkan oleh toksikan
antara lain steatosis, nekrosis, kolestasis, dan sirosis (Lu, 1995). Kerusakan hati
dapat dideteksi dengan pengujian secara biokimiawi, yaitu dengan menguji
aktivitas dari enzim aminotransferase (ALT dan AST), dimana apabila terjadi
kerusakan hati ditandai dengan peningkatan kadar dari enzim tersebut (Geregus,
2008).
Karbon tetraklorida (CCl4) dapat memberikan kerusakan sel hati berupa perlemakan hati. Sitokrom P-450 (CYP2E1) memiliki fungsi sebagai agen
pereduksi dan mengkatalisis adisi elektron yang mengakibatkan satu ion klorin
yang hilang sehingga membentuk suatu radikal bebas berupa triklorometil (•CClз)
(Geregus, 2008). •CClз dapat berikatan dengan protein dan lemak mikrosomal,
terbentuk radikal lipid yang mengaktifkan oksigen reaktif dan terjadi peroksidasi
lipid (Timbrell, 2008). Kerusakan hati oleh karbon tetraklorida dapat dilihat
dengan adanya kenaikan aktivitas serum ALT dan AST. Pada saat steatosis terjadi
peningkatan aktivitas serum ALT sebesar 3x normal dan aktivitas serum AST
sebesar 4x normal (Zimmerman, 1999).
Oleh karena itu diperlukan suatu senyawa untuk melindungi hati dari
senyawa yang toksik. Salah satu senyawa yang dapat digunakan adalah senyawa
flavonoid. Senyawa flavonoid hampir terdapat pada semua tanaman, salah satunya
adalah tanaman jarong (Stachytarpheta indica (L.) Vahl.) (Chowdhury, 2003).
Sebuah penelitian dari Joshi et al. (2010), menjelaskan bahwa ekstrak
etanol daun jarong dengan metode ekstraksi sokhletasi memiliki aktivitas
hepatoprotektif yang ditunjukkan dengan tikus yang telah diinduksi hepatotoksik
CCl4 mengalami penurunan nilai Serum Glutamic Oxaloacetic Transaminase
(SGOT), Serum Glutamic Piruvic Transaminase (SGPT), Serum Alkaline
Phosphatase (SALP) dan serum bilirubin. Adanya senyawa flavonoid dari
tanaman diketahui menjadi salah satu komponen yang dapat melindung hati.
Flavonoid merupakan golongan fenolik yang memiliki sifat polar. Flavonoid
dapat mudah tersari oleh pelarut yang memiliki sifat kepolaran yang sama, yaitu
etanol. Salah satu tingkatan konsentrasi etanol yang dapat digunakan dalam proses
pilot scale di pabrik-pabrik adalah konsentrasi 50%, yang mana dengan
I. Hipotesis
Ekstrak etanol 50% daun Jarong (Stachytarpheta indica (L.) Vahl.)
memiliki efek hepatoprotektif dengan menurunkan aktivitas ALT-AST pada tikus
18
BAB III
METODE PENELITIAN A. Jenis dan Rancangan Penelitian
Penelitian mengenai efek hepatoprotektif ekstrak etanol 50% daun jarong
(Stachytarpheta indica (L.) Vahl.) terhadap aktivitas ALT-AST pada tikus jantang
galur Wistar terinduksi karbon tetraklorida merupakan jenis penelitian
eksperimental murni dengan rancangan acak lengkap pola searah.
B. Variabel dan Definisi Operasional 1. Variabel utama
a. Variabel bebas. Variabel bebas penelitian ini adalah variasi dosis
dalam pemberian ekstrak etanol 50% daun Jarong.
b. Variabel tergantung. Variabel tergantung penelitian ini adalahnilai
aktivitas ALT-AST tikus jantan galur Wistar yang terinduksi karbon tetraklorida
setelah pemberian ekstrak etanol 50% daun Jarong.
2. Variabel pengacau
a. Variabel pengacau terkendali. Hewan uji yang digunakan, yaitu tikus
jantan galur Wistar yang berumur 2-3 bulan dengan berat badan 160-250 g, cara
pemberian ekstrak secara per oral, frekuensi waktu pemberian ekstrak, dan tempat
tumbuh daun jarong.
b. Variabel pengacau tak terkendali. Variabel pengacau tak terkendali
3. Definisi operasional
a. Daun Jarong. Daun jarong yang diambil dari tanaman jarong adalah
daun yang berwarna hijau, segar, dan sudah memiliki bunga.
b. Ekstrak etanol 50% daun Jarong. Ekstrak etanol 50% daun Jarong
didapatkan dengan cara merendam (memaserasi) simplisia kering daun jarong ke
dalam etanol dengan konsentrasi 50%, kemudian dipekatkan dengan
menggunakan vacuum rotary evaporator dan diuapkan dengan waterbath hingga
bobot tetap.
c. Efek hepatoprotektif. Efek hepatoprotektif merupakan kemampuan
ekstrak etanol 50% daun Jarong dengan dosis tertentu yang melindungi hati dari
hepatotoksin.
d. Jangka waktu 24 jam. Jangka waktu 24 jam didefinisikan sebagai
waktu pengukuran yang dilakukan 24 jam sejak pemejanan karbon tetraklorida,
dimana enam jam sebelum pemejanan karbon tetraklorida dilakukan pemberian
ekstrak etanol 50% daun Jarong kepada hewan uji.
e. Dosis efektif. Dosis efektif didefinisikan sebagai besaran dosis
tertentu yang dapat memberikan efek hepatoprotektif.
f. ALT-AST. ALT-AST adalah enzim yang ditemukan di dalam serum,
C. Bahan Penelitian 1. Bahan utama
a. Hewan uji. Hewan uji yang digunakan dalam penelitian ini adalah
tikus jantan galur Wistar yang berusia 2-3 bulan dengan berat badan 160-250 g
yang diperoleh dari daerah Bantul, Daerah Istimewa Yogyakarta.
b. Bahan uji. Bahan uji yang digunakan yaitu serbuk daun S. indica
yang diperoleh dari Kebun Obat Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
2. Bahan kimia
a. Hepatotoksin. Hepatotoksin yang digunakan adalah karbon
tetraklorida Merck® yang diperoleh dari Laboratorium Kimia Analisis Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta.
b. Kontrol negatif dan pelarut hepatotoksin. Kontrol negatif dan pelarut
hepatotoksin yang digunakan adalah olive oil Cesar® yang diperoleh dari PT
Prambanan Kencana.
c. Pelarut pengekstraksi. Pelarut pengekstrasi yang digunakan adalah
etanol 96% yang diperoleh dari Toko Progo Mulyo, Yogyakarta dan aquadest
yang diperoleh dari Laboratorium Kultur Jaringan Fakultas Farmasi Universitas
Sanata Dharma.
d. Pelarut ekstrak kental. Pelarut ekstrak kental yang digunakan adalah
CMC-Na 1%. CMC-Na diperoleh dari CV General Labora, Yogyakarta.
e. Reagen ALT. Reagen ALT yang digunakan adalah reagen ALT
Tabel I. Komposisi dan konsentrasi reagen ALT
Komposisi pH Konsentrasi
R1 : TRIS 7,15 140 mmol/L
L-Alanine 700 mmol/L
LDH (lactate dehydrogenase) ≥ 2300 U/L R2 2-Oxoglutarate 85 mmol/L
NADH 1 mmol/L
Pyridoxal-5 phospate FS
Good’s buffer 9,6 100 mmol/L
Pyridoxal-5 phospate 13 mmol/L
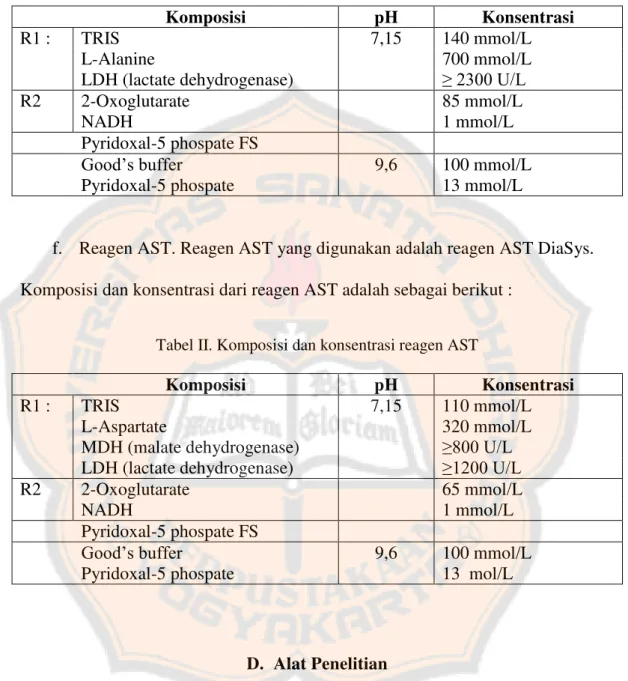
f. Reagen AST. Reagen AST yang digunakan adalah reagen AST DiaSys.
Komposisi dan konsentrasi dari reagen AST adalah sebagai berikut :
Tabel II. Komposisi dan konsentrasi reagen AST
Komposisi pH Konsentrasi
R1 : TRIS 7,15 110 mmol/L L-Aspartate 320 mmol/L MDH (malate dehydrogenase) ≥800 U/L LDH (lactate dehydrogenase) ≥1200 U/L R2 2-Oxoglutarate 65 mmol/L
NADH 1 mmol/L
Pyridoxal-5 phospate FS
Good’s buffer 9,6 100 mmol/L
Pyridoxal-5 phospate 13 mol/L
D. Alat Penelitian
1. Alat preparasi dan pembuatan ekstrak etanol daun S. indica (L.) Vahl.
Oven, mesin penyerbuk dan ayakan, moisture balance, cawan porselen,
termometer, stopwatch, gelas Beaker, gelas ukur, batang pengaduk, penangas air,
2. Alat pengujian hepatoprotektif
Gelas Beaker, gelas ukur, tabung reaksi, labu ukur, pipet tetes, batang
pengaduk (Pyrex Iwaki Glass®), timbangan analitik (Mettler Toledo®), vortex (Genie Wilten®), spuit injeksi per oral untuk tikus, spuit injeksi intraperitonial, pipa kapiler, tabung Eppendorf, sentrifuge, microvitalab 200 Merck®, blue tip, dan yellow tip.
E. Tata Cara Penelitian 1. Determinasi tanaman jarong
Tanaman jarong dideterminasi dengan mencocokkan morfologi tanaman
jarong dengan buku acuan Flora untuk Indonesia karangan van Steenis (1992).
Determinasi dilakukan di Laboratorium Farmakognosi-Fitokimia Fakultas
Farmasi Universitas Sanata Dharma.
2. Pengumpulan bahan uji
Bahan uji yang dipilih adalah daun dari tanaman jarong yang masih
berwarna hijau, terhindar dari penyakit di daerah daunnya, serta bukan merupakan
daun jarong yang telah jatuh di tanah ataupun layu. Daun tanaman jarong dipanen
dari Kebun Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta pada
bulan Agustus 2015.
3. Pembuatan serbuk daun jarong
Daun jarong dicuci bersih dengan air mengalir dan diangin-anginkan.
Selanjutnya, pengeringan dilakukan dengan oven pada suhu 40 ºC selama 48 jam.
Penetapan suhu berdasarkan pada aturan Direktorat Jenderal Pengawasan Obat
simplisia dilakukan pada suhu antara 30-90 ºC. Serbuk yang telah kering
kemudian dihaluskan dan diayak dengan ayakan mesh nomor 40.
4. Penetapan kadar air serbuk daun jarong
Serbuk daun jarong dimasukkan ke dalam alat moisture balance lalu
diratakan. Setelah itu dipanaskan pada suhu 105oC selama 15 menit (Direktorat Jenderal Pengawasan Obat dan Makanan Republik Indonesia, 1995). Serbuk yang
telah dipanaskan ditimbang kembali lalu dihitung sebagai bobot setelah
pemanasan. Kadar air serbuk simplisia yang baik adalah <10%. Kadar air serbuk
diperoleh menggunakan rumus:
⌈ Bobot sampel sebelum pemanasan − Bobot sampel setelah pemanasanBobot sampel sebelum pemanasan ⌉ X %
(Direktorat Jenderal Pengawasan Obat dan Makanan Republik Indonesia, 1995).
5. Uji tabung kandungan polifenol serbuk daun jarong
Uji kandungan polifenol dilakukan dengan menambahkan 10 mL aquadest
pada sebuah tabung berisi 2 g serbuk daun jarong dan 10 mL etanol 50% pada
tabung lain yang juga berisi 2 g serbuk daun jarong. Kedua tabung didihkan di
atas tangas air, kemudian dilakukan penyaringan. Setelah dingin, filtrat diteteskan
FeCl3 sebanyak 3 tetes, terbentuknya warna hijau-biru menunjukkan hasil positif
adanya polifenol (Wulandari dan Hartini, 2015).
6. Pembuatan etanol 50%
Dengan menggunakan rumus V1.C1 = V2.C2, etanol 96% diencerkan
7. Pembuatan ekstrak kental daun jarong
Serbuk daun jarong diekstraksi dengan etanol 50% secara maserasi.
Proses maserasi dilakukan dengan memasukkan 30 g serbuk simplisia ke dalam
labu erlenmeyer, yang kemudian direndam dengan pelarut 300 mL selama 24 jam
dengan bantuan shaker (Gunawan, Soegihardjo, Mulyani, Wahyuningsih, dan
Sudarto, 1993). Setelah itu dilakukan remaserasi dengan penambahan pelarut ke
dalam ampas dari proses maserasi yang dilakukan sebelumnya, dengan jumlah
pelarut dan waktu ekstraksi yang sama seperti maserasi pertama. Filtrat hasil
saringan dipindahkan dalam LAB untuk dievaporasi untuk menguapkan cairan
penyari pada proses maserasi. Hasil evaporasi dituangkan dalam cawan porselen
yang telah ditimbang sebelumnya agar mempermudah perhitungan rendemen
ekstrak kental yang akan diperoleh. Parameter standarisasi ekstrak etanol 50%
daun jarong dilihat dari bobot tetap yang bertujuan untuk menghitung sisa zat
dengan bobot tetap setelah dilakukan pengeringan. Menurut Farmakope Herbal
Indonesia (2013), bobot tetap telah tercapai bila sudah ditandai dengan selisih
penimbangan sebesar 0,5 mg. Ekstrak dalam cawan ditimbang setiap satu jam
hingga bobot tetap. Bobot ekstrak dihitung dengan rumus :
Bobot ekstrak = berat cawan ekstrak kental – berat cawan kosong
8. Pembuatan CMC-Na 1%
CMC-Na 1% dibuat dengan mendispersikan lebih kurang 1,0 g CMC-Na
yang telah ditimbang secara saksama dan digerus, kemudian dilarutkan dengan
100 mL aquadest. CMC-Na yang dibuat digunakan untuk melarutkan ekstrak
9. Penetapan dosis hepatotoksin karbon tetraklorida
Penetapan dosis hepatotoksin dilakukan melalui studi literatur yang
dilakukan oleh Janakat dan Al-Merie (2002) yang menyebutkan bahwa dosis
hepatotoksin karbon tetraklorida yang digunakan untuk menginduksi kerusakan
hati tikus jantan galur Wistar adalah 2 mL/kgBB dimana volume CCl4 sama
dengan volume olive oil (1:1). Pemilihan dosis hepatoksin ini karena pada dosis
tersebut telah menyebabkan kerusakan sel-sel hati dari tikus jantan galur Wistar
yang terdeksi dengan kenaikan serum ALT dan AST, namun tidak sampai
menyebabkan kematian pada tikus jantan sebagai subjek penelitian tersebut
(Janakat, Al-Merie, 2002).
10.Penetapan dosis ekstrak etanol 50% daun jarong
Penetapan dosis ekstrak etanol 50% daun jarong dihitung berdasarkan
berat badan tertinggi tikus yaitu 250 g dan ½ volume maksimal secara per oral
pada tikus yaitu 2,5 ml. Penetapan dosis tertinggi dapat ditentukan dengan rumus
sebagai berikut:
D x BB = C x V
D x BB tertinggi tikus (kg/BB) = C ekstrak (mg/mL) x ½ Vmax (2,5 ml)
D = x mg/kg BB
Dua peringkat dosis lainnya diperoleh dengan menurunkan 2 kalinya dari
11.Penetapan waktu pencuplikan darah
Penetapan waktu pencuplikan darah ditentukan melalui orientasi pada
tiga kelompok perlakuan waktu, yaitu pada jam ke-0, 24, 48. Setiap kelompok
perlakuan terdiri dari 5 hewan uji yang pengambilan darahnya dilakukan melalui
pembuluh sinus orbitalis mata sebanyak 1 cc. Kemudian nilai aktivitas ALT-AST
diukur. Pada penelitian yang dilakukan oleh Janakat dan Al-Merie (2002)
peningkatan kadar maksimal terjadi pada jam ke-18 dan jam ke-24 setelah
pemberian karbon tetraklorida secara injeksi dan kemudian berangsur menurun
pada jam ke-48 dan terjadi perbaikan sel hati setelah 3 hari pemberian
hepatotoksin.
12.Pengelompokkan dan perlakuan hewan uji
Tikus jantan galur Wistar yang diperlukan sebagai hewan uji adalah
sebanyak 30 ekor yang kemudian akan dibagi kedalam 6 kelompok secara acak
sama banyak. Kelompok I (kontrol negatif) diberi olive oil dosis 2 mL/kgBB
secara intraperitoneal, kemudian setelah 24 jam dilakukan pengambilan darah.
Kelompok II (kontrol hepatotoksin) diberi larutan karbon tetraklorida dalam
minyak zaitun (1:1) dengan dosis 2 mL/kgBB secara intraperitoneal, kemudian
setelah 24 jam dilakukan pengambilan darah. Kelompok III (kontrol ekstrak
etanol) diberi ekstrak etanol 50% daun jarong dengan dosis tertinggi yaitu 400
mg/kgB secara peroral, kemudian setelah enam jam dilakukan pengambilan darah.
Kelompok IV, V, dan VI (kelompok perlakuan uji) diberi ekstrak etanol 50%
dengan dosis bertingkat yaitu 100; 200; dan 400 mg/kgBB. Kemudian enam jam
dengan dosis 2 mL/kgBB secara intraperitoneal (Janakat dan Al-Merie, 2002).
Setelah 24 jam dari pemejanan dilakukan pengambilan darah pada daerah sinus
orbitalis mata untuk penetapan aktivitas ALT dan AST.
Pada penelitian ini pemberian ekstrak dilakukan sebagai praperlakuan
dengan mengacu pada model penelitian yang dilakukan oleh Eviani (2015) yaitu
ekstrak diberikan dalam jangka waktu enam jam.
13.Pembuatan serum
Setiap tikus diambil darahnya melalui sinus orbitalis mata menggunakan
pipa kapiler kemudian ditampung di tabung Eppendorf. Darah yang telah diambil
kemudian didiamkan selama 15 menit, lalu disentrifugasi pada kecepatan 8000
rpm selama 15 menit. Bagian supernatan diambil menggunakan micropipette, lalu
disentrifugasi kembali pada kecepatan 8000 rpm selama 10 menit. Bagian
supernatan diambil menggunakan micropipette (Gomes, 2015).
14.Pengukuran aktivitas ALT-AST
Pengukuran aktivitas serum ALT-AST dilakukan menggunakan
Microlab-200 Merck® di Laboratorium Biokimia Fisiologi Manusia, Fakultas
Farmasi, Universitas Sanata Dharma, Yogyakarta. Aktivitas serum ALT-AST
diukur pada panjang gelombang 340 nm, dan dinyatakan dengan satuan U/L.
Kisaran nilai ALT serum kontrol DiaSys Trulab N series yakni 29,8-77,0 U/L.
Tahap analisis ALT dilakukan dengan mengambil sejumlah 100 µL serum
dicampurkan dengan 1000 µL reagen I dan divortex selama 5 detik. Campuran
divortex selama 5 detik. Campuran kemudian dibaca serapannya setelah 1 menit
berselang dari pemberian reagen II (Gomes, 2015).
Tahap analisis ALT dilakukan dengan mengambil sejumlah 100 µL
serum dicampurkan dengan 1000 µL reagen I dan divortex selama 5 detik.
Campuran didiamkan selama 5 menit selanjutnya dicampur dengan 250 µL reagen
II dan divortex selama 5 detik. Campuran kemudian dibaca serapannya setelah 1
menit berselang dari pemberian reagen II. Tahap analisis AST dilakukan dengan
cara yang sama, yakni dengan mengambil sejumlah 100 µL serum dicampurkan
dengan 1000 µL reagen I dan divortex selama 5 detik. Campuran didiamkan
selama 5 menit selanjutnya dicampur dengan 250 µL reagen II dan divortex
selama 5 detik. Campuran kemudian dibaca serapannya setelah 1 menit berselang
dari pemberian reagen II.
F. Tata Cara Analisis Hasil
Data aktivitas dari ALT dan AST serum diperoleh, selanjutnya diolah
dan kemudian diuji normalitasnya menggunakan Saphiro Wilks. Kemudian
dilakukan uji Levene’s Test untuk mengetahui homogenitas varian data antar
kelompok sebagai syarat parametrik. Data yang terdistribusi normal dilakukan uji
One Way ANOVA dengan taraf kepercayaan 95% untuk mengetahui perbedaan
dari masing-masing kelompok. Post Hoc Tukey selanjutnya dilakukan guna
melihat kebermaknaan perbedaan data antara masing-masing kelompok untuk
data berdistribusi normal dan variansi homogen. Post Hoc Games Howell
selanjutnya dilakukan guna melihat kebermaknaan perbedaan data antara
Perbedaan dikatakan bermakna (signifikan) bila memiliki nilai p<0.05, sedangkan
tidak bermakna (tidak signifikan) bila p>0,05.
Bila data aktivitas ALT dan AST yang diperoleh tidak normal, maka
dilakukan uji Kruskall-Wallis. Selanjutnya dilakukan uji Mann-Whitney untuk
melihat kebermaknaan perbedaan data antar kelompok. Perbedaan dikatakan
bermakna (signifikan) bila memiliki nilai p<0,05, sedangkan tidak bermakna
(tidak signifikan) bila p>0,05.
Perhitungan persen efek hepatoprotektif terhadap hepatotoksin karbon
tetraklorida diperoleh dengan rumus sebagai berikut:
ALT = ( − purata ALT kontrol hepatotoksin − purata ALT kontrol negatif ) xpurata ALT perlakuan − purata ALT kontrol negatif %
AST = ( − purata AST kontrol hepatotoksin − purata AST kontrol negatif ) xpurata AST perlakuan − purata AST kontrol negatif %
30
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk mengetahui dan membuktikan adanya efek
hepatoprotektif ekstrak etanol 50% daun jarong (Stachytarpheta indica (L.) Vahl.)
dan mengetahui besar dosis efektif hepatoprotektif dari ekstrak etanol 50% daun
jarong (Stachytarpheta indica (L.) Vahl.) pada tikus jantan galur Wistar terinduksi
karbon tetraklorida, dengan melihat pengaruh pemberian ekstrak tersebut dalam
kurun waktu 24 jam terhadap kadar ALT dan AST. Pada penelitian ini aktivitas
serum ALT dan AST digunakan sebagai parameter uji kuantitatif.
A. Hasil Determinasi Tanaman Jarong
Tanaman jarong merupakan tanaman yang digunakan sebagai tanaman
uji pada penelitian tersebut. Determinasai tanaman digunakan untuk memastikan
bahwa daun yang digunakan adalah benar daun yang berasal dari tanaman jarong.
Tanaman jarong diperoleh dari kebun obat Kampus III Universitas Sanata
Dharma, Paingan, Maguwoharjo. Proses determinasi dilakukan di Laboratorium
Farmakognosi Fitokimia Fakultas Farmasi Universitas Sanata Dharma.
Determinasi dilakukan hingga tingkat spesies dengan cara mencocokkan
kesamaan makroskopis tanaman). Hasil determinasi (lampiran 6) menunjukkan
B. Penyiapan Bahan Uji 1. Pembuatan serbuk daun jarong
Daun jarong dibuat menjadi serbuk kering supaya kandungan fitokimia
yang terdapat pada daun jarong lebih mudah tersari oleh pelarut dan senyawa
yang diperoleh lebih banyak karena luas permukaan kontak dengan pelarutnya
semakin besar. Hasilnya didapatkan serbuk halus daun jarong yang melewati
ayakan nomor mesh 40.
2. Penetapan kadar air serbuk daun jarong
Tujuan penetapan kadar air adalah untuk melihat kandungan air yang
masih ada pada serbuk daun jarong, apakah memenuhi syarat kualitas serbuk
simplisia yang baik atau tidak. Menurut BPOM RI (1995), kadar air pada serbuk
simplisia adalah tidak lebih dari 10%.
Penetapan kadar air serbuk daun jarong dilakukan dengan metode
Gravimetri dengan menggunakan alat moisture balance. Berdasarkan hasil
perhitungan didapatkan kadar air serbuk daun jarong sebesar 8,26%. Hasil
pengujian ini menunjukkan bahwa serbuk daun jarong telah memenuhi
persyaratan kadar air sebagai serbuk simplisia yang baik.
3. Uji tabung kandungan polifenol serbuk daun jarong
Uji kandungan polifenol menunjukkan hasil positif adanya polifenol. Dari
gambar nomor 5-6 menunjukkan urutan perubahan warna yang terjadi pada filtrat
simplisia dalam air, dari warna kuning bening menjadi hijau pekat yang
menandakan hasil positif (+) pada uji polifenol (flavonoid termasuk dalam
yang terjadi pada filtrat simplisia dalam etanol 50% yang disaring dalam keadaan
panas, dari warna cokelat bening menjadi biru pekat yang menandakan hasil
positif (+) pada uji polifenol (flavonoid termasuk dalam polifenol).
Gambar 5-8. Hasil uji kualitatif kandungan polifenol dalam serbuk daun Jarong (Dokumentasi pribadi, 2015)
5. 6.
C. Pembuatan Ekstrak Etanol 50% Daun Jarong
Pembuatan ekstrak etanol 50% daun jarong dilakukan menggunakan
metode penyarian yaitu maserasi. Metode maserasi merupakan metode yang
dilakukan dengan memasukkan serbuk simplisia ke dalam labu erlenmeyer, yang
kemudian direndam dengan pelarut selama 24 jam dengan bantuan shaker. Dan
re-maserasi dilakukan dengan menambahan pelarut ke dalam ampas dari proses
maserasi yang dilakukan sebelumnya. Tujuannya adalah supaya zat-zat yang
belum tersari di maserasi sebelumnya dapat tersari dalam re-maserasi. Maserasi
dipilih sebagai metode penyarian karena peralatan yang digunakan sederhana dan
cara pengerjaan serta pengoperasian alat yang mudah. Cairan penyari yang
digunakan adalah etanol 50% karena senyawa hipotesis yang diketahui adalah
glikosida fenolik yang dapat larut dalam pelarut polar. Etanol 50% dipilih karena
bersifat polar dan sangat berguna untuk menghindari klorofil, senyawa resin atau
polimer yang biasanya tidak mempunyai aktivitas berarti namun seringkali
menimbulkan masalah farmasetis seperti terjadinya pengendapan yang sulit
dihilangkan pada ekstrak (Wijesekera, 1991).
Hasil dari maserasi dan re-maserasi didapatkan ekstrak etanol cair yang
kemudian dicampur dan diuapkan menggunakan vacum rotary evaporator.
Selanjutnya diuapkan kembali dalam cawan porselen diatas waterbath sehingga
didapatkan ekstrak kental dengan bobot tetap. Dari hasil pengeringan di atas
waterbath didapatkan bahwa perubahan bobot ekstrak etanol 50% daun Jarong
telah mencapai kurang dari 0,5 mg sehingga dapat dikatakan bahwa ekstrak telah
yaitu sebesar 5,14 g. Gambar 9 menunjukkan gambar ekstrak etanol 50% daun
jarong yang diuapkan diatas waterbath dan gambar 10 menunjukkan gambar
ekstrak kental etanol 50% daun jarong yang sudah dilarutkan dengan CMC-Na
1%.
Gambar 9. Ekstrak kental etanol 50% daun Jarong (Dokumentasi pribadi, 2015)
D. Uji Pendahuluan 1. Penetapan dosis hepatotoksin karbon tetraklorida
Penetapan dosis hepatoksin bertujuan untuk menentukan besar dosis
karbon tetraklorida yang dapat menyebabkan kerusakan hati berupa steatosis
(perlemakan hati) tanpa menyebabkan kematian pada tikus. Janakat dan Al-Merie
(2003) menyebutkan bahwa karbon tetraklorida dengan dosis 2,0 mL/kgBB
mampu meningkatkan aktivitas serum ALT dan AST yang menyebabkan
kerusakan sel-sel hati tetapi tidak menyebabkan kematian pada tikus.
2. Penetapan dosis ekstrak etanol 50% daun jarong
Penentuan dosis ekstrak etanol 50% mengacu pada penelitian yang
dilakukan oleh Joshi et al (2010) yang menyebutkan bahwa dosis efektif ekstrak
etanol daun jarong adalah 200 mg/kgBB. Dosis 200 mg/kgBB dijadikan sebagai
dosis tengah, sehingga pada penelitian ini digunakan tiga peringkat dosis dengan
faktor kelipatan 2 dan diperoleh dosis rendah 100 mg/kgBB, dosis tengah 200
mg/kgBB, dan dosis tinggi 400 mg/kgBB.
3. Penetapan waktu pencuplikan darah
Penetapan dosis hepatoksin bertujuan untuk mengetahui waktu ketika
karbon tetraklorida pada dosis 2,0 mL/kgBB memberikan efek hepatotoksis
maksimal, yang ditunjukkan dengan peningkatan aktivitas serum ALT dan AST
paling tinggi. Pada penelitian ini, senyawa diujikan pada tikus jantan galur Wistar
secara i.p dengan dosis 2,0 mL/kgBB., kemudian dilakukan pencuplikan darah
Data hasil pengujian aktivitas serum pada tiap waktu pencuplikan darah
dapat dilihat pada tabel III dan gambar 11.
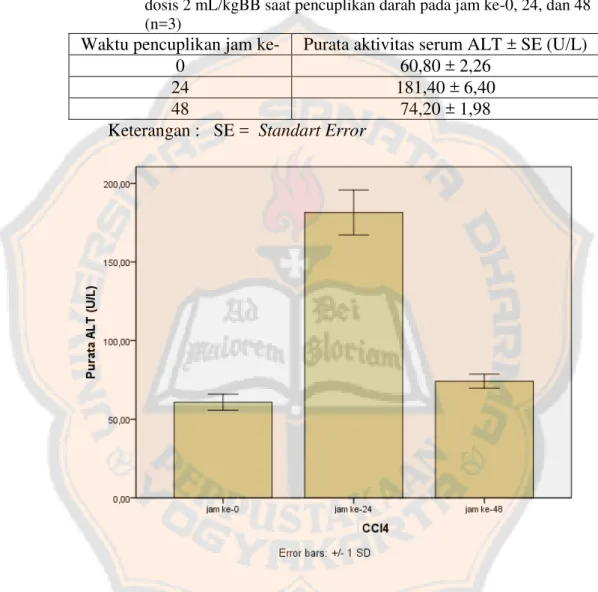
Tabel III. Purata kadar ALT tikus setelah induksi karbon tetraklorida dengan dosis 2 mL/kgBB saat pencuplikan darah pada jam ke-0, 24, dan 48 (n=3)
Waktu pencuplikan jam ke- Purata aktivitas serum ALT ± SE (U/L) 0 60,80 ± 2,26
24 181,40 ± 6,40 48 74,20 ± 1,98 Keterangan : SE = Standart Error
Gambar 11. Diagram batang purata kadar ALT pada selang waktu 0, 24, dan 48 jam setelah pemberian karbon tetraklorida dosis 2 mL/kgBB
Hasil pengukuran kadar ALT pada jam ke-0, 24, dan 48 berturut-turut adalah
60,80 ± 2,26; 181,40 ± 6,40; dan 74,20 ± 1,98 U/L. Perbandingan kadar ALT
antara kondisi sebelum menerima pelakuan (pencuplikan jam ke-0) serta jam 24
dan 48 jam setelah menerima perlakuan hepatotoksin CCl4.
Hasil statistik uji T berpasangan menunjukkan kadar ALT serum pada jam
ke-24 terjadi peningkatan yang signifikan dan berbeda bermakna dengan nilai
signifikansi 0,000 (<0,05). Selain itu terjadi peningkatan nilai ALT sebesar 3 kali
terhadap nilai ALT pada jam ke-0. Hal ini menunjukkan bahwa pemberian karbon
tetraklorida pada jam ke-24 terbukti menyebabkan kerusakan hati paling
maksimal. Kemudian pada jam ke-48 terjadi penurunan, tetapi belum mencapai
keadaan normal (p=0,000). Hasil uji T berpasangan kadar ALT ditunjukkan pada
tabel IV.
Tabel IV. Hasil uji T berpasangan kadar ALT tikus setelah induksi karbon tetraklorida dengan dosis 2 mL/kgBB saat pencuplikan darah pada jam ke-0, 24, dan 48 (n=3)
Waktu pencuplikan (jam ke-)
Jam ke-0 Jam ke-24 Jam ke-48
Jam ke-0 BB BB
Jam ke-24 BB BB
Jam ke-48 BB BB
Pengujian juga dilakukan terhadap kadar AST tikus. Data kadar AST
tertera pada Tabel V dan Gambar 12.
Tabel V. Purata kadar AST tikus setelah induksi karbon tetraklorida dengan dosis 2 mL/kgBB saat pencuplikan darah pada jam ke-0, 24, dan 48
(n=3)
Waktu pencuplikan jam ke- Purata aktivitas serum AST ± SE (U/L) 0 141,20 ± 5,15
24 452,40 ± 32,45 48 156,80 ± 4,61 Keterangan : SE = Standart Error
Gambar 12. Diagram batang purata kadar AST pada selang waktu 0, 24, dan 48 jam setelah pemberian karbon tetraklorida dosis 2 mL/kgBB
Hasil pengukuran kadar AST pada jam ke-0, 24, dan 48 berturut-turut adalah
141,20 ± 5,15; 452,40 ± 32,45; dan 156,80 ± 4,61 U/L. Perbandingan kadar AST
dilakukan dengan analisis statistik uji T berpasangan untuk melihat perbedaan
antara kondisi sebelum menerima pelakuan (pencuplikan jam ke-0) serta jam 24
dan 48 jam setelah menerima perlakuan hepatotoksin CCl4.
Hasil statistik uji T berpasangan menunjukkan terdapat perbedaan bermakna
antar kelompok. Pada jam ke-24 terjadi peningkatan yang signifikan dan berbeda
bermakna dengan nilai signifikansi 0,000 (<0,05). Selain itu terjadi peningkatan
ke-48 mengalami penurunan meskipun belum mencapai keadaan normal
(p=0,001). Hasil uji T berpasangan ditunjukkan pada tabel VI.
Tabel VI. Hasil uji T berpasangan kadar AST tikus setelah induksi karbon tetraklorida dengan dosis 2 mL/kgBB saat pencuplikan darah pada jam ke-0, 24, dan 48 (n=3)
Waktu pencuplikan (jam ke-)
Jam ke-0 Jam ke-24 Jam ke-48
Jam ke-0 BB BB
Jam ke-24 BB BB
Jam ke-48 BB BB
Berdasarkan hasil diatas, karbon tetraklorida diketahui memiliki efek
hepatotoksis yang paling tinggi pada jam ke-24, sehingga waktu pencuplikan
darah yang digunakan adalah jam ke-24 setelah pemberian karbon tetraklorida 2
mL/kgBB secara i.p.
E. Efek Hepatoprotektif Pemberian Ekstrak Etanol 50% Daun Jarong Pada Tikus Jantan Galur Wistar Terinduksi Karbon Tetraklorida
Penelitian ini dilakukan untuk mengetahui dan membuktikan adanya efek
hepatoprotektif ekstrak etanol 50% daun jarong serta mengetahui besar dosis
efektif hepatoprotektif ekstrak etanol 50% daun jarong pada tiga peringkat dosis
yang berbeda. Evaluasi efek hepatoprotektif ekstrak etanol 50% daun jarong
dilihat dari ada tidaknya penurunan kadar ALT dan AST.
Pemberian ekstrak etanol 50% daun jarong dilakukan secara per oral
dengan tiga peringkat dosis, yaitu dosis I sebesar 100 mg/kgBB; dosis II sebesar
200 mg/kgBB; dan dosis III sbesar 400 mg/kgBB. Senyawa hepatoksin yang