Rangkuman Rangkuman
Pengertian Kristalografi Pengertian Kristalografi
Kristalografi merupakan bidang ilmu yang mempelajari struktur suatu bahan dalam Kristalografi merupakan bidang ilmu yang mempelajari struktur suatu bahan dalam arti seluas-luasnya, baik keteraturan yang tampak secara eksternal ataupun secara arti seluas-luasnya, baik keteraturan yang tampak secara eksternal ataupun secara mikroskopik.
mikroskopik. Dalam pengertian lebih luas, kristalografi adalah studi tentang kristal: bentuk, Dalam pengertian lebih luas, kristalografi adalah studi tentang kristal: bentuk, pertumbuhan,
pertumbuhan, struktur, struktur, kimia, kimia, ikatan, ikatan, dan dan sifat-sifat sifat-sifat fisik. fisik. Keteraturan Keteraturan sifat sifat internal internal ini ini (pada(pada level atomik) sangat mempengaruhi sifat-sifat mekanik, fisik dan kimia material.
level atomik) sangat mempengaruhi sifat-sifat mekanik, fisik dan kimia material.
Kristal dapat terbentuk dalam; Kristal dapat terbentuk dalam;
- Kristal tunggal - Kristal tunggal - Polikristal - Polikristal - Mikrokristal - Mikrokristal - Nanokristal - Nanokristal
Amorf yaitu zat padat yang tidak memiliki bentuk pengulangan keteraturan, jangkauan Amorf yaitu zat padat yang tidak memiliki bentuk pengulangan keteraturan, jangkauan keteraturan atom biasanya sampai tetangga kedua.
keteraturan atom biasanya sampai tetangga kedua.
Sifat-sifat sesuatu bahan seperti kekuatan , kekerasan, kelistrikan , sifat termal, warna Sifat-sifat sesuatu bahan seperti kekuatan , kekerasan, kelistrikan , sifat termal, warna dan yang lainnya, ditentukan oleh struktur internal bahan tersebut.
dan yang lainnya, ditentukan oleh struktur internal bahan tersebut. Hal ini melibatkan atom Hal ini melibatkan atom dan cara-cara
dan cara-cara atom tersebut atom tersebut berikatan dengan atom berikatan dengan atom sekitarnya sekitarnya dalam Kristal, dalam Kristal, molekul, ataumolekul, atau struktur mikro lainnya. Dalam semua zat padat atom0atom disatukan bersama oleh suatu ikatan, struktur mikro lainnya. Dalam semua zat padat atom0atom disatukan bersama oleh suatu ikatan, dan ikatan inilah yang memberikan kekuatan, sifat-sifat terma dan kelistrikan pada zat tersebut. dan ikatan inilah yang memberikan kekuatan, sifat-sifat terma dan kelistrikan pada zat tersebut. Misalnya ikatan yang kuat akan menyebabkan suhu lebur yang tinggi modus kelentingan yang Misalnya ikatan yang kuat akan menyebabkan suhu lebur yang tinggi modus kelentingan yang besar,
besar, jarak jarak antar antar atom atom pendek, pendek, dan dan koefisien koefisien muai muai yang yang rendah rendah , , mobilitas mobilitas electron electron valensivalensi electron valensi dalam ikatan akan menentukan sifat hantaran listrik dan hantaran kalor suatu electron valensi dalam ikatan akan menentukan sifat hantaran listrik dan hantaran kalor suatu bahan. Demikian pula dengan sifat optisnya seperti misalny
bahan. Demikian pula dengan sifat optisnya seperti misalnya sifat tak tembus cahaya pada logam.a sifat tak tembus cahaya pada logam. Pada dasarnya kebanyakan zat padat berbentuk Kristal , dimana atom,ion , atau Pada dasarnya kebanyakan zat padat berbentuk Kristal , dimana atom,ion , atau molekul-molekul penyusunnya tersusun secara teratur dalam pola tiga dimensi, dan pola-pola ini berulang molekul penyusunnya tersusun secara teratur dalam pola tiga dimensi, dan pola-pola ini berulang dengan teratur dalam rentang yang panjang. Pada beberapa zat seperti kaca, kebanyakan plastic , dengan teratur dalam rentang yang panjang. Pada beberapa zat seperti kaca, kebanyakan plastic , dan beberapa logam, partikel penyusunnya tidak memiliki pola susunan tertentu yang berulang dan beberapa logam, partikel penyusunnya tidak memiliki pola susunan tertentu yang berulang secara teratur dan tegas seprti pada Kristal. Bentuk
secara teratur dan tegas seprti pada Kristal. Bentuk susunan Kristal seperti ini disebut amorf.susunan Kristal seperti ini disebut amorf.
Ditinjau dari struktur atom penyusunnya, bahan padat dibedakan menjadi tiga yaitu kristal Ditinjau dari struktur atom penyusunnya, bahan padat dibedakan menjadi tiga yaitu kristal tunggal (
tunggal (monocrystal monocrystal ), polikristal (), polikristal ( polycrystal polycrystal ), dan), dan amorf amorf .. Pada kristal tunggal, atom atauPada kristal tunggal, atom atau penyusunnya mempunyai struktur tetap karena atom-atom atau molekul-molekul penyusunnya mempunyai struktur tetap karena atom-atom atau molekul-molekul penyusunnya tersusun secara teratur dalam pola tiga dimensi dan pola-pola ini berulang penyusunnya tersusun secara teratur dalam pola tiga dimensi dan pola-pola ini berulang secara periodik dalam rentang yang panjang tak berhingga
secara periodik dalam rentang yang panjang tak berhingga.. Polikristal dapat didefinisikanPolikristal dapat didefinisikan sebagai kumpulan dari kristal-kristal tunggal yang memiliki ukuran sangat kecil dan saling sebagai kumpulan dari kristal-kristal tunggal yang memiliki ukuran sangat kecil dan saling menumpuk yang membentuk benda padat.
Struktur
Struktur
amorf
amorf
menyerupai pola hampir sama dengan kristal, akan tetapi pola susunanmenyerupai pola hampir sama dengan kristal, akan tetapi pola susunan atom-atom, ion-ion atau molekul-molekul yang dimiliki tidak teratur dengan jangka yang atom-atom, ion-ion atau molekul-molekul yang dimiliki tidak teratur dengan jangka yang pendek. Amorf terbentuk karena proses pendinginan yang terlalu cepat sehingga atom-atom pendek. Amorf terbentuk karena proses pendinginan yang terlalu cepat sehingga atom-atom tidak dapat dengan tepat menempati lokasi kisinya.tidak dapat dengan tepat menempati lokasi kisinya. Bahan seperti gelas, nonkristalin ataupun Bahan seperti gelas, nonkristalin ataupun vitrus yaitu memiliki struktur yang identik dengan
vitrus yaitu memiliki struktur yang identik denganamorfamorf .Susunan dua-dimensional simetris dari.Susunan dua-dimensional simetris dari dua jenis atom yang berbeda
dua jenis atom yang berbeda antara kristal danantara kristal danamorfamorfditunjukkan pada Gambar 1.1.ditunjukkan pada Gambar 1.1.
Gambar 1.1. Struktur kristal
Gambar 1.1. Struktur kristal a) struktur Kra) struktur Kristal istal yang memiliki susunan teryang memiliki susunan teratur.atur. b) merupakan struktur amorf yang susunan atomnya tidak teratur b) merupakan struktur amorf yang susunan atomnya tidak teratur
(Smallman, 2000). (Smallman, 2000).
1.2. Perkembangan Kristalografi 1.2. Perkembangan Kristalografi
Dapat dipahami bahwa kristal dengan simetri eksternal merupakan benda yang pertama diamati Dapat dipahami bahwa kristal dengan simetri eksternal merupakan benda yang pertama diamati dalam
dalam bidang ini. bidang ini. Tercatat NTercatat Nicolaus icolaus Steno pada Steno pada tahun 1669 tahun 1669 mulai mulai mengamati mengamati penumbuhanpenumbuhan kristal.
kristal.
250 tahun kemudian penelitian Steno diteruskan oleh Hauy, Wollaston, Bravais, Miller, 250 tahun kemudian penelitian Steno diteruskan oleh Hauy, Wollaston, Bravais, Miller, Schoenflies dll. yang mengembangkan kristalografi berdasarkan observasi dan teori Schoenflies dll. yang mengembangkan kristalografi berdasarkan observasi dan teori matematik tentang pola.
matematik tentang pola.
Eksperimen pertama untuk mengungkap struktur kristal dengan sinar-x dilakukan oleh Max von Eksperimen pertama untuk mengungkap struktur kristal dengan sinar-x dilakukan oleh Max von Laue pada 1912. William H. Bragg dan anaknya menggunakan XRD di 19
Laue pada 1912. William H. Bragg dan anaknya menggunakan XRD di 19 13 untuk menentukan13 untuk menentukan struktur kristal garam dapur (NaCl) yang pertama kali.
struktur kristal garam dapur (NaCl) yang pertama kali.
Tanpa mengetahui unsur dasar pembangun (saat ini kita kenal sebagai atom) mereka mampu Tanpa mengetahui unsur dasar pembangun (saat ini kita kenal sebagai atom) mereka mampu mengklasifikasi kristal ke dalam:
mengklasifikasi kristal ke dalam: ¾
¾ 230 grup ruang230 grup ruang ¾
¾ 32 klas kristal32 klas kristal ¾
Suatu obyek atau pola memiliki simetri bila benda tersebut tidak berubah dengan operasi rotasi Suatu obyek atau pola memiliki simetri bila benda tersebut tidak berubah dengan operasi rotasi atau refleksi. Hanya beberapa sudut rotasi simetri yang mungkin yakni 60
atau refleksi. Hanya beberapa sudut rotasi simetri yang mungkin yakni 60oo, 90, 90oo, 120, 120oo, 180, 180oo dandan 360
360oo..
Kombinasi operasi rotasi dan simetri berjumlah terbatas, hal ini menghasilkan
Kombinasi operasi rotasi dan simetri berjumlah terbatas, hal ini menghasilkan 32 klas kristal dan32 klas kristal dan 7 sistem kristal yakni: Kubus, heksagonal, tetragonal, trigonal, ortorombik, monoklinik, dan 7 sistem kristal yakni: Kubus, heksagonal, tetragonal, trigonal, ortorombik, monoklinik, dan triklinik (Detail pada
triklinik (Detail pada bab berikutnbab berikutnya). Dengan ya). Dengan menambah simetri translasi akan menambah simetri translasi akan diperolehdiperoleh 230
230 space group space group. Pengetahuan tentang space group dapat diperoleh dari difraksi sinar-x.. Pengetahuan tentang space group dapat diperoleh dari difraksi sinar-x.
1.3. Kristalografi Modern 1.3. Kristalografi Modern
Pada saat ini para ahli kristalografi terus menggunakan difraksi sinar-x (XRD) dan teknik Pada saat ini para ahli kristalografi terus menggunakan difraksi sinar-x (XRD) dan teknik sinar-x lainnya untuk menentukan dan
sinar-x lainnya untuk menentukan dan mengerti struktur kristal.mengerti struktur kristal. Tentu saja pengguna XRD bukan hanya kristalografer tetapi juga: Tentu saja pengguna XRD bukan hanya kristalografer tetapi juga:
¾
¾ material saintismaterial saintis ¾ ¾ kimiawankimiawan ¾ ¾ metalurgismetalurgis ¾ ¾ fisikawanfisikawan ¾
¾ bahkan para “life scientists” sep bahkan para “life scientists” seperti biologis, dokter medis dll.erti biologis, dokter medis dll. ¾
¾ demikian pula di industridemikian pula di industri Eksperimen difraksi pada saat ini: Eksperimen difraksi pada saat ini:
¾
¾ menggunakan difraktometer yang dikontrol oleh komputermenggunakan difraktometer yang dikontrol oleh komputer ¾
¾ memanfaatkan software canggih untuk analisis datamemanfaatkan software canggih untuk analisis data Informasi tentang intensi
Informasi tentang intensitas dan tas dan posisi sinar terdifraksposisi sinar terdifraksi dapat digunakan untuk menghitung petai dapat digunakan untuk menghitung peta tiga dimensi dari kerapatan elektron. Studi pada tekanan atau suhu tinggi digunakan untuk tiga dimensi dari kerapatan elektron. Studi pada tekanan atau suhu tinggi digunakan untuk mempelajari bagaimana struktur kristal berubah ketika sistem dipanaskan atau dalam stress. mempelajari bagaimana struktur kristal berubah ketika sistem dipanaskan atau dalam stress. X-ray diffraction (XRD)
X-ray diffraction (XRD) – – pada umumnya metode bubuk pada umumnya metode bubuk – – dimanfaatkan secara reguler untuk: dimanfaatkan secara reguler untuk: ¾
¾ kontrol kualitas pada industri metal dan keramikkontrol kualitas pada industri metal dan keramik ¾
¾ identifikasi mineral bagi para ahli geologi, dan untukidentifikasi mineral bagi para ahli geologi, dan untuk ¾
¾ karakterisasi asbestos bagi ilmuan kesehatankarakterisasi asbestos bagi ilmuan kesehatan
Saintis juga terus-menerus mencari suatu metode baru untuk mempelajari kristal. Pada tahun Saintis juga terus-menerus mencari suatu metode baru untuk mempelajari kristal. Pada tahun 1960an transmission
1960an transmission electron microscopes electron microscopes (TEM) dikembangkan (TEM) dikembangkan sehingga memungkinkan studisehingga memungkinkan studi difraksi
difraksi elektron oleh elektron oleh kristal. kristal. Lebih lLebih lanjut bayangan anjut bayangan TEM dari TEM dari kristal ykristal yang sangat ang sangat tipistipis menunjukkan secara visual beberapa cacat dalam pola-pola kristal seperti kehilangan atom menunjukkan secara visual beberapa cacat dalam pola-pola kristal seperti kehilangan atom (vakansi) dan kesalahan lapisan (dislokasi).
(vakansi) dan kesalahan lapisan (dislokasi).
Scanning tunneling microscopy (STM), dikembangkan pada tahun 1980an, menggunakan ujung Scanning tunneling microscopy (STM), dikembangkan pada tahun 1980an, menggunakan ujung tungsten yang sangat tajam/halus untuk memetakan topografi atomik permukaan kristal. Karena tungsten yang sangat tajam/halus untuk memetakan topografi atomik permukaan kristal. Karena kristal berinteraksi dengan sekelilingnya melalui permukaan maka studi STM memberikan kristal berinteraksi dengan sekelilingnya melalui permukaan maka studi STM memberikan informasi penting tentang penumbuhan kristal dan dissolusi sekaligus juga adsorpsi zat pada informasi penting tentang penumbuhan kristal dan dissolusi sekaligus juga adsorpsi zat pada
permukaan kristal.
Para periset biologi dalam mencoba identifikasi dan karakterisasi molekul penting dalam tanaman dan binatang pada umumnya mencoba konsentrasi dan mengkristalkan molekul- molekul.
Apabila hal ini dapat dikerjakan, strukturnya dapat ditentukan dengan X-ray diffraction. Sebagai contoh, studi sinar-x pada kristal DNA oleh Rosalind Franklin (1920-58) dan lainnya dipimpin oleh James D. Watson dan Francis Crick yang mengusulkan struktur double helix pada molekul DNA pada tahun 1952.
Sejak itu, struktur dari berbagai molekul organik penting telah dapat ditentukan dengan cara ini. Oleh karena itu banyak ahli-ahli biologi molekular dan kimia organik adalah kristalografer atau telah menggunakan data-data kristalografi.
TEORI KRISTALISASI
Kristalisasi adalah salah satu dari beberapa cara (termasuk aggregasi non spesifik/ precipitant) yang mana larutan supersaturasi metastabil dapat mencapai keadaan energi terendah yang stabil dengan mereduksi konsentrasi protein. Ada tiga tingkat dari kristalisasi yang umum untuk semua sistem : nukleasi, pertumbuhan, dan perhentian pertumbuhan.
Nukleasi adalah proses dimana molekul atau agregat non kristalin yang berada dalam keadaan bebas dalam larutan berkumpul bersama dalam suatu cara untuk menghasilkan sebuah agregat stabil secara termodinamik dengan kisi yang berulang. Kristalisasi dikenal dengan merendahkan energi bebas dari protein dengan ~3-6 kkal/mol relatif terhadap keadaan larutan Pembentukan agregat kristalin dari larutan supersaturasi bagaimanapun tidak mengharuskan pembentukan kristal maksroskopik. Malahan, agregat pertama harus melebihi ukuran spesifik (ukuran kritis) yang didefinisikan sebagai perbandingan luas permukaan agregat terhadap volumenya Jika ukuran kritis terlampaui, agregat menjadi sebuah inti superkritis yang mempunyai kemampuan untuk melanjutkan pertumbuhan. Jika ukuran inti lebih kecil dari ukuran kritis, pemutusan secara spontan akan terjadi.
Derajat dimana nukleasi terjadi ditentukan oleh derajat supersaturasi dari protein dalam larutan. Pemahaman dari supersaturasi sebaliknya dihubungkan dengan daya larut keseluruhan dari molekul yang mengalami kristalisasi. Daya larut yang tinggi menyebabkan sejumlah besar dari molekul bertumbukan secara difusi. Kemudian derajat yang lebih tinggi dari supersaturasi menghasilkan agregat yang lebih stabil (disebabkan oleh kemungkinan molekul bertumbukan secara difusi lebih tinggi) dan karena itu menambah kemungkinan dari pembentukan inti stabil. Pada kasus jumlah molekul terlarut terbatas, kondisi ini secara umum menghasilkan sejumlah besar dari kristal kecil.
Pertumbuhan kristal secara umum dimulai pada konsentrasi protein yang cukup untuk nukleasi terjadi, dan berlanjut pada konsentrasi dibawah konsentrasi ambang. Kecepatan pertumbuhan adalah ditentukan oleh kombinasi dari pertumbuhan permukaan kristal dan kecepatan difusi. Pertambahan dari molekul menuju permukaan kasar memerlukan energi yang lebih kecil daripada pertambahan pada permukaan halus. Menurut teori rantai ikatan periodik tiga jenis berbeda dari permukaan kristal yang ada : permukaan plat, permukaan “stepped”, dan permukaan kusut. Permukaan plat memerlukan nukleasi dua dimensi untuk menginduksi pertumbuhan, dan memperlambat pertumbuhan. Pertumbuhan permukaan “stepped” memerlukan hanya nukleasi satu dimensi, dan kemudian mempunyai kecepatan pertumbuhan intermediat. Permukaan “stepped” secara khusus terjadi jika hasil dari sumbu srew kristallografi menyebabkan pola pertumbuhan spiral yang terjadi pada permukaan dari kristal. Akhirnya, permukan kusut adalah kedudukan pertumbuhan yang tidak memerlukan nukleasi untuk mempromosikan
pertumbuhan selanjutnya. Kemudian jenis dari permukaan kristal pertumbuhan secara kuat dipengaruhi oleh kecepatan yang mana terjadi pertumbuhan kristal.
Pertumbuhan kristal dari inti juga secara kuat dipengaruhi oleh efek konveksi/ aliran dan difusi /tumbukan. Seperti dengan nukleasi, bertambahnya daya larut menghasilkan kecepatan pertumbuhan yang bertambah. Feher dan Kam, menggunakan mikroskop ultraviolet telah mendemonstrasikan daerah disekitar pertumbuhan kristal dengan konsentrasi protein yang lebih rendah relatif terhadap larutan disekitarnya. Kecepatan difusi dari protein didalam dan diluar dari lingkaran sekitar pertumbuhan kristal memberikan faktor kecepatan terbatas.
Pembentukan dari lingkaran pada proses pertumbuhan disebabkan konsentrasi protein yang lebih rendah disekitar pertumbuhan kristal juga mempengaruhi produksi gradien density dalam area ini. Jika pembentukan dari gradien konsentrasi sekitar pertumbuhan kristal sebanding dengan kecepatan dimana molekul bertambah terhadap permukaan (kecepatan pertumbuhan kristal), pertumbuhan yang lebih lambat mengurangi arus konveksi. Ini mungkin disertai dengan pertumbuhan kristal dalam media gel yang berpori. Pertumbuhan kristal dalam gravity nol (efektif) dapat digunakan untuk memindahkan efek konveksi dan sedimentasi .
Perhentian pertumbuhan dari kristal dapat dilakukan dalam berbagai cara. Salah satunya adalah pengurangan konsentrasi dari protein kristalisasi terhadap titik dimana fase padat dan larutan mencapai perubahan keseimbangan. Dalam kasus ini, penambahan protein dapat menghasilkan pertumbuhan kristal yang berlanjut. Poisonian dari permukaan pertumbuhan terjadi ketika molekul yang yang rusak atau asing tergabung dalam pertumbuhan permukaan kristal menghasilkan cacat yang mengganggu kisi kristal.
2.1. Sifat larutan yang mempengaruhi kristalisasi
Kristalisasi dari makromolekul adalah sebuah paradigma yang sama dengan lipatan protein. Ada berbagai macam faktor yang mempengaruhi kristalisasi protein : 1). Derajat tinggi mobilitas pada permukaan protein, 2) gambaran elektrostatik dari protein ( yaitu komposisi muatan sebagai campuran random dari muatan titik yang bergerak) , 3) komposisi zat kimia dan ketidakstabilan fisika dari protein (tidak terlipat, syarat hydrasi, sensitivitas temperature), dan 4) faktor spesifik molekul (seperti grup protestik dan ligan). Faktor-faktor ini berkontribusi secara besar terhadap kesukaran dan kekasaran dalam usaha-usaha untuk memprediksi sifat kristalisasi protein. Faktor-faktor diatas merupakan penyebab dari ketidakteraturan kristal (dan resolusi yang rendah dari data difraksi).
Faktor penting lain dalam kristalisasi adalah kemurnian dari sampel yang akan dikristalisasi. Kontaminasi 1 ppm dalam protein 10-20 mg/ml sama dengan 109molekul. Walaupun pertumbuhan kristal dilakukan memakai protein yang sudah murni, kehadiran konsentrasi tinggi zat asing dalam volume kecil, niscaya akan menimbulkan kontaminasi dari kisi kristal, dan akhirnya mendapatkan kristal yang jelek. Para ahli merekomemdasikan menggunakan HPLC untuk pemurnian secara umum dari protein dan untuk menyakinkan homogenitas pada kedua tingkat makroskopik dan mikroskopik. Lin mencatat beberapa kasus dimana menggunakan teknik HPLC telah meningkatkan keberhasilan kristalisasi dan juga resolusi maksimum pada saat kristal protein di difraksi sinar-X.
Seperti yang telah dijelaskan awal, kristalisasi molekul dari larutan supersaturasi metastabil berarti merendahkan energi bebas dari keseluruhan larutan. Precipitan kimia adalah metode yang banyak digunakan untuk pencapaian supersaturasi dari molekul untuk menginduksi kristalisasi. Untuk kristalisasi
dari protein, precipitan dapat dibagi dalam enam kategori: garam, polimer rantai dengan berat molekul yang tinggi (seperti PEG), MPD, protein organik, sulfonik kering, air terionisasi.
a. Garam.
Garam adalah precipitan yang biasa digunakan untuk kristalisasi makromolekul. Garam mempunyai latar belakang menambah kerapatan elektron rata-rata dari larutan kristalisasi yang mengurangi perbandingan sinyal noise untuk data kristalografi. Tetapi garam mempunyai kecendrungan berinteraksi
secara kuat dengan senyawa atom berat, sehingga menyebabkan pembuatan “derivative” kristal untuk fase M.I.R adalah sukar.
Kemanjuran dari garam tertentu sebagai precipitan adalah sebanding dengan kuadrat dari valensi dari kation dan anion yang membangun garam. Secara khusus anion adalah spesies yang lebih penting daripada kation, secara umum kation monovalen tidak berbahaya dan digunakan untuk mengindari pembentukan komplek protein /kation kuat yang cendrung terjadi dengan kation polyvalent (khususnya ion logam transisi khusus) Kemampuan dari garam untuk precipitan protein dapat secara umum dilukiskan dengan deret Hofmeister:
PO43>HPO42-=SO42.citrat>CH3CO2->Cl->Br ->NO3->CIO4->SCN -Dan
NH4+>K +>Na+>Li+
Anion dan kation yang paling lemah dalam deret Hofmeister mempunyai efek “salting in” daripada “salting out” protein. Anion PO43- tidak dijumpai dalam larutan dalam rentangan pH yang khusus digunakan untuk percobaan kristalisasi, dan ada dalam HPO42- dan H2PO4-. Juga kation NH4+ kehilangan H+diatas pH 8.0 dan titik didih dari NH3, membuat garam NH4+ sukar untuk digunakan untuk pH tinggi, dan juga membuat pH tinggi tidak stabil.
Dua kategori umum dari garam adalah yang pertama yang berinteraksi dengan air (garam non-chaotropik), dan yang berinteraksi dengan protein (garam chaotropik). Garam non chaotropik adalah terhidrasi terhadap larutan protein. Pengaruhnya adalah bertambahnya tegangan permukaan dari lingkungan protein dari makromolekul, kemudian dehydrasi dari permukaan protein. dan meniadakan efek volume, yang mana mengerakkan molekul protein untuk membentuk interaksi yang dekat satu sama lain. Larutan dari muatan garam ini mengubah protein dari satu dengan yang lain dengan menambah dielektrik protein, yang selanjutnya memfasilitasi interaksi protein-protein dengan tetangga terdekatnya. Pengikatan garam non-chaotropik dengan protein tidak secara umum memainkan hukum yang penting dalam kristalisasi, walaupun dalam beberapa kasus ion garam (terutama sulfat dan phosphate) terlihat mengikat makromolekul dalam struktur kristal, dan akibatnya bertindak sebagai kontak kisi antara molekul dalam kristal. Khususnya garam ini menambah kestabilan makromolekul dalam larutan.
Garam chaotropik secara umum tidak digunakan dalam kristalisasi disebabkan kecendrungan mereka untuk mengarami dalam makromolekul dan untuk menginduksi non lipatan melalui interaksi dengan elemen struktural dari protein.
b. Polimer.
Menggunakan polimer linear dengan berat molekul yang tinggi sebagai agen precipitan telah dipionir oleh Polson dan teman-temannya yang mencoba berbagi polimer termasuk polyethylene glycol, dextran, polyvinyl alcohol, dan polyvinyl pyrrolidone. Dari semua ini, plyethylene glycol (PEG) ditemukan lebih efektif dari segi kemampuan precipitan dan biaya. PEG dihasilkan dalam berbagai berat molekul, dari
200 (~3 monomer) sampai pada 1 juta (~15000 monomer), dan sebagai mono dan di methyl lainnya. Seperti garam, PEG berkompetisi dengan protein untuk air dan meniadakan efek volume ( yang bervariasi sesuai dengan panjang polymer). Namun tak seperti garam, PEG mengurangi dielektrik effektif dari larutan. Larutan dari (PEG) mempunyai kerapatan elektron rata-rata yang rapat ekivalent terhadap air dan secara umum tidak berinteraksi dengan senyawa atom berat, dan membuat PEG sangat cocok untuk kristalisasi makromolekul.. PEG dengan berat molekul kurang dari 1000 berbentuk cair dan secara umum digunakan pada konsentrasi diatas 40 % v/v. PEG dengan berat molekul diatas 1000 secara umum berbentuk padat dan digunakan dalam konsentrasi 5-50% w/v. Semua larutan PEG dibuat dengan memasukkan ~0, 1 % Na azide untuk menghindari pertumbuhan bakteri. Juga buffer konsentrasi tinggi (40 %) larutan PEG dengan Na citrate pada konsentrasi diatas 100 mM cendrung menyebabkan pembentukan transisi fasa dan perubahan warna dalam larutan PEG, yang mengsugesti beberapa bentuk reaksi.
c. MPD.
MPD adalah polyalcohol kecil ( 2-methyl-2,4 pentane diol) yang mempunyai sifat pertengahan antara yang mempunyai berat molekul rendah PEG dan protein organik. Fungsi MPD sebagai precipitan meliputi kompetisi dengan air, eklusion hydropobik dari protein protein, merendahkan dielektrik protein, dan efek seperti detergen. MPD secara umum digunakan dalam konsentrasi 40% v/v dengan air atau buffer, dan cendrung untuk menyebabkan transisi fasa. Jika dengan PEG, menggunakan MPD sebagai precipitan menghasilkan larutan density elektreon rendah yang tidak secara umum berinteraksi dengan senyawa atom berat.
d. Pelarut Organik.
Secara historik, pelarut organik telah digunakan sebagai precipitant untuk kristalisasi protein. Kristalisasi yang dilakukan dengan pelarut organik adalah dimulai selama pemurnian protein, khususnya dalam kehadiran pelarut organik biasa seperti ethanol, methanol, aceptone atau isopropanol (McPherson, 1990). Disebabkan gambaran hydropobik mereka, pelarut organik menyebabkan transisi fasa yang mirip dengan yang terbentuk oleh kehadiran MPD dan dielektrik bulk dari protein. Pelarut organik juga cendrung menyebabkan denaturasi protein, kecuali mereka digunakan pada temperature pada atau dibawah 0C. e. Sulfonik kering.
Sulfonik kering secara khusus dicantumkan dengan grup sulfonat. Studi awal oleh Lovrien dkk mengsugestikan bahwa molekul ini mungkin secara spesifik berinteraksi dengan permukaan protein dengan grup sulfonat kering. Lovrien mengsugestikan bahwa perbandingan dari ~1-5 molekul kering per molekul protein adalah cukup untuk kristalisasi..
f. Air terionisasi.
Dialisis protein terhadap air terionisasi sebagai sebuah metode dari kristalisasi mempunyai keuntungan dimana protein berada dalam lingkungan ion muatan positif dan negatif (efek Donnan). Jika awan dari anion dan kation ini dipindahkan secara dialysis, protein akan berusaha untuk bergerak disekitar dirinya yang akhirnya terjadi pembentukan struktur kisi dimensi (seperti kristalisasi).
Walaupun semua precipitan kimia telah didiskusikan diatas, bekerja dengan satu system atau lainnya, seringkali efek individual mereka sangat menonjol untuk kristalisasi dapat terjadi dan mungkin membentuk kristal satu atau dua dimensi yang jelek. Dalam kasus seperti itu, kombinasi dari precipitan (seperti garam dan PEG, MPD dan garam) menghasilkan kristal difraksi yang besar, dan grup ruang yang baik. Beberapa kombinasi yang paling baik (didasari dari percobaan kristalisasi) dapat dilihat pada table berikut :
Tabel 2.1. Kombinasi Precipitan yang terbaik Precipitan Mayor Additif Konsentrasi Precipitan
Mayor Konsentrasi Aditif (NH4)2SO4 Na citrate PEG 1000-20000 PEG 400-2000, MPD, ethanol, methanol PEG 400-2000, MPD, ethanol, methanol
(NH4)2SO4, NaCl, atau Na format 2.0-4.0 M 1.4-1.8 M 40 – 50 % 6 % - 0.5 % 6 % - 0.5% 0.2 – 0.6 M
Kecendrungan yang dapat dilihat dalam Tabel 2.1 adalah kombinasi dari salah satu spesies dielektrik tinggi (precipitan mayor) dengan sebuah spesies dengan precipitant diektrik rendah (minor), garam dengan PEG/MPD/organik), atau spesies dielektrik rendah (precipitant mayor) dengan spesies yang menaikkan dielektrik (precipitant minor, PEG/MPD/organik dengan garam). Kedua jenis kombinasi mungkin secara efektif menimbulkan ukuran yang besar dan efek kompetisi dengan air sementara menghindari repulsion muatan antar molekul dengan menambah dielektrik protein, kemudian diharapkan dapat menghasilkan kristalisasi dan kualitas dari kristal yang baik.
Aditif dapat juga digunakan untuk kristalisasi karena mempunyai sifat bereaksi dengan garam diluar dan didalam makromolekul. Larutan biphasic (seperti yang dihasilkan dengan mencampur konsentrasi tinggi dari garam dengan konsentrasi tinggi dari berat molekul tinggi PEG) efektif dalam menginduksi nukleasi dan kristalisasi.
Penambahan ion logam (terutama cadmium (Cd), cobalt (Co), dan mangan (Mn) untuk larutan kristalisasi dapat digunakan untuk menghasilkan nukleasi. Ion cadmium cendrung untuk membentuk kompleks kovalen yang sangat kuat antara grup asam karbolik yang berdekatan dalam susunan jenis planar persegi dengan semua empat oksigen asam karbolik yang terlibat dalam ikatan. Jenis dari ikatan ini dapat sebagai sebuah kontak kisi dalam sebuah kristal atau sebagai sebuah faktor nukleasi untuk pertumbuhan kristal protein. Mangan mempunyai interaksi yang mirip, sementara ion cobalt pada dasarnya berinteraksi dengan amino (lysine dan histidin).
Dua faktor kimia yang dapat digunakan untuk mengawali atau meningkatkan kristalisasi adalah mengubah visikositas senyawa dan anti twinning/solubizing senyawa(detergent dan lainnya). Seperti dicatat dalam bagian teori kristalisasi, kecepatan dimana kristal tumbuh sering mempengaruhi kualitas keseluruhan dari kristal.
Faktor penting lain dalam kristalisasi protein selain dari pada kompisisi kimia dari larutan induk adalah pH. Untuk beberapa protein, kristalisasi terjadi pada rentangan pH yang lebar dengan sedikit variasi dari morfologi kristal. Morfologi kristal, termasuk berbagai jenis twinned dan bentuk pertumbuhan polynukleasi, sering secara langsung dihubungkan dengan pH. Secara khusus, terdapat peningkatan disini
ada improvement gradual dalam morpologi k Dalam beberapa kasus, pH dari protein adalah pH pada mana pertumbuhan kristalnya paling baik.
Temperatur adalah faktor lain yang penting dalam kristalisasi protein. Kristalisasi dari protein dapatdilakukan dalam rentang temperatur dari 60 C sampai 0 C, walaupun mayoritas tercepat dari molekul adalah terkristalisasi pada 4 C atau 22 derajat (temperature kamar). Temperatur rendah cenderung bertindak sebagai bahan pengawet untuk protein yang sensitive dan juga inhibitor pertumbuhan bakteri. Daya larut protein dalam larutan garam cendrung bertambah pada temperature rendah (4 C), sementara dalam larutan PEG dan MPD, daya larut protein secara umum berkurang dengan berkurangnya temperature. Pemanasan, melting, dan pendinginan dari kristal atau agregat mungkin juga dapat dicoba untuk mendapatkan kristal besar, walaupun ini secara umum tidak sukses.
Modifikasi kimia/biokimia dari protein adalah faktor lain yang mungkin digunakan untuk mengubah kondisi kristalisasi. Karakteristik permukaan elektrostatik memainkan peranan yang penting dalam mengatur apakah sebuah protein terkristalisasi atau tidak. Kemudian, modifikasi atau muatan permukaan oleh salah satu kimia atau biokimia berarti dapat memberikan kristal dimana tidak satu pun
diketahui sebelumnya.
2.3. Metoda Fisika dari Kristalisasi
Tiga metode yang sering disertakan untuk mempengaruhi supersaturasi dalam kristalisasi dari makromolekul; Vapor diffusion (hanging drop dan sitting drop), batch, dan dialysis. Walaupun setiap dari teknik ini mencapai supersaturasi dari makromolekul tertentu untuk dikristalisasi, tetapi berapa cepat supersaturasi dicapai dalam setiap kasus bervariasi sangat besar, Setiap teknik ini akan didiskusikan dibawah:
a. Vapor diffusion.
Teknik vapor diffusion menggunakan penguapan dan difusi dari air antara larutan dari konsentrasi yang berbeda yang berarti mendekati dan mencapai supersaturasi dari makromolekul. Secara khusus larutan yang mengandung protein dicampur 1 : 1 dengan larutan yang mengandung precipitan pada konsentrasi akhir yang dicapai setelah vapor seimbang. Drop yang mengandung 1:1 campuran dari protein dan precipitan pada konsentrasi target, salah satunya hanging drop atau sitting drop. Perbedaan dalam konsentrasi precipitan antara drop dan larutan reservoir merupakan gaya penggerak yang menyebabkan air menguap dari drop sampai konsentrasi precipitan dari drop sama dengan konsentrasi precipitan dalam reservoir.
Vapor diffusion adalah teknik yang optimal untuk digunakan ketika menscrening sejumlah besar dari kondisi protein ( dengan memvariasikan komposisi dari setiap larutan reservoir). Selanjutnya metode ini dapat digunakan untuk menambah dan mengurangi konsentrasi dari protein dalam keadaan keseimbangan relatif terhadap konsentrasi awalnya
Salah satu kekurangan dari metode ini adalah cendrung untuk membentuk kristal yang lebih kecil dari metode lain. Ini disebabkan karena volume drop dibandingkan teknik lain yang menggunakan volume protein yang besar.
b. Metode Batch
Dalam metode batch, konsentrat protein dicampur dengan konsentrat precipitan untuk menghasilkan konsentrasi akhir yang supersaturasi dalam bentuk makromolekul terlarut untuk kristalisasi. Ini dapat dilakukan dengan mengambil sejumlah ml dari larutan dan akhirnya menghasilkan kristal yang
besar disebabkan volume yang besar dari protein. Teknik ini jauh lebih mahal dari pada teknik yang lain karena membutuhkan protein dengan jumlah yang besar, sehingga tidak umum digunakan untuk menscrening kondisi awal kristalisasi.
c. Dialisis
Teknik dialisis menggunakan difusi dan keseimbangan dari molekul precipitan kecil melalui membrane semipermiabel yang berarti secara lambat mendekati konsentrasi yang mana protein akan terkristalisasi. Pada awalnya, protein yang terkandung dalam membrane dialisis diseimbangkan terhadap larutan precipitan. Keseimbangan terhadap precipitan dalam lingkungan pelarut secara lambat mencapai supersaturasi untuk protein dalam membrane dialisis, dan akhirnya menghasilkan kristal. Keuntungan metode ini dibandingkan metode lain adalah larutan precipitan secara mudah dapat divariasikan dengan menggerakkan seluruh tabung dialisis dari satu kondisi ke kondisi lainnya. Protein dapat secara kontiniu “recycled” sampai kondisi yang benar dari kristalisasi ditemukan. Salah satu kekurangan dari metode ini adalah tidak dapat bekerja pada semua larutan konsentrat PEG karena PEG dapat menembus membran secara cepat.
Gambaran dari masing-masing metode diatas dapat dilihat pada Gambar 2.1. berikut:
(a)
(b)
(c) (d)
(b) Sitting drop vapor diffusion , (c) batch, dan (d) dialisis 2.4. Langkah-Langkah Kristalisasi
Kristalisasi molekul organik dilakukan dalam beberapa langkah:
a. Screen awal, untuk mengidentifikasi kondisi kristalisasi / nukleasi dari protein. Menyediakan larutan stok, terdiri dari buffer dengan pH berbeda, precipitan dan aditif dalam 50 ml tabung reaksi, kemudian difilter dengan filter 0,22 m filter dan disimpan pada temperatur kamar. Untuk screen awal, ukuran drop adalah 1 l protein dan 1 l larutan reservoir. Untuk menghindari drop dari pengeringan, jangan lebih dari 3 drop yang dibuat pada setip waktu.Tempatkan satu screen pada 4 C dan satu lagi pada temperatur kamar, jika protein stabil pada kedua temperatur tersebut. Dinginkan plat pada 4 C sebelum mempipet dengan drop untuk menghindari kondensasi pada kaca.
Desain Screen awal untuk :molekul organik 1. Untuk reservoir (20 kondisi)
1 A. Sulfat 1 M Buffer pH 6,5 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 6,5 DTT 2,5 mM Am. Sulfat 2 M Buffer pH 6,5 DTT 2,5 mM A. Sulfat 2,5 M Buffer pH 6,5 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 6,5 DTT 5 mM aA. Sulfat 1 M Buffer pH 7 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 7 DTT 2,5 mM Am. Sulfat 2 M Buffer pH 7 DTT 2,5 mM A. Sulfat 2,5 M Buffer pH 7 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 7 DTT 5 mM A. Sulfat 1 M Buffer pH 7,5 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 7,5 DTT 2,5 mM A. Sulfat 2 M Buffer pH 7,5 DTT 2,5 mM A. Sulfat 2,5 M Buffer pH 7,5 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 7,5 DTT 5 mM A. Sulfat 1 M Buffer pH 8 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 8 DTT 2,5 mM A. Sulfat 2 M Buffer pH 8 DTT 2,5 mM A. Sulfat 2,5 M Buffer pH 8 DTT 2,5 mM A. Sulfat 1,5 M Buffer pH 8 DTT 5 mM
2. Untuk Drop : diteteskan 1l molekul organik(dalam larutan daparnya, konsentrasi larutan dapar maupun konsentrasi garam yang terlarut didalamnya dijaga serendah mungkin) keatas plat yang sudah disilikonisasi. Kepada tetesan protein tadi, diteteskan 1 l larutan reservoir dan dibiarkan sesaat (beberapa menit) agar homogen
Jika plat dan reservoir sudah siap, pada permukaan reservoir diolesi dengan pasta silicon. Tujuannya adalah untuk mencegah evaporasi dari reservoir maupun drop. Kemudian plat yang sudah ada drop diatasnya, ditutupkan ke atas reservoir yang sesuai, sehingga benar-benar menutup rapat.
Eksperimen set hanging drop ini kemudian diinkubasi pada suhu yang diinginkan (suhu kamar atau 40C). Screen dicek segera setiap hari (dalam minggu pertama) amati precipitan/kristalisasi dari protein.dengan memakai pengkodean yang ada pada lembaran kerja dibawah.
b.Screen yang diatur,Setiap kondisi dari screen awal diatur untuk mendekati supersaturasi secara lambat.
Semua reservoir, dimana pada screen awal tidak teramati nukleasi, ulangi dengan modifikasi berikut:
1. Kondisi dimana protein terprecipitasi segera setelah pencampuran, konsentrasi precipitannya dikurangi setengahnya.
2. Kondisi tanpa penampakan precipitan setelah lebih dari dua minggu, maka konsentrasi protein ataupun konsentrasi precipitan ditambahkan duakali dari sebelumnya.
c. Optimasi screen, didasari hasil yang ditemukan dalam screen awal dan screen yang diatur, untuk mendapatkan kristal tunggal besar yang cocok untuk difraksi sinar-X.
Kondisi dimana nukleasi favorit yang teramati dalam screen awal atau screen yang diatur sekarang digunakan untuk optimasi screen. Untuk setiap kondisi, susun peralatan kristalisasi yang mana salah satu parameter divariasikan dan yang lain dijaga konstan.
1. Barisan A : precipitan 1 konsentrasinya divariasikan dengan precipitan 2 2. Barisan B : Precipitan 1 konsentrasinya divariasikan , tanpa precipitan 2 3. Barisan C : Buffer dan pH divariasikan
4. barisan D : Konsentrasi protein divariasikan
Rentangan konsentrasi untuk precipitan 1 dalam barisan A dan B biasanya antara setengah sampai konsentrasi precipitan dimana teramati precipitasi pada screen sebelumnya. Bandingkan hasil dari barisan A dan B untuk memperlihatkan apakah precipitan 2 penting, dan konsentrasi precipitan 1
optimal.
Hasil dari barisan C akan memperlihatkan kebergantungan pH.
Drop kemudian dicek dengan mikroskop dengan pembesaran 40 X atau pembesaran 100 x. .
d.Untuk improvisasi hasil kristal, tambahkan additif.
Hasil eksperimen direkam dengan menggunakan skala penskoran: Pengkodean :
1. :clear drop, tidak ada apa apa hanya larutan jernih
2. : precipitation, proteinnya mengendap, biasanya terlihat di bawah mikroskop sebagai warna gelap merata. Ini terjadi biasanya kalau protein yang digunakan sudah mengagregasi
3. :aggregation and denaturation, proteinnya rusak, biasanya terlihat sebagai sebaran acak berwarna gelap atau gumpalan
4. :nucleation, terlihat titik-titik kecil yang tersebar merata diseluruh drop. Nukleasi yang baik adalah pertanda pembentukan kristal
5. :microcrystal , kristal bentuk kecil-kecil, bisa dicoba dibiarkan dulu untuk melihat apakah akan tumbuh jadi kristal besar atau tetap, kalau tetap berarti memang kristalnya kecil. Hati-hati rancu dengan kristal garam !
6. : kristal protein ...
Untuk cek itu kristal garam atau protein, bias dilihat apakah kristalnya berpendar (birefringent) pada polarisasi warna atau tidak, kalau kristal protein akan berpendar dan pada bagian tepi kristal
mempunyai warna yang khas. Dalam sejarah kristalisasi protein, mikroskop polarisasi merupakan alat yang secara teratur digunakan oleh peneliti untuk mendeteksi dan mengkarakterisasi kristal yang cocok untuk analisis sinar-X. Terutama karena warna atraktif yang dihasilkannya dan teknik yang berguna untuk merepresentasikan pertumbuhan kristal dan habitatnya (Nollert, 2003). Cara yang lebih sederhana adalah kristalnya diambil dari drop, di “cuci” dengan buffernya dan kemudian dilarutkan kembali dan dicek dengan elektroforesis. Cara lain adalah,dibawah miksroskop biasa, gunakan seuntai ijuk lalu kristalnya di “sentuh”, kalau fragile (kelihatan mudah pecah atau lembut) itu tanda kristal protein, kalau garam biasanya keras dan solid.
3
Kisi dan Struktur Kristal
Dalam Kristal zat padat, atom, atau molekul-molekulnya tersusun sacara teratur dalam pola tiga dimensi. Tiap-tiap atom atau molekul tertentu tempatnya dalam suatu titik dalam ruang dan pada jarak yang tertentu. Demikian pula arah sudutnya dengan semua atom atau molekul di
sekelilingnya. Susunan sudut dalam ruang dari atom-atom dalam kristal disebut kisi ruang atau susunan kisi.
Suatu kristal yang ideal tersusun dari atom-atom yang teratur dalam suatu kisi, dimana terdapat tiga vector translasi dasar a, b, c. (Suwitra,1989:9). Semua struktur kristal dapat digambarkan atau dijelaskan dalamistilah-istilah lattice (kisi)dan sebuah basis yang ditempelkan pada setiap titik lattice (kisi).
Lattice (kisi) : Sebuah susunan titik yang teratur dan periodik di dalam ruang sebuah abstraksi matematik
Basis : Sekumpulan atom-atom
Jumlah atom dalam sebuah basis : satu buah atom atau lebih.
Contoh diperlihatkan pada Gambar 3.1.
Kisi dua dimensi Basis Struktur Kristal
Jarak antar kisi dalamarah sumbu X= a
Gambar 3.1. Kisi, basis dan struktur kristal Jarak antar kisi dalam arah sumbu Y= b
Jarak dari satu titik ke titik yang lain boleh sama atau berbeda,jika sama( dalm kisi dua dimensi) akan berbentuk bujur sandkar dan jika berbeda akan berbentuk 4 persegi panjang.
Contoh : H2O = 1 basis ada (3 atom) H1SO4 = 1 basis ( ada 7 atom )
Untuk Kristal monoatomik dalam satu basis hanya 1 atom.
Sebuah operasi translasi kisi didefinisikan sebagai perpindahan dari sebuah Kristal oleh sebuah vector translasi Kristal (
T
⃗
)T
⃗ = u
a
⃗ u
a
⃗
+u
a
⃗
Dimana :u
= bilangan bulata⃗
= vektor translasi primitif ( jarak antar kisi ) = sumbu-sumbu KristalContoh diperlihatkan pada Gambar 3.2
T
⃗ = −3a
⃗ 2a
⃗
u
= −3
u
= 2
Gambar 3.2 . Vektor translasiPosisi dari sebuah pusat atom j dari sebuah basis relative terdapat titik lattice dimana basis diletakkan adalah :
r
⃗ = x
⃗
a
y
ja
⃗ z
ja
⃗
Dengan : 0 ≤
x
j,y
j,z
j ≤ 1Contoh diperlihatkan pada Gambar 3.3
Gambar 3.3. Vektor perpindahan Cell lattice primitive
= sel yang mempunyai luas dan volume terkecil
=lawan dari sel konvensional , sel yang memepunyai luas atau volume terbesar = sel yang memiliki 1 titik kisi
= sebuah pararelepipid yang dibentuk oleh sumbu-sumbu
a
⃗ , a
⃗ , a
⃗
Sel epipid = sel yang sisinya sejajar/ bidang yang dibatasi garis-garis sejajar
Cara menentukan sel primitif ( sumbu-sumbu primitif) dapat diperlihatkan pada Gambar 3.4.
Cara lain untuk memilih sel primitive : metode Wigner Seitz
1. Hubungkan sebuah titik lattice dengan titik lattice di sekitarnya.
2. Di tengah-tengah dan tegak lurus terhadap garis penghubung ini, lukislah garis-garis atau bidang-bidang . luas terkecil atau volume terkecil yang dilingkupi oleh garis-garis atau bidang-bidang ini disebut sel primitive Wigner Seitz. Contoh sel primitive Wigner Seitz diperlihatkan pada Gambar 3.6.
Gambar 3.6. Sel primitive Wigner Seitz Contoh: Kisi Kubus ( 3 jenis )
a. Kubus sederhana/ Simple Cubic (SC)
Sel primitive = sel konvensional
Gambar 3.7. Simpel cubic (SC)
Jumlah titik lattice = 8 x 1/8 = 1 buah ( pada setiap sudut dipakai 8 kubus sel)
a
⃗ = a x
̂
a
⃗ = a y
̂
a
⃗ = a z
̂
b. Kubus Pusat Badan / Face Center Cubic ( FCC )Gambar 3.8. Kubus berpusat baan (FCC) Sel primitif ≠ sel konvensional
Jumlah titik lattice pada
Sel primitif = 8 x 1/8 = 1 buah Sel konvensional = ( 8 x 1/8 ) + 1 = 2
a
⃗ =
a (x
̂ y
̂ − z
̂)
a
⃗ =
a ( −x
̂ y
̂ z
̂
)a
⃗ =
a (x
̂ y
̂ z
̂
)φ
= 109,28
( sudut antara sumbu-sumbu ) c. Kubus Pusat Muka / Face Center CubicGambar 3.9. Kubus Pusat Muka sel primitif ± sel konvensional
jumlah titik lattice pada : sel primitive = 8 x 1/8 = 1 sel konvensional = (8 x 1/8 )+ ( 6 x ½ ) = 4
a
⃗ =
a (x
̂ y
̂
)a
⃗ =
a ( y
̂ z
̂
)a
⃗ =
a (x
̂ z
̂
)φ
= 60
( sudut antara sumbu-sumbu ) Volume sel primitifVc =|
a
⃗ . a
⃗ x a
⃗
| atau, Vc =|a
⃗ . a
⃗ , a
⃗
| atau, Vc =|a
⃗ , a
⃗ , a
⃗
|3.2. Sistem Kristal dan Kisi Bravais a) Struktur Kisi
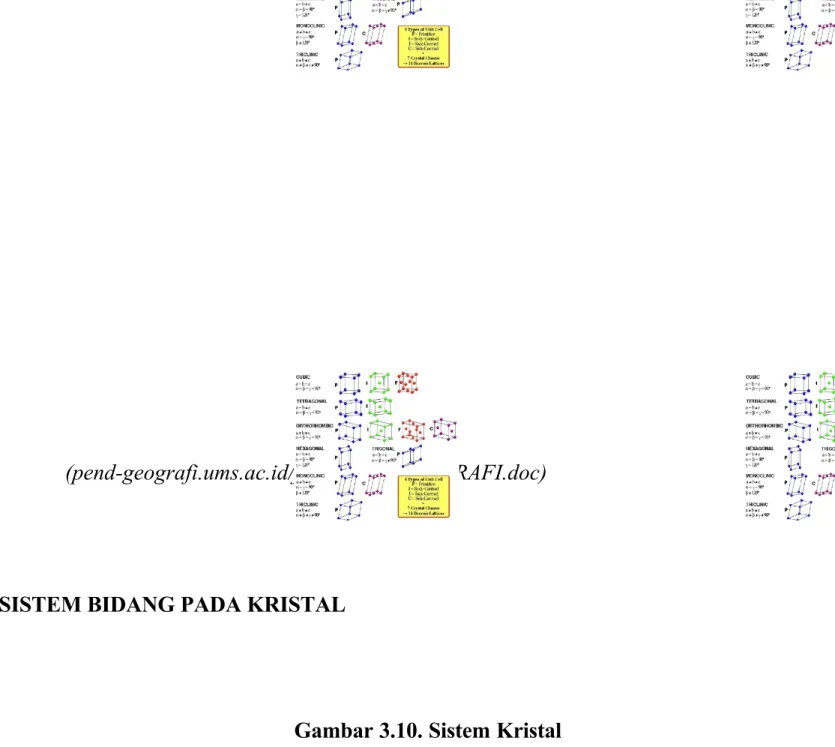
Bila dilihat kembali pada suatu unit sel , ketiga sisi unit sel itu merupakan sumbu Kristal yang dengan teratur lewat melalui titik-titik kisi yang berhubungan dengan atom/ion yang sama. Dimensi suatu unit sel ini ditentukan oleh perpotongan a,b,dan c yang disebut pula perpotongan karakteristik pada sumbu. Perpotongan karakteristik dan sudut sumbu suatu Kristal dinamakan konstanta geometris.
Dalam suatu kisi ruang , semua titik-titik kisi mungkin membentuk pasangan bidang-bidang sejajar dan berjarak yang sama yang disebut bidang-bidang kisi. Bidang-bidang inilah yang menentukan arah permukaan suatu Kristal. Variasi sudut sumbu dan ukuran relative dari dimensi a,b, dan c dalam suatu Kristal tiga dimensi secara teoritis bisa menghasilkan 32 kemungkinan kelompok titik tiga dimensi atau spacegroup. Ke tiga puluh dua kelompok titik Kristal yang dibolehkan ini menghasilkan tujuh system Kristal yang cirinya ditentukan oleh tiga unsure simetri yaitu : 1) sumbu simetri; 2) bidang simetri; dan 3)pusat simetri. Ketujuh system Kristal itu adalah : triklinik, monoklinik , orthohombik, tetragonal, kubik , trigonal , dan hesagonal. Ketujuh system Kristal ini sesuai dengan tujuh unit sel yang berbeda. Semua unit sel ini adalah paralelepipedum yang bentuknya ditentukan oleh panjang ketiga sisi unit sel itu a, b, c dan besarnya ketiga sudut
sumbu Kristal α β γ seperti terlihat pada Tabel 3.1
Tabel 3.1 Tujuh Sistem Kristal dan Parameter Kisi SISTEM KRISTAL PARAMETER KISI CONTOH Kubik Monoklinik Triklinik Tetragonal Orthohombik Trigonal Hexagonal a=b=c α=β=γ=900 a≠b≠c α=β=900≠γ a≠b≠c α≠β≠γ≠900 a=b≠c α=β=γ=900 a≠b≠c α=β=γ=900 a=b=c α=β=γ≠900<1200 a=b≠c α=β=900 γ =1200
NaCl, CaF2, Na2SO4, FeSO4
Na2SO4, FeSO4 CuSO4, Kr2Cr2O7 NiSO4 , SnO2
KNO3, BaSO4, MgSO CaSO4
System kubik adalah merupakan system yang paling simetris. Kebanyakan logam memiliki struktur kubik dan yang lain struktur heksagonal.
b) Kisi Bravais
Dalam tahun 1880 Bravais memperkenalkan idea kisi ruang. Pada dasarnya unsure-unsur simetri seperti itu bisa disusun dalam 230 kelompok ruang atau pula berulang yang berbeda. Untuk Kristal tiga dimensi , kisi harus invariant pada translasi,
T=n1a +n2b + n3c
Persyaratan ini memberikan pembatasan pada rotasi yang dibolehkan dan pada translasi yang cocok dengan rotasi yang diberikan. Komdisi umum yang harus terpenuhi agar kisi tetap invariant, menghasilkan 32 kelompok titik tiga dimensi yang dibolehkan. Ke 32 kelompom titik ini memerlukan empatbelas kisi ruang yang berbeda.keempatbelas kisi ruang ini , yang disebut kisi bravais , dapat dikelompokkan lagi menjadi tujuh system yaitu: triklinik, monoklinik, orthohombik, tetragonal, trigonal, hexagonal dan kubik.
(pend-geografi.ums.ac.id/files/KRISTALOGRAFI.doc)
SISTEM BIDANG PADA KRISTAL
Suatu kristal berisikan bidang-bidang atom, dan bidang-bidang ini turut menentukan sifat dan prilaku bahan itu. Banyak sifat-sifat Kristal yang berkaitan dengan arah Kristal, seperti misalnya kelenturan, permeabilitas, magnetic dan lainnya. Berikut ini akan dibahas arah serta kedudukan berbagai bidang dalam Kristal.
a) Arah Kristal
Hal ini bisa dilakukan dengan memproyeksikan suatu vector pada sumbu x,y,z. untuk memudahkan, proyeksi ini diukur dalam satuan kisi Kristal a,b,c. untuk harga tertentu harga-harga a, b, dan c ini bisa banyak sekali kemungkinannya , maka itu biasanya dipakai himpunan bilangan bulat terkecil yang sebanding dengan proyeksi ini, mi salnya a/r, b/r, c/r. himpunan bilangan bulat terkecil ini disebut indeks arah. Biasanya indek arah ini diberi simbol u, v, dan w. misalnya proyeksi arah kristal pada sumbu x, y , dan z masing-masing pada gambar dibawah. Dengan
membagi semua koesien dengan 1,5 maka akan didapatkan koesien 2, 4, 3 . maka dikatakan indek arah ini adalah [ 2 4 3 ]. Untuk indek arah kita gunakan penutup dengan kurung lengkung digunakan untuk menunjukkan bidang-bidang kristal seperti misalnya ( h k l). untuk indek yang ditutup dengan kurung ini tidak menggunakan koma, sedang untuk indek titik tidak menggunakan kurung tetapi memakai koma seperti terlihat pada gambar . gambar menunjukkan indek dari beberapa arah dalam kristal orthohombik , seperti arah
OA adalah [ 1 1 1 ]
OB adalah [ ½ ½ ½ ] atau [ 1 1 1 ] OC adalah [ ½ ½ 1 ] atau [ 1 1 2 ] OD adalah [0 0 ½ ] atau [ 0 0 1 ]
Semua arah yang sejajar mempunyai indek yang sama. Oleh karena itu untuk memberi nama suatu arah, ambillah sinar sejajar yang melalui titik asal O. arah ini diberu nama atau indek dari koefisien titik pada sinar itu. Tetapi karena pada snai iru banyak sekali titik-titik, maka kita pilih khusus titik yang memiliki himpunan bilangan bulat terkecil. Misalnya arah [ 1 1 1 ] lewat dari 0,0,0 melalui 1,1,1. Tetapi garis ini juga melalui ½, ½ , ½ dan 2,2,2 serta yang lainnya. Demikian pula arah [ 1 1 2 ] lewat melalui ½, ½, 1 maka itu untuk keperluan penyederhanaan kita gunakan notasi bilangan bulat terkecil.
Untuk tanda indek negatif ditunjukkan dengan tanda garis di atas bulangan indek tersebut Contoh :
Sumbu X+ indeknya ( 100 ) sumbu X_ indeknya (
(1̅00)
Sumbu Y+ indeknya ( 010 ) sumbu X_ indeknya (
(01̅0)
Sumbu Z+ indeknya ( 001 ) sumbu X_ indeknya
(001̅)
Diagonal bidang muka xy indeknya ( 110) Diagonal bidang muka xz indeknya ( 101) Diagonal bidang muka yz indeknya ( 001)
( Suwitra, 1989:44:45) b) Bidang Kristal
Indek Miller
Sistem indeks ( indeks miller )
Digunakan untuk menyatakan bidang kristal ( indeks bidang ). Aturan :
1. Tentukan titik potong antara bidang yang bersangkutan dengan sumbu-sumbu (
a
⃗ , a
⃗ , a
⃗ )
/ sumbu-sumbu primitif atau konvensional dalam satuan konstanta lattice (a
, a
, a
).2. Tentukan kebalikan ( reciprok ) dari bilangan-bilangan tadi, dan kemudian tentukan tiga bilangan bulat ( terkecil ) yang mempunyai perbandinagn yang sama.
Indeks ( h k l ) Contoh :
Bidang ABC memotong sumbu-sumbu ;
a
⃗ di 2a
a
⃗ di 2a
a
⃗ di 2a
Kebalikannya adalah,
,
Jika ketiga bilangan bulat yang mempunyaiperbandingan yang sama seperti diatas adalah 3,3,2 dengan demikian indeks bilangan ABC tersebut adalah : (3,3,2 ). Perhatikan bahwa dalam penulisan indeks tidak menggunakan tanda koma.
Misal :
3 3 2
h k l
Jika salah satu dari h k l negatif , maka indeks bidang tersebut itu ditulis (
h k l )
, artinya h bertanda negatif .d hkl=
√ +
Contoh-contoh indeks miller untuk sel kubus primitif maupun konvensional Kubus Sederhana : sel konvensional = sel primitif
Bidang ABFE
Perpotongan bidang ABFE dengan sumbu X di
1ax
̂
Y di
~ay
̂
Z di~az
̂
Kebalikannya :
,
~,
~Jadi indeks bidang ABFE adalah ( 1 0 0 ) Bidang BCGF
Perpotongan bidang BCGF dengan sumbu-sumbu X di
~ax
̂
Y di
~ay
̂
Z di~az
̂
Kebalikannya~
,
,
~Jadi indeks bidang BCGF ( 0 1 0) Bidang EFGH
Perpotongan bidang EFGH dengan sumbu-sumbu X di
~ax
̂
Y di
~ay
̂
Z di1az
̂
Kebalikannya~
,
~,Jadi indeks bidang EFGH ( 0 0 1) Bidang ACGE
Perpotongan bidang ACGE dengan sumbu-sumbu X di
1ax
̂
Y di
1ay
̂
Z di~az
̂
Kebalikannya
,
,~Jadi indeks bidang ACGE ( 1 1 0) Bidang DCGH
Bidang DCGH sejajar dengan bidang ABFE dan menempel du sumbu Y dan Z, artinya bidang tersebut tidak hanya satu tetapi lebih dari satu, maka undeks bidang DCGH adalah {1 0 0} .
Sama halnya dengan bidang ADHE yang sejajar dengan bidang BCGF, maka indeks bidang ADHE adalah {1 0 0} begitu juga dengan bidang ABCD sejajar dengan bidang EFGH maka b idang ABCD {0 01 }, dan seterusnya. Jadi, apabila bidan gnya menempel di sumbu, indeksnya akan sama dengan indeks bidang yang sejajar denganya.
STRUKTUR KRISTAL SEDERHANA a. Struktur Kristal kubik
1) Struktur Kubik Sederhana
Unit kubus ini memiliki atom pada sudut-sudut kubus.oleh karena itu atom-atom itu bersinggungan disepanjang sisi kubus,sperti tampak pada Gambar 3.11 struktur ini kurang
Gambar 3.11. struktur kisi SC (P) . (a) skema yang menggambarkan kedudukan atom pada sudut unitsel.
2) Struktur body-centre cubic (I)
Pada unit sel struktur bcc ini, atom terletak pada setiap sudut kubus dan satu atom pada pusat kubus. Atom pusat ini bersinggungan dengan ke delapan atom sudut, tetapi antar sesame
atom tidak bersentuhan dan masih ada jarak diantaranya. Jadi atom-atom hanya bersinggungan di sepanjang diagonal ruang kubus tersebut. Gambar 3.12 memeperlihatkan kedudukan bola-bola atomdalam ruang unit sel kristal bcc.
Gambar 3.12. struktur kisi BCC (P). Kedudukan a tom dalam kisi Kristal 3. Struktur Face- Centered cubic (FCC)
Gambar 3 memperlihatkan struktur kisi unit sel kristal FCC. Dimana tiap sudut kisi ditempati oleh sebuah atom dan satu atom lagi pada pusat dari masing masing bidang muka Kristal. Pada struktur ini atom pusat bidang muka Kristal bersinggungan dengan keempat atom sudut pada bidang yang bersangkutan. Sedang antar atom-atom sudut itu sendiri tidak bersentuhan , dan masih ada jarak diantaranya. Jadi atom hanya bersinggungan disepanjang diagonal bidang muka Kristal. Susunan atom atom pada struktur FCC ini sangat rapat, maka itu sering disebut pula struktur cubic close- packed (CCP).
Gambar 3.12 struktur kisi FCC (P). Memperlihatkan skema Kedudukan atom dalam kisi FCC.
3) Struktur kubik lainnya
Ada beberapa struktur Kristal yang merupakan kombinasi dari salah satu struktur kubik dasar yang saling menyusup satu dengan yang lainnya. Beberapa diantara struktur semacam ini antara lain struktur kubik intan, seng blende, natrium klorida dan cesium klorida.
Struktur Kubik Intan
Struktur intan adalah merupakan gabungan dari dua subkisi FCC. Gambar 4 memperlihatkan skema unit sel struktur intan. Salah satu subkisi tersusun dari delapan atom sudut dan enam atom pusat bidang muka unit sel. Semuanya ini membentuk satu struktur fcc dengan titik asal pada 0,0,0.
Sedang subkisi yang lain terdiri dari empat atom yang menempati kedudukan ¼, ¼, ¼ ; ¾, ¾,¼; ¾,¼¾; , dan ¼,¼ ¾. Atom atom ini bersama dengan atom-atom dalam unit sel sekitarnya membentuk struktur kisi FCC pula dengan titik asal p ada (¼, ¼, ¼ ) .
Gambar 3.12 struktur kubik intan. Skema kedudukan atom-atom dalam kisi satu unit sel.
Struktur Seng Sulfide
Sama seperti pada struktur kubik intan, struktur sulfide seng juga terdiri dari dua subkisi FCC. Pada struktur seng sulfide ini, atom-atom Zn menempati salah satu kisi FCC dan atom -atom S menempati kisi FCC yang lain dengan demikian menghasilkan struktur yang sama seperti struktur intan, seperti terlihat pada gambar 6. Koordinat atom – atom Zn adalah 0,0,0; 0,½, ½; ½,0, ½; ½,½,0 dan koordinat atom S adalah ¼, ¼, ¼; ¾, ¾,¾; ¾, ¼,¾; ¾, ¾,¼. Struktur seng sulfide ini mempunyai empat molekul ZnS per unit sel. Tiap atom memiliki empay jarak atom ynag sama dari jenis yang berlawanan yang tersusun pada sudut-sudut tetrahedron beraturan.
Struktur Natrium Klorida
Struktur ini terdiri dari dua subkisi FCC, satu subkisi dengan titik asal ion Na+ yang terletak pada 0,0,0 dan subkisi yang lain memiliki titik asal ion Cl- dengan kedudukan ditengah-tengah sepanjang sisi kubus, misalnya pada titik ½,0,0. Gambar 7 memperlihatkan struktur natrium klorida itu.
Bila kita tidak memandang perbedaan antara ion Nadan ion Cl, maka kisi ini akan merupakan kisi kubik sederhana (SC). Pada setiap unit kubik terdapat empat molekul, dengan kedudukan atom-atom pada:
Gambar 3.13. Struktur NaCl
Na : 0,0,0 ; ½,0,0 ; ½,0, ½ ; 0,½, ½ Cl : ½,½, ½; 0,0,½ ; 0,½,0 ; ½,0,0
Tiap atom mempunyai enam atom tetangga terdekat, sehingga bilangan koordinasinya adalah 6.
Struktur Cesium Klorida
Struktur Cesium Klorida merupakan gabungan dari dua buah kisi kubus sederhana (SC). Atom sudut dari salah satu subkisi merupakan atom pusat dari subkisi yang lain. Gambar 8 memperlihatkan struktur cesium klorida dimana atom yang menempati kedudukan BCC memiliki koordinat .
Cs: 0,0,0 dan Cl: ½,½,½
Gambar 3.14. Struktur dari Geometri Unit Sel
a. Jari-jari atom
Jarak kesetimbangan antara pusat dua atom berdekatan dapat dipandang sebagai jumlah jari-jari atom tersebut. Ada beberapa factor yang mempengaruhi jarak anatar atom ini. Salah satu faktornya adalah suhu. Penambahan energy kalor akan menyebabkan jarak keseimbangan antar atom bertambah sehingga menghasilkan pemuaian benda.
1) Kristal kubik sederhana (SC)
Pada struktur Kristal kubus sederhana (P), hubungan antara jari-jari atom dengan sisi kubus ‘a’ bisa dilihat pada gambar 9. Dari gambar terlihat bahwa atom-atom itu bersinggungan sepanjang sisi kubus, sehingga dengan demikian jari-jari atom r = a/2.
Pada struktur kubik sederhana ini, tiap atom memiliki enam atom tetang ga terdekat, yaitu empat atom dalam bidangnya sendiri , satu diatas dan satunya lagi dibawahnya. Banyaknya atom tetangga untuk suatu struktur Kristal dinamakan bilangan koordinasi (CN). Jadi bilangan koordinasi untuk struktur kubus sederhana adalah CN=6.
2) Kristal BCC (P)
Pada struktur BCC tetangga terdekat dari atom sudut adalah atom pusat kubus, termasuk kubus unit sel disekitarnya. Disekeliling atom sudut ini masih ada tujuh unit sel terdekat lainnya. Ini berarti atom sudut ini memiliki delapan tetangga dekat, yaitu satu atom pusat pada unit selnya sendiri dan tujuh atom pusat dari unit sel yang mengitarinya. Maka itu dikatakan pula bilangan koordinasi struktur adalah 3.15.
Gambar 3.15. hubungan antara jari- jari atom ‘r’ dengan ’konstanta kisi ‘a’. 3) Kristal FCC
Tetangga dekat dari atom sudut ini adalah empat atom pusat bidang muka yang berada pada bidang atom itu sendiri, empat atom pusat bidang muka diatasnya dan empat atom pusat bidang muka di bawahnya. Jadi atom ini mempunyai 12 atom tetangga dekat sehingga dikatakan bilangan koordinasinya adalah CN= 12. Pada gambar 10 terlihat atom-atom itu bersinggungan dimuka bidang Kristal (AC) yang panjangnya sama dengan empat kali jari-jari atom.
Gambar 3.16. Kedudukan atom-atom kisi FCC
4
SIMETRI KRISTAL, GRUP TRITIK DAN GRUP RUANG
Suatu langkah yang cukup penting dalam menganalisis struktur kristal adalah dengan melihat simetri yang ada, kemudian dikelompokkan pada beberapa grup. Hal ini ak an menyederhanakan perhitungan matematis yang panjang.
™ translasi, ™ inversi,
™ refleksi (mirror ) dan ™ rotasi.
Kumpulan beberapa operasi ini dapat menghasilkan “ point group” (grup titik) dan “ space
group” (grup ruang).
4.1. Pengertian Dasar
Pengertian dasar operasi-operasi simetri tersebut adalah sebagai berikut: a.Translasi
Translasi merupakan pergeseran spasial dengan tetap mempertahankan kondisi semula
Gambar 4.1. Operasi Translasi b. Pusat Inversi
Suatu benda mempunyai pusat inversi jika ada sebuah titik sedemikian rupa sehingga operasi pembalikan terhadap titik ini akan membuat benda ini tetap invarian.
r→ - r r
O
-r
Gambar 4.2. Operasi Inversi rmenunjukkan vektor posisi.
c. Refleksi (mirror)
Gambar 4.3. Operasi refleksi 4.2. Grup Titik dan Operasi Translasi
Simetri ruang di sekitar sebuah titik dapat digambarkan dengan sekelompok elemen simetri yang disebut point group. Elemen simetri dapat dinyatakan secara geometri yang menghasilkan operasi simetri, yakni, pada sebuah titik, garis, atau bidang.
Obyek pengujian dapat mengandung lebih dari satu elemen simetri.
Pada point group, titik senantiasa berada pada origin, dan semua elemen simetri selalu melewati titik ini.
Gambar 4.4. Operasi grup titik pada sel satuan Dalam dua dimensi hanya ditemukan dua jenis elemen simetri:
™ menggambarkan simetri rotasi, dan
™ yang menunujukan simetri refleksi.
Sebuah obyek yang mempunyai simetri rotasi diberi simetri R(atau simetri fold R). Sebanyak lima kemungkinan, masing-masing sebesar 360/ R, dengan Radalah 1, 2, 3, 4, dan 6.
1
2
3
4
6
Gambar 4.5. Operasi simetri 1,2,3,4, dan 6Dalam stereogram dapat digambarkan:
1
2
3
4
6
Gambar 4.6. Stereogram operasi 1,2,3,4,6 Sementara untuk R= 5 tidak memenuhi kaidah translasi.
Elemen satu fold adalah elemen identitas dan merupakan hal yang lumrah bahwa setiap obyek memiliki simetri satu fold. Sementara obyek yang mengalami proses simetri refleksi, diberi simbol m (mirror), operasi simetrinya adalah garis lurus, dengan translasi pencerminan.
m
Gambar 4.7. Simetri refleksi
Sejauh ini point group yang sudah dievaluasi: 1, 2, 3, 4, 6 danm
1-fold
3-fold
4-fold
6-fold
m
(mirror)
(a)
(b)
Gambar 4.8. a) Obyek dua dimensi dan point groupnya, b) Stereogram point group dari obyek (a).
Selanjutnya sebuah mirror dapat juga ditempatkan paralel terhadap sumbu rotasi. Oleh karena itu ada empat tambahan point group yang diperoleh dari kombinasi sumbu rotasi dengan bidang refleksi paralel, yakni, 2mm, 3m, 4mm, dan 6mm.
Lebih jelas dalam diperlihatkan pada Gambar 4.9.
2
mm
4
mm
6
mm
Gambar 4.9. Contoh grup titik
(Akan tetapi dalam kasus 3m, tambahan garis-garis m ini bertepatan dengan set pertama sehingga penulisan simbol 3mm tidak memiliki arti apapun)
Tabel 4.1. Point Group dua Dimensi
Sistem Point
group
Pengertian simbol, penyesuaian letak posisi
Posisi I Posisi II Posisi III
Oblique 1,2 Rotasi di
seki-tar sebuah titik
-
-Persegipanjang 1m
2mm
Rotasi di seki-tar sebuah titik
m ⊥ x
-m ⊥ y
Bujursangkar 4
4mm
Rotasi di seki-tar sebuah titik
-m ⊥ x,y -m pada 45o terhadap x, y Heksagonal 3 3m 6 6mm -Rotasi di seki-tar sebuah titik
-m⊥ x, y, u -m⊥ x, y, u -- m pada 30o terhadap x,y,u
Lebih ilustratif kalau dilihat dalam gambar: Oblique
Persegi panjang 1m 2mm Bujursangkar 4 4mm Heksagonal 3 3m 6 6mm
Gambar 4.10. Grup titik dua dimensi Point Group Tiga Dimensi
Perpaduan elemen-elemen simetri dalam tiga dimensi adalah sumbu rotasi ( R), sumbu inversi ( R ), dan bidang refleksi (m).
Sebuah obyek dikatakan mengalami proses inversi, diberi simbol R , jika ia dibawa ke dalam yang semula dengan kombinasi rotasi sebesar (360/ R) derajat dan inversi melalui origin.
1
Gambar 4.11. Contoh grup titik tiga dimensi
Pada dua dimensi, inversi adalah tepat seperti rotasi 2 sehingga tidak dimasukkan dalam operasi simetri. Namun dalam tiga dimensi, dimasukkan ke dalam operasi simetri.
Gambar 4.12. Contoh operasi inverse dalam tiga dimensi
4.3. Space Group
Sebelum membahas susunan simetri tiga dimensi dalam kristal, hal yang lebih ilustratif untuk memahami susunan simetri adalah menyatakannya dalam dua dimensi yang didasarkan pada kisi-kisi bidang. Sebuah kisi bidang dapat memiliki satu, dua, tiga, empat atau enam fold sumbu rotasi dan sebagai konsekuensinya terdapat 5 kisi-kisi bidang berbeda. Sebagian besar kisi bidang adalah kisi jajaran-genjang:⇒ satu-fold dan dua-fold simetri.
Kisi-kisi persegi panjang dan diamond dapat memiliki: ⇒ bidang mirror dan juga ditambah
dengan sumbu dua-fold.
Sumbu simetri tiga fold atau enam fold menghendaki agar dua vektor sel ekivalen memiliki kemiringan 120o⇒ kisi segitiga.
Sedangkan simetri empat fold menghendaki kisi bujursangkar. Simetri resultan dari elemen simetri pola dua dimensi dikenal sebagai plane group
.
Dalam tiga dimensi kumpulan operasi simetri ini disebut grup ruang (Space Group).
Sebelum pembahasan pembahasan mendetail tentang grup ruang akan diungkapkan terlebih dahulu beberapa operasi simetri lainnya yaitu glide plane dan sumbu skrup.
•
•
•
•
4.4. Glide Plane
Gabungan operasi refleksi lewat bidang vertikal (garis titik-titik diantara bidang mirror) dan translasi setengah sumbu sepanjang suatu sumbu tertentu dikenal sebagai glide plane. Lebih jelas lihat gambar kucing berikut ini:
Gambar 4.13. Operasi bidang Glide
Jadi sampai saat ini operasi simetri dua dimensi dapat memiliki elemen simetri berdasarkan: (a) sumbu rotasi satu-fold, dua-fold, tiga-fold, empat-fold dan enam-fold; dan (b) mirror yang ditunjukan olehm dan/atau glide plane.
Mirror pada plane group pmdan glide plane pada plane group pg:
• • •• pm • • •• pg
Gambar 4.14. Contoh operasi bidang glide
Istilah pdisini adalah primitif (terletak di pojok-pojok) dan gadalah glide.Jadi pm berarti sebuah kisi primitif memiliki satu set mirror sedangkan pg berarti glide plane pada permukaan mirror.
4.5. Sumbu Sekrup
Dalam kristal yang memiliki sumbu sekrup, perulangan atom atau molekul oleh operasi sekrup harus konsisten dengan periodisitas kisi sepanjang arah tersebut.
Gambar 4.15. Operasi simetri sekrup
Untuk sebuah sumbu rotasi n-fold, rotasi n sebesar 360/n menghendaki obyek kembali ke posisinya yang semula. Untuk sumbu skrup, hal ini disertai dengan translasi. Terdapat empat macam translasi sekrup yang lebih bermakna secara geometris pada pengelompokan ruang/bidang kristal yakni; sekrup 2-fold, sekrup 3-fold, sekrup 4-fold, dan sekrup 6-fold.
Translasi sekrup 2-fold diberi simbol 21 dengan operasi rotasi 180o disertai translasi sepanjang
sumbu sebesar setengah jarak perulangan. Pada translasi sekrup 3-fold terdapat dua kemungkinan translasi, yakni 1/3 dan 2/3 dikalikan dengan p eriode perulangan sepanjang sumbu sekrup 3-fold, masing-masing diberi simbol 31 dan 32.
z z
z
z
z