BAB IV. HASIL DAN PEMBAHASAN
I. PENELITIAN PENDAHULUAN
Penelitian pendahuluan dilakukan untuk menentukan waktu perendaman dan waktu germinasi terbaik untuk memproduksi sampel. Hal ini penting untuk mencegah kegagalan dalam jumlah yang cukup besar. Waktu perendaman dan waktu germinasi yang tidak sesuai akan mengakibatkan kecambah menjadi tidak dapat tumbuh atau bahkan dapat menjadi busuk.
Waktu perendaman penting untuk diketahui karena lamanya waktu perendaman akan menentukan seberapa banyak air yang dapat masuk ke dalam biji (imbibisi) sehingga dapat mempengaruhi kondisi lingkungan yang dibutuhkan dalam proses germinasi. Imbibisi air ini sangat penting karena digunakan untuk rehidrasi biji yang menjadi tahap awal dalam proses germinasi (Bewley dan Black, 1983). Kacang komak memiliki kulit biji yang cukup tebal yaitu sekitar 0.1 ± 0.01 mm sehingga diperlukan perlakuan khusus agar air dapat lebih mudah untuk masuk ke dalam biji. Salah satu perlakuannya adalah dengan penggunaan air bersuhu 50oC sebagai media perendaman.
Air bersuhu 50oC digunakan untuk mempersingkat waktu perendaman karena peningkatan suhu air rendaman dapat meningkatkan kecepatan imbibisi air ke dalam biji. Kelemahan dari penggunaan air bersuhu lebih tinggi adalah dapat melarutkan beberapa vitamin dan mineral yang larut air bersama oligosakarida, fitat, dan tanin. Akan tetapi pada air bersuhu 50oC, kehilangan total padatan, komponen N, total gula, oligosakarida, Ca, Mg, dan tiga vitamin larut air (thiamin, riboflavin, dan niasin) hilang dalam jumlah sedikit. Ketika suhu meningkat menjadi 60oC, kehilangan nutrisi akan meningkat tajam (Salunkhe, et al., 1985).
Waktu perendaman yang diukur adalah 12 jam dan 24 jam sedangkan waktu germinasi masing-masing waktu perendaman adalah 24, 30, 36, dan 42 jam. Waktu perendaman ini dipilih berdasarkan pada proses pembuatan kecambah secara umum yaitu biji direndam selama 12-24 jam
dan dig Tiap p kacang perend Lampi yang m Pengam energi pengam sekitar dan Bl kompo karboh rendah pada G Gamb rata ke 1977). germinasi pa perlakuan wa g komak daman dan iran 1. Proses perk mengakibatk mbilan air d kinetik akib matan, penin r 156-187 % lack (1983), onen sel te hidrat pada o h. Persentase Gambar 9. bar 9. Grafi terhad Kacang ko ecepatan ger Epigeal yai ada ruang ge aktu perend sebagai sa waktu ger kecambahan kan jaringan diikuti denga bat diambiln ngkatan ber % terhadap b , setelah im erjadi, beber organ penyim e peningkata ik persentas dap berat ke omak memil rminasi 85-9 itu jika koti
elap selama 2 aman dan w ampel. Hasi rminasi kac n dimulai den biji mengem an keluarnya nya energi a rat kacang k berat kering mbibisi awal rapa matrik mpanan dihi an berat biji e peningkat ring biji kac
iki tipe germ 5% (Kay, 19 iledon terang 24-48 jam (S waktu germin il pengama cang komak ngan pengam mbang dan m a panas yang air (Taylorso komak sete kacang kom dan hidrasi ks seperti c drolisis men i setelah per
tan berat bij cang komak minasi epige 979) atau m gkat ke atas Salunkhe, et nasi digunak atan terhad k dapat di mbilan air de merentangny g mencirikan on, 1984). B lah perenda mak. Menur pada dindi cadangan pr njadi moleku rendaman da ji setelah p
eal dan mem minimal 75% s tanah. Besa t al., 1985). kan 40 biji dap waktu lihat pada engan cepat a kulit biji. n hilangnya Berdasarkan aman yaitu rut Bewley ng sel dan rotein dan ul berbobot apat dilihat erendaman miliki rata-(Skerman, arnya daya
pertum dan Bl paling germin sedang germin Perlaku yang d Cabrej persen perend untuk pada w pada G Gamb 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 % k
ecambah yang tum
buh wa mbuhan dari lack, 1983). besar terdap nasi 30 jam gkan paling k nasi 24 jam uan germina Panjang rad dihasilkan le as, et al (20 ntase germin daman 12 jam produksi sa waktu peren Gambar 10. bar 10. Perse perend 0 0 0 0 0 0 0 0 24 50.0057.5 ktu rendam hipokotil m Persentase j pat pada per m yaitu 67.5% kecil terjadi m yaitu 50% asi 36 dan 42 dikel dan pe ebih kecil d 007) yaitu p nasi antara m dan waktu ampel. Perse ndaman dan entase kecam daman dan w 30 67.50 0 60. Waktu ger 12 jam menyebabka jumlah keca rlakuan pere % dengan p pada perlaku % dengan pa 2 jam mengh ersentase jum dibandingkan anjang radik 81-84%. O u germinasi entase kecam waktu germ mbah kacang waktu germin 36 52.50 .00 55.0 rminasi (jam waktu rend an pola pert mbah kacan endaman sela panjang radi uan perenda anjang radik hasilkan keca mlah kecamb n yang diha kel berkisar Oleh karena 30 jam diam mbah kacang minasi yang g komak yan nasi yang be 42 65.00 00 55. m) am 24 jam tumbuhan in ng komak ya ama 12 jam ikel rata-rat aman 12 jam kel rata-rata ambah yang bah yang dap asilkan pada antara 4.4-5 a itulah ma mbil sebagai g komak yan berbeda dip ng tumbuh p erbeda 00 ni (Bewley ang tumbuh dan waktu ta 2.66 cm m dan waktu a 2.24 cm. g berakar. pat tumbuh a penelitian 5.9 cm dan aka waktu i perlakuan ng tumbuh perlihatkan pada waktu
J. PEMBUATAN KECAMBAH DAN TEPUNG KECAMBAH KACANG KOMAK
Kecambah kacang komak (Lablab purpureus (L.) Sweet) dibuat dengan cara merendam kacang komak yang telah disortir berdasarkan keadaan fisik yaitu yang tidak berlubang, rusak, dan patah. Perendaman dilakukan dalam air bersuhu 50oC selama 12 jam yaitu sesuai dengan penelitian pendahuluan sebelumnya. Air bersuhu 50oC ini akan mempercepat imbibisi air ke dalam biji karena terjadi pelunakan kulit biji kacang komak yang tebal. Perbandingan antara kacang komak dengan air adalah 1:3 mengacu pada penelitian yang dilakukan oleh Cabrejas, et al. (2007). Perendaman selama 12 jam akan melarutkan senyawa-senyawa antinutrisi yang bersifat toksik seperti tripsin inhibitor, hemaglutinin, alkaloid, dan saponin sehingga menghasilkan air rendaman yang berbusa.
Kacang komak yang telah direndam kemudian ditiriskan dan ditempatkan dalam wadah berlubang yang telah dilapisi dengan daun pisang. Penggunaan wadah berlubang dikarenakan untuk mencegah genangan air dalam wadah sehingga biji tidak mudah menjadi busuk. Daun pisang merupakan media yang cukup baik dalam menjaga kelembaban di dalam wadah. Penggunaan daun pisang sebagai media germinasi telah dilakukan pada pembuatan kecambah secara tradisional selain dari penggunaan kain saring dan kain lap basah. Kacang komak tersebut lalu digerminasi selama 30 jam dalam ruang gelap bersuhu ruang (35oC). Kecambah kacang komak yang dihasilkan diperlihatkan pada Gambar 11.
Gambar 11. Kecambah kacang komak (Lablab purpureus (L.) Sweet dengan waktu perendaman 12 jam dan waktu germinasi 30 jam.
Setelah penyimpanan dalam ruang gelap selama 30 jam, sesegera mungkin dilakukan pengeringan untuk mencegah tumbuhnya mikroba seperti kapang karena kadar air dan aktivitas air dalam biji sangat tinggi akibat proses perendaman. Pengeringan dilakukan dengan menggunakan oven pengering bersuhu 50oC selama 24 jam. Kecambah yang telah kering kemudian digiling menggunakan pin disc mill dengan ayakan 60 mesh untuk menyeragamkan ukuran. Tepung kecambah kacang komak dan tepung kontrol yang dihasilkan diperlihatkan pada Gambar 12.
Gambar 12. Tepung kecambah kacang komak (kiri) dan tepung kontrol (kanan) yang dihasilkan
K. PEMBUATAN KONSENTRAT PROTEIN KECAMBAH KACANG KOMAK
Konsentrat protein adalah hasil olah atau hasil ekstraksi dari suatu bahan organik sehingga kadar proteinnya menjadi lebih tinggi dibandingkan dengan pada bahan asalnya (Muchtadi, 1991). Menurut Siegel dan Fawcett (1976), penamaan konsentrat protein kacang-kacangan diberikan pada produk tinggi protein yang dipersiapkan dengan metode presipitasi protein pada kacang-kacangan. Konsentrat protein dibuat berdasarkan metode ekstraksi dan presipitasi protein pada titik isoelektriknya.
Tepung kecambah yang dihasilkan sebelumnya dilarutkan dalam akuades dengan perbandingan 1:6-8 kemudian diatur pHnya menjadi 9 dengan NaOH 1 N. Menurut Cheftel et al. (1985), pemilihan suasana basa sebagai pH selama ekstraksi berdasarkan pada kenyataan bahwa sebagian besar asam amino akan bermuatan negatif pada pH di atas titik isoelektriknya, muatan sejenis cenderung untuk tolak-menolak. Hal ini
menyebabkan minimumnya interaksi antara residu-residu asam amino yang berarti kelarutan protein akan meningkat. Perlakuan pemanasan 50-51oC selama 1 jam akan meningkatkan kelarutan protein karena kelarutan protein dipengaruhi oleh suhu dan meningkat kelarutannya pada suhu antara 40-50oC (Zayas, 1997).
Pengendapan terjadi karena adanya pemisahan antara komponen protein larut dan komponen nonprotein yang tidak larut. Filtrat kemudian dipisahkan dengan endapannya melalui penyaringan sehingga didapatkan filtrat yang hanya mengandung protein yang larut. Pengendapan filtrat dilakukan pada pH 4.5 yang merupakan titik isoelektrik kacang komak (Subagio, 2006). Pada titik isoelektrik ini, jumlah muatan protein adalah nol, gaya tarik menarik menjadi dominan dan molekul-molekul mulai berasosiasi yang ditandai dengan ketidaklarutan (Zayas, 1997). Kelarutan globulin juga mendekati minimum pada pH 4.5 (Siegel dan Fawcett, 1976).
Protein yang mengendap pada titik isoelektrik tersebut kemudian dipisahkan dengan disentrifus pada kecepatan 4000 rpm. Komponen protein dan nonprotein yang larut akan terpisah dan berada di dalam supernatan sedangkan protein yang tidak larut akan berada di dalam endapan. Endapan ini kemudian dipisahkan dan ditempatkan dalam wadah loyang. Kemudian endapan dikeringkan menggunakan oven vakum bersuhu 45oC selama 24 jam. Konsentrat protein yang telah kering kemudian diblender kering untuk memperkecil dan menyeragamkan ukurannya. Konsentrat protein kecambah kacang komak dan konsentrat protein kontrol diperlihatkan pada Gambar 13.
Gambar 13. Konsentrat protein kecambah kacang komak (kiri) dan konsentrat protein kontrol (kanan) yang dihasilkan
L. PEMBUATAN FRAKSI PROTEIN DAN NONPROTEIN KECAMBAH KACANG KOMAK
Pembuatan fraksi protein dan nonprotein dari kecambah kacang komak memiliki kesamaan prinsip pembuatan dengan konsentrat protein kecambah kacang komak. Akan tetapi komponen protein yang dihasilkannya lebih murni dibandingkan pengkonsentratan protein biasa. Proses pembuatannya berdasarkan prinsip ekstraksi dan presipitasi protein (Suwarno, 2003).
Tepung kecambah kacang komak dilarutkan dalam akuades dengan perbandingan 1:10 (tepung kecambah:akuades) bersuhu 60oC. Kemudian diekstraksi alkalik pada pH 8.5 – 8.7 dengan NaOH 2N pada suhu 60 oC selama 30 menit. Ekstraksi alkalik pada suhu 60oC ini berfungsi untuk melarutkan protein seperti halnya pada pembuatan konsentrat. Larutan kemudian disentrifus 2000 rpm untuk memisahkan komponen protein yang larut dengan komponen nonprotein yang tidak larut. Komponen yang tidak larut dan mengendap sebagai residu tersebut ialah fraksi nonprotein.
Setelah pemisahan antara residu (fraksi nonprotein) dengan supernatan, residu dikeringkan dalam oven pengering 50oC selama 12 jam sedangkan supernatannya diolah untuk proses ekstraksi selanjutnya. Supernatan yang terpisah ini mengandung fraksi protein. Untuk mengendapkan proteinnya, dilakukan ekstraksi asidik pada pH 4.5 dengan penambahan HCl 2N. Pada pH 4.5, protein kecambah kacang komak mengendap karena pada pH isoelektrik (pI) muatan gugus amino dan karboksil bebas akan saling menetralkan sehingga bermuatan nol (Winarno, 1992) sehingga gaya tarik-menarik akan dominan dan protein menjadi tidak larut.
Proses sentrifus akan memisahkan komponen protein yang tidak larut (residu) dengan komponen nonprotein yang larut (supernatan). Fraksi protein adalah komponen protein yang tidak larut. Residu fraksi protein ini kemudian dikeringkan dalam oven pengering bersuhu 50oC selama 12 jam. Kedua fraksi yang telah kering kemudian diblender kering dan disimpan dalam refrigerator untuk analisis kapasitas antioksidan.
M. ANALISIS PROKSIMAT
Tabel 6. Komposisi kimia konsentrat protein kecambah kacang komak dan konsentrat protein kontrol (Lablab purpureus (L.) Sweet) x
Komponen
Jenis konsentrat protein
Kontrol Kecambah Air (%) 12.98 ± 0.28b 11.68 ± 0.44a Abu (%) 3.89 ± 0.00b 3.57 ± 0.30a Protein (%) 72.28 ± 0.92b 47.71 ± 12.48a Lemak ( %) 1.51 ± 0.63a 1.56 ± 0.49a Karbohidrat (%) y 9.33 ± 1.64b 35.48 ± 12.93a
x dihitung berdasarkan basis kering
y dihitung menggunakan by difference dari air, abu, protein, dan lemak a, b angka dengan huruf yang berbeda dalam tiap baris yang sama
menunjukkan perbedaan nyata pada signifikansi 5% dengan paired sample t-test
a. Kadar air
Kadar air suatu bahan pangan sangat mempengaruhi terhadap daya simpannya. Kadar air juga mempengaruhi kualitas suatu bahan pangan. Jika kadar air bahan terlalu tinggi, maka bahan tersebut akan rentan terserang kerusakan baik secara fisik, kimia, maupun mikroorganisme.
Kadar air dari konsentrat protein kecambah dan konsentrat protein kontrol ditunjukkan pada Tabel 6. dan Lampiran 2. Berdasarkan pengukuran terhadap kadar air, diketahui bahwa kadar air konsentrat protein kecambah kacang komak dan konsentrat protein kontrol berturut-turut adalah 11.68 ± 0.44% dan 12.98 ± 0.28% dalam basis kering.
Kadar air yang lebih rendah pada konsentrat protein kecambah kacang komak karena proses perendaman dalam perkecambahan mengakibatkan peningkatan permeabilitas dinding sel sehingga difusi
air lebih mudah dan komponen terlarut keluar dari bahan (Muchtadi dan Sugiyono, 1992). Winata (2001) juga menyebutkan pembengkakan granula yang irreversible cenderung memiliki rongga antar sel yang lebih besar sehingga selama pengeringan, air yang dikandung lebih mudah terlepas.
Berdasarkan teori yang ada, seharusnya peningkatan kadar air berkorelasi dengan kenaikan aktivitas air ataupun daya serap air. Hal ini terkait pada kemampuan gugus hidrofil pada permukaan untuk mengikat air bebas. Ketidakterkaitan antara kadar air, Aw, dan daya serap air dalam penelitian karena diduga proses pengeringan kecambah ataupun konsentrat yang dilakukan kurang terstandarisasi. Proses pengeringan yang terlalu lama menyebabkan jumlah air yang keluar menjadi lebih banyak.
Data hasil pengukuran terhadap kadar air kemudian diuji menggunakan paired sample t-test pada selang kepercayaan 95%. Hasil pengolahan statistik data hasil pengukuran kadar air dapat dilihat pada Lampiran 23. Berdasarkan pengujian statistik diketahui bahwa kedua sampel berbeda nyata kadar airnya (p<0.05). Perbedaan yang nyata antara kedua sampel ditandai dengan huruf yang berbeda dibelakang angka.
b. Kadar abu
Kadar abu dari konsentrat protein kecambah dan konsentrat protein kontrol ditunjukkan pada Tabel 6. dan Lampiran 3. Berdasarkan pengukuran terhadap kadar abu, diketahui bahwa kadar abu konsentrat protein kecambah kacang komak dan konsentrat protein kontrol berturut-turut adalah 3.57 ± 0.30% dan 3.89 ± 0.00% dalam basis kering.
Kadar abu yang lebih rendah pada konsentrat protein kecambah dibandingkan pada konsentrat protein kontrol disebabkan adanya pelarutan elemen makro dan mikro mineral yang larut air selama proses perendaman saat perkecambahan. Penggunaan air bersuhu lebih tinggi
akan menyebabkan kehilangan yang lebih besar pada komponen-komponen yang larut dalam air seperti vitamin larut air dan beberapa mineral yang larut air (Salunkhe, et al., 1985).
Data hasil pengukuran terhadap kadar abu kemudian diuji menggunakan paired sample t-test pada selang kepercayaan 95%. Hasil pengolahan statistik data hasil pengukuran kadar abu dapat dilihat pada Lampiran 24. Berdasarkan pengujian secara statistik diketahui bahwa kedua sampel berbeda nyata (p<0.05) kadar abunya yang ditandai dengan huruf yang berbeda dibelakang angka.
c. Kadar protein
Kadar protein dari konsentrat protein kecambah dan konsentrat protein kontrol ditunjukkan pada Tabel 6 dan Lampiran 4. Berdasarkan pengukuran terhadap kadar protein, diketahui bahwa kadar protein konsentrat protein kecambah kacang komak dan konsentrat protein kontrol berturut-turut adalah 47.71 ± 12.48% dan 72.28 ± 0.92% dalam basis kering.
Kadar protein pada proses perkecambahan awalnya akan meningkat karena proses germinasi akan mengaktifkan enzim protease untuk memecah protein menjadi asam-asam amino. Namun, ketika tepung kecambah tersebut kembali diproses menjadi konsentrat protein, beberapa asam amino dapat hilang dan larut bersama air. Molekul-molekul asam amino yang lebih kecil akan cenderung larut dalam air. Menurut Damodaran (1996), beberapa protein albumin yang kaya akan sulfur pada umumnya dapat larut pada pH isoelektrik sehingga dapat hilang bersama supernatan.
Menurut Subagio (2006), pada pembuatan isolat protein kacang komak, presipitasi pH yang digunakan tidak bisa mendapatkan seluruh ekstrak protein karena hanya 50% ekstrak protein yang dapat mengendap pada pH 4-4.5. Proses perendaman dapat memicu reaksi hidrolisis protein menjadi polipeptida yang lebih kecil yang tidak dapat mengendap pada pH 4. Hasil ini mengindikasikan bahwa biji kacang
komak memiliki protein dengan kelarutan yang baik pada pH rendah. Selain itu, menurut Swanson (1990), ternyata proses ekstraksi alkali pada protein dapat menyebabkan penurunan asam amino esensial seperti sistein dan lisin.
Kadar protein konsentrat protein kecambah berada dibawah standar untuk disebut sebagai konsentrat protein yaitu 60-70% dalam basis kering (Hanson, 1974). Akan tetapi, Muchtadi (1991) juga menyatakan bahwa konsentrat protein adalah hasil olah atau hasil ekstraksi dari suatu bahan organik sehingga kadar proteinnya menjadi lebih tinggi dibandingkan dengan pada bahan asalnya. Peningkatan kadar protein konsentrat protein kecambah kacang komak ini ditunjukkan dari kadar protein tepung kecambah kacang komak yaitu 25.16% (bk) (Anita, 2009) kemudian meningkat menjadi 47.71% (bk) dalam bentuk konsentratnya.
Data hasil pengukuran terhadap kadar protein kemudian diuji menggunakan paired sample t-test pada selang kepercayaan 95%. Hasil pengolahan statistik data hasil pengukuran kadar protein dapat dilihat pada Lampiran 25. Berdasarkan pengujian secara statistik diketahui bahwa kedua sampel berbeda nyata (p<0.05) kadar proteinnya. Kadar protein kosentrat protein kecambah dan konsentrat protein kacang komak lebih rendah dibandingkan konsentrat protein pada mucuna bean (Mucuna pruriens) yaitu 78.3%.
d. Kadar lemak
Kadar lemak dari konsentrat protein kecambah dan konsentrat protein kontrol ditunjukkan pada Tabel 6 dan Lampiran 5. Berdasarkan pengukuran terhadap kadar lemak, diketahui bahwa kadar lemak konsentrat protein kecambah kacang komak dan konsentrat protein kontrol berturut-turut adalah 1.56 ± 0.49% dan 1.51 ± 0.63% dalam basis kering.
Kadar lemak dipengaruhi oleh degradasi lemak akibat aktivitas enzim lipase. Enzim lipase ini akan memecah lemak menjadi
asam-asam lemak bebas. Peningkatan kadar lemak pada konsentrat protein kecambah kacang komak dapat dikarenakan meningkatnya aktivitas enzim lipase. Enzim lipase dapat aktif dengan adanya keberadaan air karena enzim lipase merupakan enzim hidrolitik yang membutuhkan air untuk memecah lemak.
Menurut Swanson (1990), selama solubilisasi dan ekstraksi isolat protein sayuran, beberapa materi nonprotein seperti polifenolik, klorofil dan karotenoid, fitat, dan lipid serta produk turunannya dapat ikut terekstrak. Flavor beany, pahit, flavor seperti kertas karton pada beberapa isolat protein kacang-kacangan dapat menyebabkan konversi asam lemak tidak jenuh menjadi aldehid, keton, dan alkohol. Oksidasi lipid kemungkinan terjadi selama penyimpanan biji, proses ekstraksi alkali, atau penyimpanan isolat protein yang dapat menghasilkan flavor hasil oksidasi yang tidak diinginkan.
Data hasil pengukuran terhadap kadar lemak kemudian diuji menggunakan paired sample t-test pada selang kepercayaan 95%. Hasil pengolahan statistik data hasil pengukuran kadar lemak dapat dilihat pada Lampiran 26. Berdasarkan pengujian secara statistik diketahui bahwa kedua sampel tidak berbeda nyata (p>0.05) kadar lemaknya. Hal ini diduga karena kadar lemak awal dari kacang komak cukup rendah yaitu hanya 1.06% (bk) (Anita, 2009) sehingga cenderung sedikit pemecahan lemak yang terjadi.
e. Kadar karbohidrat
Kadar karbohidrat dari konsentrat protein kecambah dan konsentrat protein kontrol ditunjukkan pada Tabel 6 dan Lampiran 6. Berdasarkan pengukuran terhadap kadar karbohidrat, diketahui bahwa kadar karbohidrat konsentrat protein kecambah kacang komak dan konsentrat protein kontrol berturut-turut adalah 35.48 ± 12.93% dan 9.33 ± 1.64% dalam basis kering.
Kadar karbohidrat yang masih tinggi ini dimungkinkan tahap yang dilalui kecambah kacang komak masih dalam tahap awal.
Pomeranz (1991) menjelaskan bahwa pada tahap awal perkecambahan, minyak dalam biji dipecah dan asam lemak bebas terbentuk lalu dinding sel didegradasi diikuti dengan pemecahan protein. Hanya pada tahap lanjut, perkecambahan akan mengubah pati menjadi gula.
Kadar karbohidrat dihitung berdasarkan metode by difference yaitu kadar karbohidrat merupakan hasil selisih antara 100% kadar nutrisi dalam bahan dengan jumlah antara kadar air, kadar abu, kadar protein, dan kadar lemak. Kadar karbohidrat yang masih sangat besar pada konsentrat protein kecambah kacang komak diduga terjadi karena penurunan kadar air, kadar abu, dan kadar protein.
Data hasil pengukuran terhadap kadar karbohidrat kemudian diuji menggunakan paired sample t-test pada selang kepercayaan 95%. Hasil pengolahan statistik data hasil pengukuran kadar karbohidrat dapat dilihat pada Lampiran 27. Berdasarkan pengujian secara statistik diketahui bahwa kedua sampel berbeda nyata (p<0.05) kadar karbohidratnya.
N. ANALISIS SIFAT FISIKOKIMIA f. Derajat warna
Pengukuran nilai Y, x, dan y dilakukan dengan menggunakan Chromameter CR-310 Minolta. Nilai Y, x, dan y ini kemudian dikonversi menjadi nilai X, Y, dan Z yang disebut dalam sistem CIE. Sistem CIE akan mentransformasi refleksi atau transmisi objek ke dalam warna tiga dimensi menggunakan penyebaran kekuatan spektrum iluminasi dan kesesuaian fungsi warna dengan standar yang diukur (MacDougall, 2002). Sistem CIE kemudian ditransformasi lagi menjadi sistem CIELAB yaitu menggunakan penerjemahan L, a, dan b. Nilai L, a, dan b pada konsentrat protein kecambah dan konsentrat protein kontrol dapat diperlihatkan pada Lampiran 7 dan Gambar 14.
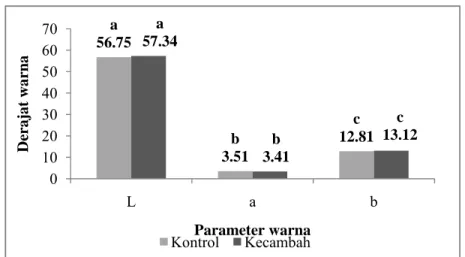
a 56.75 b 3.51 c 12.81 a 57.34 b 3.41 c 13.12 0 10 20 30 40 50 60 70 L a b D era jat wa rna Parameter warna Kontrol Kecambah
Berdasarkan pengukuran terhadap derajat warna, diketahui bahwa konsentrat protein kecambah kacang komak memiliki nilai L lebih tinggi dibandingkan kontrol yaitu 57.34 sedangkan kontrolnya 56.75. Nilai a menunjukkan bahwa konsentrat kecambah (3.41) lebih rendah dibandingkan kontrol (3.51). Sedangkan nilai b menunjukkan bahwa konsentrat kecambah lebih tinggi nilai b nya (13.12) dibandingkan pada kontrolnya (12.81). Akan tetapi ketiga pengukuran L, a, dan b ini tidak berbeda nyata (p>0.05) pada selang kepercayaan 95%. Hasil pengujian statistik derajat warna dapat dilihat pada Lampiran 28.
Gambar 14. Nilai L, a, dan b konsentrat protein kecambah kacang komak dan kontrol. Nilai yang diikuti oleh huruf yang sama pada grafik menunjukkan tidak berbeda nyata (paired sample t-test pada α = 5%)
Pengukuran warna dengan kolorimeter biasanya juga dinyatakan dengan perbedaan antara warna contoh dengan standar atau kontrol. Konsentrat kecambah memiliki perbedaan L yang positif dengan kontrol yang menunjukkan bahwa contoh lebih putih dibandingkan kontrol. Hal ini sejalan dengan nilai derajat putih konsentrat kecambah yang lebih besar dibandingkan kontrol. Perbedaan nilai a yang negatif antara contoh dengan kontrol menunjukkan bahwa contoh lebih hijau dibandingkan kontrol. Kenaikan intensitas warna hijau ini diduga adanya sintesis klorofil ketika proses perkecambahan berlangsung. Sedangkan perbedaan yang positif pada nilai b menunjukkan contoh lebih kuning dibandingkan kontrol.
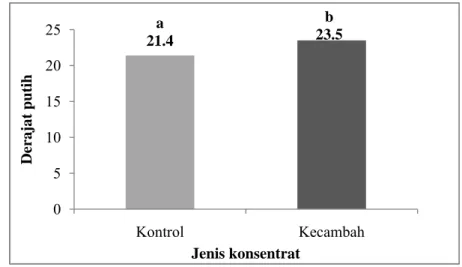
a 21.4 b 23.5 0 5 10 15 20 25 Kontrol Kecambah D er a jat put ih Jenis konsentrat
Secara visual, dapat dilihat pada Gambar 13 bahwa konsentrat protein kecambah kacang komak memiliki warna yang lebih cerah dibandingkan konsentrat protein kontrol. Hal ini ditunjukkan dengan nilai L (lightness) yang lebih besar yaitu 57.34. Peningkatan kecerahan warna diduga disebabkan karena proses perendaman akan melarutkan senyawa-senyawa pengotor yang berada di kulit biji. Pengotor ini juga akan terendapkan bersama komponen nonprotein dalam proses pembuatan konsentrat protein. Ketika proses pelarutan protein kemudian dilakukan proses penyaringan, komponen pengotor akan tertahan disaringan.
g. Derajat putih (Whiteness)
Derajat putih adalah atribut untuk menduga objek mendekati warna referensi yang lebih putih (Waggle, et al., 1989). Derajat putih diukur dengan menggunakan parameter warna putih yaitu MgO yang bernilai 81.6 lalu dikonversi ke standar BaSO4 dengan nilai 110.8. Derajat putih sangat penting karena dapat mempengaruhi penerimaan konsumen pada produk terutama produk tepung-tepungan. Derajat putih pada konsentrat protein kecambah dan konsentrat protein kontrol dapat diperlihatkan pada Lampiran 8 dan Gambar 15.
Gambar 15. Derajat putih konsentrat protein kecambah kacang komak dan kontrol. Nilai yang diikuti oleh huruf yang sama pada grafik menunjukkan tidak berbeda nyata (paired sample t-test pada α = 5%)
Berdasarkan pengukuran terhadap derajat putih, diketahui bahwa konsentrat protein kecambah kacang komak memiliki derajat putih yang lebih tinggi yaitu 23.5 dibandingkan dengan konsentrat protein kontrol yaitu 21.4. Akan tetapi pada kedua sampel tidak ada perbedaan yang nyata (p>0.05) dalam derajat putihnya pada selang kepercayaan 95%. Hasil pengujian statistik derajat putih dapat dilihat pada Lampiran 29.
Derajat putih memiliki hubungan yang linear dengan nilai L (Lightness). Semakin tinggi nilai L, maka nilai derajat putih juga semakin besar. Kenaikan nilai derajat putih konsentrat protein kecambah kacang komak juga ditandai dengan peningkatan nilai kecerahan (L). Hal ini disebabkan oleh adanya pelarutan kotoran-kotoran selama proses germinasi dan juga selama pembuatan konsentrat. Kotoran akan larut bersama air rendaman maupun mengendap bersama komponen nonprotein di saringan.
Selama germinasi, terjadi proses degradasi protein menjadi asam-asam amino. Asam-asam amino yang berukuran molekul lebih kecil dapat dengan mudah larut dalam air sehingga beresiko terjadi kehilangan selama pembuatan konsentrat. Asam-asam amino tertentu seperti lisin dapat mendorong terjadinya reaksi non-enzimatis dengan komponen gula menghasilkan reaksi mailard. Produk dari reaksi mailard ini adalah melanoidin yang dapat membentuk warna coklat pada produk. Oleh karena terjadi kehilangan beberapa asam amino menyebabkan berkurangnya substrat bagi reaksi mailard sehingga warna dari konsentrat protein kecambah kacang komak lebih tinggi dibandingkan konsentrat protein kontrol.
h. Densitas kamba
Densitas kamba merupakan massa partikel yang menempati suatu unit volume tertentu (Wirakartakusumah, et al., 1992). Densitas kamba menyatakan keringkasan suatu bahan dalam menempati volume. Semakin besar densitas kambanya, maka semakin ringkas bahan
te le se ke D pr ba ad D pa da G ka N be ka ba da de m de rsebut karen bih besar. D ecara signif edelai, P. a ensitas kam rotein kontro Berdasa ahwa densita dalah 0.8663 ensitas kam ada selang k apat dilihat p Gambar 16. acang komak
ilai yang dii erbeda nyata Densita acang koma ahwa pada v apat menem ensitas kam menggunakan ensitas kamb na dapat me Densitas ka fikan (p<0. ngularis, da mba pada k ol dapat dipe arkan pengu as kamba da 3 g/ml dan k mba pada pad kepercayaan pada Lampir Densitas k k dan kontro ikuti oleh hu a (paired sam as kamba y ak dibanding volume yang mpati volum mba yang n jenis pen banya tidak nempati vol amba pada t 05) lebih an P. calca konsentrat p erlihatkan pa ukuran terh ari konsentra konsentrat pr da kedua sam 95%. Hasil ran 30. kamba (g/m ol.
uruf yang sam mple t-test pa yang lebih b gkan konsen sama yaitu me tersebut tidak berb nggiling dan berbeda nya lume yang s tepung kaca besar dens atarus (Chau protein keca ada Lampiran hadap densi at protein kec rotein kontro mpel tidak b pengujian st ml) konsentr ma pada gra ada α = 5%) besar pada ntrat protein 1 ml, konsen sebanyak 0 beda nyata n blender ata (p>0.05) sama dalam ang komak sitasnya dib u dan Cheu ambah dan n 9 dan Gam itas kamba, cambah kaca ol adalah 0. berbeda nyat tatistik dens rat protein afik menunju konsentrat kontrol me ntrat protein 0.8663 g. A a disebabka yang sama ) antara ked berat yang dilaporkan bandingkan ung, 1998). konsentrat mbar 16. diketahui ang komak 8597 g/ml. ta (p>0.05) sitas kamba kecambah ukkan tidak kecambah enunjukkan n kecambah Akan tetapi an karena a sehingga dua sampel.
a 0.472 b 0.636 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 kontrol Kecambah Ak tivitas air Jenis konsentrat
Densitas kamba kedua sampel sedikit lebih tinggi dibandingkan makanan berbentuk bubuk lainnya yang umumnya berkisar antara 0.30-0.80 g/ml (Wirakartakusumah, et al., 1992).
i. Aktivitas air (Aw)
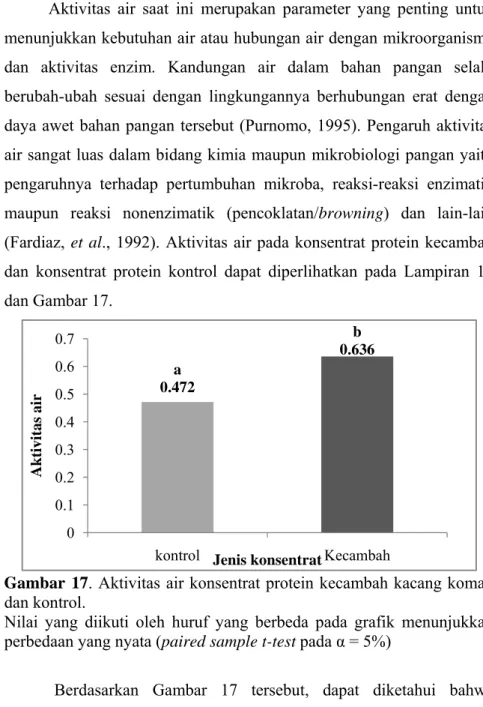
Aktivitas air saat ini merupakan parameter yang penting untuk menunjukkan kebutuhan air atau hubungan air dengan mikroorganisme dan aktivitas enzim. Kandungan air dalam bahan pangan selalu berubah-ubah sesuai dengan lingkungannya berhubungan erat dengan daya awet bahan pangan tersebut (Purnomo, 1995). Pengaruh aktivitas air sangat luas dalam bidang kimia maupun mikrobiologi pangan yaitu pengaruhnya terhadap pertumbuhan mikroba, reaksi-reaksi enzimatik maupun reaksi nonenzimatik (pencoklatan/browning) dan lain-lain (Fardiaz, et al., 1992). Aktivitas air pada konsentrat protein kecambah dan konsentrat protein kontrol dapat diperlihatkan pada Lampiran 10 dan Gambar 17.
Gambar 17. Aktivitas air konsentrat protein kecambah kacang komak dan kontrol.
Nilai yang diikuti oleh huruf yang berbeda pada grafik menunjukkan perbedaan yang nyata (paired sample t-test pada α = 5%)
Berdasarkan Gambar 17 tersebut, dapat diketahui bahwa perlakuan germinasi dapat meningkatkan aktivitas air konsentrat protein menjadi 0.636 dibandingkan konsentrat protein kontrol yaitu 0.472. Kenaikan aktivitas air ini disebabkan adanya proses imbibisi air ke
dalam biji saat proses perendaman. Aktivitas air di atas 0.6 menunjukkan bahwa konsentrat protein kecambah rentan terhadap pertumbuhan khamir osmofilik (Pomeranz, 1991). Pengujian dengan statistik menggunakan paired sample t-test juga menunjukkan perbedaan yang nyata (p<0.05) antara kedua sampel. Hasil pengujian statistik dapat dilihat pada Lampiran 31.
Dalam proses germinasi, air digunakan untuk mengaktifkan enzim-enzim hidrolitik seperti amilase, protease, dan lipase. Enzim-enzim ini akan memecah makromolekul seperti karbohidrat, protein, dan lemak menjadi mikromolekul seperti glukosa, asam amino, dan asam lemak bebas. Menurut Troller dan Christian (1978), ketika Aw meningkat maka kecepatan reaksi enzimatik juga akan meningkat. Hal ini disebabkan adanya peningkatan lubang kapiler yang diisi dengan air menghasilkan pelarutan substrat yang lebih besar, dan meningkatkan kecepatan reaksi. Air bebas tersedia untuk mendorong reaksi enzimatis sehingga reaksi hidrolisis dapat terjadi.
e. Daya cerna protein in vitro
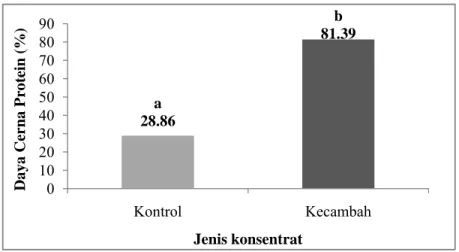
Daya cerna protein secara in vitro menggunakan tiga macam enzim (multienzim) yaitu tripsin, kimotripsin, dan pankreatin. Pereaksi folin digunakan untuk mewarnai asam amino yang terbentuk baik dari bahan itu sendiri maupun yang berasal dari degradasi enzim yang digunakan. Penentuan secara in vitro dilakukan untuk mengetahui simulasi pencernaan protein di luar tubuh. Hal ini untuk mengurangi biaya dan waktu pengujian. Daya cerna protein secara in vitro pada konsentrat protein kecambah dan konsentrat protein kontrol dapat diperlihatkan pada Lampiran 11 dan Gambar 18.
Berdasarkan pengujian terhadap daya cerna protein, diketahui bahwa konsentrat protein kecambah kacang komak memiliki daya cerna protein yang lebih tinggi yaitu 81.39% sedangkan konsentrat protein kontrol adalah 28.86%. Kedua sampel ini berbeda nyata (p<0.05) pada
a 28.86 b 81.39 0 10 20 30 40 50 60 70 80 90 Kontrol Kecambah Da ya Cer n a P ro tein (%) Jenis konsentrat
selang kepercayaan 95%. Hasil pengujian statistik terhadap daya cerna protein secara in vitro dapat dilihat pada Lampiran 32.
Gambar 18. Daya cerna protein (%) konsentrat protein kecambah kacang komak dan kontrol.
Nilai yang diikuti oleh huruf yang berbeda pada grafik menunjukkan perbedaan yang nyata (paired sample t-test pada α = 5%)
Peningkatan daya cerna protein dengan adanya proses germinasi disebabkan adanya peningkatan aktivitas protease. Protease inilah yang akan memecah molekul-molekul besar protein menjadi asam-asam amino yang berukuran lebih kecil dan lebih sederhana. Hal ini yang menyebabkan jumlah asam amino yang terkandung dalam konsentrat protein kecambah kacang komak lebih tinggi dibandingkan konsentrat protein kontrol. Selain itu, kenaikan daya cerna protein disebabkan adanya penurunan aktivitas enzim inhibitor dan hidrolisis asam fitat yang setara dengan degradasi protein. Penurunan tripsin inhibitor pada kacang komak yang digerminasi adalah sebesar 19.39% dan asam fitat tereduksi sebanyak 48.94% (Osman, 2007)
Oleh karena protein-protein yang terkandung dalam konsentrat protein kecambah telah terpecah menjadi asam-asam amino, maka multienzim dalam pengujian daya cerna protein dapat dengan mudah mendegradasinya menjadi molekul yang lebih mudah dicerna dan diserap. Kenaikan jumlah asam amino inilah yang diukur dengan pewarnaan folin. Menurut Osman (2007), daya cerna protein secara in vitro pada kecambah Dolichos lablab adalah 92.27% dan nilai daya
O ce pe O. ANAL a. D da be te te Si be da Ju de ko pa G ko N be se erna ini le emasakan, p LISIS SIFA aya serap a Protein aya serap ai erpengaruh. rsebut paling rsebut seper isi kationik, erbeda-beda Daya alam bahan umlah air y engan jumla onsentrat pro ada Lampira Gambar 19. omak dan ko ilai yang dii erbeda nyata
Berdas erap air kon
ebih tinggi emangganga T FUNGSIO air n merupakan ir suatu bah Gugus asa g berpengaru rti karbonil, anionik, da (Fardiaz, et serap air d kemudian yang tersera ah air setelah otein kecamb an 12 dan Ga Daya serap ontrol. ikuti oleh hu a (paired sam sarkan hasil nsentrat prot i dibanding an, autoklaf, ONAL PRO n komponen han meskipu am amino p uh terhadap , hidroksil, an nonionik al., 1992). ditentukan d membiarkan ap merupaka h sentrifusi. bah dan kon ambar 19.
air (%) kon uruf yang sam mple t-test pa l pengukura tein kecamb gkan efek dan mentah OTEIN n yang paling un kompone polar yang daya serap a amino, karb menyerap a dengan cara n air denga an selisih j Hasil peng nsentrat prote nsentrat pro ma pada gra ada α = 5%) an tersebut d bah kacang k proses pe h. g berpengaru n-komponen terdapat pa air. Gugus a boksil, dan air dalam ju menambahk an bahan be jumlah air gukuran day ein kontrol d tein kecamb afik menunju diketahui ba komak yaitu erendaman, uh terhadap n lain juga ada protein amino polar sulfihidril. umlah yang kan air ke erinteraksi. mula-mula a serap air ditunjukkan bah kacang ukkan tidak ahwa daya u 380.89%
lebih tinggi dibandingkan konsentrat protein kontrol yaitu 282.78%. Menurut Zayas (1997), peningkatan kelembaban relatif dan aktivitas air akan menyebabkan gugus polar mengikat lebih banyak air sehingga membentuk multilayer air di sekeliling gugus polar protein. Hal ini terjadi pada kenyataan bahwa meningkatnya aktivitas air pada konsentrat protein yang diberi perlakuan germinasi akibat adanya proses perendaman selama 12 jam.
Germinasi akan menyebabkan terjadinya denaturasi parsial sehingga terjadi modifikasi terhadap struktur sekunder, tersier, dan kuartener pada molekul protein tanpa terjadinya pemecahan ikatan-ikatan kovalen. Denaturasi dapat menyebabkan terbukanya lipatan polipeptida (Winarno, 1992). Pembukaan rantai polipeptida akan menyebabkan pengikatan air yang lebih banyak daripada bentuk globular (Fardiaz, et al., 1992). Proses denaturasi ini terjadi karena adanya kinerja enzim-enzim proteolitik yang dapat membuka rantai polipeptida. Enzim-enzim ini diduga menyerang dengan lebih mudah ketika proses perendaman yang dapat menyebabkan pembengkakan granula-granula. Jarak antar granula yang lebih besar menyebabkan enzim lebih mudah membuka rantai polipeptida tersebut.
Daya serap air yang diukur kemudian dilakukan pengujian menggunakan paired sampel t-test pada selang kepercayaan 95%. Hasil pengujian statistik dapat dilihat pada Lampiran 33. Berdasarkan pengujian tersebut, diketahui bahwa daya serap air konsentrat protein kecambah kacang komak tidak berbeda nyata (p>0.05) dengan konsentrat protein kontrol. Daya serap air konsentrat protein kecambah kacang komak juga lebih tinggi jika dibandingkan daya serap air isolat protein kacang komak yaitu 321% (Subagio, 2006) dan pada konsentrat protein lentil (105%) serta kacang kapri (118%) (Swanson, 1990). Penggunaan daya serap air dalam produk pangan diantaranya pada produk-produk pangan seperti sosis, roti dan cake.
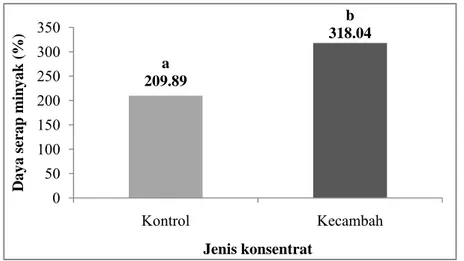
a 209.89 b 318.04 0 50 100 150 200 250 300 350 Kontrol Kecambah Day a sera p minya k ( %) Jenis konsentrat b. Daya serap minyak
Kemampuan penyerapan minyak atau lemak tergantung pada struktur proteinnya. Menurut Lin, et al. (1974), struktur protein yang bersifat lipofilik disebabkan oleh kandungan cabang protein nonpolar yang lebih dominan, sehingga berkontribusi terhadap meningkatnya daya serap minyak. Daya serap minyak dari konsentrat protein kecambah kacang komak dan konsentrat protein kontrol ditunjukkan pada Lampiran 13 dan Gambar 20.
Gambar 20. Daya serap minyak (%) konsentrat protein kecambah kacang komak dan kontrol.
Nilai yang diikuti oleh huruf yang berbeda pada grafik menunjukkan perbedaan yang nyata (paired sample t-test pada α = 5%)
Berdasarkan pengukuran daya serap minyak pada kedua jenis konsentrat protein tersebut, diketahui bahwa daya serap minyak konsentrat protein kecambah kacang komak lebih tinggi yaitu 318.04% dibandingkan konsentrat protein kontrol yaitu 209.89%. Pengujian secara statistik dengan paired sample t-test menunjukkan perbedaan yang nyata (p<0.05) antara kedua sampel pada selang kepercayaan 95%. Hasil pengujian statistik daya serap minyak dapat dilihat pada Lampiran 34.
Daya serap minyak dipengaruhi oleh sumber protein, kondisi proses, komposisi bahan tambahan lain, ukuran partikel, dan suhu (Zayas, 1997). Seperti halnya dengan daya serap air, kenaikan daya serap minyak pada konsentrat yang diberi perlakuan germinasi diduga
karena meningkatnya jumlah gugus nonpolar akibat proses denaturasi oleh enzim-enzim proteolitik. Denaturasi akan meningkatkan jumlah gugus nonpolar yang terpapar ke permukaan dengan cara membukanya struktur protein. Semakin banyak gugus nonpolar yang terpapar maka semakin banyak minyak yang dapat diikat oleh protein.
Jika dibandingkan, daya serap minyak pada konsentrat protein kecambah kacang komak (318.04%) lebih tinggi dibandingkan isolat protein kacang komak (254%) yang dilaporkan oleh Subagio (2006). Konsentrat kecambah kacang komak juga memiliki daya serap minyak yang lebih tinggi dibandingkan beach pea (64-82%), Woodstone pea (90.1-94.5%), dan fieldpea (90-127%) (Chavan, et al., 2001 dikutip dalam Subagio, 2006) serta pada konsentrat protein lentil (92%) dan kacang kapri (97%) (Swanson, 1990).
Daya serap minyak yang lebih tinggi pada konsentrat protein kecambah kacang komak memungkinkan penggunaanya pada beberapa produk pangan yang membutuhkan sifat pengikatan terhadap lemak yang tinggi diantaranya pada produk daging sintetis. Penambahan protein kecambah ini dimaksudkan untuk memperbaiki pengikatan lemak atau mencegah sejumlah kehilangan air selama proses pengolahan, dan juga dapat digunakan untuk memperbaiki karakteristik citarasa. Produk pangan yang membutuhkan daya serap minyak yang tinggi adalah daging, sosis, dan donat.
c. Daya emulsi
Emulsi diartikan sebagai campuran dari dua cairan atau lebih yang tidak saling melarutkan, cairan yang satu terdispersi dalam bentuk globula-globula atau butir-butir kecil di dalam cairan lainnya. Cairan yang terdispersi disebut fase tidak kontinyu sedangkan cairan yang mendispersikan disebut fase kontinyu (Fardiaz, et al., 1992).
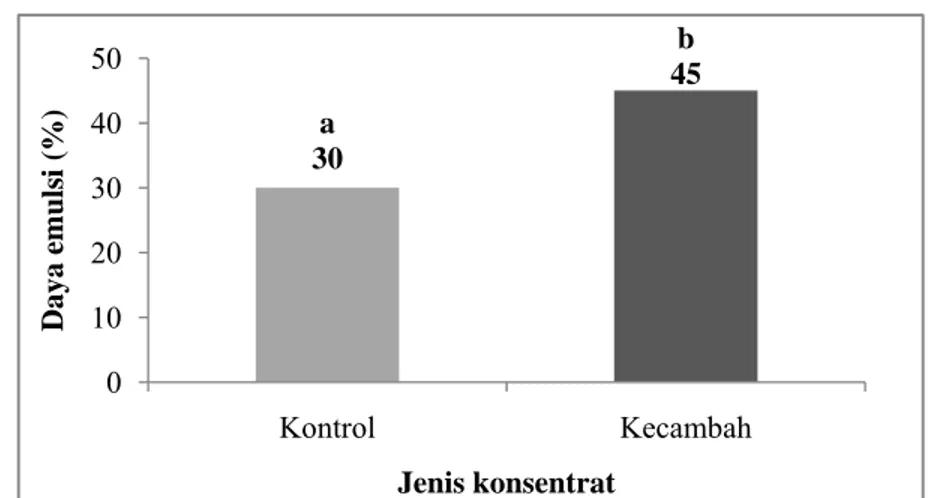
a 30 b 45 0 10 20 30 40 50 Kontrol Kecambah Daya emuls i (%) Jenis konsentrat
Daya emulsi dari konsentrat protein kecambah kacang komak dan konsentrat protein kontrol ditunjukkan pada Lampiran 14 dan Gambar 21.
Gambar 21. Daya Emulsi (%) konsentrat protein kecambah kacang komak dan kontrol.
Nilai yang diikuti oleh huruf yang berbeda pada grafik menunjukkan perbedaan yang nyata (paired sample t-test pada α = 5%)
Berdasarkan pengukuran daya emulsi pada konsentrat protein kecambah kacang komak dan konsentrat protein kontrol diketahui bahwa daya emulsinya masing-masing adalah 45% dan 30%. Kedua sampel berbeda nyata (p<0.05) pada selang kepercayaan 95%. Hasil analisis statistik pada daya emulsi ditunjukkan pada Lampiran 35. Daya emulsi konsentrat protein kecambah dan konsentrat protein kacang komak masih lebih tinggi jika dibandingkan dengan daya emulsi pada konsentrat protein lentil (19%) dan kacang kapri (25%) (Swanson, 1990).
Perbandingan jumlah asam amino lipofilik-hidrofilik yang seimbang mempengaruhi daya emulsi (Zayas, 1997). Jumlah asam amino lipofilik dan hidrofilik konsentrat protein kecambah kacang komak yang besar ditunjukkan dari tingginya daya serap air dan daya serap minyak dibandingkan konsentrat protein kontrol. Keseimbangan ini akan menurunkan tegangan permukaan dan interfasial. Sifat lipofilik dan hidrofilik ini berperan dalam orientasi protein dimana gugus lipofik
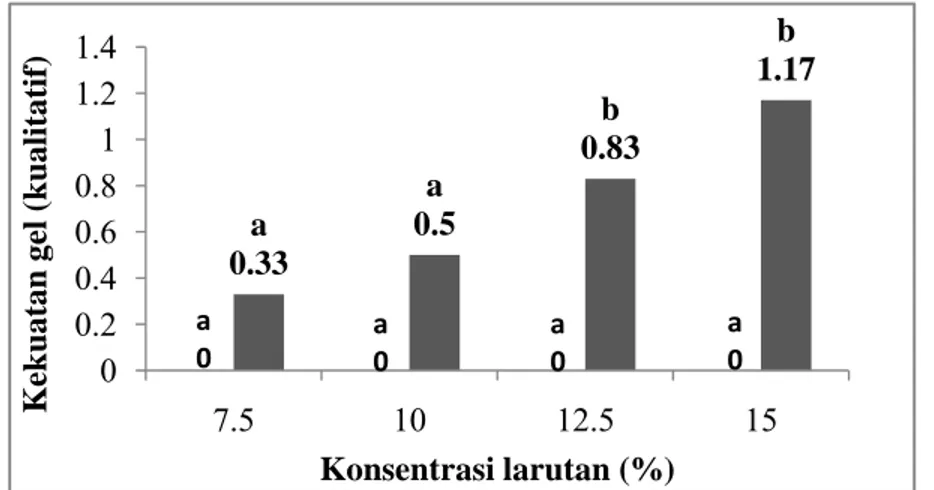
a 0.33 a 0.5 b 0.83 b 1.17 0 0.2 0.4 0.6 0.8 1 1.2 1.4 7.5 10 12.5 15 Kek u atan gel (k ualitatif) Konsentrasi larutan (%) a 0 a 0 a 0 a 0
akan menghadap ke minyak dan gugus hidrofilik menghadap ke air (Zayas, 1997).
Daya emulsi yang lebih tinggi pada konsentrat protein kecambah kacang komak berpotensi sebagai emulsifier. Emulsifier ini berfungsi sebagai surfaktan yang dapat menurunkan tegangan permukaan antara komponen hidrofilik dan lipofilik sehingga dapat menahan minyak dan membentuk emulsi dalam air yang stabil. Produk pangan yang banyak menggunakan emulsi antara lain adalah sosis, bologna, sup, dan cakes.
d. Kekuatan gel
Gelasi adalah fenomena agregasi protein dimana interaksi-interaksi antara polimer-polimer dan polimer-pelarut serta gaya tarik dan gaya tolaknya sedemikian seimbangnya sehingga suatu jalinan tersier yang tersusun seperti matriks terbentuk. Matriks ini mampu untuk menjerat sejumlah besar air di dalamnya (Fardiaz, et al., 1992). Teknik gelasi yang digunakan dalam penelitian ini adalah gelasi yang diinduksi oleh panas. Kekuatan gel diukur dari empat konsentrasi larutan yang berbeda yaitu 7.5%, 10%, 12.5%, dan 15%.
Gambar 22. Kekuatan gel (kualitatif) konsentrat protein kecambah kacang komak dan kontrol. Nilai yang diikuti oleh huruf yang sama pada grafik (konsentrasi larutan yang sama) menunjukkan tidak berbeda nyata (non parametric two-related samples pada α = 5%)
Kekuatan gel dari konsentrat protein kecambah kacang komak dan konsentrat protein kontrol ditunjukkan pada Lampiran 15 dan Gambar 22. Berdasarkan pengukuran kekuatan gel pada konsentrat protein kecambah kacang komak dan konsentrat protein kontrol diketahui bahwa kekuatan gel dari konsentrat protein kecambah kacang komak lebih besar dari konsentrat protein kontrol. Kedua sampel berbeda nyata (p<0.05) pada konsentrasi larutan 12.5% dan 15%. Hal ini menunjukkan bahwa konsentrat protein kecambah kacang komak dapat membentuk gel pada konsentrasi larutan yang lebih rendah dibandingkan konsentrat protein kontrol. Hasil analisis statistik pada kekuatan gel ditunjukkan pada Lampiran 36.
Peningkatan kekuatan gel pada konsentrat protein kecambah disebabkan adanya kenaikan asam-asam amino hidrofobik selama germinasi. Asam amino hidrofobik ini berperan dalam menstabilkan jaringan yang kuat pada sistem gel. Selain itu, peningkatan jumlah gugus –SH dan –SS- akibat denaturasi akan memperkuat jaringan intermolekular. Reaksi penting dalam pembentukan gel adalah pembentukan jembatan disulfida. Selama germinasi, terjadi pembukaan ikatan disulfida dan aktivasi gugus sulfihidril sebagai hasil dari pembukaan lipatan rantai polipeptida protein. Gugus SH yang reaktif dapat membentuk ikatan disulfida intermolekular yang baru (Zayas, 1997).
Kekuatan gel pada konsentrat kontrol lebih rendah dikarenakan jumlah globulin 11S yang lebih rendah sehingga protein pada biji tidak dapat membentuk gel yang kuat sebab tidak terdapat gugus sulfihidril dalam jumlah yang cukup. Gugus sulfihidril tersebut dibutuhkan untuk membentuk ikatan disulfida dalam gel (Subagio, 2006). Oleh karena itu, dapat diduga perlakuan germinasi dapat meningkatkan kekuatan gel pada konsentrat protein kacang komak dengan cara meningkatkan jumlah gugus sulfihidril dan ikatan disulfidanya. Walaupun gel yang terbentuk masih tergolong lemah.
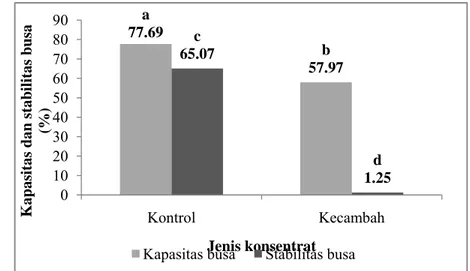
a 77.69 b 57.97 c 65.07 d 1.25 0 10 20 30 40 50 60 70 80 90 Kontrol Kecambah Kapasitas dan stab ilitas b usa (%) Jenis konsentrat
Kapasitas busa Stabilitas busa
e. Kapasitas dan stabilitas busa
Kapasitas busa protein berarti kemampuan protein untuk membentuk lapisan film tebal pada permukaan gas-cair sehingga sejumlah besar gelembung udara dapat bergabung dan terstabilkan. Sedangkan stabilitas busa berarti kemampuan protein untuk menstabilkan busa melawan gravitasi dan stress mekanis (Damodaran, 1996). Kapasitas dan stabilitas busa dipengaruhi oleh beberapa faktor diantaranya kelarutan protein, fleksibilitas permukaan protein, dan hidrofobisitas protein (Zayas, 1997). Jenis reaksi yang berperan dalam pembentukan busa adalah pembentukan film yang stabil untuk menjerat gas. Kapasitas dan stabilitas busa dari konsentrat protein kecambah kacang komak dan konsentrat protein kontrol ditunjukkan pada Lampiran 16 dan Gambar 23.
Gambar 23. Kapasitas dan Stabilitas busa (%) konsentrat protein kecambah kacang komak dan kontrol. Nilai yang diikuti oleh huruf yang sama pada grafik menunjukkan tidak berbeda nyata (paired sample t-test pada α = 5%)
Berdasarkan pengukuran terhadap kapasitas dan stabilitas busa, konsentrat protein kecambah kacang komak lebih kecil kapasitas busanya (57.97%) dan lebih tidak stabil busanya (1.91%) dibandingkan konsentrat protein kontrol (77.69% dan 65.07%). Perbedaan kapasitas dan kestabilan pembuasaan dipengaruhi oleh pH medium, konsentrasi protein, whipping aids, dan penghambatan pembusaan (Zayas, 1997).
Kapasitas dan stabilitas busa kedua sampel berbeda nyata (p<0.05) pada selang kepercayan 95%. Hasil analisis statistik pada kapsitas dan stabilitas busa ditunjukkan pada Lampiran 37 dan 38.
Perbedaan konsentrasi protein kedua sampel yang signifikan yaitu konsentrat protein kecambah kacang komak (47.71%) dan konsentrat protein kontrol (72.28%) mempengaruhi kemampuannya dalam membentuk busa dan menstabilkannya. Hal ini dikarenakan peningkatan konsentrasi akan meningkatkan interaksi protein-protein yang lebih besar yang dapat juga meningkatkan viskositas dan memfasilitasi pembentukan lapisan protein multilayer kohesif pada permukaan. Selain itu, peningkatan konsentrasi dapat mendorong pembentukan lapisan yang lebih tebal yang dapat membatasi efek pengeringan protein dari lapisan (Adebowale dan Lawal, 2003).
Kestabilan busa dipengaruhi oleh konsentrasi protein. Konsentrasi protein yang tinggi akan meningkatkan ketebalan, kekuatan mekanik, dan kohesivitas pada lapisan (Zayas, 1997). Selain itu, kapasitas dan stabilitas busa juga dipengaruhi oleh adanya interaksi hidrofobik. Interaksi hidrofobik yang terlalu tinggi akan menyebabkan efek salting out yang dapat menurunkan kapasitas dan stabilitas busa (Adebowale dan Lawal, 2003). Interaksi hidrofobik yang lebih besar pada konsentrat protein kecambah menyebabkan kapasitas dan stabilitas busanya lebih rendah dibandingkan konsentrat protein kontrol.
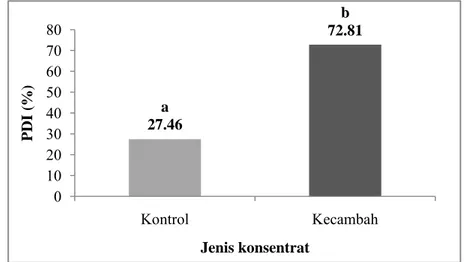
f. Protein dispersability index (PDI)
Kelarutan protein adalah sifat fungsional pertama yang biasanya digunakan untuk mengetahui sifat fungsional lainnya. Kelarutan protein meningkat dengan komposisi asam amino dan sekuen, bobot molekul, konformasi serta komponen polar dan nonpolar dalam asam amino. Kelarutan protein juga dipengaruhi oleh faktor lingkungan yaitu kekuatan ionik, tipe pelarut, pH, suhu, dan kondisi proses (Zayas, 1997). Protein dispersability index (PDI) pada konsentrat protein
a 27.46 b 72.81 0 10 20 30 40 50 60 70 80 Kontrol Kecambah PDI (%) Jenis konsentrat
kecambah dan konsentrat protein kontrol dapat diperlihatkan pada Lampiran 17 dan Gambar 24.
Berdasarkan pengukuran PDI tersebut, diketahui bahwa konsentrat protein kecambah kacang komak dan konsentrat protein kontrol memiliki PDI berturut-turut adalah 72.81 dan 27.46. Kedua sampel berbeda nyata (p<0.05) nilai PDI-nya pada selang kepercayaan 95%. Hasil pengujian statistik PDI kedua sampel ditunjukkan pada Lampiran 39.
Gambar 24. Protein dispersability index (%) konsentrat protein kecambah kacang komak dan kontrol. Nilai yang diikuti oleh huruf yang berbeda pada grafik menunjukkan perbedaan yang nyata (paired sample t-test pada α = 5%)
Kelarutan protein yang tinggi dipengaruhi oleh adanya kondisi proses yang dapat meningkatkan kelarutan protein yaitu ekstraksi, presipitasi, dan netralisasi. Selain itu, germinasi juga menyebabkan degradasi protein yang bermolekul besar menjadi asam amino yang bermolekul lebih kecil. Molekul-molekul yang lebih kecil ini cenderung untuk lebih terdispersi dan larut dalam larutan. PDI juga digunakan sebagai indikator sifat fungsional protein lain. PDI yang tinggi dapat memprediksikan kenaikan pembentukan emulsi, pembentukan busa, dan pembentukan gel. Peningkatan konsentrasi protein yang larut menyebabkan pembentukan partikel yang lebih kecil selama emulsifikasi dan dapat meningkatkan stabilitas emulsi pada creaming (Zayas, 1997).
ko pr se se ju g. N ke le ke ko di G ka pa pa ba pr K 95 Oleh omak yaitu rotein kecam eperti adona ereal untuk umlah protein Nitrogen solu Nitrog elarutan pro mah. Padat ecepatan ren onsentrat pr iperlihatkan Gambar 25. N acang koma ada grafik ada α = 5%) Berdas ahwa konse rotein kontro Kedua sampe 5%. Hasil karena PDI 72.81, mak mbah kacang an bakery, bayi (Pom n yang terdis ubility index gen solubilit otein. Pengu tan yang t ndah (Zayas rotein kecam pada Lampi Nitrogen sol ak dan kontr menunjukka sarkan pengu entrat protei ol memiliki el tidak berb pengujian s I dari kons a menurut n g komak dap donat, minu meranz, 1991 spersi dalam (NSI) ty index (N ujian NSI t tidak larut , 1997). Nit mbah dan iran 18 dan G lubility index rol. Nilai ya an tidak ber ujian nitroge in kecambah nilai NSI be beda nyata ( statistik NSI sentrat prote nilai PDI ny pat digunaka uman, hidro 1). PDI yan m sistem pang NSI) diguna termasuk pe dipisahkan trogen solub konsentrat Gambar 25. x (%) konsen ang diikuti rbeda nyata en solubility h kacang k erturut-turut (p>0.05) pad I kedua sam ein kecamb ya tersebut, an pada prod olisat protein ng tinggi m gan juga bes
akan untuk engadukan y n dengan s bility index ( protein kon ntrat protein oleh huruf y a (paired sa index (NSI) komak dan t adalah 2.82 da selang ke mpel ditunju ah kacang konsentrat duk pangan n sayuran, menyatakan sar. mengukur yang lebih sentrifugasi (NSI) pada ntrol dapat n kecambah yang sama mple t-test ), diketahui konsentrat 2 dan 1.49. epercayaan ukkan pada
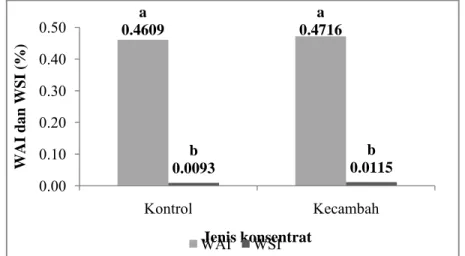
a 0.4609 a 0.4716 b 0.0093 b 0.0115 0.00 0.10 0.20 0.30 0.40 0.50 Kontrol Kecambah WAI da n WSI (%) Jenis konsentrat WAI WSI
Lampiran 40. NSI pada konsentrat protein kecambah kacang komak jauh lebih rendah dibandingkan pada konsentrat protein lentil (90.5) dan kacang kapri (90.4) yang dibuat dengan klasifikasi udara (Swanson, 1990).
NSI juga digunakan secara luas untuk memprediksi fungsionalitas protein. NSI yang lebih tinggi pada konsentrat protein kecambah kacang komak mengindikasikan daya pembentukan emulsi, gelasi, dan pembentukan busa yang lebih baik dibandingkan konsentrat protein kontrol. Hal ini diduga karena proses germinasi menyebabkan denaturasi dan degradasi protein menjadi asam amino sehingga jumlah hidrofil meningkat dan asam amino yang terlarut menjadi lebih banyak.
h. Water Absorption Index (WAI) dan Water Solubility Index (WSI) WAI dan WSI menyatakan indeks penyerapan dan kelarutan di dalam air. Water Absorption Index (WAI) dan Water Solubility Index (WSI) pada konsentrat protein kecambah dan konsentrat protein kontrol dapat diperlihatkan pada Lampiran 19 dan Gambar 26.
Gambar 26. Water Absorbtion Index (WAI) dan Water Solubility Index (WSI) konsentrat protein kecambah kacang komak dan kontrol.
Nilai yang diikuti oleh huruf yang sama pada grafik menunjukkan tidak berbeda nyata (paired sample t-test pada α = 5%)
Berdasarkan pengukuran terhadap WAI dan WSI, diketahui bahwa WAI dari konsentrat protein kecambah kacang komak dan konsentrat protein kontrol berturut-turut adalah 0.4716 dan 0.4069. Kedua sampel ini tidak berbeda nyata WAI-nya (p>0.05) pada selang kepercayaan 95%. Sedangkan WSI dari konsentrat protein kecambah kacang komak dan konsentrat protein kontrol berturut-turut adalah 0.0115 dan 0.0093. Kedua sampel ini tidak berbeda nyata WSI-nya (p>0.05) pada selang kepercayaan 95%. Hasil pengujian statistik WAI dan WSI kedua sampel ditunjukkan pada Lampiran 41 dan 42.
WAI dan WSI konsentrat protein kecambah lebih tinggi daripada konsentrat protein kontrol namun tidak berbeda nyata (p>0.05). WAI tergantung pada ketersediaan gugus hidrofilik dan kapasitas pembentukan gel. Adanya pembengkakan pati saat germinasi menyebabkan WAI semakin besar. Kenaikan jumlah gugus hidrofil yang terpapar ke permukaan menyebabkan lebih banyak jumlah air yang terikat dalam proses penyerapan. Proses germinasi juga akan mendegradasi molekul-molekul besar (amilosa dan amilopektin) menghasilkan molekul yang lebih kecil yang relatif lebih mudah larut dalam air. Kemudahan dalam perlarutan dalam air ini menyebabkan WSI nya meningkat.
P. ANALISIS KAPASITAS ANITIOKSIDAN a. Uji DPPH
Uji DPPH merupakan salah satu metode uji pengukuran aktivitas antioksidan di dalam bahan pangan. Uji DPPH tidak spesifik menguji suatu komponen antioksidan, tetapi digunakan untuk pengukuran aktivitas antioksidan total pada bahan pangan. Pengukuran total aktivitas antioksidan akan membantu untuk memahami sifat-sifat fungsional bahan pangan. Uji DPPH juga merupakan uji yang sederhana, cepat dan murah.
sta m ra ge 19 m ka 27 G ke N pe di ka 91 ny no K (p be DPPH abil pada su menjadi mole adikal diteta elombang 5 997 di dalam menggunakan acang komak 7. Gambar 27. ecambah kac ilai yang di erbedaan yan Berdas iketahui bah acang koma 14.50 AEAC yata (p>0.0 onproteinnya Kedua sampe p>0.05) akt erada pada H (1,1-diphen uhu ruang d ekul diamagn apkan deng 17 nm deng m Rajeshwar n uji DPPH k dan kontro Aktivitas an cang komak iikuti oleh h ng nyata (pa sarkan pengu hwa aktivita ak dan kont C. Kedua s 05) aktivita a berturut-tu el fraksi no tivitas antio fraksi non nyl-2-picrylh dan menerim netik yang s gan penurun gan penamb r, et al., 200 dari fraksi ol ditunjukk ntioksidan p dan kontrol huruf yang b aired sample ukuran aktiv as antioksida trol berturut sampel fraks as antioksid urut adalah 9 onprotein te oksidannya. nprotein ke hydrazil) ada ma elektron stabil. Kema nan absorba bahan antiok 05). Kapasit protein dan an pada Lam ada fraksi p . berbeda pad t-test pada α vitas antioksi an pada fra t-turut adala si protein t dannya. Sed 924.75 AEA ersebut juga Aktivitas cambah ka alah radikal b atau hidrog ampuan redu ansinya pad ksidan (Soa tas antioksid nonprotein mpiran 20 da protein dan n da grafik me α = 5%) idan dengan aksi protein ah 885.00 A tersebut tida dangkan pa AC dan 887. a tidak berb antioksidan acang koma bebas yang gen radikal uksi DPPH da panjang ares, et al., dan dengan kecambah an Gambar non protein enunjukkan n uji DPPH, kecambah AEAC dan ak berbeda ada fraksi 00 AEAC. beda nyata n tertinggi ak (924.75
AEAC). Hasil pengujian statistik kapasitas antioksidan dapat dilihat pada Lampiran 43.
Menurut Hartoyo dan Yulia (2007), aktivitas antioksidan pada fraksi protein mungkin disebabkan kandungan protein atau asam amino yang bersifat antioksidan. Beberapa contoh protein atau asam amino yang telah dikenal mempunyai aktivitas antioksidan diantaranya sistein, metionin, triptofan, lisin, SOD, katalase dan GSH. Hartoyo dan Yulia (2007) juga menyebutkan pada fraksi protein terdapat komponen fitokimia yang yang mempunyai potensi sebagai antioksidan diantaranya steroid, triterpenoid, dan fenol hidrokuinon.
Fraksi nonprotein memiliki aktivitas antioksidan yang ditandai dengan lebih tingginya jumlah fitokimia dalam fraksi nonprotein dibandingkan pada fraksi protein. Menurut Hartoyo dan Yulia (2007), komponen fitokimia yang terkandung di dalam fraksi nonprotein adalah steroid, saponin, fenol hidrokuinon, dan triterpenoid. Peningkatan kapasitas antioksidan pada fraksi nonprotein kecambah kacang komak didukung dengan adanya peningkatan kemampuan mereduksi dan total fenol dalam fraksi nonprotein kecambah kacang komak.
Pada kecambah kacang komak, fraksi nonprotein cenderung memiliki aktivitas antioksidan yang lebih tinggi dibandingkan fraksi proteinnya. Hal ini diduga karena terjadi sintesis tokoferol (vitamin E) dalam proses germinasi. Tokoferol merupakan golongan monofenol yang memiliki aktivitas antioksidan. Tokoferol cenderung lebih larut dalam senyawa nonpolar seperti lemak. Adanya sintesis tokoferol dalam kecambah terlihat dari kadar total fenol pada fraksi nonprotein kecambah yang tinggi. Hal ini disebabkan dalam fraksi nonprotein terkandung lemak, karbohidrat yang tidak larut, serta beberapa komponen lain yang tidak larut dengan perlakuan basa.
b. Uji aktivitas kemampuan mereduksi
Kemampuan mereduksi yang tinggi ditandai dengan semakin tinggi absorbansinya pada 700 nm. Telah dilaporkan juga bahwa
a 0.291 b 0.210 a 0.279 c 0.250 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 Protein Nonprotein Kemampua n mere duksi Jenis fraksi Kontrol Kecambah
kemampuan mereduksi dapat menjadi mekanisme pertahanan antioksidan, hal ini mungkin melalui kemampuan komponen antioksidan dalam mereduksi logam transisi. Logam tereduksi (seperti Fe (II) atau Cu (I) secara cepat bereaksi dengan hidroperoksida lemak, membentuk lipid reaktif yang radikal, dan perubahan logam tereduksi menjadi bentuk teroksidasi (Oboh, 2006). Aktivitas kemampuan mereduksi dari fraksi protein dan nonprotein kecambah kacang komak dan kontrol ditunjukkan pada Lampiran 21 dan Gambar 28.
Gambar 28. Kemampuan mereduksi pada fraksi protein dan non protein kecambah kacang komak dan kontrol.
Nilai yang diikuti oleh huruf yang berbeda pada grafik menunjukkan perbedaan yang nyata (paired sample t-test pada α = 5%)
Berdasarkan pengujian aktivitas kemampuan mereduksi, diketahui bahwa kemampuan mereduksi pada fraksi protein kecambah kacang komak dan kontrol berturut-turut adalah 0.279 dan 0.291 pada dosis 100 µg ekstrak. Kedua sampel fraksi protein tersebut tidak berbeda nyata (p>0.05) pada selang kepercayaan 95%. Sedangkan pada fraksi nonproteinnya berturut-turut adalah 0.250 dan 0.210 pada dosis 100 µg ekstrak.. Kedua sampel fraksi nonprotein tersebut berbeda nyata (p<0.05) pada selang kepercayaan 95%. Kemampuan mereduksi tertinggi terdapat pada fraksi protein tepung kontrol (0.291). Hasil pengujian statistik aktivitas kemampuan mereduksi dapat dilihat pada Lampiran 44.
a 29.17 b 29.83 a 49.58 b 116.00 0 20 40 60 80 100 120 140 Protein Nonprotein Total fenol (ppm) Jenis fraksi Kontrol Kecambah
Aktivitas kemampuan mereduksi pada fraksi protein kedua sampel lebih tinggi dibandingkan fraksi nonproteinnya. Hal ini memperlihatkan aktivitas pendonoran elektron yang lebih tinggi pada fraksi protein dibandingkan fraksi nonproteinnnya. Kemampuan mereduksi yang lebih tinggi pada fraksi protein diduga disebabkan adanya aktivitas antioksidatif dari asam-asam amino tertentu seperti metionin, sistein, dan histidin.
c. Total fenol
Pengujian aktivitas total fenol merupakan dasar dilakukan pengujian aktivitas antioksidan, karena diketahui bahwa senyawa fenolik berperan dalam mencegah terjadinya peristiwa oksidasi. Pengukuran total antioksidan bahan pangan asal tanaman dapat dilakukan dengan mengukur kadar total fenolik menggunakan reagen Folin-ciocalteau. Hal ini karena sebagian besar antioksidan dalam bahan asal tanaman merupakan senyawa polifenol. Total fenol dari fraksi protein dan nonprotein kecambah kacang komak dan kontrol ditunjukkan pada Lampiran 22 dan Gambar 29.
Gambar 29. Total fenol (ppm) pada fraksi protein dan non protein kecambah kacang komak dan kontrol.
Nilai yang diikuti oleh huruf yang berbeda pada grafik menunjukkan perbedaan yang nyata (paired sample t-test pada α = 5%)
Berdasarkan pengukuran total fenol, diketahui bahwa total fenol pada fraksi protein kecambah kacang komak dan kontrol berturut-turut adalah 49.58 ppm dan 29.17 ppm. Kedua sampel fraksi protein tersebut tidak berbeda nyata (p>0.05) pada selang kepercayaan 95%. Sedangkan pada fraksi nonproteinnya berturut-turut adalah 116 ppm dan 29.83 ppm. Kedua sampel fraksi nonprotein tersebut tidak berbeda nyata (p>0.05) pada selang kepercayaan 95%. Total fenol tertinggi dimiliki oleh fraksi nonprotein kecambah kacang komak (116 ppm). Hasil pengujian statistik total fenol dapat dilihat pada Lampiran 45.
Fraksi nonprotein kecambah kacang komak memiliki total fenol yang tertinggi yaitu 116 ppm. Total fenol yang tinggi pada fraksi nonprotein kecambah disebabkan adanya kenaikan jumlah tokoferol yang disintesis selama germinasi. Tokoferol ini merupakan senyawa monofenol yang lebih larut dalam senyawa nonpolar seperti lemak. Kenaikan total fenol ini sejalan dengan kenaikan aktivitas antioksidan metode DPPH pada fraksi nonprotein kecambah.
Selain itu, proses germinasi ternyata dapat meningkatkan total fenol dimana pada kedua fraksi kecambah kacang komak ditemukan kenaikan total fenol. Hal ini diduga karena menurut Rubenstein et al. (1987), pada saat germinasi 12 jam pertama, aktivitas biji lebih ke arah pertumbuhan, sedangkan pada germinasi 12 jam sampai 48 jam, aktivitas biji lebih ke arah produksi fenolik. Hal ini dapat terjadi karena biosintesis senyawa fenolik berada pada jalur yang sama dengan biosintesis hormon pengatur pertumbuhan yaitu auksin. Auksin merupakan hormon yang terlibat dalam mengontrol pertumbuhan batang, akar, absisi daun dan buah, aktivitas fisiologis lainnya bagi tanaman.