ASAM DIKARBOKSILAT
OlehSHINTA DITA UTAMI
NIM. 1406103040002Untuk memenuhi salah satu tugas dan persyaratan guna mengikuti Matakuliah Kimia Organik II
PROGRAM STUDI PENDIDIKAN KIMIA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS SYIAH KUALA
2016
Halaman
DAFTAR ISI ...2
BAB I PENDAHULUAN ...3
BAB II PEMBAHASAN ...5
1. Struktur Asam Dikarboksilat...5
2. Tatanama dan Isomer Asam Dikarboksilat ...7
3. Sifat-sifat Asam Dikarboksilat...11
4. Pembuatan Asam Dikarboksilat...17
5. Kegunaan Asam Dikarboksilat ...19
BAB III RANGKUMAN...21
DAFTAR PUSTAKA...24
LAMPIRAN ...25
BAB I PENDAHULUAN 1.1 Latar Belakang
Senyawa-senyawa organik tidak hanya memiliki satu gugus fungsi saja. Akan tetapi, banyak senyawa organik yang mengandung beberapa macam gugus
fungsi dalam satu molekul. Senyawa organik yang memiliki dua gugus fungsi atau dikenal dengan dwifungsi. Senyawaan organik tersebut misalnya asam dikarboksilat yang memiliki dua gugus fungsi yang sama dan juga terdapat senyawa organik yang mempunyai dua gugus fungsi yang berbeda seperti asam hidroksi atau keto*. Dalam makalah ini hanya membahas tentang asam dikarboksilat.
Asam dikarboksilat merupakan senyawa yang mempunyai dua gugus karboksil dalam struktur kimianya. Di alam banyak kita temukan asam dikarboksilat sederhana. Asam-asam dikarboksilat sederhana tersebut memiliki nama dari sumber asalnya. Contohnya, asam oksalat yang merupakan asam dikarboksilat paling sederhana dengan strukturnya terdiri dari dua gugus karboksil. Dimana asam oksalat tersebut banyak terdapat pada tanaman dari keluarga oxalis.
Dalam makalah ini membahas materi asam dikarboksilat yang mencakup dari struktur asam dikarboksilat , sifat-sifatnya baik itu sifat kimia maupun sifat fisik dari asam dikarboksilat itu sendiri dan isomer yang dimiliki dari asam dikarboksilat. Selain itu, tatanama asam dikarboksilat dari tatanama IUPAC-nya maupun nama lazim atau trivial. Pembuatan asam dikarboksilat serta kegunaannya dalam kehidupan sehari-hari akan dibahas dalam makalah ini juga.
1.2 Tujuan Pembelajaran
1. Mampu mengetahui dan memahami berbagai struktur dari asam dikarboksilat.
2. Mampu menamai senyawa asam dikarboksilat sesuai aturan IUPAC dan mengetahui tatanama trivial dari asam dikarboksilat serta isomer dari asam dikarboksilat.
3. Mengetahui dan memahami sifat-sifat dari asam dikarboksilat baik sifat fisik maupun kimia.
4. Mengetahui cara pembuatan asam dikarboksilat beserta kegunaannya dalam kehidupan.
BAB II PEMBAHASAN 2.1 Struktur Asam Dikarboksilat
Asam dikarboksilat atau asam alkanadioat memiliki dua gugus karboksil di dalam struktur kimianya. Asam dikarboksilat ini mempunyai rumus umum
yaitu CnH2n(COOH)2. Berdasarkan jenis ikatannya, asam dikarboksilat terbagi menjadi dua yaitu asam dikarboksilat jenuh dan tak jenuh. Asam dikarboksilat jenuh yaitu asam-asam dikarboksilat yang memiliki deretan sejenis dari rumus umum CnH2n(COOH)2 seperti asam oksalat dan lainnya. Sedangkan asam
dikarboksilat tak jenuh yakni asam maleat dan asam fumarat. Berikut ini macam-macam struktur dari asam dikarboksilat : a. Struktur Umum :
Asam dikarboksilat mempunyai struktur umum yaitu :
(CH2)n- (COOH)2 atau HOOC-R-COOH
Contohnya :
1. Asam oksalat : HO C C OH O O
, asam oksalat merupakan asam dikarboksilat yang paling sederhana.
2. Asam propanadioat : HO C O H2 C C OH O . b. Struktur Garis :
1. asam etanadioat (asam oksalat)
2. asam butanadioat (asam suksinat)
3. asam pentanadioat (asam glutarat)
4. HO OH
O CH2
CH3 O
5. HO O O OH H H
asam cis-2-pentenadioat c. Struktur termampatkan
1. HO2C(CH2)5CO2H : asam heptanadioat (asam pimelat)
2. HO2C(CHOH)2CO2H : asam 2,3-dihidroksipentanadioat
3. HO2CCH2=C(CH3)CH2CO2H : asam 3-metil-2-pentenadioat
4. HO2CCHBr(CH2)3CHBrCO2H : asam 2,6-dibromoheptanadioat
5. HO2CCH(OH)CH(OH)CO2H : asam tartarat
d. Struktur poligon
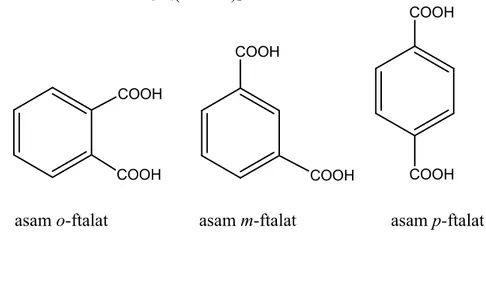
1. : asam o-ftalat (asam ftalat)
2.
CO2H
CO2H
: asam m-ftalat (asam isoftalat)
3. : asam p- ftalat (asam tereftalat)
4. : asam difenat (asam 2,2′-bifenildikarboksilat)
2.2 Tatanama dan Isomer Asam Dikarboksilat a. Tatanama IUPAC Asam Dikarboksilat
Penamaan asam dikarboksilat menurut aturan IUPAC sama halnya dengan penamaan asam karboksilat. Akan tetapi, akhiran dari asam dikarboksilat dengan asam karboksilat berbeda. Dimana, asam dikarboksilat dibubuhi awalan asam dan
ditambah akhiran –dioat (tambahan –di menunjukkan adanya dua gugus karboksil). Huruf –a dari alkana tetap ada di depan huruf mati.
Penamaan asam dikarboksilat bercabang, rantai terpanjang asam dikarboksilat yang mengandung dua gugus karboksil digunakan sebagai dasar nama atau rantai utama. Pemberian nomor dimulai dari atom karbon karboksil ujung yang satu ke atom karbon karboksil ujung yang lain. Atom karbon karboksil yang paling dekat dengan rantai cabang atau subtituen dan ikatan rangkap atau ikatan rangkap tiga harus mendapat nomor terendah.
Contoh : 1. C HO O H2 C HC CH2 C O OH CH3
Nama IUPAC : asam 3-metil pentanadioat
2. HO C CH O C H C H2 C C OH O C5H11 OH
Nama IUPAC : asam 2-hidroksi-4-pentil-3-heksenadioat
3.
CO2H
HO2C
Nama IUPAC : asam 2-isopropiltereftalat
b. Tatanama Trivial Asam Dikarboksilat
Nama trivial dari senyawa-senyawa asam dikarboksilat lebih sering digunakan daripada nama IUPAC. Nama-nama trivial atau nama umum dari asam
3 2 1 5 4 6 5 4 3 2 1
dikarboksilat ini biasanya berasal dari kata Latin atau Yunani yang menyatakan sumber asal diperoleh asamnya. Contohnya, asam malonat yang ditemukan pada apel (Yunani, malon), asam suksinat yang mula-mula diperoleh dari tengguli atau kuning sawo ( Latin, succinum), asam adipat dan pimelat yang terdapat pada lemak ( Latin, adeps) dan (Yunani,pimele) serta asam-asam dikarboksilat lainnya.
Penamaan trivial untuk asam dikarboksilat bercabang menggunakan huruf Yunani (α, β, γ dan seterusnya). Dimana huruf Yunani tersebut menunjukkan atau menandai posisi subtituen dalam hubungannya dengan gugus karboksil. Penamaan tersebut dimulai dengan atom karbon α.
Contohnya : HO C O H C C H H2 C C O OH Cl Cl
nama trivial : asam α, β-dikloropentanadioat
HO C O H C HC2 HC HC2 C OH O OH OH
nama trivial : asam α, γ-dihidroksiheksanadioat
Tabel 1.1 beberapa contoh asam dikarboksilat alifatik
Rumus Molekul Nama IUPAC Nama Trivial
HOOC-COOH asam etanadioat asam oksalat
HOOC-CH2-COOH asam propanadioat asam malonat
HOOC-(CH2)2-COOH asam butanadioat asam suksinat
HOOC-(CH2)3-COOH asam pentanadioat asam glutarat
HOOC-(CH2)4-COOH asam heksanadioat asam adipat
HOOC-(CH2)5-COOH asam heptanadioat asam pimelat
HOOC-(CH2)6-COOH asam oktanadioat asam suberat
HOOC-(CH2)7-COOH asam nonadioat asam azelat
δ HOCOHCCHH2CCOOH Cl Cl γ HOCOHCCHH2CCOOH Cl Cl β HOCOHCCHH2CCOOH Cl Cl α HOCOHCCHH2CCOOH Cl Cl γ HOC OHCCHH2CC O OH Cl Cl β HOC OHCCHH2CCO OH Cl Cl α HOC OHCCHH2CCO OH Cl Cl
HOOC-(CH2)8-COOH asam dekanadioat asam sebakat
( Sumber : Sumardjo, 2008 : 91)
c. Isomer Asam Dikarboksilat
Isomer yang terjadi pada asam dikarboksilat ialah isomer geometri (cis-trans) dan isomer posisi. Isomer geometri yang biasa terjadi pada asam dikarboksilat dan banyak ditemukan dalam berbagai literatur yaitu asam maleat dan asam fumarat yang merupakan isomer dari asam 2- butenadioat.
a. Isomer geometri (cis-trans) Contohnya :
1. Pada asam 2-butenadioat C C H COOH HOOC H C C COOH H HOOC H
Asam maleat Asam fumarat
(asam trans-2-butenadioat) (asam cis-2-butenadioat) 2. Pada asam 2-pentenadioat ( asam glutakonat)
(asam cis-2-pentenadioat) (asam trans-2-pentenadioat) 3. Pada asam 2-metil-2-butenadioat
Asam sitrakonat Asam mesakonat
(asam cis-2-metil-2-butenadioat) (asam trans-2-metil-2-butenadioat)
b. Isomer posisi
Asam ftalat atau asam benzena dikarboksilat memiliki tiga bentuk isomer posisi yaitu asam o-ftalat atau dikenal dengan nama umumnya asam ftalat, asam
m-ftalat yang dikenal sebagai asam isoftalat dan asam p-ftalat yang dikenal dengan asam tereftalat. Ketiga isomer tersebut memiliki posisi atau letak karboksilnya yang berbeda-beda. Struktur ketiga asam benzena dikarboksilat tersebut sebagai berikut :
Rumus molekul : C6H4(COOH)2
COOH COOH COOH COOH COOH COOH
asam o-ftalat asam m-ftalat asam p-ftalat
2.3 Sifat-sifat Asam Dikarboksilat a. Sifat fisik
Sifat fisis dari asam karboksilat umumnya berwujud padatan yang berupa kristal ataupun bubuk. Kebanyakan senyawa asam dikarboksilat, seperti asam oksalat berupa padatan tak berwarna. Kecuali, etil malonat yang berwujud cairan tak berwarna dengan bau buah yang sedap.
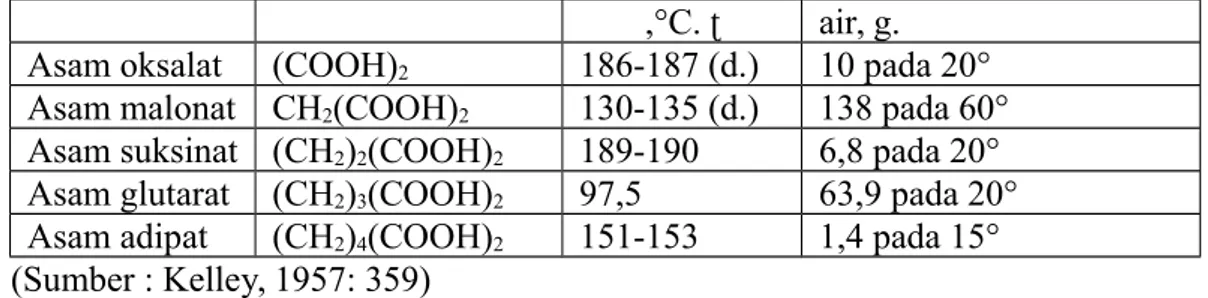
Asam dikarboksilat yang mengandung atom karbon yang berjumlah genap memiliki titik leleh yang sangat tinggi dan kelarutan dalam air rendah dibandingkan dengan atom karbon yang ganjil. Hal tersebut dapat dilihat pada tabel dibawah ini.
Tabel 1.2 Sifat Fisis asam dikarboksilat
,°C. ʈ air, g. Asam oksalat (COOH)2 186-187 (d.) 10 pada 20°
Asam malonat CH2(COOH)2 130-135 (d.) 138 pada 60°
Asam suksinat (CH2)2(COOH)2 189-190 6,8 pada 20°
Asam glutarat (CH2)3(COOH)2 97,5 63,9 pada 20°
Asam adipat (CH2)4(COOH)2 151-153 1,4 pada 15°
(Sumber : Kelley, 1957: 359)
Keterangan : (d.) = dengan dekomposisiʈ b. Sifat kimia
Asam-asam dikarboksilat mempunyai gugus fungsional yang berbeda dengan asam-asam karboksilat. Dimana asam-asam dikarboksilat tersebut sering menunjukkan sifat kimia yang unik. Pada umumnya, sifat kimia dari asam-asam dikarboksilat dengan asam-asam karboksilat sama, namun ada beberapa yang berbeda.
Keasaman pada asam dikarboksilat lebih besar dibandingkan asam-asam karboksilat. Hal tersebut dikarenakan asam-asam-asam-asam dikarboksilat memiliki dua gugus karboksil dimana keasamannya akan bertambah menjadi sangat asam. Asam-asam dikarboksilat mempunyai dua tetapan keasaman ionisasi :
HOOC(CH2)nCOOH -OOC(CH
2)nCOOH -OOC(CH2)nCOO
-K1 K2
Tetapan keasaman ionisasi pertama (K1) lebih besar daripada tetapan keasaman
ionisasi kedua (K2), dan harga pK1 lebih kecil dibandingkan dengan harga pK2.
Tabel 1.3 Tetapan keasaman beberapa asam dikarboksilat
Nama senyawa Tetapan keasaman
K1 K2
Asam oksalat 5,4 x 10-2 5,4 x 10-5
Asam malonat 1,4 x 10-3 0,2 x 10-5
Asam suksinat 6,2 x 10-5 0,2 x 10-5
Asam adipat 3,7 x 10-5 0,4 x 10-5
Dapat dilihat dari tabel diatas, K1 dari asam-asam dikarboksilat lebih besar
dibandingkan dengan Ka dari asam asetat (1,8 x 10-5). Hal tersebut disebabkan
oleh adanya gugus karboksil yang bersifat sebagai gugus penarik elektron sehingga membantu pemantapan muatan negatif yang terdapat pada ion monokarboksilat.
Makin dekat jarak antara dua gugus fungsi maka akan semakin kuat pengaruh keasamannya. Jadi, asam oksalat mempunyai K1 yang paling besar. Oleh
sebab itu, asam oksalat merupakan asam yang cukup kuat dibandingkan asam-asam dikarboksilat lainnya. Sebaliknya, nilai K2 lebih kecil dibandingkan Ka dari
asam asetat dikarenakan tolakan di antara muatan negatif yang terbentuk menggoyahkan dianion dari dikarboksilat.
Asam-asam dikarboksilat dapat mengalami dekarboksilasi bila dipanaskan. Contohnya, asam oksalat jika dipanaskan akan mengurai menjadi CO2 dan asam format. Selanjutnya akan mengurai menjadi CO dan H2O. Dengan
reaksinya : COOH
HOOC CO2 HCOOH CO H2O
asam oksalat asam format
200 °C
+ 200 °C +
Asam malonat mengalami dekarboksilasi bila dipanaskan akan melepaskan CO2 dengan lebih mudah. Reaksi ini diperkirakan berlangsung
melalui keadaan transisi siklik, dimana menghasilkan enol asam asetat yang kemudian bertautometri. Reaksinya sebagai berikut :
O C C H2 C O H O OH kalor C O O + O C OH H2C H C O H3C OH
asam malonat enol dari asam asetat asam asetat
Reaksi sederhananya :
HOOC HC2 COOH 135 °C CO2 + CH3COOH
asam asetat asam malonat
Asam-asam dikarboksilat dapat diubah menjadi esternya. Misalnya, anhidrida ftalat dapat diubah menjadi berbagai macam dialkil ftalat :
O O O C C OR OR O O 2 ROH kalor H2O
anhidrida ftalat dialkil ftalat
+ +
Ester dari asam-asam dikarboksilat dapat bereaksi dengan alkohol berdwifungsi membentuk poliester. Poliester yang paling terkenal adalah serat sintetik Dacron. Dacron dibuat dari dimetil tereftalat dengan etilena glikol (1,2-etanadiol).
C C
O O
O
H3C O CH3
+
2 HOCH2CH2OHH+
HOH2CH2COC COCH2CH2OH
O O
+
2 CH3OH C COCH2CH2O O O x Dacrondimetil tereftalat etilena glikol
Ester dari asam dikarboksilat juga dapat mengalami reduksi dengan hidrogenasi katalitik atau yang disebut hidrogenolisis ester. Contohnya ester dari asam adipat yaitu dietil adipat dengan suhu dan tekanan tertentu serta dengan penambahan katalis tembaga kromat menghasilkan sepasang alkohol.
Reaksinya sebagai berikut :
H3CH2COC O (CH2)4 COCH2CH3 O CuCr 2O4 katalis 255°, 200 atm H2 HOCH2(CH2)4CH2OH
+
2 COCH2CH3 dietil adipat 1,6- heksanadiol (90%) etanolAsam-asam dikarboksilat dengan dua atau tiga atom karbon di antara dua gugus karboksil jika dipanaskan akan melepaskan air, dimana membentuk anhidrida siklik dengan cincin yang beranggota lima atau enam.
H2C H2C C C O O OH OH 235°C O O O
+
H2Oasam suksinat anhidrida suksinat
kalor
Penambahan anhidrida asetat untuk kondisi yang lebih lembut menghasilkan anhidrida siklik dan asam asetat. Salah satu contoh reaksinya seperti di bawah ini :
H2C CH2COOH CH2COOH
+
H3CC O O CCH3 O C H2 C O C H2 C H2C O O+
2 CH3COOH asam glutarat anhidrida asetatanhidrida glutarat asam asetat
Reaksi antara asam dikarboksilat dengan ditambahkan basa akan menghasilkan garam sama halnya pada asam karboksilat. Salah satu contoh reaksi asam dikarboksilat dengan penambahan natrium hidroksida yang akan menghasilkan garam dari asam dikarboksilat seperti di bawah ini :
HO2CCH2CH2CHCO2H
NH2
+
NaOH HO2CCH2CH2CHCO2-NH2
Na+
+
H2O2.4 Pembuatan Asam Dikarboksilat
Pembuatan dari asam dikarboksilat hampir sama dengan pembuatan asam karboksilat. Asam-asam dikarboksilat dapat dibuat dengan beberapa metode, yaitu:
1. Oksidasi alkena
Sikloheksena dapat dioksidasi dengan menggunakan katalis MnO4 dengan
pemanasan akan menghasilkan asam adipat. Reaksi ini memerlukan zat pengoksidasi yang kuat seperti pada alkohol. Reaksinya :
MnO4
kalor HO2CCH2CH2CH2CH2CO2H asam heksanadioat
sikloheksena (asam adipat)
2. Oksidasi rantai samping aromatik
Asam-asam dikarboksilat aromatik dapat dibuat dengan mengoksidasi rantai samping alkil pada cincin aromatik. Reaksi ini menunjukkan sangat stabilnya cincin aromatik. Dimana, gugus metil yang bersifat seperti-alkana yang teroksidasi bukan cincin aromatiknya.
Asam tereftalat dihasilkan dengan oksidasi ini dengan menggunakan katalis kobalt dan udara untuk oksidasinya. Reaksi pembuatan asam tereftalat dari asam p-xilena :
CH3
H3C O2, Co(III) HOOC COOH
CH3CO2H
p-xilena asam tereftalat
Selain asam tereftalat , asam ftalat dapat juga dibuat dari naftalena atau o -xilena melalui oksidasi yang serupa, dengan menggunakan katalis V2O5 atau
kobalt dan oksigen. Berikut reaksi sintesis asam ftalat melalui oksidasi dari naftalena : O2, V2O5 400° COOH COOH asam ftalat naftalena
3. Hidrolisis Sianida (Nitril)
Hidrolisis sianida atau nitril ini memerlukan suasana asam atau basa dalam reaksinya. Pembuatan asam dikarboksilat dari metode ini dapat diperoleh dari alkena ataupun glikol.
a. Dari alkena, H2C CH2 Cl2 H2C CH2 Cl Cl
NaCN dalam alkohol
kalor H2C CH2
CN CN
H2O, H+
kalor H2C CH2
COOH COOH
etilen etilen diklorida suksinonitril asam suksinat
b. Dari glikol CH2(CH2OH)2 CH2(CH2Cl)2 CH2(CH2CN)2 CH2(COOH)2 HCl KCN dalam alkohol kalor H2O, H+ kalor 1,3-propanadiol 1,3-Dibromopropana
Glutaronitril asam glutarat
Sintesis Grignard dapat digunakan dalam pembuatan asam dikarboksilat dari dibromoalkana yang mana posisi atom bromin terletak di kedua ujung atom karbon. Contoh reaksi pembuatan asam pimelat dari 1,5-dibromopentana :
BrMg(CH
2)
5MgBr
(1) CO
2(2) H
2O, H
+COOH(CH
2)
5COOH
5. Ester malonat
Ester ini dapat digunakan untuk sintesis asam dikarboksilat dengan rumus umumnya RCH(COOH)2 atau R2C(COOH)2.
HOOC(CH2)5COOH 2 Na+[CH(COOC2H5)2] CH2[CH2CH(COOH)2]2 CH2BrCH2CH2Br CH2[CH2CH(COONa)2]2 CH2[CH2CH(COONa)2]2
1,3- dibromopropana etil sodiomalonat
alkohol
larutan NaOH
kalor
larutan HCl
- 2CO2 asam pimelat
+
kalor
2.5 Kegunaan Asam Dikarboksilat
Kegunaan dari senyawa asam-asam dikarboksilat antara lain :
1. Asam oksalat digunakan sebagai penghilang karat, sebagai pereaksi pada pembuatan zat warna, sebagai bahan pemurni dalam industri farmasi dan keperluan lainnya.
2. Asam suksinat digunakan dalam industri makanan dan minuman, terutama sebagai pemanis.
3. Asam Glutarat digunakan dalam produksi poliester poliol, poliamida, peliat ester dan inhibitor korosi, dalam sintesis obat-obatan, surfaktan dan senyawa logam finishing.
4. Asam adipat digunakan sebagai monomer untuk produksi nilon melalui reaksi polikondensasi dengan heksametilena diamina,
membentuk 6,6-nilon, sebagai reaktan untuk membentuk komponen pemlastis dan pelumas ,dalam bumbu masakan sebagai penyedap rasa. 5. Asam suberat digunakan sebagai plasticizer, pelumas, cairan hidrolik,
kosmetik, lilin. Selain itu asam suberat juga digunakan dalam sintesis poliamida dan resin alkid serta digunakan sebagai perantara untuk aromatik, antiseptik dan bahan lukisan.
6. Asam tereftalat digunakan sebagai bahan dasar yang diperlukan untuk pembuatan serat sintentik Dacron.
7. Asam ftalat sering digunakan dalam industri, terutama sebagai bahan baku untuk sintesis zat-zat organik lain, seperti plastik,beberapa zat warna , resin, dan beberapa insektida.
8. Asam dodekanadioat digunakan dalam produksi nilon (nylon-6,12), poliamida, pelapis, perekat, gemuk, poliester, zat warna, deterjen, dalam antiseptik, dan wewangian. Asam ini sekarang diproduksi oleh fermentasi alkana rantai panjang dengan strain tertentu dari Candida tropicalis.
BAB III RANGKUMAN
Asam dikarboksilat (asam alkanadioat) mempunyai dua gugus fungsional yang sama yaitu gugus karboksil. Rumus umum dari asam dikarboksilat ini yaitu
CnH2n(COOH)2. Asam dikarboksilat jenuh yaitu asam-asam dikarboksilat yang
memiliki deretan sejenis dari rumus umum CnH2n(COOH)2 seperti asam oksalat
dan lainnya. Sedangkan asam dikarboksilat tak jenuh yakni asam maleat dan asam fumarat. Asam dikarboksilat mempunyai tiga macam struktur yakni struktur garis, struktur poligon dan struktur termampatkan.
Penamaan asam dikarboksilat menurut aturan IUPAC awalannya dibubuhi asam dan ditambah akhiran –dioat (tambahan –di menunjukkan adanya dua gugus karboksil). Untuk asam dikarboksilat bercabang, rantai terpanjang yang mengandung dua gugus karboksil digunakan sebagai rantai utama. Penomoran dimulai dari atom karbon karboksil ujung yang satu ke atom karbon karboksil ujung yang lain. Atom karbon karboksil yang paling dekat dengan cabang /subtituen /ikatan rangkap ataupun rangkap tiga harus mendapatkan nomor terendah.
Nama-nama trivial atau nama umum dari asam dikarboksilat biasanya berasal dari kata Latin atau Yunani yang menyatakan sumber asal diperoleh asamnya. Untuk asam dikarboksilat bercabang menggunakan huruf Yunani (α, β, γ dan seterusnya). Isomer yang terjadi pada asam dikarboksilat ialah isomer geometri (cis-trans) dan isomer posisi. Asam maleat dan asam fumarat merupakan isomer cis-trans dari asam 2- butenadioat. Asam ftalat atau asam benzena dikarboksilat memiliki tiga bentuk isomer posisi yaitu asam o-ftalat, asam m -ftalat, dan asam p-ftalat.
Pada umumnya asam dikarboksilat berwujud padatan tak berwarna berupa bubuk ataupun kristal. Kecuali etil malonat berwujud cairan tak berwana dengan bau buah yang sedap. Asam dikarboksilat yang mengandung atom karbon yang berjumlah genap memiliki titik leleh yang sangat tinggi dan kelarutan dalam air rendah dibandingkan dengan atom karbon yang ganjil. Pada umumnya, sifat kimia dari asam-asam dikarboksilat dengan asam-asam karboksilat sama, namun ada beberapa yang berbeda.
Keasaman pada asam dikarboksilat lebih besar dibandingkan asam-asam karboksilat. Semakin dekat jarak antara dua gugus fungsi maka akan semakin kuat pengaruh keasamannya. Asam-asam dikarboksilat dapat mengalami dekarboksilasi bila dipanaskan. Asam-asam dikarboksilat dapat diubah menjadi esternya. Ester dari asam-asam dikarboksilat dapat bereaksi dengan alkohol berdwifungsi membentuk poliester dan juga dapat mengalami reduksi dengan hidrogenasi katalitik atau yang disebut hidrogenolisis ester. Pada pemanasan, asam dikarboksilat dapat membentuk anhidrida asam dan dengan penambahan anhidrida asetat.
Asam dikarboksilat jika direaksikan dengan suatu basa akan menghasilkan garam sama halnya dengan asam karboksilat. Asam karboksilat dapat dibuat dengan oksidasi alkena, oksidasi rantai samping aromatik, hidrolisis sianida (nitril), reagensia Grignard dan dari ester malonat. Asam-asam dikarboksilat mempunyai banyak kegunaan dalam kehidupan sehari-hari. Umumnya, beberapa senyawa asam dikarboksilat memiliki peranan dalam industri seperti, plastik,beberapa zat warna, dalam produksi poliester poliol, dan lainnya.
DAFTAR PUSTAKA
Fessenden,Ralp J, dan Joan S. Fessenden. 1991. Kimia Organik Edisi Ketiga
Jilid 2. (Terjemahan A.H. Pudjatmaka). Jakarta: Erlangga
Hart,Harlod. 1983. Kimia Organik: Suatu Kuliah Singkat Edisi Keenam. (Terjemahan Suminar Achmadi). Jakarta: Erlangga.
Hart,Harlod, Leslie E. Craine, dan David J. Hart. 2003. Kimia Organik: Suatu
Kuliah Singkat Edisi Kesebelas. (Terjemahan Suminar Achmadi).
Jakarta: Erlangga.
Kelley,Louise. 1957. Organic Chemistry Second Edition. New York : McGraw-Hill Book Company.