ABSTRAK
Promoter adalah sekuen DNA spesifik yang berperan dalam mengendalikan transkripsi gen yang terletak di sebelah hulu dari bagian struktural suatu gen. Isolasi promoter sangat diperlukan dalam upaya analisis sekuen dan faktor transkripsi yang akan berperan sebagai regulator gen. Penelitian ini dilakukan untuk mengetahui karakteristik promoter gen antivirus ProAV yang diisolasi dari udang windu Penaeus monodon. Isolasi promoter dilakukan dengan menggunakan teknik PCR dan karakterisasi sekuen dilakukan dengan program BLAST-N dan Genetyx Versi 7. Hasil penelitian menunjukkan bahwa promoter antivirus ProAV telah berhasil diisolasi dari udang windu dengan panjang fragmen 368 bp. Analisis BLAST-N memperlihatkan bahwa promoter tersebut memiliki similaritas yang tinggi (95-98%) dengan sekuen promoter pada Bank Gen. Keberadaan motif faktor transkripsi yang berperan penting dalam regulasi promoter, misalnya: kotak TATA, MRE, TCF-1, SP-1, GAL-4, dan GATA-1 telah diidentifikasi pada sekuen promoter tersebut, yang diduga memiliki peran penting dalam mengendalikan gen target. Keberadaan faktor transkripsi tersebut berimplikasi bahwa promoter tersebut berpotensi dalam mengatur gen antivirus.
Kata kunci: isolasi, karakterisasi, promoter, faktor transkripsi, udang windu.
---
*) Bab ini telah dipublikasi dengan judul: Cloning of ProAV Promoter Isolated from Tiger Prawn Penaeus monodon, pada jurnal Indonesian Aquaculture Journal 2009; 4 (1): 1-7.
ISOLATION AND CHARACTERIZATION OF
ANTIVIRAL GENE PROMOTER FROM TIGER SHRIMP
Penaeus monodon
ABSTRACT
Promoter is a specific DNA sequence involved in the transcription regulator of gene, where the promoter is usually located in the upstream of structural gene. Isolation of promoter is essentially needed in order to establish the sequence analysis and transcription factor that are functioned in the gene regulator. The research was conducted to analyze the characteristics of antiviral gene promoter isolated from tiger prawn Penaeus monodon. ProAV promoter was isolated by PCR method and its sequence was characterized by using the BLAST-N and Genetyx Version 7. The results showed the success in isolating a promoter from tiger prawn at fragment position of 368 bp in length. BLAST-N showed that the promoter had high similarity (95-98%) compared with the other promoters in the GeneBank. The existence of the important transcription factors in promoter regulation, such as TATA box, MRE, TCF-1, SP-1, GAL-4, and GATA-1 were identified from the promoter sequence. The existence of the transcription factors implied that the promoter would be useful in the gene transcription regulator.
Keywords: isolation, characterization, promoter, transcription factor, tiger shrimp.
PENDAHULUAN
Promoter merupakan sekuen DNA spesifik yang berperan dalam pengendalian transkripsi gen yang terletak di daerah hulu struktural gen. Oleh karena itu, promoter berperan aktif dalam pengaturan tingkat ekspresi suatu gen target (Hoare & Beaumont 2003). Kesesuain promoter merupakan elemen paling penting dalam kesuksesan penerapan sistem transformasi gen, karena promoter mengatur kapan, dimana, dan kondisi apa, serta target gen yang diaktifkan. Promoter yang sesuai dengan kepentingan akuakultur dan dapat diterima oleh konsumen sebaiknya diisolasi dari sumber yang tidak berpotensi dalam resiko kesehatan.
Proses transkripsi suatu gen sangat dipengaruhi oleh karakteristik sekuen promoter yang mengaturnya. Proses transkripsi suatu gen umumnya diawali oleh penempelan faktor transkripsi (transcription factor, TF) dan kompleks enzim RNA polimerase yang berada pada daerah promoter. Oleh karena itu, promoter berperan penting dalam penerapan teknologi transgenesis, sehingga pemilihan promoter yang sesuai akan sangat menentukan tingkat ekspresi transgen dari karakter gen target yang diintroduksi .
Pada awal perkembangan teknologi transgenesis pada ikan, konstruksi gen dengan komponen promoter dan gen target yang digunakan berasal dari hewan mamalia dan hewan tingkat rendah. Penggunaan konstruksi gen tersebut tidak memberikan pengaruh nyata pada pertumbuhan ikan, dimana penggunaan promoter yang bukan berasal dari ikan menghasilkan ekspresi transgen yang rendah atau bahkan tidak terekspresi. Alam et al. (1996), Hanley et al. (1998), dan Alimuddin et al. (2003) telah membuktikan bahwa promoter yang diisolasi dari ikan memiliki aktivitas yang lebih tinggi dalam pengaturan ekspresi transgen dibandingkan dengan promoter yang diisolasi dari mamalia atau virus. Peningkatan pertumbuhan yang signifikan diperoleh setelah promoter dan gen GH yang digunakan berasal dari ikan (all-fish gen construct), misalnya pada ikan salmon transgenik menggunakan promoter methallothionein dan gen GH dari ikan salmon (Yaskowiak et al. 2006) dan ikan transgenik mud loach menggunakan promoter β-aktin dan GH dari ikan mud loach (Nam et al. 2001). Ikan nila hitam transgenik yang menggunakan promoter β-aktin dari ikan medaka Jepang, Oryzias latipes dengan GH ikan nila hitam juga memiliki kecepatan tumbuh yang tinggi yakni 7 kali lebih besar dibandingkan dengan ikan bukan transgenik pada umur 1 tahun (Kobayashi et al. 2007). Pada umumnya, promoter memiliki elemen penting misalnya kotak CCAAT yang berfungsi dalam peningkatan ekspresi dengan stimulasi tertentu, unit CC(A/T)6GG yang lebih dikenal dengan istilah motif CarG
yang berperan dalam pengaturan ekspresi sementara, dan kotak TATA yang berperan dalam mengarahkan proses transkripsi berlangsung pada posisi yang benar (Takagi et al. 1994).
Penerapan transgenenis pada krustase khususnya pada udang masih sangat sedikit, sehingga informasi penggunaan promoter juga sangat terbatas.
Transgenesis pada udang telah dilaporkan pada udang vaname L. vannamei dengan mengintroduksikan gen pengkode TSV-CP (taura syndrome virus-coat protein) dengan menggunakan promoter β-aktin udang (pβactP2) (Sun et al. 2005; Lu & Sun 2005), dan pada udang windu P. monodon dengan menggunakan promoter CMV (cytomegalovirus) (Arenal et al. 2008). Luo et al. (2007) telah mengisolasi tujuh promoter dari udang windu, tetapi hanya dua diantaranya memperlihatkan aktivitasnya secara in vitro menggunakan gen reporter GFP (green fluorescent protein). Selain itu, Ho & Song (2009) telah berhasil mengisolasi promoter gen antimikroba penaeidin dari udang windu dan secara in vitro dengan menggunakan gen berpendar Renilla luciferase, telah dilaporkan bahwa promoter tersebut memperlihatkan aktivitas yang tinggi pada embrio udang windu. Oleh karena itu, pada penelitian ini dilakukan isolasi dan karakterisasi promoter antivirus ProAV dari udang windu dalam rangka pembuatan konstruksi gen all shrimp yang akan digunakan dalam produksi udang windu tahan penyakit. Penelitian itu bertujuan untuk mengetahui tingkat similaritas sekuen nukleotida promoter antivirus dengan promoter lainnya yang ada dalam Bank Gen sebagai uji konfirmasi kebenaran promoter yang telah diisolasi. Selain itu, penelitian ini ditujukan untuk mengetahui keberadaan motif-motif faktor transkripsi dan sekuen spesifik promoter yang dilibatkan dalam mengatur gen target.
BAHAN DAN METODE
Sampel Udang Windu Penaeus monodonUdang windu P. monodon berukuran 10,1-74,4 g dikoleksi dari beberapa tambak udang di Sulawesi Selatan, termasuk dari tambak yang telah terserang penyakit virus bintik putih (white spot syndrome virus, WSSV). Sampel udang dikoleksi secara hidup dan selanjutnya dibawa ke Laboratorium Bioteknologi, Balai Riset Perikanan Budidaya Air Payau (BRPBAP) Maros untuk pengambilan otot (daging) udang secara aseptik sebagai bahan untuk ekstraksi DNA genom.
Ekstraksi DNA Genom
DNA genom udang windu diekstraksi dengan menggunakan metode fenol-kloroform yang telah dikembangkan pada ikan kerapu (Parenrengi et al. 2000) dengan sedikit modifikasi. Sebanyak 20-25 mg daging udang diambil secara aseptik dan dimasukkan ke dalam tabung steril 1,5 mL. Sampel ditambahkan dengan 250 µL buffer lisis (0,5 M NaCl; 0,001 M EDTA; 1% SDS; 0,8% Triton-X; dan 0,1 Tris-HCl pada pH 9,0) kemudian 40 µL 10% SDS dan 40 µL Proteinase K (larutan 20 mg/mL). Sampel diinkubasi pada suhu 55oC selama 1-3 jam sampai lisis sempurna. Kemudian sampel ditambahkan 25 µL RNase (larutan 20 mg/mL) dan dibiarkan pada suhu ruangan selama 15-30 menit. Sampel ditambahkan 500 µL fenol:kloroform:isoamil-alkohol (25:24:1) dan selanjutnya dihomogenkan dengan vorteks. Sampel dibiarkan pada suhu ruangan selama 10 menit sebelum disentrifugasi pada kecepatan 13.000 rpm selama 4 menit. Supernatan yang terbentuk dipindahkan ke tabung mikro baru, kemudian ditambahkan lagi 500 µL fenol:kloroform:isoamil-alkohol (25:24:1) dan disentrifugasi kembali pada kecepatan 13.000 rpm selama 4 menit. Supernatan ditambahkan dengan satu kali volume kloroform:isoamil-alkohol (24:1) dan selanjutnya disentrifugasi dengan kecepatan 13.000 rpm selama 2 menit. Supernatan dipresipitasi dengan etanol absolut dingin dengan membolak-balikkan tabung mikro kemudian disentrifugasi pada kecepatan 6.000 rpm selama 30 menit. Pelet yang terbetuk dicuci dengan 1 mL etanol 70% dan kemudian disentrifugasi pada kecepatan 6.000 rpm selama 15 menit. Pelet DNA dikering-udarakan sekitar 20 menit, kemudian ditambahkan dengan 50 µL sterile distilled water (SDW) agar pelet DNA dapat larut sempurna dan selanjutnya disimpan dalam freezer (suhu -20oC) sampai digunakan untuk peroses selanjutnya.
Kualitas dan kuantitas DNA genom hasil isolasi dapat diketahui melalui analisis kemurnian dan kandungan DNA dengan menggunakan UV-spektrofotometer. Kemurnian genom hasil ekstraksi selain dianalisis secara kualitatif dengan metode elektroforesis juga diukur secara kuantitatif melalui metode UV-spektrofotometer pada rasio absorpsi 260 nm dan 280 nm (OD260/OD280). Sedangkan konsentrasi genom DNA dihitung berdasarkan rumus
analisis eletroforesis pada gel agarosa 0.7%. Skema ekstrkasi DNA genom udang windu menggunakan metode fenol-kloroform disajikan pada Lampiran 1.
Isolasi Promoter
Isolasi promoter antivirus ProAV dilakukan dengan menggunakan teknik PCR. DNA genom yang telah diisolasi dari udang windu digunakan sebagai cetakan DNA (templat) pada proses PCR. Metode isolasi promotor mengacu pada metode yang telah dikembangkan oleh Luo et al. (2007), dengan menggunakan primer forward ProAV-F: 5’- gtc gga tcc agt ccc aca ctc cat caa -3’ dan primer reverse ProAV-R: 5’- ctg gga tcc ctg aaa gga ata tta ata tct tg -3’. Kedua primer tersebut dilengkapi dengan situs restriksi BamHI (nukleotida yang digarisbawahi) untuk membantu proses kloning ke dalam vektor ekspresi. Amplifikasi fragmen promoter dilakukan pada mesin PCR GeneAmp PCR System 2700 (Applied Biosystem). Reaksi PCR yang digunakan adalah kit PureTaq Ready-To-Go PCR Beads (GE Healtcare) dan primer masing-masing 1 uL (50 ρmol/µL) serta SDW untuk mencapai volume akhir 25 µL. Kit tersebut mengandung 2,5 unit Taq Polimerase; 10 mM Tris-HCl pH 9; 50 mM KCl; 1,5 mM MgCl2; dan 200 μM
setiap dNTP-mix.
Proses PCR dijalankan pada suhu pre-denaturasi 94oC selama 3 menit; 35 siklus untuk (denaturasi 94oC selama 1 menit, annealing 56oC selama 45 detik, ekstensi 72oC selama 1 menit); dan final ekstensi 72oC selama 5 menit. Untuk
mengetahui keberhasilan isolasi promoter, hasil PCR dielektroforesis pada gel agarose 1,0% untuk melihat pita tunggal yang terbentuk pada gel. Fragmen DNA pada gel agarosa didokumentasi dengan Gel Documentation System (Biometra). Untuk menentukan berat molekul fragmen DNA digunakan marker VC 100bp Plus DNA Ladder (Vivantis).
Kloning Promoter
Purifikasi Promoter. Purifikasi fragmen DNA promoter dilakukan dengan menggunakan kit GF-1 Gel DNA Recovery (Vivantis) sesuai dengan manual kit yang digunakan. Fragmen DNA yang telah dipotong dari gel dicampur
dengan buffer GB dengan rasio 1:1, kemudian diinkubasi pada suhu 50oC sampai gel larut sempurna. Larutan ditransfer ke kolom spin dalam tabung mikro, kemudian disentrifugasi pada kecepatan 10.000 rpm selama 1 menit. Kolom selanjutnya dicuci dengan 750 µL wash buffer, kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit atau sampai kering. Kolom dipindahkan ke tabung mikro baru, kemudian ditambahkan 30-50 µL elution buffer dan diinkubasi selama 2 menit di suhu ruang, kemudian disentrifugasi pada kecepatan 10.000 rpm selama 1 menit. Skema purifikasi fragmen DNA dari gel agarosa menggunakan kit GF-1 Gel DNA Recovery dapat dilihat pada Lampiran 2.
Ligasi Promoter ke Vektor pGEM-T Easy. Fragmen DNA hasil
purifikasi dari promoter yang telah berhasil diisolasi, disisipkan ke dalam vektor kloning pGEM-T Easy (Promega) mengikuti prosedur manufaktur. Vektor pGEM-T Easy dan control insert DNA disentrifugasi agar kandungannya terkumpul pada dasar tabung, selanjutnya reaksi ligasi dicampur pada tabung mikro dengan komposisi: 1,3 µL 2 x rapid ligase buffer; 0,5 µL vektor pGEM-T Easy (50 ng); 1 µL T4 DNA ligase (3 unit/µL); produk PCR sebanyak 5 µL; dan SDW 5,2 µL. Inkubasi dilakukan selama dua jam pada suhu ruang dan dilanjutkan dengan diinkubasi semalam di dalam refrigerator (suhu berkisar 4 oC).
Pembuatan Bakteri Kompeten Escherichia coli DH5α. Sebuah koloni
bakteri E.coli DH5α diambil dari biakan murni dan dikultur dalam 25 mL media cair Luria Bertani (LB) (1% tripton; 0,5% ekstrak khamir; dan 1% NaCl) dalam tabung 50 mL sebagai sub kultur dan selanjutnya diinkubasi pada inkubator bergoyang pada suhu 37oC selama 16-18 jam dengan kecepatan 250 rpm. Hasil
sub kultur sebanyak 2,5 mL (1%) dimasukkan ke dalam erlenmeyer 25 mL yang mengandung media cair LB dan selanjutnya diinkubasi pada inkubator bergoyang pada suhu 37oC selama 3 jam. Kultur bakteri langsung diletakkan di atas es selama 30 menit. Sebanyak 1,5 mL dimasukkan ke dalam tabung mikro 1,5 mL kemudian disentrifugasi dengan kecepatan 5.000 rpm selama 2 menit pada suhu 4oC. Setelah supernatan dibuang, pelet ditambahkan lagi 1,5 mL cairan kultur bakteri dan selanjutnya disentrifugasi dengan kecepatan 5.000 rpm selama 2 menit. Supernatan dibuang dan pelet dicuci dengan buffer NaCl2 dingin. Larutan
Supernatan dibuang dan pelet dicuci dengan 1 mL CaCL2 dingin, selanjutnya
diinkubasi pada suhu ruangan selama 20 menit. Larutan disentrifugasi dengan kecepatan 5.000 rpm selama 2 menit pada suhu 4oC dan supernatan yang terbentuk dibuang, dan pelet disuspensi dengan 200 µL CaCl2 dingin yang
kemudian diinkubasi di es selama 20 menit sampai 1 jam. Bakteri yang tersuspensi siap untuk digunakan untuk transformasi.
Transformasi. Transformasi vektor kloning ke bakteri dilakukan dengan menggunakan bakteri kompeten E. coli DH5α yang telah dibuat sebelumnya. Sebanyak 4-5 µL hasil reaksi ligasi dicampur ke dalam tabung mikro yang telah berisi 200 µL bakteri kompeten dan selanjutnya diinkubasi dalam es selama 20-30 menit. Campuran tersebut diberi kejutan panas pada suhu 42oC selama 45 detik, kemudian diletakkan dalam es selama 2 menit. Hasil kejutan panas ditambahkan 800 uL larutan SOC yang mengandung 970 µL buffer SOB (2 g tripton; 0,5 g ekstrak kamir; 1 mL NaCL 1 M; 0,25 mL KCl 1 M; dalam 97 mL SDW); 10 µL MgSO4.7H2O; 10 µL MgCl2.6H2O; dan 10 µL glukosa 1M, yang selanjutnya
diinkubasi pada suhu 37oC pada inkubator bergoyang dengan kecepatan 200 rpm selama 1,5 jam. Sekitar 100-150 µL bakteri tersebut disebar pada media selektif 2xYT (1,6% tripton; 1% ekstrak khamir; 0,5% NaCl; dan 1,8% bakto agar dalam SDW) yang mengandung ampisilin 1 µL/1 mL agar (100 mg/mL); IPTG (isopropanoltio-β-D-galaktopiranosida) 0,1M (10 µL/cawan); dan 2% X-gal (50 µL/cawan). Biakan bakteri diinkubasi pada suhu 37oC selama sekitar 14 jam. Untuk menyeleksi adanya insersi gen dalam plasmid pada situs pengklonan (multiple cloning site, MCS), bakteri yang mengandung plasmid akan membentuk koloni berwarna putih, sedangkan bakteri yang mengandung plasmid tetapi di dalam MSC-nya tidak tersisipi fragmen DNA akan menghasilkan koloni warna biru (lihat Lampiran 3). Bakteri yang tidak mengandung plasmid akan mati (tidak membentuk koloni). Koloni bakteri warna putih yang tumbuh diperbanyak dalam medium LB yang mengandung antibiotik ampisilin (100 µg/mL) dan diinkubasikan pada suhu 37oC untuk dipersiapkan dalam perbanyakan plasmid.
Identifikasi Transforman
Cracking Bakteri. Seleksi koloni bakteri yang membawa plasmid hasil
ligasi dilakukan dengan metode cracking. Koloni bakteri warna putih diambil menggunakan tusuk gigi steril dan dioleskan ke dasar tabung mikro 1,5 mL dan dilanjutkan dengan menggoreskannya ke dalam master plate, yang merupakan sumber koloni bakteri untuk tahap penelitian berikutnya. Master plate berisi bakteri diinkubasi pada suhu 37oC selama 8 jam. Ke dalam tabung mikro yang
berisi bakteri ditambahkan 10 μL buffer cracking (0,2 g sakarosa; 40 µL NaOH 5 M; 50 µL SDS 10%; dan sisanya SDW sehingga volume larutan menjadi 1 mL), 10 μL larutan EDTA 10 mM. Gabungan campuran larutan antara 2 µL 6 X buffer loading DNA dengan KCl 4 M dengan perbandingan volume 1:1 diletakkan di bagian dalam penutup tabung mikro. Setelah diinkubasi sekitar 5 menit, larutan di-spin down pada kecepatan 5.000 rpm selama 3 detik dan kemudian divorteks. Larutan disentrifugasi pada kecepatan 12.000 rpm selama 5 menit pada suhu 4oC. Sebanyak 10 µL supernatan yang terbentuk digunakan untuk elektroforesis menggunakan gel agaroasa 0,7%. Untuk mengetahui koloni bakteri yang membawa DNA dalam plasmid, bakteri biru digunakan sebagai kontrol. Ukuran DNA plasmid koloni bakteri yang membawa insersi akan lebih besar dibandingkan dengan kontrol.
Teknik PCR. Klon-klon bakteri yang memperlihatkan indikator positif pada uji cracking dilanjutkan dengan uji konfirmasi fragmen DNA yang terinsersi melalui teknik PCR, dengan menggunakan primer ProAV-F dan ProAV-R dimana templat DNA yang digunakan adalah larutan hasil cracking sebanyak 0,5 μL. Amplifikasi fragmen DNA target gen dilakukan seperti yang dijelaskan dalam isolasi promoter sebelumnya. Klon-klon bakteri rekombinan yang positif membawa promoter antivirus digoreskan ke dalam media agar yang mengandung ampisilin (100 µg/mL) untuk dikoleksi sebagai sumber plasmid untuk kegiatan selanjutnya. Skema pelaksanaan kloning promoter antivirus ProAV pada vektor pGEM-T Easy disajikan pada Lampiran 4.
Penderetan Nukleotida Promoter
Isolasi Plasmid. Plasmid pGEM-T Easy yang mengandung promoter antivirus ProAV diisolasi dari bakteri E. coli dengan menggunakan kit GF-1 Plasmid DNA Extraction Kit (Vivantis) dengan prosedur yang sesuai dengan manual kit yang digunakan. Satu koloni bakteri yang mengandung plasmid rekombinan ditumbuhkan di dalam 10 mL media LB (10 g/L tripton, 5 g/L ekstrak khamir, 10 g/L NaCl, pH 7,5) yang mengandung ampisilin 100 mg/L pada inkubator bergoyang dengan kecepatan 250 rpm pada suhu 37oC selama semalam (sekitar 16-18 jam). Bakteri diendapkan dalam tabung mikro secara bertahap dengan sentrifugasi pada kecepatan 10.000 rpm pada suhu 4oC selama 10 menit. Supernatan dibuang dan pelet dilarutkan dengan 250 μL larutan S-1, kemudian divorteks pelan atau pipeting sampai pelet larut sempurna. Suspensi larutan ditambah dengan 250 μL larutan S-2 kemudian dicampur dengan pelan dengan cara tabung mikro dibolak-balik selama 4-6 kali dan diinkubasi di suhu ruangan tidak lebih dari 5 menit. Larutan dinetralkan dengan penambahan 250 μL buffer NB (neutralizing buffer) dan dicampur dengan pelan dengan cara tabung mikro dibolak-balik selama 6-10 kali kemudian disentrifugasi dengan kecepatan 14.000 rpm selama 10 menit. Supernatan dipindah ke kolom spin dan disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit. Kolom spin dicuci dengan 700 μL wash buffer kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit. Plasmid DNA diresuspensi dengan 100 μL SDW dan dibiarkan selama 1 menit, kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit untuk melarutkan DNA, dan selanjutnya disimpan dalam freezer -20oC untuk digunakan pada tahap selanjutnya. Kuantitas dan kualitas isolat plasmid diukur dengan menggunakan UV-VIS spektrofotometer pada panjang gelombang 260 nm dan 280 nm seperti yang dijelaskan pada tahapan ekstraksi DNA genom sebelumnya. Skema isolasi DNA plasmid dengan menggunakan kit GF-1 Plasmid DNA Extraction disajikan pada Lampiran 5.
Penderetan Sekuen Nukleotida. Hasil PCR promoter gen antivirus ProAV dari plasmid dipurifikasi dengan menggunakan kit Gel/PCR DNA Fragment Extraction (Geneaid). Secara singkat, potongan gel agarosa ditambah dengan 500 µL buffer DF kemudian divorteks, dan selanjutnya diinkubasi pada
suhu 55oC selama 10-16 menit sampai agarosa larut sempurna. Sebanyak 700 µL larutan sampel dipindahkan ke kolom DF, kemudian disentrifugasi pada kecepatan 13.000 rpm selama 1 menit. Kolom DF ditambahkan dengan 600 µL wash buffer, kemudian disentrifugasi dengan kecepatan 13.000 rpm selama 1 menit. Setelah larutan dibuang, kolom DF ditempatkan ke dalam tabung mikro baru, dan disentrifugasi dengan kecepatan 13.000 rpm selama 3 menit. DNA dilarutkan dengan menambahkan 50 µL SDW kemudian disentrifugasi dengan kecepatan 13.000 rpm selama 3 menit. Amplifikasi PCR untuk sekuensing dilakukan dengan menggunakan campuran larutan (3 µL 5 X buffer sekuensing, 2 µL primer (1,6 ρmol/µL), 1 µL Big Dye, 4 µL templat DNA) dengan program PCR adalah suhu 96oC selama 2 menit, 96oC selama 10 menit, 55oC selama 5 menit, dan 60oC selama 4 menit. Hasil PCR dipurifikasi dengan menambahkan 10 µL air bebas DNA dan RNA, dan 5 µL EDTA 125 mM, 5 µL natrium asetat 3 M, 60 µL etanol absolut. Sampel diinversi sebanyak 4 kali dan diinkubasi pada suhu ruang selama 15 menit, kemudian disentrifugasi dengan kecepatan 3.000 rpm selama 30 menit. Supernatan dibuang dan pelet ditambah dengan 70 µL etanol 70%, kemudian disentrifugasi dengan kecepatan 3.000 rpm selama 30 menit. Setelah supernatan dibuang, pelet dikering-anginkan dan kemudian dilarutkan dengan 10 µL air bebas DNA dan RNA. Sampel selanjutnya siap untuk disekuensing dengan menggunakan alat sekuenser automatis AB-3130 (Applied Biosystem). Hasil sekuensing dilihat secara manual dengan menggunakan program sequence navigator.
Analisis Data
Untuk mengetahui kemiripan (similaritas) promoter yang dihasilkan, sekuen promoter disejajarkan (alignment) dengan sekuen promoter yang telah ada di dalam Bank Gen dengan menggunakan program BLAST-N (basic local alignmen search tool-nucleotide). Sekuen promoter hasil penderetan dianalisis dengan menggunakan program Genetyx Versi 7 (Genetyx Coorporation) untuk mendapatkan similaritas sekuen, motif faktor transkripsi (regulator), dan keberadan sekuen spesifik promoter antivirus. Data hasil analisis disajikan secara deskriptif.
HASIL DAN PEMBAHASAN
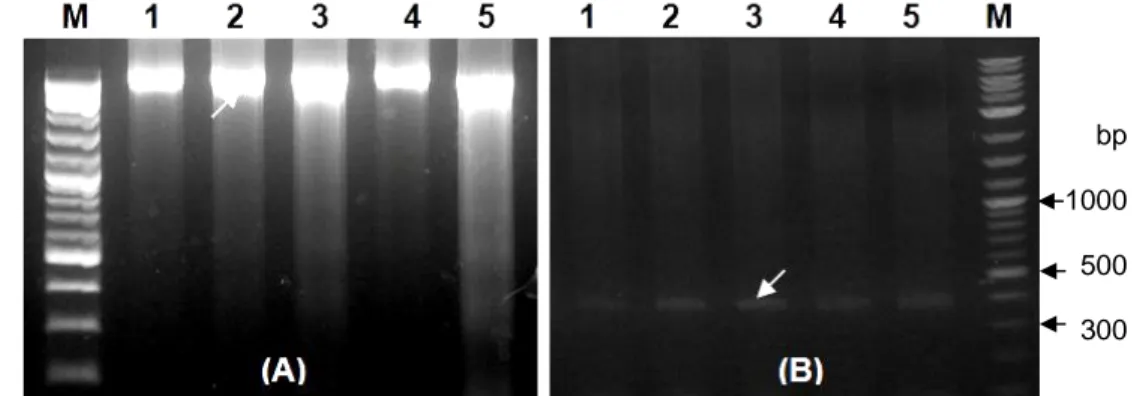
DNA genom yang berasal dari beberapa sampel udang windu telah berhasil diisolasi yang ditandai dengan keberadaan pita tunggal pada gel eletroforesis (Gambar 1A). Dengan menggunakan DNA genom tersebut sebagai templat dan primer spesifik promoter gen antivirus ProAV, promoter udang windu telah berhasil diisolasi pada posisi fragmen sekitar 0,4 kb (368 bp) (Gambar 1B).
Gambar 1 Hasil elektroforesis DNA genom (A) dan fragmen tunggal promoter ProAV (B) yang diisolasi dari udang windu P. monodon. M=marker DNA, 1-5= sampel udang windu, dan tanda panah mengindikasikan fragmen DNA genom dan promoter ProAV.
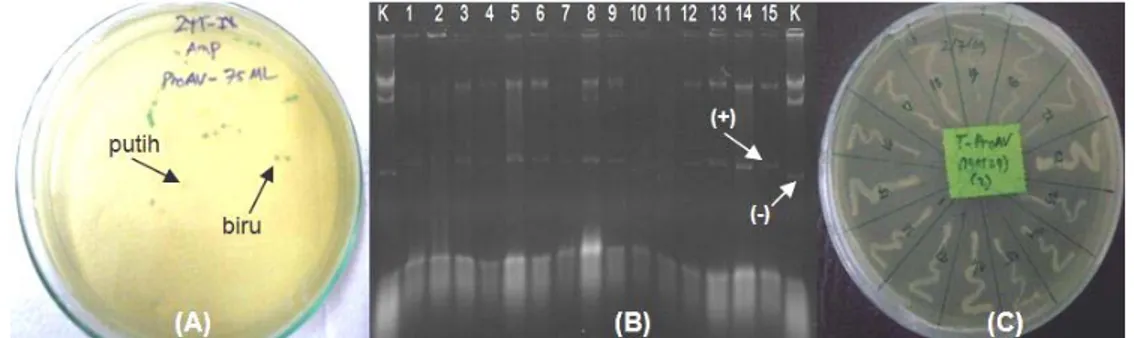
Promoter antivirus ProAV yang berhasil diisolasi dari DNA genom udang windu, selanjutnya dikloning ke dalam vektor pGEM-T Easy. Keberhasilan dalam mengkloning gen dapat diketahui dengan cara mengidentifikasi masuknya gen atau DNA pada bakteri inang (transforman). Hasil seleksi koloni bakteri warna putih-biru menunjukkan adanya insersi gen yang diindikasikan dengan adanya koloni bakteri warna putih yang ditumbuhkan pada media agar dan adanya penambahan berat molekul plasmid DNA bakteri inang yang digunakan pada teknik cracking (Gambar 2). Proses masuknya vektor rekombinan pembawa gen ke dalam sel kompeten (bakteri) diketahui dengan mengamati ekspresi gen penanda yang dibawa oleh vektor tersebut. Kobolak & Muller (2003) memberikan gambaran penggunaan vektor pGEM-T Easy pada bakteri E. coli yang memiliki marker gen LacZ dan marker gen resisten ampisilin, dimana LacZ sebagai gen bp
1000
500
pelapor (reporter gene). Selanjutnya Toha (2001) menyatakan bahwa apabila dalam media terdapat IPTG, gen LacZ yang mengkode enzim β-galaktosidase dapat diketahui karena mampu menguraikan 5-bromo-4-kloro-3-indolil-β-D-galaktopiranosida (X-gal) menjadi galaktosa dan 5-bromo-4-kloroindigo, sehingga menghasilkan koloni bakteri berwarna biru. Oleh karena itu, apabila terjadi insersi gen atau fragmen DNA pada MCS, maka gen LacZ tidak dapat berfungsi sebagai mana mestinya sehingga tidak terjadi penguraian X-gal menjadi galaktosa yang menyebabkan koloni bakteri tetap berwarna putih.
Gambar 2 Seleksi koloni putih-biru, cracking, dan plating klon bakteri pembawa promoter antivirus ProAV. A=seleksi koloni klon bakteri yang ditumbuhkan pada media agar dimana tanda panah menunjukkan koloni putih dan biru, dan B=hasil cracking klon bakteri pembawa promoter pada gel agarosa dimana tanda panah menunjukkan indikator positif sebagai pembawa promoter dan negatif sebagai kontrol bakteri koloni biru, dan C=hasil plating klon bakteri pembawa promoter ProAV pada media agar.
Untuk memastikan apakah fragmen DNA tersebut merupakan target promoter ProAV yang diinginkan, maka fragmen DNA dipurifikasi dari gel agarosa kemudian dilakukan pembacaan nukleotidanya atau dikenal dengan istilah sekuensing. Dari beberapa sampel yang berhasil diisolasi, dua di antaranya diambil secara acak untuk dilakukan analisis lebih lanjut melalui sekuensing nukleotida promoter. Berdasarkan hasil pembacaan sekuen nukleotida yang diperkirakan memiliki panjang fragmen DNA sekitar 0,4 kb (368 bp). Dari hasil pembacaan tersebut dilakukan penyejajaran (alignment) sekuen (Gambar 3) dengan referensi sekuen yang telah ada dalam Bank Gen, untuk memastikan kebenaran promoter yang telah diisolasi.
Gambar 3 Alignment sekuen promoter ProAV yang diisolasi dari udang windu P. monodon dengan sekuen promoter PmAV referensi dari Bank Gen (kode aksesi DQ641258-1). Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida, A=adenina, C=sitosina, G=guanina, dan T=timina.
Hasil penyejajaran sekuen promoter yang telah diisolasi tersebut menunjukkan tingkat kemiripan yang tinggi dengan sekuen promoter yang telah ditemukan oleh Luo et al. (2007) pada udang windu di Cina. Dari dua sample sekuen promoter yang dianalisis, didapatkan tingkat similaritas 95-98% (Tabel 1). Tingginya tingkat similaritas tersebut memberikan keyakinan akan keberhasilan dalam mengisolasi promoter antivirus ProAV dari udang windu dari tambak Sulawesi Selatan, Indonesia.
Hasil analisis BLAST-N terhadap nukleotida promoter ProAV udang windu menunjukkan adanya variasi nuklotida dengan sekuen gen promoter udang windu P. monodon referensi Bank Gen yang umumnya didapatkan pada bagian awal dan akhir sekuen nukleotida. Analisis faktor transkripsi menunjukkan keberadaan sekuen spesifik promoter, misalnya TATAAA atau dikenal sebagai kotak TATA (TATA-box) dan TGCACCC atau dikenal sebagai MRE, atau dikenal sebagai TFIID, serta sekuen [A/C]A[A/C]AG atau dikenal dengan TCF-1
P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon(Q641258-1)
yang merupakan motif utama yang umumnya didapatkan pada promoter. Selain sekuen CCCGCC yang dikenal sebagai SP-1, dan [TU]CC[TU]C yang dikenal sebagai faktor transkripsi GAL-4, juga didapatkan sekuen AGATAG yang lebih dikenal dengan motif transkripsi GATA-1, serta beberapa motif transkripsi lainnya. Distribusi lokasi beberapa motif faktor transkripsi promoter ProAV yang diisolasi dari DNA genom udang windu disajikan pada Gambar 4.
Tabel 1 Similaritas sekuen promoter ProAV yang diisolasi dari udang windu P. monodon dengan sekuen total gen antivirus PmAV pada Bank Gen (kode aksesi DQ641258-1).
Deskripsi Pemenuhan query
(%) Similaritas (%) Promoter ProAV P. monodon (sampel-1) 98 95 Promoter ProAV P. monodon (sampel-2 ) 97 98
TFIID merupakan faktor transkripsi pertama yang secara langsung berkaitan dengan kotak TATA, sehingga penempelan faktor transkripsi ini akan mengarahkan faktor transkripsi lainnya dan RNA polimerase untuk mengenali daerah promoter. Stansfield et al. (2006) menyebutkan bahwa TFIID memiliki fungsi serupa dengan faktor sigma pada bakteri, dimana setelah terikat dengan kotak TATA, TFIID membantu pengaturan TF-TF lain yang dibutuhkan untuk inisiasi sintesis RNA. Percobaan secara in vitro telah dibuktikan bahwa jika TFIID dihilangkan, maka tidak akan terbentuk kompleks pra-inisiasi, meskipun faktor transkripsi lain ditambahkan. Yuwono (2005) menyatakan bahwa faktor transkripsi TFIID sebenarnya merupakan kompleks protein yang terdiri atas beberapa macam yakni protein pengikat kotak TATA (TATA-box binding protein, TBP) dan 8-10 TAF (TBP-associated factor) atau faktor transkripsi yang terkait dengan TBF. Pada promoter eukariot yang tidak memiliki kotak TATA, TFIID berikatan dengan SP-1 yang umumnya melekat pada kotak GC. Faktor transkripsi SP-1 merupakan domain pengikat DNA yang mengandung zinc sehingga dikenal sebagai jari-jari zinc (zinc finger). Faktor transkripsi lain
misalnya yang ditemukan pada promoter ProAV ini adalah GAL-4 yang merupakan faktor transkripsi yang modulnya mengandung dua atom zinc dan enam asam amino sisteina, sehingga GAL-4 dikenal sebagai motif regulator yang berperan dalam regulasi gen GAL yang bertanggung jawab dalam metabolisme glukosa pada khamir Saccharomyces cereviae.
Gambar 4 Distribusi motif faktor transkripsi pada sekuen promoter antivirus ProAV yang diisolasi dari udang windu P. monodon. Garis vertikal menunjukkan posisi motif faktor transkripsi dalam sekuen.
Beberapa motif faktor transkripsi yang diidentifikasi dalam sekuen promoter antivirus ProAV memiliki kesamaan dengan faktor transkripsi yang didapatkan pada promoter penaeidin (ProPEN) yang diisolasi dari udang windu P. monodon. Ho & Song (2009) telah berhasil mengisolasi dan mengkarakterisasi dua tipe promoter ProPEN pada udang windu yakni tipe-536 dan tipe-411, dimana dari dua tipe tersebut didapatkan motif faktor transkripsi antara lain kotak TATA, GATA, dorsal, dan AP-1 yang diduga dilibatkan dalam pengaturan transkripsi gen resistensi pada krustase pada umumnya. Dua di antaranya (kotak TATA dan GATA) didapatkan juga pada promoter antivirus ProAV pada penelitian ini.
Analisis kekerabatan antar promoter udang windu menunjukkan bahwa, kedua sampel promoter antivirus ProAV yang diisolasi dari udang windu asal Sulawesi Selatan, Indonesia ini memiliki kekerabatan yang relatif dekat dengan promoter ProAV yang diisolasi dari udang windu di Cina, dan relatif terpisah dengan promoter gen penaeidin ProPEN. Ho & Song (2009) melaporkan bahwa ada dua tipe promoter gen penaeidin yang diisolasi dari udang windu dan memiliki kemiripan dengan promoter gen penaedin yang diisolasi dari udang vaname.
Hasil dari penelitian tahap pertama ini menunjukkan keberadaan faktor transkripsi utama dan beberapa elemen regulator penting, serta kemiripan sekuen dengan promoter yang ditemukan oleh Luo et al. (2007). Hasil tersebut menunjukkan bahwa promoter antivirus ProAV ini akan bermanfaat dalam teknologi transgenesis dalam pengaturan gen-gen eksogenous yang diintroduksi. Pada penelitian tahap selanjutnya akan difokuskan pada aktivitas promoter antivirus ProAV pada embrio dan larva udang windu dengan menggunakan gen berpendar sebagai gen pelapor.
KESIMPULAN
Promoter antivirus ProAV telah berhasil diisolasi dari udang windu P. monodon. Promoter tersebut memiliki tingkat similaritas yang tinggi dengan promoter udang windu yang tersedia di Bank Gen.