2. TINJAUAN PUSTAKA
2.1 Immunoglobulin Y (IgY)
Immunoglobulin Y atau IgY merupakan antibodi utama pada ayam dan memiliki struktur yang homolog dengan IgG pada mamalia. Perbedaan antara IgY dengan IgG terletak pada fungsi region konstan. IgY ayam tidak memiliki persamaan imunologis dengan IgG mamalia dan urutan DNA IgY ayam lebih menyerupai urutan DNA pada IgE manusia (Carlander 2002). IgY ditemukan oleh Klemperer tahun pada 1893, yang menggambarkan adanya kekebalan pasif terhadap toksin tetanus yang diturunkan dari induk ke anak ayam. Selain pada ayam, IgY juga dapat ditemukan pada serum dan kuning telur pada reptil dan amphibi (Larsson et al. 1993). IgY terdapat dalam kuning telur dan serum ayam dalam bentuk molekul immunoglobulin yang konsentrasinya sekitar 10-20 mg/ml (Patoja et al. 2000).
IgY ditransfer melalui dua cara, yaitu melalui epitel folikel dari ovarium selama masa oogenesis, serupa transfer IgG melalui plasenta pada mamalia (transplacenta), dan melalui kantung kuning telur selama masa embrio (Rose dan Orlans 1981; Gassman et al. 1990). Ig Y memiliki sifat biologik yang merupakan gabungan dari sifat biologik IgE dan IgG (Carlander 2002; Michael 2010).
Immunoglobulin Y merupakan protein yang stabil dan lebih tahan terhadap suhu serta perubahan pH dibandingkan IgG, tapi sangat sensitif terhadap denaturasi (Larsson et al. 1993; Silva dan Tambourgi 2010). Aktivitas IgY dapat dipertahankan cukup lama pada suhu 37 ºC. Aktivitas IgY masih baik sampai jangka waktu 6 bulan dan bahkan dapat dipertahankan selama 10 tahun pada penyimpanan suhu 4 ºC (Larsson et al. 1993). Aktivitas IgY tidak stabil pada suhu di atas 70 ºC dan pH di bawah 4. Inkubasi pada pH di atas 4 masih dapat ditoleransi namun pada pH 2 dengan suhu 37 ºC, aktivitas IgY menurun drastis. Penurunan aktivitas tersebut disebabkan oleh perubahan konformasi (Higgins 1995; Szabo et al. 1998; Michael et al. 2010).
Komponen penyusun IgY sebagian besar berupa molekul protein. Protein merupakan makromolekul amfoter yaitu setiap molekulnya memiliki muatan listrik positif dan negatif. Perbedaan ukuran dan muatan listrik pada setiap
kelompok protein menyebabkan protein dapat dipisahkan (Wilson dan Walker 2000). Ig Y lebih mudah dipisahkan dari protein lain dengan cara pemisahan fraksi yang terlarut pada air. Beberapa metode telah digunakan untuk isolasi dan purifikasi skala besar IgY dari kuning telur. Pada dasarnya tahap pemurnian atau purifikasi protein terdiri dari dua tahap yaitu tahap pertama yang bertujuan untuk mendapatkan larutan protein dan tahap kedua yang bertujuan untuk memisahkan protein berdasarkan ukuran molekul protein (Polson et al. 1980).
Immunoglobulin Y dapat dimurnikan dari serum atau plasma, namun sejauh ini kuning telur menjadi sumber utama untuk pemurnian IgY. Kuning telur dapat dikoleksi setiap hari dari induk ayam yang sama dengan lebih dari 100 mg IgY dari satu telur ayam (Silva dan Tambourgi 2010). Berbagai metode dapat digunakan untuk isolasi IgY dari kuning telur. Metode pemurnian immunoglobulin terbagi dalam dua tahapan yaitu diferensiasi kelarutan bahan dan kromatografi. Pemurnian diferensiasi kelarutan bahan meliputi garam, PEG, dan presipitasi asam kaprilat, sedangkan pemurnian secara kromatografi meliputi filtrasi gel, pertukaran ion, hidroksi apatit, dan afinitas. Bhanushali et al. (1994) telah mengenalkan sebuah metode yang sederhana dan tidak mahal untuk memurnikan IgY melalui pengenceran dengan aqua destilata dan ammonium sulfat 29%. Selain metode tersebut, IgY dapat pula dimurnikan dengan aliran cepat Q Sepharose kromatografi untuk menghilangkan protein nonimmunoglobulin (Silva dan Tambourgi 2010).
2.2 Immunoglobulin G (IgG)
Immunoglobulin G merupakan antibodi monomer yang umum pada mamalia dan diproduksi setelah IgM. IgG dibuat dan disekresikan oleh sel plasma di limpa, limfonodus, dan sumsum tulang. IgG ditemukan dalam jumlah paling besar di dalam darah yaitu sebesar 75% dari seluruh jumlah antibodi sehingga memiliki peranan penting dalam mekanisme perlawanan oleh antibodi (Tizard 2004; Guyton dan Hall 2007). IgG merupakan satu-satunya antibodi yang diturunkan transplasenta untuk menyediakan antibodi bagi perkembangan fetus hingga kekebalan fetus terbentuk sempurna (Harlow dan Lane 1988).
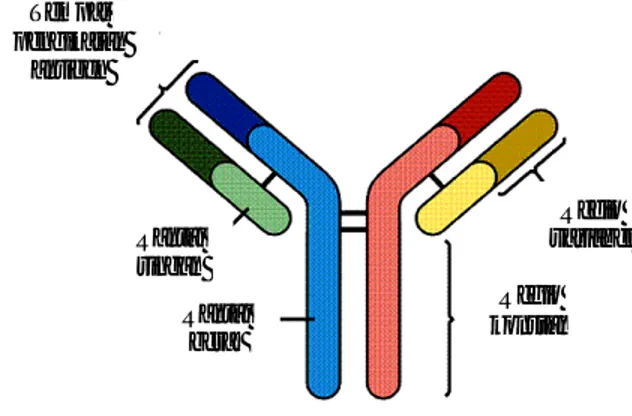
Berat molekul IgG sekitar 180 kDa dan memiliki dua rantai berat serta dua rantai ringan yang identik. Dengan mikroskop elektron, IgG terlihat berupa molekul berbentuk Y dengan “lengan” dari Y yang mampu mengikat antigen (Gambar 1). Kedua fragmen “lengan” dari molekul adalah identik dan masih memiliki kemampuan untuk mengikat antigen. Bagian hipervariabel pada rantai ringan dan rantai berat bersama-sama membentuk suatu tempat pengikatan antigen tunggal. Kekhususan interaksi antara antigen dan antibodi dijelaskan berdasarkan susunan asam amino pada bagian hipervariabel mengakibatkan terjadinya tempat pengikatan antigen yang berbentuk unik. Bentuk konformasi dari tempat pengikatan antigen dengan immunoglobulin itulah yang menentukan determinan antigen khusus yang akan bereaksi dengannya (Tizard 2004).
Gambar 1 Struktur IgG (Mader 1997).
IgG memiliki struktur yang kecil sehingga lebih mudah bersirkulasi di dalam darah. IgG berperan khusus dalam reaksi inflamasi jaringan dengan meningkatkan permeabilitas vascular. IgG merupakan antibodi yang paling efisien dalam mempresipitasi reaksi imun. Waktu paruh biologik IgG ialah selama 23 hari dan merupakan imunitas paling baik sebagai serum transfer (Tizard 2004).
Molekul IgG dibentuk dan diedarkan oleh sel plasma dalam 4 sub-tipe yaitu IgG1, IgG2, IgG3, IgG4. IgG dapat mengaktifkan makrofag untuk mencerna partikel antigen dengan menempelkannya pada antibodi. Keberadaan molekul antibodi yang terdapat di permukaan bakteri dapat menyebabkan aglutinasi dan opsonisasi. IgG juga dihubungkan dengan hipersensitivitas tipe II dan III. IgG
Tempat pengikatan antigen Rantai ringan Rantai berat Regio variabel Regio konstan
dapat mengaktifkan komponen jalur klasik ketika molekul yang dibutuhkan berakumulasi di permukaan antigen (Tizard 2004).
IgG adalah antibodi pertama yang terlibat dalam respon imunitas lanjutan. Keberadaan IgG tertentu pada umumnya diartikan sebagai puncak respon antibodi terhadap antigen. IgG dapat mengikat berbagai macam patogen seperti
virus, bakteri, dan fungi. Patogen dihancurkan dengan cara aglutinasi dan immunisasi. Selanjutnya sistem kekebalan komplemen diaktifkan melalui jalur klasik dengan menggunakan fragmen konstan untuk mengikat patogen. Patogen diopsonisasi dan ditelan oleh makrofag serta neutrofil dengan proses fagositosis dan netralisasi toksin. IgG juga memiliki peran penting dalam mengikat sel NK
(Natural Killer) pada ADCC (Antibody Dependent Cell-mediated Cytotoxicity) (Tizard 2004).
2.3 Fasciola gigantica
Fasciola sp atau biasa disebut cacing hati termasuk dalam Kingdom Animalia, Filum Platyhelminthes, Kelas Trematoda, Subkelas Digenea, Ordo Echinostomida, Family Fasciolidae, dan Genus Fasciola (Kusumamihardja 1992). Cacing ini merupakan salah satu cacing parasit yang banyak menyerang ternak ruminansia seperti domba, kambing, sapi, dan kerbau. Cacing ini juga dapat menjadi parasit pada hewan lain seperti babi, anjing, rusa, zebra, kelinci, marmot, kuda, bahkan manusia (Soulsby 1986). Penyakit yang disebabkan oleh cacing ini dikenal dengan nama fasciolosis, liver rot, ovine fascioliasis,’pokey jaw’, atau distomosis (Foreyt 2001; Mitchell 2007).
Cacing yang biasa ditemukan di Indonesia adalah spesies Fasciola gigantica, sedangkan spesies Fasciola hepatica umumnya ditemukan pada ternak yang diimpor ke Indonesia (Kusumamihardja 1992). Hal ini dikarenakan inang antara yang berperan dalam siklus hidup Fasciola hepatica yaitu Lymnaea truncatula tidak ditemukan di Indonesia, sedangkan inang antara Fasciola gigantica yaitu Lymnaea rubiginosa dapat ditemukan di Indonesia (Kusumamihardja 1992; Mitchell 2007).
Fasciola sp. berbentuk pipih dorsoventral, seperti daun tanpa rongga tubuh. Fasciola gigantica di Indonesia berukuran 14-54 mm, dengan sisi kiri dan
kanan yang hampir sejajar dan bahu yang kurang jelas. Alat penghisap ventral sejajar dengan bahu, besarnya hampir sama dengan alat penghisap mulut, dan kutikula dilengkapi dengan sisik. Usus buntunya bercabang-cabang sejajar dengan sumbu badan, sirus tumbuh sempurna dan kantong sirus mengandung kelenjar prostat serta kantong semen, ovarium bercabang terletak di sebelah kanan garis median, kelenjar vitelin mengisi bagian lateral tubuh (Kusumamihardja 1992).
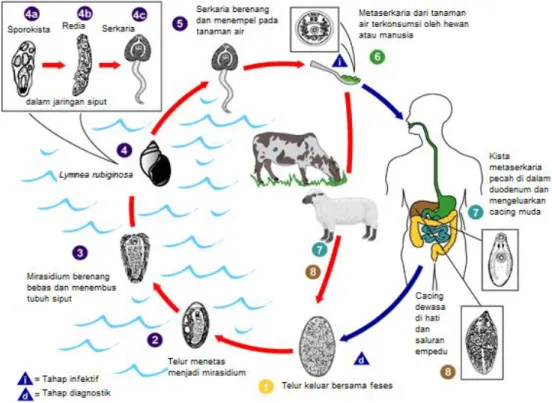
Siklus hidup Fasciola sp. bersifat tidak langsung dan memerlukan inang antara berupa siput air (Gambar 2). Perkembangan dari stadium telur sampai metaserkaria hanya dapat terjadi pada lingkungan yang tergenang air dan bertindak sebagai faktor pembatas siklus hidup cacing di luar tubuh ternak. Cacing dewasa hidup di dalam hati dan saluran empedu inang defenitif. Telur Fasciola gigantica masuk ke dalam duodenum bersama empedu dan keluar bersama tinja hospes definitif. Di luar tubuh ternak, telur berkembang menjadi mirasidium.
Mirasidium memiliki masa hidup hanya beberapa jam sehingga harus segera masuk ke tubuh inang antara yaitu Lymnaea rubiginosa dengan alat penggeraknya berupa silia. Mirasidium masuk ke dalam tubuh siput dengan cara menempel pada bagian ventral siput dan dengan bantuan enzim protease, sehingga epitel kulit siput dapat dihancurkan. Di dalam tubuh siput, mirasidium berkembang menjadi sporokista, redia, dan serkaria. Sporokista yang pecah akan menyebabkan redia terbebas dan secara aktif berpindah menuju hati dan pankreas siput. Sporokista memperbanyak diri dengan pembelahan transversal sehingga dari satu mirasidium terbentuk banyak sporokista. Gumpalan sel di dalam sporokista kemudian tumbuh menjadi redia setelah 10 hari siput terinfeksi mirasidium. Redia yang berbentuk silinder dengan otot kalung leher selanjutnya menghasilkan serkaria dari pembelahan sel pertumbuhannya. Serkaria akan keluar dari tubuh siput, berenang, dan menempel pada tumbuhan air. Serkaria akan berubah menjadi metaserkaria yang berbentuk kista pada tempat yang cocok. Ternak akan terinfeksi apabila minum air atau makan tanaman yang mengandung kista (Soulsby 1986; Mitchell 2007).
Gambar 2 Siklus hidup cacing hati (DPD CDC 2009).
Fasciolosis dapat menyebabkan kerugian ekonomi yang besar akibat kematian ternak, hati yang diafkir, predisposisi penyakit lain, dan biaya perawatan dokter hewan. Patogenesa dan gejala klinis yang ditimbulkan akibat fasciolosis tergantung pada jumlah dan tahap perkembangan cacing hati, tingkat kerusakan yang terjadi, lokasi di dalam tubuh inang, jumlah cacing yang menginfeksi, invasi telur, larva, dan cacing dewasa di dalam jaringan. Fasciola sp. hidup sebagai parasit di saluran empedu dengan merusak sel-sel epitel dan menghisap darang inangnya. Fasciolosis pada kerbau dan sapi biasanya bersifat kronik, sedangkan pada domba dan kambing dapat bersifat akut. Kejadian akut dapat menyebabkan kematian tiba-tiba, sedangkan kejadian kronis menyebabkan anemia, pengafkiran hati, dan penurunan produksi (Soulsby 1986; Mitchell 2007).
Kasus fasciolosis merupakan penyakit ternak yang bersifat kosmopolitan dan distribusinya di negara-negara yang memelihara hewan ruminansia. Prevalensi fasciolosis yang tinggi ditentukan pada bagian dunia dengan curah hujan tinggi dan padang rumput yang basah (Dunn 1994). Malek (1980)
menyatakan faktor penting yang mendukung siklus hidup dan penyebaran Fasciola sp. adalah jumlah ternak yang terinfeksi, keberadaan siput sebagai inang antara, iklim, suhu, kelembaban, komposisi kimia tanah, flora air, dan kecukupan suplai air. Kontrol fasciolosis yang dapat dilakukan antara lain manajemen pakan, anthelmentik, kontrol biologi, vaksinasi, dan nutrisi tambahan (Subandriyo et al. 2004)
2.4 Ekskretori Sekretori (ES)
Cacing umumnya melepaskan protein ekskretori sekretori sebagai produk metabolisme. ES dapat berperan sebagai molekul antigen pemicu respons imunitas inang definitif (Rhoads dan Fetterer 1997). Fasciola sp. menghasilkan berbagai jenis antigen ekskretori sekretori yang berbeda-beda pada berbagai tahap hidupnya yang beredar pada sirkulasi inangnya. Antigen tersebut menjadi pembelajaran terbaik dan potensial untuk diagnostik, yang dikenal dengan gut-associated antigen. Molekul tersebut berasal dari usus parasit dan dilepaskan ke sirkulasi inang melalui regurgitasi regular isi pencernaan usus. Kehadiran ES menjadi indikasi infeksi aktif cacing yang masih hidup ( Shehab et al. 1999).
Cacing dapat melepaskan ekskretori sekretori pada kondisi in vivo dan in vitro. Secara in vivo, ES dilepaskan selama cacing menjalani proses infeksi dan menetap pada inang definitifnya. Secara in vitro, ekskretori sekretori dilepaskan sebagai akibat metabolisme, dan sebagai upaya cacing untuk mendapatkan nutrisi dari lingkungannya (Cock et al. 1993). Rhoads dan Fetterer (1997) menyatakan bahwa pelepasan ekskretori sekretori disebabkan oleh proses perkembangan dan pertahanan parasit seperti penetasan telur dan molting. Ekskretori sekretori dapat merangsang respons imunitas dan berpotensi sebagai alergen.
Ekskretori sekretori (ES) merupakan antigen yang dapat memicu tanggap kebal inang definitif (McKeand et al. 1995). Selain antigen ES, terdapat antigen somatik dan antigen permukaan yang juga merupakan antigen parasit yang dapat dikenali oleh inangnya. Antigen somatik hanya dapat dikenali oleh inang jika cacing tersebut telah mati dan dihancurkan. Antigen permukaan selalu berubah seiring dengan rangkaian perkembangan cacing yang mengalami molting sepanjang hidupnya. Inang definitif sulit untuk memberi respon tanggap kebal
terhadap antigen somatik maupun antigen permukaan. Antigen ES mempunyai sifat untuk lebih dapat dikenali oleh sistem tanggap kebal daripada antigen somatik dan antigen permukaan sehingga diduga lebih protektif untuk memicu respon tanggap kebal (Chowdhury dan Tada 1994).
Antigen ES mengandung glikoprotein yang menutupi kulit cacing dan juga mengandung sebagian kecil enzim sehingga mempermudah migrasi cacing (Bird dan Jean 1991). Enzim tersebut secara konstan dilepaskan untuk memudahkan migrasi ke jaringan inang. Berdasarkan sifatnya tersebut, ES sering digunakan sebagai salah satu upaya untuk mengatasi penyakit kecacingan. Aplikasi ES tersebut antara lain untuk kontrol biologi, pembuatan vaksin ataupun obat dengan menggunakan bahan biologi asal cacing untuk memanipulasi respon kekebalan inang (Wulandari 2004).
Efektifitas penggunaan bahan biologi asal cacing perlu dipertimbangkan karena dapat menimbulkan efek samping yang dapat merugikan. Implikasi akibat terbentuknya kompleks ES dan antibodi dapat menimbulkan lesi patologik, misalnya dalam kasus pemberian vaksin yang berasal dari larva Schistosoma mansoni yang diinduksikan pada baboon kenya menunjukkan perubahan patologi. Mukosa colon ileum terlihat inflamasi berupa granuloma, lesion, hipertropi otot, dan atropi vili (Farah dan Nyindo 1996). Namun perubahan patologik tersebut hanya bersifat sementara dan akan hilang dalam beberapa waktu (Wulandari 2004).
Analisis dua dimensi gel elektroforesis mengindikasikan bahwa Fasciola hepatica melepaskan sekitar 60 protein dalam substansi ekskretori sekretori. Sebanyak 29 protein merupakan protein esensial yaitu cathepsin L protease, superoxide dismuthase, thioredoxin peroxidase, glutathione S transferase, dan protein yang terikat pada asam lemak. Cathepsin L menempati jumlah yang paling banyak ditemukan dalam ES Fasciola sp. (Ridi et al. 2007).
2.5 Enzime Linked Immunosorbent Assay (ELISA)
ELISA atau biasa dikenal juga dengan Enzime Immunoassay (EIA) merupakan salah satu teknik uji serologis yang mulai dikenalkan pada tahun 1971 oleh Engvall dan Perlmann. Prinsip pengujian ini adalah mengukur langsung interaksi antara antigen dan antibodi sehingga termasuk dalam uji pengikatan primer seperti halnya FAT dan RIA (Tizard 2004). Selain uji pengikatan primer, terdapat uji pengikatan sekunder yang mengukur hasil interaksi antigen-antibodi secara in vitro, yaitu uji AGPT, SAT, dan CFT. Uji pengikatan primer lebih sensitif dibanding uji pengikatan sekunder.
ELISA merupakan uji pengikatan primer yang paling banyak digunakan karena hasilnya sangat akurat terutama untuk imunodiagnostik pada penyakit parasitik (Tizard 2004). ELISA dapat digunakan untuk diagnosis penyakit infeksi misalnya dalam mendeteksi adanya antigen (bakteri, virus, parasit atau jamur) atau antibodi. ELISA dapat digunakan untuk mendiagnosa penyakit noninfeksi, seperti evaluasi program vaksinasi, memonitor hormon, obat-obatan, antibiotika, toksin, pestisida, komponen serum, protein onkofetal, sitokin ataupun penyakit-penyakit autoimun (Suwarno 2003).
Ligan dalam reaksi ELISA mengikat antibodi atau antigen yang akan dideteksi oleh antibodi yang telah dikonjugasi dengan enzim. Enzim tersebut akan menghidrolisis substrat yang ditambahkan ke dalam komplek antigen - antibodi. Hidrolisis substrat biasanya berlangsung dalam waktu tertentu dan reaksi dihentikan dengan membubuhkan asam atau basa kuat. Enzim akan menginduksi perubahan warna dari substratnya dan kemudian diukur oleh spektrofotometer (ELISA reader) secara otomatis. Jenis enzim yang biasa digunakan adalah horseradish peroksidase, alkalin fosfatase, glukosa oksidase, dan beta galaksidase. Enzim yang digunakan tidak boleh mengurangi sifat imunologik antigen maupun antibodi (Kresno 2001). Jenis substrat yang digunakan harus disesuaikan dengan enzim yang digunakan untuk mengkonjugasi. Kromogen yang terdapat dalam substrat merupakan indikator warna terjadinya reaksi enzim dengan substrat. Tingkat perubahan warna sebagai indikator reaksi enzim dengan substrat tersebut merupakan penanda konsentrasi antigen atau antibodi yang
diukur (Murtini 2010). Substrat yang paling sering digunakan adalah ortho phenylenediamine (OPD) dan tetramethylbenzidine (TMB) (Kresno 2001).
Hasil pengujian ELISA dapat dinilai secara kualitatif maupun kuantitatif. Penilaian kualitatif dapat dibaca secara visual melalui perubahan warna yang terjadi dan dibedakan dari kontrol yang tidak berwarna (positif atau negatif). Penilaian secara kuantitatif dilakukan dengan membaca perubahan warna yang terbentuk menggunakan ELISA reader. Ada beberapa macam konfigurasi ELISA yang penggunaannya disesuaikan dengan kepentingan penelitian yang dilakukan yaitu ELISA langsung, ELISA tidak langsung, ELISA sandwich, ELISA penangkap antibodi, dan ELISA kompetitif (Burgess 1995). Pengujian ELISA memiliki spesifisitas dan sensitifitas yang tinggi sehingga sangat baik digunakan untuk menetapkan diagnosis secara akurat. ELISA menjadi tes serologis yang paling banyak digunakan karena sederhana, terpercaya dengan mekanisme yang mudah (Awad et al. 2009).