LAPORAN PRAKTIKUM KIMIA FISIKA II TETAPAN IONISASI ASAM
Selasa, 20-Mei-2014
Disusun Oleh : Yasa Esa Yasinta
1112016200062
Kelompok : 5
Gilang Yudha Pratama
Risky Hari Setiawan
Savira Aulia
PROGRAM STUDI PENDIDIKAN KIMIA
JURUSAN PENDIDIKAN ILMU PENGETAHUAN ALAM FAKULTAS ILMU TARBIYAH DAN KEGURUAN UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
I. ABSTRAK
Telah dilakukan percobaan tentang tetapan ionisasi asam, dengan tujuan
menentukan besarnya derajat ionisasi (ɑ) dan harga tetapan keseimbangan
ionisasi (K) larutan asam asetat. Dalam tetapan ionisasi asam ini kami
menggunakan sampel NaCl, CH3COONa, HCl, CH3COOH, dan KCl, dengan
konsentrasi yang berbeda-beda. Mulai konsentrasi 0,1 M, 0,05 M, 0,025 M,
0,0125 M, 0,00625 M.
II. PENDAHULUAN
Menurut Archenius asam didefinisikan sebagai suatu senyawa yang
apabila dilarutkan dalam air akan membebaskan ion hidrogen (H+) sedangkan
basa adalah melepaskan ion hidroksida (OH-). Namun reaksi ini hanya berlaku
pada pelarut air tidak pada yang bukan pada pelarut air. Sebagai contoh reaksi
yang berlangsung pada larutan dengan amonia cair sebagai pelarut :
Dengan reaksi ion:
Asam secara paling sederhana dapat didefinisikan sebagai zat yang dilarutkan
dalam air akan mengalami disosiasi yang menghasilkan ion hidrogen sebagai
satu-satunya ion positif. Beberapa asam dan hasil disosiasinya adalah sebagai
berikut :
Disosiasi suatu asam merupakan proses reversible untuk itu hukum
kekekalan massa dapat diterapkan, misalnya disosiasi asam
(anonym,2011)
Sebagaimana telah kita lihat, sebagian besar asam adalah asam lemah.
Mari ari kita asumsikan suatu asam monoprotik lemah HA. Ionisasinya dalam
airadalah dalah HA (aq) + H2O (l) ↔ H3O+ (aq) + A-(aq) atau lebih sederhananya,
HA (aq) ↔ H+ (aq) + A-(aq) konstanta kesetimbangan untuk ionisasi asam ini, yang
kita namakan konstanta ionisasi asam. Ka= [H3O+][𝐴−]
[HA] semakin besar Ka, semakin kuat asamnya – artinya, semakin tinggi konsentrasi ion H+ pada
kesetimbangan karena ionisasinya. Karena ionisasi asam lemah tidak pernah
sempurna, semua spesi (asam yang tidak terionisasi, ion H+ , dan ion A-) berada
pada kesetimbangan. (Raymond Chang . 2004.Hal 105)
Kita telah melihat bahwa besarnya Ka menyatakan kekuatan asam. Cara
lain untuk mengetahui kekuatan asam ialah mengukur persen ionisasi, yaitu
Persen ionisasi = konsentrasi asam ionisasi pada kesetimbanagan
konsentrasi awal asam x 100 %
Semakin kuat asam semakin besar persen ionisasai. (Raymond Chang,
2004 hal 109)
Suatu hubungan penting antara konstanta ionisasi dari basa konjugatnya
dapat diturunkan sebagai berikut, menggunakan asam asetat sebagai contoh:
CH3COOH(aq) ↔ H+ (aq) + CH3COO-(aq)
Ka = [H+][CH3COO−] [CH3COOH]
Basa konjugatnya, CH3COO- , bereaksi dengan air berdasarkan persamaan
CH3COO
-(aq) + H2O (l) ) ↔CH3COOH -(aq) + OH-(aq) (Raymond Chang, 2004
hal 115)
L=1
l= panjang (cm), ρ= tahanan jenis (ohm.cm). Daya hantar jenis larutan adalah
besarnya daya hantar 1 cm3 larutan dengan luas penampang 1 cm2, dengan
satuan ohm-1 cm-1 (Burhanudin hal 42)
Untuk larutan elektrolit, daya hantar ekivalen mempunyai arti yang
lebih penting karena lebih banyak aplikasinya. Daya hantar ekivalen ialah daya
hantar 1 grek larutan elektrolit yang terdapat diantara dua buah electrode yang
berjarak 1 cm. Daya hantar ekivalen (˄) mempunyai hubungan dengan daya hantar jenis yang dinyatakan oleh persamaan: ˄= 1000C Ls ohm-1cm2grek-1
dengan C= konsentrasi elektrolit dalam grek/liter, Ls = daya hantar jenis
(ohm-1.cm2 ) (Burhanudin hal 43).
Harga ˄ satuan larutan dapat ditentukan dengan jalan mengukur Ls =
(1/R)(l/A), maka Ls dapat ditentukan jika R, l, dan A diketahui. Besarnya (l/A)
untuk setiap jenis electrode adalah tetap, dan disebut tetapan sel K. jadi: Ls =
K/R. untuk elektrolit lemah pada setiap konsentrasi tertentu berlaku: ɑ= ˄c/˄0
dengan ɑ= derajat ionisai. Dalam larutan asam asetat terjadi keseimbangan:
Dengan Kc= tetapan keseimbangan ionisasi asam asetat. Dengan mengukur
harga-harga ˄c dan ˄0, maka besarnya ɑ dan Kc asam asetat dapat ditentukan.
III. ALAT, BAHAN Dan METODE Alat:
Sel konduktometer Multimeter digital Gelas kimia Gelas ukur
Bahan:
KCl Kristal
Larutan NaCl 0,1 M, 0,05 M, 0,025 M, 0,0125 M, 0,00625 M CH3COONa 0,1 M, 0,05 M, 0,025 M, 0,0125 M, 0,00625 M CH3COOH 0,1 M, 0,01M, 0,05 M
HCl 0,1 M, 0,05 M, 0,025 M, 0,0125 M, 0,00625 M
Metode:
1. Buatlah larutan KCl 0,1 M sebanyak 50 ml. isilah sel konduktor
dengan larutan ini secukupnya. Ukurlah tahanan sel sekarang
dengan multimeter. Pengukuran dilakukan pada 25°C dan berlaku
untuk cairan yang lain.
2. Cucilah sel dengan akuades sampai bersih. Isilah sel dengan
akuades, dan tentukan tahananya.
3. Buatlah larutan NaCl pada berbagai konsentrasi yaitu: 0,1 M, 0,05
M, 0,025 M, 0,0125 M, 0,00625 M. tentukan tahanan
masing-masing larutan tersebut dengan sel konduktometer.
4. Lakukan langkah diatas terhadap larutan-larutan: HCl,
CH3COONa
5. Tentukan besarnya tahanan larutan asam asetat pada konsentrasi:
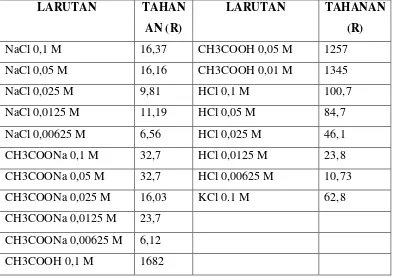
IV. HASIL PENGAMATAN Dan PEMBAHASAN Tabel penghamatan:
LARUTAN TAHAN
AN (R)
LARUTAN TAHANAN
(R)
NaCl 0,1 M 16,37 CH3COOH 0,05 M 1257
NaCl 0,05 M 16,16 CH3COOH 0,01 M 1345
NaCl 0,025 M 9,81 HCl 0,1 M 100,7
NaCl 0,0125 M 11,19 HCl 0,05 M 84,7
NaCl 0,00625 M 6,56 HCl 0,025 M 46,1
CH3COONa 0,1 M 32,7 HCl 0,0125 M 23,8
CH3COONa 0,05 M 32,7 HCl 0,00625 M 10,73
CH3COONa 0,025 M 16,03 KCl 0.1 M 62,8
CH3COONa 0,0125 M 23,7
CH3COONa 0,00625 M 6,12
CH3COOH 0,1 M 1682
Perhitungan:
NaCl 0,1 M:
˄ = 1000 C Ls
˄ = 1000
0,1 16,37 x 10
-3 = 163,7
NaCl 0,05 M:
˄ = 1000
0,05 16,16 x 10
˄ = 1000
0,1 62,8 x 10
-3 = 628
t = o [1 + 0,02 (t – 25)] o = 390,55
Derajat ionisasi:
ɑ= ˄c/˄0
CH3COOH0,1M
ɑ= 168,2/ 390,55 = 0,43
CH3COOH 0,05 M
ɑ= 251,4/ 390,55 = 0,64
CH3COOH 0,01 M
ɑ= 1.345,0/390,55 = 3,44
NaCl 0,00625 M
ɑ= 1049,6/0,00625 = 167.936
HCl 0,00625 M
ɑ= 1716,8/0,00625 = 274.688
CH3COONa 0,00625
ɑ= 979,2/0,00625 = 156.672
KCl 0,1 M
Pembahasan:
Pada praktikum kali ini kami melakukan percobaan tentang tetapan
ionisasi asam. Tujuan dari praktikum kali ini yaitu menentukan besarnya derajat
ionisasi. Kami menggunakan sampel NaCl, CH3COONa, HCl, CH3COOH,
dan KCl, dengan konsentrasi yang berbeda-beda. Mulai konsentrasi 0,1 M, 0,05
M, 0,025 M, 0,0125 M, 0,00625 M. setelah melakukan perhitungan dari data
percobaan yang didapat, kami mendapatkan besarnya derajat ionisasi dari
masing – masing sampel tersebut. Larutan CH3COOH 0,1 M derajat
ionisasinya sebesar 0,43 dan 0,05 M sebesar 0,64. Hal ini sesuai dengan teori
dimana derajat ionisasi dari elektrolit lemah itu kurang dari 1, sebab hanya
sebagian yang teruarai menjadi ion. Tetapi ketika dialakukan percobaan dengan
molaritas sebesar 0,01 M derajat ionisasinya sebesar 3,44. Hal ini tidak sesuai
dengan teori atau literature yang ada, dan disebabkan oleh kurang telitinya
praktikan, dan terjadi kesalahan dalam melakukan pengenceran. Berikutnya
dengan elektrolit kuat seperti NaCl, KCl, CH3COONa, dan HCl derajat ionisasi
yang didapatkan sangat besar sekali mencapai ribuan. Padahal berdasarkan
literature yang ada derajat ionisasi pada elektrolit kuat itu sama dengan 1, sebab
semua zat yang dilarutkan terurai menjadi ion.
V. KESIMPULAN
1. HCl, NaCl, KCl, CH3COONa termasuk elektrolit kuat dan mempunyai
derajat ionisasi sama dengan 1, sebab semua zat yang dilarutkan terurai
menjadi ion.
2. CH3COOH termasuk elektrolit lemah dan mempunyai derajat ionisasi
3. Pada percobaan kali ini perhitungan yang didapat tidak sesuai dengan
literature yang ada, dapat dfikarenakan kurang telitinya praktikan dalam
melakukan percobaan.
VI. REFERENSI
Chang, Raymond. 2004. KIMIA DASAR KONSEP-KONSEP INTI Edisi
Ketiga Jilid 2.Jakarta: Erlangga
Milama, Burhanudin. 2014. Panduan Praktikum Kimia Fisika 2. Jakarta :
UIN P.IPA FITK-Press
http://www.scribd.com/document_downloads/direct/172356079?extension=pdf& ft=1400841303<=1400844913&user_id=177075685&uahk=e7ZkSCP465ZLT FfQHoC0pWKBB4c