1 RENCANA PELAKSANAAN PEMBELAJARAN
Nama Sekolah : SMA Muhammadiyah Pohgading Mata Pelajaran : Kimia
Kelas/Semester : X/II (genap)
Materi Pokok : Larutan Elektrolit dan Non Elektrolit Alokasi Waktu : 1 X 3 JP
A. Kompetensi Inti
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya
KI 2 : Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalamberinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
KI 3 : Memahami, menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingintahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasankemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat danminatnya untuk memecahkan masalah.
KI 4 : Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metoda sesuai kaidah keilmuan
B. Kompetensi Dasar dan Indikator
1.1 Menyadari adanya keteraturan struktur partikel materi sebagai wujud kebesaran Tuhan Yang Maha Esa dan pengetahuan tentang struktur partikel materi sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab,
2 kritis, kreatif, inovatif, demokratis (komunikatif), dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari. 2.2 Menunjukkan perilaku kerjasama, santun, toleran, cinta damai dan peduli
lingkungan serta hemat dalam memanfaatkan sumber daya alam.
2.4 Menunjukkan perilaku responsif, dan proaktif serta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuat keputusan.
3.8 Menganalisis sifat larutan elektrolit dan larutan nonelektrolit berdasarkan daya hantar listriknya.
4.8 Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan untuk mengetahui sifat larutan elektrolit dan larutan non- elektrolit .
Indikator :
1.1.1 Memahami dan menyadari adanya keteraturan struktur partikel materi sebagai wujud kebesaran Tuhan Yang Maha Esa dan pengetahuan tentang struktur partikel materi sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
2.1.1 Memahami dan menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis (komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
3.8.1 Menyebutkan pengertian larutan elektrolit dan non elektrolit
3.8.2 Mengidentifikasi sifat-sifat larutan elektrolit dan non elektrolit melalui percobaan.
3.8.3 Mengelompokkan larutan ke dalam larutan elektrolit dan non elektrolit berdasarkan sifat hantaran listriknya
3.8.4 Menjelaskan penyebab kemampuan larutan elektrolit menghantarkan arus listrik
3.8.5 Mendeskripsikan bahwa larutan elektrolit dapat berupa senyawa ion dan senyawa kovalen polar.
3 4.8.1 Merancang percobaan untuk menyelidiki sifat larutan berdasarkan daya
hantar listriknya
4.8.2 Melakukan percobaandaya hantar listrik pada beberapa larutan.
4.8.3 Mengamati dan mencatat data hasil percobaandaya hantar listrik pada beberapa larutan.
4.8.4 Menganalisis data hasil percobaan daya hantar listrik larutan elektrolit dan larutan non-elektrolit.
4.8.5 Menyimpulkan sifat larutan berdasarkan daya hantar listrik larutan elektrolit dan larutan non-elektrolit.
4.8.6 Menyimpulkan bahwa larutan elektrolit dapat berupa senyawa ion atau senyawa kovalen polar
4.8.7 Mengkomunikasikan hasil percobaan larutan elektrolit dan non elektrolit
C. Tujuan Pembelajaran
1. Siswa dapat menyadari adanya keteraturan sifat hantar listrik pada larutan sebagai wujud kebesaran Tuhan YME.
2. Siswa dapat menunjukan sikap positip (individu dan sosial) dalam diskusi kelompok
3. Siswa dapat menunjukkan perilaku dan sikap menerima, menghargai, dan melaksanakan kejujuran, ketelitian, disiplin dan tanggung jawab
4. Siswa dapat menyebutkan pengertian larutan elektrolit dan non elektrolit
5. Siswa dapat mengidentifikasi sifat-sifat larutan elektrolit dan iswnon elektrolit melalui percobaan
6. Siswa dapat mengelompokkan larutan ke dalam larutan elektrolit dan non elektrolit berdasarkan sifat hantaran listriknya
7. Siswa dapat menjelaskan penyebab kemampuan larutan elektrolit menghantarkan arus listrik
8. Siswa dapat mendeskripsikan bahwa larutan elektrolit dapat berupa senyawa ion dan senyawa kovalen polar.
9. Siswa dapat merancang percobaan untuk menyelidiki sifat larutan berdasarkan daya hantar listriknya
4 11. Siswa dapat mengamati dan mencatat data hasil percobaan daya hantar listrik
pada beberapa larutan.
12. Siswa dapat menyimpulkan bahwa larutan elektrolit dapat berupa senyawa ion atau senyawa kovalen polar
13. Siswa dapat menganalisis data hasil percobaan larutan berdasarkan daya hantar listrik larutan elektrolit dan larutan non-elektrolit.
14. Siswa dapat menyimpulkan sifat larutan berdasarkan daya hantar listrik larutan elektrolit dan larutan non-elektrolit.
D. Materi Pembelajaran
1. Materi fakta: Penerapan eloktrolit dan non elektrolit dalam kehidupan (misalnya gambar-gambar Konduktor, Isolator, Pelarut dan Terlarut)
2. Materi konsep
a. Larutan
b. Larutan elektrolit c. Larutan non elektrolit d. Reaksi
5 3. Prinsip
a. Peran ion dalam hantaran listrik larutan(teori Arrhenius) b. Kekuatan elektrolit
c. Prosedur
d. Langkah kerja percobaan daya hantar listrik dalam larutan
Larutan adalah campuran yang homogen dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit disebut zat terlarut, sedangkan zat yang jumlahnya lebih banyak disebut pelarut. Suatu zat dikatakan larutan jika campuran antara zat terlarut dan pelarutnya bersifat homogeny. Elektrolit merupakan suatu zat yang ketika dilarutkan dalam air akan menghasilkan larutan yang dapat menghantarkan arus listrik. Suatu larutan dapat dikatakan sebagai larutan elektrolit jika zat tersebut mampu menghantarkan listrik. Sedangkan Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik atau atau semua zat bila dilarutkan dalam air tidak mengalami ionisasi dan menghasilkan larutan yang tidak dapat menghantarkan arus listrik dan tidak menimbulkan gelembung gas (dalam eksperimen).
PERBEDAAN ELEKTROLIT DAN NON ELEKTROLIT Perbedaan keduanya dapat dilihat dari tabel berikut ini,
No Elektrolit Elektrolit Non-elektrolit
Lemah Kuat 1 Kurang dapat menghantarkan listrik dengan baik Dapat menghantarkan listrik dengan sangat baik Tidak dapat menghantarkan listrik 2 Terjadi proses ionisasi (terurai menjadi ion-ion) yang tidak sempurna Lampu menyala redup atau
Terjadi proses ionisasi (terurai menjadi ion-ion) dengan
sempurna
Tidak terjadi proses ionisasi
6 3 ada gelembung gas
(sedikit)
Lampu menyala terang dan ada banyak gelembung gas
Lampu tidak menyala dan tidak ada gelembung gas
4 Berupa larutan asam basa lemah
Berupa larutan asam basa kuat
Berupa larutan gula, alkohol dan urea
JENIS SENYAWA ELEKTROLIT
No Jenis Senyawa
Sifat Senyawa ( elektrolit / non elektrolit )
Padat Lelehan Larutan 1.
2.
Senyawa ion (NaCl, MgCl2)
Senyawa kovalen polar (HCl, HBr) Non elektrolit Non elektrolit Elektrolit Non elektrolit Elektrolit Elektrolit
Pada senyawa ion yang berwujud lelehan dan larutan ion-ionya dapat bergerak bebas, sedangkan pada wujud padat tidak. Demikian pula pada senyawa kovalen hanya yang berwujud larutanlah yang ionnya dapat bergerak bebas. Jadi sifat elektrolit suatu senyawa ditentukan oleh ionnya.
E. Pendekatan, Model dan Metode Pembelajaran Pendekatan : SAINTIFIK
Metode : Eksperimen, Ceramah, Diskusi Kelompok, Penugasan, Presentasi. Model : Inquiri
F. Media, Alat, dan Sumber Pembelajaran Media : Internet http://denipermanadenchoen.blogspot.com/2013/04/larutan-elektrolit-dan-non-elektrolit_16.html http://zelin-zelinevriani.blogspot.com/2013/05/contoh-larutan-elektrolit-dan-non_16.html http://rumushitung.com/2013/01/03/definisi-kimia-dari-berbagai-sumber/
7 Alat/Bahan : LCD Proyektor, gambar.
Sumber Belajar :
- Sudarmo, unggul. 2013. Kimia untuk SMA/MA Kelas X. Jakarta: Erlangga. - Susilowati, endang dan Harjani, tarti. 2013. Buku Guru Kimia 1 untuk Kelas X
SMA dan MA Kelompok Peminatan matematika dan Ilmu Alam. Solo: Wangsa
Jatra Lestari.
- Rahardjo, budi sentoso. 2014. Kimia Berbasis Eksperimen 1 untuk Kelas X
SMA dan MA Kelompok Peminatan Matematika dan Ilmu Alam. Solo: Tiga
Serangkai Pustaka Mandiri. G. Langkah-langkah Pembelajaran.
Rincian Kegiatan Waktu
1. Pendahuluan
Guru memberikan salam, dilanjutkan dengan meminta ketua kelas memandu do'a.
Guru memotivasi dan memberi apersepsi dengan memberikan gambar/video.
Mengkondisikan siswa untuk belajar dan memotivasi siswa terkait materi “Larutan Elektrolit dan Non Elektrolit”. - Apersepsi: bertanya jawab tentang listrik.
“Berasal dari manakah arus listrik?”
“Apakah kita membutuhkan listrik dalam kehidupan sehari-hari?”
Menyampaikan inti pembelajaran hari ini mengenai larutan elektrolit dan non elektrolit.
- Memotivasi
Guru memperlihatkan gambar
8
Rincian Kegiatan Waktu
Guru meminta salah satu siswa menceritakan hasil pngamatan foto/gambar tersebut.
Guru menyampaikan kompetensi dasar (KD) yang akan diajarkan
Guru menyampaikan tujuan pembelajaran.
Guru membagi kelompok (masing-masing beranggotakan 3-5 orang siswa).
2. Kegiatan Inti Mengamati
Secara berkelompok peserta didik mengamati gambar atau video larutan Elektrolit dan Nonelektrolit dalam peranannya bagi kehidupan manusia.
Mengkaji literatur tentang larutan elektrolit dan nonelektrolit.
Menanya
Guru memberikan kesempatan kepada peserta didik untuk mengajukan pertanyaan berkaitan dengan hasil pengamatan. Guru memberi kesempatan bagi peserta didik lain yang ingin
menanggapi atau menjawab pertanyaan siswa.
Mengajukan pertanyaan apakah semua larutan dapat
9
Rincian Kegiatan Waktu
menghantarkan arus listrik? Mengapa ketika banjir orang bisa tersengat arus listrik? Apa manfaat larutan elektrolit dalam kehidupan?
Mengumpulkan Data
Merancang percobaan untuk menyelidiki sifat larutan berdasarkan daya hantar listrik dan mempresentasikan hasilnya untuk menyamakan persepsi.
Melakukan percobaan.daya hantar listrik pada beberapa larutan.
Mengamati dan mencatat data hasil percobaan.daya hantar listrik pada beberapa larutan.
Mengasosiasi.
Menganalisis data hasil percobaan untuk menyimpulkan sifat larutan berdasarkan daya hantar listriknya (larutan elektrolit dan larutan non-elektrolit).
Mengelompokkan larutan berdasarkan jenis ikatan dan menjelaskannya.
Menyimpulkan bahwa larutan elektrolit dapat berupa senyawa ion atau senyawa kovalen polar.
Mengomunikasikan
Menyajikan laporan hasil percobaan tentang daya hantar listrik larutan elektrolit kuat, larutan elektrolit lemah, dan larutan nonelektrolit.
Secara bergilir setiap kelompok diberi kesempatan mempersentasikan hasil diskusi kelompoknya
Kelompok lain dapat memberi tanggapan dan pertanyaan. Guru memberi penilaian atas hasil kerja kelompok dan
kemampuan peserta didik berkomunikasi lisan 3. Penutup
Guru mereviu dengan memberikan pertanyaan-pertanyaan untuk mengukur ketercapaian tujuan pembelajaran.
Guru memberikan tugas untuk dikerjakan di rumah (PR). Guru mengingatkan materi pertemuan berikutnya reaksi reduksi
oksidasi.
Guru mengucapkan salam.
10 H. Penilaian
Jenis/teknik penilaian dan bentuk instrumen
Teknik Bentuk Instrumen
Pengamatan Sikap Lembar Pengamatan Sikap dan Rubrik Tes Unjuk Kerja Tes Uji Petik Kerja
Tes Tertulis Tes Uraian dan Pilihan
Portofolio Panduan Penyusunan Portofolio 1. Contoh Instrumen
a. Lembar Pengamatan Sikap
No Aspek yang dinilai 3 2 1 Keterangan
1 Menyadari adanya Tuhan YMK.
2 Melakukan percobaan dengan disiplin dan teliti.
3 Menunjukkan ketekunan dan
tanggungjawab dalam belajar dan bekerja baik secara individu maupun berkelompok
Rubrik Penilaian Sikap
No Aspek yang dinilai Rubrik
1 Menyadari adanya Tuhan YMK.
3: Menyadari tidak ada sesuatu yang terjadi di alam semesta ini tanpa kehendak Tuhan Yang Maha Kuasa.
2: Sedikitmenyadari bahwa tidak ada sesuatu yang terjadi di alam semesta ini tanpa kehendak Tuhan Yang Maha Kuasa.
1: Tidak menyadari bahwa sesuatu yang terjadi di alam semesta ini tanpa kehendak Tuhan Yang Maha Kuasa.
2 Melakukan percobaan dengan disiplin dan teliti.
3: Melakukan percobaan dengan disiplin dan teliti.. 2: Melakukan percobaan dengan disiplin dan tapi
tidak teliti..
1: Tidak melakukan percobaan dengan disiplin dan teliti..
3 Menunjukkan rasa ingin tahu.
3: Selalu bertanya kepada guru secara kritis. 2: Kadang bertanya kepada guru secara kritis. 1: Tidak pernah Bertanya kepada guru secara kritis.
11 Deskripsi sikap ini digunakan untuk pertimbangan dalam menentukan profil siswa (bukan angkanya yang penting, namun deskripsi sikap siswa).
b. Lembar Tes Unjuk Kerja
No Aspek yang dinilai Ya Tidak Keterangan
1 Memahami tujuan dan langkah kerja suatu percobaan.
2 Mengidentifikasi dan mengevaluasi informasi dari berbagai referensi. 3 Menunjukkan ketelitian dan
tanggungjawab dalam percobaan 4 Mampu berkerja secara individu maupun
berkelompok
5 Menggunakan bahasa dan kosakata juga bahasa tubuh yang sesuai saat mempresentasikan hasil percobaan.
c. Lembar Tes Tertulis
1) Ke dalam air ditambahkan cuka dan alcohol kemudian diuji sifat listriknya. Spesi kimia dalam campuran tersebut yang menghantarkan arus listrik adalah ….
Jawaban : C2H3O2- dan H+
2) Jika MgNH4PO4 dilarutkan dalam air maka dalam larutan akan terdapat ion-ion ….
Jawaban : Mg2+, NH4+, dan PO43-.
3) Ketika dalam air NH3 dapat membentuk larutan …. Jawaban : Elektrolit lemah
4) Apakah air tergolong elektrolit atau nonelektrolit? Jelaskan. Jawaban :
Air murni tergolong nonelektrolit, sebab air tidak terurai menjadi ion-ionnya, tetapi tetap sebagai molekul. Walaupun terurai sangat kecil.
5) Mengapa HCl kering dalam keadaan gas tergolong nonelektrolit, tetapi dalam larutan dalam air tergolong elektrolit kuat? Jelaskan.
Jawaban :
HCl dalam keadaan gas tidak terurai, sebab tidak ada yang mengaktivasi menjadi ion-ionnya, sedangkan dalam larutan air, molekul-molekul air mengaktivasi molekul-molekul HCl sehingga terjadi reaksi H2O dan H+ membentuk H3O+ dan Cl-.
d. Lembar Portofolio
Daya Hantar Listrik Larutan
Suatu bahan ada yang menghantarkan listrik dan ada yang tidak menghantarkan listrik. Demikian pula larutan dalam air. Larutan yang dapat menghantarkan listrik disebut larutan elektrolit sedangkan larutan yang tidak menghantarkan listrik disebut larutan
12 non elektrolit. Percobaan berikut untuk menyelidiki daya hantar listrik berbagai larutan dalam air.
1. Buat alat penguji daya hantar listrik seperti gambar di samping. Alat ini dapat dibuat sendiri dengan bahan yang sederhana. Gunakan elektroda dari grafit batrai bekas.
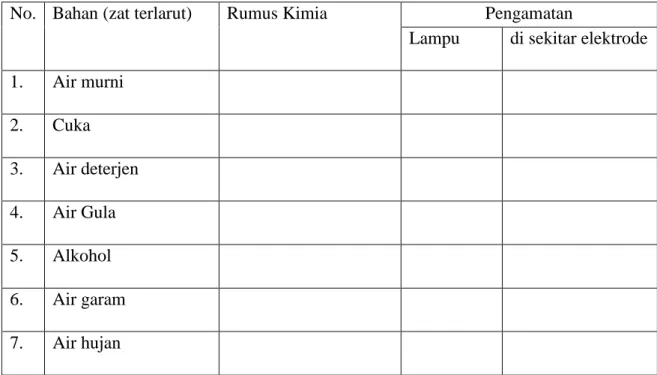
2. Ujilah larutan yang terdapat pada tabel berikut dengan cara mencelupkan elektroda ke dalam larutan (bila akan berganti larutan, cucilah elektrodanya dan keringkan dengan kertas tisu. Tabel Pengamatan
No. Bahan (zat terlarut) Rumus Kimia Pengamatan
Lampu di sekitar elektrode 1. Air murni 2. Cuka 3. Air deterjen 4. Air Gula 5. Alkohol 6. Air garam 7. Air hujan Catatan:
Beri tanda (+) jika lampu menyala dan tanda (-) jika lampu tidak menyala. Pertanyaannya:
1. Larutan mana sajakah yang menghasillkan gelembung? Jawaban :
2. Dari tabel pengamatan, larutan apa saja yang dapat menyebabkan lampu terang? Jawaban :
3. Dari tabel pengamatan, larutan apa saja yang dapat menyebabkan lampu redup? Jawaban :
4. Dari tabel pengamatan, larutan apa saja yang dapat menyebabkan lampu tidak menyala? Jawaban :
5. Berdasarkan percobaan, larutan manakah yang termasuk ke dalam larutan elektrolit? Jawaban :
13 6. Berdasarkan percobaan, larutan manakah yang termasuk ke dalam larutan non elektrolit?
Jawaban :
7. Diantara larutan yang diuji, larutan manakah yang termasuk larutan elektrolit kuat? Jawaban :
8. Diantara larutan yang diuji, larutan manakah yang termasuk larutan elektrolit lemah? Jawaban :
9. Berdasarkan tabel pengamatan, bagaimana sifat-sifat suatu larutan termasuk larutan elektrolit lemah?
Jawaban :
10. Berdasarkan tabel pengamatan, bagaimana sifat-sifat suatu larutan termasuk larutan elektrolit kuat?
Jawaban :
11. Berdasarkan tabel pengamatan, bagaimana sifat-sifat suatu larutan termasuk larutan non elektrolit?
Jawaban :
12. Diantara larutan elektrolityang telah teridentifikasi, manakah larutan elektrolit yang zat terlarutnya tergolong:
a. Senyawa ionik: b. Senyawa kovalen:
13. Berdasarkan tabel pengamatan, tuliskan persamaan reaksi ionisasinya! Jawaban :
Mengetahui :
Kepala SMA Muh. Pohgading,
PATHAN, S. Pd
NIP 19671231 1 99003 1 121
Pohgading, 7 Juli 2014
Guru Mata Pelajaran,
ELISA HARPIANA, S.Pd.
Catatan Kepala Sekolah
... ... ... .