Laporan Praktikum ke -4 Hari/Tanggal : Selasa/ 30 September 2014 m.k Penyakit Organisme Akuatik Kelompok : IX
Asisten : Syifah
ISOLASI DAN IDENTIFIKASI CENDAWAN PATOGEN
Disusun Oleh :
Savni Retalia Sababalat C14120023
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
I. PENDAHULUAN
1.1 LatarBelakang
Terdapat banyak kendala dalam budidaya akuatik, antara lain penyakit, baik penyakit non-infeksi maupun infeksi. Penyakit non-infeksi antara lain yaitu: sungut menghadap ke bawah, sungut tumbuh pendek, mata juling, tutup insang melengkung, punggung bengkok, kembang sisik, sirip ekor patah, serta ekor dan sirip tumbuh mengkerut. Penyakit non-infeksi disebabkan oleh lingkungan yang buruk, pakan yang tidak higienis dan faktor genetis (Susanto, 2007). Penyakit infeksi terdiri dari penyakit bakterial, mikotik dan parasitik, dan penyakit sistesemia enterik oleh bakteri Edwarsiella ictaluri, penyakit mikotik oleh Saprolegnia sp. serta penyakit parasitik oleh Learnea sp. dan Trichodina sp. Jika penyakit tersebut tidak segera diatasi dapat membuat budidaya akuatik menjadi cacat dan mengalami kematian bahkan tidak mendapatkan profit yang maksimal. Budidaya akuatik terutama pada ikan yang menderita penyakit dan mengalami kecacatan fisik harga jualnya akan turun sehingga dapat mengurangi keuntungan usaha.
Kegiatan budidaya sering mengalami gagal panen karena serangan dari penyakit. Salah satunya adalah penyakit mikotik. Penyakit mikotik adalah penyakit yang disebabkan oleh cendawan. Cendawan adalah organisme heterotrofik yang memiliki filamen. Ikan yang terinfeksi cendawan tidak akan dapat bertahan hidup lebih lama. Bahkan infeksi ini dapat dapat tersampaikan pada individu yang berada pada waktu dan tempat yang sama. Infeksi ini dapat menyebar melalui spora yang dikeluarkan oleh cendawan.
1.2 Tujuan
II.METODOLOGI
2.1 WaktudanTempat
Praktikum ini dilaksanakan pada hari 23 -24 September 2014 pada pukul 15.00-16.30 WIB dan pengamatan kedua pukul 12.00 WIB bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
2.2 AlatdanBahan
Alat yang digunakan pada praktikum ini adalah kaca objek, kaca penutup, gunting, pembakar bunsen, tissue, dan alat bedah. Sedangkan bahan-bahan yang digunakan adalah ikan lele yang terinfeksi cendawan, cendawan yang telah dikultur, pewarna lactophenolcotton blue, alkohol 70%, media GYA (Glukosa Yeast Agar), antibiotik penicilin streptomycine 125 mg/l.
2.3 Prosedur
2.3.1 Cara Isolasi Cendawan
Pertama dilakukan sterilisasi meja dan alat-alat yang akan digunakan. Ikan yang telah terinfeksi diambil. Bagian luar ikan diusap dengan alcohol 70 %. Hifa dipotong dengan gunting dan ditanam pada media yang telah diberi antibiotic secara aseptik. Diinkubasi selama 24-48 jam. Cendawan tersebut dipindahkan ke dalam media cair yang telah diberi antibiotic. Diinkubasi lagi selama 24-48 jam.
2.3.2 Identifikasi Cendawan pada ikan nila (Oreochromis niloticus)
III. HASIL DAN PEMBAHASAN 3.1 Hasil
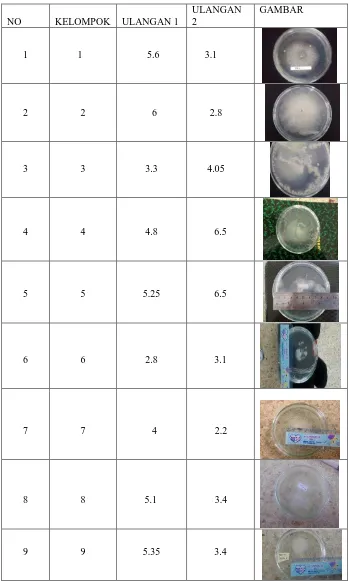
Berikut tabel hasil isolasi dan identifikasi cendawan pada ikan nila (Oreochromis niloticus ) serta gambar hasil isolasi.
Tabel 1. Hasil Isolasi Cendawan pada ikan nila
NO KELOMPOK ULANGAN 1
ULANGAN 2
GAMBAR
1 1 5.6 3.1
2 2 6 2.8
3 3 3.3 4.05
4 4 4.8 6.5
5 5 5.25 6.5
6 6 2.8 3.1
7 7 4 2.2
8 8 5.1 3.4
10 10 4.3 3.6 _ ( Tidak ada foto)
11 11 3.8 4.5
12 12 3.75 4.3
Dari hasil di atas dapat dilihat bahwa cendawan tumbuh pada setiap kelompok, kecuali kelompok 10. Diameter cendawan isolasi yang terbesar pada ulangan pertama terdapat pada kelompok 1 sebesar 5.6 dan ulangan ke-2 pada kelompok 4 dan 5 sebesar 6.5 milimeter, sedangkan diameter cendawan isolasi yang terkecil terdapat pada kelompok 6 sebesar 2.6 ulangan pertama, ulangan ke-2 kelompok 7 sebesar 2,2 milimeter.
3.2 Pembahasan
Fungi atau cendawan adalah organisme eukariotik heterotrofik (konsumen bahan organik), tidak berklorofil, bereproduksi dengan membentuk spora secara seksual dan aseksual, biasanya berbentuk benang, berlubang dan bercabang, dinding sel terbuat dari khitin, selulosa atau tanpa selulosa dan bahan organik lainnya. Cendawan air memerlukan senyawa organik untuk nutrisinya. Cendawan yang hidup dari benda organik yang terlarut disebut saprofit, sedangkan cendawan yang mendapatkan kebutuhan esensialnya dari inang disebut parasit. Beberapa cendawan meskipun saprofitik, dapat juga menyerang inang yang hidup lalu tumbuh dengan subur sebagai parasit. Cendawan dapat menimbulkan penyakit pada manusia, tumbuhan dan hewan. Kelompok cendawan air yang sering ditemukan menyerang ikan budidaya adalah Saprolegnia, Achlya dan Aphanomyces (Bruno dan Wood, 1999).
Saprolegnia sp. termasuk dalam filum Phycomycetes, kelas Oomycetes, ordo Saprolegniales, famili Saprolegniaceae dan genus Saprolegnia . Ciri umum genus ini antara lain hidup di daerah tropis dengan suhu > 24
0
sporangia dan zoospora diproduksi setelah 48 sampai 72 jam. Saprolegnia juga ditemukan pada daerah subtropis dan menyerang salmon atlantik, trout rainbow, trout coklat, coho salmon dan di Jepang juga menyerang ikan ayu (Brown dan Bruno, 2002). Oleh sebab itu Saprolegnia juga dikenal sebagai winter fungi. Ciri-ciri lain yang dimiliki oleh genus Saprolegnia adalah memiliki sporangium yang berdiameter 100 mikron lebih lebar dari hifanya. Saprolegnia patogen pada ikan yaitu Saprolegnia parasitica (penyebab ulcerative dermal necrosis pada salmon Atlantik), Saprolegnia diclina dan Saprolegnia ferax.Saprolegniasis diteliti sebagai penyakit infeksi cendawan kronis, dengan penampakan seperti tumpukan kapas pada kulit dan insang pada ikan dan telur yang menyebar pada seluruh permukaan tubuh. Pada infeksi awal lesi pada kulit berwarna abu-abu atau putih, berbentuk melingkar atau sepeti sabit yang dapat berkembang dengan cepat dan menyebabkan kerusakan pada epidermis. Ikan yang terinfeksi menjadi lesu, kehilangan keseimbangan dan menyebabkan ikan lebih mudah untuk dimangsa.
Aphanomyces sp. termasuk dalam filum Phycomycetes, kelas Oomycetes, Ordo Saprolegniales, famili Saprolegniaceae dan genus Aphanomyces (Scott, 1961). Ciri-ciri biologis Aphanomyces yaitu memiliki miselium berdiameter 5-15 mikron. Hifanya bercabang, tidak bersepta dan berpigmen. Zoospora muncul pada ujung sporangium dalam bentuk memanjang, kemudian menjadi kista di sekitar ujung sporangium. Zoospora dibentuk dari hifa vegetatif dengan diameter sama dan tidak digunakan untuk berkembang biak. Salah satu ciri Aphanomyces parasitik adalah menghasilkan kantung spora lebih dari satu dan keluar dari bagian tengah (samping) hifa sedangkan Aphanomyces saprofitik hanya menghasilkan satu cluster spora dan keluar dari bagian terminal/ujung hifa (Alderman, 1982).
Aphanomyces sp. adalah salah satu cendawan yang dihubungkan sebagai penyebab utama penyakit EUS (Ulcerative Epizootic Syndrome). Aphanomyces sp. yang bersifat patogen dapat menembus organ utama sehingga disebut dermatomycosis atau mycotic dermatomycosis. Penyebab kematian sebenarnya dihubungkan dengan kegagalan osmoregulasi atau kesulitan respirasi ketika infeksi terjadi pada insang (Bruno dan Stamps dalam Bruno dan Wood, 1999).
(perubahan suhu secara mendadak >5 0C dari kisaran suhu optimum) yang menyebabkan ikan stres dan lebih mudah terinfeksi.
Menurut Sharma (1989) cendawan ini mirip dengan Saprolegnia sp. hanya saja terdapat perbedaan berupa: sporangiumnya terbentuk di ujung hifa, memiliki tiga tahap zoospora sehingga disebut polyplanetism, dimana zoospora primer yang tidak memiliki flagel keluar secara bergerombol yang sebelumnya mengumpul di mulut zoosporangia, selanjutnya terjadi pembentukan zoospora sekunder dan tersier. Pembentukan siste primer terjadi di mulut sporangium, zoospora primer masih bergerombol. Pembentukan sporangium kedua dengan cara membentuk cabang di bawah sporangium pertama yang telah kosong. Zoospora sekunder berbentuk reniform dan memiliki dua flagel, begitu pula zoospora tersier, sedangkan zoospora primer berbentuk seperti pyriform dan tidak memiliki flagel. Pada reproduksi seksual, setiap oogonia menghasilkan 1-10 oospora..
Ada tiga bentuk garis pertahanan ikan menghadapi serangan cendawan (Bruno dan Wood, 1999) yaitu: Kulit merupakan tempat kontak pertama terjadinya infeksi. Sekresi lendir akan meningkat mengikuti kontak dengan zoospora sekunder yang bertujuan mengurangi keberadaan cendawan pada permukaan tubuh ikan. 2.Lendir bagian luar yang dapat mencegah miselia tumbuh dari spora. 3. Respon selular yang terdeteksi oleh lendir eksternal. Lapisan lendir berperan utama sebagai penghalang fisik koloni cendawan ataupun agen infeksi lain.
Dari hasil di atas dapat dilihat bahwa cendawan tumbuh pada setiap kelompok, kecuali kelompok 10. Diameter cendawan isolasi yang terbesar pada ulangan pertama terdapat pada kelompok 1 sebesar 5.6 dan ulangan ke-2 pada kelompok 4 dan 5 sebesar 6.5 milimeter, sedangkan diameter cendawan isolasi yang terkecil terdapat pada kelompok 6 sebesar 2.6 ulangan pertama, ulangan ke-2 kelompok 7 sebesar ke-2,ke-2 milimeter. Jenis cendawan yang tumbuh pada praktikum yang dilakukan adalah saprolegnia karena Ciri umum genus ini antara lain hidup di daerah tropis dengan suhu > 24
0
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Dari hasil pengamatan dapat diketahui bahwa cendawan yang menyerang ikan akuatik salah satunya nila dan lele maupun cendawan yang terdapat pada media GYA adalah Saprolegnia sp. Dimana pada sampel ikan tumbuh Saprolegnia yang menyerupai benang-benang halus bewarna putih seperti kapas.
4.2 Saran
DAFTAR PUSTAKA
Alder iseases of Aquatic Animals. Dalam: Roberts RJ. (Editor). Microbial Diseases of Fish. New York: Academic Press.
Bruno, D. W. Dan B. P. Wood. 1999. Fish diseases and disorders, Volume 3: Viral, bacterial and fungal infections. FRS Marine Laboratory, PO BOX 101, Victoria Road, Aberdeen AB11 9DB, UK. P. 599 – 626.
Mulyani S. 2006. Gambaran Darah Ikan Gurame Osphronemus gouramy yang Terinfeksi Cendaw dan Ilmu Kelautan. Institut Pertanian Bogor.
Nuryati, F. B. P Sari. 2009. Identifikasi Dan Uji Postulat Koch Cendawan Penyebab Penyakit Pada Ikan Gurame. [Jurnal Akuakultur Indonesia] . Vol.8(2):21-27 (2009).
Sharma OP. 1989. Text Book of Fungi. New Delhi: Tata Mc Graw-Hill.
Scoot WW. 1961. Aphanomyces Monograph of the Genus Aphanomyces. Blacksburg. Virginia: Virginia Agricultural Experiment Station.
Susanto. 1999. Pembesaran ikan air tawar. Kanisius. Yogyakarta.
LAMPIRAN