ISOLASI, PENAPISAN, RESPON TUMBUH DAN PROSES
KOLONISASI CENDAWAN MUTUALISTIK AKAR
RIDA OKTORIDA KHASTINI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
@ Hak Cipta milik IPB Tahun 2007
Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
SURAT PERNYATAAN
Saya yang bertanda tangan di bawah ini :
Nama : Rida Oktorida Khastini NIM : G351040151
Program Studi : Biologi (BIO)
dengan ini menyatakan bahwa tesis dengan judul ”Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar” adalah benar-benar merupakan hasil penelitian yang saya lakukan di bawah bimbingan Komisi Pembimbing saya, dan belum pernah diteliti oleh peneliti lain. Penelitian tersebut dilakukan di Laboratorium Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB), IPB dan di Laboratorium Bagian Mikologi, IPB dan Rumah Kaca Pusat Penelitian Kehutanan sejak Februari 2006 sampai dengan Agustus 2007.
Bogor, Oktober 2007
Rida Oktorida Khastini
ISOLASI, PENAPISAN, RESPON TUMBUH DAN PROSES
KOLONISASI CENDAWAN MUTUALISTIK AKAR
RIDA OKTORIDA KHASTINI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Depertemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar
Nama : Rida Oktorida Khastini NIM : G351040151
Disetujui Komisi Pembimbing
Dr. Ir. Nampiah Sukarno Ketua
Dr. Ir. Utut Widyastuti Suharsono M.S Prof. Dr. Yasuyuki Hashidoko
Anggota Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT, yang senantiasa melimpahkan segala karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan.
Tesis yang berjudul Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar merupakan hasil penelitian yang dilakukan di Laboratorium Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB), IPB dan di Laboratorium Bagian Mikologi, Departemen Biologi, FMIPA, IPB dan Rumah Kaca Pusat Penelitian Kehutanan sejak Februari 2006 sampai dengan Agustus 2007.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu penyelesaian karya ilmiah ini, antara lain Dr. Nampiah Sukarno, Dr. Utut Widyastuti Suharsono, dan Prof. Dr. Yasuyuki Hashidoko selaku komisi pembimbing serta Dr. Ir. Aris Tjahjoleksono selaku penguji yang telah memberikan bimbingan, saran, dan perhatian, yang sangat berarti selama penelitian hingga tersusunnya tesis ini. Tak lupa penulis ucapkan terima kasih kepada Dr. Ane Sesma dan Dr. Anne Osbourne dari John Innes Center, Inggris atas plasmid pCambGFP yang diberikan, serta SEAMEO BIOTROP atas sebagian dana penelitian. Penghargaan juga diberikan pada Staf Pusat Penelitian Sumbar Daya Hayati dan Bioteknologi (PPSHB), IPB dan di Laboratorium Bagian Mikologi, IPB dan Rumah Kaca Pusat Penelitian Kehutanan yang telah banyak membantu dalam melaksanakan penelitian dan penyusunan tesis.
Ungkapan terimakasih juga disampaikan kepada Mama, Bapa, Iyu dan Ubhie yang senantiasa memberikan dukungan, kasih sayang dan doa yang tak ternilai. Kepada Ibu Dra. Sri Listyowati M.Si, Ibu Rita Tri Puspitasari M.Si, dan Ibu Dr. Happy Widyastuti, Mba Pepi, Pa Mulya, Pa Edi, Mba Retno, Kanthie, Awie, Riza, Venti dan teman-teman yang tidak dapat penulis sebutkan satu persatu, penulis ucapkan terimakasih atas kebersamaan dan bantuannya.
Semoga tesis ini bermanfaat.
Bogor, Oktober 2007
RIWAYAT HIDUP
Penulis dilahirkan di Majalengka pada tanggal 28 Oktober 1981 dari ayah Khasmuin dan ibu Tatin Sustiatin, S. Pd. Penulis merupakan putri pertama dari dua bersaudara.
Pada tahun 1999 penulis lulus dari SMU Negeri 1 Cilegon dan pada tahun yang sama lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB untuk program sarjana. Penulis memasuki Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam pada tahun yang sama. Setelah lulus sarjana pada tahun 2004, penulis langsung melanjutkan pendidikan ke Sekolah pascasarjana IPB, pada Program Studi Biologi.
ABSTRAK
RIDA OKTORIDA KHASTINI. Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar. Dibimbing oleh Nampiah Sukarno, Utut Widyastuti, dan Yasuyuki Hashidoko.
mikroskop fluoresen dengan filter 512 nm menghasilkan auto fluoresen pada beberapa jaringan akar namun struktur kolonisasi cendawan A. niger-GFP pada akar tanaman masih dapat teramati dan dapat dibedakan dari jaringan akar.
ISOLASI, PENAPISAN, RESPON TUMBUH DAN PROSES
KOLONISASI CENDAWAN MUTUALISTIK AKAR
RIDA OKTORIDA KHASTINI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
@ Hak Cipta milik IPB Tahun 2007
Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
SURAT PERNYATAAN
Saya yang bertanda tangan di bawah ini :
Nama : Rida Oktorida Khastini NIM : G351040151
Program Studi : Biologi (BIO)
dengan ini menyatakan bahwa tesis dengan judul ”Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar” adalah benar-benar merupakan hasil penelitian yang saya lakukan di bawah bimbingan Komisi Pembimbing saya, dan belum pernah diteliti oleh peneliti lain. Penelitian tersebut dilakukan di Laboratorium Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB), IPB dan di Laboratorium Bagian Mikologi, IPB dan Rumah Kaca Pusat Penelitian Kehutanan sejak Februari 2006 sampai dengan Agustus 2007.
Bogor, Oktober 2007
Rida Oktorida Khastini
ISOLASI, PENAPISAN, RESPON TUMBUH DAN PROSES
KOLONISASI CENDAWAN MUTUALISTIK AKAR
RIDA OKTORIDA KHASTINI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Depertemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar
Nama : Rida Oktorida Khastini NIM : G351040151
Disetujui Komisi Pembimbing
Dr. Ir. Nampiah Sukarno Ketua
Dr. Ir. Utut Widyastuti Suharsono M.S Prof. Dr. Yasuyuki Hashidoko
Anggota Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT, yang senantiasa melimpahkan segala karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan.
Tesis yang berjudul Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar merupakan hasil penelitian yang dilakukan di Laboratorium Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB), IPB dan di Laboratorium Bagian Mikologi, Departemen Biologi, FMIPA, IPB dan Rumah Kaca Pusat Penelitian Kehutanan sejak Februari 2006 sampai dengan Agustus 2007.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu penyelesaian karya ilmiah ini, antara lain Dr. Nampiah Sukarno, Dr. Utut Widyastuti Suharsono, dan Prof. Dr. Yasuyuki Hashidoko selaku komisi pembimbing serta Dr. Ir. Aris Tjahjoleksono selaku penguji yang telah memberikan bimbingan, saran, dan perhatian, yang sangat berarti selama penelitian hingga tersusunnya tesis ini. Tak lupa penulis ucapkan terima kasih kepada Dr. Ane Sesma dan Dr. Anne Osbourne dari John Innes Center, Inggris atas plasmid pCambGFP yang diberikan, serta SEAMEO BIOTROP atas sebagian dana penelitian. Penghargaan juga diberikan pada Staf Pusat Penelitian Sumbar Daya Hayati dan Bioteknologi (PPSHB), IPB dan di Laboratorium Bagian Mikologi, IPB dan Rumah Kaca Pusat Penelitian Kehutanan yang telah banyak membantu dalam melaksanakan penelitian dan penyusunan tesis.
Ungkapan terimakasih juga disampaikan kepada Mama, Bapa, Iyu dan Ubhie yang senantiasa memberikan dukungan, kasih sayang dan doa yang tak ternilai. Kepada Ibu Dra. Sri Listyowati M.Si, Ibu Rita Tri Puspitasari M.Si, dan Ibu Dr. Happy Widyastuti, Mba Pepi, Pa Mulya, Pa Edi, Mba Retno, Kanthie, Awie, Riza, Venti dan teman-teman yang tidak dapat penulis sebutkan satu persatu, penulis ucapkan terimakasih atas kebersamaan dan bantuannya.
Semoga tesis ini bermanfaat.
Bogor, Oktober 2007
RIWAYAT HIDUP
Penulis dilahirkan di Majalengka pada tanggal 28 Oktober 1981 dari ayah Khasmuin dan ibu Tatin Sustiatin, S. Pd. Penulis merupakan putri pertama dari dua bersaudara.
Pada tahun 1999 penulis lulus dari SMU Negeri 1 Cilegon dan pada tahun yang sama lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB untuk program sarjana. Penulis memasuki Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam pada tahun yang sama. Setelah lulus sarjana pada tahun 2004, penulis langsung melanjutkan pendidikan ke Sekolah pascasarjana IPB, pada Program Studi Biologi.
ABSTRAK
RIDA OKTORIDA KHASTINI. Isolasi, Penapisan, Respon Tumbuh dan Proses Kolonisasi Cendawan Mutualistik Akar. Dibimbing oleh Nampiah Sukarno, Utut Widyastuti, dan Yasuyuki Hashidoko.
mikroskop fluoresen dengan filter 512 nm menghasilkan auto fluoresen pada beberapa jaringan akar namun struktur kolonisasi cendawan A. niger-GFP pada akar tanaman masih dapat teramati dan dapat dibedakan dari jaringan akar.
ABSTRACT
RIDA OKTORIDA KHASTINI. Isolation, Screening, Growth Responses and Colonization Process of Root Mutualistic Fungi. Supervised by Nampiah Sukarno, Utut Widyastuti and Yasuyuki Hashidoko.
development of penetration structure, followed by development of apresorium in root epidermis, and intercellular mycelium and chlamydospore like structure in the root cortex. Similar colonization process was also observed using GFP marker gene. The root plant also produce auto fluorescence under 515 nm wavelength filter that made the complication in the observation of fungal colonization process using GFP gene, but the fungal structure within the root was still able to be discriminated from that of root cells.
DAFTAR ISI A.2 Cendawan mutualistik akar non mikoriza... 6 B. Analisis proses kolonisasi dan peningkatan pertumbuhan oleh
endofit akar ... 7 A. Isolasi dan penapisan cendawan mutualistik akar... 12 A.1. Cendawan mutualistik akar non mikoriza ... 12 A.2. Cendawan mikoriza arbuskula (CMA) ... 13 B. Analisis respon tumbuh tanaman inang yang diinokulasi cendawan
mutualistik akar ... 13 C. Analisis proses kolonisasi cendawan mutualistik akar non mikoriza .. 15 C.1. Metode pewarnaan biru tripan ... 15 C.2. Penggunaan gen penanda GFP (Green Fluorescent Protein) .... 15 C.2.1 Produksi Speroplas Cendawan (Hasiba 1992) ... 16 C.2.2 Introduksi Gen Fluoresen Hijau (GFP) pada cendawan
mutualistik akar Aspergilus niger... 16 C.2.2.1 Isolasi plasmid pCamb-GFP... 16 C.2.2.2 Introduksi gen GFP... 18 C.2.3 Uji integrasi dan stabilitas gen GFP di dalam genom
cendawan ... 18 C.2.3.1 Isolasi DNA Genom Cendawan ... 19 C.2.3.2 Amplifikasi DNA Cendawan Aspergillus-GFP... 20
Hasil Pengamatan ... 21 A. Isolasi dan penapisan cendawan mutualistik akar... 21 B. Analisis respon tumbuh tanaman inang yang diinokulasi cendawan
mutualistik akar ... 23 B.1 Pengaruh isolat terpilih cendawan mutualistik akar terhadap
pertumbuhan berbagai tanaman inang... 23 B.1.1 Uji spesifisititas respon tumbuh dan kolonisasi ... 23 B.1.2 Pengaruh inokulasi ganda A. niger 1 dan Glomus sp.1 ... 25 B.2 Pengaruh cendawan mutualistik akar non mikoriza terhadap
penyerapan fosfat (P) tanaman inang ... 26 C. Analisis proses kolonisasi cendawan mutualistik akar non mikoriza... 27 C.1 Metode pewarnaan biru tripan ... 27 C.2. Penggunaan gen penanda GFP (Green Fluorescent Protein)... 28 Pembahasan... 33 A. Isolasi dan penapisan cendawan mutualistik akar... 33 B. Analisis respon tumbuh tanaman inang yang diinokulasi cendawan
mutualistik akar ... 36 C. Analisis proses kolonisasi cendawan mutualistik akar... 38 C.1 Metode pewarnaan biru tripan... 38 C.2. Penggunaan gen penanda GFP (Green Fluorescent Protein)... 39
DAFTAR TABEL
Halaman
1 Cendawan yang berhasil diisolasi dari rizosfir dan rizoplan tanaman karet dan tumbuhan pada tanah gambut. ... 21
2 Penapisan isolat-isolat cendawan pada tanaman Centrosema
pubescens ... 22 3 Respon tumbuh berbagai tanaman inang yang diinokulasi cendawan
mutualistik akar pada P 50%... 23 3 Pengaruh perlakuan P terhadap pertumbuhan berbagai tanaman
inang yang diinokulasi A. niger 1 ... 26
DAFTAR GAMBAR
Halaman
1 Struktur taksonomi secara umum pada CMA dan kaitannya dengan cendawan lain berdasarkan urutan gen SSU rRNA (Walker & Schüßler 2004) ... 4 2 Bagan alur penelitian ... 11 3 Peta plasmid pCamb-GFP (Sesma & Osbourne 2004) ... 16 4 Gambar 4 Parameter respon tumbuh berbagai tanaman
inang yang diinokulasi cendawan mutualistik akar pada P 50% ... 24 5 Struktur kolonisasi Glomus sp. 1 pada akar Brassica sp. pada
perbesaran 10 x. a. apresorium, b. hifa internal ... 27 6 Pengaruh inokulasi ganda cendawan mutualistik akar mikoriza dan
non mikoriza pada Centrosema pubescen umur 3 bulan pada taraf P 50%. ... ... 27 7 Struktur kolonisasi fungi A. niger 1 di dalam akar pada umur 6
9 Speroplas segar cendawan A. niger setelah pemurnian dengan sistem dua fase sukrosa dan manitol. a. perbesaran 10x, b. perbesaran 40x ... 29 10 Persentase perkecambahan protoplas ... 30 11 Gen GFP diekspresikan secara konstitutif di seluruh struktur
cendawan pada perbesaran 40x. a. struktur aseksual (kepala konidia), b. miselium... 31 12 Miselium cendawan transgenik pada berbagai subkultur (generasi).
(a) generasi T0, (b) generasi T1, dan (c) generasi T2. ... 31 13 Hasil amplifikasi gen ... 32 14 Struktur kolonisasi A. niger transgenik di dalam akar. a. hifa
interseluler, b. Struktur klamidospora... 33
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Peningkatan produksi pertanian, perkebunan dan kehutanan dapat dilakukan melalui proses intensifikasi seperti penggunaan bibit unggul, proses pemupukan dan pemberantasan hama yang terpadu. Proses tersebut pada umumnya dilakukan di daerah yang wilayah pertaniannya semakin sempit akibat diubah menjadi areal pemukiman dan areal industri seperti pulau Jawa. Proses ekstensifikasi merupakan cara alternatif yang dapat dilakukan, namun terkendala oleh kondisi lahan di Indonesia yang umumnya bersifat marjinal. Jenis tanah ini mendominasi lahan kering yang ada di Sumatera, Kalimantan dan Irian Jaya dengan penyebarannya yaitu 10.04 juta ha di Kalimantan Timur; 7.62 juta ha di Irian Jaya; 5.71 juta ha di Kalimantan Barat; 4.81 juta ha di Kalimantan Tengah dan 2.27 juta ha di Riau (Puslitbang Tanah 1999). Kondisi lahan tersebut menyebabkan terhambatnya pertumbuhan tanaman. Hal ini disebabkan oleh kebutuhan unsur-unsur hara makro yang berada di dalam tanah dan dibutuhkan oleh tanaman berada dalam bentuk terfiksasi oleh liat atau unsur lain. Salah satu faktor pembatas pertumbuhan tanaman pada tanah marjinal ialah terbatasnya kemampuan serapan hara P oleh tanaman akibat rendahnya kandungan unsur tersebut di dalam tanah. Kondisi tersebut salah satunya dapat diatasi dengan pemberian pemupukan.
kemarau yang panjang maka efisiensi pemupukan tersebut akan lebih rendah lagi. Akibat dampak yang ditimbulkan tersebut maka petani mulai menggunakan pupuk hayati.
Latar belakang penggunaan pupuk hayati di Indonesia diantaranya disebabkan oleh tumbuhnya kesadaran masyarakat terhadap potensi pencemaran lingkungan melalui penggunaan pupuk kimiawi yang berlebihan. Harga pupuk kimiawi melambung tinggi akibat adanya krisis ekonomi yang terjadi pada tahun 1997 dan dicabutnya subsidi pupuk oleh pemerintah pada tahun 1998. Selain itu adanya program pemerintah yaitu Go Organik pada tahun 2010 turut meningkatkan minat masyarakat untuk menggunakan pupuk hayati.
Mikroorganisme termasuk cendawan mempunyai potensi yang dapat dikembangkan sebagai pupuk hayati. Cendawan yang dapat digunakan sebagai pupuk hayati diantaranya ialah cendawan mutualistik akar. Cendawan mutualistik akar terdiri dari cendawan mikoriza dan non mikoriza. Cendawan yang termasuk ke dalam simbion mutualistik akar non mikoriza diantaranya ialah Aspergillus dan Piriformospora indica (Varma et al. 1999). Sebagai pupuk hayati, cendawan mutualistik akar non mikoriza mempunyai banyak keunggulan dibandingkan dengan cendawan mikoriza. Cendawan tersebut umumnya tumbuh lebih cepat, dapat diperbanyak dalam media buatan, mengkolonisasi hampir semua jenis tumbuhan dan dapat mengkolonisasi hampir semua jenis tumbuhan termasuk tumbuhan bukan inang mikoriza (non host) (Sukarno N dan Suharsono UW, data tidak dipublikasikan). Walaupun cendawan mutualistik non mikoriza mempunyai banyak keunggulan dibandingkan dengan cendawan mikoriza, namun penelitian terhadap cendawan mutualistik non mikoriza yang berhubungan dengan respon tumbuh tanaman inang relatif baru dilakukan. Selain itu, proses kolonisasi cendawan tersebut juga belum banyak dipelajari (Varma et al. 1999).
dan memonitor dinamika proses kolonisasi yang terjadi di dalam jaringan hidup karena gen ini dapat berpendar dan dapat diamati langsung tanpa memerlukan protein substrat ataupun kofaktor (Chalfie et al. 1994).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi dan menganalisis cendawan mutualistik akar potensial termasuk tahapan kolonisasi menggunakan pewarnaan akar dan gen GFP dan untuk pengembangan pupuk hayati yang handal.
Hipotesis
TINJAUAN PUSTAKA
A. Cendawan Mutualistik Akar
Cendawan mutualistik akar merupakan mikroorganisme yang berpotensi untuk digunakan sebagai pupuk hayati. Cendawan ini terdiri dari 2 kelompok yaitu cendawan mikoriza dan cendawan non mikoriza. Cendawan mikoriza terdiri dari beberapa kelompok, diantaranya ialah cendawan mikoriza arbuskula (CMA) yang umumnya bersimbiosis dengan tanaman pertanian, perkebunan dan hutan tanaman industri (HTI)
A. 1 Cendawan Mikoriza Arbuskula (CMA)
Mayoritas tanaman dalam kondisi alamiah berasosiasi dengan cendawan mikoriza (Smith & Read 1997) dan cendawan mikoriza arbuskula merupakan cendawan mikoriza yang paling umum dijumpai karena berasosiasi dengan sebagian besar tumbuhan di dunia.
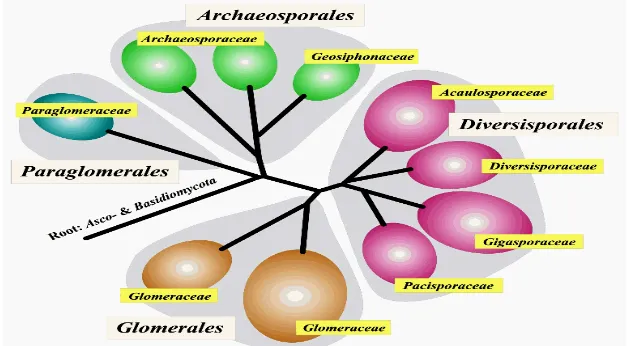
Menurut klasifikasi dari Morton & Benny (1990) cendawan mikoriza arbuskula (CMA) merupakan cendawan simbion obligat, mempunyai hifa aseptat, dan reproduksinya dilakukan secara aseksual. CMA digolongkan dalam filum Zygomycota kelas Zygomycetes dengan ordo Glomales. Walker & Schüβler (2004) menggolongkan CMA ke dalam filum baru yaitu Glomeromycota berdasarkan urutan gen SSU rRNA (Gambar 1).
Filum ini mempunyai Kelas Glomeromycetes dengan 4 ordo, yaitu Glomerales, Diversisporales, Archaeosporales, dan Paraglomerales. Ordo Glomeralesdengan famili Glomeraceae. Ordo Diversisporalesterdiri dari 4 famili, yaitu Gigasporaceae, Diversisporaceae, Acaulosporaceae dan Pacisporaceae. Ordo Archaeosporales terdiri dari 2 famili, yaitu Archaeosporaceae dan Geosiphonaceae. Ordo Paraglomerales mempunyai famili Paraglomeraceae (Walker & Schüßler 2004).
Keuntungan yang diperoleh tanaman dengan adanya simbiosis dengan CMA yaitu tanaman dapat dengan mudah memperoleh unsur hara seperti fosfat (P). Fosfat adalah salah satu unsur hara esensial yang diperlukan dalam jumlah relatif banyak oleh tumbuhan, tetapi ketersediaannya pada tanah-tanah tertentu terbatas, sehingga seringkali menjadi salah satu pembatas utama dalam peningkatan produktivitas tumbuhan. Smith et al. (2003) mengemukakan bahwa CMA dan simbiosisnya merupakan penyedia utama P yang diperlukan oleh tanaman. Kemampuan hifa eksternal CMA mengeksploitasi P tanah yang berlokasi di sekitar daerah deplesi P akar sehingga mengatasi keterbatasan difusi fosfat anorganik yang lambat dalam tanah. Adanya hifa eksternal yang berukuran lebih kecil (1/10) dibandingkan dengan akar tanaman lebih cocok untuk mengeksplorasi P dan air yang terdapat di dalam ruang pori mikro tanah yang tidak dapat dicapai oleh rambut akar, selain itu hifa juga dapat menyerap air. Orcutt & Nielsen (2000) mengemukakan bahwa CMA mampu mengubah lingkungan organik rhizosfer secara kimia melalui pelepasan asam organik, peningkatan aktivitas fosfatase dan peningkatan produksi fitohormon yang dapat mengubah fenotipe akar sehingga meningkatkan kapasitas penyerapan total hara seperti P.
Struktur infeksi CMA dimulai dari terbentuknya miselia aseptat dari propagul cendawan yang berupa spora, miselia dan akar terkolonisasi yang tumbuh di daerah rizosfer perakaran. Miselia selanjutnya melakukan kontak dengan permukaan akar dan melakukan penetrasi pada epidermis atau rambut akar dan membentuk struktur apresorium. Tahapan berikutnya ialah terbentuknya hifa inter dan intraseluler di daerah korteks akar.
berperan dalam transfer nutrisi antara cendawan dan tumbuhan. Vesikula dibentuk secara intra dan interseluler. Struktur ini berfungsi sebagai cadangan makanan bagi cendawan. Hifa yang tumbuh di dalam akar disebut struktur intraradikal, sedangkan yang tumbuh di luar akar tanaman dan mengeksplorasi media tumbuh disebut struktur ekstraradikal. Struktur ekstraradikal terdiri dari miselia, spora, dan hifa pelengkap (auxiliary cell). Struktur ekstraradikal tumbuh menjauhi akar, mengeksplorasi rizosfer, dan melakukan penyerapan air dan nutrisi.
A.2 Cendawan Mutualistik Akar Non Mikoriza
Berbagai jenis cendawan termasuk cendawan endofit diketahui dapat berasosiasi dengan akar tanaman membentuk simbiosis mutualisme. Cendawan endofit ialah cendawan yang sebagian besar atau seluruh struktur hidupnya berada dalam jaringan tanaman, dan dalam asosiasinya tidak menimbulkan gejala patogen (Baldani et al. 1998, Petrini 1991, Wennstrom 1994, Wilson 1995). Cendawan endofit yang berasal dari dalam tanaman dan dapat meningkatkan pertumbuhan tanaman inang disebut sebagai cendawan mutualistik akar non mikoriza. Jenis cendawan ini berperan dalam kesuburan tumbuhan inangnya karena dapat berfungsi sebagai pupuk hayati, pengendali hayati hama dan penyakit, dan mendekomposisi bahan organik (Saeed et al. 2002, Zareen et al. 2001, Rubini et al. 2005).
Pengetahuan tentang cendawan mutualistik akar yang dapat meningkatkan pertumbuhan tumbuhan inang sampai saat ini sangat rendah dan sebagian besar penelitian terhadap cendawan yang mengkolonisasi akar dilakukan terhadap cendawan mikoriza (Varma et al. 1999).
Varma et al. (1999) dalam penelitiannya tidak mempelajari struktur simbiosis lebih lanjut yang terjadi diantara ke 2 simbion pada tingkat selular, sehingga ada atau tidaknya invaginasi plasma membran sel inang yang memungkinkan terjadinya transfer nutrisi seperti pada simbiosis mutualisme mikoriza arbuskula tidak dapat diketahui.
B. Analisis Proses Kolonisasi dan Peningkatan Pertumbuhan oleh Cendawan Endofit Akar
Pertumbuhan cendawan pada akar tanaman inang dapat dipelajari dengan menggunakan 2 metode yaitu metode pewarnaan cendawan pada akar dan menggunakan gen penanda khusus diantaranya GFP (Green Fluorescent Protein).
B.1 Pewarnaan Cendawan pada Akar
Metode pewarnaan akar merupakan metode yang memanfaatkan zat pewarna (staining) untuk mewarnai jaringan cendawan sehingga struktur cendawan pada akar tanaman dapat dikenali. Terdapat dua macam metode pewarnaan yaitu non vital staining dan vital staining.
Pada metode non vital staining, pewarna yang digunakan diantaranya ialah biru tripan dan chlorazol black E yang akan bereaksi dengan dinding sel cendawan baik yang hidup maupun yang mati, sehingga tidak dapat membedakan jaringan cendawan yang hidup dan yang mati. Selain itu metode ini tidak dapat digunakan untuk mengenali cendawan yang bersimbiosis dalam sistem yang hidup.
sama halnya dengan metode non vital staining. Hal ini disebabkan pada metode tersebut, perlu adanya preparasi yang akan merusak sistem simbiosis tersebut.
B.2 Gen Penanda Khusus
Gen penanda seleksi seperti GFP telah banyak digunakan dalam berbagai penelitian pada sejumlah besar organisme baik pada prokariot maupun eukariot (Chalfie et al. 1994, Cubbit et al. 1995). Menurut Lorang et al. (2001) gen GFP dapat digunakan sebagai alat untuk menganalisa interaksi yang terjadi antara cendawan dan tanaman. Penggunaan gen penanda GFP pada cendawan telah banyak dilakukan, misalnya pada Candida albicans (Cormack et al. 1997) digunakan untuk membedakan protein yang berhubungan dengan sifat patogenisitas yang dihasilkan oleh tipe liar dan mutan pada sel inang. Gen GFP juga digunakan untuk mempelajari aliran sitoplasma yang berperan dalam pertumbuhan dan pertunasan pada khamir (Niedenthal et al. 1996). Pada cendawan penyebab penyakit blas pada padi, gen GFP digunakan sebagai gen penunjuk (reporter gene) untuk mempelajari virulensi dari cendawan tersebut (Xu et al. 2002). Gen GFP digunakan untuk mempelajari proses kolonisasi Aspergillus fumigatus sebagai cendawan patogen manusia (Langfelder et al. 2001), Ustilago maydis sebagai cendawan patogen pada tanaman jagung (Spelling 1996), Aspergillus flavus sebagai cendawan perusak biji-bijian dan penghasil aflatoksin yang disimpan di dalam gudang (Du et al. 1999). Gen GFP juga telah dipakai pada cendawan yang berpotensi dalam bidang industri seperti pada Aspergillus niger untuk memonitor sekresi enzim glukoamilase dan selulase (Gorgon et al. 2000), dan pada Penicillium griseoroseum untuk deteksi produksi enzim pektinolitik yang diperlukan industri tekstil dan makanan (Lopes et al. 2004).
Gen GFP ialah gen yang berasal dari ubur-ubur Aequorea victoria. GFP merupakan polipeptida dengan 238 asam amino, berukuran 27-kDa menyerap cahaya pada panjang gelombang maksimum 395 dan 475 nm serta memancarkan cahaya pada panjang gelombang maksimum 508 nm. Gen GFP tipe liar yang berasal dari A. victoria tidak efisien ditranslasikan pada genom cendawan, tanaman maupun hewan (Spelling 1996, Cormack 1997, Ferna´ndez-A´balos
dapat meningkatkan aktivitas fluoresen dan mengurangi photobleaching (Cubbit 1995, Crameri 1996, Siemering 1996).Beberapa jenis GFP mengalami modifikasi seperti sGFP yaitu dengan cara substitusi serin menjadi treonin pada asam amino ke-65 (S65T) dapat mengekspresikan protein dan dapat ditranslokasikan pada genom eukariot.
Beberapa keuntungan gen GFP sebagai penanda seleksi terutama pada sel hidup dibandingkan penanda lainnya ialah seperti β-glucoronidase (GUS), chloramphenicol acetyltransferase (CAT), β- galactosidase (LacZ) atau luciferase (LUC). Keuntungan tersebut meliputi stabilitas (sedikit atau tanpa adanya photobleching), tidak memerlukan kofaktor atau substrat untuk aktifitasnya, dapat berpendar dan dapat diamati langsung tanpa memerlukan protein substrat ataupun kofaktor (Chalfie etal. 1994).
Gen GFP dapat diintegrasikan ke dalam genom cendawan melalui beberapa cara yaitu elektroforasi, penggunaan lithium asetat dan pembentukan speroplas. Menurut Riach & Kinghorn (1996), keberhasilan transformasi gen pada cendawan ditentukan oleh beberapa faktor yaitu produksi speroplas dan regenerasinya, promotor dan vektor yang digunakan dalam proses tansformasi dan stabilitas integrasi gen tersebut.
Menurut Hashiba (1992) speroplas cendawan dapat diproduksi dengan mengggunakan enzim digesti. Tingkat efektifitas metode ini dipengaruhi oleh tingkat pertumbuhan cendawan, waktu inkubasi dan jenis enzim yang digunakan.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Februari 2006 sampai April 2007 di Laboratorium dan rumah kaca bagian Mikologi Gunung Gede, Departemen Biologi FMIPA IPB dan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB.
Bahan
Bahan yang digunakan ialah sampel akar tanaman dan tanah yang berasal dari lahan gambut Kalimantan Tengah dan kebun karet Jasinga Bogor, Jawa Barat. Pengujian respon tumbuh tanaman inang oleh cendawan mutualistik akar menggunakan tanaman pertanian, kehutanan, perkebunan dan tanaman obat. Pupuk Johnson digunakan sebagai perlakuan berbagai taraf P. Pewarna biru tripan dan gen GFP digunakan untuk analisis tahapan kolonisasi dan plasmid pCamb-GFP digunakan sebagai vektor pembawa GFP.
Analisis molekular menggunakan primer spesifik sGFPf (5’-CGACGTAAACGGCCACAAGT-3’), sGFPr (5’-GTCCATGCCGTGAGTGATCC -3’), Nosf (5’-GAATCCTGTTGCCGGTCTTGCG-3’), dan Nosr (5’-CGGGACTCTAATCATAAAAACC-3’), digunakan untuk mengidentifikasi keberadaan gen penyandi sGFP dan terminator Nos dari genom cendawan transgenik Aspergillus-GFP serta primer Ubqf (5’-CCAGGACAAGATGATGTGCC-3’) dan Ubqr(5’-AAGAAGCTGAAGCATCCAGC -3’) digunakan untuk mengamplifikasi gen penyandi ubiquitin sebagai kontrol internal.
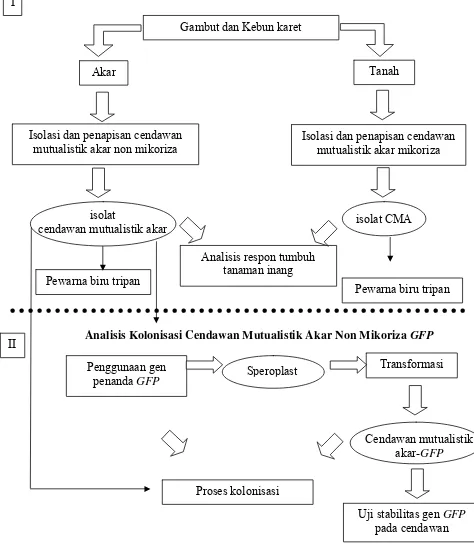
Metode Penelitian
Secara garis besar penelitian ini dibagi menjadi 2 bagian (Gambar 2) yaitu : 1. Isolasi dan penapisan cendawan mutualistik akar mikoriza dan non
2. Analisis proses kolonisasi cendawan mutualistik akar dengan menggunakan metode pewarna biru tripan dan gen penanda .
I
Gambut dan Kebun karet
Tanah Akar
Isolasi dan penapisan cendawan mutualistik akar mikoriza
Gambar 2 Bagan alur penelitian Analisis respon tumbuh
tanaman inang isolat
cendawan mutualistik akar isolat CMA
Transformasi
Cendawan mutualistik akar-GFP Speroplast
Proses kolonisasi
Analisis Kolonisasi Cendawan Mutualistik Akar Non Mikoriza GFP
Pewarna biru tripan
Penggunaan gen penanda GFP Pewarna biru tripan
Isolasi dan penapisan cendawan mutualistik akar non mikoriza
II
A. Isolasi dan Penapisan Cendawan Mutualistik Akar
Cendawan mutualistik akar non mikoriza diisolasi dari akar tanaman, sedangkan cendawan mikoriza diisolasi dari tanah rhizosfer yang berasal dari tanah gambut Kalimantan Tengah dan tanaman karet Jasinga, Bogor. Penapisan cendawan mutualistik akar dilakukan dengan menggunakan tanaman Centrosema pubescens sehingga diperoleh cendawan mutualistik akar mikoriza dan non mikoriza yang memberikan respon terbaik untuk dilakukan analisis selanjutnya.
A.1. Cendawan Mutualistik Akar Non Mikoriza
Isolasi cendawan mutualistik akar non mikoriza dilakukan dengan metode sebagai berikut: akar tanaman dicuci menggunakan air dan dipotong dengan ukuran panjang 1 cm. Akar kemudian disterilisasi permukaannya menggunakan alkohol 70% (v/v) selama 1 menit dan NaOCl 0.1% (v/v) selama 15 menit. Akar kemudian dikeringkan dengan menggunakan tissue steril. Potongan akar ditempatkan dalam media Potato Dextrose Agar (PDA) yang mengandung antibiotik kemisetin 500 mg/l dan rose bengal 1% (b/v). Media tersebut diinkubasikan pada suhu ruang selama 7 hari. Miselium cendawan yang tumbuh selanjutnya dimurnikan sampai didapatkan isolat murni.
Cendawan yang berhasil diisolasi selanjutnya diuji pada tanaman Centrosema pubescens untuk menentukan sifat simbiosisnya. Isolat cendawan yang tidak menyebabkan gejala penyakit pada tanaman inang dan meningkatkan pertumbuhan akan digolongkan sebagai cendawan endofit mutualistik sedangkan yang menyebabkan penyakit pada tanaman akan digolongkan sebagai cendawan parasit.
A.2. Cendawan Mikoriza Arbuskula (CMA)
Cendawan mikoriza arbuskula diisolasi menggunakan metode penyuburan (trapping). Selanjutnya spora tunggal dari campuran spora yang berasal dari biakan pot penyuburan kemudian ditumbuhkan pada akar tanaman Centrosema pubescens dan dipelihara di dalam rumah kaca selama 3 bulan dengan pemberian pupuk Johnson yang mengandung konsentrasi P setengah dosis. Setelah 3 bulan pemeliharaan dilakukan analisa biakan pot dengan menghitung jumlah spora, identifikasi spora dan persentase kolonisasi CMA. Spora didapatkan dengan cara menyaring media dengan saringan bertingkat (Brundett et al. 1994). Spora yang baik dipilih dan diletakkan pada kaca obyek dengan media PVLG untuk selanjutnya diidentifikasi (Schenck & Perez 1990).
Analisis kolonisasi cendawan pada akar dilakukan setelah proses pewarnaan dengan biru tripan (Brundrett et al. 1994).) Secara garis besar teknik pewarnaan akar dilakukan dengan cara sebagai berikut: akar dicuci, direndam dalam KOH 10% (v/v), kemudian KOH dibuang, dan dicuci dengan air mengalir. Selanjutnya direndam dalam HCl 2% (v/v) selama 12 jam. Setelah itu HCl dibuang, dan terakhir akar diwarnai dengan pewarna biru tripan. Akar selanjutnya disimpan dalam asam gliserol 50% (v/v) sampai dilakukan pengamatan dan penghitungan persentase kolonisasi cendawan pada akar
B. Analisis Respon Tumbuh Tanaman Inang yang Diinokulasi Cendawan Mutualistik Akar
Cendawan mutualistik akar mikoriza dan non mikoriza yang memberikan respon terbaik diinokulasikan pada berbagai jenis tanaman yaitu tanaman pertanian (Oryza sativa, dan Zea mays), kehutanan (Acasia sp. dan Pharaserianthes falcataria), perkebunan (Theobroma cacao), tanaman obat (Phaleria macrocarpa), dan tanaman bukan inang mikoriza (Brassica sp.).
Isolat cendawan mutualistik akar mikoriza diperbanyak dengan menggunakan metode biakan pot. Hasil perbanyakan inokulum digunakan untuk menginokulasi tanaman uji tersebut diatas. Sebanyak 400 g inokulum berupa akar tanaman inang, spora dan miselia cendawan mikoriza arbuskula pada biakan pot dicampurkan dengan medium zeolit sebanyak 2 kg. Selanjutnya masing-masing ditumbuhkan secara terpisah pada media tersebut.
Tanaman Oryza sativa, Zea mays, dan Brassica sp., dipelihara selama 3 bulan sedangkan tanaman Theobroma caccao, Phaleria macrocarpa, Acasia sp., dan Pharaserianthes falcataria dipelihara selama 6 bulan. Respon pertumbuhan tanaman diamati dan dianalisis. Parameter yang diamati yaitu tinggi tajuk, bobot basah dan bobot kering tajuk, bobot basah dan bobot kering akar tanaman serta persentase kolonisasi cendawan.
Pengaruh tunggal isolat cendawan mutualistik akar non mikoriza dan mikoriza terbaik serta kombinasi kedua isolat tersebut secara bersamaan diuji pada tanaman Centrosema pubescens. Miselium cendawan mutualistik akar non mikoriza sebanyak 50 g diinokulasikan pada daerah perakaran tanaman Centrosema pubescens yang ditanam di dalam media zeolit. Inokulum CMA dicampurkan dalam media zeolit dan digunakan untuk pertumbuhan Centrosema pubescens. Pengaruh kombinasi kedua isolat secara bersamaan dilakukan dengan cara menginokulasi terlebih dahulu perakaran tanaman Centrosema pubescens dengan inokulum CMA. Setelah 2 minggu inokulasi CMA, tanaman tersebut diinokulasi miselium cendawan mutualistik akar non mikoriza pada daerah perakaran tanaman. Tanaman dipelihara selama 3 bulan di dalam rumah kaca.
dan bobot kering tajuk, bobot basah dan bobot kering akar tanaman serta persen kolonisasi.
Percobaan menggunakan rancangan acak lengkap (RAL) dan menggunakan 5 ulangan. Data selanjutnya diolah menggunakan program SAS versi 6.12 dan diuji lanjut menggunakan uji Perbandingan Ganda Duncan. Model linier rancangan penelitian adalah sebagai berikut (Mattjik & Sumertajaya 2000):
Yijkl=μ+αi+βj+ (αβ)ij+δijk
Ket:
Yijkl : nilai respon jenis mikoriza taraf ke-i, P taraf ke-j, ulangan ke-k dan waktu
pengamatan ke-k μ : rataan umum
(αβ)ij: pengaruh interaksi jenis mikoriza dengan P
βj : pengaruh P taraf ke-j
δijk : komponen acak perlakuan
C. Analisis Proses Kolonisasi Cendawan Mutualistik Akar Non Mikoriza C.1. Metode Pewarnaan Biru Tripan
Sebanyak 107 sel/ml suspensi spora cendawan mutualistik akar non mikoriza diinokulasikan pada daerah perakaran tanaman Centrosema pubescens berumur 1 MST yang ditumbuhkan secara hidroponik di dalam botol tertutup. Larutan Johnson dengan konsentrasi P 50% digunakan sebagai unsur hara pada sistem hidroponik. Tanaman dipelihara selama 3 bulan dengan penggantian larutan hara dilakukan setiap 2 minggu.
Kolonisasi dan struktur infeksi cendawan diamati dengan mewarnai akar tanaman dengan menggunakan metode pewarnaan biru tripan (Kormanik & McGraw 1982). Akar tanaman dipotong sebesar 1 cm kemudian dicuci dengan menggunakan air mengalir. Akar kemudian direndam dalam larutan KOH 10% (v/v) untuk menghilangkan isi sel akar. Akar dicuci dengan menggunakan akuades kemudian direndam dalam larutan HCl 1% (v/v). Akar diwarnai dengan pewarna biru tripan dan disimpan dalam larutan gliserol asam. Kolonisasi cendawan diamati dan dihitung dibawah mikroskop.
C.2. Penggunaan gen penanda GFP (Green Fluorescent Protein)
speroplas (Hasiba 1992), introduksi gen GFP (Wymeleneberg et al. 1997), uji integrasi dan stabilitas gen GFP di dalam genom cendawan.
C.2.1 Produksi Speroplas Cendawan (Hasiba 1992)
Produksi speroplas cendawan dalam penelitian ini dilakukan dengan menggunakan metode Hasiba (1992). Miselia Aspergillus niger ditumbuhkan dalam media cair PD dengan konsentrasi sukrosa 2% (b/v). Selanjutnya kultur diinkubasi pada suhu ruang selama 24 jam, kemudian miselia dipanen dengan cara disaring dan selanjutnya digunakan untuk produksi speroplas. Sebanyak 1 g miselia yang berumur 24 jam dimasukkan ke dalam 25 ml larutan campuran enzim selulase dan “maserozyme” yang mengandung stabiliser osmotik manitol 0.6 M pada 100 ml Erlenmeyer. Inkubasi dilakukan pada suhu 37 oC dengan agitasi 80 rpm selama 3 jam. Suspensi speroplas dimurnikan dengan menggunakan 4 ml larutan sukrosa dalam Hepes-KOH pH 7.0. Speroplas yang murni kemudian digunakan untuk proses transformasi yaitu integrasi gen GFP pada genom cendawan mutualistik akar Aspergillus niger .
C.2.2 Introduksi Gen GFP pada Cendawan Mutualistik Akar Aspergilus niger
C.2.2.1 Isolasi Plasmid pCamb-GFP
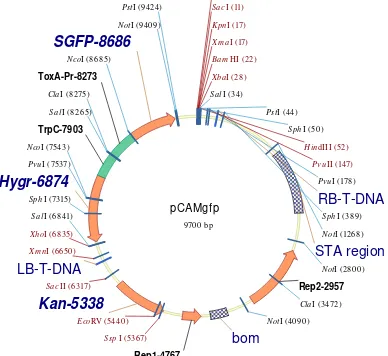
Plasmid yang digunakan dalam penelitian ini ialah plasmid pCamb-GFP yang memiliki promotor ToxA dan terminator Nos.
Gambar 3 Peta plasmid pCamb-GFP (Sesma & Osbourne 2004)
Plasmid tersebut memiliki penanda seleksi berupa resistensi terhadap antibiotik higromisin (Sesma & Osbourne 2004). Plasmid pCamb-GFP yang
digunakan dalam penelitian ini diperoleh dari Dr. Anne Sesma dan Dr. Ane Osbourne (John Innes Centre. U.K). Peta plasmid pCamb-GFP dapat dilihat pada Gambar 3.
Isolasi plasmid dilakukan dengan dengan menggunakan metode Suharsono et al. (2000) dengan tahapan sebagai berikut. Bakteri E. coli DH 10 B yang mengandung plasmid pCamb-GFP dibiakkan dalam medium LB yang mengandung 50 μg/ml antibiotik kanamisin pada suhu 37 oC di pengocok (shaker) dengan kecepatan 200-300 rpm selama semalam. Sel bakteri diendapkan dengan sentrifugasi pada kecepatan 4000 rpm, 4 oC selama 20 menit. Cairan atau supernatan dibuang dan endapan bakteri yang berwarna putih kekuningan di dasar tabung disuspensikan dengan 2 ml buffer suspensi sel (50 mM Tris-HCl, pH 7.5, 10 mM EDTA) kemudian divorteks untuk memudahkan bakteri tersuspensi. Setelah bakteri tersuspensi dengan baik, kemudian dilisis dengan cara penambahan 2 ml buffer lisis (0.2 M NaOH, 1% (b/v) SDS). Pencampuran buffer lisis dilakukan dengan membolak-balik effendorf sebanyak 8x dan dibiarkan selama 1-2 menit. Lisis bakteri ditandai dengan terbentuknya lendir. Setelah bakteri lisis, campuran suspensi ditambah 2 ml bufer netralisasi (1.32 M sodium asetat pH 4.8) dan dibolak balik hingga buffer tercampur merata. Campuran suspensi disentrifugasi (Jouan BR-4i) pada suhu 40 oC kecepatan 3000 rpm selama 20 menit. Sentrifugasi campuran suspensi menjadi dua bagian. Bagian bawah merupakan gumpalam sisa-sisa bakteri yang telah lisis sedangkan bagian atas ialah cairan jernih yang terdapat pada bagian atas yang mengandung DNA plasmid. Cairan bagian atas selanjutnya dipindahkan ke dalam tabung baru untuk pemurnian plasmid.
5.2, dan 2 volume etanol absolut lalu diinkubasikan pada suhu -20 oC selama 2 jam. DNA plasmid diendapkan dengan sentrifugasi pada kecepatan 10.000 rpm pada suhu 4 oC selama 20 menit. Setelah sentrifugasi cairan dibuang dan endapan dibilas dengan etanol 70% (v/v) dan di sentrifugasikan pada 10.000 rpm, suhu 4
o
C selama 10 menit, cairan dibuang dan endapan dikeringkan dengan vakum. DNA disuspensikan di dalam 50 µl TE 1x. Kuantitas plasmid diuji dengan menggunakan elektroforesis gel agarosa.
C.2.2.2 Introduksi Gen GFP
Introduksi gen dilakukan berdasarkan metode Wymeleneberg et al. (1997). Secara garis besar metode tersebut ialah sebagai berikut: 200 µl speroplast yang setara dengan 1.9 x 105 sel speroplas dicampur dengan plasmid pCamb-GFP sebanyak 200 µl yang setara dengan 10 µg plasmid pada 15 ml tabung Falcon. Kemudian ditambahkan ke dalam tabung larutan PEG (25% PEG 8000, Sigma) 50 µl, 50 mM CaCl, 10 mM Tris HCl pH 7.5 ditambahkan ke dalam tabung, dan diinkubasi dalam es selama 2 menit. Selanjutnya ke dalam tabung ditambahkan 2 ml larutan PEG yang dicampur secara perlahan dan diinkubasi pada suhu ruang selama 5 menit. Selanjutnya larutan 4 ml 0.7 KCl, dan 50 mM CaCl2 ditambahkan
ke dalam tabung. Sebanyak 50 µl larutan yang berasal dari tabung Falcon (larutan transforman) tersebut disebar ke dalam cawan yang berisi media PDA yang mengandung 20% (v/v) sukrosa dan 200 µg/ml higromisin.
C.2.3 Uji Integrasi dan Stabilitas Gen GFP di dalam Genom cendawan Cendawan transforman yang mengekspresikan gen GFP diseleksi lebih lanjut dengan cara mengamati pertumbuhan speroplas pada media PDA yang mengandung antibiotik higromisin dan sukrosa sebesar 20% (b/v). Speroplas yang tumbuh membentuk miselia pada media tersebut diseleksi lebih lanjut menggunakan sinar biru 515 nm pada mikroskop fluoresen (Lorang 2001). Penapisan untuk integrasi gen dilakukan dengan menggunakan subkultur transforman sebanyak 2 kali atau tiga generasi (T0, T1, dan T2).
C.2.3.1 Isolasi DNA Genom Cendawan
Sebanyak 1 g miselium cendawan diletakkan di dalam mortar, ditambahkan N2 cair kemudian digerus hingga halus. Bubuk miselium
(b/v) CTAB, 75 mM Tris-HCL, pH 8.0,15 mM EDTA, 1.05 M NaCl), dicampurkan hingga merata, kemudian diinkubasikan pada suhu 65 oC selama 1 jam. Larutan diekstraksi dengan menambahkan 6 ml larutan campuran antara kloroform dan isoamilalkohol (24:1) dingin dan dibolak-balik secara perlahan-lahan selama 1.5 menit kemudian disentrifugasi dengan kecepatan 3000 rpm pada 4 oC selama 20 menit. Supernatan yang terletak pada bagian atas diambil dan ditambahkan isopropanol dingin 0.7 x volume, lalu dibolak-balik perlahan-lahan kemudian diinkubasikan di freezer suhu -20 oC selama 2 jam. Larutan disentrifugasi dengan kecepatan 3000 rpm pada suhu 4 oC selama 20 menit. Supernatan yang dihasilkan dibuang dan endapan ditambahkan dengan etanol 70% (v/v) sebanyak 3 ml. Larutan disentrifugasi pada kecepatan yang sama lalu cairan dibuang, Tabung dikeringkan dengan cara divakum. Endapan yang telah kering disuspensikan dengan 1 x TE sebanyak 50 µl lalu diresuspensikan secara pelan. Cairan diambil dan dipindahkan ke dalam effendorf kemudian ditambahkan 0.1 vol konsentrasi (100 µg/ ml) RNase dan diinkubasikan selama semalam.
Purifikasi DNA dilakukan dengan menambahkan 1 vol larutan campuran fenol dan kloroform (1:1), lalu effendorf dibolak-balik perlahan kemudian disentrifugasi dengan kecepatan 10.000 rpm pada suhu ruang selama 15 menit. Supernatan diambil, dan ditambahkan 0.1 x vol NaOAC 3 M, pH 5.2 dan etanol absolut dingin 2-3 vol kemudian effendorf dibolak-balik perlahan-lahan. DNA genom diendapkan dengan sentrifugasi pada kecepatan 10.000 rpm pada suhu 4
o
C selama 20 menit. Setelah sentrifugasi cairan dibuang dan endapan dibilas dengan etanol 70%, lalu disentrifugasi kembali pada 10.000 rpm dengan suhu 4
o
C selama 10 menit. Cairan yang terbentuk dibuang dan endapan dikeringkan dengan vakum. DNA disuspensikan di dalam 50 µl 1 x TE. Kuantitas DNA genom diuji dengan menggunakan elektroforesis gel agarosa.
C.2.3.2 Amplifikasi DNA Cendawan Aspergillus-GFP
Amplifikasi DNA cendawan dilakukan dengan menggunakan Real Taq Polymerase, dNTP, sGFPf (5’-CGACGTAAACGGCCACAAGT-3’), sGFPr (5’-GTCCATGCCGTGAGTGATCC-3’), Nosf (5’-GAATCCTGTTGCCGGTCTTGCG -3’), dan Nosr (5’-CGGGACTCTAATCATAAAAACC-3’), digunakan untuk mengidentifikasi keberadaan mengisolasi gen penyandi sGFP dan terminator Nos dari genom cendawan transgenik Aspergillus-GFP serta primer Ubqf (5’-CCAGGACAAGATGATGTGCC-3’) dan Ubqr(5’-AAGAAGCTGAAGCATCCAGC -3’). Kondisi PCR untuk mengamplifikasi fragmen GFP ialah sebagai berikut: pradenaturasi 94 oC selama 1 menit, denaturasi pada 94 oC selama 1 menit, annealing pada suhu 53 oC selama 30 detik, pemanjangan pada suhu 72 oC selama 1 menit diikuti tahapan pendinginan dan dilakukan sebanyak 35 siklus Kondisi PCR untuk fragmen Nos dan Ubiquitin sama seperti kondisi PCR untuk GFP, tetapi berbeda pada suhu annealing sebesar 55 oC untuk amplifikasi Nos dan 58
o
C untuk ubiquitin. Ubiquitin digunakan sebagai kontrol positif.
HASIL DAN PEMBAHASAN
Hasil Pengamatan
A. Isolasi dan Penapisan Cendawan Mutualistik Akar
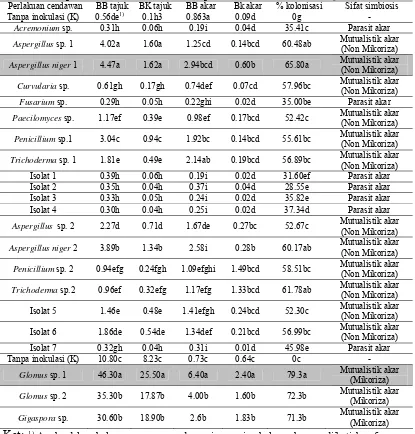
Sebanyak 22 isolat cendawan yang terdiri dari 10 isolat yang berasal dari rizoplan kebun karet dan 12 isolat yang berasal dari dari rizosfer dan rizoplan tanaman gambut (Tabel 1).
Hasil isolasi cendawan yang berasal dari akar tanaman karet dan rizoplan tanah gambut berupa cendawan dari genus Acremonium, Aspergillus, Curvularia, Fusarium, Penicillium, Trichoderma, Glomus, Gigaspora, dan beberapa isolat yang belum teridentifikasi.
Tabel 1 Cendawan yang berhasil diisolasi dari rizosfir dan rizoplan tanaman karet dan tumbuhan pada tanah gambut
Isolat Cendawan
Rizoplan tumbuhan karet Rizosfer tumbuhan gambut
Acremonium sp. Aspergillus sp. 2
Aspergillus sp. 1 Aspergillus niger 2
Aspergillus niger 1 Penicillium sp. 2
Curvularia sp. Trichoderma sp.2
Fusarium sp. Isolat 5
Paecilomyces sp. Isolat 6
Penicillium sp.1 Isolat 7
Trichoderma sp. 1 Glomus sp. 2
Tabel 2 Penapisan isolat-isolat cendawan pada tanaman Centrosema pubescens
Perlakuan cendawan BB tajuk BK tajuk BB akar Bk akar % kolonisasi Sifat simbiosis Tanpa inokulasi (K) 0.56de1) 0.1h3 0.863a 0.09d 0g -
Acremonium sp. 0.31h 0.06h 0.19i 0.04d 35.41c Parasit akar
Aspergillus sp. 1 4.02a 1.60a 1.25cd 0.14bcd 60.48ab Mutualistik akar
(Non Mikoriza)
Aspergillus niger 1 4.47a 1.62a 2.94bcd 0.60b 65.80a Mutualistik akar
(Non Mikoriza)
Curvularia sp. 0.61gh 0.17gh 0.74def 0.07cd 57.96bc Mutualistik akar
(Non Mikoriza)
Fusarium sp. 0.29h 0.05h 0.22ghi 0.02d 35.00be Parasit akar
Paecilomyces sp. 1.17ef 0.39e 0.98ef 0.17bcd 52.42c Mutualistik akar
(Non Mikoriza)
Penicillium sp.1 3.04c 0.94c 1.92bc 0.14bcd 55.61bc Mutualistik akar
(Non Mikoriza)
Trichoderma sp. 1 1.81e 0.49e 2.14ab 0.19bcd 56.89bc Mutualistik akar
(Non Mikoriza)
Aspergillus niger 2 3.89b 1.34b 2.58i 0.28b 60.17ab Mutualistik akar
(Non Mikoriza)
Penicillium sp. 2 0.94efg 0.24fgh 1.09efghi 1.49bcd 58.51bc Mutualistik akar
(Non Mikoriza)
Trichoderma sp.2 0.96ef 0.32efg 1.17efg 1.33bcd 61.78ab Mutualistik akar
(Non Mikoriza)
Isolat 5 1.46e 0.48e 1.41efgh 0.24bcd 52.30c Mutualistik akar (Non Mikoriza)
Isolat 6 1.86de 0.54de 1.34def 0.21bcd 56.99bc Mutualistik akar (Non Mikoriza)
Gigaspora sp. 30.60b 18.90b 2.6b 1.83b 71.3b Mutualistik akar
(Mikoriza)
Ket: 1)
Angka dalam kolom yang sama pada masing-masing kelompok yang diikuti huruf yang sama tidak berbeda nyata berdasarkan uji jarak berganda Duncan, P< 0.05.
B. Analisis Respon Tumbuh Tanaman Inang yang Diinokulasi Cendawan Mutualistik Akar
B.1 Pengaruh Isolat Terpilih Cendawan Mutualistik Akar terhadap Pertumbuhan Berbagai Tanaman Inang
B.1.1 Uji Spesifistitas Respon Tumbuh dan Kolonisasi
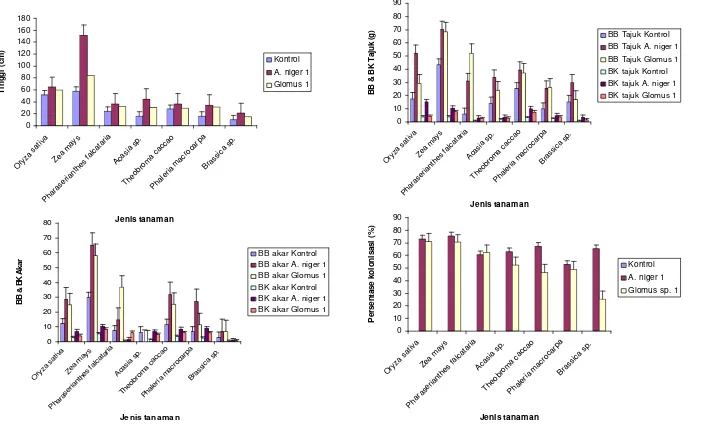
Hasil uji respon tumbuh cendawan mutualistik terpilih yaitu A. niger 1 dan Glomus sp. 1 pada berbagai tanaman uji dosis P 50% untuk mempelajari spesifistitas respon tumbuh dan kolonisasi disajikan pada Gambar 3.
Pada perlakuan inokulasi tunggal, A. niger 1 maupun Glomus sp. 1 meningkatkan pertumbuhan semua tanaman uji pada semua parameter yang diamati. Jika kedua perlakuan tunggal dibandingkan, A. niger 1 mempunyai respon tumbuh yang lebih baik dari Glomus sp. 1.
Masing-masing cendawan mutualistik mengkolonisasi akar tanaman uji. Persentase kolonisasi A. niger 1 berkisar antara 53% sampai 75.67% dengan kolonisasi tertinggi terdapat pada Zea mays dan kolonisasi terendah terdapat pada Phaleria macrocarpa. Sedangkan pada Glomus sp. 1, persentase kolonisasi tertinggi yaitu sebesar 71.33% terdapat pada tanaman Oryza sativa, dan persentase kolonisasi terendah yaitu sebesar 25.67% terdapat pada Brassica sp. Pada perlakuan kontrol tidak dijumpai kolonisasi cendawan baik A. niger 1 maupun Glomus sp.1 (Gambar 4).
Cendawan mutualistik akar non mikoriza A. niger 1 dan cendawan mutualistik akar mikoriza Glomus sp. 1 dapat meningkatkan pertumbuhan tananam seperti tinggi, bobot kering dan bobot basah tajuk, bobot kering dan bobot basah akar berkisar antara 2-4 kali lebih tinggi dibandingkan dengan kontrol. Peningkatan pertumbuhan tersebut terjadi pada semua tanaman yang diuji yaitu Oryza sativa, Zea mays, Pharaserianthes falcataria, Acasia sp., Theobroma cacao, Phaleria macrocarpa, dan Brassica sp.
Gambar 5 Struktur kolonisasi Glomus sp. 1 pada akar Brassica sp. pada perbesaran 10 x. a. apresorium, b. hifa internal
B.1.2 Pengaruh Inokulasi Ganda A. niger 1 dan Glomus sp.1
Pengaruh inokulasi ganda antara A. niger 1 dan Glomus sp. 1 diuji pada tanaman Centrosema pubescens. Respon tumbuh yang dinyatakan dengan bobot basah dan bobot kering tajuk menunjukkan perlakuan inokulasi ganda A. niger 1 dan Glomus sp. 1 meningkatkan respon tumbuh tanaman dibandingkan tanaman kontrol yaitu sebesar 51.67 g dan 17.2 g (Gambar 6). Respon tersebut lebih rendah dibandingkan perlakuan tunggal A. niger 1 yaitu masing-masing sebesar 62.3 g dan 22.6 g namun lebih tinggi dibandingkan perlakuan tunggal Glomus sp.1 yaitu masing-masing sebesar 58.2 g dan 18.3 g.
Gambar 6 Pengaruh inokulasi ganda cendawan mutualistik akar mikoriza dan non mikoriza pada Centrosema pubescen umur 3 bulan pada taraf P 50%
B.2 Pengaruh Cendawan Mutualistik Akar Non Mikoriza terhadap Penyerapan P Tanaman Inang
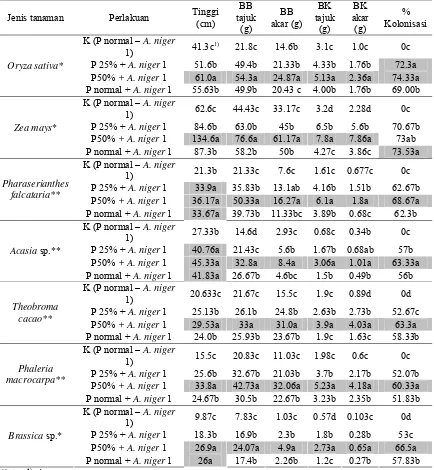
Pengaruh inokulasi cendawan A. niger 1pada berbagai taraf pemupukan P pada berbagai tanaman uji yaitu Oryza sativa, Zea mays, Theobroma cacao, Acasia sp., Pharaserianthes falcataria, Phaleria macrocarpa, dan Brassica sp. disajikan pada Tabel 4.
Tabel 3 Pengaruh perlakuan P terhadap pertumbuhan berbagai tanaman inang yang diinokulasi A. niger 1
Jenis tanaman Perlakuan Tinggi
(cm)
ngka dalam kolom yang sama pada masing-masing kelompok yang diikuti huruf yang sama tidak berbeda nyata berdasarkan uji jarak berganda Duncan, P< 0.05.
Inokulasi cendawan dapat meningkatan pertumbuhan yang signifikan yang dinyatakan dengan tinggi, bobot basah dan bobot kering tajuk, bobot basah dan bobot kering akar serta persentase kolonisasi dibandingkan dengan tanaman kontrol yaitu tanaman yang tidak diinokulasi tetapi mendapat pemupukan P dosis normal (kontrol positif) (Tabel 3).
Pemberian fosfat sebanyak 25%, 50%, dan 100% pada perlakuan inokulasi meningkatkan respon tumbuh dibandingkan tanaman kontrol. Secara umum respon tumbuh tertinggi diperoleh pada perlakuan P sebesar 50% dan peningkatan respon ini menurun pada perlakuan P dosis normal kecuali pada tinggi tanaman Pharaserianthes falcataria, Acasia sp. dan Brassica sp. yang menunjukkan bahwa penambahan fosfat lebih lanjut tidak berpengaruh nyata terhadap parameter tersebut. Hal ini sejalan dengan persentase kolonisasi yang secara umum pemberian P meningkatkan kolonisasi sampai P 50% dan pemberian P lebih lanjut (P normal) menurunkan kolonisasi pada taraf yang mendekati dengan P 25% kecuali pada tanaman Zea mays yang menunjukkan bahwa persentase kolonisasi meningkat sampai pemberian P dosis normal.
C. Analisis Proses Kolonisasi Cendawan Mutualistik Akar C.1 Metode Pewarnaan Biru Tripan
Analisis proses kolonisasi cendawan mutualistik akar A. niger 1 pada tanaman Centrosema pubescens yang ditumbuhkan secara in vitro dilakukan menggunakan pewarnaan biru tripan. Tanaman kontrol yang tidak diinokulasi cendawan dibandingkan dengan tanaman uji yang diinokulasi cendawan mutualistik akar A. niger 1.
15 um c.
10 um
a. b.
Gambar 7 Struktur kolonisasi fungi A. niger 1 di dalam akar pada umur 6 mingu setelah inokulasi pada perbesaran 10 x. a. apresorium, b. hifa internal, c. Struktur yang menyerupai klamidospora
Propagul A. niger 1 yang diinokulasikan pada tanaman uji berupa massa konidia. Pada pengamatan minggu kedua setelah inokulasi konidia yang digunakan sebagai inokulum telah berkecambah membentuk hifa yang telah melakukan kontak dengan akar membentuk apresorium dan struktur interseluler. Pada umur satu bulan setelah inokulasi, akar telah terkolonisasi cendawan sebanyak 23.1% namun belum terbentuk klamidospora. Pada pengamatan 6 minggu kolonisasi telah mencapai 48.2% dan telah terbentuk klamidospora. Klamidospora terbentuk pada daerah korteks akar. Kolonisasi meningkat terus hingga akhir pengamatan yang berumur 12 minggu dengan persentase kolonisasi akar mencapai 71.2%. Kolonisasi cendawan berupa hifa interseluler selain ditemukan di daerah epidermis juga dapat dilihat pada daerah korteks akar. Pada akar tidak terlihat adanya arbuskula atau percabangan hifa seperti halnya pada akar yang terkolonisasi CMA. Struktur kolonisasi tidak ditemui di daerah pembuluh akar tanaman yang diuji.
C.2. Penggunaan Gen Penanda GFP (Green Fluorescent Protein)
Speroplas dapat diproduksi dari spora dan miselia. Jumlah speroplas yang dihasilkan dari miselia berbeda nyata bila dibandingkan dengan speroplas yang berasal dari spora. Jumlah speroplas yang diproduksi dari spora lebih rendah dan jumlahnya tidak konsisten untuk setiap ulangan dibandingkan dengan speroplas yang diproduksi dari miselia (Gambar 8).
Gambar 8 Jumlah speroplas yang dihasilkan dari miselia dan spora A. niger
Gambar 9 menunjukkan speroplas yang dihasilkan dari miselia. Speroplas yang dihasilkan memiliki warna hialin dengan permukaan yang halus. Speroplas yang dihasilkan dari satu gram miselia umur 24 jam yang dilarutkan dalam 25 ml campuran enzim ialah 4.5 x 105 speroplas dalam satu mililiter larutan osmotik stabiliser.
Gambar 9 Speroplas segar cendawan A. niger setelah pemurnian dengan sistem dua fase sukrosa dan manitol. a. perbesaran 10 x, b. perbesaran 40 x.
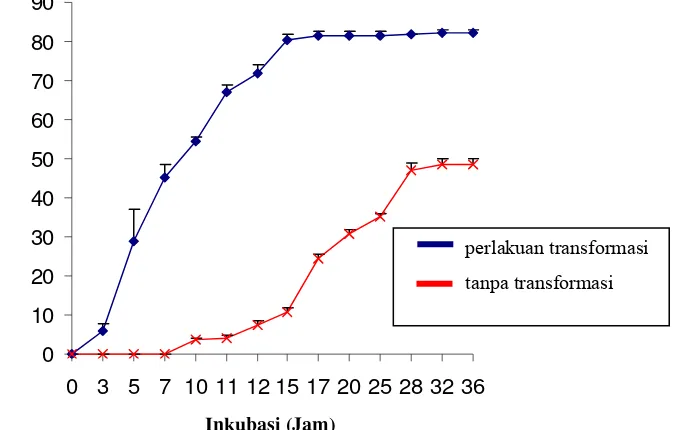
Speroplas tanpa perlakuan transformasi beregenerasi dimulai pada 3 jam setelah speroplas disebar pada media PDA dengan penambahan konsentrasi sukrosa sebesar 20%. Tingkat perkecambahan speroplas pada jam tersebut sebesar 6%. Proses perkecambahan mencapai puncaknya pada jam ke-15 dan menghasilkan persentase perkecambahan sebesar 80.33%.
Perkecambahan speroplas yang mengalami proses transformasi ditumbuhkan pada media seleksi PDA yang mengandung antibiotik higromisin sebesar 200 µg/ml ialah sebesar 48.67%. Perkecambahan dimulai dari jam ke-10 dan berakhir pada jam ke-36 setelah inokulasi (Gambar 10). Speroplas yang tumbuh pada media seleksi tersebut menandakan bahwa gen GFP pada penelitian ini telah berhasil diintegrasikan ke dalam genom cendawan A. niger. Efisiensi transformasi dari proses integrasi gen GFP ke dalam genom cendawan A. niger pada penelitian ini ialah sebesar 2.4 % untuk 1µg plasmid.
0
Gambar 10 Persentase perkecambahan speroplas
pendaran hijau kekuningan ketika diamati dengan mikroskop fluoresen maupun mikroskop cahaya. Hal ini menunjukkan bahwa gen GFP telah terintegrasi dengan baik ke dalam genom cendawan mutualistik A. niger tersebut dan ekspresinya bersifat konstitutif pada semua bagian cendawan (Gambar 11).
15 µm
15 µm
a. b.
Gambar 11 Gen GFP diekspresikan secara konstitutif di seluruh struktur cendawan pada perbesaran 40 x. a. struktur aseksual (kepala konidia), b. miselium
a b c
10 µm 10 µm 15 µm
Gambar 12 Miselium cendawan transgenik pada berbagai subkultur (generasi). (a) generasi T0, (b) generasi T1, dan (c) generasi T2.
Hasil pengamatan lebih lanjut terhadap integrasi gen GFP pada genom A. niger sampai pada generasi T2 menunjukkan hasil yang cukup stabil. Seluruh subkultur dan struktur seksual cendawan yang dilakukan dari T0 sampai T2 menghasilkan pendaran hijau kekuningan pada mikroskop fluoresen yang dilengkapi dengan sinar biru pada panjang gelombang 515 nm. Pendaran hijau kekuningan semakin meningkat dengan bertambahnya jumlah subkultur (Gambar 12).
masing masing sebesar 643 dan 152 bp pada semua generasi yang diuji. Berdasarkan data hasil amplifikasi kontrol internal ubiquitin yang berukuran 256 bp menunjukkan bahwa fragmen DNA sebesar 643 dan 152 bp bukan fragmen DNA kontaminan melainkan gen GFP dan terminator Nos (Gambar 13).
M T0 T1
Gambar 13 Hasil amplifikasi PCR
15 µm 10 µm
Gambar 12 Struktur kolonisasi A. niger transgenik di dalam akar pada perbesaran 10 x. a. hifa interseluler, b. Struktur klamidospora
Pembahasan
A. Isolasi dan Penapisan Cendawan Mutualistik Akar
Sifat simbiosis juga dapat diketahui melalui proses kolonisasi yang terdapat di dalam akar tanaman uji tersebut. Isolat cendawan endofit mutualistik akan mengkolonisasi akar hanya pada bagian epidermis sampai ke korteks akar sedangkan cendawan parasitik akan mengkolonisasi ke seluruh bagian sampai pada jaringan pembuluh akar. Hal ini terlihat dari pengamatan kolonisasi cendawan parasit yang berhasil diisolasi dan diuji pada tanaman Centrosema pubescens. Selain itu pada tanaman yang diinokulasi cendawan parasit akar, pertumbuhan dan perkembangan tanaman terhambat. Hal tersebut dapat dilihat dari respon tumbuh tanaman yang lebih kecil dibandingkan tanaman kontrol.
Keragaman cendawan mutualistik non mikoriza pada kedua lokasi yang diteliti termasuk rendah jika dibandingkan dengan penelitian Hasan (2002) yang berhasil mengisolasi 14 isolat cendawan mutualistik akar tanaman legum di Kebun Percobaan Universitas Assiut Mesir. Salah satu faktor yang mempengaruhi keragaman tersebut yaitu faktor lingkungan biotik dan abiotik yang meliputi iklim, temperatur, jenis tanah dan pH. Begitu pula dengan keragaman spora CMA dari kedua lokasi tersebut termasuk sangat rendah karena hanya didapatkan dua genus cendawan pembentuk mikoriza yaitu Glomus dan Gigaspora. Hal ini berbeda seperti yang dilaporkan oleh Ekamawati (1997) yang melakukan eksplorasi CMA tanah gambut di Kalimantan barat dan menemukan empat genus CMA yaitu Glomus, Acaulospora, Scutelospora dan Entrophospora. sedangkan hasil eksplorasi pada tanah gambut di Riau terdapat 5 genus yaitu Acaulospora, Entrophospora,Gigaspora, Glomus dan Sclerocystis (Ervayenri et al. 1999).
keragaman spora yang ada. Hal ini didukung oleh pernyataan Sieverding (1991) yang menunjukkan bahwa sistem monokultur dapat mengurangi keragaman spesies cendawan yang ditemukan di tanah setelah beberapa tahun dilakukan penanaman yang terus menerus.
Kondisi tanah pada kedua lokasi yang diteliti tidak mendukung pertumbuhan tanaman yang optimal, sehingga tanaman tersebut harus bersimbiosis dengan mikroorganisme yang dapat membantu untuk bertahan pada lingkungan marjinal. Simbiosis mutualisme yang terjadi antara tumbuhan dan cendawan dalam hal ini cendawan mutualistik akar mikoriza dan non mikoriza diduga merupakan salah satu cara dan strategi hidup yang dilakukan tumbuhan untuk beradaptasi pada kedua wilayah tersebut. Cendawan Aspergillus dan Penicillium yang berhasil diisolasi selain bersimbiosis mutualistik dengan tanaman jugamerupakan jenis cendawan yang diketahui dapat melarutkan P yang terfiksasi di dalam tanah. Cendawan tersebut mempunyai kemampuan untuk membebaskan asam-asam organik seperti asam sitrat (Cunningham & Kuiack 1992, Illmer et al. 1995, Reyes et al. 2001), asam oksalat (Cunningham & Kuiack 1992, Gharieb 2000) dan asam fumarat. Asam organik ini akan membentuk kelat dengan ion ion Ca2+, Mg 2+, Fe 3+, dan Al 3+ sehingga mampu meningkatkan konsentrasi fosfor tersedia di dalam tanah sehingga dapat diserap tanaman. Kucey & Legget (1989) menunjukkan bahwa terdapat hubungan yang signifikan antara
jumlah cendawan pelarut P dan kandungan P di dalam tanah. Beberapa penelitian
menunjukkan bahwa terdapat peningkatan hasil dan pertumbuhan tanaman akibat
inokulasi cendawan pelarut P pada percobaan pot maupun pada kondisi lapangan
(Kucey & Leggett 1989, Wahid & Mehana 2000). Disamping itu cendawan memiliki kelebihan dibandingkan dengan bakteri pelarut Ca-P. Salah satu kelebihannya yaitu cendawan lebih toleran terhadap asam. Kemampuan tersebut menjadikan cendawan berpotensi sebagai agen pelarut P anorganik yang tidak tersedia atau dalam bentuk terfiksasi oleh unsur lain menjadi bentuk yang dapat digunakan tanaman (H2PO4-) yang tumbuh pada tanah masam (Puente et al.
2004).
karena dapat mengkolonisasi akar tanaman tanpa menimbulkan gejala penyakit pada tanaman inang tersebut. Walaupun demikian A. niger 1 belum bisa dikelompokkan sebagai cendawan mikoriza. Hal ini disebabkan oleh struktur kolonisasi A. niger 1 pada akar tanaman berbeda dengan struktur dan proses kolonisasi Glomus sp.1. Pada Glomus sp. 1 selain hifa internal terbentuk pula arbuskula yang berperan sebagai proses transfer nutrisi, sedangkan pada A. niger 1, struktur tersebut tidak dibentuk.
Penelitian mengenai cendawan mikoriza arbuskula telah lama dan sudah banyak dilakukan, sedangkan penelitian mengenai cendawan endofit mutualistik akar non mikoriza masih sedikit dilakukan. Penelitian terbaru menunjukkan bahwa beberapa cendawan endofit seperti dark septate endophyte (DSE) dan Heteroconium chaetospira yang bersimbiosis dengan akar Rhododendron obtusum (Usuki & Narisawa 2003). Namun penelitian tersebut hanya menjelaskan proses kolonisasi. Proses transfer nutrisi dua arah yang terjadi dari tanaman inang ke cendawan atau dari cendawan ke tanaman inang masih belum diketahui.
B. Analisis respon tumbuh tanaman inang yang diinokulasi cendawan mutualistik akar
Cendawan A. niger 1 dapat mengkolonisasi seluruh tanaman yang diuji termasuk tanaman Brassica sp. yang merupakan tanaman bukan inang mikoriza (Tabel 3). Cendawan mutualistik akar mikoriza menurut Smith & Read (1997) dapat mengkolonisasi hampir 95% jenis tumbuhan di dunia. Namun terdapat sekitar 5% tumbuhan di dunia tidak dapat bersimbiosis. Kelompok tumbuhan disebut tumbuhan bukan inang mikoriza.
yang telah diinokulasi Glomus mossae menunjukkan bahwa kolonisasi internal hanya terdapat pada sel yang mati dan tidak mempunyai plasma membran (Glen et al. 1985).
Gao et al. (2001) melaporkan berbagai pola kolonisasi CMA tanaman mutan Lycopersicum esculentum yang tidak dapat bersimbiosis dengan mikoriza dibandingkan dengan tanaman tipe liarnya. Pada tanaman tipe liar menunjukkan pola kolonisasi CMA yang normal, sedangkan pada tanaman mutan menunjukkan pola kolonisasi yang tidak normal seperti hifa tertahan pada bagian permukaan akar, hifa melakukan penetrasi pada epidermis akar namun kolonisasi pada bagian korteks jarang dijumpai. Tanaman Brassica sp. pada penelitian ini termasuk ke dalam tipe kolonisasi yang tidak normal yaitu struktur kolonisasi hanya ditemui pada jaringan epidermis akar dan tidak dijumpai pada korteks akar. Persentase kolonisasi Glomus sp. 1 pada tanaman Brassica sp. yaitu sebesar 25.67% namun menunjukkan respon tumbuh yang lebih baik dibandingkan tanaman kontrol.
Sebaliknya inokulasi A. niger 1 pada tanaman Brasssica sp. dapat meningkatkan respon tumbuh tanaman tersebut secara signifikan. Bobot basah dan bobot kering tajuk maupun akar Brassica sp. memiliki nilai tertinggi dibandingkan tanaman kontrol dan tanaman yang diinokulasi CMA. Peningkatan respon tumbuh tanaman Brassica berkorelasi positif dengan kolonisasinya. Hal ini sesuai dengan penelitian Chuang et al. (2006) yang menginokulasikan A. niger asal tanah pada Brassica chinensis. Tanaman tersebut mengalami peningkatan signifikan pada parameter pertumbuhannya.
Pada tanaman Zea mays, tanaman yang diinokulasi A. niger 1 menunjukkan selain tanaman yang sehat ditandai dengan pembungaan yang lebih cepat dibandingkan tanaman kontrol dan tanaman yang diinokulasi Glomus sp.1. Cendawan A. niger dilaporkan dapat mensintesis hormon auksin dan giberelin yang dapat meningkatkan pertumbuhan dan perkembangan tanaman inang seperti juga yang dilaporkan oleh Hasan (2003) dan Zulfitri (2007). Walaupun pada kelompok cendawan mikoriza diketahui juga dapat mensintesis hormon seperti auksin (Smith & Read 1997), namun pada perlakuan inokulasi Glomus sp 1 tidak menunjukkan respon pembungaan. Auksin pada kelompok cendawan mikoriza tidak berperan dalam respon pembungaan tanaman karena hormon tersebut hanya digunakan cendawan dalam proses kolonisasi akar. Respon pembungaan yang cepat tersebut diduga berhubungan dengan hormon tumbuh yang dihasilkan cendawan yang dapat memicu terjadinya pembungaan lebih cepat.
Peranan cendawan mutualistik akar mikoriza dan non mikoriza dalam hal ini Glomus sp. 1 dan A niger 1 ialah membantu penyerapan hara seperti fosfat yang tidak dapat diserap oleh tanaman. Walaupun jumlah unsur tersebut berada dalam jumlah yang melimpah di dalam tanah, namun tidak bisa digunakan tanaman karena berada dalam bentuk terikat. Rata-rata tanah mengandung fosfat total sebesar 0.02-0.5%, tersedia dalam bentuk anorganik yang sulit larut dan hanya 1% yang siap dimanfaatkan oleh tanaman (Barber 1984). Fosfat merupakan salah satu unsur hara yang penting bagi tanaman. Unsur tersebut merupakan bagian esensial dari gula fosfat yang berperan dalam nukleotida seperti RNA dan DNA, komponen fosfolipid membran, berperan dalam metabolisme energi, dan merangsang terjadinya pembelahan sel (Salisbury & Ross 1995). Defisiensi unsur ini dapat berpengaruh terhadap membran sel tanaman dan transpor unsur lain seperti Ca yang merupakan kation divalen (Bennet 1996).