Informasi Dokumen
- Penulis:
- Taro Saito
- Ismunandar
- Pengajar:
- Professor Ito
- Dr. Bambang Prijamboedi
- Professor Yoshito Takeuchi
- Sekolah: Kanagawa University
- Mata Pelajaran: Kimia Anorganik
- Topik: Kimia itu Mudah: langsung
- Tipe: buku
- Tahun: 2004
- Kota: Kanagawa
Ringkasan Dokumen
I. Unsur dan Periodisitas
Bagian ini membahas tentang unsur-unsur yang membentuk dasar kimia anorganik. Unsur-unsur diatur dalam sistem periodik, yang merupakan alat penting dalam memahami sifat dan reaksi unsur. Dengan memahami asal-usul dan distribusi unsur, siswa dapat mengapresiasi bagaimana unsur-unsur terbentuk dan berinteraksi di alam. Hal ini sangat relevan dengan tujuan pendidikan untuk memberikan pemahaman dasar tentang struktur atom dan sifat-sifat unsur yang berbeda.
1.1 Asal-usul dan distribusi unsur
Di sini, dijelaskan bahwa unsur-unsur terbentuk melalui proses fusi dalam bintang dan distribusinya di alam semesta. Pemahaman ini penting untuk menyadari bagaimana unsur-unsur berkontribusi dalam berbagai reaksi kimia dan proses yang terjadi di alam. Hal ini juga menekankan pentingnya kimia dalam konteks ilmiah yang lebih luas.
1.2 Penemuan unsur
Bagian ini mencatat sejarah penemuan unsur-unsur kimia, dari alkemi hingga kimia modern. Ini menunjukkan perkembangan pemahaman manusia tentang materi dan pentingnya penelitian dalam menemukan unsur baru. Ini memberikan siswa konteks sejarah yang memperkaya pemahaman mereka tentang kimia.
1.3 Struktur elektron unsur
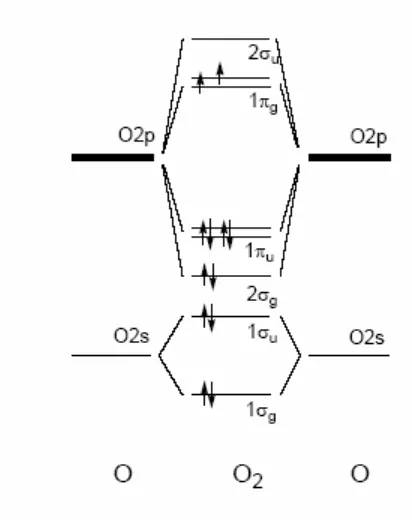
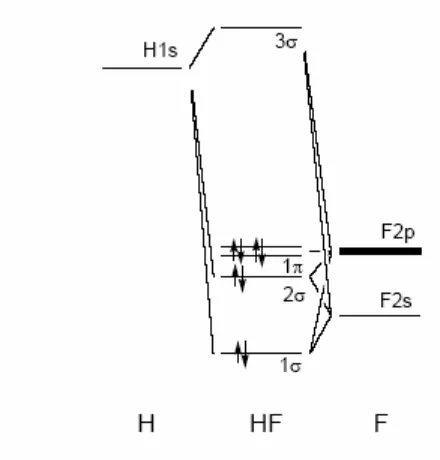
Pembahasan tentang orbital atom dan konfigurasi elektron memberikan dasar bagi siswa untuk memahami bagaimana atom berinteraksi satu sama lain. Ini penting dalam mendasari konsep ikatan kimia dan reaksi, yang merupakan inti dari studi kimia.
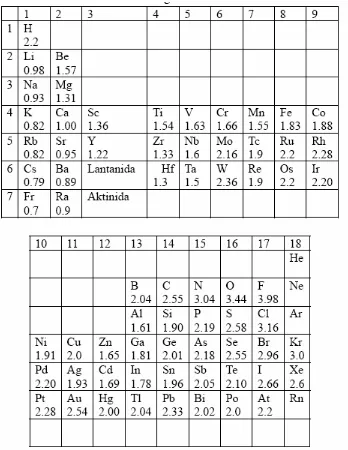
1.4 Klasifikasi unsur dalam blok sistem periodik
Klasifikasi unsur dalam sistem periodik membantu siswa memahami hubungan antar unsur. Ini adalah alat yang penting dalam mempelajari sifat-sifat kimia dan perilaku unsur yang berbeda, serta menjelaskan bagaimana unsur-unsur berinteraksi dalam senyawa.
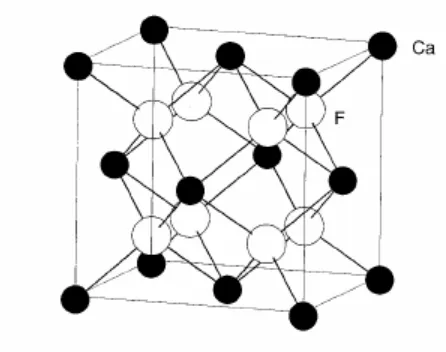
1.5 Keadaan terikat unsur
Bagian ini menjelaskan tentang berbagai bentuk unsur dan senyawa, termasuk senyawa molekular dan padat. Memahami keadaan terikat unsur sangat penting untuk mempelajari sifat fisik dan reaksi kimia, yang merupakan tujuan utama dalam pendidikan kimia.
II. Ikatan dan Struktur
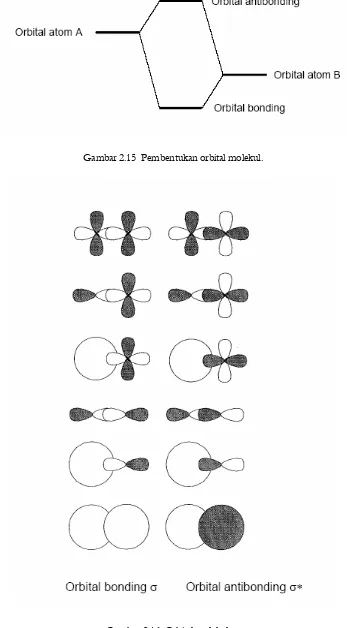
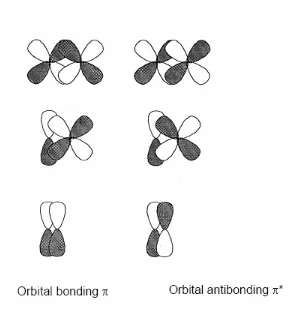
Bagian ini membahas bagaimana ikatan terbentuk dan bagaimana struktur molekul memengaruhi sifat-sifat kimia. Pemahaman tentang ikatan kovalen, ionik, dan logam sangat penting untuk siswa dalam mempelajari interaksi antar atom dan molekul. Ini mendukung tujuan pendidikan untuk membekali siswa dengan pengetahuan dasar tentang bagaimana senyawa terbentuk dan berfungsi.
2.1 Klasifikasi ikatan
Klasifikasi ikatan menjadi ikatan kovalen, ionik, dan logam membantu siswa memahami berbagai cara atom dapat berinteraksi. Ini penting untuk menjelaskan sifat-sifat senyawa yang berbeda dan bagaimana mereka berperilaku dalam reaksi kimia.
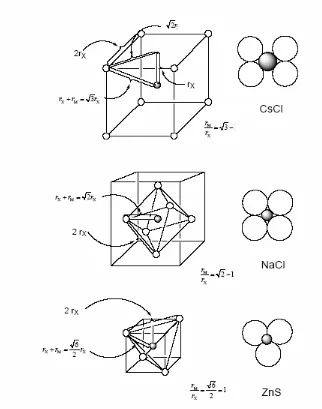
2.2 Faktor geometri yang menentukan ikatan dan struktur
Faktor geometri seperti jari-jari atom dan entalpi kisi memengaruhi stabilitas dan reaktivitas senyawa. Pemahaman ini penting bagi siswa untuk dapat memprediksi perilaku senyawa dalam berbagai kondisi, yang merupakan keterampilan penting dalam kimia.
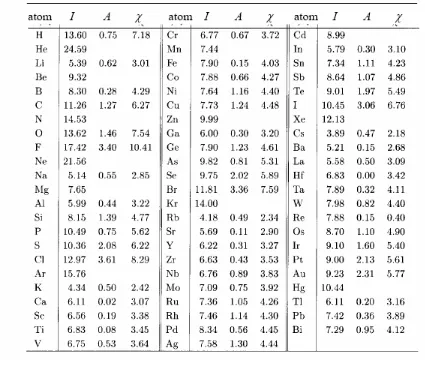
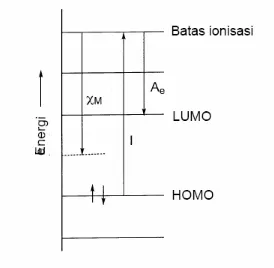
2.3 Faktor elektronik yang menentukan ikatan dan struktur
Aspek elektronik seperti muatan inti efektif dan energi ionisasi memberikan wawasan tentang bagaimana elektron memengaruhi ikatan dan struktur. Ini adalah konsep kunci dalam memahami reaktivitas dan stabilitas senyawa, yang harus dikuasai oleh siswa.
III. Reaksi Anorganik
Bagian ini membahas konsep dasar reaksi anorganik, termasuk termodinamika dan elektrokimia. Memahami reaksi ini penting untuk siswa karena memberikan dasar bagi mereka untuk mengeksplorasi reaksi kimia yang lebih kompleks dan aplikasinya dalam berbagai bidang.
3.1 Termodinamika
Pembahasan tentang prinsip-prinsip termodinamika memberikan siswa pemahaman tentang energi dalam reaksi kimia. Ini penting untuk memahami bagaimana reaksi berlangsung dan faktor-faktor yang mempengaruhi hasil reaksi.
3.2 Elektrokimia
Elektrokimia membahas interaksi antara listrik dan reaksi kimia, yang penting dalam banyak aplikasi teknologi. Memahami konsep ini memungkinkan siswa untuk mengaitkan teori dengan praktik dalam bidang energi dan material.
3.3 Oksidasi reduksi
Reaksi redoks adalah bagian penting dari banyak proses kimia. Memahami bilangan oksidasi dan reaksi redoks membantu siswa dalam mempelajari reaksi yang lebih kompleks dan aplikasinya dalam industri dan penelitian.