BAHAN AJAR
MEKANISME REAKSI SENYAWA ORGANIK
DISUSUN OLEH:
HALIMATUSSAKDIAH, S.Si, M.Sc
PROGRAM STUDI KIMIA FAKULTAS TEKNIK UNIVERSITAS SAMUDRA
GENAP 2020/2021
KATA PENGANTAR
Alhamdulillah, segala puji dan syukur yang mendalam hanya kepada Allah SWT atas segala limpahan rahmat, hidayah dan karunia yang tak pernah berujung. Sang Penguasa semesta alam dan Yang Maha Mengendalikan segala isinya serta tiada daya upaya tanpa Ridho-Nya. Dengan petunjuk dan kasih sayang-Nya, akhirnya dapat diselesaikan Modul Kimia Organik Dasar. Modul ini disiapkan untuk membantu mahasiswa memahami dasar- dasar reaksi kimia organik.
Modul ini masih banyak kekurangan baik dari segi isi maupun teknis penulisan, sehingga memerlukan kritik dan saran dari semua pihak yang bersifat membangun guna perbaikan dan penyempurnaannya. Semoga Modul ini membawa kemajuan bagi mahasiswa Universitas Samudra, khususnya Program Studi Kimia Fakultas Teknik.
Langsa, 10 April 2021
Penyusun
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... ii
Tinjauan Mata Kuliah ... vi
A. Deskripsi Mata Kuliah... vi
B. Kompetensi Dasar ... vi
C. Kemampuan Akhir yang Diharapkan ... vii
D. Susunan Judul Modul dan Keterkaitan Antar Modul (Peta Kedudukan Modul)... vii
E. Petunjuk Umum Mempelajari Mata Kuliah ... viii
Modul I: Pengantar Kimia Organik... 1
Kegiatan Belajar 1 ... 1
1. Tujuan Kegiatan Pembelajaran ... 1
2. Uraian Materi ... 1
3. Rangkuman ... 8
4. Tes Formatif ... 8
Kunci Jawaban... 8
1. Tes Formatif 1... 8
Daftar Pustaka ... 9
Modul II Tinjauan Ulang Atom dan Molekul ... 10
Kegiatan Belajar 1 ... 10
1. Tujuan Kegiatan Pembelajaran ... 10
2. Uraian Materi ... 10
3. Rangkuman ... 15
4. Tes Formatif ... 16
Kegiatan Belajar 2 ... 16
1. Tujuan Kegiatan Pembelajaran ... 16
2. Uraian Materi ... 16
3. Rangkuman ... 27
4. Tes Formatif ... 28
Kunci Jawaban... 28
1. Tes Formatif 1... 28
2. Tes Formatif 2... 28
Daftar Pustaka ... 29
Modul III Orbital dan Peranannya dalam Ikatan Kimia Kovalen ... 30
Kegiatan Belajar 1 ... 30
1. Tujuan Kegiatan Pembelajaran ... 30
2. Uraian Materi ... 30
3. Rangkuman ... 44
4. Tes Formatif ... 45
Kegiatan Belajar 2 ... 45
1. Tujuan Kegiatan Pembelajaran ... 45
2. Uraian Materi ... 45
3. Rangkuman ... 52
4. Tes Formatif ... 53
Kunci Jawaban... 53
1. Tes Formatif 1... 53
2. Tes Formatif 2... 54
Daftar Pustaka ... 54
Modul IV Struktur Senyawa Organik Berdasarkan Gugus Fungsi ... 55
Kegiatan Belajar 1 ... 55
1. Tujuan Kegiatan Pembelajaran ... 55
2. Uraian Materi ... 55
3. Rangkuman ... 57
4. Tes Formatif ... 58
Kunci Jawaban... 58
1. Tes Formatif 1... 58
Daftar Pustaka ... 58
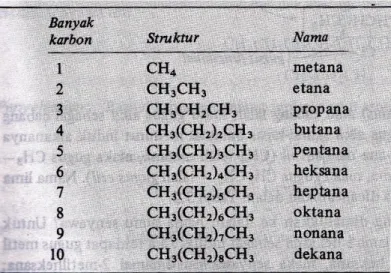
Modul V Hidrokarbon Alkana ... 59
2. Uraian Materi ... 59
3. Rangkuman ... 73
4. Tes Formatif ... 74
Kunci Jawaban... 74
1. Tes Formatif 1... 74
Daftar Pustaka ... 76
Modul VI Alkil Halida ... 77
Kegiatan Belajar 1 ... 77
1. Tujuan Kegiatan Pembelajaran ... 77
2. Uraian Materi ... 77
3. Rangkuman ... 87
4. Tes Formatif ... 87
Kunci Jawaban... 88
1. Tes Formatif 1... 88
Daftar Pustaka ... 88
Modul VII Hidrokarbon Alkena dan Alkuna ... 89
Kegiatan Belajar 1 ... 89
1. Tujuan Kegiatan Pembelajaran ... 89
2. Uraian Materi ... 89
3. Rangkuman ... 91
4. Tes Formatif ... 91
Kunci Jawaban... 92
1. Tes Formatif 1... 92
Daftar Pustaka ... 92
Modul VIII Alkohol dan Eter ... 94
Kegiatan Belajar 1 ... 94
1. Tujuan Kegiatan Pembelajaran ... 94
2. Uraian Materi ... 94
3. Rangkuman ... 108
4. Tes Formatif ... 109
1. Tes Formatif 1... 109
Daftar Pustaka ... 109
Modul IX Benzena dan Turunannya ... 111
Kegiatan Belajar 1 ... 111
1. Tujuan Kegiatan Pembelajaran ... 111
2. Uraian Materi ... 111
3. Rangkuman ... 127
4. Tes Formatif ... 128
Kunci Jawaban... 129
1. Tes Formatif 1... 129
Daftar Pustaka ... 129
Modul X Aldehid dan Keton... 130
Kegiatan Belajar 1 ... 130
1. Tujuan Kegiatan Pembelajaran ... 130
2. Uraian Materi ... 130
3. Rangkuman ... 147
4. Tes Formatif ... 148
Kunci Jawaban... 148
1. Tes Formatif 1... 148
Daftar Pustaka ... 149
Modul XI Asam Karboksilat dan Turunannya ... 150
Kegiatan Belajar 1 ... 150
1. Tujuan Kegiatan Pembelajaran ... 150
2. Uraian Materi ... 150
3. Rangkuman ... 185
4. Tes Formatif ... 186
Kunci Jawaban... 186
1. Tes Formatif 1... 186
Modul XII Amina ... 188
Kegiatan Belajar 1 ... 188
1. Tujuan Kegiatan Pembelajaran ... 188
2. Uraian Materi ... 188
3. Rangkuman ... 204
4. Tes Formatif ... 205
Kunci Jawaban... 205
1. Tes Formatif 1... 205
Daftar Pustaka ... 205
GLOSARIUM ... 206
Mata kuliah ini merupakan mata kuliah dasar dan wajib. Setelah mengikuti perkuliahan ini mahasiswa diharapkan mampu menjelaskan sifat dan kereaktifan senyawa viiubstit melalui struktur kimianya. Mata kuliah ini mempelajari tentang Pengantar Kimia Organik Dasar, Tinjauan Ulang Atom dan Molekul, Orbital dan Peranannya Dalam Ikatan Kimia Kovalen, Struktur Senyawa Organik berdasarkan Gugus Fungsi, Hidrokarbon Alkana, Alkilhalida, Hidrokarbon Alkena dan Alkuna, Alkohol dan Eter, Benzena dan Turunannya, Aldehid dan Keton, Asam Karboksilat dan Turunannya, dan Amina. Pelaksanaan kuliah menggunakan pendekatan konsep dalam bentuk ceramah, viiubst jawab dan latihan serta dilengkapi dengan LCD dan penyelesaian tugas. Tahap penguasaan mahasiswa selain evaluasi melalui tes unit dan UAS juga evaluasi terhadap tugas-tugas.
Setelah mengikuti Mata kuliah Kimia Organik Dasar ini, mahasiswa diharapkan memiliki kompetensi dasar yang mencakup:
1. Mampu menjelaskan konsep dasar kimia organik, sifat dan kereaktifan senyawa organik melalui struktur kimianya.
2. Mampu menjelaskan dasar-dasar reaksi kimia organik.
3. Mampu mengklasifikasikan senyawa hidrokarbon dan penamaannya.
4. Mampu mengklasifikasikan senyawa organik berdasarkan gugus fungsional.
Kemampan akhir yang diharapkan setelah mengikuti Mata kuliah Kimia Organik
TINJAUAN MATA KULIAH
A. Deskripsi Mata Kuliah
B. Kompetensi Dasar
C. Kemampuan Akhir yang Diharapkan
mengklasifikasikan senyawa hidrokarbon dan penamaannya, dan mengklasifikasikan senyawa organik berdasarkan gugus fungsional.
D. Susunan Judul Modul dan Keterkaitan Antar Modul (Peta Kedudukan Modul)
Kimia Organik
Benzena dan Turunannya
Alkohol dan Eter Alkil Halida Hidrokarbon Alkena
dan Alkuna
Hidrokarbon Alkana Aldehid dan
Keton
Asam karboksilat dan Turunannya
Amina
Gugus Fungsi Senyawa Organik
Tinjauan Ulang Atom dan Molekul
Orbital dan Peranannya dalam Ikatan Kimia Kovalen
Konsep Dasar Kimia Organik Entry Behaviour Requairement
Untuk memudahkan dalam mempelajari mata kuliah ini, maka disediakan bahan ajar dalam bentuk modul. Modul ini dirancang untuk pelaksanaan pembelajaran mandiri sebelum dilaksanakan pertemuan baik secara tatap muka maupun secara daring. Ketika digunakan pada pembelajaran mandiri, ikutilah petunjuk berikut agar memudahkan dalam mempelajarinya.
1. Pahami tujuan kegiatan pembelajaran dari setiap modul agar dapat mengukur ketercapaian pembelajarannya.
2. Pelajari materi kegiatan belajar dengan seksama sesuai dengan selera, situasi dan kondisi yang dikehendaki.
3. Jika dirasa telah paham dengan materi yang dipelajari, kerjakan latihan yang ada pada kegiatan belajar.
4. Cocokkan hasil pekerjaan latihan dengan kunci jawaban latihan yang tersedia di bawah contoh soal latihan.
5. Jika ada yang belum sesuai antara hasil pekerjaan latihan dengan kunci jawaban, pelajari kembali materi dari soal latihan yang belum terjawab dengan benar, kemudian coba lagi mengerjakan soal latihannya hingga jawabannya benar.
6. Setelah semua soal latihan terjawab dengan benar, kerjakanlah soal tesnya.
7. Cocokkan hasil pengerjaan soal tes formatif dengan kunci jawaban yang tersedia pada bagian akhir dari modul ini.
8. Jika ada yang belum sesuai antara hasil pengerjaan soal tes formatif dengan kunci jawaban, ulangi kembali mengerjakan soal tersebut sampai jawabannya benar.
9. Selama mempelajari isi bahan ajar ini, diperkenankan menggunakan referensi lain atau minta keterangan dari teman sejawat atau dosen pengampu.
10. Setelah menyelesaikan semua aktivitas pembelajaran dan dirasa telah menguasai materi sesuai dengan tujuan pembelajaran, disarankan menemui dosen pengampu untuk tindak lanjutnya.
E. Petunjuk Umum Mempelajari Mata Kuliah
1. Mahasiswa mampu menjelaskan pengertian kimia organik.
2. Mahasiswa mampu menjelaskan jenis-jenis kimia organik.
Sejarah Penemuan Kimia Organik
Senyawa organik merupakan senyawa yang sudah dikenal lama dalam kehidupan manusia. Mesir kuno telah menggunakan pewarna indigo (biru) dan alizarin (merah Turki) untuk mewarnai kain. Mesir kuno juga telah mampu mengawetkan mayat (mumi) menggunakan formalin. Orang-orang Phoenix menggunakan warna ungu kerajaan yang diperoleh dari molusca sebagai bahan pewarna kain.
Pada Abad ke-18, Seorang ahli kimia dari Swedia menyimpulkan bahwa Senyawa organik diperoleh dari makhluk hidup yang dapat mempengaruhi proses penting (Torbern Bergman, 1770). Selanjutnya, senyawa organik diartikan sebagai senyawa kimia yang diperoleh dari makhluk hidup. Sampai abad ke-19 para ahli kimia masih mempercayai bahwa zat-zat semacam senyawa organik hanya terdapat dalam mahluk hidup dengan bantuan tenaga gaib (vital force) dan tidak dapat disintesis di laboratorium.
Pada awal perkembangan ilmu kimia sebagai ilmu pengetahuan, berlaku klasifikasi senyawa ke dalam senyawa organik dan senyawa anorganik berdasarkan asal-usul senyawa.
Semua senyawa yang berasal dari makhluk hidup digolongkan ke dalam senyawa organik, sedangkan yang berasal dari mineral digolongkan dalam senyawa anorganik. Pada waktu itu diyakini hanya dapat terjadi oleh adanya pengaruh dari daya yang dimiliki makhluk hidup
MODUL I PENGANTAR KIMIA ORGANIK
Kegiatan Belajar 1
1. Tujuan Kegiatan Pembelajaran
2. Uraian Materi
(senyawa organik) dari ammonium sianat (senyawa anorganik) pada tahun 1828, maka goyahlah keyakinan adanya pengaruh ―vital vorce‖ dalam pembentukan senyawa organik.
Pada tahun 1828 Friedrich Wöhler (1800-1882) kimiawan dari Jerman berhasil mensintesis senyawa organik dari senyawa anorganik, yaitu dari amonium sianat/NH4OCN yang dipanaskan menghasilkan urea (H2N-CO-NH2), dengan reaksi:
KOCN + NH4Cl KCl + NH4OCN (senyawa anorganik) NH4OCN H2N – CO – NH2
(senyawa organik)
Dalam perkembangan selanjutnya diperoleh suatu kesimpulan bahwa di antara senyawa organic dan anorganik tidak ada perbedaan mengenai hukum-hukum kimia yang berlaku. Meskipun diantara senyawa organik dan anorganik tidak ada perbedaan yang hakiki sebagai senyawa kimia, namun pengkajiannya tetap dipandang perlu dipisahkan dalam cabang kimia yang spesifik.
Abad ke-20, ditemukan bahwa asam-asam amino yang merupakan blok pembangun kehidupan ternyata dapat disintesis dari bahan yang sederhana, yakni metana, amoniak, dan air.
Secara garis besar alasan yang melandasi pemisahan bidang kajian kimia organik dan kimia anorganik adalah:
1. Jumlah senyawa organik jauh lebih banyak daripada senyawa anorganik.
2. Semua senyawa organik mengandung atom karbon, yang mempunyai keunikan dalam hal kemampuannya membentuk rantai dengan sesama atom karbon, dan mempunyai sifat yang khas.
Definisi Kimia Organik
Definisi Kimia menurut Kamus Merriam-Webster, Kimia adalah ilmu yang mempelajari komposisi, struktur, sifat suatu zat dan transformasi energi yang terjadi di dalamnya. Menurut Kamus Webster 1913, organik adalah substansi/zat yang berasal dari alam yang berhubungan dengan proses penting. Pengertian kimia organik kemudian mengalami perkembangan seiring dengan temuan-temuan penting di bidang kimia organik yang muncul dari tahun ke tahun.
Kimia organik adalah cabang ilmu kimia yang mempelajari sifat, struktur, mekanisme, dan reaksi senyawa organik. Untuk membedakan dengan senyawa anorganik maka senyawa organik adalah senyawa yang dibangun oleh rantai karbon, mempelajari kimia organik sangat penting bagi orang yang ingin mempelajari farmasi, biokimia, fitokimia, sintesis kimia dan ilmu lain.
Kimia organik merupakan disiplin ilmu kimia yang spesifik membahas studi mengenai struktur, sifat, komposisi, reaksi dan persiapan (sintesis atau arti lainnya) tentang persenyawaan kimiawi yang bergugus karbon dan hidrogen, yang dapat juga terdiri atas beberapa elemen lain, termasuk nitrogen, oksigen, unsur halogen, fosfor, silikon dan belerang.
Definisi asli dari kimia organik ini berasal dari kesalahpahaman bahwa semua senyawa organik pasti berasal dari organisme hidup, namun telah dibuktikan bahwa ada beberapa perkecualian. Bahkan sebenarnya, kehidupan juga sangat bergantung pada kimia anorganik; sebagai contoh, banyak enzim yang mendasarkan kerjanya pada logam transisi seperti besi dan tembaga, juga gigi dan tulang yang komposisinya merupakan campuran dari senyama organik maupun anorganik. Contoh lainnya adalah larutan HCl, larutan ini berperan besar dalam proses pencernaan makanan yang hampir seluruh organisme (terutama organisme tingkat tinggi) memakai larutan HCl untuk mencerna makanannya, yang juga digolongkan dalam senyawa anorganik. Mengenai unsur karbon, kimia anorganik biasanya berkaitan dengan senyawa karbon yang sederhana yang tidak mengandung ikatan antar karbon misalnya oksida, garam, asam, karbid, dan mineral. Namun hal ini tidak berarti bahwa tidak ada senyawa karbon tunggal dalam senyawa organik misalnya metana dan turunannya. Kimia organik sebagai suatu ilmu secara umum disetujui telah dimulai pada tahun 1828 dengan sintesis urea organik oleh Friedrich Woehler, yang secara tidak sengaja menguapkan larutan ammonium sianat NH4OCN.
Perbedaan Antara Senyawa Organik dengan Senyawa Anorganik
Perbedaan antara senyawa organik dengan senyawa anorganik, ditabulasi dalam Tabel 1.1 berikut.
Tabel 1.1 Perbedaan Antara Senyawa Organik dengan Senyawa Anorganik
No Senyawa organik Senyawa Anorganik
1 Kebanyakan berasal dari makhluk hidup dan beberapa dari hasil sintesis
Berasal dari sumber daya alammineral (bukan makhluk hidup)
2 Senyawa organik lebih mudah terbakar Tidak mudah terbakar 3 Strukturnya lebih rumit Struktur sederhana 4 Semua senyawa organik mengandung
unsur karbon
Tidak semua senyawa anorganik yang memiliki unsur karbon
5 Hanya dapat larut dalam pelarut organik Dapat larut dalam pelarut air atau organik.
6 CH4, C2H5OH, C2H6 dsb NaF, NaCl, NaBr, NaI dsb
Beberapa Senyawa Organik dalam Kehidupan
Senyawa organik dapat dijumpai hampir di setiap sudut kehidupan manusia, baik di luar maupun dalam tubuh manusia, beberapa diantaranya yaitu:
1. Biomolekul
Karbohidrat/gula
Lipid
Asam-asam amino/protein
Basa heterosiklik (DNA)
2. Bahan Alam
Paclitaxel (TaxolTM). Senyawa antikanker yang diisolasi (diambil lalu dimurnikan) dari kulit kayu pohon Yew.
Epibatidine. Senyawa analgesik (penghilang rasa nyeri) yang diisolasi dari kulit kodok Epipedobates anthonyi.
3. Sintesis
Polimer
Zat warna
• Obat-obatan (farmasetik)
Senyawa organik tidak hanya berasal dari makhluk hidup. Pengembangan dan kemajuan teknologi membuktikan bahwa senyawa organik dapat disintesis dari senyawa anorganik, seperti hasil penelitian yang membuktikan bahwa amonium sianat/NH4OCN (senyawa anorganik) yang dipanaskan menghasilkan urea (H2N-CO-NH2, senyawa organik).
Beberapa jenis senyawa organik dapat dijumpai dalam kehidupan sehari-hari, yaitu:
1. Biomolekul 2. Bahan alam 3. Sintesis
1. Jelaskan pengertian kimia organik!
2. Jelaskan perbedaan antara senyawa organik dan anorganik!
Tes Formatif 1
1. Kimia organik merupakan disiplin ilmu kimia yang spesifik membahas studi mengenai struktur, sifat, komposisi, reaksi dan persiapan (sintesis atau arti lainnya) tentang persenyawaan kimiawi yang bergugus karbon dan hidrogen, yang dapat juga terdiri atas beberapa elemen lain, termasuk nitrogen, oksigen, unsur halogen, fosfor, silikon dan belerang.
2. perbedaan antara senyawa organik dan anorganik, yaitu:
Senyawa organik:
- Kebanyakan berasal dari makhluk hidup dan beberapa dari hasil sintesis - Senyawa organik lebih mudah terbakar
- Strukturnya lebih rumit
- Semua senyawa organik mengandung unsur karbon - Hanya dapat larut dalam pelarut organik
4. Tes Formatif
Kunci Jawaban
3. Rangkuman
Senyawa Anorganik
- Berasal dari sumber daya alammineral (bukan makhluk hidup) - Tidak mudah terbakar
- Struktur sederhana
- Tidak semua senyawa anorganik yang memiliki unsur karbon - Dapat larut dalam pelarut air atau organic
- Contohnya: NaF, NaCl, NaBr, NaI dsb
1. Fessenden & Fessenden. 1982. Kimia Organik. Edisi Ketiga. Jilid I. Alih Bahasa Aloysius Hadyana Pudjaatmaka. Penerbit Erlangga. Jakarta.
2. Stanley H Pine, James B. Hendrickson, Donald J Cram, & George S. Hammond. Kimia Organik. Edisi Keempat. Penerbit ITB. Bandung.
3. Harold Hart, Leslie E. Craine, & David J. Hart. 2003. Kimia Organik. Edisi Kesebelas.
Alih Bahasa Suminar Setiati Achmadi. Penerbit Erlangga. Jakarta.
Daftar Pustaka
1. Mampu menjelaskan konsep struktur elektron dari atom.
2. Mampu menjelaskan jari-jari atom dan keelektronegatifan.
Struktur Elektron dari Atom
Dalam Kimia Organik ada 4 unsur yang harus dimengerti atau dipahami diantaranaya adalah C (karbon), H (Hidrogen), O (Oksigen) dan N (Nitrogen). Keempat unsur ini ada di kedua periode pertama dari susunan dan elektronnya terdapat dalam dua kulit elektron yang paling dekat dengan inti.
Setiap kulit elektron berhubungan dengan sejumlah energi tertentu. Elektron yang paling dekat dengan inti lebih tertarik oleh proton dalam inti daripada elektron yang lebih jauh kedudukannya. Karena itu, semakin dekat elektron terdapat ke inti, semakin rendah energinya, dan elektron ini sukar berpindah dalam reaksi kimia. Kulit elektron yang terdekat ke inti adalah kulit yang terendah energinya, dan elektron dalam kulit ini dikatakan berada pada tingkatan energi pertama. Elektron dalam kulit kedua, yaitu pada tingkat energi kedua mempunyai energi yang lebih tinggi daripada elektron dalam tingkat pertama, dan elektron dalam tingkat ketiga atau pada tingkat energi ketiga, mempunyai energi yang lebih tinggi lagi.
Orbital atom merupakan bagian dari ruang di mana kebolehjadian ditemukannya sebuah elektron dengan kadar energi yang khas (90% - 95%). Rapat elektron adalah istilah lain yang digunakan untuk menggambarkan kebolehjadian ditemukannya sebuah elektron pada titik tertentu; rapat elektron yang lebih tinggi, berarti kebolehjadiannya lebih tinggi, sedangkan rapat elektron yang lebih rendah berarti kebolehjadiannya juga rendah.
MODUL II
TINJAUAN ULANG ATOM DAN MOLEKUL
Kegiatan Belajar 1
1. Tujuan Kegiatan Pembelajaran
2. Uraian Materi
Kulit elektron pertama hanya mengandung orbital bulat 1s. Kebolehjadian untuk menemukan elektron 1s adalah tertinggi dalam bulatan ini. Kulit kedua, yang agak berjauhan dari inti daripadakulit pertama, mengandung satu orbital 2s dan tiga orbital 2p. Orbital 2s seperti orbital 1s, adalah bulat.
Jari-Jari Atom
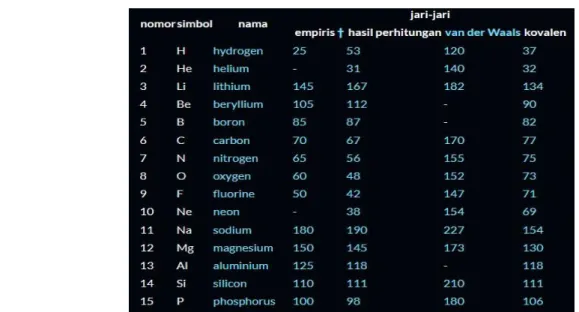
Jari-jari atom adalah jarak dari pusat inti ke elektron paling luar. Jari-jari atom ditentukan dengan mengukur panjang ikatan (jarak antara inti) dalam senyawa kovalen seperti pada Cl – Cl atau H – H kemudian membaginya dengan dua. Jari-jari atom sering disebut jari- jari kovalen. Satuan jari-jari atom adalah Angstrom (Å), 1 Å = 10-8 cm.
Terdapat beberapa jenis jari-jari atom yang dipakai untuk menyatakan jarak dari inti atom ke lintasan stabil yang paling luar dari elektronnya, di antaranya yaitu :
Jari-jari kovalen
Jari-jari logam
Jari-jari van der Waals
Ketiganya dipilih disebabkan oleh perbedaan dari sifat-sifat elemen yang diukur.
1. Jari-jari Kovalen
Jari-jari atom diukur memakai jari-jari kovalen untuk elemen-elemen yang mempunyai jenis ikatan kovalen. Pada umumnya elemen-elemen ini merupakan elemen- elemen non-logam. Secara teknis jarak yang diukur yaitu setengah dari jarak internuklir antara dua atom bertetangga terdekat dalam kisi kristal. Jari-jari kovalen untuk elemen-elemen yang tidak bisa berikatan bisa diperkirakan dengan cara melakukan kombinasi jari-jari dari elemen- elemen yang bisa berikatan pada molekul untuk atom yang berbeda atau tak sama.
2. Jari-jari Logam
Jari-jari atom diukur memakai jari-jari logam untuk elemen-elemen yang termasuk pada elemen-elemen logam. Jari-jari logam yaitu setengah jarak dari jarak internuklir terdekat dari atom-atom dalam kristal logam.
3. Jari-jari Van Der Waals
Jari-jari atom diukur memakai jari-jari van der Waals untuk elemen yang atom- atomnya tak bisa saling berikatan. Contoh dari kelompok ini yaitu gas mulia, di mana dikatakan bahwa atom-atom dari elemen ini tidak termampatkan atau terpadatkan.
Dalam tabel periodik, jari-jari atom bertambah nilainya palu satu golongan ke bawah sejalan dengan bertambahnya lintasan elektron, dan berkurang kiri ke kanan karena dengan bertambahnya muatan inti – dengan perkecualian untuk golongan gas mulia.
Tabel 2.1 Nilai Jari Jari Atom Hasil Perhitungan Van Der Waals
Faktor-faktor yang mempengaruhi panjang jari-jari atom, yaitu:
1. Jumlah Kulit Atom
Semakin banyak jumlah kulit yang dimiliki pada suatu atom, maka jari-jari atomnya juga semakin panjang. Nilai senyama atom Natrium lebih panjang daripada Litium, dikarenakan jumlah kulit yang dimiliki atom Natrium itu lebih banyak daripada atom Litium itu sendiri.
2. Muatan Inti Atom
Apabila jumlah kulit dari dua atom adalah sama banyak, maka yang berpengaruh pada panjangnya yaitu muatan inti atom. Makin banyak inti atom berarti makin besar juga muatan intinya dan gaya tarik inti atom pada elektron lebih kuat hingga elektron lebih mendekat ke inti atom.
Dalam tabel periodik dapat diamati bahwa:
a. Di dalam satu periode dari kiri kekanan semakin pendek, sedangkan unsur satu golongan dari atas ke bawah semakin panjang. Hal ini bisa dijelaskan bahwasanya kecenderungan
b. Pada satu periode dari kiri ke kanan muatan inti semakin bertambah, sedangkan jumlah kulit elektronnya tetap, akibatnya yaitu gaya tarik inti pada elektron terluar makin kuat hingga menngakibatkan jarak elektron kulit terluar dengan inti makin dekat.
c. Dalam satu golongan semakin ke bawah jumlah kulit semakin banyak walaupun dalam hal ini jumlah muatan inti semakin banyak, Akan tetapi pengaruh bertambahnya jumlah kulit itu lebih besar daripada pengaruh muatan inti, mengakibatkan jarak elektron kulit terluar terhadap inti semakin jauh
Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom untuk bermuatan negatif atau untuk menangkap elektron dari atom lain. Besarnya keelektronegatifan dapat diukur dengan menggunakan skala Pauling. Harga skala Pauling berkisar antara 0,7 – 4,0.
Skala Pauling adalah skala yang dikenalkan pertama sekali tahun 1932, dan merupakan skala yang paling sering digunakan dalam pengukuran elektronegativitas suatu unsur. Fluor (unsur yang paling elektronegatif) diberikan skala Pauling dengan harga 4,0, dan harganya menurun sampai cesium dan fransium yang setidaknya hanya memiliki elektronegatifitas pada skala 0,7.
Dalam skala Pauling:
• Fluor, unsur yang paling elektronegatif, mempunyai nilai keelektronegatifan 4.
• Litium, keelektronegatifannya rendah, mempunyai nilai 1.
• Suatu unsur dengan keelektronegatifan yang sangat rendah (seperti litium) kadang- kadang disebut unsur elektropositif.
• Karbon mempunyai nilai keelektronegatifan menengah yaitu 2,5
Unsur-unsur dalam periode yang sama dari kiri ke kanan, muatan inti atom makin bertambah sehingga gaya tarik inti ke elektron terluar bertambah. Akibatnya, jari-jari atom makin kecil, energi ionisasi makin besar, afinitas elektron makin besar (makin negatif), dan kecenderungan untuk menarik elektron makin besar.
Potensial Ionisasi atau energi ionisasi adalah energi minimum yang diperlukan oleh suatu atom netral atau ion untuk melepas 1 buah elektron yang terikat paling luar dalam fase gas. Energi ionisasi dinyatakan dalam kJ mol–1. Semakin kecil jari-jari atom, potensial ionisasinya cenderung semakin besar. Hal ini karena semakin kecil jari-jari atom, akan semakin kuat suatu elektron ditarik oleh inti atom sehingga diperlukan energi yang lebih besar untuk melepaskan elektron tersebut.
Dalam kimia organik ada 4 unsur yang harus dimengerti atau dipahami diantaranaya adalah C (Karbon), H (Hidrogen), O (Oksigen) dan N (Nitrogen). Keempat unsur ini ada di kedua periode pertama dari susunan dan elektronnya terdapat dalam dua kulit elektron yang paling dekat dengan inti. Orbital atom merupakan bagian dari ruang di mana kebolehjadian ditemukannya sebuah elektron dengan kadar energi yang khas (90% - 95%). Setiap kulit
3. Rangkuman
Jari-jari atom adalah jarak dari pusat inti ke elektron paling luar. Jari-jari atom ditentukan dengan mengukur panjang ikatan (jarak antara inti) dalam senyawa kovalen seperti pada Cl – Cl atau H – H kemudian membaginya dengan dua. Jari-jari atom sering disebut jari- jari kovalen. Satuan jari-jari atom adalah Angstrom (Å), 1 Å = 10-8 cm.
Keelektronegatifan adalah kecenderungan suatu atom untuk bermuatan negatif atau untuk menangkap elektron dari atom lain. Besarnya keelektronegatifan dapat diukur dengan menggunakan skala Pauling. Harga skala Pauling berkisar antara 0,7 – 4,0.
1. Bagaimana jari-jari atom dalam satu golongan dan satu periode dalam Tabel Periodik Unsur!
2. Bagaimana sifat keelektronegatifan unsur-unsur satu golongan dibandingkan dengan kenaikan nomor atomnya?
3. Bagaimana sifat keelektronegatifan unsur-unsur satu periode dibandingkan dengan kenaikan nomor atomnya?
1. Mampu menjelaskan hubungan antara elektron dan ikatan kimia, serta rumus kimia dalam kimia organik.
2. Mampu menjelaskan hubungan antara panjang ikatan dan sudut ikatan, serta energi disosiasi ikatan.
Pengantar Ikatan Kimia
G. N. Lewis (1875-1946) dan W. Kossel (1853-1927) mengaitkan kestabilan gas mulia dengan konfigurasi elektronnya. Gas mulia mempunyai konfigurasi penuh yaitu konfigurasi oktet (mempunyai 8 elektron pada kulit terluar) kecuali helium dengan
Kegiatan Belajar 2
1. Tujuan Kegiatan Pembelajaran
2. Uraian Materi
4. Tes Formatif
konfigurasi oktet dengan melepas atau menerima elektron tambahan, dan menggunakan pasangan elektron bersama. Hal itulah yang terjadi ketika unsur-unsur membentuk ikatan.
Kecenderungan unsur-unsur menjadikan kofigurasi elektronnya sama seperti gas mulia terdekat dikenal sebagai aturan oktet.
Atom dapat terikat menjadi molekul dengan cara yang berbeda-beda karena struktur elektron berbeda-beda. Teori G. N. Lewis dan W. Kossel, yaitu:
a. Ikatan ion dihasilkan dari perpindahan elektron dari satu atom ke atom yang lain.
b. Ikatan kovalen dihasilkan dari penggunaan bersama-sama sepasang elektron oleh dua atom.
c. Atom memindahkan atau membuat pasangan elektron untuk mencapai konfigurasi elektron gas mulia. Konfigurasi ini biasanya adalah delapan elektron dalam kulit terluar, sesuai dengan konfigurasi elektron dari Neon dan Argon. Aturan ini disebut Aturan Oktet.
Ketika dua atom atau ion ―berpegangan‖ dengan sangat erat, dapat dikatan bahwa diantaranya terdapat suatu ikatan kimia. Dalam pembentukannya, yang berperan adalah elektron valensi, yaitu elektron yang berada pada kulit terluar. Untuk memudahkan penggambaran elektron valensi pada atom suatu unsur dan ikatan yang terbentuk dapat digunakan simbol Lewis (simbol titik-elektron Lewis).
Simbol Lewis dari suatu unsur terdiri dari simbol unsur tersebut dan satu titik untuk setiap satu elektron valensi yang dimilikinya. Sebagai contoh, perhatikan simbol Lewis untuk unsur-unsur golongan utama periode 2 dan 3 berikut.
Atom unsur-unsur golongan gas mulia (golongan VIII A) dengan 8 elektron valensi memiliki sifat sangat stabil (tidak reaktif), energi ionisasi tinggi, dan afinitas elektron rendah.
Pada umumnya semua atom berusaha untuk menerima, atau melepas, ataupun saling berbagi elektron agar memiliki jumlah elektron yang sama dengan atom gas mulia dengan nomor
observasi ini mengacu pada rumusan teori: aturan oktet, yang menyatakan bahwa atom-atom cenderung akan menerima, atau melepas, ataupun saling berbagi (sharing) elektron sehingga memiliki 8 elektron valensi.
Atom-atom cenderung ingin berikatan karena dengan adanya ikatan, energi potensial antara partikel positif dan partikel negatif — entah antar ion dengan muatan yang berlawanan ataupun antar inti dengan elektron-elektron di antaranya — akan lebih rendah. Ikatan kimia dibagi menjadi 3 jenis berdasarkan 3 cara kombinasi dari unsur logam dan unsur nonlogam, yakni logam dengan non logam (ikatan ionik), non logam dengan non logam (ikatan kovalen), dan logam dengan logam (ikatan logam).
A. Ikatan Ionik (Ikatan Elektrovalen): “Transfer Elektron”
Ikatan ionik adalah pemindahan satu atau lebih elektron valensi dari satu atom ke atom yang lain. Atom yang menyerahkan elektron menjadi bermuatan positif, yaitu kation. Atom yang menerima elektron menjadi bermuatan negatif, dinamakan anion. Atom logam (energi ionisasi rendah) cenderung melepaskan elektronnya, lalu diterima oleh atom nonlogam (afinitas elektron besar). Dari proses transfer elektron dari atom logam ke atom nonlogam ini akan terbentuk ion positif dan ion negatif dengan konfigurasi elektron gas mulia yang saling tarik menarik dengan gaya elektrostatis yang disebut ikatan ionik. Sebagai contoh, dalam pembentukan senyawa ionik NaCl terjadi transfer elektron dari atom Na ke atom Cl.
. .
. . : :
Na + Cl Na+
+
. . . .
Cl : -
natriumatom atom klor
kation natrium
anion klor
-
-
- -
- -
- -
- +
+ +
+ +
+ +
+
+ -
B. Ikatan Kovalen: “Sharing Elektron”
Atom-atom nonlogam cenderung tidak ingin melepaskan elektronnya (energi ionisasi tinggi) dan ingin menarik elektron-elektron dari atom lainnya (afinitas elektron besar) sehingga terdapat satu atau lebih pasangan elektron yang dipakai untuk berbagi bersama.
Ikatan kimia yang terbentuk dari sharing elektron terlokalisasi antara atom ini disebut ikatan kovalen. Sebagai contoh, 2 atom H berikatan kovalen membentuk molekul H2 dan 2 atom Cl berikatan kovalen membentuk molekul Cl2.
Pada waktu dua atom hidrogen bergabung membentuk molekul, sejumlah kalor dibebaskan. Sebaliknya, jumlah kalor (energi) diperlukan dalam usaha memecahkan molekul menjadi atom-atomnya. Untuk memecah 1 mol molekul hidrogen (satu gram bobot molekul, yaitu 2 gram) menjadi atom-atomnya diperlukan kalor 104 kcal (atau 435 kJ).
Struktur Lewis untuk senyawa kovalen dapat digambarkan dengan setiap pasangan elektron ikatan (PEI) digambarkan sebagai satu garis dan pasangan elektron bebas (PEB) digambarkan sebagai titik-titik. Berikut struktur Lewis untuk beberapa senyawa kovalen.
Ikatan kovalen dengan berbagi satu pasangan elektron disebut sebagai ikatan kovalen Na + Cl..
-
Na Cl Na Cl-
+
+ +
: : .. :
.. ..
. .
atau
satu elektron dipindahkan dari Na ke Cl
sekarang tiap atom mempunyai oktet lengkap dalam kulit ter- luarnya. (kulit terluar terisi dari Na tak ditunjukkan)
rangkap dua, contohnya CO2. Ikatan kovalen dengan berbagi tiga pasangan elektron disebut ikatan rangkap tiga, contohnya N2.
Menurut Gilbert Newton Lewis, Gas mulia Helium hanya mempunyai dua elektron di sekeliling inti Gas mulia Neon, mempunyai 10 elektron. Sedangkan menurut G. N. Lewis, atom gas mulia tidak bergabung dengan atom lain sehingga mempunyai susunan elektron yang paling stabil. Atom lain kemungkinan bereaksi untuk mencapai keadaan dengan susunan stabil ini. Cara pembentukan ikatan yaitu melalui pemindahan seluruh elektron dari satu atom ke atom lain dan melalui penggunaan elektron bersama.
Berikut ini merupakan contoh karbon dan ikatan kovalen:
Kalor lebih sedikit diperlukan untuk memutuskan ikatan karbon-karbon pada etana dibandingkan dengan ikatan hidrogen-hidrogen pada molekul hidrogen. Ikatan karbon-karbon pada metana lebih panjang (1,54 Å) dibandingkan ikatan hidrogen-hidrogen (0,74 Å) dan juga agak lemah. Memutuskan ikatan karbon-karbon dengan kalor adalah langkah pertama dalam cracking minyak bumi, satu proses komersial penting dalam pengolahan bensin.
Banyaknya ikatan kovalen tergantung pada banyaknya elektron tambahan yang diperlukan untuk mencapai konfigurasi gas mulia.
H:C:H H..
H..
atau H C H
H H
metana
Cl C Cl
Cl Cl C atau
:Cl: . . . .
:Cl: . . . . :Cl
. .: :Cl
. .:
karbon tetra klorida
C. Ikatan Kovalen Polar
Ikatan kovalen yang dapat dibentuk antara atom sejenis (H-H, C-C) dan atom yang nilai elektronegatifitasnya tidak terlalu berbeda seperti (C-H, C-Cl) karena elektronegativitas atom tidak terlalu jauh disebut ikatan kovalen polar. Polarisasi ikatan ditunjukkan dengan tanda panah yang kepalanya menuju ke tanda negatif dan ekornya berada pada tanda positif.
Cara lain, muatan parsial ditulis dengan + dan - (dibaca ―delta plus‖ dan ―delta minus‖ atau
‖parsial positif‖ dan ‖parsial negatif‖).
D. Ikatan Kovalen Ganda
Dua pasang elektron digunakan bersama antara karbon dan oksigen. Oleh karena itu ikatannya dinamakan ikatan rangkap dua (double bond). Setiap atom oksigen masih mempunyai dua pasang elektron yang tidak melakukan ikatan bebas, atau pasangan elektron yang tidak melakukan ikatan bersama
Hidrogen sianida, HCN, adalah contoh senyawa sederhana dengan ikatan rangkap tiga, yaitu ikatan yang menggunakan bersama tiga pasang elektron.
. . . .
O C O
XX
XX
XX XX
XX
XX
. . . .
O C O
XX
XX
XX XX
XX
XX
. . . .
O C O
XX
XX
XX XX
XX
XX
H XC xxx atau atau
... N H C N H C NXX
hidrogen sianida
=
H H
H
H H
H C C C C H C C H
Rumus Kimia dalam Kimia Organik
Dalam ilmu Kimia ada beberapa cara untuk menuliskan rumus-rumus senyawa kimia organik, dalam hal ini ada 3 hal:
1. Rumus Empiris 2. Rumus Molekul 3. Rumus Struktur
1. Rumus Empiris
Rumus Empiris adalah rumus yang memperlihatkan perbandingan yang paling sederhana dari unsur-unsur dalam senyawa. Misalnya asetilen dan benzena keduanya mempunyai rumus empiris yang sama. Rumus ini jarang dipakai karena kita tidak dapat mengetahui apa-apa mengenai struktur dari molekul-molekul jenis dimana atom-atom terikat bersama.
Contoh :
Rumus empirisnya senyawa Etana (C2H6) adalah CH3
C : H 1 : 3
2. Rumus Molekul
Rumus Molekul adalah rumus yang menunjukan jumlah nyata atom dalam molekul sekaligus perbandingannya. Misalnya rumus molekul untuk asetilen dan benzena masing- masing adalah C2H2 dan C6H6, dari sini bisa dilihat bahwa setiap atom asetilen memiliki dua atom C dan dua atom H, dan begitu juga untuk benzena yang memiliki 6 atom karbon dan enam atom hidrogen.
Contoh:
Rumus molekul senyawa Propanol adalah C3H8O.
3. Rumus Struktur
Rumus Struktur adalah rumus yang menunjukan struktur dari molekul, semua ikatan valensi dan atom-atom yang dihubungkannya dalam molekul, dan merupakan rumus yang paling berguna dan sering digunakan dalam kimia organik, karena dapat meramalkan keaktifan kimianya.
Dalam rumus struktur masih dibagi menjadi 3 rumus lagi, yaitu:
a. Rumus Lewis
Rumus Lewis yaitu rumus yang menggunakan tanda ―.‖ (titik) sebagai elektron valensi, rumus ini tudak dipakai secara luas karena sukar dalam menggambarkannya.
Contoh: CH4
b. Rumus Ikatan-Garis :
Rumus Ikatan-Garis yaitu rumus yang menunjukan tiap pasang elektron yang berikatan dengan garis.
Contoh : H2
Untuk lebih mudahnya, rumus ikatan garis dapat disederhanakan menjadi Rumus Struktur Sederhana yaitu rumus yang memperlihatkan ikatan tetapi yang masih juga dapat menyimpulkan strukturnya.
Contoh C2H6
c. Rumus Tiga Dimensi
Rumus Tiga Dimensi yaitu rumus yang menunjukan ikatan yang menonjol dikertas, dengan bentuk segitiga panjang, biasanya digunakan apabila dinginkan sifat utama tiga dimensinya dari molekul kecil, dengan rumus tiga dimensi ini juga kita juga dapat menggambarkan struktur lain yang mengandung karbon tetrahedral.
Contoh : CH4
Rumus struktur lengkap sering dimampatkan menjadi rumus yang lebih pendek dan lebih sederhana.
Rumus struktur dapat dimampatkan lebih jauh bila molekul mempunyai dua atau lebih gugus atom yang identik. Tanda kurung digunakan untuk gugus atom yang berulang diikuti subskrip untuk menyatakan jumlah gugus yang berulang dalam suatu molekul.
(CH3)2CHOH
(CH3)3CCl
CH3(CH2)3CH3 CH3CH2CH2CH2CH3
Senyawa yang mengandung cincin satau atau lebih disebut senyawa siklik. Struktur siklik biasanya dinyatakan dengan rumus 24ubstit (segi banyak), yang merupakan jenis lain dari rumus struktur termampatkan.
C CH3
H
H3C OH
C CH3
CH3
H3C Cl
Panjang Ikatan dan Sudut Ikatan
Panjang ikatan adalah jarak antara inti dari dua atom yang terikat kovalen. Sudut ikatan adalah sudut yang terbentuk dalam ikatan bila ada lebih dari dua atom dalam molekul.
Kebanyakan struktur organik mengandung lebih dari tiga atom dan lebih bersifat berdimensi tiga daripada berdimensi dua.
Energi Disosiasi Ikatan
Bila atom saling terikat membentuk molekul, maka akan melepaskan energi (panas atau cahaya). Bila molekul diuraikan (disosiasi) menjadi atom-atom maka memerlukan energi.
Ada 2 cara untuk mendisosiasi ikatan, yaitu:
1. Pemaksapisahan heterolitik
2. Pemaksapisahan homolitik
Pemaksapisahan homolitik menghasilkan atom yang mempunyai elektron tak berpasangan yang disebut dengan radikal bebas. Radikal bebas tidak stabil dan sangat reaktif.
H H
O
sudut i katan 104,5oe
panjang i katan 0,96 Ao
N H
H H
panjang i katan
sudut i katan
1,008
107,3
o
Ao
N H
H H
ke muka, menghadap ke pengamat
di belakang, menjauhi pengamat
dalam bidang kertas
Pemaksapisahan homolitik lebih berguna daripada pemaksapisahan heterolitik dalam penentuan energi yang diperlukan untuk disosiasi ikatan karena perhitungan tidak disulitkan oleh tarikan ionik antara hasilnya. Untuk memecah ikatan yang stabil memerlukan energi yang lebih besar.
HF H + F ΔH = 135 kkal/mol
HOOH OH + OH ΔH = 35 kkal/mol
Atom yang dihubungkan oleh ikatan ganda memerlukan energi lebih banyak untuk disosiasi daripada ikatan tunggal.
230 kkal/mol 88 kkal/mol
Ikatan kimia dibagi menjadi 3 jenis berdasarkan 3 cara kombinasi dari unsur logam dan unsur nonlogam, yakni:
1. Ikatan logam dengan non logam (ikatan ionik),
2. Ikatan non logam dengan non logam (ikatan kovalen), dan 3. Ikatan logam dengan logam (ikatan logam).
Dalam ilmu Kimia ada beberapa cara untuk menuliskan rumus-rumus senyawa kimia organik, dalam hal ini ada 3 hal :
1. Rumus Empiris 2. Rumus Molekul
+ Cl +
..
.
+ . ..
.. ..
: :
H
Cl
H H H
H H
H H
.
.
H3C H3C. .
3. Rangkuman
H3C CH3
HC CH
1. Apakah yang dimaksud dengan ikatan ionik dan ikatan kovalen, berikan contohnya!
2. Suatu senyawa memiliki beberapa sifat, yaitu mudah larut dalam air, pada fase cair bersifat konduktor, memiliki titik didih dan titik leleh yang tinggi. Jenis ikatan kimia apakah yang membentuk senyawa tersebut? Jelaskan!
3. Jelaskan hubungan antara panjang ikatan dan energi disosiasi ikatan!
Tes Formatif 1
1.2. Dalam satu golongan bertambahnya nomor atom, keelektronegatifan makin kecil.
3. Dalam satu periode bertambahnya nomor atom, keelektronegatifan makin besar.
Tes Formatif 2
1. Ikatan ionik adalah ikatan yang terbentuk antar logam dan non logam dan menghasilkan senyawa polar berupa ion-ion dengan muatan yang berbeda. Contoh ikatan ionik adalah natrium klorida (NaCl) dan asam sulfat (H2SO4).
Ikatan kovalen adalah ikatan yang terbentuk antar non logam yang menghasilkan senyawa
4. Tes Formatif
Kunci Jawaban
2. Jenis ikatan ionik, karena ikatan ionik memiliki ciri-ciri titik didih dan titik leleh yang tinggi, bersifat keras namun tidak lentur, dan kebanyakan berupa garam. Senyawa ion bila dilarutkan dalam air atau dalam fase cair, dapat menghantarkan listrik atau bertindak sebagai konduktor.
3. Hubungan antara panjang ikatan dan energi disosiasi ikatan yaitu semakin besar panjang ikatan suatu senyawa kimia maka energi disosiasi yang dibutuhkan semakin kecil, dan sebaliknya, semakin kecil panjang ikatan senyawa kimia maka energi disosiasi yang dibutuhkan semakin besar.
1. Fessenden & Fessenden. 1982. Kimia Organik. Edisi Ketiga. Jilid I. Alih Bahasa Aloysius Hadyana Pudjaatmaka. Penerbit Erlangga. Jakarta.
2. Stanley H Pine, James B. Hendrickson, Donald J Cram, & George S. Hammond. Kimia Organik. Edisi Keempat. Penerbit ITB. Bandung.
3. Harold Hart, Leslie E. Craine, & David J. Hart. 2003. Kimia Organik. Edisi Kesebelas.
Alih Bahasa Suminar Setiati Achmadi. Penerbit Erlangga. Jakarta.
Daftar Pustaka
1. Mahasiswa mampu menjelaskan beberapa hal umum mengenai orbital ikatan dan anti- ikatan.
2. Mahasiswa mampu menjelaskan orbital hidrida karbon, nitrogen dan oksigen.
Ikatan dalam Hidrogen
Menurut Louis De Broglie: Elektron mempunyai sifat gelombang dan materi.
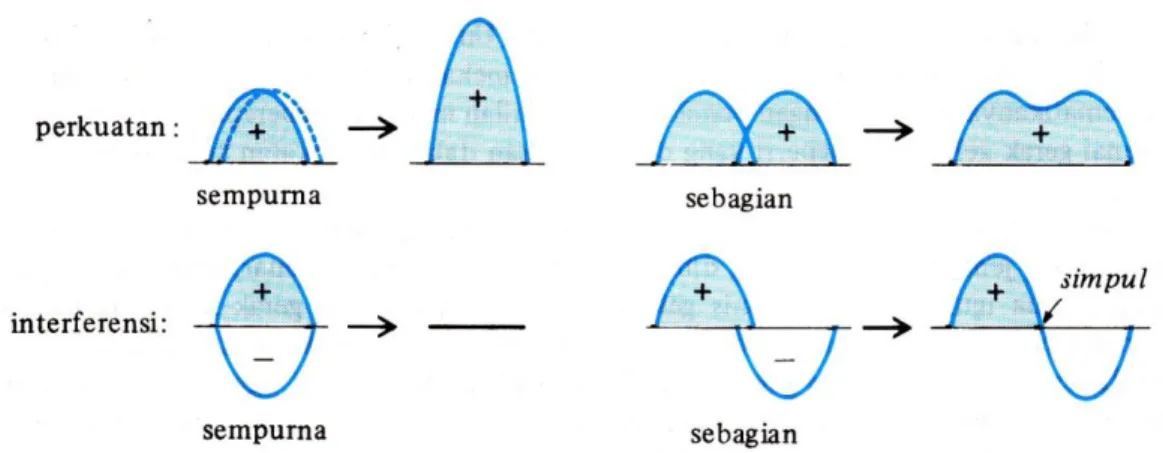
Pendapat ini menjadi cikal bakal konsep mekanika kuantum mengenai gerak elektron dan teori orbital molekul. Sistem gelombang elektron adalah berdimensi tiga. Untuk memahaminya dapat dikaitkan dengan konsep gelombang berdimensi satu dan dua, seperti gelombang diam (petikan pada senar gitar atau pukulan pada drum).
Gambar 3.1 Beberapa Gelombang Diam dari Senar yang Bervibrasi dengan Ujung Tertentu
Dua gelombang dapat sefase atau keluar fase. Gelombang sefase apabila amplitudo positif dan negatif dari dua gelombang saling sesuai. Gelombang keluar fase apabila amplitudo positif dan negatif dari dua gelombang saling berlawanan.
MODUL III
ORBITAL DAN PERANANNYA DALAM IKATAN KIMIA KOVALEN
Kegiatan Belajar 1
1. Tujuan Kegiatan Pembelajaran
2. Uraian Materi
Gambar 3.2 Dua Gelombang Diam dapat Sefase atau Keluar Fase
Gelombang sefase akan saling menguatan. Gelombang keluar fase akan saling melemahkan atau interferensi.
Gambar 3.3 Perkuatan dan Interferensi Gelombang
Orbital atom berkelakuan seperti fungsi gelombang dan dapat mempunyai amplitudo positif dan negatif. Bila orbital memiliki amplitudo positif dan negatif maka orbital mempunyai simpul.
Satu orbital atom dapat bertumpang tindih dengan orbital atom dari atom lain. Bila orbital yang bertumpang tindih sefase, hasilnya adalah perkuatan dan suatu orbital molekul ikatan. Antaraksi antara orbital atom yang keluar fase menghasilkan interferensi, yang menimbulkan simpul antara dua inti, maka akan menuju ke orbital molekul anti-ikatan.
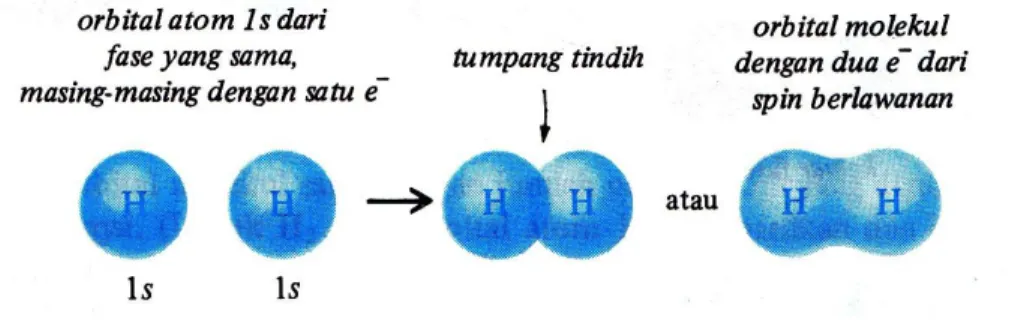
Hidrogen (H2) adalah molekul paling sederhana. Bila inti terdapat pada jarak tertentu dari yang lain, maka orbital atom akan bertumpang tindih untuk saling memperkuat dan membentuk orbital molekul ikatan. Panjang ikatan untuk H2 adalah 0,74 Å. Orbital molekul ini menghasilkan ikatan kovalen antara dua atom hidrogen dalam H2.
Gambar 3.5 Pembentukkan Orbital Molekul Ikatan H2
Ikatan Sigma
Orbital molekul yang mengikat dua atom hidrogen menjadi satu adalah simetrik secara silindrik artinya, simetrik sepanjang garis, atau sumbu, yang menghubungkan kedua inti.
Anggaplah sumbu sebagai poros, dan putarlah orbital sekeliling sumbu ini. Bila ketampakan orbital tidak berubah akibat putaran, orbital adalah simetrik sekeliling sumbu tersebut.
Gambar 3.6 Ikatan Sigma dari Hidrogen
Setiap orbital molekul yang simetrik sekeliling sumbu yang menghubungkan inti disebut orbital molekul sigma (); ikatannya adalah ikatan sigma. Ikatan dalam H2 hanya satu dari banyak ikatan sigma yang dijumpai.
B. Orbital Ikatan dan Orbital Anti-Ikatan
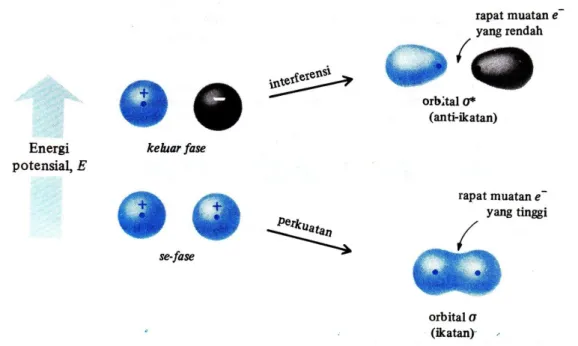
Bila sepasang orbital bertumpang tindih maka ada kemungkinan sefase yang akan menghasilkan perkuatan atau keluar fase yang menimbulkan interferensi.
Gambar 3.7 Perkuatan dan Iterferensi dari Dua Orbital 1s (Tanda + dan – menyatakan Fase dari Fungsi Gelombang, dan Bukan Muatan Listrik)
Orbital berenergi lebih tinggi disebut orbital anti-ikatan. Energi molekul H2 dengan dua elektron dalam orbital ikatan adalah lebih rendah sebesar 104 kkal/mol daripada energi gabungan dari dua atom hidrogen yang terpisah. Energi molekul hidrogen dengan elektron dalam orbital anti ikatan *, sebaliknya, adalah lebih tinggi daripada energi dua atom hidrogen yang terpisah.
Orbital molekul, seperti orbital atom, dapat memegang nol elektron, satu elektron atau dua elektron yang berpasangan. Kedua elektron dalam molekul hidrogen pergi ke orbital berenergi terendah yang tersedia, yaitu orbital ikatan .
Beberapa Hal Umum Mengenai Orbital Ikatan dan Anti-Ikatan
1. Setiap orbital (molekul atau atom) dapat memegang maksimum dua elektron, yang harus mempunyai arah (spin) berlawanan.
2. Jumlah orbital molekul sama dengan jumlah orbital atom yang digunakan dalam pembentukannya. (untuk H2, dua orbital atom 1s menghasilkan dua orbital molekul : dan *).
3. Dalam pengisian orbital molekul dengan elektron, orbital berenergi terendah diisi dahulu.
Bila dua orbital terdegenerasi (dari energi yang sama), masing-masing mendapat satu elektron sebelum salah satu orbital terisi penuh.
Orbital Hibrida Karbon
Karbon mempunyai dua elektron dalam orbital 1s. Orbitas 1s tersebut tidak digunakan untuk ikatan. Keempat elektron pada tingkat energi kedua dari karbon adalah elektron ikatan.
Ada empat orbital atom pada tingkat energi kedua: satu orbital 2s dan tiga orbital 2p. Namun demikian, karbon tidak menggunakan keempat orbital dalam keadaan murninya untuk ikatan.
Sebagai gantinya, karbon bercampur, atau berhibridisasi, yaitu empat orbital atom tingkat kedua menurut salah satu dari tiga cara untuk ikatan, yaitu:
1. Hibridisasi sp3, digunakan bila karbon membentuk empat ikatan tunggal.
2. Hibridisasi sp2, digunakan bila karbon membentuk ikatan rangkap.
3. Hibridisasi sp, digunakan bila karbon membentuk ikatan ganda tiga atau ikatan rangkap terkumulasi (dua ikatan rangkap terhadap suatu atom karbon tunggal).
Atom karbon lebih membentuk senyawa dengan orbital hibrida daripada dengan orbital atom yang tak berhibridisasi. Hibridisasi memberikan ikatan yang lebih kuat karena tumpang tindihnya lebih besar, dan akan menghasilkan molekul berenergi lebih rendah dan lebih stabil.
A. Hibridisasi sp3
Keempat orbital sp3 mempunyai energi sama – agak lebih tinggi daripada energi orbital 2s, tetapi agak lebih rendah daripada energi orbital 2p. Masing-masing orbital sp3 mengandung satu elektron untuk ikatan.
Diagram di atas disebut diagram orbital. Orbital sp3 yang dihasilkan dari pencampuran orbital 2s dan 2p berbentuk seperti bola bowling, yaitu ada cuping besar dan cuping kecil (dari amplitudo yang berlawanan) dengan simpul pada inti.
Ujung kecil dari orbital hibrida tidak digunakan untuk ikatan karena tumpang tindih ujung yang lebih besar dengan orbital lain memberikan tumpang tindih yang lebih lengkap dan menghasilkan ikatan yang lebih kuat. Empat orbital hibrida sp3 mengelilingi inti atom karbon.
Karena tolakan antara 36ubstitu dalam berbagai orbital, orbital sp3 ini terletak sejauh mungkin yang satu dari yang lain sambil meluas dan membentuk geometri tetrahedron. Geometri ini memberikan sudut ikatan teridealisasi 109,5о. Suatu atom karbon sp3 sering disebut sebagai atom karbon tetrahedral. Berikut ini beberapa macam cara untuk menggambarkan metana.
Pembentukkan ikatan sigma C – H dalam metana, CH4 (Cuping kecil dari orbital sp3 tak nampak)
Etana (CH3 CH3) mengandung dua atom karbon sp3. Masing-masing atom karbon dalam etana adalah tetrahedral. Pembentukkan ikatan sigma sp3 – sp3 dalam etana ditunjukkan dalam
Dalam setiap molekul, setiap atom karbon terikat pada empat atom lain ada dalam keadaan hibrida sp3, dan ikatan sigma.
Contoh struktur karbon dengan karbon sp3 (setiap C mempunyai empat ikatan sigma).
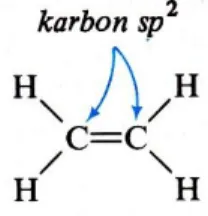
B. Hibridisasi sp2
Bila karbon terikat ke atom lain oleh ikatan rangkap dua, atom karbon ada dalam
Untuk membentuk orbital ikatan sp2, karbon menghibridisasi orbital 2s-nya hanya dengan dua orbital 2p-nya. Satu orbital p pada atom karbon tetap tak terhibridisasi. Karena tiga orbital atom digunakan untuk membentuk orbital sp2, maka dihasilkan tiga orbital hibrida sp2. Masing-masing orbital sp2 mempunyai bentuk yang sama seperti orbital sp3 dan mengandung satu elektron yang dapat digunakan untuk ikatan.
Tiga orbital sp2 sekeliling inti karbon terletak sejauh mungkin yang satu dari yang lain – yaitu, orbital sp2 terletak dalam bidang sudut 120о (secara ideal) diantaranya. Suatu atom karbon terhibridisasi sp2 dikatakan karbon trigonal (tri sudut).
Bagaimana dengan sisa orbital p pada setiap karbon? Setiap orbital p mempunyai dua cuping, satu di atas bidang ikatan sigma dan yang lain (dengan amplitudo yang berlawanan) di bawah bidang. Setiap orbital p mengandung satu elektron. Bila elektron p ini menjadi berpasangan dalam orbital molekul ikatan, maka energi sistem akan turun. Karena orbital p berdampingan dalam molekul etilena, ujung orbital tak dapat saling tumpang tindih, seperti halnya dalam pembentukkan ikatan sigma. Kedua orbital p ini kemudian tumpang tindih lewat sisinya.
Hasil dari tumpang tindih sisi terhadap sisi lain disebut ikatan pi (π). Ikatan pi (π) merupakan
bawah bidang dari ikatan sigma. Ikatan pi adalah ikatan kedua dari ikatan rangkap dua. Setiap atom karbon yang terikat pada tiga atom lain adalah dalam keadaan hibrida sp2.
Dalam senyawa stabil, orbital p pada karbon sp2 harus tumpang tindih dengan orbital p dari atom yang berdekatan, yang dapat berupa atom karbon lain atau suatu atom dari unsur lain.
Energi orbital σ* lebih tinggi dari pada energi orbital π2*. Banyak energi yang diperlukan untuk meningkatkan elektron dari orbital σ ke orbital σ*, karena itu lebih besar energinya daripada energi yang diperlukan untuk meningkatkan elektron dari orbital π ke orbital π*.
C. Hibridisasi sp
Bila atom karbon dihubungkan hanya terdapat dua atom lainnya, seperti dalam asetilena ( ), keadaan hibridisasinya adalah sp. Satu orbital 2s bercampur dengan hanya satu orbital 2p untuk membentuk dua orbital hibrida sp. Dalam hal ini, tinggal dua orbital 2p yang tak terhibridisasi, masing-masing dengan satu elektron.
Kedua orbital sp terletak sejauh mungkin, dalam garis lurus dengan sudut 180о diantaranya.
Dalam , kedua atom karbon dihubungkan oleh ikatan sigma sp – sp. Masing- masing karbon juga terikat terhadap atom hidrogen oleh ikatan sigma sp – s.
HC CH
HC CH
Kedua orbital p dari satu karbon kemudian bertumpang tindih dengan orbital p dari karbon lain untuk membentuk dua ikatan pi, satu ikatan pi ada di atas dan di bawah ikatan sigma.
Reaksi kimia suatu senyawa yang mengandung ikatan ganda tiga tak terlalu berbeda dari senyawa yang mengandung ikatan rangkap. Ikatan ganda tiga memiliki dua ikatan pi.
Pengaruh Hibridisasi terhadap Panjang Ikatan
Orbital hibrida dengan proporsi karakter s yang lebih besar mempunyai energi yang lebih rendah dan berada lebih dekat ke inti daripada orbital hibrida yang kurang karakter s nya.
Orbital sp lebih dekat ke inti, maka panjang ikatan semakin pendek dan lebih kuat di bandingkan orbital sp3.
Orbital Hibrida dari Nitrogen dan Oksigen A. Amina
Secara elektronika, nitrogen sama dengan karbon, dan orbital atom dari nitrogen berhibridisasi menurut cara yang sangat bersamaan dengan karbon.
Nitrogen dapat menghibridisasi keempat orbital atom tingkat kedua menjadi empat orbital ikatan sp3 yang ekuivalen.
Nitrogen mempunyai lima elektron yang didistribusikan dalam empat orbital sp3. Satu orbital sp3 dari nitrogen diisi dengan sepasang elektron, dan nitrogen dapat membentuk senyawa dengan hanya tiga ikatan kovalen terhadap atom yang lain. Molekul amoniak mengandung atom nitrogen sp3 yang terikat pada tiga atom hidrogen. Molekul amina mempunyai struktur yang sama: suatu atom nitrogen sp3 terikat pada satu atau lebih atom karbon. Nitrogen dalam amina dan amoniak mempunyai satu orbital yang terisi dengan sepasang elektron valensi menyendiri.
Pasangan 42ubstitu menyendiri dalam orbital terisi pada nitrogen dari amoniak dan amina memungkinkan senyawa ini berfungsi sebagai basa. Bila amina diperlakukan dengan asam, elektron yang tak terbagi digunakan untuk membentuk ikatan sigma dengan asam.
Hasilnya adalah garam amina.
B. Air, Alkohol, dan Eter
Oksigen juga membentuk ikatan dengan orbital hibrida sp3. Oksigen mempunyai enam elektron ikatan, ia membentuk dua ikatan kovalen dan mempunyai dua orbital berisi.
Air, alkohol dan eter adalah contoh senyawa yang mengandung oksigen sp3.
C. Senyawa Karbonil
Gugus karbonil (C=O) mengandung atom karbon sp2 yang dihubungkan dengan atom oksigen oleh ikatan rangkap. Geometri gugus karbonil ditentukan oleh karbon sp2. Gugus karbonil adalah planar sekeliling karbon sp2 trigonal. Oksigen mempunyai dua pasang elektron menyendiri.
Gugus karbonil lebih polar daripada gugus C – O dalam alkohol atau eter, karena elektron pi yang bergerak lebih mudah tertarik ke oksigen yang elektronegatif daripada elektron sigma dari C – O.
Orbital molekul ikatan memiliki energi yang lebih rendah dan stabilitas yang lebih besar daripada orbital atom tempat terbentuknya. Orbital molekul anti ikatan memiliki energi lebih tinggi dan stabilitas lebih rendah daripada orbital atom tempat terbentuknya.
Hibridisasi adalah penggabungan beberapa orbital dari atom – atom yang berikatan dan ditata ulang sehingga membentuk orbital baru dengan tingkat energi yang sama.
Hibridisasi sering digunakan dalam kimia organik, biasanya digunakan untuk menjelaskan
3. Rangkuman
molekul yang terdiri dari atom C, N, dan O (kadang kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana.
Pembentukan ikatan dalam senyawa harus sesuai dengan aturan hibridisasi yaitu:
1. Orbital yang bergabung harus mempunyai tingkat energi sama atau hampir sama.
2. Orbital hibrida yang terbentuk sama banyaknya dengan orbital yang bergabung.
3. Dalam hibridisasi yang bergabung adalah orbital bukan elektron.
1. Berikan rumus struktur lengkap (yang menunjukkan semua atom dan ikatan) untuk propana (CH3 CH2 CH3). Jenis orbital mana yang tumpang tindih untuk membentuk masing-masing ikatan?
2. Jenis tumpang tindih apa yang terdapat dalam setiap ikatan CH3 CH = CH2 (misalnya sp2 – s)? Berapa sudut ikatan masing-masing (kira-kira)?
1. Mahasiswa mampu menjelaskan ikatan rangkap terkonjugasi.
2. Mahasiswa mampu menjelaskan tentang benzena serta resonansi.
Ikatan Rangkap Terkonjugasi
Molekul organik dapat mengandung lebih dari satu gugus fungsi. Ada dua cara pokok untuk menempatkan ikatan rangkap dalam senyawa organik, yaitu:
1. Dua ikatan rangkap yang bersumber pada atom berdampingan disebut ikatan rangkap terkonjugasi.
Kegiatan Belajar 2
1. Tujuan Kegiatan Pembelajaran
2. Uraian Materi
4. Tes Formatif
2. Ikatan rangkap yang menggabungkan atom yang tak berdampingan, disebut ikatan rangkap tak terkonjugasi atau ikatan rangkap terisolasi.
Ikatan rangkap terkonjugasi mengalami antaraksi elektronik yang terdapat diantaranya. Ikatan rangkap terkonjugasi mengandung elektron pi terdelokalisasi, yaitu rapat elektron pi terdistribusi lewat daerah yang agak besar dalam molekul.
Ikatan rangkap terisolasi berkelakuan mandiri, masing-masing ikatan bereaksi seakan-akan yang lain tidak ada. Ikatan rangkap terisolasi mengandung elektron pi terlokalisasi terbatas pada dua inti.
Benzena
Benzena (C6H6) adalah senyawa siklik dengan enam atom karbon yang tergabung dalam cincin. Setiap atom karbon terhibridisasi sp2 dan cincinnya adalah planar. Setiap atom karbon memiliki satu orbital tak terhibridisasi yang dapat menyumbangkan satu elektron untuk ikatan pi.
Dengan enam elektron p, benzena dapat mengandung tiga ikatan pi.
Telah diketahui bahwa semua panjang ikatan karbon-karbon dalam benzena adalah sama, yaitu 1,40 Å. Keenam ikatan tersebut lebih panjang dari ikatan rangkap C=C dan lebih pendek dari ikatan C–C. Keenam 47ubstitu pi terdelokaslisasi sempurna dalam awan muatan elektron yang berbentuk seperti kue donat.
Resonansi
Metana (CH4) dan etilena (CH2 = CH2) adalah contoh senyawa organik dengan struktur yang dapat digambarkan secara beralasan dengan menggunakan rumus ikatan valensi tunggal (artinya dengan menggunakan garis untuk pasangan elektron ikatan). Dalam setiap
teliti oleh rumus ikatan valensi tunggal. Delokalisasi dari elektron pi menghasilkan sistem dalam mana elektron pi mencakup lebih daripada dua atom.
Notasi ikatan valensi secara klasik tak mencakup dalam keadaan ini. Untuk dapat menggambarkan distribusi elketron pi dalam benzena dengan menggunakan rumus ikatan valensi klasik, harus digunakan dua rumus.
Kedua struktur Kekule dikatakan ada dalam resonansi yang satu dengan yang lain. Struktur Kekule juga disebut sebagai lambang resonansi atau struktur resonansi, untuk benzena.
Benzena adalah hibrida resonansi dari dua struktur resonansi. Struktur nyata dari naftalena adalah gabungan dari struktur resonansi:
Struktur nyata dari piridina adalah gabungan dari struktur resonansi:
Struktur nyata adalah gabungan dari semua lambang resonansi. Analoginya: Seekor badak (suatu binatang nyata) digambarkan sebagai hibrida resonansi antara unicorn (khayalan) dan naga (khayalan). Seekor badak tak bergeser bolak balik dari unicorn ke naga, tetapi binatang dengan karakteristik unicorn dan naga kedua-duanya.
• Gugus nitro ( – NO2)
• Ion karbonat (CO32-)
Pergeseran Elektron
Bila menulis struktur resonansi, ingatlah bahwa inti-inti atom dalam sebuah molekul tak dapat bertukar posisi – hanya elektronlah yang terdelokalisasi. Hanya elektron pi atau elektron valensi menyendiri saja yang dapat terdelokalisasi.
Elektron tersebut tidak benar-benar bergeser, melainkan memang terdelokalisasi.
Bila menggunakan panah pergeseran elektron, perhatian khusus harus dicurahkan terhadap berapa elektron dapat ditampung oleh sebuah atom.
Geseran elektron yang menunjukkan bagaimana beranjak dari struktur kiri ke struktur kanan:
Panah geseran elektron yang menunjukkan bagaimana beranjak dalam kedua jurusan:
Penyumbang Utama dan Tambahan
Struktur resonansi yang sama memberikan sumbangan yang sama terhadap struktur yang nyata. Struktur resonansi untuk suatu senyawa atau ion tidak selalu memberikan sumbangan yang sama terhadap struktur yang nyata.
Struktur dengan atom yang memiliki oktet elektron valensi dan tidak ada pemisahan muatan merupakan penyumbang utama dalam struktur nyata karena energinya lebih rendah.
Struktur sebelah kiri merupakan struktur resonansi yang lebih penting atau penyumbang utama dalam struktur nyata. Struktur sebelah kanan merupakan struktur resonansi yang kurang penting atau penyumbang tambahan.