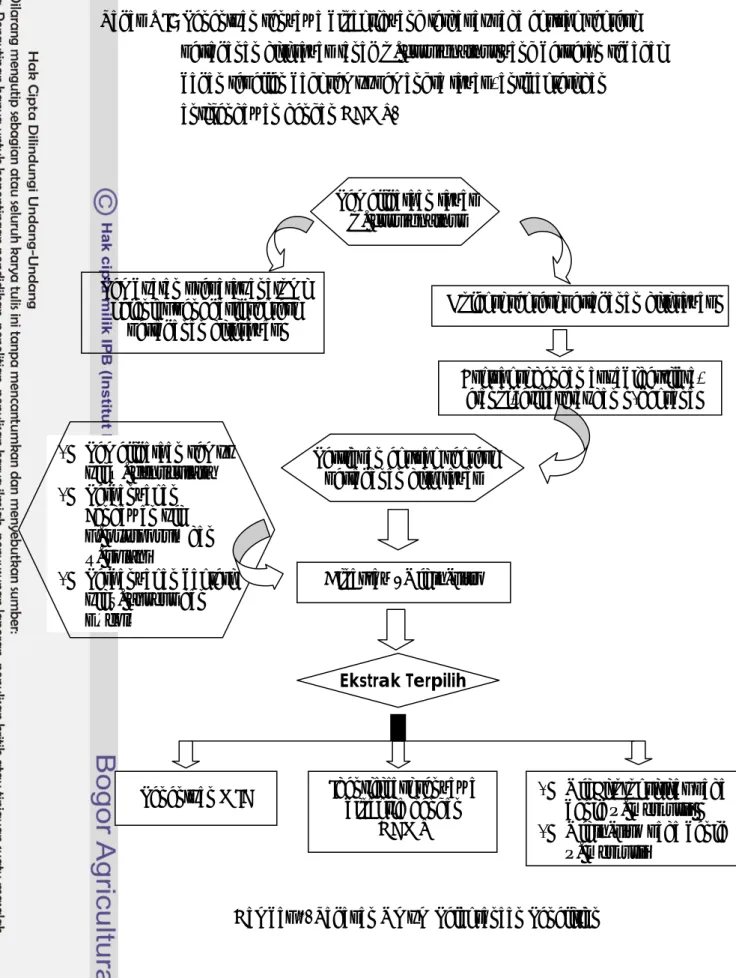
METODE PENELITIAN
Tempat dan Waktu PenelitianPenelitian ini dilaksanakan pada bulan Juli 2003 sampai bulan Juli 2005 di Laboratorium Bioteknologi Hewan, Pusat Studi Bioteknologi IPB; Laboratorium Biologi Hasil Hutan Pusat Studi Ilmu Hayati IPB; serta Laboratorium Zoologi Fakultas MIPA IPB.
Bahan dan Alat Penelitian
Bahan utama dalam penelitian ini adalah cairan sekresi pertahanan diri kasta prajurit rayap tanah C. curvignathus. Rayap tanah C. curvignathus berasal dari Hutan Percobaan Yanlappa Jasinga, Bogor yang telah dipelihara di Laboratorium Biologi Hasil Hutan, Pusat Studi Ilmu Hayati IPB selama satu tahun (laboratory reared termites colony). Pemeliharaan rayap dilakukan di dalam bak-bak plastik berukuran 50 x 60 x 40 cm yang disimpan pada ruang gelap dengan kelembaban udara berkisar antara 85%-90%.
Bahan kimia untuk ekstraksi sekresi pertahanan rayap tanah C. curvignathus meliputi etanol, etil asetat, n-heksan, aquabidestilata dan gas nitrogen. Bahan untuk analisis mikroba yaitu media tumbuh NA (Nutrient Agar), NB (Nutrient Broth), Bacto Tryptone, Yeast extraxt, NaCl, Agar, NaOH, bakteri S. aureus dan E. coli enteropatogen (EPEC) K1.1. yang diperoleh dari Laboratorium Bioteknologi Hewan Pusat Penelitian Bioteknologi IPB. Bahan untuk analisis
cendawan yaitu media tumbuh PDA (Potato Dextrose Agar), cendawan F. oxysporum dan R. solani yang diperoleh dari benih pinus dan tanah dari
pesemaian pinus PT. Perhutani Pompok Landak Cianjur, benih P. merkusii diperoleh dari sumber benih di Ponorogo Jawa Timur yang, dipanen pada bulan Juli 2004, tanah, pasir, clorox, dan jagung. Semut yang digunakan untuk pengujian toksisitas ekstrak sekresi pertahanan diri rayap berasal dari arboretum Fakultas Kehutanan IPB spesies O. denticulata. Bahan untuk pembuatan preparat anatomi kelenjar penghasil sekresi pertahanan diri rayap tanah C. curvignathus meliputi asam pikrat jenuh, asam asetat glasial, formalin, etanol 95%, Etanol 50%, Etanol 70%, Etanol 80%, Etanol 90%, Etanol 95%, Etanol 100%, Xylol, hematoksilin quosa, eosin 50% dan balsam canada.
Alat yang digunakan untuk ekstraksi sekresi pertahanan diri rayap tanah C. curvignathus meliputi alat-alat gelas, pipet pasteur, timbangan analitik, desikator, dan lemari pendingin. Alat untuk identifikasi komponen senyawa aktif yang terdapat pada sekresi pertahanan diri rayap tanah C. curvignathus meliputi Gas Chromatography Mass Spectra (GC-MS). Alat untuk uji antimikroba meliputi autoklaf, seperangkat peralatan gelas, timbangan analitik, inkubator 37oC, jarum ose, lampu spiritus dan shaker incubator. Alat untuk pembuatan preparat anatomi kelenjar sekresi pertahanan diri rayap tanah C. curvignathus mencakup gelas obyek, kaca penutup gelas obyek, dan mikroskop Scanning Electron (SEM).
Tahapan Penelitian
Penelitian ini dilakukan dalam enam tahap kegiatan sebagai berikut :
Tahap I : Pembuatan preparat anatomi kelenjar frontal penghasil sekresi pertahanan diri rayap tanah C. curvignathus.
Tahap II : 1. Koleksi sekresi pertahanan diri rayap tanah C. curvignathus.
2. Ekstraksi sekresi pertahanan diri rayap tanah C. curvignathus dengan n-heksan, etil asetat, etanol dan aquabidestilata
3. Karakterisasi ekstrak sekresi pertahanan diri rayap tanah
C. curvignathus yang meliputi pengukuran pH, viskositas, dan suhu. Tahap III : Pengujian toksisitas sekresi pertahanan diri rayap tanah
C. curvignathus terhadap semut O. denticulata Tahap IV : Pengujian aktivitas antibakteri yang meliputi: 1. Perbanyakan kultur bakteri uji
2. Pengujian daya hambat pertumbuhan dengan metode sumur 3. Penentuan nilai konsentrasi daya hambat minimum (MIC) Tahap V : Pengujian aktivitas anticendawan yang meliputi:
1. Perbanyakan kultur cendawan uji
2. Pengujian daya hambat pertumbuhan cendawan secara in-vitro 3. Uji fitotoksisitas ekstrak sekresi pertahanan diri rayap tanah C. curvignathus pada benih P. merkusii.
Tahap VI: Penentuan senyawa bioaktif yang terdapat pada ekstrak sekresi pertahanan diri rayap tanah C. curvignathus yang berperan sebagai bahan repellen bagi semut pemangsa rayap, antibakteri dan
anticendawan dengan GCMS.
Pembuatan preparat anatomi kelenjar penghasil sekresi
pertahanan diri rayap
Bioassay / Uji in-vitro
Koleksi sekresi pertahanan diri rayap
Esktraksi dengan aquabidestilata, etanol, etil asetat dan n-heksana
Identifikasi senyawa bioaktif dengan
GCMS
Penentuan MIC • Uji Fitotoksisitas pada
benih P. merkusii • Uji in-vivo pada benih
P. merkusii Pemeliharaan rayap C. curvignathus • Pemeliharaan semut uji O. denticulata • Perbanyakan cendawan uji F. oxysporum dan R. solani • Perbanyakan bakteri uji S. aureus dan E. coli
Persiapan ekstrak sekresi pertahanan diri rayap
Ekstrak Terpilih
Metode kegiatan penelitian sebagai berikut: 1. Perbanyakan rayap tanah C. curvignathus
Rayap tanah C. curvignathus berasal dari Hutan Percobaan Yanlappa Jasinga, Bogor yang telah dipelihara di Laboratorium Biologi Hasil Hutan, Pusat Studi Ilmu Hayati IPB selama satu tahun (Laboratory reared termites colony). Pemeliharaan rayap tanah C. curvignathus dilakukan di dalam bak-bak plastik berukuran 50 x 60 x 40 cm yang disimpan pada ruang gelap dengan kelembaban udara berkisar antara 85%-90%.
2. Pembuatan Preparat Gelas Obyek
Prosedur pembuatan preparat anatomi saluran kelenjar sekresi pertahanan diri prajurit rayap tanah C. curvignathus sebagai berikut :
a. Rayap kasta prajurit C. curvignathus dicuci dengan NaCl fisiologis selanjutnya difiksasi dengan larutan bovine selama 18 jam.
b. Spesimen direndam secara berurutan dalam larutan: Etanol 70% - etanol 80% - etanol 95% - etanol 100% (tahap dehidrasi) masing-masing selama 1 jam.
c. Spesimen kemudian direndam dalam campuran larutan etanol dan xylol (1:1) selama 1 jam – xylol I selama 1 jam dan – xylol II selama 10 menit (tahap dealkoholisasi).
d. Pada tahap xylol II, ke dalam wadah dimasukkan parafin sedikit demi sedikit hingga jenuh; kemudian wadah dipindahkan ke dalam inkubator/ termostat pada suhu 57oC.
e. Kemudian berturut-turut dilakukan infiltrasi parafin I – parafin II dan parafin III masing-masing selama 45 menit.
f. Pembuatan blok parafin (blocking) untuk penyelubungan spesimen. Parafin murni dipanaskan kemudian dituang pada kotak karton tanpa tutup yang tidak permanen. Setelah permukaan parafin mulai mengental, spesimen diletakkan dengan posisi tegak di dalam parafin. Selanjutnya karton parafin tersebut diletakkan pada permukaan air agar pendinginan parafin terjadi lebih cepat.
g. Pengirisan dengan mikrotom, dengan ketebalan 8 μm dan menghasilkan pita-pita yang selanjutnya akan diletakkan pada permukaan gelas obyek dengan perekat albumin. Gelas obyek kemudian diletakkan diatas pelat pemanas pada suhu 30oC dan dibiarkan selama 24 jam.
h. Kemudian dilakukan pewarnaan yaitu dengan mencelupkan gelas obyek secara berurutan ke dalam larutan berikut : Xylol I – Xylol II - Xylol III - etanol 90% - etanol 80% - etanol 70% - etanol 50% (masing-masing selama 5 menit) – hematoksilin aquosa– eosin 50% (masing-masing selama 2 menit) - etanol 70% - etanol 80% - etanol 95% - etanol 100% (masing-masing selama beberapa celup) – dibersihkan dengan tissu – xylol I – xylol II (masing-masing selama 5 menit).
i. Gelas obyek selanjutnya dikeringudarakan, kemudian pada bagian permukaan yang ada preparatnya diberi setetes balsam canada dan dilekatkan gelas penutup diatasnya.
3. Pembuatan Gambar SEM
Prosedur pembuatan gambar SEM rayap tanah C. curvignathus sebagai berikut : prajurit rayap tanah C. curvignathus dimasukkan ke dalam gelas kaca kemudian dilakukan fresh-dry selama 48 jam untuk menghilangkan air dan lemak yang terdapat di dalam tubuh rayap. Kemudian sampel direkatkan pada aluminum stubs dan dilapisi dengan emas melalui proses vakum (6-7 Pa) selama 20 menit dan diamati serta dibuat gambar SEM dengan menggunakan mikroskop SEM JEOL 5310.
4. Koleksi sekresi pertahanan diri rayap tanah C. curvignathus
Koleksi sekresi pertahanan diri rayap tanah C. curvignathus dilakukan berdasarkan metode Prestwich et al. (1984) dan Quintana et al. (2003) yang dimodifikasi. Sekresi pertahanan diri rayap dikeluarkan dari fontanel prajurit rayap dengan menggunakan pipet pasteur. Untuk setiap pelarut digunakan cairan sekresi yang diambil dari 4000 ekor rayap. Pelarut untuk ekstraksi meliputi aquabidestilata, etanol, etil asetat dan n-heksan, dengan demikian total rayap yang digunakan sebanyak 16.000 ekor. Cairan sekresi yang
menempel pada pipet pasteur dipindahkan ke dalam botol kaca dan selanjutnya siap untuk diekstraksi.
5. Ekstraksi sekresi pertahanan diri rayap tanah C. curvignathus
Ekstraksi sekresi pertahanan diri rayap tanah C. curvignathus dilakukan berdasarkan metode Preswitch et al. (1980) dan Chuah et al. (1990) yang dimodifikasi. Sebanyak 10 ml aquabidestilata dicampurkan dengan sekresi pertahanan diri rayap, kemudian dilakukan homogenisasi, dan selanjutnya pelarut diuapkan dengan cara fresh-dry. Filtrat yang terjadi disimpan di dalam botol kaca dan selanjutnya disimpan pada suhu –10oC dan siap digunakan untuk pengujian bioassay.
Pada ekstraksi dengan pelarut organik, sekresi pertahanan diri rayap dilarutkan ke dalam 10 ml pelarut etanol, kemudian dilakukan homogenisasi. Selanjutnya pelarut diuapkan dengan ditiup gas nitrogen. Filtrat disimpan dalam botol kaca dan selanjutnya disimpan pada suhu –10oC. Untuk mendapatkan ekstrak dengan pelarut etil asetat dan n-heksan, dilakukan perlakuan yang sama seperti pada perlakuan pelarut etanol.
6. Pengukuran karakteristik fisiko-kimia ekstrak sekresi pertahanan rayap Karakterisasi fisiko-kimia ekstrak sekresi pertahanan diri rayap meliputi pengukuran pH, suhu, warna, dan pengukuran viskositas berdasarkan metode Nandika et al. (1994). Pengukuran viskositas ekstrak sekresi dilakukan dengan viskometer mikro berdiameter 1 mm, dengan rumus :
1 poise = Berat (kg) Panjang (m) x Waktu2 (S2)
7. Pengujian toksisitas sekresi pertahanan rayap C. curvignathus terhadap semut O. denticulata
Pengujian toksisitas ekstrak sekresi pertahanan rayap C. curvignathus dilakukan berdasarkan metode Chen et al. (2002) yang dimodifikasi. Media pengujian adalah sebuah cawan petri yang disajikan pada Gambar 2. Ekstrak sekresi rayap sebanyak 200 μl diteteskan pada kertas saring steril yang berukuran setengah lingkaran, kemudian kertas saring dikeringanginkan. Di dalam cawan petri diletakkan dua kertas saring, satu kertas saring steril dan satu kertas saring yang mengandung ekstrak sekresi rayap. Tiga puluh ekor
semut O. denticulata diletakkan pada bagian tengah cawan petri. Pengamatan meliputi waktu kejadian kematian semut pertama kali dan waktu kematian semut mencapai seratus persen. Sebagai perlakuan kontrol adalah cawan petri yang diletakkan dua kertas saring steril (tidak mengandung ekstrak sekresi rayap) kemudian dimasukkan semut O.denticulata pada cawan petri. Pengujian dilakukan dengan tiga kali ulangan.
Semut O. denticulata diperoleh dari arboretum Fakultas Kehutanan Institut Pertanian Bogor. Klasifikasi semut O. denticulata sebagai berikut:
Phylum : Arthropoda Kelas : Insecta Ordo : Hymenoptera Famili : Formicidae Sub-famili : Ponerinae Genus : Odontoponera
Spesies : Odontoponera denticulata
Gambar 2. Media pengujian toksisitas ekstrak sekresi pertahanan diri rayap C. curvignathus terhadap Semut O. denticulata
Pengujian perilaku pertahanan diri rayap terhadap semut dilakukan dengan meletakkan dua ekor semut O. denticulata pada kelompok rayap berdasarkan metode Collins dan Prestwich (1983). Kelompok rayap diletakkan pada sebuah cawan petri, yang disajikan pada Gambar 3. Tiga kelompok rayap digunakan dalam pengujian meliputi kelompok pertama terdiri dari 20 ekor kasta pekerja dan 20 ekor kasta prajurit, kelompok kedua terdiri dari 50 ekor kasta pekerja dan 50 ekor kasta prajurit, dan kelompok ketiga adalah 100 ekor
kasta pekerja dan 100 ekor kasta prajurit. Pengujian dilakukan dengan tiga kali ulangan pada setiap kelompok rayap. Pengamatan dilakukan selama enam jam sejak peletakan semut O. denticulata pada setiap kelompok rayap.
Gambar 3. Media pengujian pertahanan diri rayap tanah C. curvignathus terhadap semut O. denticulata
8. Pengujian aktivitas antibakteri 8.1 Persiapan kultur bakteri uji
Bakteri yang digunakan adalah biakan murni bakteri Staphyloccus aureus dan Eschericia coli enteropatogen K1.1. yang diperoleh dari Laboratorium Bioteknologi Hewan Pusat Penelitian Bioteknologi IPB. Komposisi medium padat untuk menumbuhkan bakteri terdiri dari : Bacto Tryptone 1%, yeast extract 0,5 %, NaCl 1% dan Agar 1,5% dan diatur pada pH 7,0 (netral). Inkubasi dilakukan pada suhu 370C.
8.2 Penentuan fase pertumbuhan akhir (late log phase) bakteri
Tahap ini bertujuan untuk menentukan late log phase bakteri. Bakteri yang digunakan adalah E. coli dan S. aureus. Penentuannya dilakukan dengan cara sebagai berikut : satu ose dari agar miring biakan murni NA diinokulasikan ke dalam lima mililiter NB. Selanjutnya diinkubasi selama 24 jam. Kultur yang telah 24 jam diambil sebanyak 10 μl dan dinokulasikan kembali ke dalam 10 mililiter NB. Selanjutnya diinkubasi dan diamati pada jam ke-0, 8, 12, 16 dan 26 jam menggunakan spektrofotometer pada panjang gelombang 600 nm. Setelah diketahui late
log phase untuk setiap bakteri dilakukan penghitungan sel menggunakan alat hemasitometer.
8.3 Persiapan bakteri uji
Hasil late log phase untuk bakteri E.coli dan S. aureus ialah 16 jam. Pada umur tersebut, jumlah bakteri telah mencapai 108 CFU/ml. Konsentrasi bakteri yang digunakan untuk pengujian adalah106 CFU/ml. 8.4 Pengujian aktivitas antibakteri
Esktrak sekresi rayap disiapkan pada konsentrasi 40%. Ekstrak sekresi dalam pelarut n-heksan (EN) diencerkan dengan air steril yang berisi Tween 80 (0,5%), sedangkan ekstrak sekresi dalam pelarut etanol (EE), etil asetat (EEA), aquabidestilata (EA) diencerkan dengan air steril (aquabidestilata). Pengujian aktivitas antibakteri dilakukan menggunakan difusi sumur berdasarkan Carson dan Riley (1995) sebagai berikut : Dari persiapan kultur bakteri yang telah dilakukan, dipindahkan secara aseptik sebanyak 20 μl ke dalam media NA 30 ml. Selanjutnya media dibiarkan memadat, kemudian dibuat sumur dengan diameter 6 mm. Satu cawan petri memiliki delapan sumur yang masing-masing diisi dengan EA, EE, EEA, EN, dan pelarut ekstrak sebagai perlakuan kontrol (aquabidestilata, etanol, etil asetat, n-heksan) masing-masing sebanyak 60 μl. Selanjutnya cawan petri diinkubasi selama 24 jam pada suhu 370C, Pengamatan zona hambatan dilakukan dengan mengukur diameter zona bening (milimeter) yang terbentuk di sekitar sumur. Pengujian dilakukan duplo.
8.5 Penentuan nilai konsentrasi hambat tumbuh minimal bakteri (MIC / minimum inhibitory concentration)
Nilai MIC adalah konsentrasi terendah yang mampu mematikan semua bakteri yang diinokulasikan ke dalam medium. Ekstrak yang digunakan adalah ekstrak etanol, karena menghasilkan penghambatan pertumbuhan tertinggi. Pengujian dilakukan berdasarkan metode difusi sumur (Carson dan Riley, 1995). Konsentrasi esktrak etanol yang diuji sebesar 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, dan 70 %. Bakteri uji
meliputi S. aureus dan E. coli. Penghitungan nilai MIC dilakukan berdasarkan metode Bloomfield (1991), yaitu dengan memplotkan antara ln Mo (konsentrasi ekstrak) pada sumbu X terhadap nilai kuadrat zona penghambatan (X2) pada sumbu Y. Perpotongan antara kurva linier dengan sumbu X merupakan nilai Mt (diperoleh dengan regresi linear). Besarnya nilai MIC ditetapkan sebagai ¼ x Mt.
9. Pengujian aktivitas anticendawan 9.1 Penyediaan inokulum cendawan
Cendawan patogen penyebab lodoh didapatkan melalui isolasi dari tanah pesemaian dan benih P. merkusii. Tanah pesemaian didapat dari pesemaian pinus PT. Perhutani Pompok Landak Cianjur, sedangkan benih pinus berasal dari Ponorogo Jawa Timur dengan daya berkecambah (DB) 70%.
Isolasi cendawan patogen dari tanah dilakukan dengan metode pengenceran. Pengenceran yang digunakan adalah 10-2, 10-3, dan 10-4. Sepuluh gram tanah yang berasal dari pesemaian pinus yang terserang patogen disuspensikan dalam 90 ml aquadestilata steril sehingga membentuk pengenceran 10-1. Suspensi tersebut dikocok dan dibiarkan dalam beberapa menit. Pengenceran selanjutnya dilakukan dengan mencampur sebanyak 1 ml suspensi pertama dengan 9 ml aquadestilata steril sehingga membentuk pengenceran 10-2, cara yang sama dilakukan untuk mendapatkan pengenceran 10-3 dan 10-4. Selanjutnya 0,1 ml masing-masing suspensi tersebut ditumbuhkan pada media Martin Agar (MA) dan diinkubasikan pada suhu kamar. Setelah patogen tumbuh, isolat dimurnikan dan diuji patogenisitasnya.
Isolasi cendawan dari benih dilakukan dengan metode pengujian kesehatan benih. Metode kesehatan benih yang digunakan adalah metode blotter yang direkomendasikan oleh ISTA (International Seed Treatment Association). Metode ini didasarkan pada pertumbuhan kecambah dan propagul cendawan. Tiga helai kertas merang steril dilembabkan dengan cara dicelupkan ke dalam aquadestilata steril, selanjutnya kertas merang
tersebut diletakkan di dalam cawan petri. Benih pinus sebanyak 25 buah ditempatkan di atas kertas merang. Kegiatan dilakukan secara aseptik di meja laminar.
Benih tanpa perlakuan desinfektan digunakan untuk mendeteksi cendawan yang ada di permukaan benih, sedangkan benih yang diberi perlakuan desinfektan NaOCl 1% selama 5 menit dan kemudian dibilas dengan aquadestilata steril digunakan untuk mendeteksi cendawan yang berada dalam jaringan benih. Masing-masing perlakuan dilakukan dengan 10 ulangan.
Benih uji dalam cawan petri diinkubasikan selama tujuh hari. Pada hari pertama benih ditempatkan pada suhu ruang selama 24 jam dengan penyinaran NUV 12 jam terang dan 12 jam gelap. Pada 24 jam kedua benih diinkubasikan pada suhu –20oC, selanjutnya pada hari ketiga sampai hari ketujuh benih diinkubasi pada suhu ruang dengan penyinaran NUV. Pada hari ke delapan dilakukan pengamatan terhadap cendawan yang muncul, baik pada perlakuan desinfektan maupun tidak. Selanjutnya isolat yang diperoleh diuji patogenisitasnya.
9.2 Uji patogenisitas cendawan (pemilihan cendawan uji)
Isolat cendawan yang diperoleh dari kedua proses isolasi (dari tanah dan benih) diuji patogenisitasnya untuk menentukan cendawan patogen yang akan digunakan dalam pengujian selanjutnya. Isolat cendawan yang diperoleh diperbanyak dengan cara mengambil tiga potongan koloni cendawan dari biakan di media PDA yang berumur lima hari (∅ 6 mm) kemudian ditanam pada media CMS (Corn Meal Sand) yang terdiri dari campuran pasir, hancuran biji jagung dan air (96:4:20 g/g/ml), dalam labu erlenmeyer volume 250 ml yang telah disterilisasi (121oC, 1 atmosfer) selama 60 menit. Labu beserta isinya diinkubasi pada suhu kamar selama dua minggu. Sebagai kontrol media patogen, disiapkan labu erlenmeyer berisi jenis media yang sama tanpa inokulasi cendawan dan diinkubasikan pada suhu kamar selama dua minggu.
Setelah masa inkubasi, isolat cendawan bersama medianya sebanyak 4,5 gram dicampur dengan 100 gram media tanam steril yang terdiri dari campuran top soil (tanah latosol Darmaga), kompos dan sekam (dengan perbandingan 4:3:3 b/b/b) yang telah disterilisasi (121oC, 1 atmosfer) selama 60 menit. Media tanam tersebut kemudian dimasukkan ke dalam politube (polytube) dan ditambahkan 10 ml aquadestilata steril, selanjutnya diinkubasikan selama 4 hari. Uji patogenisitas dilakukan dengan menanam semai P. merkusii berumur 2 minggu di dalam politube. Untuk isolat dilakukan penanaman semai pada media tanam steril tanpa isolat cendawan. Jumlah semai yang ditanam pada setiap perlakuan sebanyak 20 semai dengan dua kali pengulangan. Pengamatan dilakukan terhadap persentase semai yang terserang penyakit lodoh. Isolat yang paling kuat patogenisitasnya digunakan untuk penelitian selanjutnya.
9.3 Pengujian terhadap cendawan patogen secara in-vitro
Berdasarkan uji patogenisitas, ditentukan cendawan F. oxysporum dan R. solani yang digunakan dalam tahap penelitian selanjutnya. Inokulum cendawan F. oxysporum dan R. solani diperbanyak pada media PDA. Pengujian aktivitas anticendawan masing-masing ekstrak (EA, EE, EEA, EN) dilakukan dengan metode Mori et al. (1997). Media yang digunakan adalah PDA (Potato Dextrose Agar). PDA steril disiapkan dalam tiap cawan petri yang telah dicampur dengan masing-masing ekstrak dengan konsentrasi 10% (berat ekstrak/berat media agar). Selanjutnya pada cawan petri tersebut ditanam 1 potong cendawan F. oxysporum (umur 5 hari, ∅ 6 mm). Masing-masing perlakuan dibuat duplo.
Untuk perlakuan kontrol, ditanam 1 potong cendawan F. oxysporum (umur 5 hari, ∅ 6 mm) pada cawan petri yang terdiri dari media PDA, dan media PDA yang dicampur dengan pelarut ekstrak (etanol, etil asetat, n-heksan dan aquabidestilata) dengan konsentrasi 10% (berat pelarut/berat media agar). Perlakuan yang sama dilakukan pada cendawan uji R. solani. Kemudian cawan petri diinkubasi pada suhu ruang (26oC – 28oC).
Pertumbuhan cendawan diukur setiap hari selama 7 hari. Pada hari ke-7 dihitung persentase penghambatan dengan rumus (Mori et al. 1997):
R 1 – R 2
Aktivitas anticendawan (AFA) = --- x 100% R 1
Dimana :
R 1 = pertumbuhan miselia cendawan kontrol (mm) R 2 = pertumbuhan miselia cendawan perlakuan (mm)
Aktivitas setiap ekstrak akan dinilai dengan melihat besaran nilai aktivitas anti cendawan (Antifungal activity/AFA) dan diklasifikasikan ke dalam katagori yang disajikan pada Tabel 1.
Tabel 1. Klasifikasi Tingkat Aktivitas Anti Cendawan (AFA) Aktivitas Anti Cendawan (AFA) Tingkat Aktivitas
AFA ≥ 75% Sangat Kuat (++++) 75% ≤ AFA < 50% Kuat (+++) 50% ≤ AFA < 25% Sedang (++)
25% ≤ AFA < 0 Lemah (+)
0 Tidak Aktif (-)
Sumber : Mori et al. (1997)
9.4 Pengujian konsentrasi ekstrak terpilih
Hasil pengujian penghambatan pertumbuhan cendawan patogen secara in-vitro menunjukkan bahwa hanya ekstrak etil asetat yang mampu menghambat pertumbuhan cendawan R. solani, sedangkan pada cendawan F. oxysporum tidak ada ekstrak yang mampu menghambat pertumbuhan cendawan patogen. Selanjutnya penelitian menggunakan ekstrak etil asetat dengan cendawan uji R. solani. Pengujian konsentrasi ekstrak pada tahapan ini bertujuan untuk menentukan konsentrasi minimal ekstrak etil asetat yang mampu menghambat pertumbuhan cendawan R. solani.
Media yang digunakan adalah PDA (Potato Dextrose Agar). PDA steril disiapkan dalam tiap cawan petri yang telah dicampur dengan masing-masing ekstrak. Konsentrasi ekstrak yang digunakan adalah 2%, 4%, 6%, 8% dan 10% (berat ekstrak/berat media agar). Selanjutnya pada cawan petri tersebut ditanam 1 potong cendawan R. solani (umur 5 hari,
∅ 6 mm). Masing-masing perlakuan dibuat duplo. Untuk kontrol, ditanam 1 potong cendawan R. solani (umur 5 hari, ∅ 6 mm) pada cawan petri yang hanya terdiri dari media PDA. Selanjutnya cawan petri diinkubasi pada suhu ruang (26oC – 28oC). Pertumbuhan cendawan diukur setiap hari selama 7 hari. Pada hari ke-7 dihitung persentase penghambatan dengan rumus (Mori et al. 1997):
R 1 – R 2
Aktivitas anticendawan (AFA) = --- x 100% R 1
Dimana :
R 1 = pertumbuhan miselia cendawan kontrol (mm) R 2 = pertumbuhan miselia cendawan perlakuan (mm)
9.5 Pengujian pengaruh fitotoksisitas ekstrak sekresi pertahanan rayap
C. curvignathus terhadap daya berkecambah benih P. merkusii
Benih yang akan diuji diseleksi terlebih dahulu dengan cara merendamnya dalam aquadestilata steril selama 24 jam. Benih yang tenggelam digunakan dalam pengujian. Benih uji direndam dalam ekstrak etil asetat selama 1 jam dengan konsentrasi ekstrak 8% dan kontrol aquadestilata steril. Setelah perlakuan perendaman, masing-masing benih dicuci dengan aquadestilata steril dan dikeringkan dengan cara diletakkan di atas kertas saring steril, kemudian dibiarkan selama 1, 12, dan 24 jam.
Masing-masing perlakuan diulang tiga kali dan masing-masing ulangan menggunakan 25 benih. Selanjutnya sebanyak 25 benih pinus pada masing-masing perlakuan diletakkan diatas kertas merang lembab berlapis tiga, berukuran 20 x 20 cm yang sebelumnya telah dialasi dengan plastik dengan ukuran yang sama. Kertas merang yang telah berisi benih tersebut kemudian ditutup dengan satu lembar kertas merang lembab, setelah itu lembaran tersebut digulung. Gulungan tersebut kemudian diinkubasikan pada suhu ruang dan disinari dengan NUV 12 jam terang dan 12 jam gelap secara bergantian selama 14 hari. Pada hari ke-14 gulungan dibuka dan dihitung persentase daya berkecambah benihnya. Persentase daya berkecambah benih dihitung dengan rumus sebagai berikut :
Jumlah benih yang tumbuh Daya berkecambah benih = --- x 100%
Jumlah benih keseluruhan
Pengujian pengaruh fitotoksisitas ekstrak sekresi rayap terhadap daya berkecambah benih disusun dalam rancangan acak lengkap faktorial (Faktorial RAL) dengan 2 faktor, yang meliputi faktor perendaman benih (A) dan faktor lama pembiaran benih setelah direndam (B), sebagai berikut:
A1: perendaman benih pinus dalam ekstrak sekresi rayap dengan pelarut etil asetat konsentrasi 8%
A2: perendaman benih pinus dengan aquadestilata steril (kontrol) B1: pembiaran benih pinus setelah perlakuan perendaman selama 1 jam B2: pembiaran benih pinus setelah perlakuan perendaman selama 12 jam B3: pembiaran benih pinus setelah perlakuan perendaman selama 24 jam 9.6 Pengujian terhadap cendawan patogen secara in- vivo
Percobaan dilakukan untuk melihat kemampuan pengendalian hayati ekstrak sekresi pertahanan diri rayap tanah C. curvignathus dalam pelarut etil asetat terhadap cendawan patogen R. solani penyebab lodoh pada benih pinus.
Persiapan media tanam dan inokulasi cendawan patogen
Media tanam yang digunakan adalah campuran tanah top soil dan pasir (1:1 b/b) yang telah disterilkan (121oC, 1 atmosfer selama 60 menit) yang tidak diambil dari pertanaman P. merkusii. Media tanam yang digunakan dalam percobaan terdiri dari dua jenis media yang meliputi media tanam kontrol (tanpa inokulasi cendawan patogen) dan media tanam yang diinokulasi dengan cendawan patogen. Inokulasi cendawan patogen dilakukan dengan mencampurkan 3,5 gram media patogen yang telah disiapkan dengan 200 gram media tanam dalam gelas plastik, kemudian ditambahkan 15 ml aquadestilata steril. Wadah tanam selanjutnya ditutup dengan plastik dan didiamkan selama 4 hari. Setelah 4 hari dilakukan penanaman benih pinus kontrol dan benih yang telah direndam dalam ekstrak sekresi rayap.
Persiapan benih P. merkusii
Benih pinus kontrol diperoleh dari benih yang direndam dalam aquadestilata steril selama 24 jam, benih yang tenggelam disterilkan permukaannya dengan merendam dalam larutan NaOCl 0,5% selama 5 menit untuk memperoleh benih yang aseptik. Benih selanjutnya dibilas
beberapa kali dengan aquadestilata steril kemudian dikeringanginkan dengan meletakkannya dalam wadah yang telah dialasi kertas saring steril. Benih pinus kontrol yang digunakan sebanyak 25 buah dengan 3 kali ulangan.
Benih perlakuan diperoleh dari benih pinus yang bernas dan aseptik
kemudian direndam dalam ekstrak sekresi pertahanan diri rayap C. curvignathus dalam pelarut etil asetat dengan konsentrasi 8% selama
1 jam. Selanjutnya benih dikeringanginkan selama 1 jam. Benih pinus perlakuan yang digunakan sebanyak 25 buah dengan 3 kali ulangan.
Pengujian in- vivo pada benih pinus
Benih kontrol dan benih perlakuan ditanam pada media tanam yang telah disiapkan. Wadah tanam ditempatkan di dalam rumah kaca. Penyiraman dilakukan setiap sore hari dengan menggunakan aquadestilata steril. Pengamatan yang dilakukan adalah daya berkecambah dan serangan penyakit lodoh. Daya berkecambah benih dihitung berdasarkan persentase jumlah total benih yang berkecambah pada hari ke-7 dan hari ke-21 (ISTA, 1999) dengan rumus:
Jumlah KN pada hari ke-7 + Jumlah KN pada hari ke-21
DB = --- x 100% Jumlah benih yang ditanam
DB = Daya berkecambah KN = kecambah normal
Serangan penyakit lodoh dihitung berdasarkan persentase jumlah total dari benih dan semai yang terserang penyakit lodoh dengan rumus sebagai berikut:
Jumlah benih dan semai yang terserang lodoh
Serangan Lodoh (%) = --- x 100% Jumlah benih yang ditanam
Pengujian in-vivo benih pinus terhadap cendawan patogen disusun dalam rancangan acak lengkap faktorial (Faktorial RAL) dengan 2 faktor, yang meliputi faktor faktor perendaman benih (A) dan faktor media tanam (B), sebagai berikut:
A1: perendaman benih pinus dalam ekstrak sekresi rayap dengan pelarut etil asetat konsentrasi 8%
A2: perendaman benih pinus dengan aquadestilata steril (kontrol) B1: media tanam tidak diinokulasi dengan cendawan patogen B2: media tanam diinokulasi dengan cendawan patogen 10. Identifikasi komponen volatil
Ekstrak sekresi pertahanan diri kasta prajurit dalam pelarut etanol dan etil asetat dianalisa dengan detektor gas chromatografi spektrometer massa (GCMS) untuk mengidentifikasi komponen volatil ekstrak. Instrumen GCMS yang digunakan adalah GCMS tipe Shimadzu QP 5050, kondisi analisis mengikuti metode Clement et al. (2001) yang disajikan pada Tabel 2.
Tabel 2. Kondisi GCMS merk Shimadzu QP 5050 Kondisi GC Kolom Gas pembawa Detektor Suhu interface Suhu injektor Volume injeksi Teknik injeksi Waktu sampling Program suhu: Suhu awal
Laju kenaikan suhu Suhu akhir
Kolom kapiler DB-5 MS 122-5532 panjang 30 m, diameter dalam 0,25 mm dan tebal lapisan 0,25 μm. Helium dengan tekanan 40.20 Kpa
MS (Mass Spectrometry) 330oC 300oC 1 μL Split/Splitless 0,5 menit
40oC ditahan selama 5 menit 4 oC / menit
330oC, ditahan selama 5 menit Kondisi MS Energi ionisasi Kisaran massa Interval Resolusi Waktu 0.90 kv 33 – 550 0.5 detik 1000 1.6 – 56.0
Identifikasi komponen volatil dilakukan sebagai berikut:
1. Interpretasi spektra masa yaitu membandingkan spektra massa suatu senyawa target dengan spektra massa standar yang terdapat pada mass spectra library koleksi NIST (National Institute Standard and Tehnology), WILEY 229 dan PESTICD.LIB. Mass spectra library koleksi NIST 62 memiliki koleksi pola spektra massa lebih dari 62.000 pola. Pustaka spektra masa ini sudah berbentuk program software yang dapat dibaca dengan bantuan komputer.
2. Penentuan nilai Linear Retention Indices (LRI) dimana setiap peak yang terdeteksi pada detektor dan dicatat oleh integrator mempunyai waktu retensi masing-masing. Untuk program temperatur gradien, digunakan perhitungan LRI. Nilai LRI merupakan hubungan antara waktu retensi standar n-alkana (C8 – C40) yang disuntikkan pada kondisi yang sama dengan kondisi penyuntikan sampel. Perhitungan nilai LRI dilakukan dengan persamaan sebagai berikut (Madruga dan Mottram 1998):
(Rt
x- Rt
n)
LRI
x = --- + n x100
Rt
n+1- Rt
nKeterangan:
LRIx = indeks retensi linear komponen x Rtx = waktu retensi komponen x (menit)
Rtn = waktu retensi standar alkana sebelum puncak komponen x Rtn+1 = waktu retensi standar alkana sesudah puncak komponen x n = jumlah atom karbon standar alkana yang muncul sebelum komponen x
Hasil perhitungan LRI suatu komponen dibandingkan dengan nilai LRI yang terdapat pada pustaka dengan kolom GCMS yang digunakan dan dipak dengan fase diam yang sama.
HASIL DAN PEMBAHASAN
Karakteristik Morfologi Prajurit Rayap C. curvignathus
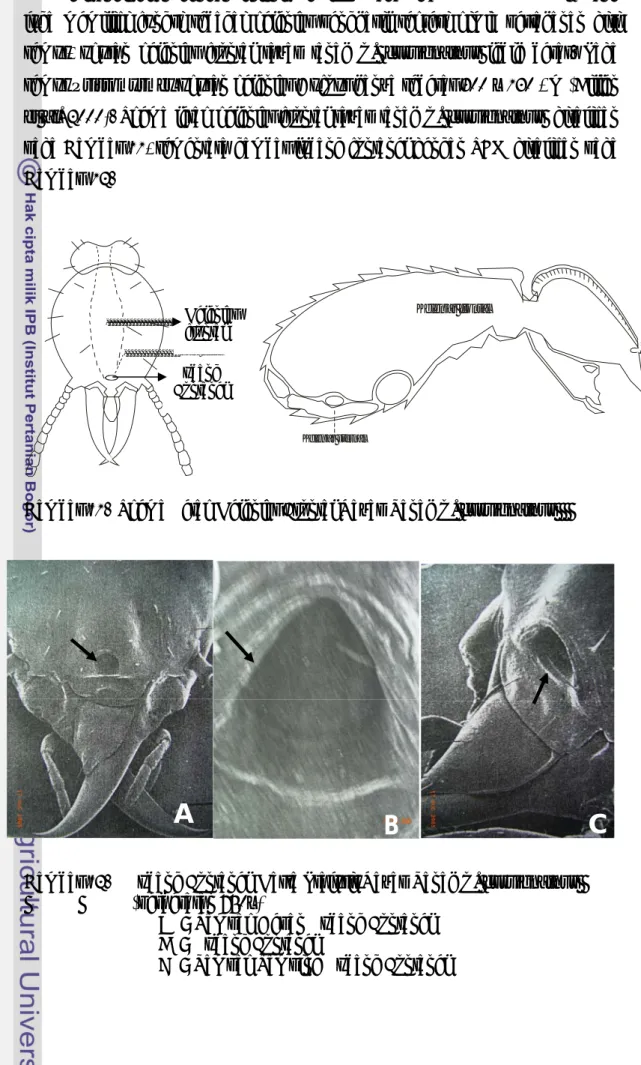
Karakter morfologi yang diamati dari prajurit rayap C. curvignathus terdiri dari ukuran seluruh tubuh rayap, panjang kepala dengan mandibel, panjang kepala tanpa mandibel, lebar kepala, panjang mandibel, jumlah ruas tubuh, jumlah ruas antena, jumlah seta pada kepala, bentuk mandibel, bentuk pronotum dan lebar pronotum. Kasta prajurit rayap tanah C. curvignathus memiliki kepala berwarna kuning, antena, labrum, dan pronotum kuning pucat. Bentuk kepala bulat lonjong dengan ukuran panjang sedikit lebih besar daripada lebarnya.
Rata-rata ukuran seluruh tubuh prajurit rayap C. curvignathus berkisar antara 2,65 + 0,12 mm, panjang kepala dengan mandibel 2,17 + 0,11 mm, panjang kepala tanpa mandibel berkisar antara 1,3 + 0,16 mm. Rata-rata lebar kepala 0,96 + 0,15 mm, panjang mandibel 0,78 + 0,10 mm, antena terdiri dari 13 -15 ruas, sedangkan jumlah seta pada kepala berkisar antara 11 - 16 buah. Mandibel berbentuk seperti arit dan melengkung diujungnya, bentuk pronotum seperti pelana dengan panjang 0,22 + 0,10 mm dan lebar 1,03 + 0,10 mm. Bagian abdomen ditutupi dengan rambut yang menyerupai duri. Abdomen berwarna putih kekuning-kuningan dengan jumlah ruas 10-12 ruas. Bentuk kepala dan mandibel prajurit rayap tanah C. curvignathus disajikan pada Gambar 4.
A B C D
Gambar 4. Kasta Prajurit (A,B), Bentuk Kepala (C), Bentuk Mandibel (D) Rayap Tanah C. curvignathus
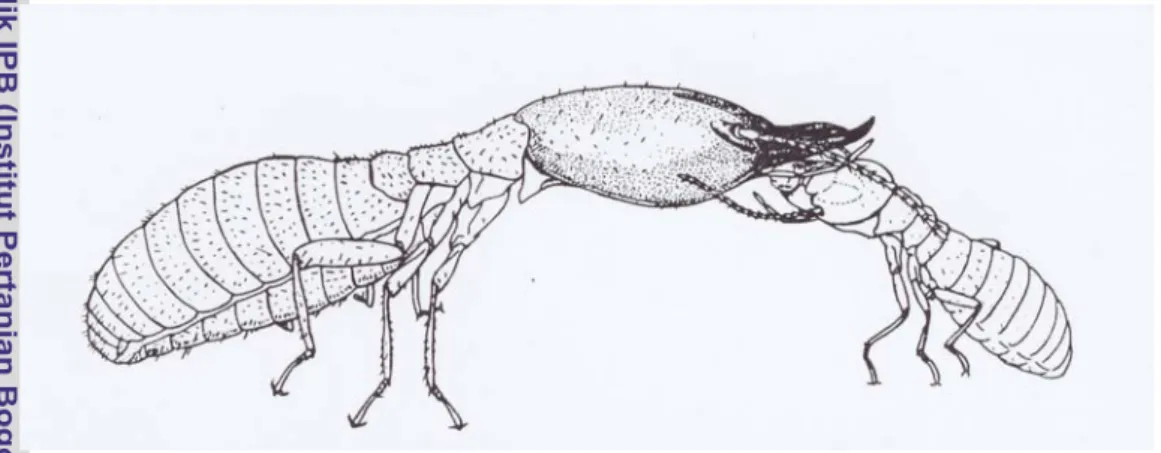
Kasta prajurit merupakan anggota koloni rayap yang memiliki bentuk morfologi yang spesifik, sangat terspesialisasi dengan bentuk kepala yang mengalami sklerotisasi (penebalan), tidak mengerjakan pekerjaan apapun dalam koloni, selain sebagai pertahanan koloni dan melindungi anggota koloni dari serangan musuh. Karena bentuk kepala yang unik, tebal dan memiliki mandibel yang sangat kuat, kasta prajurit tidak mampu mengigit dan mengunyah makanan, karena itu kasta prajurit mendapat makanan yang sudah dihaluskan dan disuapi makanan oleh kasta pekerja melalui proses trofalaksis. Proses trofalaksis disajikan pada Gambar 5.
Gambar 5. Kasta pekerja rayap memberi makan kepada kasta prajurit (Noirot, 1969) Quennedey (1984) menyatakan bahwa kasta prajurit pada famili Rhinotermitidae genus Coptotermes memiliki senjata kimia yang merupakan hasil sekresi yang dikeluarkan melalui lubang fontanel yang terdapat di dekat mandibel rayap. Sekresi pertahanan diri ini dihasilkan oleh kelenjar frontal yang berkembang dengan sempurna ke arah abdomen dan umumnya memenuhi sebagian besar abdomen.
Dengan beberapa kriteria, khususnya yang berhubungan dengan perkembangan kelenjar pertahanan diri prajurit rayap, Quennedey (1998) membagi distribusi perkembangan kelenjar pertahanan diri prajurit rayap pada tiga subdivisi, meliputi:
(1) Rayap famili Protermitidae, Mastotermitidae, Kalotermitidae, Termopsidae dan Hodotermitidae memiliki kelenjar pertahanan diri yang tidak
berdiferensiasi atau berkembang dengan sempurna, sehingga lebih banyak menggunakan mandibel sebagai alat pertahanan diri.
(2) Rayap famili Mesotermitidae dan Rhinotermitidae memiliki kelenjar per- tahanan diri yang berkembang dengan sempurna dari kepala sampai ke bagian abdomen
(3) Rayap famili Metatermitidae dan Termitidae memiliki kelenjar pertahanan diri yang berkembang dengan sempurna pada bagian kepala rayap dan hanya sedikit pada bagian abdomen.
Karakteristik Anatomi Kelenjar Sekresi Pertahanan Prajurit Rayap C. curvignathus
Kasta prajurit rayap C. curvignathus menggunakan sekresi kimia untuk melumpuhkan musuhnya. Sekresi pertahanan diri rayap dikeluarkan dari lubang fontanel yang berada di dekat mandibel. Lubang tersebut merupakan ujung dari kelenjar frontal (frontal gland) yang memiliki panjang rata-rata sekitar 2,5 + 0,10 mm dan diameter 0,8 + 0,16 mm. Ukuran kelenjar frontal yang sangat luas ini dibutuhkan karena viskositas sekresi yang diproduksi sangat kental (sekitar 0,0005 – 0,002 poise).
Kelenjar frontal sangat besar sehingga menekan tempat pencernaan makanan (digestive track) dan memenuhi hampir seluruh abdomen prajurit rayap (Quennedey dan Deligne 1975). Genus Coptotermes umumnya memiliki kelenjar frontal yang sangat besar. Kasta prajurit rayap C. intermedius memiliki panjang kelenjar frontal rata-rata sekitar 3 mm dengan diameter 1 mm, hampir sama dengan panjang tubuhnya, sedangkan pada kasta prajurit rayap C. travians panjang kelenjar frontal rata-rata sekitar 2,8 mm dengan diameter 0,8 mm. Karenanya, kasta prajurit rayap genus Coptotermes sering disebut dengan kelenjar berjalan (walking gland) (Quennedey 1998). Gambar anatomi kasta prajurit rayap C. curvignathus yang disajikan pada Gambar 6 menunjukkan bahwa kelenjar frontal memang memenuhi hampir seluruh abdomen rayap.
Lubang Fontanel
Kelenjar Frontal
*
*
*
Kelenjar Sternal
Gambar 6. Kelenjar Frontal Kasta Prajurit Rayap Tanah C. curvignathus (Perbesaran 40x) * : kelenjar frontal
Kelenjar frontal prajurit rayap C. curvignathus dimulai dari lubang fontanel yang berada di kepala prajurit rayap. Lubang fontanel merupakan tempat keluarnya cairan sekresi pertahanan diri rayap. Lubang fontanel memiliki diameter yang berukuran 0,2 + 0,18 mm disajikan pada Gambar 7. Dari lubang fontanel, kelenjar frontal memanjang dari bagian kepala prajurit rayap, thoraks sampai pada bagian abdomen.
A
Lubang Fontanel Lubang FontanelB
Gambar 7. Lubang Fontanel Prajurit Rayap Tanah C. curvignathus A : Perbesaran 100x B : Perbesaran 400x
Pada rayap genus Macrotermes, yang melakukan pertahanan diri dengan menggunakan mandibel dan tidak menggunakan sekresi pertahanan diri, kelenjar pertahanan tidak berkembang dengan sempurna, panjang kelenjar sangat pendek dan terdapat pada abdomen ruas kedua (Brune 1998). Pada rayap yang menggunakan sekresi pertahanan diri, kelenjar pertahanan (frontal)
berkembang dengan sempurna dan mempunyai ukuran yang panjang, misalnya pada rayap Globitermes sulphures, Microtermes alboparticus, dan Odontotermes smeathmani, panjang kelenjar frontal memenuhi separuh abdomen, sedangkan pada rayap Allodontotermes giffardii dan Hypotermes xenotermitis memiliki panjang kelenjar frontal dua pertiga abdomennya, dan rayap Pseudacanthotermes spiniger memiliki panjang kelenjar frontal yang memenuhi sembilan sampai sepuluh ruas abdomennya (Preswitch 1982).
Kelenjar frontal rayap C. curvignathus sangat panjang dan berdiferensiasi dengan sempurna yang tersusun dari sel kelas 1 dan sel kelas 3, tetapi ketebalan dinding sel kelenjar frontal sangat tipis, dan lebih tipis dari dinding sel kelenjar sternal, dengan ukutan rata-rata sebesar 4 – 10 μm (Quennedey 1977). Kelenjar frontal dengan perbesaran 100 kali dan 400 kali disajikan pada Gambar 8.
A
B
Gambar 8. Kelenjar Frontal Prajurit Rayap Tanah C. curvignathus A : Perbesaran 100x B : Perbesaran 400x
Dibandingkan dengan kelenjar sternal, yang berfungsi untuk mengeluarkan feromon penanda jejak, kelenjar frontal sangat panjang dan berdiferensiasi dengan sempurna. Kelenjar sternal berada di bagian bawah abdomen rayap dan memiliki ukuran yang lebih kecil dari kelenjar frontal (Noirot 1969). Kelenjar sternal rayap tanah C. curvignathus disajikan pada Gambar 9.
Kelenjar sternal
Gambar 9. Kelenjar Sternal Kasta Prajurit Rayap Tanah C. curvignathus Perbesaran 400x
Pada rayap genus Kalotermitidae, ukuran kelenjar sternal hampir sama dengan rayap genus Coptotermes, walaupun prajurit rayap ini tidak menggunakan sekresi kimia untuk melumpuhkan musuhnya (Scheffrahn et al. 1998). Kasta prajurit rayap genus Kalotermitidae memiliki bentuk mandibel yang berkembang dengan baik sehingga dapat menggigit dan menghancurkan musuhnya. Dengan demikian, kelenjar frontal prajurit rayap yang menggunakan sekresi kimia mengalami perkembangan dengan sempurna, karenanya hampir memenuhi seluruh abdomen.
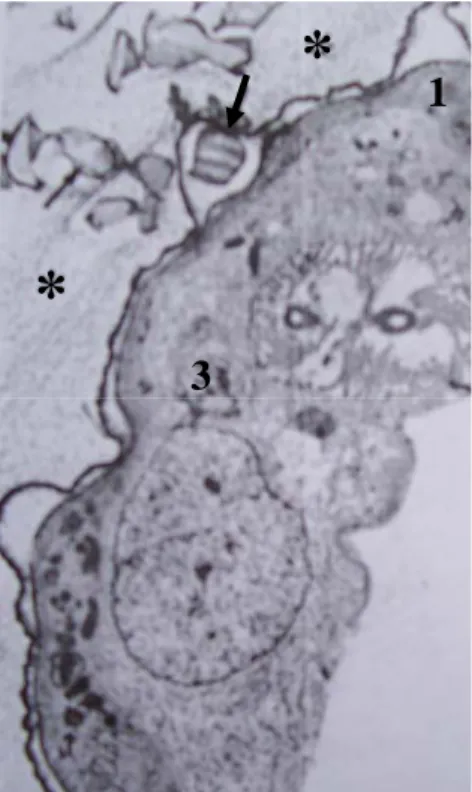
Quennedey (1998) menyatakan bahwa sel penyusun kelenjar frontal prajurit rayap genus Coptotermes terdiri dari sel kelas 1 dan sel kelas 3. Kelenjar frontal prajurit rayap C. lacteus pada bagian jaringan epitel yang terdiri dari sel kelas 1 dan sel kelas 3 disajikan pada Gambar 10.
*
1
*
3
Gambar 10. Kelenjar Frontal Kasta Prajurit Rayap C. lacteus (Perbesaran 5.600x, Quennedey 1998)
1 : Sel kelas 1 3 : Sel kelas 3
* : Bahan sekresi kimia yang diproduksi oleh sel kelas 3 : Globula besar yang menembus kutikula rayap, diproduksi oleh Sel kelas 1
Sel kelas 1 memiliki bentuk rata, memiliki sitoplasma dengan bentuk nukleus panjang, beberapa mitokondria, badan golgi yang kecil, ribosom bebas dan mengandung agregat granul glikogen dan badan mikloid. Sel kelas1 bertanggung jawab dalam pembentukan sekresi kimia rayap. Sel kelas 3 terdiri dari dua unit sel: sel sekretori dan sel kanal berbentuk panah. Sel sekretori menunjukkan karakteristik sentral ekstraselular yang memiliki mikrofili dengan panjang 1 μm. Ekstraselular tersebut merupakan ujung dari epikutikula yang berhubungan langsung dengan kutikula rayap. Pada sitoplasma sel sekretori terdapat retikulum endoplasma dan badan golgi yang berukuran besar, yang berfungsi melanjutkan proses pembentukan sekresi kimia dari sel kelas 1 (Quennedey 1998).
Dibandingkan dengan kelenjar Dufour pada semut Pristomyrmex, yang juga memiliki fungsi sebagai kelenjar penghasil sekresi kimia pertahanan diri semut, ukuran kelenjar frontal rayap tanah C. curvignathus lebih besar. Pada semut Pristomyrmex ukuran kelenjar Dufour hanya sebesar 300 x 130 μm (Billen et al. 2000). Skema letak kelenjar frontal rayap tanah C. curvignathus disajikan pada Gambar 11, sementara gambar lubang fontanel dengan SEM disajikan pada Gambar 12.
Gambar 11. Skema Letak Kelenjar Frontal Rayap Tanah C. curvignathus
Gambar 12. Lubang Fontanel Kasta Prajurit Rayap Tanah C. curvignathus (perbesaran 750x)
A : Tampak Depan Lubang Fontanel B : Lubang Fontanel
C : Tampak Samping Lubang Fontanel
A
B
C
. . .. . . . .. . .. . . . . . . . .. . . . . . . . . . . . . . .. . . .. . . . .. . . .. . . . . . . . .. . . . .. . . . . .. . .. . . .. . . . . . . . .. . . . . . . . .. . . . .. . . .. . . . .. . . .. . . . .. . .. .. . . .. . . . . . . . . . . . . . . . . .. . . . . . . . . . . . .. . . . . . . .. . .. . .. . . . . . . . .. . . .. . . . .. . . .. . . . .. . . . . .. . . . . . . . .. . .. . . .. . . . .. . . . . . . . .. . . .. . . . . . . .. . . . . . . . .. . . . . .. . .. . . . . . . . .. . . . . .. . .. .. . . . . . .. .. . . . . . . . . . . . .. . . . . . . . .. . . . . .. . .. . . .. . . . . . . . .. . . . . . Kelenjar frontal Kelenjar sternal - - - Kelenjar frontal - - - - lubang fontanel - - - Lubang fontanel Kelenjar frontal Lubang FontanelKarakterisasi Sekresi Pertahanan Rayap C. curvignathus
Sekresi pertahanan diri rayap yang dikeluarkan dari lubang fontanel kasta prajurit berwarna putih susu, berbentuk cairan kental dan mudah menguap. Nilai rendemen ekstrak sekresi sebesar 27,9081% – 38,0982%. Nilai rendemen ekstrak aquabidestilata lebih tinggi daripada nilai rendemen ekstrak pelarut lain. Hal ini menunjukkan bahwa sekresi rayap mudah terlarut dalam air atau pelarut polar. Besarnya rendemen ekstrak sekresi pada setiap pelarut disajikan pada Tabel 3. Tabel 3. Rendemen ekstrak sekresi pertahanan rayap C. curvignathus
pada empat pelarut yang berbeda
Pelarut Berat rayap
(gram) Berat ekstrak sekresi (gram) Rendemen (%) Etil Asetat 20,7854 5,8008 27,9081 Etanol 20,7425 7,1344 34,3951 n-heksan 20,7688 6,5824 31,6937 Aquabidestilata 20,8094 7,928 38,0982
Sekresi pertahanan diri merupakan senjata kimia rayap dan terdapat pada kelenjar pertahanan yang memiliki tempat penyimpanan cairan sekresi dengan ukuran besar sehingga sekresi dapat dikeluarkan dalam jumlah banyak dan kemudian dapat terbentuk serta disimpan kembali. Sekresi ini dikeluarkan melalui kontraksi mandibel (pada genus Nasutitermes) atau dengan cara mengerahkan tenaga dan melakukan kontraksi pada abdomen sehingga sekresi keluar dari lubang fontanel (pada genus Coptotermes). Jarak keluarnya sekresi dapat mencapai satu sampai lima sentimeter (Nelson et al. 2001).
Senyawa kimia yang terdapat pada serangga dapat dibagi menjadi tiga jenis yaitu feromon, hormon dan alomone. Feromon merupakan sarana komunikasi kimia diantara individu anggota koloni, hormon adalah sarana komunikasi kimia pada satu individu anggota koloni, dan alomone merupakan sekresi kimia yang berfungsi sebagai pertahanan diri terhadap pemangsa, sebagai anticendawan dan anti bakteri terhadap parasit (Morgan 2004).
Sekresi pertahanan diri dikeluarkan rayap untuk membuat musuh menjadi sakit dan mati. Sekresi ini merupakan alomone yang berfungsi sebagai pertahanan
diri. Sekresi pertahanan biasanya dilepaskan oleh kasta prajurit rayap karena keadaan lingkungan di sekitar rayap membahayakan anggota koloninya. Fungsi utama sekresi pertahanan adalah untuk melindungi anggota koloni rayap dari pemangsa. Kasta prajurit mengeluarkan feromon alarm sebagai tanda bahaya kepada anggota koloni sebelum mengeluarkan sekresi pertahanan. Ini merupakan prosedur utama dalam perlindungan anggota koloni rayap. Feromon alarm dikeluarkan kasta prajurit ketika berada di dalam sarang, di sekitar sarang, dan juga pada jarak yang jauh dari sarang, yaitu saat rayap pekerja yang sedang mengembara mencari makanan di luar sarang dan diserang oleh pemangsa.
Sekresi pertahanan diri rayap mudah menguap (volatile) dan biasanya diproduksi dalam jumlah banyak. Sekresi pertahanan rayap diproduksi pada kelenjar pertahanan (frontal gland) yang sangat panjang dan memenuhi hampir seluruh abdomen dengan berujung pada sebuah lubang fontanel yang terletak di kepala rayap, sedangkan sekresi pertahanan diri pada serangga genus Hymenoptera diproduksi pada kelenjar pertahanan yang letaknya berdekatan dengan senjata utamanya, yaitu mandibel dan sengat penusuk (Nishimoto et al. 2001).
Pada rayap, reaksi pertahanan dapat timbul karena beberapa sinyal dari sarang seperti adanya getaran yang terus menerus dari sarang dan gerakan kepala atau dari senyawa kimia yang meliputi feromon alarm dan penanda jejak. Ernst (1959) merupakan peneliti pertama yang mengamati adanya senyawa kimia sebagai sekresi pertahanan pada rayap genus Nasutitermes. Sekresi pertahanan rayap dari berbagai spesies kemudian banyak diteliti dan diidentifikasi setelah penemuan Ernst. Sekresi tersebut paling banyak diproduksi pada kelenjar frontal kasta prajurit dan mengandung senyawa monoterpen yang mudah menguap. Kasta prajurit dan kasta pekerja rayap saling melengkapi dalam sistem pertahanan sarang dan bertanggung jawab dengan cara yang berbeda terhadap keutuhan koloni dari serangan musuh.
Respon selama proses rekruitmen pertahanan yang diberikan oleh kasta prajurit dan kasta pekerja juga berbeda. Jika terjadi bahaya pada koloni rayap, kasta prajurit yang pertama kali memberi respon terhadap feromon alarm, yang bertindak sebagai atraktan jarak pendek, baru diikuti oleh kasta pekerja yang
memberi respon terhadap sekresi pertahanan diri yang dikeluarkan oleh kasta prajurit. Kasta pekerja melanjutkan pekerjaan kasta prajurit, yaitu melumpuhkan musuh dengan cara mengubur musuh dengan bahan yang dimiliki (faecal material) (Cornelius dan Bland 2001). Ekstrak sekresi pertahanan diri kasta prajurit rayap berbentuk cair dan kental (oily) dengan warna putih susu sampai abu-abu. Warna ekstrak sekresi pertahanan diri rayap C. curvignathus disajikan pada Gambar 13.
A
B
C
D
Gambar 13. Botol berisi ekstrak sekresi pertahanan rayap tanah C. curvignathus A : Ekstrak sekresi dalam pelarut aquabidestilata
B : Ekstrak sekresi dalam pelarut etil asetat C : Ekstrak sekresi dalam pelarut n-heksan D : Ekstrak sekresi dalam pelarut etanol
Menurut cara kerjanya (mode of action), sekresi pertahanan dapat dibagi menjadi tiga kategori, yaitu: pertama, sekresi kental, lengket dan bekerja secara mekanik daripada kimia; kedua, sekresi yang tidak kental dan tidak menyebabkan iritasi, bekerja secara repelen sehingga membuat pemangsa menjauhi rayap dan ketiga, sekresi kental yang sangat beracun yang bekerja pada proses fisiologi pemangsa atau musuh yang spesifik (Pasteels dan Bordereau 1998).
Rayap genus Coptotermes memiliki penyebaran yang sangat luas di daerah tropis dan subtropis. Moore (1969) menyatakan bahwa kasta prajurit rayap tanah Coptotermes lacteus di Australia mengeluarkan sekresi pertahanan diri yang kental dan berwarna putih susu dari lubang fontanel yang terletak di kepala rayap. Sekresi pertahanan diri rayap C. lacteus mudah menguap dan menjadi tidak berwarna serta membentuk lapisan cairan tipis pada musuh. Sekresi pertahanan
diri ini dapat direkonstruksi kembali dengan menambahkan air. Analisis kimia menunjukkan bahwa sekresi pertahanan diri kasta prajurit rayap C. lacteus adalah suspensi heterogen n-alkena (C22-C27) dalam larutan air, mucopolisakarida yang terdiri dari unit glukosa dan glukosamine.
Karakteristik fisiko-kimia ekstrak sekresi pertahanan rayap C. curvignathus meliputi nilai pH, viskositas, warna dan suhu ekstrak disajikan
pada Tabel 4. Nilai pH ekstrak sekresi berkisar antara 4 – 5,5; sedangkan nilai suhu ekstrak pada semua pelarut hampir sama, yaitu 27-27,5oC.
Tabel 4. Suhu, pH, viskositas dan warna ekstrak sekresi pertahanan rayap C. curvignathus pada pelarut yang berbeda
Pelarut pH Suhu
(oC)
Viskositas (poise)
Warna
Etil Asetat 4 27 0,0005 Putih susu
Etanol 5 27,5 0,00002 Putih susu
n-heksan 5,5 27 0,00003 Putih susu
Aquabidestilata 4,5 27 0,0002 Abu-abu
Menurut Olegbemiro et al. (1990) sekresi pertahanan diri rayap mengandung senyawa yang bersifat racun terhadap semut. Kandungan sekresi paling banyak adalah senyawa aldehid, senyawa yang telah lama diketahui sebagai racun syaraf bagi serangga. Kasta prajurit rayap umumnya menyerang dan menyakiti musuh dengan mandibel yang tajam kemudian menyemprotkan sekresi pertahanan diri yang mengandung senyawa kimia aldehid, hidrokarbon monoterpen beracun atau keton yang dikeluarkan dari kelenjar frontal, kelenjar ludah atau kelenjar cibarial.
Kasta prajurit rayap genus Globitermes mengeluarkan sekresi pertahanan diri dengan cara melakukan kontraksi pada abdomen kemudian cairan sekresi keluar dari kelenjar cephalic hypertrophied. Pada serangga ordo Hymenoptera, sekresi pertahanan diri dikeluarkan dari tusuk sengat. Sekresi pertahanan diri rayap juga mengandung senyawa yang berfungsi sebagai anti bakteri dan anti cendawan (Traniello et al. 2002).
Proses metabolisme pembentukan sekresi pertahanan diri dalam tubuh rayap masih belum dipahami. Ada pendapat ahli serangga yang menyatakan
bahwa sekresi pertahanan diri terbentuk dengan sendirinya (de novo) bukan dari ekstrak makanan yang dikonsumsi serangga. Kemungkinan adanya peran mikroorganisme dalam biosintesis sekresi pertahanan diri juga tidak ditemukan, walaupun ada beberapa bakteri dan cendawan yang mampu memproduksi senyawa sekresi (Nishida 2002).
Eisner et al. (1974) menyatakan bahwa metabolisme pembentukan sekresi pertahanan diri serangga merupakan proses serangga menyerap zat aktif tanaman, khususnya senyawa terpen (sequestration process). Sebagai contoh adalah sekresi pertahanan diri larva penggerek batang pinus Neodiprion sertifer mengandung senyawa asam resin pinus yang terlarut dalam α dan β pinene. Umumnya sekresi pertahanan diri serangga mengandung senyawa terpene, baik monoterpen, diterpen atau sesquiterpen.
Rayap merupakan serangga yang unik diantara serangga lain dalam proses biosintesis sekresi pertahanan diri. Tidak semua individu rayap dalam suatu spesies memiliki kelenjar yang berfungsi untuk memproduksi sekresi pertahanan diri. Selain itu, bentuk morfologi kepala kasta prajurit yang mengalami penebalan dan memiliki mandibel sebagai senjata untuk melumpuhkan musuh membuat kasta prajurit tidak dapat mengigit dan mengunyah makanan. Kasta prajurit mendapat makanan yang sudah dihaluskan yang disuapkan oleh kasta pekerja melalui proses trofalaksis. Dengan perkataan lain, makanan yang telah dihaluskan dan berbentuk cairan diberikan kepada kasta prajurit, yang selanjutnya diolah menjadi sekresi pertahanan diri.
Brune (1998) menyatakan bahwa ada beberapa susbstansi yang bertentangan dengan teori proses sequestrasi dalam pembentukan sekresi pertahanan diri rayap, yaitu (1) kelenjar frontal tidak berhubungan langsung dengan sistem pencernaan, sehingga kecil kemungkinan adanya aliran ekstrak makanan ke kelenjar frontal untuk diolah menjadi sekresi pertahanan, (2) jaringan kelenjar frontal mengandung sel sekretori, sehingga perubahan bentuk lemak dapat diamati, (3) ekstrak kasta pekerja dari semua spesies yang diteliti sangat sedikit mengandung mono- atau diterpen dan (4) makanan yang mengandung senyawa monoterpen dan diterpen merupakan makanan “spesies-spesifik”.
Rayap tingkat tinggi dan rayap tingkat rendah memiliki kemampuan yang berbeda dalam melakukan biosintesis terpen menjadi sekresi pertahanan diri. Rayap genus Coptotermes termasuk dalam golongan rayap tingkat rendah dan tidak memiliki kemampuan untuk melakukan biosintesis terpen menjadi sekresi pertahanan diri. Dengan demikian senyawa yang terdapat dalam sekresi pertahanan diri kasta prajurit rayap genus Coptotermes bukan berasal dari golongan terpen.
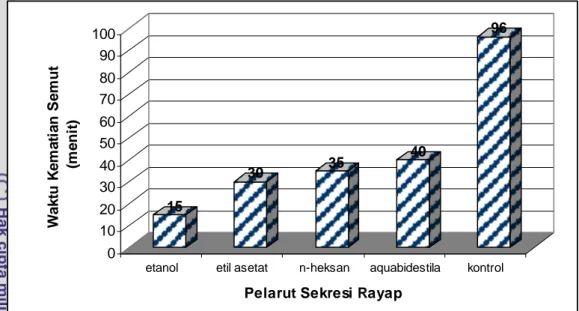
Aktivitas Sekresi Rayap C. curvignathus Terhadap Semut O. denticulata Hasil penelitian menunjukkan bahwa ekstrak sekresi rayap membuat semut mengalami kematian dengan nilai mortalitas mencapai 100 persen pada waktu yang berbeda. Pada satu jam pengamatan setelah semut diletakkan pada media pengujian, kematian semut yang pertama terjadi pada cawan petri dengan kertas saring yang diberi ekstrak etanol, yaitu 15 menit, kemudian diikuti dengan semut yang terdapat pada cawan petri yang diberi ekstrak etil asetat, n-heksan dan aquabidestilata berturut-turut 30 menit, 35 menit dan 40 menit. Sementara pada perlakuan kontrol, kejadian kematian semut pertama terjadi setelah 4 hari.
Penelitian yang dilakukan oleh Chen et al. (2002) pada semut Solenopsis invicta dengan enam ekstrak minyak esensial menghasilkan waktu kematian pertama semut untuk media pengujian dengan ekstrak minyak rosemary, geranium dan pohon teh setelah 15 menit, dan waktu kematian pertama pada perlakuan kontrol selama 5 hari. Sekresi pertahanan diri rayap mengandung senyawa yang bersifat racun terhadap semut. Kandungan sekresi paling banyak adalah senyawa aldehid, senyawa yang telah lama diketahui sebagai racun syaraf bagi serangga (Olegbemiro et al. 1990). Waktu kejadian kematian pertama semut O. denticulata untuk setiap perlakuan disajikan pada Gambar 14.
15 30 35 40 96 0 10 20 30 40 50 60 70 80 90 100 W a k tu K e ma ti a n S e mu t (m e n it)
etanol etil asetat n-heksan aquabidestila kontrol
Pelarut Sekresi Rayap
Gambar 14. Waktu kejadian kematian semut O. denticulata pertama dalam media pengujian toksisitas sekresi pertahanan rayap tanah C. curvignathus Waktu rata-rata kematian semut mencapai 100 persen pada setiap ekstrak sekresi rayap berbeda-beda. Ekstrak sekresi rayap dalam pelarut etanol memiliki waktu rata-rata kematian tertinggi yaitu 2 hari 6 jam, kemudian diikuti oleh ekstrak sekresi rayap dalam pelarut etil asetat, aqubidestilata dan n-heksan, berturut-turut setelah 3 hari 2 jam; 3 hari 7 jam; 3 hari 10 jam. Sementara pada perlakuan kontrol, kematian rayap mencapai 100 persen pada hari ke 7. Penelitian Smedley et al. (2002) yang menguji daya tahan semut Solenopsis sp terhadap racun yang dikeluarkan oleh rambut ulat Pieris rapae menunjukkan bahwa semut dapat bertahan selama 2 hari dan kematian semut pertama terjadi setelah 15 menit terkontaminasi racun. Waktu rata-rata kematian semut mencapai 100 persen pada setiap ekstrak sekresi rayap disajikan pada Gambar 15.
54 74 79 82 168 0 20 40 60 80 100 120 140 160 180 W a k tu K e ma ti a n S e mu t (m e n it)
etanol etil asetat n-heksan aquabidestila kontrol
Pelarut Sekresi Rayap
Gambar 15. Waktu kematian seluruh semut O. denticulata dalam media pengujian toksisitas sekresi pertahanan rayap tanah C. curvignathus
Pada pengujian pertahanan diri rayap terhadap semut, prajurit rayap langsung memberikan reaksi terhadap kehadiran semut pada media pengujian. Walaupun ukuran semut lebih besar dari prajurit rayap (Gambar 16), prajurit rayap secara bersama-sama langsung menyerang semut dan berusaha melumpuhkan semut. Prajurit rayap bergerak dengan cepat menuju semut, mengelilingi semut, mengeluarkan sekresi pertahanan diri, dan menggigit bagian tubuh semut, sementara kasta pekerja rayap berusaha menjauh dari arena pertempuran. Kasta prajurit tidak melepaskan gigitannya, walaupun semut berusaha untuk melepaskan gigitan rayap, sampai semut mengalami kematian.
Jika terjadi interaksi langsung antara semut dan rayap, rayap memiliki reaksi yang lebih lamban dari semut, baik pada respon pertahanan dan pada gerakan untuk membela diri, karenanya rayap melengkapi sistem pertahanan diri dengan sekresi kimia dan mandibel yang keras sebagai senjata mekanik untuk melumpuhkan semut. Peristiwa pertempuran kasta prajurit rayap dengan semut disajikan pada Gambar 17.
Gambar 17. Kasta prajurit rayap tanah C. curvignathus melakukan penyerangan terhadap semut O. denticulata dalam media pengujian
Semut yang diletakkan pada media pengujian berusaha untuk menjauhi rayap dan mengelilingi cawan petri. Pada kelompok rayap dengan jumlah 20 ekor kasta pekerja dan 20 ekor kasta prajurit, semut diserang oleh kasta prajurit dan mengalami kematian setelah tiga jam kemudian, sedangkan pada kelompok rayap dengan jumlah 50 ekor kasta pekerja dan 50 ekor kasta prajurit, kematian semut terjadi lebih cepat, yaitu 2 jam setelah peletakan semut pada media pengujian. Sementara pada kelompok ketiga yang terdiri dari 100 ekor kasta pekerja dan 100 ekor kasta prajurit, semut mengalami kematian 1 jam setelah peletakan semut pada media pengujian. Waktu kematian semut dalam jumlah anggota kelompok rayap yang berbeda disajikan pada Gambar 18.
3 2 1 0 0.5 1 1.5 2 2.5 3 W akt u ke m at ian sem u t ( jam ) 40 100 200
Jumlah anggota rayap (ekor)
Gambar 18. Waktu kematian semut O. denticulata dalam media pengujian pertahanan diri rayap C. curvignathus
Sekresi pertahanan yang dimiliki rayap merupakan senjata kimia yang berguna untuk melindungi anggota koloni rayap. Sistem pertahanan ini diperlukan karena sebagai serangga sosial, rayap hidup dalam satu koloni besar dan berada pada kondisi sarang yang hangat dan mendukung pertumbuhan mikroorganisme (Christe et al. 2003). Rayap memproduksi sekresi pertahanan dengan mekanisme yang bervariasi, baik secara perilaku dan fisiologi, misalnya dengan fungsi antibiotik yang diproduksi simbion (Lamberty et al. 2001), allogrooming (Rose angus et al. 1998), sekresi antibiotik (Roseangus et al. 2000), dan pertahanan ke- kebalan diri (immune defense) (Traniello et al. 2002). Morgan (2004) menyatakan bahwa sekresi pertahanan diri rayap merupakan alomone yang mempunyai fungsi sebagai agen pertahanan diri untuk melindungi rayap dari serangan predator.
Aktivitas Sekresi Rayap C. curvignathus Terhadap Bakteri Patogen E. coli dan S. aureus
Pengaruh Pelarut Ekstrak Terhadap Aktivitas Antibakteri
Sekresi pertahanan diri rayap diekstraksi dengan pelarut yang memiliki nilai polaritas yang berbeda. Hal ini dimaksudkan untuk mengetahui kepolaran senyawa antibakteri yang terdapat di dalam ekstrak sekresi rayap. Sifat kepolaran tersebut sangat penting untuk efektivitas identifikasi senyawa antibakteri yang terdapat pada sekresi rayap pada penelitian selanjutnya (Pomeranz dan Meloan 1999).
Pelarut yang digunakan dari yang non polar ke yang paling polar adalah n-heksan, etil asetat, etanol dan aquabidestilata, dengan nilai polaritasnya berturut-turut 0, 38, 68, dan 90. Pengujian antibakteri dilakukan untuk menentu- kan kemampuan ekstrak dalam membunuh atau menghambat pertumbuhan bakteri uji. Salah satu cara pengujian yaitu dengan uji hayati, dengan menggunakan Metode Sumur berdasarkan Carson dan Riley (1995). Pada cara difusi ini larutan antibakteri diletakkan di dalam sumur, kemudian larutan tersebut akan berdifusi, lalu masuk ke dalam medium agar yang telah diinokulasi dengan mikroba penguji. Setelah inkubasi terjadi hambatan dari pertumbuhan mikroba penguji, sehingga terdapat daerah bening yang terbentuk di sekitar sumur yang ditetesi suspensi antibakteri tersebut.
Pengujian antibakteri dilakukan terhadap ekstrak sekresi rayap dan pelarut ekstrak sekresi. Tujuan dilakukannya uji antibakteri terhadap pelarut adalah untuk mengetahui apakah pelarut tersebut juga mempunyai aktivitas antibakteri. Hasil pengujian menunjukkan bahwa ekstrak sekresi rayap dalam pelarut n-heksan ternyata tidak memperlihatkan efek penghambatan terhadap semua bakteri uji, demikian juga dengan ekstrak aquabidestilata. Hasil penelitian Moshi dan Mbwambo (2005) pada ekstrak n-heksan dari akar tanaman Terminalia sericea juga menunjukkan tidak ada penghambatan pertumbuhan terhadap bakteri uji S. aureus dan E. coli. Sedangkan ekstrak etanol dan ekstrak etil asetat dapat menghambat pertumbuhan bakteri uji, baik pada bakteri S. aureus dan bakteri E. coli. Sementara itu, pelarut ekstrak yang digunakan dalam penelitian ini (n-heksan, etil asetat, etanol dan aquabidestilata) tidak menunjukkan aktivitas antibakteri. Hal ini menunjukkan bahwa bahan pelarut tidak memberi konstribusi terhadap aktivitas antibakteri ekstrak sekresi rayap C. curvignathus.
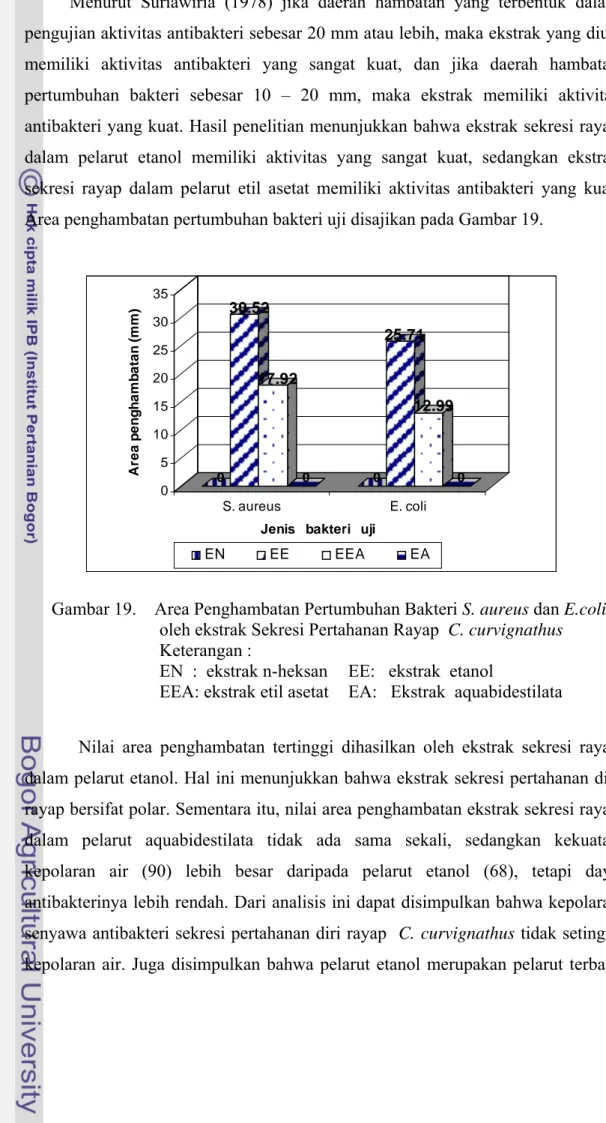
Ekstrak etanol dapat menghambat pertumbuhan bakteri S. aureus dengan zona areal penghambatan pertumbuhan bakteri rata-rata sebesar 30,52 mm, sedangkan pada bakteri E. coli rata-rata sebesar 25,71 mm. Ekstrak etil asetat dapat menghambat pertumbuhan bakteri S. aureus dengan zona areal penghambatan pertumbuhan bakteri rata-rata sebesar 17,92 mm, sedangkan pada bakteri E. coli rata-rata sebesar 12,99 mm.
Menurut Suriawiria (1978) jika daerah hambatan yang terbentuk dalam pengujian aktivitas antibakteri sebesar 20 mm atau lebih, maka ekstrak yang diuji memiliki aktivitas antibakteri yang sangat kuat, dan jika daerah hambatan pertumbuhan bakteri sebesar 10 – 20 mm, maka ekstrak memiliki aktivitas antibakteri yang kuat. Hasil penelitian menunjukkan bahwa ekstrak sekresi rayap dalam pelarut etanol memiliki aktivitas yang sangat kuat, sedangkan ekstrak sekresi rayap dalam pelarut etil asetat memiliki aktivitas antibakteri yang kuat. Area penghambatan pertumbuhan bakteri uji disajikan pada Gambar 19.
0 30.52 17.92 0 0 25.71 12.99 0 0 5 10 15 20 25 30 35 A re a pe ng ha m b a ta n ( m m ) S. aureus E. coli
Jenis bakteri uji
EN EE EEA EA
Gambar 19. Area Penghambatan Pertumbuhan Bakteri S. aureus dan E.coli oleh ekstrak Sekresi Pertahanan Rayap C. curvignathus
Keterangan :
EN : ekstrak n-heksan EE: ekstrak etanol
EEA: ekstrak etil asetat EA: Ekstrak aquabidestilata
Nilai area penghambatan tertinggi dihasilkan oleh ekstrak sekresi rayap dalam pelarut etanol. Hal ini menunjukkan bahwa ekstrak sekresi pertahanan diri rayap bersifat polar. Sementara itu, nilai area penghambatan ekstrak sekresi rayap dalam pelarut aquabidestilata tidak ada sama sekali, sedangkan kekuatan kepolaran air (90) lebih besar daripada pelarut etanol (68), tetapi daya antibakterinya lebih rendah. Dari analisis ini dapat disimpulkan bahwa kepolaran senyawa antibakteri sekresi pertahanan diri rayap C. curvignathus tidak setinggi kepolaran air. Juga disimpulkan bahwa pelarut etanol merupakan pelarut terbaik
yang dapat digunakan untuk ekstraksi zat antibakteri sekresi pertahanan diri rayap C. curvignathus. Sifat polaritas antibakteri ini penting untuk identifikasi senyawa antibakteri selanjutnya. Areal zona bening penghambatan pertumbuhan bakteri oleh ekstrak sekresi rayap dalam berbagai pelarut disajikan pada Gambar 20.
et EA EE EEA aq ea EN nh aq EA EE et ea EEA nh EN
Staphylococcus aureus Escherichia coli Gambar 20. Zona penghambatan pertumbuhan bakteri oleh ekstrak sekresi pertahanan rayap C. curvignathus dalam berbagai pelarut
Ket. : EN :Ekstrak n-heksan nh: n-heksan (kontrol) EE :Ekstrak etanol et : etanol (kontrol) EEA:Ekstrak etil asetat ea : etil asetat (kontrol) EA : Ekstrak aquabidestilata aq : aquabidestilata (kontrol) Menurut Kanazawa et al. (1995) suatu senyawa yang mempunyai polaritas optimum akan mempunyai aktivitas antibakteri maksimum, karena untuk interaksi suatu senyawa antibakteri dengan bakteri diperlukan keseimbangan hidrofilik-lipofilik (HLB: hydrophilic lipophilic balance). Polaritas senyawa merupakan sifat fisik senyawa antimikroba yang penting. Sifat hidrofilik diperlukan untuk menjamin senyawa antibakteri larut dalam air yang merupakan tempat hidup mikroba, tetapi senyawa yang bekerja pada membran sel hidrofobik memerlukan pula sifat lipofilik, sehingga senyawa antibakteri memerlukan keseimbangan hidrofilik-lipofilik untuk mencapai aktivitas yang optimal (Branen & Davidson 1993).
Hasil penelitian menunjukkan bahwa bakteri gram negatif E. coli lebih resisten terhadap ekstrak sekresi rayap daripada bakteri gram positif S. aureus. Hasil penelitian Lamberty et al. (2001b) menunjukkan hasil yang sama bahwa
cairan sekresi pertahanan serangga umumnya lebih aktif menahan pertumbuhan bakteri gram positif daripada bakteri gram negatif. Hal ini disebabkan karena bakteri gram positif dan bakteri gram negatif mempunyai dinding sel yang berbeda sensitivitasnya terhadap perlakuan fisik, enzim dan antibiotik (Fardiaz 1992).
Perbedaan kedua jenis bakteri tersebut disebabkan oleh perbedaan struktur lapisan dinding selnya. Bakteri gram negatif memiliki struktur dinding sel yang berlapis-lapis serta kandungan lemak relatif tinggi (11-12%) sehingga lebih tahan terhadap perubahan lingkungan yang disebabkan oleh bahan kimia (Pelczar dan Reid 1977). Sedangkan dinding sel bakteri gram positif terdiri dari unit membran yaitu suatu susunan yang teratur dari peptidoglikan dan asam teikoat. Nuraida et al. (1999) menyebutkan bahwa bakteri gram negatif mempunyai ketahanan yang lebih baik terhadap ekstrak polar daging biji picung dibandingkan dengan bakteri gram positif, yang disebabkan oleh perbedaan senyawa penyusun struktur dinding selnya. Perbedaan dinding sel antara bakteri gram positif dengan bakteri gram negatif disajikan pada Gambar 21.
N-asetilglukosamin N-asam asetilmuramik Peptida pendek Jembatan peptida Asam telkoat Lapisan peptido-glikan Lapisan dinding luar Membran sel Lapisan peptido-glikan Membran sel A C B
Gambar 21. Struktur dinding dan membran sel bakteri: (A) Gram Positif ; (B) Gram Negatif ; (C) Lapisan peptidoglikan (Sumber : Cano dan Colome 1986)