5
BAB II
TINJAUAN PUSTAKA
2.1 Sistem KardiovaskularOrgan utama dari sistem kardiovaskular adalah jantung dan pembuluh darah, di mana organ tersebut memainkan peran penting dalam fisiologi manusia. Sistem kardiovaskular memiliki fungsi utama transportasi. Darah sebagai alat transportasi membawa nutrisi, gas, limbah, antibodi, elektrolit, dan banyak zat lain dari dan ke sel tubuh (Marieb & Brito, 2018).
2.1.1 Jantung
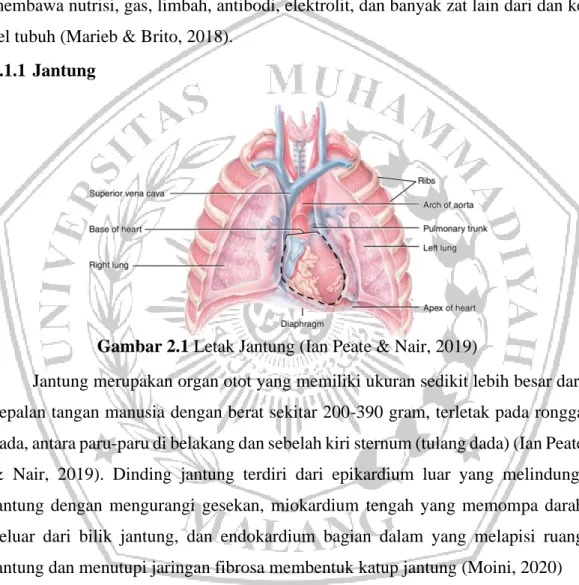
Jantung merupakan organ otot yang memiliki ukuran sedikit lebih besar dari kepalan tangan manusia dengan berat sekitar 200-390 gram, terletak pada rongga dada, antara paru-paru di belakang dan sebelah kiri sternum (tulang dada) (Ian Peate & Nair, 2019). Dinding jantung terdiri dari epikardium luar yang melindungi jantung dengan mengurangi gesekan, miokardium tengah yang memompa darah keluar dari bilik jantung, dan endokardium bagian dalam yang melapisi ruang jantung dan menutupi jaringan fibrosa membentuk katup jantung (Moini, 2020)
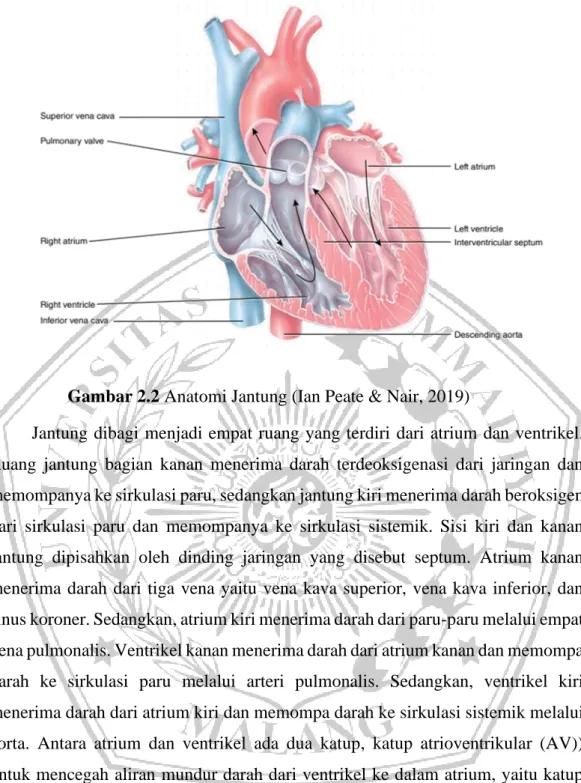
Jantung dibagi menjadi empat ruang yang terdiri dari atrium dan ventrikel. Ruang jantung bagian kanan menerima darah terdeoksigenasi dari jaringan dan memompanya ke sirkulasi paru, sedangkan jantung kiri menerima darah beroksigen dari sirkulasi paru dan memompanya ke sirkulasi sistemik. Sisi kiri dan kanan jantung dipisahkan oleh dinding jaringan yang disebut septum. Atrium kanan menerima darah dari tiga vena yaitu vena kava superior, vena kava inferior, dan sinus koroner. Sedangkan, atrium kiri menerima darah dari paru-paru melalui empat vena pulmonalis. Ventrikel kanan menerima darah dari atrium kanan dan memompa darah ke sirkulasi paru melalui arteri pulmonalis. Sedangkan, ventrikel kiri menerima darah dari atrium kiri dan memompa darah ke sirkulasi sistemik melalui aorta. Antara atrium dan ventrikel ada dua katup, katup atrioventrikular (AV)) untuk mencegah aliran mundur darah dari ventrikel ke dalam atrium, yaitu katup trikuspid dan katup bicuspid (Ian Peate & Nair, 2019).
2.1.2 Pembuluh Darah
Pembuluh darah membentuk sirkuit tertutup dari tabung yang membawa darah dari jantung ke seluruh tubuh dan kembali lagi ke jantung. Proses jantung memompa darah akan menghasilkan tekanan pada pembuluh darah, untuk dapat menahan tekanan tersebut pembuluh darah dilapisi dinding yang terbuat dari tiga
lapisan yang dikenal sebagai tunik. Lapisan luar adalah tunica adventitia (atau tunica externa) yang terbuat dari jaringan fibrosa. Lapisan tengah yang terdiri dari otot polos dan jaringan elastis disebut Tunika media. Lapisan terdalam adalah tunica intima (atau tunica interna) yang terdiri dari epitel skuamosa (sel endotel) (McGuinness, 2020).
Pembuluh darah dalam sistem kardiovaskular terdiri dari tiga jenis, yaitu arteri, kapiler, dan vena. Arteri adalah sistem distribusi pembuluh darah. Saat bergerak menjauhi jantung, arteri bercabang menjadi pembuluh berdiameter kecil (arteriol) yang memasok darah untuk sebagian besar jaringan di tubuh. Arteri di sirkuit paru membawa darah terdeoksigenasi, sedangkan arteri di sirkuit sistemik membawa darah beroksigen. Selanjutnya pembuluh darah kapiler yang merupakan sistem pertukaran pembuluh darah. Kapiler berdiameter sangat kecil, banyak di antaranya hanya setebal satu sel dan membentuk jaringan bercabang yang disebut lapisan kapiler. Pada pembuluh darah kapiler antara sel jaringan dan darah terjadi pertukaran gas, nutrisi, limbah, dan molekul lain dengan cepat. Pembuluh vena berfungsi sebagai sistem pengumpulan pembuluh darah. Vena mengalirkan darah dari pembuluh kapiler dan mengembalikannya ke jantung. Berlawanan dengan arteri di sirkuit paru, vena mengangkut darah yang mengandung oksigen, sedangkan di sirkuit sistemik, vena mengangkut darah yang terdeoksigenasi (Amerman, 2019).
2.2 Definisi Infark Miokard Akut
Infark Miokard Akut (IMA) adalah kondisi nekrosis jaringan miokardium dengan kondisi klinis yang konsisten (Morrow & Braunwald, 2017). Istilah infark miokard mengacu pada iskemia jaringan miokard akibat obstruksi sebagian atau seluruhnya dari arteri koroner dengan peristiwa akut yang biasanya disertai dengan peningkatan enzim jantung, perubahan elektrokardiogram (EKG) yang khas, dan
gejala nyeri, atau kelainan trombus atau gerakan dinding yang terdeteksi. Iskemia jaringan miokard didefinisikan sebagai cedera pada otot jantung akibat dari ketidakseimbangan suplai dan permintaan oksigen dan substrat (Gresham, 2019). 2.3 Epidemiologi Infark Miokard Akut
Infark miokard akut merupakan manifestasi paling parah dari penyakit arteri koroner, yang menyebabkan lebih dari 2-4 juta kematian di Amerika Serikat, lebih dari 4 juta penyebab kematian di Eropa dan Asia utara, dan lebih dari sepertiga penyebab kematian di negara maju setiap tahunnya. Peningkatan penggunaan terapi berbasis bukti dan perubahan gaya hidup telah mendorong penurunan angka kematian akibat penyakit jantung koroner dalam beberapa dekade terakhir. Namun, infark miokard tetap mempengaruhi kesehatan global, lebih dari 7 juta orang di seluruh dunia setiap tahun (Reed et al., 2017).
Insiden relatif STEMI dan NSTEMI mengalami penurunan dan peningkatan. Tingkat insiden STEMI di Swedia, adalah 58 per 100.000 per tahun pada tahun 2015. Di negara-negara Eropa lainnya, tingkat insiden berkisar dari 43 hingga 144 per 100.000 per tahun. Demikian pula, tingkat insiden yang disesuaikan yang dilaporkan dari AS menurun dari 133 per 100.000 pada tahun 1999 menjadi 50 per 100.000 pada tahun 2008, sedangkan insiden NSTEMI tetap konstan atau sedikit meningkat (Ibanez et al., 2018).
Sebanyak 478.000 pasien di Indonesia terdiagnosis penyakit jantung koroner pada tahun 2013. Infark miokard akut dengan ST-elevasi mengalami peningkatan prevalensi dari 25% ke 40% (Saputra et al., 2016). Bahkan penelitian yang dilakukan Gayatri et al., (2016) di RSUD dr. Dradjat Prawiranegara selama tahun 2014 ditemukan 95 kasus (63%) dari 151 kasus sindrom koroner akut (SKA) adalah IMA-EST.
2.4 Etiologi Infark Miokard Akut
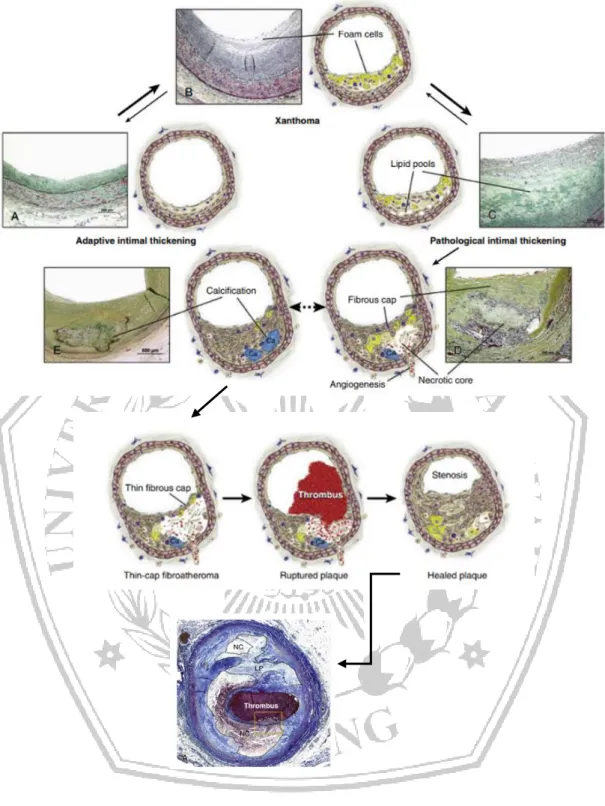
Etiologi infark miokard akut adalah terjadinya rupture, fisura, atau erosi plak aterosklerotik yang tidak stabil diikuti oleh agregasi trombosit dan pembentukan trombus yang mengganggu aliran darah distal yang berlangsung lama. Beberapa mekanisme memainkan peran penting dalam perkembangan plak aterosklerotik antara lain, peradangan dengan aktivasi sel endotel, perekrutan monosit, proliferasi sel otot polos dan sintesis matriks, nekrosis partikel lipid, kalsifikasi, dan
thrombosis (Chandra & Swamy, 2019). Aterosklerosis adalah penebalan dan hilangnya elastisitas dari dinding arteri yang terjadi di intima dan media, menyebabkan pengerasan dinding pembuluh darah dan penyempitan lumen pembuluh darah (Gresham, 2019). Penyebab lainnya terjadi IMA adalah ketidak sesuaian antara suplai dan kebutuhan oksigen akibat vasospasme koroner, emboli koroner, diseksi arteri koroner, kelainan bawaan, keadaan hiperkoagulasi, dan penyalahgunaan zat (Baliga & Eagle, 2017).
2.5 Patofisiologi Infark Miokard Akut
Patofisologi yang mendasari terjadinya Infark Miokard Akut adalah plak ateroma pembuluh darah koroner yang pecah akibat perubahan komposisi plak dan penipisan jaringan fibrosa. Pecahnya plak menyebabkan proses agregasi trombosit dan aktivasi jalur koagulasi sehingga terbentuknya thrombus yang kaya akan trombosit. Thrombus ini akan menyumbat lubang pembuluh darah koroner, baik secara total maupun parsial, atau menjadi mikroemboli yang menyumbat pembuluh koroner yang lebih distal. Selain itu terjadi pelepasan zat vasoaktif yang menyebabkan vasokonstriksi sehingga memperberat gangguan aliran darah koroner. Berkurangnya aliran darah koroner menyebabkan iskemia miokardium. Suplai oksigen yang berhenti selama kurang-lebih 20 menit menyebabkan miokardium mengalami nekrosis (Infark miokard), seperti pada gambar 2.4. Oklusi total pembuluh darah koroner bukan menjadi satu-satunya penyebab infark miokard. Sumbatan subtotal yang disertai vasokonstriksi yang dinamis dapat menyebabkan terjadinya iskemia dan nekrosis jaringan otot jantung (miokard). Selain nekrosis, iskemia juga menjadi penyebab gangguan kontraktilitas miokardium karena proses hibernating dan stunning (setelah iskemia hilang), distritmia dan remodeling ventrikel (perubahan bentuk, ukuran dan fungsi ventrikel) (PERKI, 2018).
2.6 Klasifikasi Infark Miokard Akut
Berdasarkan pengambilan keputusan terapi infark miokar akut dibedakan menjadi dua jenis ST-segment Elevation Myocardial Infarction (STEMI) dan Non
ST-segment Elevation Myocardial Infarction (N-STEMI) di mana pasien dengan
STEMI harus segera mendapatkan terapi perfusi (Tibaut et al., 2017). Diagnosis N-STEMI ditegakkan jika terdapat keluhan angina pektoris akut disertai elevasi segmen ST yang presisten di 2 sadapan yang bersebelahan pada rekaman EKG. Sedangkan, pada N-STEMI dan angina pektoris tidak stabil (APTS) terdapat keluhan angina pektoris akut tanpa elevasi segmen ST di dua sadapan yang bersebelahan yang menetap pada rekaman EKG (PERKI, 2018). Selain itu Infark Miokard dibedakan menjadi lima jenis berdasarkan patofisiologi klinik dan prognostiknya (Tibaut et al., 2017).
2.6.1 Tipe I : Infark Miokard Spontan
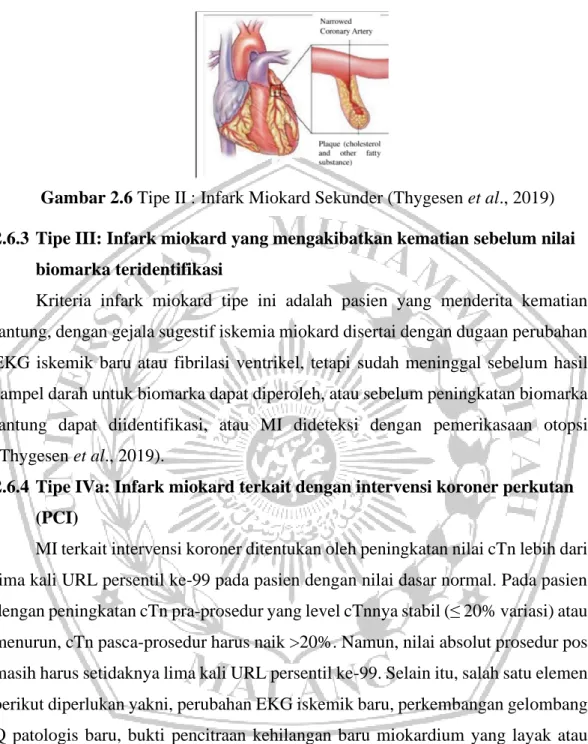
Infark miokard spontan terjadi akibat gangguan plak aterosklerotik mengakibatkan pembentukan trombus dan penurunan aliran darah miokard atau emboli trombosit distal dengan nekrosis miosit berikutnya (Tibaut et al., 2017). 2.6.2 Tipe II : Infark Miokard Sekunder akibat ketidakseimbangan Iskemik
Ketidakseimbangan antara suplai oksigen miokard dan / atau kebutuhan karena kondisi lain (bukan CAD) merupakan mekanisme patofisiologi dari infark miokard tipe II. Kondisi lain tersebut di antaranya, disfungsi endotel koroner, spasme arteri koroner, emboli koroner, takiaritmia atau bradiaritmia, gagal jantung, anemia, gagal napas, hipotensi, hipertensi, gagal ginjal atau prosedur mayor (Tibaut
et al., 2017). Pada pasien yang menjalani angiografi koroner tepat waktu, deskripsi
ruptur plak dengan trombus di arteri terkait infark dapat membantu dalam membedakan antara MI tipe 2 dengan MI tipe 1, tetapi angiografi tidak selalu pasti diindikasikan secara klinis, atau diperlukan. untuk menegakkan diagnosis ini. Aterosklerosis koroner adalah temuan umum pada tipe 2 pasien MI dipilih untuk
angiografi koroner. Secara umum, pasien-pasien ini memiliki prognosis yang lebih buruk daripada mereka yang tidak menderita (Thygesen et al., 2019).
2.6.3 Tipe III: Infark miokard yang mengakibatkan kematian sebelum nilai biomarka teridentifikasi
Kriteria infark miokard tipe ini adalah pasien yang menderita kematian jantung, dengan gejala sugestif iskemia miokard disertai dengan dugaan perubahan EKG iskemik baru atau fibrilasi ventrikel, tetapi sudah meninggal sebelum hasil sampel darah untuk biomarka dapat diperoleh, atau sebelum peningkatan biomarka jantung dapat diidentifikasi, atau MI dideteksi dengan pemerikasaan otopsi (Thygesen et al., 2019).
2.6.4 Tipe IVa: Infark miokard terkait dengan intervensi koroner perkutan (PCI)
MI terkait intervensi koroner ditentukan oleh peningkatan nilai cTn lebih dari lima kali URL persentil ke-99 pada pasien dengan nilai dasar normal. Pada pasien dengan peningkatan cTn pra-prosedur yang level cTnnya stabil (≤ 20% variasi) atau menurun, cTn pasca-prosedur harus naik >20%. Namun, nilai absolut prosedur pos masih harus setidaknya lima kali URL persentil ke-99. Selain itu, salah satu elemen berikut diperlukan yakni, perubahan EKG iskemik baru, perkembangan gelombang Q patologis baru, bukti pencitraan kehilangan baru miokardium yang layak atau baru, kelainan gerakan dinding regional dalam pola yang sesuai dengan etiologi iskemik, temuan angiografik konsisten dengan komplikasi pembatas aliran prosedural seperti diseksi koroner, oklusi arteri epikardial mayor atau oklusi cabang samping / trombus, gangguan aliran kolateral, atau embolisasi distal. Perkembangan terisolasi dari gelombang Q patologis baru memenuhi kriteria tipe 4a MI jika nilai cTn dinaikkan dan ditingkatkan tetapi lebih dari lima kali URL
persentil ke-99. Demonstrasi post-mortem dari trombus terkait prosedur di arteri penyebab, atau area nekrosis yang dibatasi secara makroskopik dengan atau tanpa perdarahan intra-miokard memenuhi kriteria MI tipe 4a (Thygesen et al., 2019). 2.6.5 Tipe IVb: Infark miokard yang berhubungan dengan trombosis stent
Subkategori MI terkait PCI adalah trombosis stent / perancah, MI tipe 4b, seperti yang didokumentasikan oleh angiografi atau otopsi menggunakan kriteria yang sama yang digunakan untuk MI tipe 1. Penting untuk menunjukkan waktu terjadinya stent / scaffold thrombosis dalam kaitannya dengan waktu prosedur PCI (Thygesen et al., 2019).
2.6.6 Tipe V: Infark miokard terkait coronary artery bypass grafting (CABG) MI terkait CABG didefinisikan sebagai peningkatan nilai cTn> 10 kali URL persentil ke-99 pada pasien dengan nilai cTn dasar normal. Pada pasien dengan peningkatan cTn pra-prosedur yang level cTnnya stabil (<_ 20% variasi) atau menurun, cTn pasca prosedur harus naik > 20%. Namun, nilai post prosedural absolut masih harus > 10 kali URL persentil ke-99. Selain itu, salah satu elemen berikut diperlukan: Perkembangan gelombang Q patologis baru, Angiografik mendokumentasikan oklusi graft baru atau oklusi arteri koroner asli yang baru, Bukti pencitraan hilangnya miokardium baru atau kelainan gerakan dinding regional baru dalam pola yang konsisten dengan etiologi iskemik. a Perkembangan terisolasi gelombang Q patologis baru memenuhi kriteria tipe 5 MI jika nilai cTn dinaikkan dan dinaikkan tetapi <10 kali URL persentil ke-99 (Thygesen et al., 2019).
2.7 Manifestasi Klinis Infark Miokard Akut
Manifestasi klinis yang biasanya timbul pada pasien infark miokard akut adalah nyeri dada substernal tiba-tiba atau ketidaknyamanan yang sering digambarkan sebagai rasa tertekan, berat, atau sesak yang berlangsung selama 10 menit atau lebih. Gejala dapat menyebar ke lengan, bahu, punggung, perut, atau rahang. Pasien juga dapat mengalami mual, muntah, diaphoresis, atau sesak napas. Manifestasi lain mungkin datang dengan gejala atipikal yang tidak termasuk nyeri dada, seperti nyeri epigastrik, gangguan pencernaan, menusuk, atau nyeri dada pleuritik, dan meningkatnya dispnea saat beraktivitas. Pasien yang cenderung mengalami gejala atipikal biasanya orang tua berusia 75 tahun atau lebih, wanita,
dan pasien dengan riwayat diabetes, gangguan fungsi ginjal, dan demensia. Pada pemeriksaan fisik tidak ada temuan spesifik yang mengindikasikan IMA. Namun, pada temuan non spesifik, IMA dapat menyebabkan S4 atau pemisahan S2 secara paradoks pada auskultasi. Sebaliknya, harus dievaluasi adanya komplikasi MI (misalnya, gagal jantung, murmur baru dari regurgitasi mitral karena disfungsi otot papiler) yang jika ada, akan mempercepat evaluasi dan intervensi terapeutik (DiPiro
et al., 2020).
2.7.1 Pemeriksaan Elektrokardiogram
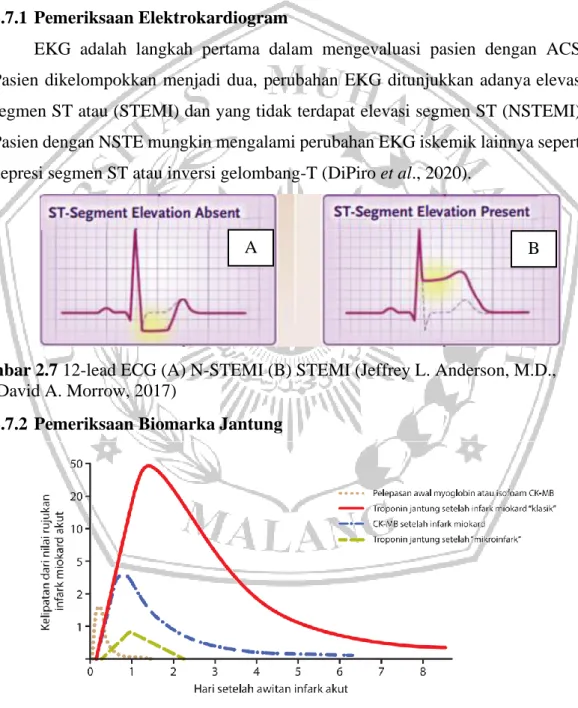
EKG adalah langkah pertama dalam mengevaluasi pasien dengan ACS. Pasien dikelompokkan menjadi dua, perubahan EKG ditunjukkan adanya elevasi segmen ST atau (STEMI) dan yang tidak terdapat elevasi segmen ST (NSTEMI). Pasien dengan NSTE mungkin mengalami perubahan EKG iskemik lainnya seperti depresi segmen ST atau inversi gelombang-T (DiPiro et al., 2020).
2.7.2 Pemeriksaan Biomarka Jantung
Gambar 2.7 12-lead ECG (A) N-STEMI (B) STEMI (Jeffrey L. Anderson, M.D., and David A. Morrow, 2017)
A B
Kreatinin kinase-MB (Ck-MB) atau troponin I/T merupakan biomarka untuk diagnosis infark miokard. Troponin I/T sebagai biomarka nekrosis jantung mempunyai sensitivitas lebih tinggi dari CK-MB. Namun, peningkatan biomarka jantung hanya menunjukkan adanya nekrosis miosit, tetapi tidak dipakai untuk menentukan penyebab nekrosis miosis tersebut. Dalam keadaan nekrosis miokard, pemeriksaan CK-MB atau troponin I/T menunjukkan kadar yang normal dalam 4-6 jam setelah awitan SKA, sehingga pemeriksaan hendaknya diulang 8-12 jam setelah awitan angina. Jika awitan SKA tidak dapat ditentukan dengan jelas, maka pemeriksaan hendaknya diulang 6-12 jam setelah pemeriksaan pertama. Kadar CK-MB yang meningkat dapat dijumpai pada seseorang dengan kerusakan otot skeletal dengan waktu paruh yang singkat, mengingat waktu paruh yang singkat, CK-MB lebih terpilih untuk mendiagnosis ekstensi infark (infark berulang) maupun infark periprosedural (PERKI, 2018).
2.8 Komplikasi Klinis Infark Miokard Akut 2.8.1 Disfungsi Ventrikel Kiri
Hipotensi, hipoksia, dan / atau perkembangan trombosis arteri koroner, infark dapat meluas menyebabkan lebih banyak disfungsi, syok kardiogenik, dan kematian Nekrosis akut lebih dari 40% dari ventrikel kiri dikaitkan secara klinis dengan syok kardiogenik dan mungkin tidak kompatibel dengan kelangsungan hidup. Pada pasien dengan MI dan disfungsi ventrikel kiri dapat menyebabkan hipotensi, syok, dan kematian (Buja & Butany, 2016).
2.8.2 Aneurisma Ventrikel Kiri
Pada pasien dengan IMA yang sembuh gerakan dinding ventrikel kiri yang abnormal merupakan temuan klinis yang umum. Aneurisma adalah tonjolan terlokalisasi di dinding ventrikel kiri, dikaitkan dengan hipertensi, dan lebih sering terjadi pada pria daripada wanita. Insiden aneurisma yang dilaporkan setelah IMA bervariasi dari 3% sampai 20%. Pengobatan dengan terapi fibrinolitik secara signifikan mengurangi kejadian aneurisma ventrikel kiri (Buja & Butany, 2016). 2.8.3 Ruptur pada dinding bebas
Pecahnya dinding bebas jantung merupakan komplikasi katastropik yang dilaporkan pada 1-6% pasien yang dirawat dengan STEMI. Ruptur jantung memiliki dua puncak kejadian, satu dalam waktu 24 jam; yang lainnya dari 3 sampai
5 hari setelah onset. Ruptur dini mungkin terkait dengan pembedahan hematoma di zona infark. Ruptur terlambat terjadi selama minggu pertama setelah infark ketika dinding lunak dan nekrotik, sebelum proliferasi jaringan ikat menjadi menonjol. Pecah lebih sering terjadi pada wanita dan hipertensi (terutama pasien dengan hipertensi setelah serangan infark), tetapi lebih jarang terjadi pada jantung yang mengalami hipertrofi (Buja & Butany, 2016).
Pecah biasanya mempersulit infark pertama. Para ahli patologi mengatakan ini karena jaringan fibrosa dari infark sebelumnya melindungi dari ruptur. Ahli jantung mengatakan bahwa infark sebelumnya mengurangi kontraktilitas ventrikel kiri dan tekanan geser pada dinding infark. Ruptur dapat terjadi di tepi atau di tengah infark, tetapi sering membedah secara miring melalui miokardium daripada mengalir langsung dari endokardium ke epikardium. Faktor risiko lain termasuk infark anterior, kurangnya aliran darah kolateral, gelombang Q pada EKG, CK MB puncak> 150 IU / l, asupan kortikosteroid atau obat anti inflamasi nonsteroid, dan terapi fibrinolitik lebih dari 14 jam setelah onset gejala (Buja & Butany, 2016). 2.8.4 Cacat pada Septum Ventrikel
Ruptur septum setelah infark miokard lebih jarang terjadi daripada ruptur dinding bebas, yang merupakan komplikasi kurang dari 2% dari infark miokard. Terapi reperfusi telah mengurangi frekuensi ruptur akut septum ventrikel. Tidak ada predisposisi usia atau jenis kelamin yang jelas, tetapi hipertensi dan aktivitas fisik dapat menjadi faktor predisposisi. Ruptur septum biasanya terjadi dalam 24 jam setelah MI. Defek septum ventrikel dapat mempersulit infark anteroseptal atau posteroseptal dan dapat bervariasi dari ukuran lubang jarum hingga diameter beberapa sentimeter. Cacat ini seringkali berbentuk corong, lebih kecil di sisi kanan septum daripada di sisi kiri. Yang perlu diperhatikan adalah infark pada dinding bebas ventrikel kanan sering muncul berdekatan dengan infark septum. Oleh karena itu, pasien ini sering mengalami kegagalan ventrikel kanan, tidak hanya karena beban hemodinamik yang dibebankan pada ventrikel kanan akibat pirau kiri ke kanan, tetapi juga karena kerusakan iskemik pada miokardium ventrikel kanan. Masalah konduksi yang kadang terjadi adalah akibat nekrosis cabang berkas yang infark dengan miokardium septum yang berdekatan (Buja & Butany, 2016).
2.8.5 Regurgitasi Mitral
Regurgitasi mitral pada pasien setelah MI dapat terjadi karena berbagai mekanisme. Regurgitasi mitral terjadi akibat infark otot papiler, infark yang mengenai dinding lateral, infark yang besar disertai dilatasi ventrikel kiri, o perpindahan / misalignment otot papiler. Adanya edema paru akut atau syok kardiogenik pada STEMI posterior / posterolateral menunjukkan adanya regurgitasi mitral akut. Frekuensi ruptur otot papiler kurang dari 1%. Pecahnya otot papiler posterior jauh lebih sering daripada pecahnya otot papiler anterior. Ini karena otot papiler anterior biasanya memiliki suplai darah ganda dan oleh karena itu kurang rentan terhadap cedera iskemik yang parah. Pada periode akut, nekrosis otot papiler atau ventrikel kiri bebas dari alat katup. Jika hanya satu dari beberapa kepala otot papiler yang pecah, pasien dapat bertahan hidup; namun, beban hemodinamik dari regurgitasi mitral berat yang ditumpangkan pada infark akut seringkali mematikan. Penyembuhan infark otot papiler oleh fibrosis dapat menyebabkan gangguan fungsi katup kronis (Buja & Butany, 2016).
2.8.6 Trombi Mural Endokard
Trombi mural endokard terjadi berdekatan dengan infark miokard di mana terdapat cedera endokard dan aliran relatif stasis, bahkan tanpa adanya aneurisma atau infark transmural. Karena trombus mural yang terbentuk di area dengan aliran darah tinggi (yaitu, ventrikel kiri atau aorta) mengatur secara perlahan, trombus semacam itu dapat menjadi sumber emboli lama setelah infark yang mendasari sembuh. Sementara trombus diamati pada 50% pasien dengan infark anterior apikal besar atau aneurisma, kejadian klinis tromboemboli relatif jarang. Antikoagulasi dan / atau terapi antiplatelet yang diterapkan secara sistematis pada pasien pasca MI dapat berkontribusi pada kebebasan relatif dari kejadian tromboemboli (Buja & Butany, 2016).
2.8.7 Kelainan Elektrofisiologi
Terlepas dari penyakit yang mendasari, temuan tertentu yang ditemukan pada pasien IMA berhubungan dengan takiaritmia ventrikel. Hal ini berkaitan dengan dilatasi ventrikel, hipertrofi miokard, fibrosis miokard dan hasil dari ketiganya, dan penurunan fraksi ejeksi atau gagal jantung. Dalam beberapa menit setelah iskemia miokard, terjadi perubahan metabolik yang parah yang terbukti menjadi
aritmogenik, termasuk peningkatan kalium ekstraseluler disertai dengan akumulasi kalsium intraseluler, ion hidrogen, laktat, monofosfat siklik, lisofosfolipid, ester asam lemak, asam lemak bebas, dan radikal bebas. Gangguan metabolisme juga dapat dibuktikan di daerah yang berdekatan dengan miosit nekrotik. Perubahan metabolisme ini berkontribusi pada lingkungan untuk masuk kembali dan aritmia terkait otomatisitas juga. Pada pasien dengan gagal jantung New York Heart Association (NYHA) kelas III atau IV, angka kematian selama 1 tahun adalah 50%, dengan setengah dari kematian ini terjadi secara tiba-tiba. Kematian paling mendadak dalam keadaan ini berhubungan dengan takiaritmia ventrikel (Buja & Butany, 2016).
2.8.8 Kematian Jantung Mendadak
Kematian jantung mendadak pada pasien IMA sebagian besar disebabkan oleh fibrilasi ventrikel. Risiko kematian jantung mendadak termasuk fraksi ejeksi ventrikel kiri yang rendah, VT yang dapat diinduksi selama studi elektrofisiologi, dan area infark yang lebih besar. Kematian jantung mendadak biasanya didefinisikan sebagai kematian yang terjadi dalam hitungan detik hingga menit hingga 6 jam setelah dimulainya proses patologis dan biasanya, tetapi tidak harus, terjadi di luar rumah sakit. Dalam beberapa kasus, ada kejadian yang disaksikan dengan bukti nyeri dada sedangkan dalam kasus lain kematian tidak disaksikan (Buja & Butany, 2016).
Persyaratan utama untuk atribusi kematian mendadak ke IHD adalah ditemukannya aterosklerosis yang signifikan yang menghasilkan lebih dari 75-80% stenosis dari setidaknya satu arteri koroner tanpa adanya temuan anatomik atau toksikologi lain yang diketahui menyebabkan kematian. Seperti yang dinyatakan di atas, beberapa pasien dengan infark miokard yang terdiagnosis mengalami kematian mendadak karena aritmia ventrikel. Pada otopsi, kasus ini akan menunjukkan bukti lesi koroner akut seperti erosi plak atau ruptur akibat trombosis serta bukti nekrosis miokard. Banyak kasus lain, terutama yang terjadi di luar rumah sakit, mungkin tidak memiliki bukti nekrosis miokard yang dapat dibuktikan, dan lesi koroner akut mungkin cukup halus; namun, bukti adanya stenosis arteri koroner yang signifikan ada. Mekanisme ini diduga melibatkan beberapa kombinasi agregasi platelet pada plak koroner, spasme koroner, dan embolisasi platelet hilir
yang menyebabkan iskemia miokard akut dan fibrilasi ventrikel (Buja & Butany, 2016).
2.8.9 Lesi Perikardial
Perikarditis fibrinosa nonimunologis sering terjadi pada stadium akut infark, dan penyembuhan menghasilkan plak fibrotik kecil yang tidak bermakna. Perikarditis hemoragik dan tamponade jantung dapat mempersulit ruptur miokard dan diperkirakan jarang terjadi akibat terapi antikoagulasi yang digunakan pada pasien dengan infark akut. Perikarditis yang tertunda, 4 hari atau lebih setelah infark, sering disebut sebagai sindrom Dressler, disertai dengan demam, leukositosis, peningkatan laju sedimentasi, dan efusi pleura serta perikardial. Etiologi dan patogenesis sindrom Dressler tidak pasti, tetapi mekanisme imunologi tampaknya terlibat. Sindrom Dressler terjadi hingga 2 tahun setelah infark pada 1-4% pasien. Antikoagulan merupakan kontraindikasi karena risiko tamponade jantung. Sindrom Dressler pada dasarnya telah menghilang di era reperfusi (Buja & Butany, 2016).
2.8.10Penyakit Jantung Iskemik Kronik
MI akut yang ekstensif dikaitkan dengan gagal jantung akut, syok kardiogenik, dan aritmia maligna. Secara kronis, efek kumulatif dari kerusakan iskemik menyebabkan gagal jantung kronis. Gagal jantung kronis tidak hanya dimediasi oleh hilangnya miokardium tetapi juga oleh remodeling patologis progresif pada miokardium yang layak. Remodelling miokard melibatkan perubahan kompleks, termasuk hipertrofi, hiperfungsi, dan disfungsi kardiomiosit; kematian kardiomiosit karena onkosis; apoptosis dan autofagi; upaya penggantian kardiomiosit dengan aktivasi mekanisme sel induk; proliferasi jaringan ikat; perubahan mikrosirkulasi; dan geometri ventrikel yang berubah. Pemasangan stent arteri koroner dan pencangkokan bypass arteri koroner, kecuali dilakukan lebih awal, mungkin tidak efektif dalam menstabilkan atau membalik proses yang mengarah pada dilatasi struktural tetap pada jantung dan secara klinis terlihat sebagai kardiomiopati iskemik (Buja & Butany, 2016).
2.9 Faktor Resiko Infark Miokard Akut 2.9.1 Aktivitas Fisik
Aktivitas fisik dapat berkontribusi hingga 20% -30% penurunan risiko penyakit jantung koroner. Namun, penelitian menunjukkan bahwa beberapa jenis aktivitas fisik dapat memiliki efek berbeda pada risiko penyakit IMA dan dapat berinteraksi bersama. Misalnya, beberapa aktivitas waktu senggang seperti berjalan kaki, naik tangga, dan bersepeda memberikan perlindungan terhadap IMA, sedangkan yang lain, seperti aktivitas fisik domestik yang intensif, mungkin tidak menawarkan perlindungan terhadap IMA. Orang yang tidak aktif dengan beberapa faktor risiko jantung lebih mungkin mengalami IMA (Vedika Rathore, Neelima Singh, 2018).
2.9.2 Merokok
Merokok dianggap sebagai faktor risiko kuat dari infark miokard, aterosklerosis prematur, dan kematian jantung mendadak. Merokok menyebabkan STEMI dini terutama pada pasien yang lebih sehat. Merokok meningkatkan risiko AMI melalui mekanisme yang beragam dan kompleks. Sehubungan dengan aterogenesis, merokok meningkatkan konsentrasi kolesterol LDL dan trigliserida serum dan mengurangi kolesterol HDL serum. Selain itu, asap rokok meningkatkan kerusakan radikal bebas pada LDL, yang menyebabkan akumulasi kolesterol LDL yang teroksidasi di dalam dinding arteri. Merokok tampaknya berkontribusi pada karakteristik inflamasi vaskular dari aterosklerosis, seperti yang ditunjukkan oleh kadar protein reaktif C serum yang lebih tinggi pada perokok dibandingkan bukan perokok. Merokok, terutama melalui kandungan nikotinnya, mengaktifkan sistem saraf simpatis (SNS), meningkatkan detak jantung dan tekanan darah sistolik. Peningkatan hasil produk tekanan kecepatan dalam peningkatan kebutuhan oksigen miokard. Peningkatan aktivitas SNS juga menyebabkan vasokonstriksi arteri koroner, menurunkan aliran darah miokard pada saat kebutuhan oksigen meningkat. Selain meningkatkan kebutuhan oksigen miokard dan mengurangi aliran darah koroner, merokok juga menyebabkan peningkatan kadar karboksihemoglobin dalam darah, yang berpotensi mengurangi pengiriman oksigen miokard dari oksihemoglobin (Vedika Rathore, Neelima Singh, 2018).
2.9.3 Konsumsi Alkohol
Konsumsi alkohol dikaitkan dengan risiko infark miokard yang lebih tinggi. Sebagaimana ditinjau oleh McKee dan Britton dan sumber lebih lanjut, sejumlah mekanisme yang mungkin telah dibahas menjelaskan efek akut pesta minuman keras pada kejadian penyakit jantung koroner. Minuman keras telah terbukti meningkatkan lipoprotein densitas rendah, yang pada akhirnya terkait dengan morbiditas dan mortalitas kardiovaskular, minuman keras juga telah dikaitkan dengan peningkatan risiko trombosis, yang terjadi setelah penghentian episode minum berat dan minuman keras tampaknya memengaruhi peminum terhadap perubahan histologis miokardium dan sistem konduksi, serta penurunan ambang batas untuk fibrilasi ventrikel (Vedika Rathore, Neelima Singh, 2018).
Namun, ada kontroversi mengenai konsumsi alkohol dan risiko AMI. Sebagian besar penelitian menunjukkan bahwa konsumsi alkohol dapat meningkatkan kolesterol lipoprotein densitas tinggi (HDL-C), apolipoprotein-a1 dan adiponektin serta menurunkan kadar fibrinogen, dimana HDL-C merupakan faktor pelindung utama yang dapat menjelaskan sekitar 50% hubungan sebab akibat. Namun, beberapa peneliti percaya bahwa nilai HDL-C rendah, yang hanya dapat menjelaskan sekitar 16% dari hubungan sebab akibat. Selain itu, beberapa peneliti menemukan bahwa konsumsi alkohol dapat meningkatkan prostasiklin dari dinding pembuluh darah, meningkatkan fungsi sel endotel vaskular, meningkatkan sensitivitas insulin dan melawan trombosis. Selain itu, konsumsi alkohol reguler jangka panjang dapat meningkatkan variabilitas detak jantung dan dengan demikian mengurangi risiko onset MI. Sebagian besar penelitian menunjukkan bahwa konsumsi alkohol dapat meningkatkan LDH-C, trigliserida, detak jantung, tekanan darah dan dengan demikian meningkatkan risiko aterosklerosis, fibrilasi atrium dan anoksia, yang mengakibatkan kerusakan sel otot jantung dan sistem kardiovaskular serta menghasilkan enzim fibrinolitik penghambat (Vedika Rathore, Neelima Singh, 2018).
2.9.4 Dyslipidemia
Dislipidemia, faktor risiko utama penyakit kardiovaskular, umumnya didefinisikan sebagai kadar kolesterol total, LDL, trigliserida, apo B atau Lp (a) di atas persentil ke-90 atau HDL dan tingkat apo A di bawah persentil ke-10 dari
populasi umum. Peningkatan kadar trigliserida dan padat, partikel LDL kecil bertindak sebagai faktor risiko predisposisi infark miokard. Kadar trigliserida non puasa tampaknya menjadi prediktor yang kuat dan independen untuk risiko IMA di masa depan, terutama bila kadar kolesterol total juga meningkat. Alasan di baliknya adalah bahwa penurunan kadar HDL-C dan peningkatan kadar trigliserida menyebabkan gangguan metabolisme dan dengan demikian menyebabkan konsekuensi yang merugikan. Ali et al., Menyimpulkan bahwa ada frekuensi tinggi dislipidemia pada pasien muda dengan infark miokard akut, dengan hipertrigliseridemia urutan menurun diikuti oleh hiperkolesterolemia, peningkatan LDL dan HDL rendah. Studi prospektif seperti studi Framingham menetapkan hubungan dislipidemia dan penyakit arteri koroner. Kadar kolesterol total, LDL, dan HDL yang rendah merupakan faktor risiko utama aterosklerosis koroner. Koreksi dislipidemia dapat menurunkan risiko infark miokard (Vedika Rathore, Neelima Singh, 2018).
2.9.5 Diabetes Melitus
Diabetes meningkatkan risiko penyakit jantung koroner (PJK) sebanyak dua hingga empat kali lipat. Pasien dengan diabetes menanggung risiko lebih besar terkena penyakit vaskuler aterosklerotik di jantung serta di area vaskularisasi lainnya. Diabetes meningkatkan risiko infark miokard karena meningkatkan laju perkembangan aterosklerotik dan mempengaruhi profil lipid serta memfasilitasi pembentukan plak aterosklerotik (Vedika Rathore, Neelima Singh, 2018).
2.9.6 Hipertensi
Hipertensi sistolik dan diastolik meningkatkan risiko infark miokard dan semakin tinggi tekanannya, semakin besar risikonya. Ini adalah faktor risiko utama penyebab aterosklerosis pada pembuluh darah koroner, mengakibatkan serangan jantung atau infark miokard. Hipertensi dan infark miokard sangat erat kaitannya. Di usia tua, hipertensi bahkan lebih buruk bagi jantung dan bertanggung jawab atas setidaknya 70 persen penyakit jantung. Beberapa mekanisme dapat menjelaskan peningkatan risiko koroner pada pasien hipertensi. Hipertensi mempercepat efek pada ateroma, meningkatkan tekanan geser pada plak, memberikan efek fungsional yang merugikan pada sirkulasi koroner, dan merusak fungsi endotel dan kontrol tonus simpatis. Pengendalian hipertensi dengan kepatuhan yang ketat terhadap
pengobatan yang tepat dan penerapan modifikasi gaya hidup mengurangi risiko infark miokard secara signifikan (Vedika Rathore, Neelima Singh, 2018).
2.9.7 Obesitas
Peningkatan Body Mass Index (BMI) berhubungan langsung dengan kejadian infark miokard. Infark sangat ditingkatkan oleh obesitas ekstrim, Zhu et al., Melakukan meta-analisis dari penelitian sebelumnya dan menyarankan bahwa kelebihan berat badan dan obesitas berhubungan dengan risiko IMA yang lebih tinggi. Kegemukan dan obesitas dapat mempengaruhi kesehatan, dan BMI seseorang perlu dikendalikan untuk mencegah IMA. Schargrodsky et al., Menunjukkan bahwa kelebihan berat badan merupakan faktor risiko independen untuk IMA (Vedika Rathore, Neelima Singh, 2018).
2.9.8 Stres
Stres kehidupan kronis, isolasi sosial dan kecemasan meningkatkan risiko serangan jantung dan stroke. Stres psikologis akut juga dikaitkan dengan peningkatan risiko penyakit jantung koroner, dan telah dilaporkan bahwa kesedihan yang intens pada hari-hari setelah kematian orang yang signifikan dapat memicu timbulnya infark miokard. Mekanisme patofisiologis dari stres emosional akut masih belum jelas, tetapi diasumsikan terkait dengan stres hemodinamik di arteri koroner dan pecahnya plak aterosklerotik, yang mengakibatkan thrombosis (Vedika Rathore, Neelima Singh, 2018).
2.9.9 Gout
Penderita gout memiliki peningkatan risiko infark miokard. Pada pasien gout, respon inflamasi yang terkait dengan gout memainkan peran kunci dalam inisiasi dan perkembangan aterosklerosis, dan lingkungan pro-trombotik mengarah pada kejadian koroner akut seperti angina atau infark miokard (Vedika Rathore, Neelima Singh, 2018).
2.9.10Penyakit Periodontal
Penyakit periodontal adalah sekelompok penyakit inflamasi di mana bakteri dan produk sampingannya merupakan agen etiologi utama. Indikasi pertama hubungan antara penyakit gigi dan aterosklerosis diberikan pada tahun 1963. Sejak saat itu, semakin banyak bukti yang menunjukkan bahwa kesehatan gigi yang
buruk, terutama adanya penyakit periodontal, meningkatkan risiko terjadinya PJK (Vedika Rathore, Neelima Singh, 2018).
2.9.11Riwayat Keluarga
Riwayat keluarga dari infark miokard merupakan faktor risiko independen. Beberapa varian genetik dikaitkan dengan peningkatan risiko IMA dan riwayat keluarga IMA. Analisis gabungan baru-baru ini dari 12 studi kohort menemukan risiko relatif gabungan untuk kejadian di masa depan pada orang dengan kerabat tingkat pertama dengan penyakit kardiovaskular, dibandingkan dengan orang tanpa kerabat tingkat pertama yang terkena. Riwayat keluarga dengan infark miokard akut merupakan faktor risiko yang kuat dan independen dalam penelitian terhadap 1.060 kasus dan 1.071 kontrol dari Argentina. Anteseden ≥1 kerabat tingkat pertama dengan infark miokard akut meningkatkan risiko sekitar dua kali lipat pada pria dan hampir tiga kali lipat pada wanita, dengan tren risiko yang signifikan pada jumlah kerabat yang terkena (Vedika Rathore, Neelima Singh, 2018).
2.9.12Usia
Usia lanjut dikaitkan dengan peningkatan mortalitas pada infark miokard akut. Mekanisme di mana bertambahnya usia berkontribusi secara dramatis terhadap kematian tidak diketahui. Sekitar 80% kematian akibat penyakit jantung terjadi pada orang berusia 65 atau lebih (Vedika Rathore, Neelima Singh, 2018). 2.9.13Jenis Kelamin
Pria cenderung mengalami serangan jantung lebih awal daripada wanita. Tingkat serangan jantung wanita meningkat setelah menopause tetapi tidak sama dengan tingkat pria. Meski begitu, penyakit jantung merupakan penyebab utama kematian baik bagi pria maupun wanita (Vedika Rathore, Neelima Singh, 2018).
2.10 Penatalaksanaan Terapi Infark Miokard Akut
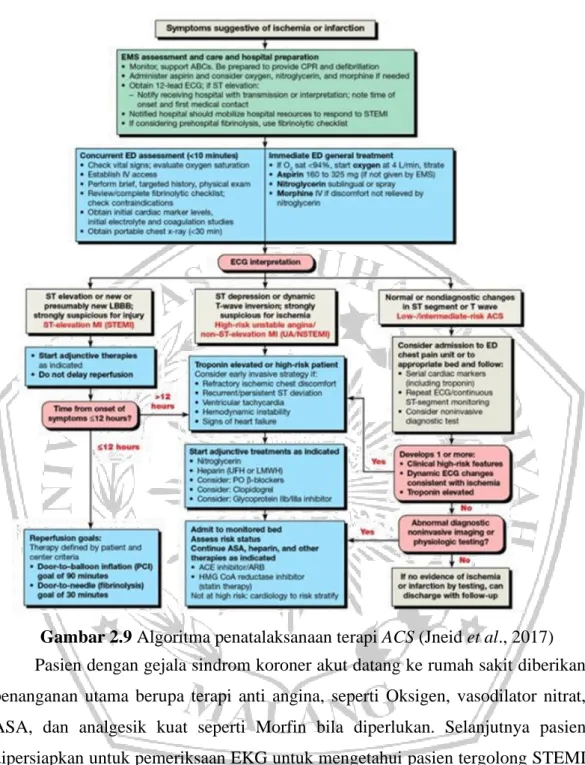
Pasien dengan gejala sindrom koroner akut datang ke rumah sakit diberikan penanganan utama berupa terapi anti angina, seperti Oksigen, vasodilator nitrat, ASA, dan analgesik kuat seperti Morfin bila diperlukan. Selanjutnya pasien dipersiapkan untuk pemeriksaan EKG untuk mengetahui pasien tergolong STEMI atau N-STEMI, pemeriksaan data lab, dan data klinik. Saat hasil EKG telah keluar dan pasien dikategorikan STEMI dengan onset gejala di bawah 12 jam, maka segera dilakukan terapi reperfusi berupa pemasangan PCI selama 90 menit atau pemberian terapi fibrinoloitik selama 30 menit jika tidak tersedia PCI. Namun, apabila pasien dikategorikan STEMI degan onset gejala lebih dari 12 jam, maka dilakukan penatalaksanaan seperti pasien N-STEMI (Jneid et al., 2017).
2.10.1Terapi Non Farmakologi
Penatalaksanaan terapi pasien IMA dibuat berdasarkan stratifikasi risiko awal dan berkelanjutan. Identifikasi subtipe sindrom koroner akut yang cepat (STEMI, N-STEMI) sangat penting karena tujuan pengobatan dan kerangka waktu intervensi sedikit berbeda berdasarkan presentasi klinis dan risiko kematian atau komplikasi selanjutnya. Pasien harus segera dirujuk ke unit gawat darurat, unit nyeri dada, atau fasilitas yang setara untuk evaluasi mencakup EKG 12-lead dan cTn sehingga perawatan yang cepat dapat dimulai. Pasien dengan kemungkinan gejala iskemik seperti nyeri dada persisten, dispnea parah, sinkop atau presinkop, atau harus mengaktifkan sistem EMS dan mencari transportasi melalui ambulans karena personel EMS diperlengkapi untuk menangani serangan jantung jika hal itu terjadi dan pendekatan ini dikaitkan dengan inisiasi terapi reperfusi lebih dini. Pada pasien dengan sindrom koroner akut, pengobatan ditujukan untuk mencapai hasil jangka pendek dan jangka Panjang. Hasil jangka pendek yang diinginkan adalah pemulihan awal aliran darah ke arteri terkait infark untuk mencegah perluasan infark (dalam kasus IMA) atau mencegah oklusi lengkap (dalam kasus UA), pencegahan kematian dan komplikasi MI lainnya, pencegahan reoklusi arteri koroner, dan meredakan ketidaknyamanan dada iskemik. Hasil jangka panjang yang diinginkan adalah pengendalian faktor risiko penyakit jantung koroner, pencegahan Major Adverse Cardiovascular Events (MACE) tambahan, termasuk infark kembali, stroke, dan gagal jantung, dan peningkatan kualitas hidup (DiPiro et al., 2020).
Pasien dengan STEMI adalah prioritas tertinggi dan harus segera dirujuk ke lab kateterisasi jantung untuk PCI primer dengan tujuan memulihkan aliran darah secara mekanis ke arteri terkait infark secepat mungkin. Pasien dengan N-STEMI akan menjalani stratifikasi risiko tambahan untuk menentukan pendekatan terbaik, yang biasanya merupakan pendekatan invasif awal (misalnya, PCI) untuk pasien berisiko menengah dan tinggi. Tindakan pengobatan umum untuk pasien berisiko menengah dan tinggi termasuk masuk ke rumah sakit, pemberian oksigen (jika saturasi oksigen <90% [0,90]), tirah baring dengan pemantauan segmen ST multi-lead terus menerus untuk aritmia dan iskemia, pengukuran tanda-tanda vital yang sering, pereda nyeri iskemik, dan inisiasi terapi antitrombotik yang cepat (DiPiro et
Ketika PCI primer untuk pasien dengan STEMI tidak memungkinkan dalam waktu yang tepat, fibrinolisis merupakan sarana reperfusi yang penting dan mencegah 30 kematian dini per 1000 pasien yang dirawat dalam waktu 6 jam setelah timbulnya gejala. Kontraindikasi relatif terhadap terapi fibrinolitik harus dikurangi jika memungkinkan untuk mengurangi risiko perdarahan mayor, termasuk ICH, sebelum pemberian. Manfaat mortalitas fibrinolisis paling tinggi bila diberikan lebih awal setelah onset gejala tetapi dapat diabaikan jika diberikan kepada pasien dengan durasi gejala lebih dari 12 jam. Ketika terapi fibrinolitik diindikasikan, agen khusus fibrin (alteplase, reteplase, atau tenekteplas) direkomendasikan daripada agen khusus non-fibrin (misalnya, streptokinase) karena keberhasilan reperfusi yang lebih besar dan perdarahan sistemik yang lebih sedikit dengan agen khusus fibrin (DiPiro et al., 2020).
2.10.2Terapi Farmakologi 2.10.2.1 Oksigen
Pada pasien STEMI direkomendasikan untuk mengukur saturasi oksigen perifer. Oksigen diindikasikan pada pasien dengan hipoksemia dan pada pasien dengan edema pulmonal dengan SaO2 < 90% untuk mempertahankan saturasi > 95%. Penggunaan Oksigen secara rutin dapat mempengaruhi pasien dengan meningkatkan resistensi pembuluh darah koroner dan mengurangi aliran darah koroner. Penggunaan oksigen tambahan secara rutin untuk pasien yang dirawat tidak direkomendasikan (PERKI, 2018).
2.10.2.2 Vasodilator Nitrat
Pada pasien MI akut nitrat dapat meredakan vasospasme dan mengurangi nyeri, berdasarkan kemampuannya untuk meningkatkan aliran darah koroner dengan vasodilatasi koroner dan untuk menurunkan preload ventrikel dengan meningkatkan kapasitansi vena, nitrat sublingual telah direkomendasikan untuk pengobatan awal pasien IMA. Saat ini, satu-satunya kelompok pasien dengan STEMI yang tidak boleh diberikan Nitrogliserin sublingual adalah mereka yang dicurigai mengalami infark ventrikel kanan atau hipotensi (misalnya tekanan sistolik <90 mm Hg), terutama jika disertai dengan bradikardia. Pasien harus diobservasi untuk perbaikan gejala atau perubahan hemodinamik. Bahkan dosis kecil dapat menyebabkan hipotensi dan bradikardia mendadak, suatu reaksi yang
biasanya dapat dibalik dengan atropin intravena. Sediaan nitrat oral kerja lama harus dihindari pada awal STEMI karena status hemodinamik pasien yang sering berubah. Pada pasien dengan periode waxing dan nyeri dada yang lama, Nitrogliserin intravena dapat membantu mengontrol gejala dan mengoreksi iskemia, tetapi membutuhkan pemantauan tekanan darah yang sering. Inisiasi strategi reperfusi pada pasien dengan STEMI tidak boleh ditunda saat menilai respons pasien terhadap nitrat sublingual atau intravena. Meskipun alasan patobiologis yang kuat, pemberian nitrat belum terbukti meningkatkan hasil klinis dibandingkan dengan plasebo pada pasien dengan MI (Morrow & Braunwald, 2017).
2.10.2.2.1 Nitrogliserin
Nitrogliserin efektif dalam meredakan gejala angina, sehingga sering digunakan pada pasien ACS dengan angina berkelanjutan yang tidak mengalami hipotensi. Awalnya, Nitrogliserin harus diberikan setiap 5 menit hingga tiga dosis sesuai kebutuhan untuk angina. Nitrogliserin bekerja dengan cara melebarkan arteri koroner, sehingga dapat mengobati ACS yang berhubungan dengan vasospasme. Nitrogliserin IV sering kali merupakan pengobatan anti-iskemik awal yang direkomendasikan, terutama jika terdapat HTN yang tidak terkontrol, pengobatannya harus dilanjutkan sampai gejala muncul teratasi, tekanan darah terkontrol, dan gejala gagal jantung mereda. Toleransi hemodinamik terhadap Nitrogliserin IV dapat terjadi, membutuhkan dosis lebih tinggi dengan terapi jangka panjang. Karena penghentian Nitrogliserin IV secara tiba-tiba dapat memicu gejala angina, infus harus dihentikan secara bertahap. Efek samping nitrat yang paling signifikan adalah kemerahan, sakit kepala, hipotensi, dan takikardia. Karena penurunan tekanan darah yang sinergis dapat terjadi yang menyebabkan hipotensi, pemberian nitrat dikontraindikasikan pada pasien yang baru saja menggunakan penghambat fosfodiesterase-5 oral (DiPiro et al., 2020).
2.10.2.2.2 ISDN
Vasodilator yang digunakan dalam pengobatan angina pektoris. Tindakannya mirip dengan Nitrogliserin tetapi dengan onset kerja yang lebih lambat. Dinitrat Isosorbida diubah menjadi oksida nitrat aktif untuk mengaktifkan guanylate cyclase. Aktivasi ini meningkatkan kadar guanosin siklik 3 ', 5' monofosfat
(cGMP). cGMP mengaktifkan protein kinase dan menyebabkan serangkaian reaksi fosforilasi yang menyebabkan defosforilasi rantai ringan miosin dari serat otot polos. Akhirnya terjadi pelepasan ion kalsium yang menyebabkan relaksasi otot polos dan vasodilatasi (DrugBank, 2021).
2.10.2.3 Antihipertensi 2.10.2.3.1 Beta Bloker
β ‐ Blocker secara signifikan mengurangi kematian dan infark miokard berulang pada pasien yang telah menderita infark miokard dan sangat efektif ketika ST-elevation myocardial infarction (STEMI) dipersulit oleh iskemia persisten atau berulang atau takiaritmia lebih awal setelah onset infark . Namun, tidak ada uji coba besar yang menilai efek penyekat β pada tingkat kelangsungan hidup atau kejadian koroner pada pasien dengan angina stabil. Terapi β-Blocker harus dimulai dan dilanjutkan selama 3 tahun pada semua pasien dengan fungsi ventrikel kiri normal setelah infark miokard atau ACS. Terapi β-Blocker harus digunakan pada semua pasien dengan disfungsi sistolik ventrikel kiri (fraksi ejeksi ≤40%) dengan gagal jantung atau infark miokard sebelumnya, kecuali ada kontraindikasi. Penggunaan harus dibatasi pada Carvedilol, Metoprolol Succinate, atau Bisoprolol, yang telah terbukti mengurangi risiko kematian (Li, 2016).
2.10.2.3.2 Angiotensin Converting Enzim Inhibitor
Penggunaan ACE-I pada pasien IMA terbukti secara eksperimental menguntungkan pada remodeling ventrikel, perbaikan hemodinamik, dan penurunan gagal jantung kongestif. Pasien MI dengan komplikasi gagal jantung atau gangguan fungsi ventrikel harus menerima pengobatan seumur hidup dengan ACE inhibitor. Selain itu, pasien MI yang juga menderita hipertensi, diabetes, atau penyakit ginjal kronis harus diobati dengan penghambat ACE untuk pencegahan sekunder jangka panjang kecuali ada kontraindikasi Penghambat ACE bekerja dengan cara menghambat konversi angiotensin I menjadi angiotensin II (Morrow & Braunwald, 2017).
2.10.2.3.3 Calcium Chanal Blocker
Calcium channel blockers terutama golongan dihidropiridin merupakan obat pilihan untuk mengatasi angina vasospatik. CCB dihidropiridin direkomendasikan untuk mengurangi gejala pada pasien yang telah mendapatkan nitrat dan penyekat
beta, CCB non-dihidropiridin direkomendasikan untuk pasien NSTEMI dengan indikasi kontra terhadap penyekat beta (Kelas I-B) . CCB non-dihidropiridin (long-acting) dapat dipertimbangkan sebagai pengganti terapi penyekat beta (Kelas IIb-B). Penggunaan CCB dihidropiridin kerja cepat (immediate-release) tidak direkomendasikan kecuali bila dikombinasi dengan penyekat beta (Kelas III-B) (PERKI, 2018).
2.10.2.4 Antidislipidemia
Penghambat reduktase 3-hidroksi-3-metilglutaril koenzim A (HMG-CoA), juga dikenal sebagai statin, biasanya diresepkan untuk mengurangi kolesterol LDL (low-density lipoprotein / LDL). Beberapa uji klinis acak terkontrol plasebo telah menunjukkan bahwa statin mengurangi risiko relatif kejadian koroner utama. Namun, ada variabilitas substansial dalam penurunan kolesterol LDL dan hasil klinis dengan terapi statin. Selain itu, meskipun obat-obatan ini dapat ditoleransi dengan baik, sebagian kecil pasien dapat mengalami efek samping yang serius dari rhabdomyolysis. Gen kandidat yang terkait dengan farmakokinetik dan farmakodinamik statin telah dipelajari untuk kontribusinya terhadap variabilitas ini. Kebanyakan statin diangkut oleh OATP1B1 ke dalam hepatosit, di mana mereka merupakan penghambat kompetitif HMG-CoA reduktase, enzim pembatas kecepatan yang terlibat dalam sintesis kolesterol. Melampaui sifat penurun lipid mereka, statin diyakini memiliki efek pleiotropik, yang meliputi stabilisasi plak, anti-inflamasi, antitrombogenisiti, dan modulasi. Data mengenai terapi awal untuk golongan statin pada pasien dengan STEMI atau NSTEMI dapat diberikan Atorvastatin, Simvastatin, Pravastatin, Rosuvastatin, dan Fluvastatin (Cavallari & Momary, 2018).
2.10.2.5 Fibrinolitik
Tujuan pemberian agen fibrinolitik adalah untuk melarutkan bekuan yang menghambat aliran darah di arteri koroner dengan mengaktifkan sistem fibrinolitik. Agen fibrinolitik mengubah proenzim plasminogen yang tidak aktif menjadi keadaan aktifnya, plasmin. Plasmin kemudian mendegradasi fibrin, konstituen utama trombus, menjadi produk degradasi fibrin yang dapat larut, yang pada akhirnya menghasilkan pelarutan bekuan. Agen fibrinolitik secara tradisional dikategorikan sebagai agen fibrin-selektif versus non selektif, tergantung pada
apakah mereka melisiskan gumpalan tanpa adanya aktivasi plasminogen sistemik. Streptokinase, Anistreplase, dan Urokinase adalah agen fibrinolitik nonfibrin selektif, dan tanpa pandang bulu mengaktifkan plasminogen yang bersirkulasi dan terikat gumpalan menjadi plasmin. Aktivitas ini tidak hanya menyebabkan disolusi lokal trombus, tetapi juga menyebabkan degradasi sistemik fibrinogen yang bersirkulasi. Sebaliknya, Alteplase dan turunannya, serta stafilokinase, mencerna fibrinogen yang terikat gumpalan secara relatif selektif dan cenderung tidak menguras faktor koagulasi sistemik sebanyak streptokinase. Obat selektif fibrin lebih efisien dalam melarutkan trombus. Namun, sifat selektif dari agen litik spesifik fibrin memang memiliki beberapa efek samping yang tidak diinginkan; kurangnya penipisan fibrinogen sistemik dapat meningkatkan risiko rethrombosis dan reoklusi (Morrow & Braunwald, 2017).
2.10.2.6 Antiplatelet
Terapi antiplatelet memainkan peran utama dalam pengurangan risiko kardiovaskular. Terapi antiplatelet dimulai dengan monoterapi aspirin dan telah berkembang hingga mencakup beberapa obat antiplatelet oral yang memengaruhi berbagai mekanisme fungsi trombosit. Selain aspirin, obat antiplatelet oral yang saat ini disetujui termasuk Ticlopidine, Clopidogrel, Prasugrel, dan Ticagrelor. Ticlopidine jarang digunakan karena meningkatkan risiko neutropenia dan purpura trombositopenik trombotik. Dengan demikian, pembahasan akan terbatas pada agen lainnya. Clopidogrel, Ticagrelor dan Prasugrel baru-baru ini disetujui oleh FDA. Meskipun agen-agen ini memiliki sifat dan indikasi farmakokinetik dan farmakodinamik yang berbeda, mereka semua memiliki mekanisme yang sama untuk memblokir reseptor platelet P2Y12, yang mengakibatkan atenuasi aktivasi dan agregasi platelet yang dimediasi oleh adenosin difosfat (ADP). Jadi, mereka semua diklasifikasikan sebagai penghambat reseptor P2Y12 (Cavallari & Momary, 2018).
Antagonis P2Y12 menghambat aktivasi platelet adenosin difosfonat (ADP). ADP dilepaskan dari butiran penyimpanan alfa setelah aktivasi trombosit dan mengikat reseptor P2Y12 di bagian yang berada di luar sel. Setelah ADP dan P2Y12 membentuk ikatan disulfida, bagian luar reseptor mengalami perubahan konformasi ke dalam. Reseptor P2Y12 digabungkan dengan GαI2 dan Gβγ. Aktivasi hasil
reseptor P2Y12 dalam aktivasi GαI2, yang bertanggung jawab untuk aktivasi phosphoinositide-3-kinase dan penghambatan adenylyl cyclase yang menghasilkan penurunan tingkat siklik adenosin monofosfat dalam trombosit. Urutan peristiwa intraseluler ini mendorong pelepasan alfa dan granula padat, aktivasi integrin (GPIIbIIa), amplifikasi agregasi platelet, dan stabilisasi agregat platelet (Cavallari & Momary, 2018).
2.10.2.7 Antikoagulan
Dalam manajemen awal, penghambatan koagulasi sangat penting untuk membatasi penyebaran trombus pada pasien dengan infark miokard akut, baik ditangani secara invasif atau konservatif. Antikoagulan dapat digunakan dalam untuk menghambat pembentukan dan / atau aktivitas trombin, sehingga mengurangi kejadian terkait thrombus tersebut. Pemilihan antikoagulan harus didasarkan pada profil risiko perdarahan iskemik berikutnya (Li, 2016).
2.10.2.7.1 Unfractionated Heparin/ UFH
UFH adalah antikoagulan pertama yang digunakan dalam pengobatan IMA. UFH adalah campuran heterogen dari mukopolisakarida, dengan berat molekul mulai dari 2000 sampai 30.000 Da yang mengikat dan mengaktifkan antitrombin. Antitrombin teraktivasi menghambat beberapa faktor koagulasi, termasuk faktor Xa, yang menghasilkan efek antikoagulan. Karena kerjanya melalui pengikatan pada antitrombin, UFH diklasifikasikan sebagai inhibitor trombin tidak langsung. Pemeberian UFH secara subkutan (SC) diserap dengan buruk, oleh karena itu pemberian intravena (IV) adalah rute pemberian yang disukai. Kelemahan utama UFH adalah variabilitas signifikan dari respons terapeutiknya. Komposisi heterogen dan variabel eliminasi UFH melalui retikulum endoplasma menghasilkan variabilitas respon terapeutik antar pasien yang ditandai dan memerlukan pemantauan ketat dari intensitas antikoagulan dengan waktu pembekuan aktif (ACT) atau dengan waktu tromboplastin parsial teraktivasi (aPTT). UFH juga dapat menyebabkan trombositopenia yang dimediasi secara imunologis, juga dikenal sebagai trombositopenia yang diinduksi heparin (HIT), yang jarang terjadi (2% hingga 3% pasien), tetapi berpotensi mengancam nyawa. Kelemahan lain dari UFH termasuk peningkatan aktivasi dan agregasi platelet, ketergantungan pada antitrombin untuk penghambatan aktivitas trombin, sensitivitas terhadap faktor
platelet, dan ketidakmampuan untuk menghambat trombin yang terikat gumpalan. Bahkan dengan nomogram dosis berdasarkan berat standar, kurang dari sepertiga dari pengukuran aPTT awal berada dalam kisaran terapeutik. Efek antikoagulan UFH menghilang dengan cepat, dalam beberapa jam setelah gangguan. Selama 24 jam pertama setelah penghentian heparin, terdapat risiko reaktivasi proses koagulasi, dan oleh karena itu, meningkatkan risiko kejadian iskemik rekuren secara sementara meskipun dengan pengobatan aspirin tambahan. Keinginan untuk mengatasi kekurangan UFH telah mendorong minat dalam pengembangan antikoagulan alternatif (Morrow & Braunwald, 2017).
Secara historis, UFH dosis tinggi digunakan dalam fibrinolisis atau PCI untuk mengatasi komplikasi trombotik; namun, penelitian menunjukkan bahwa dosis yang lebih tinggi ini dikaitkan dengan tingkat perdarahan yang lebih tinggi tanpa efek pada titik akhir iskemik, dan bahwa kemanjuran dipertahankan pada dosis yang lebih rendah. Dosis awal UFH yang digunakan dalam PCI (hingga 175 UI / kg) secara bertahap diturunkan menjadi 140, 100, 85, 70, 60, dan 50 UI / kg dalam uji coba terbaru ketika penghambat reseptor glikoprotein IIb / IIIa (GPI) bekas. Pola serupa ditunjukkan dengan target ACT untuk rentang optimal efikasi UFH, menunjukkan bahwa jendela terapeutik untuk UFH relatif sempit (Morrow & Braunwald, 2017).
2.10.2.7.2 Fondaparinux
Fondaparinux adalah pentasakarida sintetik yang dikembangkan untuk memiliki struktur kimia yang mirip dengan domain situs aktif pengikat antitrombin heparin. Obat yang sangat selektif ini menginduksi perubahan konformasi, yang mengarah ke penghambatan kuat faktor Xa, dan dengan demikian, mengurangi pembentukan trombin. Tidak seperti UFH dan LMWH, Fondaparinux tidak memiliki efek penghambatan pada trombin (faktor IIa) itu sendiri. Fondaparinux menghambat faktor Xa dengan mengikat secara reversibel, dengan afinitas tinggi terhadap antitrombin. Seperti LMWH, tetapi dengan cara yang lebih selektif, ini menargetkan langkah hulu ini dalam kaskade koagulasi pembentukan thrombin (Morrow & Braunwald, 2017).
2.10.2.7.3 Enoxaparin
Enoxaparin adalah turunan heparin dengan berat molekul rendah (LMWH) yang menggunakan aktivitas antikoagulannya melalui antitrombin III, penghambat endogen faktor Xa dan trombin IIa. Tidak seperti rekan heparin tak terpecah (UFH), Enoxaparin memiliki ketersediaan hayati yang lebih besar, insiden trombositopenia yang diinduksi heparin lebih rendah dan antikoagulasi yang lebih stabil dan dapat diprediksi, memungkinkan pemberian dosis tetap tanpa perlu pemantauan. Keuntungan ini menjadikannya antikoagulan yang menarik untuk digunakan dalam manajemen sindrom koroner akut. Enoxaparin adalah alternatif rasional untuk UFH pada pasien dengan angina tidak stabil / infark miokard non STelevasi atau infark miokard elevasi ST, dengan peningkatan klinis sederhana pada komplikasi perdarahan (Lee & Gibson, 2017).
2.11 Tinjaun Enoxaparin
2.11.1Struktur dan Mekanisme Kerja Enoxaparin
Mekanisme kerja Enoxaparin bergantung pada antithrombin, terutama dengan mempercepat laju netralisasi faktor koagulasi teraktivasi tertentu oleh antitrombin, tetapi mekanisme lain mungkin juga terlibat. Enoxaparin mengikat dan mempercepat aktivitas antitrombin III. Dengan mengaktifkan antitrombin III, Enoxaparin secara selektif mempotensiasi penghambatan faktor koagulasi Xa dan
Gambar 2.10 Struktur kimia Enoxaparin (Li, 2016)
IIa. Faktor Xa mengkatalisis konversi protrombin menjadi trombin, sehingga penghambatan Enoxaparin pada proses ini menyebabkan penurunan trombin dan pada akhirnya mencegah pembentukan gumpalan fibrin (DrugBank, 2021).
2.11.2Farmakokinetika Enoxaparin
Farmakokinetik LMWH tidak dapat diserap melalui mukosa usus dan karenanya harus diberikan secara parenteral melalui infus intravena atau injeksi subkutan. Rata-rata bioavailabilitas absolut Enoxaparin, setelah 1,5 mg / kg diberikan secara subkutan, berdasarkan aktivitas anti-Factor Xa sekitar 100% pada sukarelawan sehat. Enoxaparine dimetabolisme di hati dengan desulfasi dan / atau depolimerisasi untuk menurunkan berat molekul spesies dengan potensi biologis yang jauh berkurang. Kreatinin Klirens dari fragmen aktif mewakili sekitar 10% dari dosis yang diberikan dan total ekskresi ginjal dari fragmen aktif dan non-aktif 40% dari dosis. LMWH hampir secara eksklusif dibersihkan oleh ginjal karena ukurannya yang lebih kecil. Oleh karena itu, disfungsi ginjal dapat menyebabkan akumulasi LMWH, yang menyebabkan perdarahan. Pada individu yang sehat, waktu paruh biologis dari LMWHs adalah sekitar 4–6 jam. Volume distribusi Enoxaparine adalah 4,3 L dan 80% Enoxaparin dalam darah terikat pada protein plasma (Li, 2016).
2.11.3Farmakodinamika Enoxaparin
Enoxaparin adalah mukopolisakarida yang sangat asam terbentuk dari bagian yang sama dari D-glukosamin tersulfat dan asam D-glukuronat dengan jembatan sulfamin. Berat molekul berkisar antara 3800 sampai 5000 dalton. Enoxaparin terjadi di dan diperoleh dari hati, paru-paru, sel mast, dll., dari vertebrata. Enoxaparin adalah antikoagulan terkenal dan umum digunakan yang memiliki sifat antitrombotik. Enoxaparin menghambat reaksi yang mengarah pada pembekuan darah dan pembentukan bekuan fibrin baik secara in vitro maupun in vivo. Enoxaparin bekerja di banyak tempat dalam sistem koagulasi normal. Enoxaparin dalam jumlah kecil dalam kombinasi dengan antitrombin III (kofaktor Enoxaparin) dapat menghambat trombosis dengan menonaktifkan Faktor X yang diaktifkan dan menghambat konversi protrombin menjadi trombin. Setelah trombosis aktif berkembang, sejumlah besar Enoxaparin dapat menghambat koagulasi lebih lanjut dengan menonaktifkan trombin dan mencegah konversi fibrinogen menjadi fibrin.
Enoxaparin juga mencegah pembentukan gumpalan fibrin yang stabil dengan menghambat aktivasi faktor penstabil fibrin. Penggunaannya harus dihindari pada pasien dengan klirens kreatinin kurang dari 20mL / menit. Pada pasien-pasien ini, heparin tidak terpecah hanya boleh digunakan. Sedangkan untuk pemantauan, waktu tromboplastin parsial aktif (aPTT) hanya akan meningkat pada dosis tinggi heparin berat molekul rendah (LMWH). Oleh karena itu, pemantauan aPTT tidak disarankan. Namun, aktivitas anti-Xa dapat diukur untuk memantau efektivitas LMWH (Y. Li, 2016).
2.11.4Dosis Enoxaparin
Pada pasien dengan NSTE-ACS yang menjalani pendekatan berbasis iskemia, penggunaan Enoxaparin subkutan (sc) pada 1 mg / kg setiap 12 jam hingga 3 hari didukung oleh dua uji klinis yang menunjukkan penurunan MACE yang signifikan dibandingkan dengan IV UFH, tanpa meningkatkan perdarahan besar. Pasien yang tiba di PCI dan telah menerima kurang dari dua dosis SC harus menerima dosis bolus Enoxaparin IV tambahan 0,3 mg / kg untuk memberikan antikoagulasi yang cukup selama prosedur. Pasien yang telah menerima setidaknya dua dosis SC dan tiba di PCI dalam 8 jam setelah dosis terakhir mereka tidak memerlukan antikoagulasi tambahan untuk PCI. Pasien yang menjalani PCI dalam 8-12 jam setelah dosis terakhir mereka juga harus menerima dosis bolus Enoxaparin IV tambahan. Pasien dengan CrCl kurang dari 30 mL / menit (0,5 mL / s) harus menerima Enoxaparin 1 mg / kg setiap 24 jam, bukan setiap 12 jam (DiPiro et al., 2020).
Pada pasien dengan STEMI yang menerima reperfusi dengan fibrinolitik, Enoxaparin telah menunjukkan penurunan 17% yang signifikan pada kematian dan MI dibandingkan dengan UFH. Perdarahan mayor meningkat, tetapi tidak ada peningkatan ICH yang terjadi pada kurang dari 1% pasien. Dosis Enoxaparin dalam percobaan ini menggunakan bolus 30 mg IV diikuti segera dengan 1 mg / kg SC setiap 12 jam. Dosis bolus diperlukan dalam pengaturan STEMI karena kebutuhan yang cepat untuk terapi reperfusi. Pasien berusia 75 tahun atau lebih dengan CrCl kurang dari 30 mL / menit (0,5 mL / s) perlu menerima perubahan dosis untuk mengurangi risiko perdarahan pada pasien berisiko tinggi ini. Percobaan pada pasien yang menerima PCI primer untuk STEMI telah menggunakan dosis IV
tunggal dari 0,5 mg / kg Enoxaparin. Sebuah meta-analisis dari uji coba yang mengevaluasi dosis Enoxaparin pada PCI primer menunjukkan penurunan mortalitas dan perdarahan mayor yang secara signifikan lebih kecil dibandingkan dengan UFH. Terlepas dari data ini, uji klinis definitif belum dilakukan dengan Enoxaparin dalam pengaturan ini (DiPiro et al., 2020).
2.11.5 Toksisitas Enoxaparin
Seperti kebanyakan antikoagulan, perdarahan adalah komplikasi paling utama pada LMWH. Tingkat kejadian dilaporkan kurang dari 3%. Mengingat bentuk pemberian LMWH di bawah kulit, ada risiko tinggi terjadinya memar ringan di tempat suntikan. Injeksi subkutan memiliki bioavailabilitas sekitar 100%. Jika terjadi perdarahan yang signifikan, protamin sulfat dapat digunakan untuk membalikkan sebagian efek antikoagulan LMWH. Protamin menetralkan sekitar 60% aktivitas antikoagulan LMWH. Untuk LMWH yang diberikan dalam 8 jam sebelumnya, dosis yang dianjurkan adalah 1mg protamine sulfate per 1mg Enoxaparin atau 100 unit anti-Factor-Xa dalteparin (Tahaineh et al., 2018). Protamin sulfat merupakan peptida kationik yang berikatan dengan heparin dengan berat molekul rendah sehingga membentuk kompleks ionik tanpa aktivitas antikoagulan. Penggunaan protamine sulfate berkorelasi dengan komplikasi perdarahan yang lebih sedikit pasca PCI (Yamamoto et al., 2018).