ISOLASI DAN SELEKSI BAKTERI PENCERNA SERAT ASAL
RUMEN KERBAU BERDASARKAN PERTUMBUHANNYA
PADA BERBAGAI PAKAN SUMBER SERAT
SKRIPSI RISTIA ASTUTI
DEPARTEMEN NUTRISI DAN MAKANAN TERNAK FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2010
RINGKASAN
RISTIA ASTUTI. D24052760. 2010. Isolasi dan Seleksi Bakteri Pencerna Serat Asal Rumen Kerbau Berdasarkan Pertumbuhannya pada Berbagai Pakan Sumber Serat. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Toto Toharmat, MAgrSc. Pembimbing Anggota : Dr. Ir. Dwierra Evvyernie A, MS., MSc.
Pakan sumber serat merupakan komponen utama pakan ternak ruminansia. Pemberian pakan sumber serat pada ternak ruminansia muda dapat merangsang pertumbuhan mikroba dan perkembangan rumen. Kendala yang sering ditemui pada ternak ruminansia muda yaitu diare akibat ketidaksiapan rumen pedet terhadap pakan berserat dan infeksi virus, bakteri atau protozoa. Inokulasi mikroba pencerna serat pada ruminansia muda diharapkan dapat mempercepat masa adaptasi ternak terhadap pakan sumber serat sehingga dapat mencegah terjadinya diare dan menekan mikroorganisme patogen penyebab diare. Penelitian ini bertujuan menyeleksi mikroba pencerna serat asal kerbau karena kerbau merupakan ternak ruminansia yang dapat mencerna serat kasar lebih efisien dibandingkan sapi.
Bakteri dari tiga cairan rumen kerbau (A, B dan C) yang berasal dari wilayah kering, Jonggol, telah diseleksi. Bakteri terseleksi ditumbuhkan pada media dan diinkubasi selama tiga hari pada suhu 39 oC. Alang-alang, serat sawit dan jerami padi telah digunakan sebagai media sumber serat. Koloni yang tumbuh dan mengandung bakteri yang seragam diseleksi dan dimurnikan sebagai suatu isolat. Peubah yang diamati adalah jumlah bakteri (OD 600 nm), aktivitas enzim selulase, pola pertumbuhan dan tingkat pertumbuhan konstan (µ) isolat tersebut. Perlakuan dialokasikan dalam Rancangan Acak Lengkap berpola faktorial 17 x 3 dengan 3 ulangan. Data yang diperoleh dianalisis dengan sidik ragam dan bila berbeda nyata dilakukan uji jarak Duncan.
Penelitian ini berhasil mengisolasi 17 isolat dari tiga rumen (A, B dan C) yang mampu tumbuh di substrat alang-alang, jerami padi dan serat sawit. Isolat tersebut mampu mendegradasi selulosa, yang artinya keseluruhan isolat tersebut termasuk dalam bakteri selulolitik. Jumlah isolat dari cairan rumen kerbau A sebanyak lima isolat yaitu: AJ6, AJ7, AS2, AS3 dan AS7. Jumlah isolat dari cairan rumen kerbau B sebanyak sembilan isolat yaitu BJ1, BJ2, BJ3, BL1, BL3, BL5, BL7, BS3, BS4 dan jumlah isolat dari cairan rumen kerbau C sebanyak tiga isolat yaitu CJ6, CL2 dan CL4. Perbedaan (P < 0.05) aktivitas enzim (CMC-ase) terjadi pada pakan sumber serat tetapi tidak terdapat perbedaan dari masing-masing isolat. Selain itu, tidak terdapat perbedaan antara populasi isolat dan sumber serat media terhadap populasi bakteri total. Nilai aktivitas enzim selulase berdasarkan rataan secara keseluruhan berkisar antara 6,86-9,74 unit/ml/jam tertinggi. Populasi bakteri tertinggi ditemukan pada sumber serat alang-alang dengan isolat BL1, BL5 dan BL7. Waktu generasi isolat berkisar antara 1,667-6,3 jam dan waktu generasi tercepat dihasilkan oleh isolat CL2. Aktivitas enzim terbaik dihasilkan oleh isolat BJ1, akan tetapi semua isolat yang diperoleh mempunyai potensi untuk dijadikan probiotik dalam pakan ternak ruminansia muda.
ABSTRACT
Isolation and Selection of Cellulolytic Bacteria from Buffalo Rumen Based on Growth Rate in Various Fibrous Feed
R. Astuti, T. Toharmat, and D. Evvyernie
An experiment was conducted to isolate fiber digesting bacteria from buffalo rumen and to determine their potential as candidates of probiotic. Inoculated growth media was incubated an aerobically for 3 days at 39oC. Each colony containing uniform bacteria was selected as an isolate. Each isolate was grown separatelly in growth media and the following variables were determined: bacteria population (OD 600 nm), CMC-ase activity, bacteria growth and growth rate constant (µ). The total of 17 bacteria were isolated from the buffalo rumen solution (AJ6, AJ7, AS2, AS3, and AS7 from buffalo A; BJ1, BJ2, BJ3, BL1, BL3, BL5, BL7, BS3, BS4; from buffalo B; CJ6, CL2, and CL4 from buffalo C). The isolate indicated different ability in digesting cellulose with different characteristics. All isolates were evaluated for their characteristics in a designed experiment. A randomized design with factorial 17x3 was applied in this experiment. Factor A was isolates obtained from buffalo rumen (A, B and C). Factor B was fiber sources that were used as bacteria growth media. Data were analyzed by Analysis of Variance and significant differences were further evaluated using Duncan Multiple Range Test. There was no differences in CMC-ase activity in all Isolates but the sources of fiber influenced the CMC-ase activity (P<0.05). Interaction between the two factors was not significant. All isolates and all sources of fiber did not affect significantly for total bacterial population and interaction between the two factors was not significant. The results indicate that the isolates had different characteristics in digesting the fiber.
ISOLASI DAN SELEKSI BAKTERI PENCERNA SERAT ASAL
RUMEN KERBAU BERDASARKAN PERTUMBUHANNYA
PADA BERBAGAI PAKAN SUMBER SERAT
RISTIA ASTUTI D24052760
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2010
Judul Skripsi : Isolasi dan Seleksi Bakteri Pencerna Serat Asal Rumen Kerbau Berdasarkan Pertumbuhannya pada Berbagai Pakan Sumber Serat Nama : Ristia Astuti
NIM : D24052760
Menyetujui:
Pembimbing Utama Pembimbing Anggota
Prof. Dr. Ir. Toto Toharmat, MAgrSc Dr. Ir. Dwierra Evvyernie A, MS., MSc NIP. 19590902 198303 1 003 NIP. 19610602 198603 2 001
Menyetujui: Ketua Departemen
Ilmu Nutrisi dan Teknologi Pakan Fakultas Peternakan IPB
Dr. Ir. Idat Galih Permana, MSc. Agr. NIP. 19670506 199103 1 001
RIWAYAT HIDUP
Penulis dilahirkan di Kota Tenggarong, Kabupaten Kutai Kartanegara pada tanggal 17 September 1987 dari pasangan ayah Darmawan dan ibu Lisnawati.
Penulis mengawali pendidikan dasarnya di Sekolah Dasar 017 Tenggarong pada tahun 1993 dan diselesaikan pada tahun 1999. Pendidikan lanjutan pertama dimulai oleh penulis pada tahun 1999 dan diselesaikan pada tahun 2002 di Sekolah Lanjutan Tingkat Pertama Negeri (SLTPN) 3 Tenggarong. Penulis kemudian melanjutkan ke Sekolah Menengah Atas Negeri (SMAN) 1 Tenggarong pada tahun 2002 dan lulus pada tahun 2005.
Penulis diterima sebagai mahasiswa tingkat persiapan bersama di Institut Pertanian Bogor melalui jalur BUD (Beasiswa Utusan Daerah). Pada tahun 2006 penulis diterima di program studi Ilmu Nutrisi dan Teknologi Pakan Fakultas Peternakan, Institut Pertanian Bogor. Penulis aktif di kegiatan Organisasi FMBUD KUKAR (Forum Mahasiswa Beasiswa Utusan Daerah Kutai Kartanegara) di Bogor.
KATA PENGANTAR
Alhamdulillahirabbil’aalamiin. Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia dan rahmat-Nya sehingga penulisan skripsi ini dapat diselesaikan. Penelitian ini mengambil tema mengenai enzim selulase yang disekresikan oleh isolat-isolat bakteri hasil seleksi dari cairan rumen kerbau pada media tumbuh jerami padi, alang-alang dan serat sawit. Penelitian ini berjudul: Isolasi dan Seleksi Bakteri Pencerna serat Asal Rumen Kerbau Berdasarkan Pertumbuhannya pada Berbagai Pakan Sumber Serat. Skripsi ini ditulis berdasarkan hasil penelitian yang penulis lakukan mulai bulan Februari - April 2009 bertempat di Laboratorium Ilmu Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Tujuan dari penelitian ini adalah untuk mendapatkan isolat bakteri pencerna serat dengan aktivitas yang optimum yang diperoleh dari cairan rumen kerbau. Isolat ini selanjutnya diharapkan dapat dijadikan kultur yang digunakan sebagai inokulan atau probiotik pada pedet atau rumiansia muda.
Penulis dengan rendah hati mengucapkan terima kasih kepada seluruh pihak yang telah membantu penulis sehingga penulisan skripsi ini dapat terselesaikan dengan baik. Semoga skripsi ini dapat bermanfaat khususnya bagi penulis sendiri dan untuk pembacanya.
Bogor, Februari 2010
DAFTAR ISI
RINGKASAN ... ii
ABSTRACT ... iii
RIWAYAT HIDUP ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1 Latar Belakang ... 1 Perumusan Masalah ... 2 Tujuan ... 2 TINJAUAN PUSTAKA ... 3 Klasifikasi Kerbau ... 3
Efektivitas Ternak Kerbau dalam Mencerna Pakan Berserat ... 3
Mikroba Rumen ... 4
Bakteri Selulolitik ... 5
Pembiakan dan Isolasi Bakteri ... 6
Kultivasi Bakteri ... 7
Pertumbuhan Bakteri ... 8
Pakan Sumber Serat ... 10
Jerami Padi ... 10 Alang-alang ... 11 Serat Sawit... 12 Serat Kasar ... 13 Enzim Selulase ... 14 METODE ... 16
Lokasi dan Waktu ... 16
Materi ... 16
Alat ... 16
Bahan ... 16
Rancangan ... 16
Perlakuan ... 16
Peubah yang diamati ... 17
Rancangan Percobaan ... 17
Prosedur ... 17
Persiapan Sampel ... 17
Metode Tahap I ... 18
Pengenceran Hasil Inkubasi ... 18
Isolasi (Pemurnian) Bakteri ... 19
Uji Kemampuan Kultur Tunggal ... 19
Metode Tahap II ... 19
Uji Aktivitas Enzim Selulase ... 19
Karakteristik Pertumbuhan Bakteri Selulolitik Rumen Kerbau ... 20
HASIL DAN PEMBAHASAN ... 22
Keadaan Kerbau dan Proses Penelitian ... 22
Isolat Bakteri yang Diperoleh ... 23
Populasi Bakteri Total ... 24
Aktivitas Enzim CMC-ase Isolat Bakteri pada Substrat Jerami Padi, Serat Sawit dan Alang-alang ... 26
Pertumbuhan Isolat Bakteri ... 28
KESIMPULAN DAN SARAN ... 31
Kesimpulan ... 31 Saran... 31 UCAPAN TERIMAKASIH ... 32 DAFTAR PUSTAKA ... 34 LAMPIRAN ... 39 ix
DAFTAR TABEL
Nomor Halaman
1. Bakteri Rumen (x 108/ml) pada Sapi dan Kerbau yang Diberi Pakan Berserat Tinggi ... 4 2. Komposisi Nutrien Jerami Padi ... 9 3. Komposisi Kimia Alang-alang pada Berbagai Tingkat Umur ... 11 4. Isolat Bakteri Terpilih dari Rumen Kerbau Dengan Berbagai
Substrat Serat Sebagai Media Tumbuh ... 22 5. Rataan Populasi Bakteri Total (108 CFU/ml) dari Isolat dalam Media
Berupa Pakan Sumber Serat yang Berbeda... 23 6. Aktivitas CMC-ase dari Isolat Bakteri pada Berbagai Substrat Serat
(unit/ml/jam) ... 25 7. Pertumbuhan Isolat dengan Pengukuran Nilai Absorbansi ... 27 8. Kinetika Pertumbuhan Isolat ... 28
DAFTAR GAMBAR
Nomor Halaman
1. Kurva Pertumbuhan Bakteri ... 9 2. Kerbau A, B dan C Asal Jonggol yang Digunakan Sebagai Sumber
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi Bahan Pembuat Media BHI ... 38
2. Komposisi Media Pengencer (Media Putih) ... 38
3. Komposisi Media BHI Modifikasi ... 38
4. Komposisi Larutan Mineral 1 ... 39
5. Komposisi Larutan Mineral 2 ... 39
6. ANOVA Populasi Bakteri Total dalam Media Berupa Pakan Sumber Serat Berbeda ... 40
7. ANOVA Aktivitas CMC-ase dari Isolat Bakteri pada Berbagai Substrat Serat ... 40
8. Uji Jarak Duncan Faktor A pada Aktivitas Enzim ... 40
PENDAHULUAN
Latar Belakang
Ruminansia mempunyai kemampuan untuk mencerna pakan sumber serat, hal ini dikarenakan dalam rumen terdapat bakteri, protozoa, dan fungi. Dengan adanya mikroba tersebut, maka ternak ruminansia mempunyai kemampuan mencerna selulosa, hemiselulosa, pati dan karbohidrat secara fermentatif yang terjadi dalam rumen. Proses fermentasi tersebut menjadikan ruminansia berbeda dengan monogastrik.
Sapi dan kerbau adalah ternak ruminansia paling dikenal di daerah tropis (Ogimoto dan Imai, 1981). Secara tradisional pakan ternak ruminansia di wilayah tropis berasal dari sisa hasil pertanian yang merupakan bahan berserat kasar tinggi (Ryle dan Orskov, 1987). Kerbau merupakan ternak ruminansia yang mampu mencerna serat kasar secara efisien, karena waktu retensi pakan lebih lama (Bhattacharya dan Mullick, 1965). Laju aktivitas selulolitik dari ternak kerbau (43,2%/hari) lebih tinggi dibandingkan dengan ternak sapi (6,3%/hari) (Suryahadi et al. 1995). Jenis bakteri selulolitik yang diisolasi dan diidentifikasi dari cairan rumen ternak kerbau dan sapi adalah Ruminococcus flavefaciens, Ruminococcus albus, dan
Bakteroides ruminicola. Di Indonesia, peternakan sapi perah dan sapi pedaging sangat tergantung dengan konsentrat, tetapi peternakan kerbau rakyat cukup dengan digembalakan di padang rumput tanpa penambahan konsentrat sebagai sumber energi. Walaupun demikian, produktivitas kerbau hasil gembalaan sudah cukup optimal meskipun tanpa konsentrat (Suryahadi et al., 1996). Hal tersebut merupakan gambaran bahwa efektifitas kerbau dalam mencerna pakan serat lebih baik dibanding ternak sapi.
Transfer mikroba dari ruminansia dewasa kepada ruminansia muda hingga saat ini dilakukan secara alami. Kondisi ini menyebabkan adaptasi ternak ruminansia muda terhadap pakan sumber serat menjadi lebih lama. Saat ini penggunaan pakan sumber serat menjadi suatu kebutuhan mengingat ketersedian pakan hijauan berkualitas sangat terbatas. Limbah pertanian seperti jerami padi merupakan bahan lignoselulosa yang mempunyai potensi sebagai pakan sumber serat. Namun kendala penggunaan pakan berserat adalah tingginya jumlah ikatan lignoselulosa yang sulit
dicerna. Oleh karena itu perlu dilakukan upaya mempercepat adaptasi ternak muda terhadap pakan berserat tinggi serta meningkatkan nilai guna pakan berserat tersebut sehingga dapat dimanfaatkan lebih optimal sebagai pakan ruminansia. Salah satu upaya yang diperkirakan dapat dilakukan adalah inokulasi mikroba rumen kerbau yang berkemampuan mencerna pakan sumber serat terutama pada ruminansia muda.
Kerbau dikenal sebagai ternak yang mampu memakan dan memanfaatkan pakan berkualitas lebih rendah secara lebih efisien dibandingkan dengan sapi. Salah satu kemungkinannya adalah dalam rumen kerbau terdapat bakteri pencerna serat kasar yang lebih baik dan tidak ditemukan pada sapi, sehingga daya cerna pakan pada kerbau lebih baik dibandingkan pada sapi. Oleh karena itu untuk membuat probiotik yang dapat meningkatkan keseimbangan mikroorganisme dalam saluran pencernaan diperlukan isolat bakteri pendegradasi serat asal kerbau yang memiliki kemampuan tinggi dalam mencerna pakan sumber serat.
Tujuan
Penelitian ini bertujuan untuk mendapatkan isolat bakteri pencerna serat dengan aktivitas yang optimum yang diperoleh dari cairan rumen kerbau. Isolat ini selanjutnya diharapkan dapat dijadikan kultur yang digunakan sebagai inokulan atau probiotik untuk pedet atau ruminansia muda.
TINJAUAN PUSTAKA
Klasifikasi Kerbau
Menurut Reksohadiprojo (1984) ada dua tipe kerbau Asia yang tergolong dalam spesies yang sama dengan taksonomi sebagai berikut:
Kerajaan : Animalia Filum : Chordata Kelas : Mamalia Subkelas : Theria Ordo : Artiodactyla Subordo : Ruminantia Famili : Bovidae Subfamili : Bovinae Genus : Bubalus
Spesies : Bubalus bubalis
Kerbau Tipe rawa (swamp buffalo) banyak terdapat di Filipina sampai India termasuk Indonesia. Ciri-ciri kerbau rawa adalah berwarna keabu-abuan, leher terkulai dan memiliki tanduk besar yang mengarah ke belakang sehingga sering digunakan sebagai hewan kerja. Kerbau rawa juga biasa digunakan sebagai penghasil daging. Kerbau sungai (river buffalo) adalah kerbau yang biasa berkubang pada sungai yang berair jernih. Populasinya menyebar dari India sampai ke Mesir dan Eropa. Bulunya berwarna hitam atau abu-abu agak gelap dengan tanduk melingkar atau lurus memanjang ke belakang. Kerbau sungai umumnya tipe kerbau penghasil susu (Fahimuddin, 1975).
Efektivitas Ternak Kerbau dalam Mencerna Pakan Berserat
Kerbau tumbuh lebih baik daripada sapi dalam kondisi pakan yang buruk, karena kerbau lebih efisien daripada sapi dalam mencerna dan mempergunakan serat kasar dan selulosa. Suatu percobaan menunjukkan kemampuan sapi mencerna selulosa jerami gandum mencapai 24,3% tetapi kerbau sampai 30,7% (Ichhponani dan Sidhu, 1966). Pada penelitian yang lain kecernaan jerami yaitu 64,7% pada sapi dan 79,8% pada kerbau (Sharma dan Mudgal, 1966). Kemampuan kerbau mencerna serat dengan efisien didukung oleh aktifitas mikroorganisme dalam rumen. Pada
analisis laboratorium yang menggunakan sampel isi rumen kerbau dan sapi, diperoleh hasil bahwa sampel isi rumen kerbau memproduksi volatil fatty acid (VFA) lebih cepat dari pada sampel isi rumen sapi dengan pakan yang bervariasi (Ichhponani et al., 1962).
Dalam suatu percobaan in vitro dengan menggunakan cairan rumen sapi dan kerbau menunjukkan suatu keunggulan rumen kerbau untuk menggunakan selulosa dan struktur dinding sel lainnya. Hal ini terlihat pada kecepatan dalam penguraian kertas saring yang diinkubasi dengan cairan rumen kerbau lebih cepat dibandingkan dengan kertas saring yang diinkubasi menggunakan cairan rumen sapi (Ichhponani et al., 1971b). Pradhan (1994) menyatakan bahwa aktifitas selulase dalam rumen kerbau lebih tinggi dibandingkan dengan sapi, aktifitas selulase pada kerbau 399 dan sapi 360 µg gula/mg protein.
Mikroba Rumen
Mikroba rumen yang bersifat anaerob adalah penting dalam proses fermentasi rumen, karena dapat melakukan berbagai reaksi dan interaksi dengan makanan yang dikonsumsi ternak, untuk menghasilkan nutrien yang dapat diserap dan selanjutnya dapat dimanfaatkan oleh tubuh ternak. Selain sifatnya yang anaerob, mikroba rumen juga memerlukan kondisi pH 5,7-7,3 dan suhu 38-41oC (Hoover dan Miller, 1992). Jenis mikroba penting yang menghuni rumen adalah bakteri, protozoa dan fungi.
Sutardi (1977) menyatakan, bahwa adanya bakteri dan protozoa yang hidup dalam rumen menyebabkan ruminansia dapat mencerna bahan makanan yang mengandung serat kasar tinggi. Berbagai jenis mikroorganisme yang masing-masing memiliki produk fermentasi antara dan produk fermentasi akhir yang bermacam-macam menyebabkan kehidupan di dalam rumen kompleks. Interaksi yang luas antara mikroorganisme di dalam rumen adalah interaksi yang bersifat ketergantungan, saling menguntungkan dan kompetitif.
Bakteri merupakan penghuni terbesar dalam rumen yaitu 1010-1012/ml cairan rumen, sedangkan populasi protozoa 105-106/ml cairan rumen (Ogimoto dan Imai, 1981). Jumlah bakteri dalam rumen kerbau mencapai 1,89-2,34 x 1010 /ml cairan rumen (Le Viet Ly, 1994). Menurut Suryahadi et al. (1996) jenis bakteri selulolitik yang diisolasi dan diidentifikasi dari cairan rumen ternak kerbau dan sapi adalah
Ruminococcus flavefaciens, Ruminococcus albus, Bakteroides ruminicola. Aktivitas selulolitik dari ternak kerbau lebih tinggi dibandingkan dengan ternak sapi yaitu 43,2% dan 16,3%/hari.
Tabel 1. Jumlah Bakteri Rumen (x 108/ml) pada Sapi dan Kerbau yang Diberi Pakan Berserat Tinggi
Bakteri Sapi Kerbau
Jumlah Total 11,62 18,45
Selulolitik 2,58 6,86
Proteolitik 0,41 0,54
Amilolitik 8,63 11,05
Sumber: Pradhan (1994)
Pada Tabel 1 dapat diketahui bahwa jumlah total bakteri pada kerbau (18,45 x 108/ml) lebih besar dibandingkan dengan jumlah bakteri total pada sapi (11,62 x 108/ml). Terlihat bahwa bakteri selulolitik 2-3 kali lipat lebih besar pada kerbau dibandingkan sapi. Persentase bakteri selulolitik pada sapi sebesar 22,2% dan pada kerbau 37,2% dari total bakteri. Pada percobaan in vitro pada berbagai kondisi menunjukkan bahwa pemecahan selulosa terjadi lebih awal pada inokulan rumen kerbau dari pada sapi (Pradhan, 1994).
Bakteri Selulolitik
Guedon (2002) menyatakan bahwa mikroorganisme selulolitik berperan penting dalam biosfer. Beberapa spesies bakteri hidup pada kondisi temperatur, tekanan dan pH yang ekstrim. Habitatnya termasuk tanah, rawa, sungai, danau, sedimen air laut, kayu, kapas, lumpur, silase, kompos, bahan sayuran yang membusuk, tempat sumber air panas dan tempat sumber asam maupun sumber alkalin.
Menurut Beguin (1992), bakteri selulolitik juga terdapat dalam usus herbivora vertebrata. Semuanya bersifat anaerob yang bersimbiosis dalam menghancurkan makanan. Secara fisiologi bakteri selulolitik dapat dibagi menjadi beberapa kelompok yaitu: (1) fermentasi anaerob, tipe gram positif (Clostridium,
Ruminococcus dan Caldicellulosiruptor) tetapi juga mengandung sedikit spesies gram negatif yang secara genetik masih berhubungan dekat dengan keluarga
Clostridium (Butyrivibrio dan Acetivibrio) dan yang tidak (Fibrobacter), (2) bakteri aerob gram positif (Cellulomonas dan Thermobifida) dan (3) bakteri aerob yang dapat bergerak (Cytophaga dan Sporocytophaga) (Lynd et al., 2002).
Pembiakan dan Isolasi Bakteri
Mikroorganisme dibiakkan pada bahan nutrien yang disebut medium. Banyak sekali medium yang dipakai tergantung banyak faktor, salah satu di antaranya ialah jenis organisme yang akan ditumbuhkan. Bahan yang diinokulasikan pada medium disebut inokulum. Dengan menginokulasikan medium agar nutrien (nutrient agar), sel-sel itu akan terpisah sendiri. Setelah inkubasi, sel-sel mikroba individu itu memperbanyak diri sedemikian cepatnya sehingga di dalam waktu 18 sampai 24 jam terbentuklah massa sel yang dapat dilihat dan dinamakan koloni. Setiap koloni yang berlainan dapat mewakili macam organisme yang berbeda-beda dimana setiap koloni merupakan biakan murni satu macam mikroorganisme (Pelczar dan Chan, 1986).
Isolasi adalah proses pemurnian bakteri dari sekelompok bakteri yang terdapat dalam habitat yang sama. Pemurnian bertujuan untuk mendapatkan bakteri murni yang hanya terdiri dari satu spesies saja. Bakteri yang sudah dimurnikan, kemudian akan dibiakkan dalam media buatan untuk mendapatkan kultur bakteri murni dalam jumlah banyak. Fardiaz (1988) menjelaskan bahwa terdapat tiga jenis isolasi yang umum dilakukan yaitu isolasi pada media cawan, isolasi pada medium cair, dan isolasi sel tunggal. Isolasi agar cawan dilakukan dengan menggunakan goresan kuadran atau metode agar tuang. Keberhasilan metode ini sangat tinggi karena kebanyakan bakteri, kapang dan khamir dapat membentuk koloni pada media padat sehingga lebih mudah diisolasi dengan cara menyebarkan sel-sel tersebut pada agar cawan sehingga timbul koloni-koloni yang terpisah. Isolasi medium cair digunakan untuk beberapa bakteri yang ukuran selnya besar, tidak dapat tumbuh pada agar cawan, hanya dapat tumbuh pada kultur cair. Metode yang digunakan adalah metode pengenceran. Metode ini mempunyai kelemahan karena hanya dapat digunakan untuk mengisolasi mikroba yang jumlahnya dominan dalam suatu campuran populasi mikroba. Isolasi sel tunggal digunakan untuk mengisolasi sel mikroba yang ukurannya besar serta tidak dapat diisolasi dengan metode cawan maupun pengenceran.
Kultivasi Bakteri
Kultivasi adalah menumbuhkan mikroba hasil seleksi mikroba (isolat) dalam medium/kultur/biakan di luar habitat alami. Kondisi media kultivasi harus sesuai dengan habitat aslinya sehingga isolat yang dibiakkan dapat berkembang dengan baik. Saat kondisi media kultivasi sesuai dengan habitat aslinya, maka pertumbuhan dan reproduksi bakteri dapat diamati dan diukur, pengaruh berbagai kondisi baik terhadap pertumbuhan maupun reproduksi bakteri tersebut dapat dipelajari, demikian juga perubahan yang dihasilkan oleh bakteri di dalam lingkungan tumbuhnya dapat diketahui. Keberhasilan metode kultivasi yang menghasilkan biakan bakteri yang baik tergantung pada kebutuhan nutrisi yang terdapat dalam media biakan. Nutrien yang dibutuhkan oleh bakteri antara lain: sumber karbon (karbohidrat), sumber nitrogen (protein/amoniak), ion-ion anorganik tertentu, metabolit penting (vitamin, asam amino) dan air (Volk dan Wheleer, 1988).
Pada dasarnya, semua organisme membutuhkan energi untuk mempertahankan kehidupannya. Mikroorganisme membutuhkan karbon, nitrogen, sulfur, unsur logam dan vitamin untuk menunjang kehidupannya, serta air untuk fungsi-fungsi metabolik dan pertumbuhannya (Pelczar dan Chan, 1986). Volk dan Wheleer (1988) menjelaskan bahwa proses perombakan bahan organik menjadi bahan yang diperlukan oleh sel adalah: perombakan bahan yang mengandung protein, karbohidrat, atau lipid; penyerapan bentuk materi dalam bentuk sederhana; kemudian sintesis protein, karbohidrat dan lipid dalam sel.
Di samping kebutuhan nutrien yang sesuai untuk kultivasi bakteri, juga diperlukan kondisi fisik yang memungkinkan untuk pertumbuhan optimum bakteri. Keberhasilan kultivasi bakteri tergantung pada kombinasi nutrien dan lingkungan fisik yang sesuai. Beberapa persyaratan lingkungan fisik yang harus dipenuhi antara lain, suhu, atmosfer gas, dan derajat keasaman, serta beberapa kondisi khusus lainnya (Pelczar dan Chan, 1986).
Pertumbuhan bakteri juga dipengaruhi oleh keberadaan gas atmosfer seperti oksigen dan karbondioksida. Atas dasar ini maka, terdapat empat kelompok bakteri yaitu: 1) aerobik adalah organisme yang membutuhkan oksigen, 2) anaerob adalah organisme yang tidak memerlukan oksigen dalam hidupnya, 3) anaerobik fakultatif adalah organisme yang dapat tumbuh dalam lingkungan aerobik maupun anaerobik,
dan 4) mikroaerofilik adalah organisme yang tumbuh dengan baik jika hanya ada sedikit oksigen dalam lingkungannya (Pelczar dan Chan, 1986).
Pertumbuhan bakteri juga tergantung dari jumlah energi metabolis yang tersedia. Jumlah ATP dari heksosa ini diperoleh dari jalur fermentasi oleh mikroorganisme rumen (Russel dan Brucker, 1991). Penambahan cairan rumen dalam media, selain memberikan kondisi yang sesuai juga memberikan supply nutrien bagi mikroorganisme rumen (Hungate, 1960).
Pertumbuhan Bakteri
Pertumbuhan umum digunakan untuk bakteri dan mikroorganisme lain dan biasanya mengacu pada perubahan di dalam hasil panen sel (pertambahan total massa sel) dan bukan perubahan individu organisme. Pertumbuhan merupakan pertambahan jumlah atau massa melebihi yang ada di dalam inokulum asalnya. Selama fase pertumbuhan seimbang, pertambahan massa bakteri berbanding lurus dengan pertambahan komponen selular yang lain seperti DNA, RNA dan protein (Pelczar dan Chan, 1986).
Pertumbuhan ialah pertambahan teratur semua komponen suatu mikroorganisme. Pada waktu inkubasi setiap sel induk berbagi diri dengan pembelahan biner dalam waktu 20-30 menit menjadi dua sel anak (Hadioetomo, 1985). Hobson (1988) menyatakan bahwa waktu penggandaan populasi bakteri adalah 21-27 menit. Waktu generasi pada setiap bakteri tidak sama, ada yang hanya memerlukan 20 menit bahkan ada yang memerlukan sampai berjam-jam atau berhari-hari. Waktu generasi adalah waktu yang diperlukan oleh mikroorganisme untuk meningkatkan jumlah sel menjadi dua kali lipat jumlah semula (Sumarsih, 2003).
Pertumbuhan jasad renik dapat diukur berdasarkan konsentrasi sel (jumlah sel persatuan isi biakan) atau densitas sel (berat kering dari sel-sel persatuan sel biakan) dan jumlah sel hidup biasanya dianggap sebagai ukuran konsentrasi sel. Pengukuran jumlah bakteri dapat menggunakan teknik absorbsi cahaya. Absorbansi cahaya dari suatu biakan dengan cara fotoelektris dan menghubungkan jumlah jasad renik hidup dengan ukuran-ukuran optik dalam suatu kurva standar, dengan kurva standar ini semua hasil pengukuran optik dapat diubah menjadi konsentrasi sel. Bila bakteri
diinokulasikan ke dalam medium baru, pembiakan tidak segera terjadi tetapi ada periode penyesuaian pada lingkungan yang dikenal dengan pertumbuhan adaptif. Kemudian akan memperbanyak diri (replikasi) dengan laju yang konstan, sehingga akan diperoleh kurva pertumbuhan. Pada kurva pertumbuhan dikenal beberapa fase pertumbuhan yaitu dengan fase lag, fase eksponensial, fase stasioner dan fase kematian. Fase pertumbuhan bakteri secara umum dapat dilihat pada Gambar 1.
Gambar1. Kurva Pertumbuhan Bakteri Sumber: Cann (2007)
Fase lag terjadi peningkatan ukuran sel, pada waktu ini sel belum terlalu banyak membelah. Sel mulai memperbanyak diri secara lambat setelah menyesuaikan diri dalam medium baru. Fase eksponensial terjadi pertumbuhan seimbang, sel membelah dengan kecepatan yang tetap dan maksimal. Pertumbuhan yang paling cepat terjadi pada fase eksponensial ini. Fase stasioner ditandai dengan penurunan kecepatan pertumbuhan (pembelahan bakteri berkurang), terjadi karena penumpukan limbah metabolisme, racun, kekurangan nutrien, dan perubahan kondisi pada lingkungan. Pertumbuhan sel yang hidup masih lebih banyak daripada jumlah sel yang mati. Fase kematian ditandai dengan jumlah sel yang mati lebih banyak daripada sel yang hidup karena nutrien semakin menurun (bahkan habis), energi cadangan di dalam sel juga habis dan terkumpulnya produk limbah. Pada fase kematian eksponensial tidak diamati pada kondisi umum pertumbuhan kultur bakteri, 9
kecuali bila kematian dipercepat dengan penambahan zat kimia toksik, panas atau radiasi (Tarigan, 1988).
Pakan Sumber serat
Jerami Padi
Jerami padi merupakan salah satu sisa hasil pertanian yang potensial sebagai sumber energi yang dapat dimanfaatkan bagi ternak ruminansia. Menurut Doyle et al. (1986) perbandingan antara produksi padi dan jerami padi diperkirakan 1:1. Jerami padi pada umumnya masih dipandang sebagai limbah pertanian yang kurang berguna dibanding hijauan berkualitas rendah lainnya karena adanya faktor pembatas yaitu rendahnya kandungan nutrien serta koefisien cernanya. Jerami padi mengandung serat kasar dan silika yang tinggi disertai kadar protein, pati dan lemak yang rendah. Jerami padi mengandung silikat yang terikat ke dalam gugus organik. Bersama-sama dengan mineral lain, silikat membentuk suatu lapisan tipis yang menyelimuti bagian luar dinding sel sehingga dapat menghalangi kerja enzim pencerna bahan organik. Pertambahan satu persen kadar silikat dalam hijauan pakan akan menurunkan koefisien cerna bahan organik sebanyak satu persen (Sofyan dan Sriharini, 1986)
Doyle et al. (1986) menyatakan bahwa kandungan nutrien jerami padi umumnya rendah, protein kasarnya berkisar 2,2-9,5%, hemiselulosa 21-29% dan lignin 4-8%. Hogan dan Leche (1981) melaporkan bahwa komponen jerami padi yang dapat dicerna secara in vitro hanya 45-50% saja. Rendahnya kandungan nutrisi menyebabkan pemakaian jerami padi dalam ransum ternak ruminansia menjadi terbatas. Kandungan nutrien jerami padi diperlihatkan pada Tabel 2.
Silika merupakan kristal yang terdapat dalam dinding sel dan mengisi ruang antar sel. Kristal silikat tidak larut dalam cairan rumen, dengan demikian merupakan hambatan utama bagi mikroba rumen dan enzim yang dihasilkannya untuk mencerna jerami padi (Sutrisno, 1983). Kandungan silika diduga terkait dengan umur panen, karena umur panen yang cukup tinggi menyebabkan jerami padi sulit dirombak oleh mikroba rumen (Sutardi, 1980). Hal tersebut mengakibatkan penggunaan jerami padi masih terbatas sebagai bulk dan menggantikan tidak lebih dari 25% kebutuhan ternak akan rumput.
Tabel 2. Komposisi Nutrien Jerami Padi Komponen Kadar (% BK) Bahan kering 91 Abu 11-19 Protein kasar 3-5 Lemak 1,82 Serat kasar 27-40 BETN 40,38 Ca 0,11-0,58 P 0,14-0,30 Selulosa 33 Silika 13 Sumber:Nista et al (2004) Alang-alang
Alang-alang (Imperata cylindrica) pada umumnya masih dipandang sebagai tanaman pengganggu (weed) yang sangat merugikan dari pada sebagai pakan. Pandangan ini didasarkan pada sifatnya yang mudah sekali menyebar, sulit diberantas dan merupakan tanaman pengganggu yang paling merugikan kepada tanaman perkebunan dan tanaman pangan. Sedangkan penggunaan sebagai pakan masih sangat terbatas. Soewardi (1974) menyatakan bahwa penggunaan tanaman pengganggu seperti halnya alang-alang harus dipandang sebagai usaha untuk meningkatkan kegunaannya dan sejauh mungkin mengurangi sifat merusaknya. Penggunaan alang-alang sebagai hijauan pakan perlu memperhatikan faktor-faktor lain yang dipandang dari segi peternak itu sendiri, agar menguntungkan dan dapat dipertanggungjawabkan secara ekonomis maupun biologis (Soewardi, 1974).
Soerjani (1970) melaporkan bahwa alang-alang telah menempati tanah seluas 16 juta ha dan setiap tahunnya bertambah 150.000 ha. Berpatokan pada data Soerjani (1970) dan penelitian Soewardi (1974) maka padang alang-alang merupakan sumber bahan pakan yang sangat potensial dan akan membuka kemungkinan pengembangan peternakan di daerah kosong ternak. Alih fungsi alang-alang dapat mengatasi kekurangan bahan pakan di daerah padat ternak ,hal ini juga membantu mengurangi
kepadatan alang-alang sebagai tanaman pengganggu. Pertimbangan lain adalah bahwa pakan merupakan faktor pembatas utama pengembangan peternakan di Indonesia (Susetyo, et al 1977) dan ternak ruminansia selama ini bersaing dengan pertanian tanaman pangan dan tanaman perdagangan dalam penggunaan tanah.
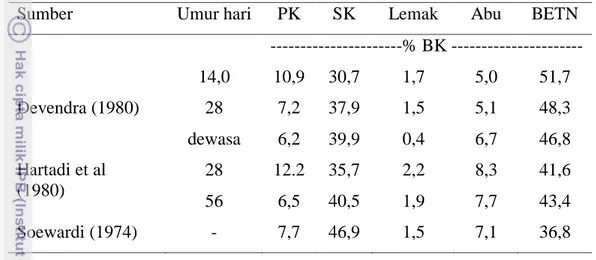
Tabel 3. Komposisi kimia Alang-Alang pada Berbagai Tingkat Umur
Sumber Umur hari PK SK Lemak Abu BETN
---% BK --- Devendra (1980) 14,0 10,9 30,7 1,7 5,0 51,7 28 7,2 37,9 1,5 5,1 48,3 dewasa 6,2 39,9 0,4 6,7 46,8 Hartadi et al (1980) 28 12.2 35,7 2,2 8,3 41,6 56 6,5 40,5 1,9 7,7 43,4 Soewardi (1974) - 7,7 46,9 1,5 7,1 36,8 Serat Sawit
Berdasarkan taksonominya, kelapa sawit digolongkan ke dalam divisi
Tracheopyta, subdivisio Pteropsida, kelas Angiospermae, subkelas
Monocotyledonae, ordo Cocoideae, famili Palmae, subfamili Cocoideae, genus
Elaeis dan spesies Elaeis guenensis Jacq (Lubis, 1992). Menurut Sofyan et al. (2000), terdapat dua tahap pengolahan kelapa sawit. Tahap pertama pengolahan kelapa sawit dari buah kelapa sawit yang menghasilkan minyak kelapa sawit (Crude Palm Oil), inti kelapa sawit, serat kelapa sawit dan lumpur kelapa sawit. Tahap kedua adalah pengolahan inti kelapa sawit yang menghasilkan minyak inti sawit dan bungkil kelapa sawit.
Industri kelapa sawit menghasilkan limbah agroindustri yang dapat dimanfaatkan oleh ternak, yaitu bungkil kelapa sawit, lumpur kelapa sawit, dan serat kelapa sawit (Mansjur, 1980). Angka konversi dari lumpur sawit adalah 30% dan serat 20%, sedangkan bungkil inti sawit 40-60% dari inti (Sofyan et al., 2000).
Produksi serat sawit tinggi, namun tidak diikuti dengan kualitasnya. Faktor yang menyebabkan limbah ini miskin akan nutrien, antara lain adanya kadar lignin dan kadar mineral yang tidak seimbang, serta kecernaannya rendah (Aritonang, 1986). Serat sawit mengandung serat kasar yang tinggi. Komponen serat kasar yang
tinggi (40,5-41,5 %) terdiri dari bagian-bagian berupa lignin, hemiselulosa, dan abu. Serat sawit merupakan limbah yang mengandung ikatan lignoselulolik, dimana selulosa tidak terdapat dalam bentuk bebas melainkan berikatan dengan lignin. Uji biologis menunjukkan bahwa limbah kelapa sawit tersebut lebih cocok untuk ruminansia, karena serat kasar yang tinggi menyamai komposisi rumput-rumputan (Aritonang, 1986). Serat kelapa sawit dapat diberikan pada ruminansia sebanyak 15-35% dari ransum (Sofyan et al., 2000).
Serat Kasar
Serat kasar merupakan fraksi dari karbohidrat yang tidak larut dalam basa dan asam encer setelah pendidihan masing-masing 30 menit (Sofyan et al.,2000). Serat kasar terdiri dari selulosa, hemiselulosa, dan lignin. Selulosa merupakan komponen utama penyusun dinding sel tumbuhan selain hemiselulosa dan lignin. Bagi hewan ruminansia, selulosa merupakan sumber energi bagi mikroorganisme dalam rumen dan sebagai bahan pengisi rumen, sedangkan bagi hewan-hewan monogastrik selulosa adalah komponen yang tidak dapat dicerna. Meskipun bagi hewan non-ruminansia selulosa tidak memiliki peran spesifik, namun keberadaannya penting dalam meningkatkan gerak peristaltik (Tillman et al.,1982).
Hemiselulosa adalah polisakarida pada dinding sel tanaman yang larut dalam alkali dan menyatu dengan selulosa. Hodrolisis hemiselulosa akan menghasilkan tiga jenis monosakarida yaitu xylan dan arabinosa dalam jumlah yang lebih banyak dan glukosa dalam jumlah yang lebih sedikit. Hidrolisa hemiselulosa dapat difermentasi oleh beberapa macam mikroorganisme yang mampu menggunakan gula pentosa sebagai substratnya (Sa’id, 1994). Selulosa dan hemiselulosa lebih mudah dihancurkan oleh mikroorganisme selulolitik, namun ikatan lignoselulosa menyebabkan pakan serat sulit untuk dicerna (Laconi, 1992). Lignoselulosa banyak terdapat dalam limbah pertanian yang terutama mengandung selulosa (40-60%), hemiselulosa (20-30%) dan lignin (15-30%).
Enzim Selulase
Enzim merupakan katalis hayati yaitu senyawa organik yang dihasilkan oleh sel-sel hidup (Pelczar dan Chan, 1986), terdiri dari satu atau beberapa gugus polipeptida (protein). Enzim dapat diproduksi dengan cara mengekstraksi komponen
tanaman, hewan dan mikroorganisme (Darwis dan Sukara, 1989). Tanpa enzim suatu reaksi selular akan berlangsung sangat lambat, bahkan mungkin tidak terjadi reaksi. Enzim bersifat sangat spesifik dalam mengkatalis reaksi, sehingga meskipun jumlah enzim ribuan di dalam sel dan substrat pun sangat banyak, tidak akan terjadi kekeliruan (Shahib, 1992).
Selulase adalah enzim yang dapat mendegradasi selulosa. Enzim ini mampu menghidrolisa selulosa menjadi gula sederhana atau glukosa (Mulyanto, 2005). Menurut Schlegel (1994) mekanisme pemecahan selulosa oleh selulase sekurang-kurangnya terdiri dari tiga enzim: (1) Enzim-enzim endo-β-1,4 glukanase mempengaruhi secara serentak ikatan β-1,4 di dalam makro molekul dan menghasilkan potongan-potongan besar berbentuk rantai dengan ujung-ujung bebas, (2) Enzim ekso-β-1,4 glukanase memotong mulai dari ujung-ujung rantai, disakarida selobiosa, (3) Enzim-enzim β glukosidase menghidrolisasi selobiosa dengan membentuk glukosa.
Enzim selulase bersifat indusibel yaitu enzim yang dihasilkan sebagai tanggapan terhadap jenis makanan yang terdapat di dalam lingkungan pertumbuhan organisme penghasilnya. Enzim selulase merupakan suatu kompleks enzim yang terdiri dari beberapa enzim yang bekerja terhadap satu atau bersama-sama menggunakan selulosa menjadi D-glukosa (Kim et al., 1984).
Mikroorganisme penghasil selulase adalah jamur dan bakteri. Menurut Landecker (1972) di antara mikroorganisme tanah yang ada ternyata jamur merupakan spesies yang paling baik kemampuan hidup dan daya saingnya dalam mengunakan sumber serat dibandingkan dengan mikroorganisme lainnya. Hal ini disebabkan karena jamur mempunyai laju pertumbuhan dan efisiensi tingkat metabolik dalam menghasilkan enzim yang tinggi. Selain itu jamur juga mempunyai kemampuan memproduksi senyawa tertentu seperti antibiotik yang bersifat toksik bagi mikroorganisme lainnya.
Bakteri selulolitik menghasilkan seperangkat enzim yang menghidrolisis selulosa kristal secara sinergis menjadi oligosakarida yang lebih kecil dan akhirnya menjadi glukosa yang berfungsi sebagai sumber karbon dan nutrien bagi pertumbuhan mikroorganisme tersebut. Enzim yang berperan dalam hidrolisis tersebut adalah selulase yang dihasilkan mikroorganisme sebagai respon terhadap
adanya selulosa pada lingkungan hidupnya dan proses tersebut berlangsung jika terjadi kontak antara sel bakteri dan permukaan selulosa (Ilmen et al., 1997)
Prosedur “viskometer” sangat peka dan spesifik untuk melihat kerja enzim endoselulose dan juga dapat dipakai untuk menganalisa kerja enzim endopolisakaridase selain dari enzim selulase. Metode yang berdasarkan pada pengukuran terhadap terbentuknya gula pereduksi merupakan metode yang mengukur aktivitas kedua enzim endoselulase dan eksoselulase. Pada prosedur ini sifat kimia dan biofisika dari substrat yang digunakan akan menentukan kekhususan enzim yang diamati. Selulosa dapat larut (CMC) terutama cocok untuk menganalisa aktivitas enzim endoselulase, sedangkan selulosa yang tidak larut seperti kapas atau kertas saring, cocok untuk menganalisa kerjasama dari endo dan eksoselulase (Irawadi, 1990)
METODE
Waktu dan Tempat
Penelitian dilaksanakan dari bulan Februari sampai dengan April 2009. Semua kegiatan dikonsentrasikan di Laboratorium Nutrisi Ternak Perah dan Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Materi
Alat
Alat yang digunakan pada penelitian adalah jarum ose, gelas ukur, labu
Erlenmeyer, tabung reaksi, tutup karet, isolasi panfix, hot plate, plastik tahan panas, bunsen, spoit, pipet mikro, stirer, pipet volumetrik, bulp, pH meter, sprayer, korek api, timbangan digital, autoclave, shaker bath, vortex, spektrofotometer UV 200 RS, sarung tangan dan alumunium foil.
Bahan
Bahan yang digunakan pada penelitian antara lain: cairan rumen, jerami padi, alang-alang, serat sawit, aquades, larutan DNS (dinitro salysilic), alkohol 70%, agar bacto, medium BHI (Brain Heart Infusion) Sigma, glukosa, celubiosa, cystein-HCl, resazurin, hemin, aquadest, buffer sitrat, phenol, NaOH, Na2SO4, larutan CMC
(carboxy metyl celullose) 2% dan larutan standar glukosa. Rancangan
Perlakuan
Perlakuan yang dilakukan dalam penelitian ini terdiri atas 2 faktor dengan tiga ulangan. Adapun kedua faktor tersebut adalah:
Faktor A : isolat bakteri yang diperoleh dari cairan rumen kerbau
Peubah yang diamati
Peubah yang diamati pada penelitian ini yaitu: 1. Populasi bakteri total
2. Aktivitas Enzim (CMC-ase)
3. Pola pertumbuhan isolat, waktu penggandaan (G) dan tingkat pertumbuhan konstan (µ)
Rancangan Percobaan
Percobaan ini menggunakan Rancangan Acak Lengkap (RAL) berpola faktorial 17 x 3 dengan 3 ulangan. Faktor A yaitu isolat bakteri yang diperoleh dari cairan rumen kerbau dan faktor B yaitu sumber serat sebagai media tumbuh. Model matematik yang digunakan dalam analisa statistik adalah:
Xijk = µ + αi + βj + γij + εijk
Keterangan: Xijk = Nilai pengamatan faktor A ke -i, faktor B ke-j dan ulangan ke-k;
µ = Nilai rataan umum; αi = Pengaruh faktor A (isolat) ke-i (i= 1,2,...,17); j =
Pengaruh faktor B (serat) ke-j (j= 1,2,3); γij = Pengaruh interaksi antara faktor A
(isolat) ke-i dan faktor B (serat) ke-j; εijk = Error (galat) ke-i, ke-j dan ke-k.
Data yang diperoleh dianalisis dengan menggunakan sidik ragam (Analysis of Variance) berdasarkan Mattjik dan Sumertajaya (2002). Selanjutnya, jika setiap perlakuan berbeda nyata maka dilakukan uji jarak Duncan.
Prosedur
Penelitian ini dilakukan dalam dua tahap percobaan. Tahap pertama dilakukan percobaan isolasi dari 3 cairan rumen kerbau berbeda yang berasal dari Jonggol. Tahap kedua dilakukan uji coba kemampuan dari bakteri hasil isolasi dalam mensekresikan enzim selulase.
Persiapan Sampel
Sampel diambil dari cairan rumen kerbau lokal yang diambil dari kawasan Kecamatan Jonggol, Bogor, Jawa Barat. Ternak kerbau terpilih merupakan ternak yang konsumsi hariannya berupa hijauan lokal dengan kualitas rendah yang tumbuh
di kawasan Jonggol dan sekitarnya. Selanjutnya kerbau dipotong di rumah potong hewan (RPH) Fakultas Peternakan, Institut Pertanian Bogor untuk diambil cairan rumennya dan dalam waktu singkat dimasukkan ke dalam termos agar suhu cairan rumen stabil dan mikroorganisme cairan rumen dapat bertahan hidup.
Sebagian dari cairan rumen dimasukkan ke dalam botol vial untuk dicampur dengan giserol pada konsentrasi 3% dan disimpan di freezer pada suhu -21 oC. Stok ini digunakan sebagai cadangan untuk penelitian berikutnya.
Metode Tahap I
Inkubasi dalam Sumber Serat
Inkubasi mikroba cairan rumen dilakukan menggunakan sembilan tabung. Masing-masing mikroba dalam cairan rumen yang berasal dari kerbau berbeda diinkubasikan dalam tiga tabung tersebut. Kesembilan tabung mempunyai media berupa sumber serat yang berbeda yaitu alang-alang, serat sawit dan jerami padi. Tabung 1 – 3 berisi media BHI (Brain Heart Infusion) berdasarkan (Triyani, 2002) yang telah di modifikasi sebanyak 5 ml dialiri CO2 (kondisi anaerob) dan 0,05 g
jerami padi. Tabung 4-6 berisi media BHI modifikasi 5 ml dialiri CO2 dan 0,05 g
serat sawit dan tabung 7-9 berisi media BHI modifikasi 5 ml dialiri CO2 dan 0,05 g
alang-alang. Sebelum cairan rumen dimasukkan, sembilan tabung tersebut disterilkan terlebih dahulu dengan menggunakan autoclave pada suhu 121 oC, tekanan 15 psi selama 15 menit.
Inkubasi mikroba cairan rumen diawali dengan memasukkan 0,1 ml cairan rumen kerbau A ke dalam tabung 1, 4 dan 7, cairan rumen B ke dalam tabung 2, 5 dan 8, serta cairan rumen C ke dalam tabung 3, 6 dan 9. Kemudian diinkubasi pada suhu 38,9 oC selama ± 3 hari. Dengan demikian diperoleh tiga sumber inokulum dengan tiga sumber serat.
Pengenceran Hasil Inkubasi
Pengenceran hasil inkubasi menggunakan media putih (Triyani, 2002). Pengenceran dilakukan dengan memasukkan 0,1 ml hasil inkubasi dari masing-masing tabung pada proses inkubasi ke dalam 9,9 ml media pengencer, selanjutnya diambil 0,1 ml dari tabung tersebut dan dimasukkan ke dalam 9,9 ml media
pengencer pada tabung berikutnya. Proses tersebut dilakukan beruang-ulang hingga tahap pengenceran 10-6. Kemudian sampel media diambil 0,1 ml untuk ditumbuhkan pada media padat. Inokulum dimasukkan ke dalam media yang sudah dalam kondisi padat dan menutupi seluruh dinding tabung reaksi.
Isolasi (pemurnian) Bakteri
Koloni bakteri yang tumbuh dalam setiap tabung diambil secara aseptif menggunakan ose dan dipindahkan ke media cair yang sudah disediakan. Media cair yang digunakan yaitu media BHI modifikasi (BHI + Serat) sebanyak 5 ml. Serat yang digunakan yaitu serat campuran (alang-alang, jerami padi dan serat sawit) sebanyak 0,05 gram pada setiap tabung. Satu tabung media cair diisi untuk satu koloni, kemudian diinkubasi pada suhu 39oC selama ± 3 hari. Selanjutnya bakteri hasil inkubasi tersebut diuji kemampuan tumbuhnya pada serat tunggal.
Uji Kemampuan Kultur Tunggal
Sebagai bagian dari proses screening dilakukan uji kemampuan isolat terhadap sumber pakan serat dan kemampuannya untuk tumbuh tunggal. Isolat terseleksi ditumbuhkan kembali dalam tabung reaksi yang berisi 5 ml media basal BHI dan 0,05 g serat dengan kondisi anaerob. Serat yang digunakan ada 3 macam yaitu serat sawit, jerami padi dan alang-alang. Kultur tersebut diinkubasi pada suhu 39°C dalam shaker water bath. Pertumbuhan bakteri ditentukan dengan mengukur kekeruhan secara kuantitatif dengan mengukur OD (Optical density) media menggunakan spektrofotometer pada panjang gelombang 600 nm. Diperoleh 17 isolat bakteri yang potensial sebagai pendegradasi pakan serat dalam rumen.
Metode Tahap II
Uji Aktivitas Enzim Selulase (Ghose, 1987)
Uji aktivitas enzim CMC-ase dilakukan berdasarkan pada metode Ghose (1987). Bahan yang disiapkan yaitu larutan DNS (asam di-nitro salisilat), larutan standar glukosa, larutan buffer sitrat, larutan buffer enzim (filtrat), larutan CMC (carboxy metil celullose). Selanjutnya filtrat enzim dipindahkan ke dalam tabung reaksi kecil sebanyak 0,5 ml. Kemudian ditambahkan 0,5 ml CMC 2% yang sudah
dilarutkan dalam buffer sitrat pH 5,0. Selanjutnya divortex beberapa detik dan diinkubasi pada suhu 50 oC selama 30 menit, kemudian tambahkan 3 ml
dinitrosalcylic acid untuk menghentikan reaksi. Kemudian dipanaskan pada air mendidih selama 5 menit dan didinginkan selama 20 menit lalu ditambah 2 ml aquades sebagai pengencer, selanjutnya dibaca dengan spektrofotometer pada λ 540 nm. Penghitungan aktivitas enzim selulase dilakukan dengan rumus:
Aktivitas Enzim = kadar glukosa x factor pengenceran
BM Glukosa x waktu inkubasi
Keterangan: BM glukosa : Berat Molekul glukosa (180); Waktu inkubasi : 30 menit Karakteristik Pertumbuhan Bakteri Selulolitik Rumen Kerbau
Percobaan ini bertujuan untuk mengetahui pola pertumbuhan bakteri, waktu penggandaan (G) dan tingkat pertumbuhan konstan (µ) isolat bakteri pada fase pertumbuhan logaritma atau eksponensial. Pengamatan dilakukan dengan melihat sifat pertumbuhan bakteri dalam media cair pengukuran massa sel (berat kering sel).
Dalam kajian ini digunakan tabung Hungate yang berisi media selulosa dan diinokulasi dengan 0,5 ml biakan bakteri uji dan diinkubasi pada water shaker bath
dengan suhu 39oC. Lama inkubasi dari masing-masing tabung adalah 2, 4, 6, 8 dan 10 jam. Pada akhir inkubasi dari setiap kultur dilakukan pengukuran absorbansi dengan menggunakan spektrofotometer pada panjang gelombang 600 nm. Semakin keruh menunjukkan populasi mikroba semakin tinggi.
Nilai μ ditentukan menggunakan rumus berikut (Cann, 2007):
μ = ((log 10 Nt - log 10 N0) 2,303) (t - t 0)
Keterangan: Nt: Jumlah sel pada waktu t;
N0: Jumlah sel pada waktu 0;
(t-to): selang waktu antara waktu ke t dan waktu ke 0
Dengan mengukur peningkatan jumlah sel selama periode waktu tertentu, tingkat pertumbuhan konstan (μ) dapat dihitung.
HASIL DAN PEMBAHASAN
Keadaan Kerbau dan Proses Penelitian
Ternak kerbau donor yang terpilih telah teradaptasi dengan lingkungan dengan sumber pakan berupa rumput lapang tanpa konsentrat selama hidupnya yang lebih dari satu tahun, sehingga diyakini kerbau tersebut mempunyai mikroba rumen yang unggul dalam mencerna serat. Kondisi dalam satu tahun di wilayah tersebut mempunyai karakter pakan yang cukup bervariasi. Pada musim hujan pakan hijauan dengan kualitas baik tersedia cukup banyak. Namun pada musim kemarau ketersediaan pakan terbatas dan kualitasnya sangat rendah dan sangat tinggi akan komponen serat. Kerbau yang digunakan pada saat akan disembelih berada dalam kondisi sehat (Gambar 2), demikian juga dengan kondisi rumennya diperkirakan dalam kondisi baik.
(A) (B)
(C)
Gambar 2. Kerbau A, B dan C asal Jonggol yang Digunakan Sebagai Sumber Inokulum
Pada penelitian ini dilakukan isolasi bakteri dari cairan rumen yang diperoleh dari kerbau tersebut. Bakteri yang terisolasi diyakini adalah bakteri rumen yang hidup mendominasi cairan rumen kerbau tersebut. Teknik isolasi dan
pengembangbiakan bakteri rumen telah didasarkan pada teknik yang telah dikembangkan dari teknik awal yang diperkenalkan Hungate sejak tahun 1966 (Hobson dan Stewart, 1992). Metode isolasi bakteri rumen kerbau pada penelitian ini menggunakan metode tabung berputar dimana mikroorganisme dibiakkan dalam tabung yang berisi media padat dan menempel tipis pada dinding tabung. Perkembangan bakteri selama seleksi telah dijamin melalui pengaliran CO2 selama
proses inokulasi untuk menjaga kondisi tetap dalam keadaan anaerob. Selama masa inkubasi tabung ditutup dengan penutup karet untuk menjaga kondisi agar tetap anaerob.
Masa inkubasi yang dilakukan pada penelitian ini yaitu selama 3 hari, disesuaikan dengan capaian pertumbuhan bakteri yang optimum (Widyastuti, 2004). Lama inkubasi tersebut untuk menjamin bahwa pertumbuhan bakteri telah optimum. Pertumbuhan bakteri cukup lamban karena media yang digunakan adalah pakan sumber serat. Semakin kompleks struktur substrat yang didegradasi, maka masa inkubasi untuk pertumbuhan bakteri juga semakin lama (Fondevila dan Dehority, 1995).
Isolat Bakteri yang Diperoleh
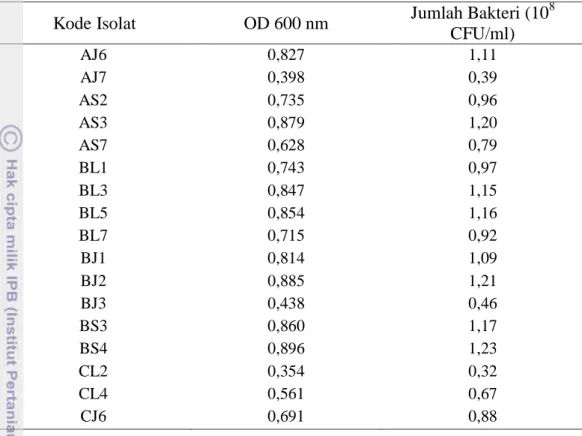
Isolasi bakteri dari tiga cairan rumen kerbau diperoleh 48 isolat. Isolat tersebut diyakini mampu hidup dalam media sumber serat. Namun isolat tersebut belum dapat dipastikan tingkat kemampuannya dalam mencerna serat. Untuk mengetahui hal tersebut isolat tersebut kemudian diseleksi kemampuan tumbuhnya dalam media tumbuh yang mengandung berbagai serat. Indikasi adanya bakteri yang hidup dalam media ditandai dengan timbulnya kekeruhan (Wulandari et al., 2005). Pertumbuhan bakteri dapat diamati melalui pengukuran dengan turbidimeter, dimana pertumbuhan bakteri yang dibiakkan sebanding dengan tingkat kekeruhan (Suyasa, 2007). Dari hasil seleksi tersebut diperoleh 17 isolat unggul (Tabel 4) yang dipilih berdasarkan tingkat kekeruhan secara kuantitatif berdasarkan OD 600 nm.
Tabel 4. Isolat Bakteri Terpilih dari Rumen Kerbau dengan Berbagai Substrat Serat Sebagai Media Tumbuh
Keterangan: kode isolat berdasarkan sumber cairan rumen (A, B, C) dan sumber serat (L: alang-alang, J: jerami padi, S: serat sawit) sebagai substrat. Contoh: AJ6 yaitu isolat ke-6 dari cairan rumen kerbau A dengan substrat jerami padi.
Populasi Bakteri Total
Pertumbuhan mikroba rumen merupakan fungsi dari pemanfaatan jumlah nutrien dan senyawa yang dihasilkannya dalam rumen. Produksi nutrien dan energi dalam cairan rumen sangat tergantung pada interaksi yang kompleks antara substrat yang difermentasi dan jenis mikroorganisme yang terlibat. Keseluruhan hasil fermentasi dalam rumen merupakan wujud saling ketergantungan di antara mikroorganisme rumen.
Dalam penelitian ini pengukuran populasi bakteri menggunakan metode turbidimetri. Metode ini berlandaskan pada kenyataan bahwa suatu populasi sel dalam medium cair akan menahan cahaya yang sebanding dengan total masanya atau konsentrasi sel dalam biakan. Dalam penggunaan turbidimetri, kekeruhan biakan bakteri dikorelasikan dengan beberapa metode penentuan lain seperti penentuan jumlah mikroba dengan metode penaburan. Maka setiap pengenceran yang telah diukur “optical density” nya dapat dihitung jumlah mikrobanya masing-masing
Kode Isolat OD 600 nm Jumlah Bakteri (10
8 CFU/ml) AJ6 0,827 1,11 AJ7 0,398 0,39 AS2 0,735 0,96 AS3 0,879 1,20 AS7 0,628 0,79 BL1 0,743 0,97 BL3 0,847 1,15 BL5 0,854 1,16 BL7 0,715 0,92 BJ1 0,814 1,09 BJ2 0,885 1,21 BJ3 0,438 0,46 BS3 0,860 1,17 BS4 0,896 1,23 CL2 0,354 0,32 CL4 0,561 0,67 CJ6 0,691 0,88 23
berdasarkan jumlah mikroba yang telah diperoleh dari metode penaburan tersebut (Muchtady dan Laksmi, 1980).
Pada penelitian ini populasi bakteri tidak dipengaruhi secara nyata oleh jenis serat maupun antar isolat (Tabel 5). Hal ini mengindikasikan bahwa isolat-isolat tersebut memiliki kemampuan yang sama dan konsisten dalam mencerna pakan sumber serat. Jenis isolat dengan substrat alang-alang menunjukkan jumlah populasi bakteri total yang lebih tinggi daripada isolat dengan substrat jerami padi dan serat sawit, seperti terlihat pada tabel 5. Hal ini diduga karena kandungan lignin pada serat alang-alang yang rendah (3,28%) sehingga isolat-isolat tersebut dapat membelah diri dengan cepat. Kandungan lignin pada serat jerami padi dan serat sawit berturut-turut adalah 21,75% dan 31,8%.
Tabel 5. Populasi Bakteri Total (108 CFU/ml) dari Isolat dalam Media Berupa Pakan Sumber Serat yang Berbeda
Keterangan: Tidak ada perbedaan nyata pada jenis serat maupun antar isolat bakteri. Kode
Isolat
Sumber Serat
Rataan Serat Sawit Jerami Padi Alang-Alang
AJ6 1,35 ± 0,29 1,49 ± 0,83 2,82 ± 0,52 1,89 ± 0,81 AJ7 1,39 ± 0,22 1,03 ± 0,40 1,87 ± 0,12 1,43 ± 0,42 AS2 1,24 ± 0,20 1,42 ± 0,38 2,45 ± 0,93 1,71 ± 0,64 AS3 1,19 ± 0,29 1,28 ± 0,27 1,85 ± 0,62 1,44 ± 0,36 AS7 1,36 ± 0,44 0,94 ± 0,48 1,56 ± 0,07 1,29 ± 0,31 BL1 1,41 ± 0,26 1,84 ± 0,81 2,63 ± 0,12 1,96 ± 0,61 BL3 1,50 ± 0,44 1,93 ± 0,42 2,18 ± 0,20 1,87 ± 0,34 BL5 1,47 ± 0,29 1,79 ± 0,24 2,48 ± 0,63 1,91 ± 0,52 BJ1 1,28 ± 0,47 1,79 ± 0,37 1,79 ± 0,87 1,62 ± 0,29 BL7 1,41 ± o,23 1,71 ± 0,49 2,63 ± 0,54 1,92 ± 0,63 BJ2 1,58 ± 0,34 1,60 ± 0,43 1,88 ± 0,68 1,69 ± 0,17 BJ3 1,26 ± 0,29 1,85 ± 0,54 1,28 ± 1,22 1,46 ± 0,33 BS3 1,09 ± 0,46 1,67 ± 0,59 1,17 ± 0,39 1,31 ± 0,31 BS4 1,16 ± 0,20s 1,28 ± 0,15 1,09 ± 0,45 1,17 ± 0,97 CL2 0,91 ± 0,36 0,89 ± 0,38 1,67 ± 0,92 1,16 ± 0,44 CL4 1,13 ± 0,37 0,96 ± 1,12 1,53 ± 0,38 1,21 ± 0,29 CJ6 1,58 ± 0,47 1,49 ± 0,15 2,08 ± 0,36 1,71 ± 0,31 Rataan 1,31±0,18 1,47±0,34 1,94±0,53 1,58 ± 0,28 24
Populasi bakteri paling tinggi terdapat pada biakan isolat BL7, BL1, BL5, dan AJ6. Hal ini menggambarkan bahwa isolat berkemampuan untuk tumbuh dan berkembang dengan memanfaatkan media berupa pakan sumber serat. Selain itu, populasi bakteri yang tumbuh pada serat alang-alang ini lebih tinggi dari pada populasi yang tumbuh pada sumber serat jerami padi dan serat sawit, tetapi aktivitas CMC-ase pada serat alang-alang lebih kecil. Hal ini diduga karena jumlah bakteri yang hidup pada serat alang-alang sedikit sehingga menyebabkan total enzim yang diproduksi bakteri menjadi rendah. Vanadianingrum (2008), menyatakan bahwa aktivitas enzim tidak dipengaruhi oleh jumlah populasi bakteri.
Aktivitas Enzim CMC-ase Isolat Bakteri pada Substrat Jerami Padi, Serat Sawit dan Alang-Alang
Enzim merupakan katalis hayati yang berupa senyawa organik dan dihasilkan oleh sel hidup (Pelczar dan Chan, 1986). Enzim dapat diproduksi dengan cara mengekstraksi sel tanaman, hewan, dan mikroorganisme (Darwis dan Sukara, 1990). Selulase adalah enzim yang dapat mendegradasi selulosa menjadi gula sederhana atau glukosa (Mulyanto, 2005). Enzim selulase terdiri atas tiga komponen enzim utama yaitu endoglukanase, eksoglukanase, dan β-glukosidase (Irawadi, 1990). Pengukuran aktivitas enzim CMC-ase dilakukan dengan cara mengukur banyaknya gula pereduksi berupa glukosa yang dihasilkan selama hidrolisis substrat CMC. Isolat bakteri dalam penelitian ini menghasilkan aktivitas enzim selulase yang beragam. Hal ini menunjukkan bahwa isolat tersebut termasuk golongan bakteri selulolitik karena bakteri tersebut memiliki kemampuan untuk melakukan proses pemecahan selulosa menjadi struktur yang lebih sederhana.
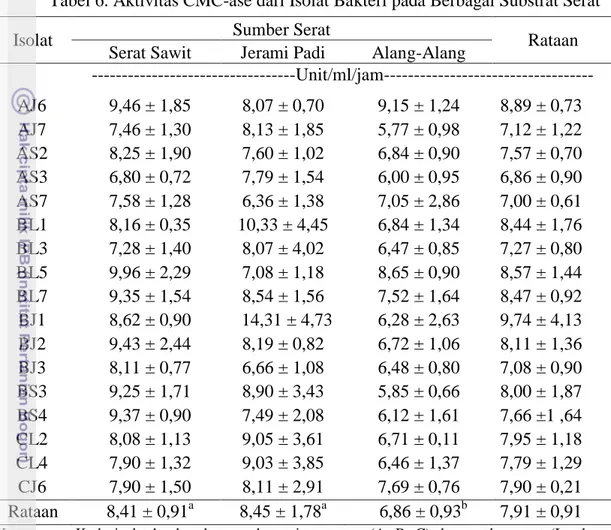
Isolat yang diperoleh menunjukkan perbedaan aktivitas CMC-ase pada pakan serat yang berbeda (Tabel 6). Aktivitas CMC-ase rata-rata yang paling tinggi ditemukan pada pakan serat jerami padi sebesar 8,62 unit/ml dan diikuti pada serat sawit sebesar 8,41 unit/ml. Aktivitas selulase isolat bakteri yang tinggi kemungkinan disebabkan oleh kadar selulosa yang lebih mudah terhidrolisis dan jumlahnya cukup tinggi yaitu 43,67% pada jerami padi dan 39,04% pada serat sawit, sehingga bakteri rumen tersebut menghasilkan selulase dalam jumlah yang tinggi pula untuk menghidrolisis selulosa pada jerami padi dan serat sawit. Aktivitas CMC-ase pada alang-alang paling kecil diantara serat yang lainnya. Hal ini sesuai dengan
kandungan selulosa alang-alang yaitu 31,77% lebih rendah dari pada dua serat lainnya.
Tabel 6. Aktivitas CMC-ase dari Isolat Bakteri pada Berbagai Substrat Serat
Keterangan: Kode isolat berdasarkan sumber cairan rumen (A, B, C) dan sumber serat (L: alang-alang, J: jerami padi, S: serat sawit) sebagai substrat. Contoh: AJ6 yaitu isolat ke-6 dari cairan rumen kerbau A dengan substrat jerami padi; Superskrip dengan huruf kecil yang berbeda pada baris yang sama menunjukkan perbedaan (P<0.05)
Hasil penelitian Sekarsari (2003) yang mengukur aktivitas CMC-ase pada jerami padi oleh isolat bakteri selulolitik rumen bernilai 0,00959 unit/ml, hasilnya lebih rendah dibandingkan dengan hasil penelitian ini. Selulosa pada substrat pakan dapat menginduksi bakteri untuk menghasilkan selulase. Suryahadi et al. (1996) menyatakan bahwa aktivitas bakteri selulolitik dari ternak kerbau lebih tinggi dibanding ternak sapi (43,2% vs 16,3%/hari).
Jenis isolat bakteri juga memberikan respon yang berbeda pada serat. Isolat BJ1 yang berasal dari cairan rumen kerbau B dengan media tumbuh jerami padi diketahui memiliki nilai paling tinggi (9,74 unit/ml/jam) dibanding isolat-isolat lain yang berkisar antara 6,86-8,89 unit/ml/jam. Perbedaan nilai aktivitas enzim selulase
Isolat Sumber Serat Rataan
Serat Sawit Jerami Padi Alang-Alang
---Unit/ml/jam--- AJ6 9,46 ± 1,85 8,07 ± 0,70 9,15 ± 1,24 8,89 ± 0,73 AJ7 7,46 ± 1,30 8,13 ± 1,85 5,77 ± 0,98 7,12 ± 1,22 AS2 8,25 ± 1,90 7,60 ± 1,02 6,84 ± 0,90 7,57 ± 0,70 AS3 6,80 ± 0,72 7,79 ± 1,54 6,00 ± 0,95 6,86 ± 0,90 AS7 7,58 ± 1,28 6,36 ± 1,38 7,05 ± 2,86 7,00 ± 0,61 BL1 8,16 ± 0,35 10,33 ± 4,45 6,84 ± 1,34 8,44 ± 1,76 BL3 7,28 ± 1,40 8,07 ± 4,02 6,47 ± 0,85 7,27 ± 0,80 BL5 9,96 ± 2,29 7,08 ± 1,18 8,65 ± 0,90 8,57 ± 1,44 BL7 9,35 ± 1,54 8,54 ± 1,56 7,52 ± 1,64 8,47 ± 0,92 BJ1 8,62 ± 0,90 14,31 ± 4,73 6,28 ± 2,63 9,74 ± 4,13 BJ2 9,43 ± 2,44 8,19 ± 0,82 6,72 ± 1,06 8,11 ± 1,36 BJ3 8,11 ± 0,77 6,66 ± 1,08 6,48 ± 0,80 7,08 ± 0,90 BS3 9,25 ± 1,71 8,90 ± 3,43 5,85 ± 0,66 8,00 ± 1,87 BS4 9,37 ± 0,90 7,49 ± 2,08 6,12 ± 1,61 7,66 ±1 ,64 CL2 8,08 ± 1,13 9,05 ± 3,61 6,71 ± 0,11 7,95 ± 1,18 CL4 7,90 ± 1,32 9,03 ± 3,85 6,46 ± 1,37 7,79 ± 1,29 CJ6 7,90 ± 1,50 8,11 ± 2,91 7,69 ± 0,76 7,90 ± 0,21 Rataan 8,41 ± 0,91a 8,45 ± 1,78a 6,86 ± 0,93b 7,91 ± 0,91 26
dari masing-masing isolat bakteri menunjukkan bahwa isolat yang diperoleh berasal dari spesies bakteri yang berbeda. Isolat bekteri yang diperoleh mempunyai sifat spesifik dalam mendegradasi komponen-komponen substrat. Isolat JB1 diduga memiliki kemampuan mendegradasi substrat secara optimal dengan menggunakan selulosa sebagai komponen utama media dan memiliki kemampuan mensekresikan enzim dalam jumlah yang banyak. Kemampuan isolat bakteri memproduksi enzim selulase menjadikannya mampu menghidrolisis selulosa yang terdapat pada substratnya menjadi glukosa yang dapat dijadikan sumber karbon bagi pertumbuhannya.
Pertumbuhan Isolat Bakteri
Pertumbuhan umum digunakan untuk bakteri dan mikroorganisme lain dan biasanya mengacu pada perubahan di dalam hasil panen sel (pertambahan total massa sel) dan bukan perubahan individu organisme. Selama fase pertumbuhan seimbang, pertambahan massa bakteri berbanding lurus dengan pertambahan komponen selular yang lain seperti DNA, RNA dan protein (Pelczar dan Chan, 1986).
Berdasarkan kurva pertumbuhan terlihat bahwa setelah bakteri diinokulasi terdapat periode dimana tidak tampak adanya suatu pertumbuhan, yang dikenal sebagai fase lamban atau lag phase. Kemudian diikuti oleh suatu periode pertumbuhan yang cepat (fase logaritma). Pada fase ini kultur paling sensitif terhadap keadaan lingkungan dan pertumbuhannya mencapai maksimum (Stanbury dan Whitaker, 1984). Fase berikutnya adalah fase tetap atau stationary phase, pada fase ini jumlah populasi sel tetap karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati. Pada fase tersebut sel lebih tahan terhadap keadaan ekstrim seperti panas, dingin, radiasi dan bahan kimia. Kemudian fase kematian atau fase penurunan, dimana laju pertumbuhan diperlambat karena jumlah nutrisi berkurang dan adanya hasil metabolisme yang beracun.
Fase pertumbuhan logaritma atau eksponensial tidak mewakili pola pertumbuhan yang normal, melainkan hanya merupakan satu bagian terpilih dari kurva pertumbuhan normal. Pada fase logaritma populasi bertambah secara teratur menjadi dua kali lipat pada interval waktu tertentu. Fase pertumbuhan ini disebut juga pertumbuhan seimbang. Berdasarkan hasil pengamatan pola pertumbuhan 17
isolat dalam medium cair (Tabel 7) menunjukkan rata-rata fase adaptasi hingga jam keempat, hal ini disebabkan bakteri mengalami proses adaptasi terhadap lingkungannya yang cukup lama, karena pada fase ini tidak ada pertambahan populasi bakteri, hanya terjadi penambahan komposisi kimiawi dan bertambah ukurannya saja.
Tabel 7. Pertumbuhan Isolat dengan Pengukuran Nilai Absorbansi
Isolat Pengamatan jam ke
2 4 6 8 10 12 BL7 0,034 0,464 0,520 0,519 0,500 0,501 BS4 0,008 0,207 0,478 0,445 0,410 0,424 BJ1 0,028 0,268 0,426 0,465 0,431 0,397 BL3 0,029 0,282 0,422 0,408 0,435 0,423 BL1 0,009 0,079 0,472 0,473 0,477 0,480 AS7 0,003 0,141 0,301 0,316 0,340 0,373 AS3 0,009 0,159 0,295 0,381 0,391 0,407 BJ3 0,023 0,223 0,401 0,429 0,427 0,421 BL5 0,004 0,021 0,259 0,385 0,423 0,546 AJ6 0,014 0,132 0,430 0,447 0,463 0,506 BJ2 0,042 0,262 0,415 0,420 0,424 0,412 BS3 0,017 0,289 0,448 0,456 0,400 0,458 CL2 0,009 0,164 0,324 0,391 0,409 0,424 AS2 0,005 0,026 0,198 0,320 0,410 0,438 CJ6 0,010 0,053 0,276 0,361 0,401 0,423 AJ7 0,001 0,014 0,191 0,449 0,419 0,455 CL4 0,009 0,054 0,250 0,354 0,392 0,429
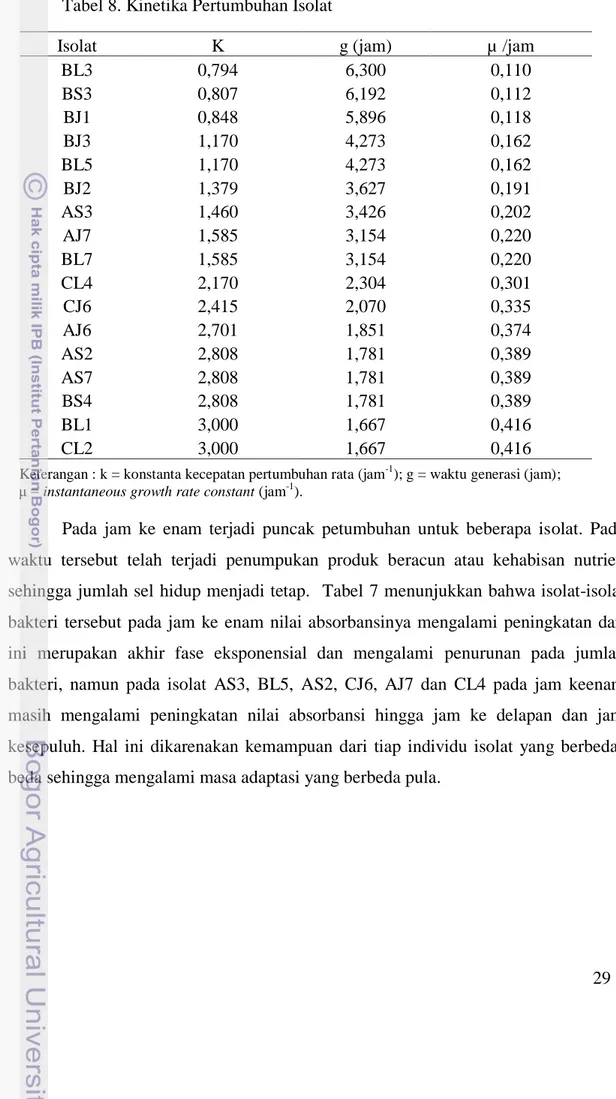
Fase logaritmik terjadi antara jam ke empat dan jam ke enam dan tingkat pertumbuhan konstan (µ) yang terjadi yaitu berkisar dari 0,110 sampai 0,416/jam (Tabel 8). Sel membelah dengan laju yang konstan, massa menjadi dua kali lipat dengan laju yang sama, sehingga keadaan pertumbuhan menjadi seimbang. Menurut Lay (1994), tinggi rendahnya laju pertumbuhan dipengaruhi oleh ketersediaan nutrisi, suhu, tekanan osmotik, pH dan kadar O2. Isolat yang memiliki waktu
generasi tercepat terjadi pada isolat CL2 yaitu isolat yang berasal dari rumen kerbau B dengan media tumbuh serat alang-alang.
Tabel 8. Kinetika Pertumbuhan Isolat
Keterangan : k = konstanta kecepatan pertumbuhan rata (jam-1); g = waktu generasi (jam); μ = instantaneous growth rate constant (jam-1
).
Pada jam ke enam terjadi puncak petumbuhan untuk beberapa isolat. Pada waktu tersebut telah terjadi penumpukan produk beracun atau kehabisan nutrien sehingga jumlah sel hidup menjadi tetap. Tabel 7 menunjukkan bahwa isolat-isolat bakteri tersebut pada jam ke enam nilai absorbansinya mengalami peningkatan dan ini merupakan akhir fase eksponensial dan mengalami penurunan pada jumlah bakteri, namun pada isolat AS3, BL5, AS2, CJ6, AJ7 dan CL4 pada jam keenam masih mengalami peningkatan nilai absorbansi hingga jam ke delapan dan jam kesepuluh. Hal ini dikarenakan kemampuan dari tiap individu isolat yang berbeda-beda sehingga mengalami masa adaptasi yang berberbeda-beda pula.
Isolat K g (jam) µ /jam
BL3 0,794 6,300 0,110 BS3 0,807 6,192 0,112 BJ1 0,848 5,896 0,118 BJ3 1,170 4,273 0,162 BL5 1,170 4,273 0,162 BJ2 1,379 3,627 0,191 AS3 1,460 3,426 0,202 AJ7 1,585 3,154 0,220 BL7 1,585 3,154 0,220 CL4 2,170 2,304 0,301 CJ6 2,415 2,070 0,335 AJ6 2,701 1,851 0,374 AS2 2,808 1,781 0,389 AS7 2,808 1,781 0,389 BS4 2,808 1,781 0,389 BL1 3,000 1,667 0,416 CL2 3,000 1,667 0,416 29
KESIMPULAN DAN SARAN
Kesimpulan
Sebanyak 17 isolat berhasil diisolasi dari tiga sumber cairan rumen kerbau. Isolat-isolat tersebut mempunyai kemampuan tumbuh dan berkembang pada substrat jerami padi, serat sawit dan alang-alang. Aktivitas enzim dalam mendegradasi selulosa pada pakan serat tertinggi dicapai oleh isolat BJ1 (9,74 unit/ml/jam) dan terendah oleh isolat AS7 (6,86 unit/ml/ jam). Jumlah bakteri total terbanyak dicapai oleh isolat BLI (1,96 x 108 CFU/ml) dan terendah oleh isolat BS4 (1,17 x 108 CFU/ml) dan waktu generasi tercepat dicapai oleh isolat CL2 (1,667 jam).
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui fermentabilitas dan kecernaan secara in vitro serta identifikasi bakteri sehigga dapat diketahui spesiesnya.