VALIDASI METODE ANALISIS ALOPURINOL DALAM TABLET SECARA SPEKTROFOTOMETRI DAN JAMU SECARA
KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK SERTA APLIKASINYA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh : Ria Kusuma Dewi NIM : 108114047
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
TINGGI FASE TERBALIK SERTA APLIKASINYA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh : Ria Kusuma Dewi NIM : 108114047
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Esa atas
berkat dan kasih-Nya sehingga penelitian dan penyusunan skripsi yang berjudul
Validasi Metode Analisis Alopurinol Dalam Tablet Secara Spektrofotometri Dan
Jamu Secara Kromatografi Cair Kinerja Tinggi Fase Terbalik Serta Aplikasinya
dapat terselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat
untuk meraih gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi, Universitas
Sanata Dharma, Yogyakarta.
Dalam pelaksanaan penelitian hingga selesainya penyusunan skripsi ini,
penulis mendapat banyak dukungan dan bantuan dari berbagai pihak. Oleh karena
itu, penulis mengucapkan terima kasih kepada:
1. Aris Widayati, M.Si, Ph.D., Apt. Selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Prof. Dr. Sri Noegrohati, Apt selaku dosen pembimbing yang dengan
sabar memberikan pengarahan, masukan, kritik dan saran baik selama
penelitian maupun penyusunan skripsi ini.
3. Jeffry Julianus, M.Si selaku dosen penguji atas saran, kritik dan masukan
yang telah diberikan.
4. Florentinus Dika Octa Riswanto M.Sc selaku dosen penguji atas saran,
kritik dan masukan yang telah diberikan.
5. Sanjayadi, M.Si yang telah membantu penulis dalam penyusunan skripsi
viii
6. Dewi Setyaningsih, M.Sc. Apt yang telah membantu penulis dalam
melakukan penelitian di laboratorium.
7. Seluruh staf laboratorium kimia fakultas farmasi Universitas Sanata
Dharma : Mas Bimo, Pak Parlan, Mas Kunto, Mas Agung, Pak Ketul, Pak
Darto yang telah banyak membantu selama penelitian di laboratorium.
8. Meta Kartika Sari dan Sugiarto Adji Soenarso atas perjuangan bersama
selama penelitian ini. Semuanya sangat bermakna dan menambah banyak
pengalaman.
9. Farmasi kelas A dan FST A 2010 kebersamaan selama ini menjadikan
hidup menjadi berwarna.
10.Mama, papa, dan adik tercinta yang selalu mendukung baik dari segi moril
materiil sehingga dapat terselesaikannya penelitian ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan
skripsi ini, sehingga segala kritik dan saran yang membangun sangat penulis
harapkan. Semoga skripsi ini dapat membantu dan bermanfaat bagi pembaca pada
khususnya ilmu pengetahuan.
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN SKRIPSI ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERSETUJUAN PUBLIKASI KARYA ... vi
x
D. Spektrofotometri Ultraviolet ... 11
1. Instrumentasi Spektrofotometri Ultraviolet ... 11
2. Interaksi Elektron Dengan Radiasi Elektromangnet ... 12
3. Hukum Lambert Beer ... 13
E. Kromatografi Cair Kinerja Tinggi ... 13
1. Instrumentasi KCKT ... 14
BAB III METODOLOGI PENELITIAN ... 30
A. Jenis Penelitian ... 30
I. Metode Spektrofotometri ... 31
xi
2. Pembakuan NaOH 0,1 N ... 32
3. Pengamatan panjang gelombang pengamatan ... 32
4. Pembuatan larutan baku alopurinol ... 32
5. Uji keseragaman bobot tablet alopurinol ... 33
6. Validasi analisis dalam tablet alopurinol ... 33
7. Penetapan kadar alopurinol dalam tablet ... 34
II. Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik ... 35
1. Penentuan panjang gelombang pengamatan alopurinol ... 35
2. Pembuatan fase gerak ... 35
3. Kurva baku alopurinol ... 35
4. Kurva baku alopurinol dalam matriks jamu ... 36
5. Pengaruh matriks jamu pada penetapan kadar alopurinol ... 37
6. Validasi metode analisis dalam jamu ... 37
7. Penetapan kadar alopurinol dalam jamu ... 38
G. Analisis Hasil ... 40
BAB IV HASIL DAN PEMBAHASAN... 44
A. Validasi metode analisis alopurinol secara spektrofotometri ... 45
1. Pembuatan dan pembakuan larutan NaOH 0,1 N ... 45
2. Penentuan panjang gelombang pengamatan ... 47
3. Pembuatan kurva baku alopurinol ... 48
4. Validasi metode analisis pada tablet ... 50
i. Akurasi pada tablet alopurinol ... 50
ii.Presisi pada tablet alopurinol ... 51
iii. LOQ pada tablet alopurinol ... 51
5. Penetapan kadar alopurinol pada tablet ... 52
B. Validasi metode analisis alopurinol secara KCKT ... 55
1. Penentuan panjang gelombang pengamatan ... 55
2. Pembuatan fase gerak ... 57
3. Kurva baku alopurinol ... 58
xii
5. Pengaruh matriks jamu dalam penetapan kadar alopurinol ... 62
6. Validasi metode analisis dalam jamu ... 64
i. Linearitas ... 64
ii. Akurasi ... 65
iii. Presisi ... 65
iv. LOQ ... 66
7. Penetapan kadar alopurinol dalam jamu ... 66
BAB V KESIMPULAN DAN SARAN ... 67
A. Kesimpulan ... 67
B. Saran ... 67
DAFTAR PUSTAKA ... 68
LAMPIRAN ... 72
xiii
DAFTAR TABEL
Halaman
Tabel I Modifikasi silika pada kolom dan aplikasinya ... 21
Tabel II Nilai indeks polaritas pelarut ... 23
Tabel III Kriteria rentang recovery ... 25
Tabel IV Kriteria presisi yang dapat diterima... 27
Tabel V Panjang gelombang maksimum alopurinol dengan pelarut NaOH 0,1 N ... 47
Tabel VI Kurva baku alopurinol ... 49
Tabel VII Rata-rata penetapan % recovery pada tablet alopurinol . 50 Tabel VIII Persen koefisien variasi dari metode penambahan baku 51
Tabel IX Penyimpangan bobot rata-rata pada tablet ... 53
Tabel X Keseragaman bobot tablet alopurinol ... 53
Tabel XI Kadar alopurinol dalam tablet ... 54
Tabel XII Panjang gelombang maksimum alopurinol dengan pelarut amonium hidroksida 5% dalam metanol ... 56
Tabel XIII Kurva baku alopurinol periode I ... 59
Tabel XIV Hubungan r dengan n ... 60
Tabel XV Kurva baku alopurinol periode II ... 60
Tabel XVI Kurva adisi alopurinol dalam matriks jamu ... 62
xiv
dan kurva adisi alopurinol dalam matriks jamu ... 63
Tabel XVIII Hasil uji t slope kurva baku alopurinol dalam pelarut periode II
dan kurva adisi alopurinol dalam matriks jamu ... 63
Tabel XIX Persen koefisien variasi dari metode penambahan baku 65
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur alopurinol ... 6
Gambar 2. Mekanisme kerja alopurinol ... 7
Gambar 3. Diagram tingkat energi elektronik ... 13
Gambar 4. Pelebaran puncak selama pemisahan dalam KCKT ... 19
Gambar 5. Reaksi kalium biftalat dengan NaOH ... 44
Gambar 6. Reaksi fenolftalein dengan NaOH ... 46
Gambar 7. Bentuk spektra panjang gelombang maksimum alopurinol dengan pelarut NaOH 0,1 N ... 48
Gambar 8. Plot kurva baku alopurinol ... 49
Gambar 9. Bentuk spektra panjang gelombang maksimum alopurinol dengan pelarut amonium hidroksida 5% dalam metanol ... 57
Gambar 10. Interaksi amonium hidroksida dengan residu silanol dalam Kolom C18 ... 58
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Sertifikat analisis baku alopurinol ... 73
Lampiran 2. Sertifikat analisis SPE MCX ... 74
Lampiran 3. Perhitungan indeks polaritas NaOH 0,1 N dan
amonium hidroksida 5% dalam metanol ... 75
Lampiran 4. Perhitungan pembakuan NaOH 0,1 N ... 76
Lampiran 5. Spektogram pada penetapan panjang gelombang
maksimum dengan pelarut NaOH 0,1 N ... 77
Lampiran 6. Pembuatan kurva baku pada metode
spektrofotometri ... 79
Lampiran 7. Data kadar alopurinol dalam tablet dan contoh
perhitungan ... 80
Lampiran 8. Akurasi alopurinol pada tablet ... 83
Lampiran 9. Penimbangan bahan untuk akurasi sampel pada tablet... 85
Lampiran 10. Perhitungan LOQ untuk metode spektrofotometri ... 88
Lampiran 11. Spektogram scanning panjang gelombang maksimum
alopurinol dengan pelarut amonium hidroksida 5%
dalam metanol ... 90
Lampiran 12. Kromatogram kurva baku alopurinol periode II ... 92
xvii
baku pada metode KCKT ... 98
Lampiran 14. Contoh perhitungan uji t untuk slope kurva baku adisi dalam matriks dan kurva baku dalam pelarut ... 100
Lampiran 15. Kromatogram kurva baku adisi alopurinol dalam Matriks jamu ... 101
Lampiran 16. Data penimbangan sampel ... 111
Lampiran 17. Kromatogram sampel A ... 114
Lampiran 18. Kromatogram sampel B ... 116
Lampiran 19. Kromatogram sampel C ... 118
xviii INTISARI
Alopurinol merupakan zat aktif yang digunakan untuk mengatasi asam urat. Identifikasi alopurinol dilakukan pada sampel tablet dan jamu. Alopurinol memiliki gugus kromofor dan auksokrom sehingga dapat dianalisis dengan metode spektrofotometri. Batas kuantitasi alopurinol dengan metode spektrofotometri adalah 15.58 g/mg. Pada sampel jamu batas kuantifikasinya 0,52g/mg sedangkan pada sampel tablet batas kuantifikasinya 300 g/mg oleh karena itu metode spektrofotometri lebih tepat digunakan dalam sampel tablet.
Metode spektrofotometri menggunakan pelarut NaOH 0,1 N, digunakan panjang gelombang maksimum 257 nm. Parameter validasi yang diteliti meliputi akurasi, presisi, LOQ. Hasil menunjukkan akurasi dinyatakan recovery sebesar 98,6-100,3%; presisi dinyatakan dengan nilai CV0.4-0.6%; sensitivitas dinyatakan nilai LOQ yang diperoleh 1,46 µg/ mg bobot sampel. Kadar alopurinol dalam tablet adalah 311,6 mg/g tablet.
Identifikasi alopurinol dalam jamu menggunakan metode Kromatografi Cair Kinerja Tinggi yang disertai ekstraksi cair cair dan proses clean up dengan SPE MCX. Metode ini menggunakan KCKT fase terbalik dengan kolom shimadzu C18 (250 x 4,6 mm, 5 μm), fase gerak campuran metanol : amonium
hidroksida 0,1% dalam akuabides (10:90), kecepatan alir 0,5 mL/menit dan detektor UV 274 nm. Hasil menunjukkan bahwa metode memiliki linearitas dengan r = 0,967; akurasi tidak dapat ditentukan, presisi dinyatakan dengan nilai % CV sebesar 0,1-0,6%; LOQ tidak dapat ditentukan.
xix ABSTRACT
Allopurinol is an active substance that is used to treat gout. Identification of allopurinol was performed on tablets and herbal medicine. Allopurinol has chromophore and auxochrome group which can be analyzed by spectrophotometric method. Limit of quantitation allopurinol with spectrophotometric method is 15,58 µg/mg. Limit quantification in herbal medicine samples is 0,52 µg / mg while in the tablet sample is 300 μg/mg therefore spectrophotometric method is more precise used in tablet samples.
Spectrophotometric method using solvent NaOH0.1 N , use maximum wavelength257 nm. Validation parameters examined included accuracy, precision, LOQ. The results obtain a good validity with % recovery 98.6-100.3%; % CV 0.4-0.6%; LOQ of 1.46 mg / mg. Levels of allopurinol in tablets was 311,6 mg /gtablet.
Identification of allopurinol in herbal medicine using High Performance Liquid Chromatography with extraction and clean-up. This method uses a reversed-phase HPLC with a Shimadzu C18 column (250 x 4.6 mm, 5 µ m), mobile
phase methanol: ammonium hydroxide 0,1 % in aquabidest (10:90), flow rate of 0.5 mL/ min and 274 nm UV detector. The results show that the method has linearity r = 0.967; accuracy can not determined, CV 0.1 to 0.6%; LOQ can not determined.
1 BAB I
PENGANTAR
A. Latar Belakang
Penyakit asam urat merupakan salah satu masalah kesehatan yang sering
dialami oleh masyarakat di Indonesia. Kebiasaan dan pola hidup yang kurang baik
serta mengkonsumsi makanan yang tinggi purin akan meningkatkan prevalensi
penyakit ini (Iskandar, 2006).
Salah satu obat yang yang banyak dipasarkan di Indonesia untuk
mengobati penyakit asam urat adalah alopurinol. Produk alopurinol yang banyak
beredar di pasaran dalam bentuk tablet dimana bentuk tablet lebih praktis dan
nyaman untuk penggunaannya (Iskandar, 2006).
Aktivitas farmakologis dan efektivitas terapi dapat tercapai ketika dosis
obat yang digunakan tepat. Oleh karena itu, dibutuhkan penjaminan mutu dan
kualitas zat aktif dalam suatu sediaan obat, yang salah satunya adalah penjaminan
kesesuaian dosis sediaan obat terhadap label klaim pada kemasan. Tujuan
penjaminan mutu ini adalah untuk melindungi konsumen agar tetap mendapatkan
obat dengan kualitas zat aktif yang tepat. Dalam penjaminan mutu suatu sediaan
obat dibutuhkan metode yang tervalidasi. Pada penelitian ini dilakukan proses
validasi metode spektrofotometri ultraviolet.
Untuk mengatasi penyakit asam urat tidak hanya digunakan produk obat
sintesis, masyarakat Indonesia juga menggunakan produk obat tradisional jamu
menyebabkan masyarakat mulai beralih dari penggunaan obat moderen ke
penggunaan obat tradisional. Pertimbangan berdasarkan pada aspek ekonomi dan
keamanan bagi kesehatan menjadi dua alasan mendasar dimana masyarakat mulai
beralih ke penggunaan obat tradisional. Penggunaan obat tradisional terus
berkembang secara luas dan digunakan di seluruh dunia selama beberapa dekade
terakhir ini. Menurut WHO, 65-80% populasi dunia menggunakan obat
tradisional sebagai pelindungan untuk kesehatan (Yee, 2003).
Berdasarkan Keputusan Kepala Badan POM no.HK.00.05.41.1384 tahun
2005,obat tradisional tidak boleh mengandung bahan kimia obat atau hasil sintesis
yang berkhasiat sebagai obat.
Untuk keamanan konsumen, harus dilakukan penelitian untuk
mengidentifikasi dan mengkuantifikasi adanya penambahan obat sintetis ke dalam
jamu asam urat. Jaminan kualitas terhadap produk tradisional jenis jamu penting
dilakukan. Tujuan dari penjaminan kualitas adalah terciptanya produk yang
berkhasiat dan aman pada obat tradisional khususnya jamu. Penjaminan kualitas
pada jamu memerlukan metode yang tervalidasi meliputi linearitas, akurasi,
presisi dan sensitivitas yang baik (Snyder, 2010). Pemilihan metode penetapan
kadar yang akan digunakan untuk analisis kuantitatif sangat penting, karena akan
mempengaruhi validitas data yang diperoleh.
Validitas metode merupakan proses yang dilakukan melalui penelitian
laboratorium untuk membuktikan bahwa karakteristik kinerja metode itu
validasi metode adalah untuk membuktikan dan menjamin bahwa metode analisis
yang digunakan memiliki validitas yang baik sehingga hasilnya dapat dipercaya.
Pada penelitian ini dilakukan proses validasi terhadap sistem KCKT
(Kromatografi Cair Kinerja Tinggi) fase terbalik hasil optimasi dalam rangkaian
penelitian penetapan kadar alopurinol dalam jamu. Berdasarkan hasil optimasi
yang diperoleh kondisi optimal sistem KCKT fase terbalik menggunakan fase
diam C18 dan fase gerak metanol : amonium hidroksida 0,1% dalam akuabides
(10:90) dengan flow rate 0,5 mL/menit yang selanjutnya digunakan sebagai
sistem acuan pada proses validasi ini.
1. Permasalahan
Berdasarkan latar belakang tersebut permasalahan yang mucul adalah
a. Apakah metode spektrofotometri UV memenuhi parameter
validitas akurasi, presisi dan LOQ (Limit of Quantitation) serta
berapakah kadar alopurinol yang terdapat dalam tablet?
b. Apakah metode KCKT fase terbalik standar adisi alopurinol
dalam matriks jamu memenuhi parameter validitas linearitas,
akurasi, presisi dan LOQ ( Limit of Quantitation) serta berapakah
kadar alopurinol yang terdapat dalam matriks jamu?
2. Keaslian Penelitian
Berbagai penelitian telah dilakukan mengenai evaluasi dan analisis baik
kualitatif maupun kuantitatif sediaan obat tradisional. Penelitian sejenis yaitu
oleh (Mayasari, 2009). Optimasi Metode Identifikasi Antalgin dan Klorfeniramin
secara KCKT Photodiode Array Setelah Pemisahan dengan Solid Phase
Extraction pada Sediaan Serbuk Obat Tradisional (Permata, 2012). Quantification
of Oxipurines and Allopurinol Metabolites in Biological Fluids by Cation
Exchange Chromatography (Sweetman, 1969). Namun validasi dan penetapan
kadar alopurinol dalam jamu asam urat dengan menggunakan metode
kromatografi cair kinerja tinggi (KCKT) fase terbalik belum pernah dilakukan
sebelumnya.
3. Manfaat Penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi mengenai validasi
metode spektrofotometri dalam penetapan kadar alopurinol dalam sediaan tablet
dan validasi metode KCKT fase terbalik dalam penetapan kadar alopurinol dalam
sediaan jamu.
b. Manfaat Metodologis
Penelitian ini diharapkan dapat memberikan informasi bahwa metode
spektrofotometri dapat digunakan dalam menetapkan kadar alopurinol dalam
sediaan tablet dan metode KCKT fase terbalik dapat menetapkan kadar alopurinol
c. Manfaat Praktis
Penelitian ini diharapkan dapat memberi tambahan informasi bagi ilmu
pengetahuan khususnya bidang kefarmasian mengenai parameter-parameter
validasi dan penetapan kadar alopurinol dengan metode spektrofotometri dan
metode KCKT fase terbalik.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui validitas metode spektrofotometri dengan melihat parameter
akurasi,presisi, LOQ serta kadar alopurinol yang terdapat dalam sediaan
tablet.
2. Mengetahui validitas metode standar adisi alopurinol dalam matriks jamu
pada KCKT fase terbalik dengan melihat parameter linearitas, akurasi, presisi
6 BAB II
PENELAAHAN PUSTAKA
A. Alopurinol
Alopurinol dengan nama kimia 1H-Pyrazolol[3,4-d]pirimidin-4ol dengan
rumus kimia : C5H4N4O. Alopurinol berupa serbuk halus putih hingga hampir
putih;berbau lemah yang sedikit larut dalam air dan etanol, larut dalam larutan
kalium dan natrium hidroksida, praktis tidak larut dalam eter dan klorofom.
(kelarutan dalam air = 0,35 g/L pada suhu 25°C). Alopurinol memiliki bobot
molekul 136,11 dan titik didih >300°C (Dirjen POM RI, 1995). Alopurinol
memiliki pka 9,4 dan log p 0,33 (Machatha, 2005).Menurut Moffat, alopurinol
memiliki serapan maksimum dalam larutan asam pada panjang gelombang 250
nm ( = 563 a) dan pada larutan alkalis memiliki serapan maksimum pada
panjang gelombang 257 nm ( = 523 a)
Struktur alopurinol sebagai berikut
(Dirjen POM RI, 1995).
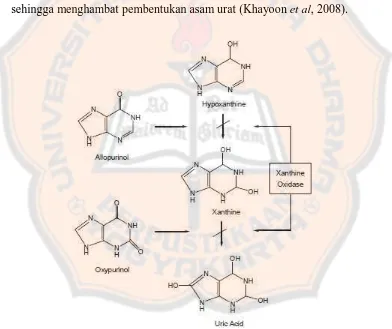
1. Mekanisme Kerja Alopurinol
Alopurinol secara struktur kimia merupakan analog struktur dari
hipoxantin, maka alopurinol adalah analog subtrat untuk enzim xantin oksidase.
Jadi, fungsi alopurinol sebagai analog subtrat akan menempati sisi aktif enzim
xantin oksidase yang biasa ditempati oleh hipoxantin. Alopurinol menghambat
aktivitas enzim secara irreversible dengan mengurangi bentuk xantin oksidase
sehingga menghambat pembentukan asam urat (Khayoon et al, 2008).
Gambar 2. Mekanisme kerja Alopurinol (Khayoon et al, 2008).
Alopurinol dalam tubuh dimetabolisme oleh xanthin oksidase menjadi
oxipurinol yang keduanya bekerja menghambat kerja enzim xanthin oksidase.
Enzim ini bertanggung jawab terhadap oksidase hipoxantin dan xantin dalam
Adanya pengeblokan produksi asam urat dengan penghambatan xantin oksidase
Oleh karena itu alopurinol bekerja dengan menurunkan pembentukan asam urat
dan purin (Khayoon et al, 2008).
2. Dampak Alopurinol
Alopurinol dapat menimbulkan reaksi kulit, reaksi alergi berupa demam,
menggigil, leukopenia atau leukositosis, eosinofilia, artralgia dan pruritus,
gangguan saluran pencernaan, pruritus, urtikaria, eksfoliatif dan lesi purpura,
dermatitis, nefritis, faskulitis dan sindrome poliartritis, kegagalan hati dan ginjal,
mual, muntah, diare, rasa mengantuk, sakit kepala dan rasa logam (Wells, 2009).
Alopurinol tidak memberikan efek mutagenik maupun karsinogenetik
karena terbukti pada penelitian menunjukkan bahwa alopurinol tidak menginduksi
penyimpangan kromosom pada sel darah manusia secara invitro pada kadar
hingga 100 μg/mL dan secara invivo mencapai dosis 60 mg/hari pada periode 40
bulan serta tidak mengindikasikan adanya efek teratogen namun alopurinol dan
oksipurinol didistribusikan ke air susu ibu sehingga alopurinol rentan
menimbulkan efek samping terutama reaksi hipersensitivitas (Medsafe, 2011).
LD50 yang ditetapkan untuk tikus secara oral dengan pemakaian akut
sebesar > 7500 mg/kg sedangkan untuk pemakaian kronis menggunakan nilai
3. Penetapan kadar alopurinol
Alopurinol dapat ditetapkan kadarnya secara spektrofotometri ultraviolet
dengan pelarut NaOH P 0,4% b/v dan asam klorida P 1% v/v (Dirjen POM RI,
1995).
B. Tablet
Tablet adalah sediaan padat yang mengandung bahan obat dengan atau
tanpa bahan pengisi. Berdasarkan metode pembuatan, dapat digolongkan sebagai
tablet cetak dan tablet kempa. Tablet kempa dibuat dengan memberikan tekanan
tinggi pada serbuk atau granul menggunakan cetakan baja. Tablet cetak dibuat
dengan cara menekan massa serbuk lembab dengan tekanan rendah ke dalam
lubang cetakan (Dirjen POM RI, 1995).
C. Obat Tradisional
Obat tradisional bahan atau ramuan bahan yang berupa bahan tumbuhan,
bahan hewan, sediaan sarian (galenik) atau campuran dari bahan tersebut yang
secara turun temurun telah digunakan untuk pengobatan berdasarkan pengalaman
(Permenkes RI No.007 Tahun 2012).
Sediaan obat tradisional yang beredar dibuat dari simplisia nabati, yaitu
bagian tanaman atau seluruh tanaman baik segar ataupun sudah dikeringkan atau
hasil penyariannya dengan berbagai bentuk sediaan seperti rajangan, serbuk, pil,
tablet, kapsul, cairan (sediaan luar dan sediaan dalam), salep, krim, parem, tapel
Sediaan obat tradisional ini perlu dilakukan berbagai jenis pengujian
untuk mengetahui mutu dari sediaan obat tradisional yang akan diproduksi. Jenis
pengujian ini meliputi pengujian mutu dan pengujian keamanan. Pengujian mutu
meliputi organoleptik, kemasan, makroskopis, kebenaran simplisia, kadar air dan
keseragaman bobot. Pengujian keamanan meliputi uji cemaran logam berat,
cemaran pestisida, cemaran mikroba, zat tambahan yang diizinkan seperti bahan
pengawet, cemaran afatoksin dan penetapan ada tidaknya bahan kima obat yang
ditambahkan dalam sediaan obat tradisional (Kepmenkes RI no
661/MENKES/SK/VII/1994).
Menurut Keputusan Badan POM RI No. 00.05.4.2411 tahun 2004,
berdasarkan cara pembuatan serta klaim penggunaan dan tingkat pembuktian
khasiat, Obat Bahan Alam Indonesia dikelompokkan menjadi 3 jenis yaitu :
1. Jamu (Obat tradisional warisan nenek moyang)
2. Obat Herbal Terstandar(telah dikembangkan berdasarkan bukti-bukti ilmiah,
uji praklinis dan standarisasi bahan baku)
3. Fitofarmaka(telah melewati uji klinis dan standariasasi bahan baku).
Menurut Keputusan Kepala Badan POM No. HK.00.05.41.1384 tahun
2005 di dalam jamu dilarang digunakan
1. Bahan kimia hasil isolasi atau sintetik yang berkhasiat obat.
2. Narkotika atau psikotropika.
3. Hewan atau tumbuhan yang dilindungi sesuai dengan ketentuan peraturan
D. Spektrofotometri Ultraviolet
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara
radiasi elektromagnet dan molekul atau atom dari suatu senyawa. Teknik yang
sering digunakan dalam analisis farmasi meliputi spektrofotometri ultraviolet,
cahaya tampak, infra merah dan serapan atom. Jangkauan panjang gelombang
untuk daerah ultraviolet adalah 190-380 nm dan daerah cahaya tampak 380-780
nm (Dirjen POM RI, 1995).
Radiasi ultraviolet diabsorpsi oleh molekul organik, molekul yang
mengandung elektron terkonjugasi dan atom yang mengandung elektron-n
menyebabkan transisi elektron di orbital terluarnya dari tingkat energi elektron
dasar ke tingkat energi elektron tereksitasi lebih tinggi. Besarnya serapan radiasi
tersebut sebanding dengan banyaknya molekul analit yang mengabsorpsi sehingga
dapat digunakan untuk analisis kuantitatif (Satiadarma, 2004).
1. Instrumentasi Spektrofotometer Ultraviolet
Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum
ultraviolet terdiri atas suatu sistem optik dengan kemampuan menghasilkan sinar
monokromatis dalam jangkauan panjang gelombang 190-380 nm. Komponen –
komponen meliputi sumber sinar, monokromator dan sistem optik.
a. Sumber lampu
Lampu deuterium digunakan untuk daerah UV pada panjang gelombang
190-380 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan
b. Monokromator
Monokromator digunakan mendispersikan sinar ke dalam
komponen-komponen panjang gelombangnya yang selanjutnya dipilih oleh celah (slit).
Monokromator berputar seingga kisaran panjang gelombang dilewatkan pada
sampel sebagai scan instrumen melewati spektrum.
c. Optik
Optik dapat dirancang untuk memecah sumber sinar sebagai sumber sinar
yang melewati 2 kompartemen pada spektrofotometer berkas ganda (double
beam), suatu larutan blangko dapat digunakan dalam satu kompartemen untuk
mengkoreksi pembacaan atau spektrum sampel. Larutan yang paling sering
digunakan sebagai blangko dalam spektrofotometri adalah semua pelarut yang
digunakan untuk melarutkan sampel atau pereaksi (Gandjar dan Rohman, 2010).
2. Interaksi elektron dengan Radiasi Elektromagnet
Secara umum ada 3 macam distribusi elektron di dalam suatu senyawa
organik yang dikenal sebagai elektron pi ( ), sigma ( ) dan elektron tidak
berpasangan (n). Apabila molekul tersebut dikenakan radiasi elektromagnetik
maka akan terjadi eksitasi elektron yang lebih tinggi (Mulja dan Suharman, 1995).
Ada empat jenis transisi elektronik yang terjadi diantara tingkat energi
dalam suatu molekul yaitu :
i. Transisi sigma-sigma star ( - ∗)
ii. Transisi n-sigma star (n- ∗)
iii. Transisi n-phi star (n- ∗)
Gambar 3. Diagram tingkat energi elektronik
3. Hukum Lambert Beer
Menurut Hukum Lambert, serapan berbanding lurus terhadap ketebalan
sel yang disinari. Menurut hukum Beer, yang hanya berlaku untuk cahaya
monokromatik dan larutan yang sangat encer, serapan berbanding lurus dengan
konsentrasi (banyak molekul zat). Kedua pernyataan ini dapat dijadikan satu
dalam hukum Lambert-Beer, sehingga diperoleh bahwa serapan berbanding lurus
terhadap konsentrasi dan ketebalan sel sesuai pada persamaan :
log Io/It = A = . b. c
Io : intensitas radiasi yang masuk
It : intensitas radiasi yang ditransmisikan
A : absorbansi
: konstanta koefisien molar ekstingsi
b : ketebalan kuvet yang dinyatakan dalam cm
c : konsentrasi analit (mol. L-1) (Watson, 2003).
E. Kromatografi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi (KCKT) adalah teknik pemisahan
gerak, dimana fase gerak dialirkan dengan bantuan tekanan menuju kolom secara
cepat dan dideteksi dengan detektor yang sesuai (Hendayana, 2006).
1. Instrumentasi KCKT
Komponen pokok instrumentasi KCKT pada dasarnya terdiri atas
kolom, wadah fase gerak, tempat penyuntikan sampel, pompa, detektor dan
sisem pengolah data untuk menampilkan hasil pemisahan.
a. Kolom
Suatu bagian dimana terdapat fase diam untuk berlangsungnya proses
pemisahan analit. Oktadesil silika (C18) merupakan fase diam yang paling banyak
digunakan karena mampu memisahkan senyawa-senyawa dengan kepolaran
rendah, sedang maupun tinggi. Oktil atau rantai alkil yang lebih pendek sesuai
untuk solut yang polar (Gandjar dan Rohman, 2010).
b. Wadah fase gerak
Wadah fase gerak harus bersih dan lembam (inert). Fase gerak sebelum
digunakan harus dilakukan degassing (penghilangan gas) yang ada pada fase
gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama di
pompa dan detektor sehingga akan mengacaukan analisis. (Gandjar dan Rohman,
2010).
c. Tempat penyuntikan sampel (injektor)
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam
fase gerak yang mengalir di bawah tekanan menuju kolom menggunakan syringe
d. Pompa
Pompa harus bersifat inert terhadap fase gerak. Pompa yang digunakan
sebaiknya mampu memberikan tekanan sampai 5000 psi dan mampu mengalirkan
fase gerak dengan kecepatan alir 3mL/menit. Tujuan penggunaan pompa adalah
untuk menjamin proses penghantaran fase gerak berlangsung secar tepat,
reprodusibel, konstan dan bebas dari gangguan (Gandjar dan Rohman, 2010).
e. Detektor
Fungsi detektor dalam KCKT adalah untuk mendeteksi
komponen-komponen cuplikan hasil pemisahan kolom secara kualitatif dan kuantitatif
bergantung pada kebutuhan analisis. Detektor KCKT yang baik harus mempunyai
sensitivitas yang cukup tinggi atau mempunyai limit deteksi yang sangat kecil,
sehingga memberikan perubahan sinyal yang besar pada perubahan konsentrasi
komponen cuplikan yang kecil. Detektor yang sensitif akan membantu analisis
kualitatif maupun kuantitatif terutama untuk trace analysis (Gandjar dan Rohman,
2010).
f. Sistem Pengolah Data (Rekorder/Integrator/Komputer)
Sistem KCKT memerlukan sistem pengolah data sebagai sistem pencatat
yang berkualitas baik dan mampu menampilkan hasil kromatogram dengan jelas,
tepat dan peka. Alat pengumpul data seperti komputer, integrator atau rekorder
dihubungkan dengan detektor. Alat ini akan mengukur sinyal elektronik yang
dihasilkan oleh detektor lalu mem-plotkannya sebagai suatu kromatogram yang
2. Parameter Pemisahan
Dalam metode kromatografi, suatu pemisahan dikatakan baik bila
memenuhi beberapa parameter utama yang dikenal dengan istilah faktor retensi
(k), faktor pemisahan (ɑ), jumlah total pelat (N) dan resolusi (R). Ketiga faktor ini
harus diperhitungkan untuk menggambarkan tingkat resolusinya.
Faktor retensi (k) adalah retensi relatif dari masing-masing puncak
kromatogram pada kolom. Faktor retensi tidak tergantung pada panjang kolom
dan aliran fase gerak, namun mewakili rasio molar dari senyawa di dalam fase
diam dan fase gerak. Faktor retensi biasanya bernilai antara 1 hingga 10. Jika nilai
k terlalu rendah, maka derajat pemisahan mungkin tidak cukup dikarenakan tidak
adanya interaksi antara analit dengan fase diam karena analit lewat fase diam
terlalu cepat. Sebaliknya, jika nilai k terlalu besar, maka waktu analisis juga akan
menjadi terlalu lama (Jeffrey, 1996).
Persamaan untuk menghitung nilai k sebagai berikut :
k=
keterangan : k=faktor retensi
tR=waktu retensi analit
t0=waktu retensi dari puncak pertama yang keluar dari kolom
Faktor pemisahan (selektivitas) merupakan besaran yang menunjukkan
dalam suatu campuran tidak dapat dipisahkan , kecuali memiliki perbedaan nilai k
dengan nilai k2>k1. Jika nilai ɑ=1 maka artinya tidak terjadi pemisahan atau
menunjukkan kedua komponen memiliki waktu retensi yang sama. Faktor
pemisahan atau selektivitas ( ) adalah suatu ukuran dari potensi sistem
kromatografi untuk mampu atau tidak memisahkan dua senyawa (Jeffrey, 1996).
Persaman selektivitas :
=
Keterangan : = faktor pemisahan
k1= faktor retensi analit 1
k2= faktor retensi analit 2
Resolusi (R) dari dua puncak tergantung pada faktor pemisahan
( ), faktor efisiensi (N) dan faktor retensi (k). Jika diasumsikan N1=N2 dibawah
kondisi pemisahan isokratik. Isokratik adalah cara pemrograman aliran fase gerak
yang hanya memerlukan satu macam komposisi pelarut tunggal maupun
campuran (Jeffrey, 1996).
Persamaan resolusi :
R= ( −1)√ = ( −1)√
Keterangan : R= resolusi
k1= faktor retensi analit 1
k2= faktor retensi analit 2
N= jumlah pelat teoritis (faktor efisiensi)
Jumlah pelat teoritis (N) atau faktor efisiensi adalah karaterisasi efisien
kolom. Faktor efisien (N) mengukur derajat ketajaman puncak kromatogram yang
didapatkan. Nilai faktor efisiensi yang meningkat menandakan proses
pengemasan (packing) yang lebih baik, panjang kolom yang lebih panjang,
kondisi aliran fase gerak yang optimum. Kolom dengan nilai efisiensi yang tinggi,
berarti dapat memisahkan campuran yang terdiri atas komponen yang memiliki
faktor pemisahan yang mirip (Jeffrey, 1996).
Persamaan jumlah pelat teoritis :
N=16
Keterangan : N= jumlah pelat teoritis
tR= waktu retensi analit
w= luas area analit
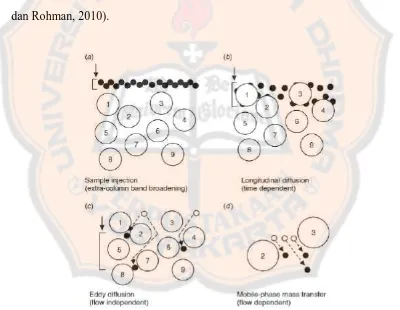
Pada saat pemisahan kromatografi, analit individual akan membentuk
profil konsentrasi yang simetri / profil Gaussian dalam arah aliran fase gerak.
Peak kromatogram secara perlahan akan melebar dan sering membentuk profil
asimetrik karena analit melanjutkan migrasinya ke fase diam (Gandjar dan
didasarkan pada difusi Eddy, difusi longitudinal, dan transfer massa (Snyder et
al., 2010).
Difusi longitudinal adalah saat analit melewati kolom. Proses difusi ini
menyebabkan pelebaran peak untuk meningkatkan retention time ( Snyder et al.,
2010). Spesies analit menyebar ke segala arah dengan difusi ketika berada di
dalam fase gerak. Difusi terjadi dengan arah yang sama dan berlawanan dengan
fase gerak sehingga berkontribusi terhadap pelebaran pita secara simetris (Gandjar
dan Rohman, 2010).
Gambar 4. Pelebaran puncak selama pemisahan dalam KCKT (Snyder et al., 2010)
Difusi Eddy menggambarkan faktor lain yang menyebabkan pelebaran
pita. Molekul analit masuk ke dalam kolom melewati partikel fase diam dengan
arah yang berbeda-beda menuju keluar kolom. Molekul yang bergerak lebih
lebih dahulu. Pelebaran pita tidak tergantung dari kecepatan alir yang digunakan
dan hanya bergantung dari penyusunan dan ukuran partikel dalam kolom.
Pelebaran pita yang diakibatkan karena difusi Eddy akan semakin besar seiring
dengan peningkatan ukuran partikel kolom (Snyder et al., 2010).
Transfer massa dapat menyebabkan pelebaran pita, terjadinya transfer
massa disebabkan oleh transfer massa fase gerak yang merupakan kecepatan alir
analit yang mempengaruhi pelebaran pita, diantara partikel fase diam terdapat
rongga bilamana analit melewatinya akan lebih cepat keluar terbaca detektor dan
bila analit cenderung lebih menyamping maka akan terjadi interaksi dahulu
terhadap partikel fase diam. Transfer massa fase diam menggambarkan analit
yang terpenetrasi ke dalam partikel fase diam dan tinggal lebih lama sebelum
meninggalkan partikel fase diam. Perbedaan lama waktu tinggal dan adanya analit
yang terlebih dahulu terelusi keluar akan menyebabkan pelebaran pita (Snyder et
al., 2010).
3. Fase Diam
Kolom pada KCKT tidak memerlukan temperatur tinggi karena sifat
ikatan kimia terhadap fase diam sangat sensitif terhadap temperatur tinggi.
pemilihan kolom berdasarkan jenis fase gerak dan sifat fisika kimia zat analit
(Snyder et al, 2010).
Sifat bahan pengisi atau fase diam dalam kolom bervariasi meskipun dari
satu produk yang sama. Variasi fase diam yang banyak digunakan dapat
kecil dan permukaan partikel kecil yang porous. Salah satu fase diam yang
digunakan dalam instrumen KCKT adalah silika.
Silika adalah suatu adsorben dengan sifat yang terkenal dan banyak
digunakan sebagai bahan isian kolom. Silika terdiri dari atom silikon yang
dijembatani secara tiga dimensi oleh atom oksigen. Silika mengandung gugus OH
(silanol) sehingga permukaannya memungkinkan untuk dimodifikasi untuk
memberikan sifat yang spesifik. Modifikasi dari kolom silika sebagai bahan isian
kolom telah sangat berkembang (Munson, 1991).
Tabel I. Modifikasi silika pada kolom dan aplikasinya (Munson, 1991)
Kolom Fase Aplikasi
C18 Octadecyl Non-polar umum
C8 Octyl Non-polar umum
Phenyl Styryl Asam lemak, ikatan rangkap
Cyano Cyanopropil Keton, aldehide
Diol Aminopropil Sugar,anion
Amino Dihydroxylhexyl Protein
SAX (Strong anion
exchanger) Aromatic quaternaryamine Anion
4. Fase Gerak
Pada pemilihan fase gerak yang perlu diperhatikan adalah fase gerak
harus berinteraksi dengan fase diam yang sesuai untuk memisahkan suatu
harus memenuhi kriteria viskositas, transparansi UV, titik didih, kemurnian, sifat
inert, toksisitas dan harga (Chan et al, 2004).
Viskositas yang rendah menghasilkan tekanan yang rendah dibanding
suatu pelarut dengan viskositas yang lebih tinggi pada suatu aliran tertentu. Untuk
transparansi UV, jika serapan UV yang digunakan maka fase gerak yang
digunakan haruslah transparan pada panjang gelombang yang digunakan (Jeffrey,
1996).
Pelarut yang digunakan dalam KCKT harus standar KCKT dan disaring
dengan ukuran pori 0,2 μm. Pelarut yang digunakan harus murni dan tidak
mengandung gas untuk menghindari pembentukan gelembung gas ketika
melewati katub atau memasuki bejana piston. Suatu sistem degassing dibutuhkan
untuk menghilangkan udara dalam larutan (Christian, 1994). Adanya gas dalam
fase gerak akan berkumpul dengan komponen lain terutama di pompa dan
detektor sehingga akan mengacaukan analisis (Gandjar dan Rohman, 2012).
Syarat-syarat fase gerak untuk KCKT adalah : murni, tanpa cemaran,
tidak bereaksi dengan kemasan, sesuai dengan detektor, dapat melarutkan
cuplikan, mempunyai viskositas yang rendah, memungkinkan memperoleh
kembali cuplikan dengan mudah, harganya wajar (Gandjar dan Rohman, 2012).
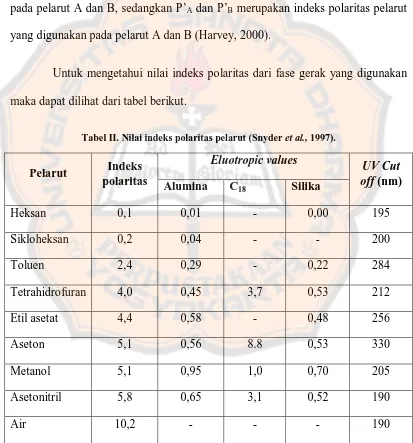
Pemilihan fase gerak yang digunakan terutama berdasarkan indeks
polaritas (P’) campuran fase geark tersebut. Semakin besar nilai indeks polaritas
menyatakan semakin polar fase gerak yang digunakan. Fase gerak yang sering
bercampur secara keseluruhan. Campuran fase gerak tersebut akan menghasilkan
nilai polaritas tersendiri yang disebut indeks polaritas fase gerak (Harvey, 2000).
P’AB = A. P’A + B. P’B
Dengan A dan B merupakan fraksi volume pelarut yang digunakan
pada pelarut A dan B, sedangkan P’A dan P’B merupakan indeks polaritas pelarut
yang digunakan pada pelarut A dan B (Harvey, 2000).
Untuk mengetahui nilai indeks polaritas dari fase gerak yang digunakan
maka dapat dilihat dari tabel berikut.
Tabel II. Nilai indeks polaritas pelarut (Snyder et al., 1997).
Pelarut Indeks polaritas
Eluotropic values UV Cut
Deret elutropik yang disusun berdasarkan polaritas pelarut merupakan
suatu panduan yang berguna dalam memilih fase gerak yang akan digunakan
dalam sistem KCKT. Nilai UV cut off (pemenggalan UV) merupakan panjang
gelombang dimana kuvet 1 cm yang digunakan pelarut akan memberikan absorbsi
lebih dari satu satuan absorbansi. Pentingnya mengetahui panjang gelombang
pemenggalan UV sangat berguna saat menggunakan detektor UV, penggunaan
panjang gelombang deteksi dianjurkan tidak bertepatan atau di sekitar panjang
gelombang pemenggalan UV dari pelarut yang digunakan sebagai fase gerak
(Gandjar dan Rohman, 2010).
F. Validasi Metode
Validasi metode analisis adalah proses dimana suatu metode ditetapkan
melalui serangkaian uji laboratorium bahawa karakter penampilan metode
tersebut memenuhi persyaratan untuk penerapan metode yang dimaksud. Tujuan
akhir validasi metode adalah untuk menjamin bahwa tiap pengukuran di masa
yang akan datang dalam suatu analisis rutin harus cukup dekat dengan nilai
kandungan analit sebenarnya yang terkandung dalam suatu sampel (Gandjar dan
Rohman, 2012).
Validasi metode menurut Association of Official Analytical Chemistry
(AOAC) adalah suatu proses yang menetapkan karakteristik suatu metode yang
ditemukan dapat memenuhi kebutuhan untuk aplikasi analisis yang diharapkan
dengan cara studi laboratorium. Validasi dibagi menjadi empat kelas yaitu kelas
A, B, C dan D. Kelas A digunakan untuk identifikasi senyawa. Kelas B digunakan
secara kuantitatif. Kelas D untuk mencari ciri suatu senyawa (Levin, 2002).
Parameter metode validasi dalam penelitian ini meliputi lineritas, spesifisitas,
keseksamaan (presisi), ketepatan (akurasi), batas deteksi (limit of detection) dan
batas kuantifikasi (limit of quantification).
Karakter penampilan metode dinyatakan sebagai parameter analisis.
Beberapa parameter yang harus dipertimbangkan dalam validasi metode analisis
adalah :
1. Akurasi (Ketepatan)
Ketepatan suatu prosedur analisis adalah kedekatan hasil yang diterima
(baik sebagai nilai teoritis maupun dengan nilai rujukan yang diterima) dengan
nilai yang diperoleh dari hasil pengukuran (Chan et al., 2004). Ketepatan
menurut (Horwitz, 2005), adalah kedekatan nilai hasil percobaan yang diperoleh
dari suatu metode terhadap nilai sebenarnya. Ketepatan diukur dengan
menghitung recovery menggunakan metode penambahan standar. Nilai recovery
tergantung pada matriks sampel, prosedur proses sampel dan konsentrasi analit.
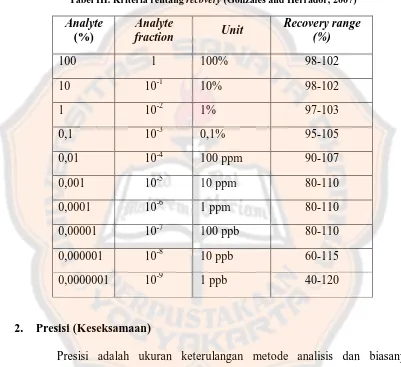
Batas penerimaan recovery menurut AOAC adalah 80-120%.
% recovery = x 100%
Keterangan : a = konsentrasi sampel + konsentrasi standar yang terukur
b = konsentrasi sampel
Acceptance criteria untuk nilai recovery diharapkan sesuai dengan matriks
sampel, prosedur pembuatan sampel dan konsentrasi analit. Rentang % recovery
yang diperbolehkan dapat dilihat pada tabel III berikut :
Tabel III. Kriteria rentang recovery (Gonzales and Herrador, 2007)
Analyte
Presisi adalah ukuran keterulangan metode analisis dan biasanya
diekspresikan sebagai simpangan baku atau Relative Standard Deviation (RSD)
dari sejumlah sampel. Sesuai ICH presisi harus dilakukan pada 3 tingkatan yang
berbeda yaitu keterulangan (repeatibility), presisi antara (intermediete precision)
dan. reprodusibilitas. penetapan pada keterulangan ada 2 cara yaitu (1) suatu
pengukuran sebanyak 9 kali yang mencakup kisaran yang digunakan dalam
dilakukan replikasi sebanyak 3 kali) atau (2) dilakukan 6 kali penetapan terhadap
larutan dengan konsentrasi yang sama (Chan et al., 2004).
Ada 2 ukuran presisi yaitu :
a. Presisi sistem (replikabilitas) : merupakan penilaian terhadap keberulangan
sistem untuk mengetahui kesalahan karena sistem , yang tidak bergantung pada
penyiapan sampel.
b. Presisi metode (repeatibilitas) : merupakan ukuran dari variabilitas intrinsik,
termasuk kesalahan yang disebabkan oleh penyiapan sampel.
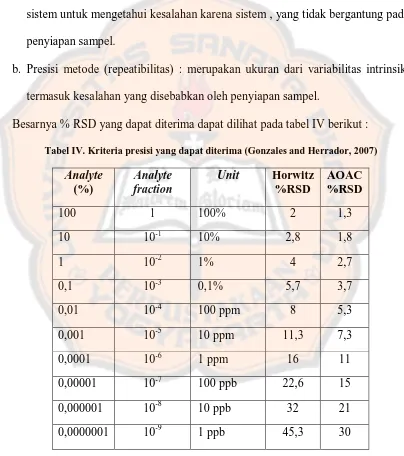
Besarnya % RSD yang dapat diterima dapat dilihat pada tabel IV berikut :
Tabel IV. Kriteria presisi yang dapat diterima (Gonzales and Herrador, 2007)
3. Linearitas
Linearitas merupakan kemampuan suatu metode untuk memperoleh
hasil-hasil uji yang secara proporsional dengan konsentrasi analit pada kisaran
yang diberikan. Linearitas suatu metode merupakan ukuran seberapa baik kurva
kalibrasi yang menghubungkan antara respon (y) dengan konsentrasi (x). (Snyder
et al., 1997).
4. Batas kuantitasi (LOQ)
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memberikan
resopon yang memenuhi kriteria cermat dan seksama. Batas deteksi dan kuantitasi
dapat dihitung secara statistik melalui garis regresi linier dari kurva kalibrasi
(Snyder et al., 1997).
G. Landasan Teori
Asam urat merupakan penyakit yang berkaitan dengan hiperurisemia
karena peningkatan sintesis asam urat yang ditandai dengan arthritis akut pada
persendian dan kartilago (Johnstone, 2005).
Penyakit asam urat dapat diatasi dengan obat sintesis maupun jamu
sebagai obat tradisional. Untuk menjaga keamanan konsumen perlu dilakukan
jaminan kualitas untuk obat sintesis maupun jamu.
Alopurinol merupakan salah satu zat aktif obat yang digunakan untuk
menurunkan kadar asam urat dalam darah. Alopurinol memiliki gugus kromofor
dan auksokrom yang dapat menyerap radiasi pada panjang gelombang di daerah
Pada tablet alopurinol mengandung tidak kurang dari 93% dan tidak
lebih dari 107% C5H4N4O dari label klaim sediaan (Dirjen POM RI, 1995).
Penggunaan metode spektrofotometri dalam penetapan kadar alopurinol dalam
tablet perlu dilakukan untuk memberikan hasil dengan reprodusibilitas dan
reabilitas yang baik. Validasi suatu metode analisis ditentukan oleh parameter :
linearitas, akurasi, presisi, LOQ.
Selain menggunakan obat sintesis untuk mengatasi asam urat, masyarakat
juga menggunakan jamu sebagai alternatif dalam mengatasi penyakit ini. Menurut
Keputusan Kepala Badan POM No. HK.00.05.41.1384 tahun 2005 di dalam jamu
dilarang digunakan bahan sintetik yang berkhasiat obat.
Menurut Sari(2014), analisis alopurinol dalam jamu tidak dapat
menggunakan metode spektrofotometri karena jamu memiliki matriks yang
kompleks dan metode spektrofotometri tidak mencapai batas kuantifikasi yang
ditentukan. Oleh karena itu dikembangkan metode analisis menggunakan KCKT.
Untuk metode KCKT ini juga dilakukan validasi metode analisis untuk menjamin
metode memiliki spesifikasi yang diterima meliputi : linearitas, akurasi, presisi
dan LLOQ.
H. Hipotesis
Dapat dilakukan validasi dan penetapan kadar alopurinol dalam tablet
30 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian non eksperimental dengan
rancangan deskriptif karena tidak dilakukan manipulasi terhadap subjek uji.
B. Variabel Penelitian
1. Variabel bebas dalam penelitian ini adalah kondisi optimal dari hasil optimasi
Sari (2014) dan Soenarso (2014).
2. Variable tergantung pada penelitian ini adalah parameter validitas yaitu
akurasi, presisi, linearitas, dan LOQ.
3. Variabel pengacau terkendali dalam penelitian ini, yaitu :
Kualitas bahan baku, kemurnian pelarut, digunakan pelarut yang memiliki
grade pro analysis.
C. Definisi Operasional
1. Alopurinol merupakan senyawa yang sering digunakan untuk mengatasi
penyakit asam urat.
2. Validasi metode yang dilakukan pada penelitian ini meliputi pengukuran
terhadap parameter-parameter validitas yaitu akurasi, presisi, linearitas, dan
3. Sampel yang digunakan yaitu dan tablet alopurinol dan jamu asam urat.
D. Bahan Penelitian
Bahan yang digunakan adalah baku alopurinol (PT. Ifars), metanol
(E.Merck), asam klorida (E.Merck), natrium hidroksida (E.Merck), kloroform
(E.Merck), ammonium hidroksida solution 25% (E.Merck), akuades dan
akuabides, matriks sampel jamu asam urat, sampel tablet alopurinol
E. Alat Penelitian
Alat yang digunakan dalam penelitian ini, yaitu : seperangkat
spektrofotometer UV-VIS merek Optima SP 300 Plus, seperangkat KCKT fase
terbalik merek Shimadzu dengan sistem gradient, kolom oktadesilsilan C18 150 x
4,6 mm dengan ukuran pori 5 m, ultrasonikator, neraca analitik Ohaus Carat
Series PAJ 1003, milipore filter ukuran 0,45 µm, mikropipet Socorex ukuran
100-1000 μL, indikator pH (E.Merck), organic and anorganic solvent membrane filter
(Whatman) ukuran pori (0,45 μm dengan diameter 47 mm), vakum dan
seperangkat alat gelas (Pyrex).
F. Tata Cara Penelitian I. Metode Spektrofotometri
1. Pembuatan larutan NaOH 0,1 N
Sejumlah 1 gram pelet NaOH dilarutkan dengan akuades hingga semua
larut sempurna lalu dimasukkan ke dalam labu ukur 250 mL dan diencerkan
2. Pembakuan NaOH 0,1 N
Ditimbang lebih kurang 400 mg kalium biftalat secara seksama yang
sebelumnya telah dihaluskan dan dikeringkan pada suhu 120ºC selama 2 jam dan
larutkan dalam 75 mL air bebas karbondioksda lalu tambahkan 2 tetes indikator
fenolftalein dan titrasi dengan larutan natrium hidroksida hingga terjadi warna
merah muda mantap. Normalitas NaOH dihitung dengan menggunakan rumus :
N NaOH =
(Mursyidi,2008).
3. Penentuan panjang gelombang pengamatan alopurinol
Dibuat seri larutan kurva baku dengan konsentrasi 4, 8, dan 12 μg/mL
dengan cara mengambil 2,4, dan 6 mL dari larutan intermediet 2 lalu dimasukkan
ke dalam labu ukur 10 mL dan diencerkan dengan menggunakan NaOH 0,1 N
hingga tanda. Kemudian ukur serapan pada panjang gelombang 200-400 nm
4. Pembuatan larutan baku alopurinol
a. Pembuatan larutan induk baku alopurinol
Sejumlah lebih kurang 50 mg baku alopurinol ditimbang seksama,
dimasukkan ke dalam labu ukur 50 mL dilarutkan dengan NaOH 0,1 N hingga
tanda sehingga diperoleh larutan dengan konsentrasi 1000 μg/mL.
b. Pembuatan larutan intermediet 1 alopurinol
Dari larutan induk diambil 1,0mL lalu dimasukkan ke dalam labu ukur
10 mL, encerkan dengan NaOH 0,1 N hingga tanda sehingga diperoleh larutan
c. Pembuatan larutan intermediet 2 alopurinol
Dari larutan induk intermediet 1 diambil 10 mL lalu dimasukkan ke
dalam labu ukur 50 mL, encerkan dengan NaOH 0,1 N hingga tanda sehingga
diperoleh larutan dengan konsentrasi 20 μg/mL.
d. Pembuatan kurva baku alopurinol
Larutan intermediet 2 diambil sebanyak 2,3,4,5,6, dan 7 mL dari
kemudian dimasukkan ke dalam labu ukur 10 mL. Ditambahkan NaOH 0,1 N
hingga batas tanda sehingga diperoleh seri larutan kurva baku alopurinol dengan
konsentrasi 4, 6, 8, 10, 12, dan 14 μg/mL. Larutan seri baku tersebut diukur
absorbansinya pada panjang gelombang pengamatan menggunakan
spektrofotometer UV. Dibuat kurva regresi linear antara kadar alopurinol dan
absorbansi yang diperoleh, kemudian ditentukan persamaan regresi linear dan
nilai koefisien korelasinya.
5. Uji keseragaman bobot tablet alopurinol
Disiapkan 20 tablet alopurinol kemudian ditimbang satu per satu untuk
mengetahui keseragaman bobot tablet. Bobot tablet yang diperoleh dihitung bobot
rata-ratanya. Setelah dilakukan uji keseragaman bobot, tablet alopurinol digerus
menggunakan mortir dan stamper dan disimpan dalam wadah yang kering.
6. Validasi metode analisis dalam tablet alopurinol
Dua puluh tablet alopurinol digerus kemudian ditimbang sampel
sebanyak 77 mg. Ke dalam masing-masing sampel ditambahkan baku alopurinol
diadisi dengan baku alopurinol kemudian larutkan dengan NaOH 0,1 N dan saring
dengan menggunakan kertas saring, masukkan ke dalam labu ukur 25 mL.
Diambil 1,0mL lalu dimasukkan ke dalam labu ukur 10 mL dan add hingga
tanda. Diambil lagi 1,0mL dan diencerkan hingga 10 mL, ukur serapan
konsentrasi larutan sampel pada panjang gelombang pengamatan dengan replikasi
5 kali. Dilakukan penetapan blanko dengan replikasi 5 kali.
Dilakukan pengukuran absorbansi larutan adisi sampel dan blanko
menggunakan spektrofotometer UV pada panjang gelombang maksimum. Nilai
absorbansi yang didapat digunakan untuk menghitung kadar alopurinol dengan
memasukkan nilai absorbansi pada persamaan kurva baku yang telah dibuat.
Dihitung persen perolehan kembali (% recovery), nilai koefisien variasi (% CV)
dan LOQ (Limit of Quantitation) alopurinol yang telah diadisi ke dalam matriks
tablet alopurinol.
7. Penetapan kadar alopurinol dalam tablet
Dua puluh tablet alopurinol digerus kemudian ditimbang sebanyak 77
mg. Dilarutkan dengan NaOH 0,1 N dan saring dengan menggunakan kertas
saring, masukkan ke dalam labu ukur 25 mL. Diambil 1,0 mL lalu dimasukkan ke
dalam labu ukur 10 mL dan add hingga tanda. Diambil lagi 1,0 mL dan
diencerkan hingga 10 mL, ukur serapan konsentrasi larutan sampel pada panjang
gelombang maksimum. Masukkan hasil absorbansi ke persamaan kurva baku
alopurinol sehingga diperoleh kadar alopurinol dalam sampel. Replikasi dilakukan
II. Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik 1. Penentuan panjang gelombang pengamatan alopurinol
Penentuan panjang gelombang pengamatan dilakukan dengan cara
mengukur spektra larutan baku alopurinol dengan menggunakan konsentrasi 5,0;
7,5; 10,0; 12,5 dan 15,0 μg/mL. Pengukuran dilakukan pada rentang panjang
gelombang 200-400 nm terhadap blanko amonium hidroksida 5% dalam metanol.
Berdasarkan spektra yang diperoleh kemudian ditentukan panjang gelombang
maksimum. Panjang gelombang ini akan digunakan pada deteksi sistem KCKT
2. Pembuatan fase gerak
Fase gerak yang digunakan yaitu campuran metanol : amonium
hidroksida 0,1% dalam akuabides (10:90). Masing-masing larutan disaring
menggunakan kertas saring Whatman yang dibantu dengan pompa vakum dan
diawaudarakan selama 15 menit. Pencampuran fase gerak dilakukan di dalam
sistem KCKT.
3. Kurva baku alopurinol
a. Pembuatan larutan stok baku alopurinol. Ditimbang secara seksama
lebih kurang 25 mg baku alopurinol, kemudian dimasukkan ke dalam labu ukur
25 mL dan dilarutkan dengan dengan amonium hidroksida 5% dalam metanol.
b. Pembuatan larutan intermediet alopurinol.Dibuat larutan intermediet
dengan konsentrasi 10 g/mL dengan cara mengambil sebanyak 100 L dari
larutan stok baku alopurinol, dimasukkan labu takar 10 mL dan diencerkan
c. Pembuatan seri larutan baku alopurinol. Diambil sejumlah100, 200,
300, dan 400 μL larutan intermediet alopurinol kemudian masing-masing
dimasukkan ke dalam labu takar 10 mL. Masing-masing labu takar diencerkan
dengan amonium hidroksida 5% dalam metanol hingga tanda. Masing-masing seri
baku alopurinol disaring menggunakan milipore kemudian di-degassing
menggunakan ultrasonikator selama 15 menit. Sejumlah 10 μL masing-masing
seri larutan baku disuntikkan ke sistem KCKT. Replikasi dilakukan 3 kali.
4. Kurva baku adisi alopurinol dalam matriks jamu
a. Pembuatan larutan stok baku alopurinol. Ditimbang secara seksama lebih
kurang 25 mg baku alopurinol, kemudian dimasukkan ke dalam labu ukur 25 mL
dan dilarutkan dengan dengan amonium hidroksida 5% dalam metanol.
b. Pembuatan larutan intermediet alopurinol.Dibuat larutan intermediet
dengan konsentrasi 500 g/mL dengan cara mengambil sebanyak 5 mL dari
larutan stok baku alopurinol, dimasukkan labu takar 10 mL dan diencerkan
dengan amonium hidroksida 5% dalam metanol hingga tanda.
c. Pembuatan seri larutan baku alopurinol. Diambil sejumlah 100, 300, dan
600 μL larutan intermediet alopurinol kemudian masing-masing dimasukkan ke
dalam labu takar 10 mL. Masing-masing labu takar diencerkan dengan amonium
hidroksida 5% dalam metanol hingga tanda, sehingga diperoleh konsentrasi 5, 15,
dan 30 μg/mL.
d. Pembuatan kurva adisi alopurinol dalam matriks jamu
Diambil 20 bungkus jamu merek asam urat yang telah dibeli, ditimbang
dihomogenkan dengan menimbang 20 bungkus jamu dan dihitung bobot
rata-ratanya, kemudian dilarutkan dengan 10 mL NaOH 0,1 N. Ditambahkan sebanyak
200 μL seri larutan baku 5, 15, 30 μg/mL dan 100, 200, 300 µL dari larutan
intermediet sehingga diperoleh massa alopurinol yang ditambahkan sebanyak 51,
103, 156 µg kemudian diekstraksi dengan kloroform 3 mL sebanyak tiga kali.
Didapatkan 2 fase pemisahan, diambil fase air (bagian atas), tampung dalam
flakon. Fase air ditambahkan HCl 0,1 N hingga pH 2 dan diperoleh volume akhir
4 mL. Sebanyak 1 mL sampel dimasukkan ke dalam catridge MCX yang telah
dikondisikan dengan metanol dan air. Kolom SPE MCX dicuci dengan dialiri 2
mL asam asetat 2% dan 2 mL metanol. Selanjutnya elusi dengan 10 mL
amonium hidroksida 5% dalam metanol. Fraksi amonium hidroksida 5% dalam
metanol ditampung dalam flakon, lalu diuapkan seluruhnya. Kemudian dilarutkan
dengan amonium hidroksida 5% dalam metanol sebanyak 10 mLlalu disaring
dengan menggunakan milipore kemudian diultrasonifikasi selama 15 menit.
Masing-masing diinjeksikan ke dalam sistem KCKT dengan replikasi lima kali.
5. Pengaruh Matriks Jamu pada Penetapan Kadar Alopurinol
Untuk mengetahui pengaruh matriks pada penetapan kadar alopurinol
dalam jamu, maka dilakukan perbandingan antara slope kurva baku alopurinol
dan slope kurva baku adisi alopurinol dalam matriks jamu.
6. Validasi metode analisis dalam jamu
Validasi metode analisis dilakukan padadata yang diperoleh di langkah 4
meliputi linearitas, akurasi dan sensitivitas.
a. Linearitas. Linearitas ditentukan dengan nilai koefisien korelasi. Luas area
untuk memperoleh regresi linier dengan persamaan y = bx + a. Nilai koefisien
korelasi (r) yang akan digunakan untuk parameter validasi linearitas.
b. Akurasi. Akurasi ditentukan dengan % perolehan kembali.
% perolehan kembali = x 100%
c. Presisi. Presisi ditentukan nilai % CV yang dapat dihitung dengan rumus
berikut.
% CV = x 100%
d. Sensitivitas. Sensitivitas ditentukan dengan nilai LOQ yang dapat dihitung
dengan rumus berikut.
LOQ = 3,3
Keterangan:
Sa: standar deviasi dari intersep kurva baku
b: slope
7. Penetapan Kadar Alopurinol dalam Jamu
Ditimbang secara seksama 0,5 gram jamu merek A,B dan C, kemudian
dilarutkan dengan 10 mL NaOH 0,1 N. Diekstraksi dengan kloroform 3
mLsebanyak tiga kali. Didapatkan 2 fase pemisahan, diambil fase air (bagian
atas), tampung dalam flakon. Fase air ditambahkan HCl 0,1 N hingga pH 2 dan
diperoleh volume akhir 4 mL. Sebanyak 1 mL sampel dimasukkan ke dalam
catridge MCX yang telah dikondisikan dengan metanol dan air. Kolom SPE MCX
dicuci dengan dialiri 2 mL asam asetat 2% dan 2 mL metanol. Selanjutnya elusi
hidroksida 5% dalam metanol ditampung dalam flakon,lalu diuapkan seluruhnya.
Kemudian dilarutkan dengan amonium hidroksida 5% dalam metanol sebanyak
10 mL lalu disaring dengan menggunakan milipore kemudian diultrasonifikasi
selama 15 menit. Sejumlah 20 μL masing-masing sampel diinjeksikan ke sistem
G. Analisis Hasil 1. Analisis Hasil Metode Spektrofotometri UV
a. Akurasi
Akurasi dinyatakan sebagai persen perolehan kembali (recovery).
%recovery = x 100%
Menurut Gonzales dan Herrador (2007) % recovery yang baik yaitu
98-102%.
b. Presisi
Presisi dinyatan sebagai % CV
% CV=
Keterangan :
CV = koefisien variasi
SD = simpangan deviasi
X = rata-rata
c. LOQ (batas kuantitasi)
Batas kuantitasi diperoleh dengan menghitung simpangan baku dari
intersep kurva baku adisi alopurinol dalam matriks jamu dan diolah menggunakan
persamaan matematis secara statistik menggunakan program powerfit, untuk
menghitung nilai LOQ digunakan rumus :
LOQ = 3,3
Keterangan :
k = 3,3
Sa = standar deviasi dari intersep kurva baku
b = slope
d. Perhitungan kadar alopurinol dalam sediaan tablet
Untuk kadar alopurinol dalam sampel, analisis dilakukan dengan cara
memplotkan absorbansi alopurinol dalam sampel tablet ke dalam kurva baku
yang didapatkan. Kadar alopurinol dihitung menggunakan persamaan :
Y = Bx + A
Keterangan :
Y = AUC alopurinol dalam sampel
X = kadar alopurinol
Sehingga kadar alopurinol dalam sampel adalah x =
2. Analisis Hasil Metode KCKT fase terbalik
a. Linearitas
Linearitas dinyatakan dalam koefisien relasi (r) pada regresi linear. Linearitas
yang baik bila r hitung ≥ nilai r pada tabel.
b. Akurasi
Akurasi dinyatakan sebagai persen perolehan kembali (recovery).
%recovery = x 100%
c. Presisi
Presisi dinyatan sebagai % CV
% CV=
Keterangan :
CV = koefisien variasi
SD = simpangan deviasi
X = rata-rata
d. LOQ (batas kuantitasi)
Batas kuantitasi diperoleh dengan menghitung simpangan baku dari
intersep kurva baku adisi alopurinol dalam matriks jamu dan diolah menggunakan
persamaan matematis secara statistik menggunakan program powerfit, untuk
menghitung nilai LOQ digunakan rumus :
LOQ = 3,3
Keterangan :
LOQ = batas kuantitasi
k = 3,3
Sa = standar deviasi dari intersep kurva baku
b = slope
e. Perhitungan kadar alopurinol dalam jamu
Untuk kadar alopurinol dalam sampel, analisis dilakukan dengan cara
memplotkan absorbansi alopurinol dalam sampel jamu ke dalam kurva baku yang
Y = Bx + A
Keterangan :
Y = AUC alopurinol dalam sampel
X = kadar alopurinol
44 BAB IV
HASIL DAN PEMBAHASAN
Alopurinol memiliki gugus kromofor dan auksokrom sehingga dapat
dianalisis menggunakan metode spektrofotometri. Menurut Sari (2014), batas
kuantitasi alopurinol dengan metode spektrofotometri adalah 15.58 g/mg. Pada
sampel jamu asam urat batas kuantifikasinya 0,52 g/mg sedangkan pada sampel
tablet batas kuantifikasinya 300 g/mg. Metode spektrofotometri UV lebih tepat
digunakan untuk penetapan kadar alopurinol dalam sampel tablet obat karena nilai
LOQ yang diperoleh jauh lebih kecil dari batas yang ditentukan.
Di dalam matriks sediaan tablet mengandung eksipien berupa zat pengisi,
zat pengikat, zat penghancur (disintegran) yang beberapa tidak larut dalam pelarut
yang digunakan. Oleh karena itu dibutuhkan optimasi isolasi proses penyaringan
agar larutan yang dibuat bebas dari partikel ekspien. Berdasarkan penelitian yang
dilakukan oleh Soenarso (2014), diperoleh bahwa penyaringan dengan
menggunakan pelarut 20 mL sebanyak satu kali merupakan ekstraksi yang
optimal.
Metode spektrofotometri untuk penetapan kadar alopurinol dalam tablet
perlu dilakukan validasi untuk menjamin bahwa metode analisis memenuhi
A. Validasi Metode Analisis Alopurinol Dalam Tablet
Prinsip metode analisis alopurinol dalam tablet (Dirjen POM RI, 1974),
dilakukan pengembangan metode analisis dengan cara melarutkan sampel tablet
ke dalam larutan NaOH 0,1 N kemudian diukur serapan pada maks dengan
spektrofotometri UV. Validasi dilakukan menurut tata cara berikut:
1. Pembuatan dan Pembakuan Larutan NaOH 0,1 N
Pelarut yang digunakan pada metode spektrofotometri ini adalah NaOH
0,1 N karena alopurinol larut baik dalam pelarut ini (Moffat, 2011). Namun
NaOH yang akan digunakan sebagai pelarut harus dilakukan standarisasi. Tujuan
dilakukan standarisasi ini adalah karena larutan NaOH bersifat hidroskopis yang
dapat menyerap air dari lingkungannya sehingga terjadi pengenceran atau dengan
kata lain dapat mengalami perubahan konsentrasi sehingga harus distandarisasi.
Selain itu NaOH juga dapat bereaksi dengan gas CO2 dari udara.
NaOH + CO2→ Na2CO3 + H2O
NaOH distandarisasi dengan menggunakan kalium hidrogen biftalat
sebagai standar primer. Pada pembakuan NaOH dengan kalium biftalat reaksi
yang terjadi adalah